Method Article
フライ精巣における撮像中心体
要約
ショウジョウバエの精子形成時に中心体タンパク質のイメージングは、中心体生物学のための重要な新しいタンパク質を同定するだけでなく、このプロセスにおける既知の選手の特定の機能を解明するために強力な方法である。
要約
中心体は、その構造および機能、細胞周期および細胞分化を通して劇的に変化微小管ベースの細胞小器官を保存されている。中心体は、有糸分裂の際に細胞分裂軸を決定し、間期繊毛の核を形成するために、不可欠である。これらの動的な変化を媒介するタンパク質の同一性は、部分的にのみ知られているままであり、これらのプロセスに関与しているタンパク質の多くの機能はまだ初歩的である。最近の研究では、ショウジョウバエの精子形成が中心体の機能と形成のための重要な新しいタンパク質を同定するとともに、中心体関連のプロセスにおける既知の選手の特定の機能への洞察を得るために強力なシステムを提供することが示されている。 ショウジョウバエはどこ変異体における確立された遺伝的モデル生物である中心体遺伝子が容易に得られ、容易に分析することができる。さらに、最近の光学顕微鏡の感度と分解能の進歩とロバストな遺伝的にタグ付けされた中心体マーカーの開発は、中心体を研究するためにシンプルかつアクセス可能なモデル系としてショウジョウバエ精巣を使用する能力を形質転換している。本論文では、新たな中心体の変異体について遺伝子スクリーニングを行うために、新たに同定された遺伝子の特定の機能への洞察を得るために遺伝的にタグ付けされた中心体マーカーの使用が記載されている。
概要
ショウジョウバエの精巣は、細胞および発生過程の様々な研究するための適切な器官系であり、年間1-9にわたり広範囲に検討されている。この原稿は、中心体、保存された細胞小器官を研究するショウジョウバエの精巣の使用に焦点を当てています。他のシステムのように、有糸分裂、減数分裂、およびciliogenesis 10 ショウジョウバエの精巣機能の中心体。中心体は、複雑なタンパク質ネットワークによって囲ま中心小体として知られている微小管ベースの構造の一対で構成されている中心体周辺物質(PCM)と呼ばれる。中心小体ペアは古い母中心小体と若い娘中心小体構成されています。細胞が有糸分裂に向かって進行するように、両方の中心小体は、分離複製し、最終的に二つの別個の中心体を形成するためにPCMを大量に獲得する。オリジナルの母中心小体を含む中心体は母中心体とCENTRと呼ばれているオリジナルの娘中心小体を含むosomeは娘中心体と呼ばれている。
ショウジョウバエの精巣は、さまざまな理由で、蛍光顕微鏡により中心体生物の分子的基礎を研究するための理想的です。
- 精巣で中心体生物学のために必要とされるショウジョウバエのタンパク質のほとんどは1,11-14精巣は、人間と他の種における中心体生物学に関連する洞察力がショウジョウバエで中心体を研究することによって得ることができることを示唆し、真核生物間で保存されている。
- 他の多くのモデルとは異なり、 ショウジョウバエの中心体の変異は、このように中心体機能の古典的な遺伝子解析を可能にし、胚性致死ではない、ので、 ショウジョウバエの変異体の解析を実行することは重要な利点を提供します。 ショウジョウバエのこのユニークな機能は、胚develoのの重要な段階で解決しない母親の貢献の存在によるものであるpment。1,11-14。このように、1は、CAN A)完全に中心体の形成を排除し、B)(母親の寄与が枯渇した後に変異体の関係にある母親の貢献により、初期胚に形成された正常な中心体の運命を研究調査変異法の原理)11に記載されている。
- 中心体にラベルを遺伝的にコード化された蛍光タグを持つ機能的な導入遺伝子が利用できます。これらの線の多くは、強力な過剰発現を防止するために、導入遺伝子の転写を駆動するためにタンパク質自体のプロモーターを用いる。タンパク質の過剰発現は、多くの場合、中心体機能1,11の分析を妨害アーティファクトをもたらすので、これは特に重要である。
- 中心小体と中心体は、このように画像化することにより中心体の迅速かつ容易な分析が可能、 ショウジョウバエの精子形成を通じて一意の長さである。
- 精子形成および中心体Bでは連続した工程iologyは精子幹細胞の中心体と精巣先端から始まり、成熟精子細胞で減少した中心体のサイズと活性( 図1、図2)との精巣の下部に終わる、精巣に沿って時系列に整理されています。これは、精子開発のさまざまな段階で中心体機能の容易な識別と分析を可能にする。
- 精巣を簡単に男性の幼虫、蛹および成人27から切除される。
- 精子形成の際に、中心体とその中心小体は、有糸分裂、減数分裂、および繊毛形成に機能するように、複数の組成、構造的および機能的な状態を進める。これらのプロセスの間に、細胞の特定の部分に中心体組み立て、重複、移動する、アンカーは、成熟分割し、繊毛が作成されます。さらに、成熟した精子細胞の中心小体は、PCL 1という名前centriolar前駆体を生じさせる。また、成熟精子細胞において、中心体は、処理Cを受けるそれは多くのPCMの成分及び中心小体( 図1および2)を失うことにより、中心体の減少をalled。このように、精巣内の研究では、1は、幹細胞では中心体の保持、中心小体複製、中心小体の安定性、中心小体伸び、中心小体分離偏析、PCMの募集、ciliogenesis、PCL形成、中心体の減少などの中心体の生活のさまざまな側面に対処することができますとりわけアストラル微小管の核形成。
- 最後に、中心体生物学の研究は、それ生物学的研究のための好ましいモデル生物行ったショウジョウバエの他の有名な特性によって助けている。これらは、短い世代時間、遺伝学の容易さ、ならびにランダムおよび部位特異的突然変異誘発が挙げられる。
一緒に、 ショウジョウバエの精巣の上記の特徴は、中心体は、簡単で迅速な、詳細な画像化により研究することができるモデルを提供しています。記載されている技術本論文では中心小体形成が11、中心小体の複製15、PCMの募集16、中心体の調節17、およびciliogenesis 18を含む中心体生物学の多くの側面を調査するために適用されている。これらの技術はまた、他の多くの間の非対称性幹細胞区画21内の減数分裂の調節19、スピンドルアセンブリ20と、中心体活性などの生物学の他の領域に中心体を研究するために適用されている。
遺伝的にタグ付けされた中心体タンパク質を発現するハエを取得し、オスの幼虫、さなぎ、または成虫から精巣を分離した中心体着工の精巣のイメージング。これらのハエは、いくつかの研究グループ1,11,15,22-25から入手できます。幼虫の精巣は、前減数分裂に精子形成の全段階を含んでおり、蛹、大人に致死的変異を分析する際に役立ちます。しかし、後期蛹や若いADULT精巣は最も堅牢で、それによって、分析のためにそれらが好ましいこと、精子形成のすべての前後の減数分裂の段階を含んでいる。精子細胞の数は、フライ古くなるにつれて減少するので、成体精巣の使用はまた、老化の文脈において中心体を研究するために適切である。26。成虫ハエから精巣単離する方法は、以前27に記載されている。
中心体およびショウジョウバエ精巣におけるそれらの機能の画像化は、ここで( 図3)提示されている3つの関連するトラックを介して達成することができる。トラックが最も適切であるかの選択は、研究者が取り組んでいる質問の性質に依存する。
トラックAは、ライブ精巣の画像が含まれます。これは、3つのトラックの中で最も急速であるが、試料が保存されること、および免疫染色する際に必要とされない必要がない場合にのみ適用することができる。トラックAで、精巣をスライドに(そのまま、ピアスまたはカット)搭載されていると慎重に簡単に識別できる細胞の単一層を形成するためにカバースリップの下に押しつぶさ。次いで、細胞を位相差顕微鏡および蛍光顕微鏡法の両方を用いて可視化する。それは透過照明の他の形態では見えないので、精子の開発28,29の種々の段階の迅速な同定を可能にする細胞情報を明らかにするため、位相コントラストの使用は、 ショウジョウバエ精巣の分析のために特に重要である。しかし、トラックAは、2つの主な欠点があります。睾丸が破裂されるとまず、細胞の形態学的整合性は、多くの場合、危険にさらされている。第二に、非固定細胞が困難な場合、指定された領域内に複数の共焦点層のイメージングを作り、試料内を移動する。特定の細胞型の解析を促進するために、精巣の穿孔又は精巣破裂は、カバースリップの下で最小限退治する目的の細胞型の形態に影響を与える方法を導くために切断されてもよい。
トラックBは、精巣の化学固定を伴います。このトラックは、試料調製のための時間の中間の量を必要とし、固定された検体は、後の分析のために保存することができるという利点を有する。さらに、固定は撮像中に試験体の動きを最小限に抑え、細胞構造がより剛性にするためのものである。しかしながら、位相差顕微鏡を識別するために、精子の開発のいくつかの段階が困難、化学固定後にあまり有益となる。
トラックCは、ほとんどの時間を集中的にですが、細胞構造を固定して免疫染色し、適切な遺伝学のタグを利用できないタンパク質の可視化を可能にしていることを付加的な利点を持っています。 ショウジョウバエの精巣内の中心体と中心体に関連した構造体を免疫染色の両方に商業的に、様々な研究グループから利用可能な多くの抗体があります。
プロトコル
1。ライブ精巣のトラックAを準備
- 8.0グラムのNaCl、0.2グラムのKCl、1.44グラム2 HPO 4、0.24グラムのKH 2蒸留水800ミリリットル中のPO 4ナトリウムを溶解することにより、PBSを調製し、pHを7.4に調整します。 1Lにボリュームを持参し、オートクレーブで滅菌する。
- 以前に27を説明するように精巣を分離します。
- PBS中1μg/ mlの1 mg / mlのストックを希釈することにより、DAPI染色バッファーを準備します。 -20℃で光及びストアから管を保護するためにアルミ箔を使用し
- 精巣を単離した後、10分間、正に帯電し、顕微鏡用スライドガラスの上にDAPI染色バッファーの6μlの試料を浸す。精巣は、試料の容易な操作を可能にし、商業的に入手可能な、正に荷電したスライドによく接着。正に荷電したスライドに共有ガラス表面への静的な正電荷を付与するために修飾される。ポリリジンコーティングと同様に、これは、精巣のWiの相互作用を促進スライドの表面番目。
- PBSを6μLで二回染色緩衝液を交換することによって、過剰なDAPIを洗ってください。各洗浄工程の後、バッファを移送するために濾紙を使用する。誤って、各洗浄時のバッファと一緒に睾丸を除去しないよう十分に注意してください。
- 試料にPBSを6を添加する。使用するバッファーの量は、カバースリップの大きさに合わせて調整されるべきである。このプロトコルで提供するボリュームは18×18ミリメートルのカバースリップのためのものです。オプション:それは、目的の細胞型の相対的な位置の近くに精巣を貫通することをお勧めします。これにより、それらの構造的完全性を維持し、潰し工程の間、これらの細胞上の最小の圧力が存在することを保証する。精巣の穿孔は、鋭い、きれいなメスを用いて行うことができる。
- 慎重に試験片の上にカバースリップを配置。
- バッファはIMながら生きた試料から蒸発しないことを確実にするために明確なマニキュアを使用したカバースリップの端をシール高齢化。
- スライド上の標本を見つけるのを容易にするために精巣の位置を指定し、画像化に進むためにマーカを使用してください。
- PBSを6μLで二回バッファを置き換えることにより、余分なDAPI染色バッファーを洗浄します。各洗浄工程の後、バッファを移送するために濾紙を使用する。誤って、各洗浄中にバッファーと一緒に標本を削除しないように注意してください。
2。固定精巣のトラックB.準備
- 1×PBS中の3.7%ホルムアルデヒドの最終濃度にPBS中37%ホルムアルデヒドのストック溶液を希釈することによって修正緩衝液を調製する
- PBS中1μg/ mlの1 mg / mlのDAPI原液を希釈することにより、DAPI染色バッファーを準備します。
- 正に荷電した顕微鏡用スライドガラスの上に、PBSの6μlのドロップ精巣を浸す。
- 手動で直線的にまたはそうでなければ優先睾丸を向ける。
- PBSを吸い取ると修正の6μLと交換するためにフィルタ一枚の紙を使用してください5分間の緩衝液。
- フィックス緩衝液を移送し、10分間DAPI染色緩衝液の6μlの試料を浸漬濾紙を使用する。
- 慎重に試験片の上に18×18ミリメートルのカバースリップを配置。
- イメージしながらバッファは、試料から蒸発しないことを保証するために明確なマニキュアを使用したカバースリップの端をシールします。
- スライド上の標本を見つけるのを容易にするために精巣の位置を指定し、画像化に進むためにマーカを使用してください。
3。免疫染色し精巣のトラックでの準備
カバースリップシリコーン処理:シリ·ソリューションを含む小さなトレイに複数の18×18ミリメートルカバースリップを浸し、ヒュームフード下、室温で1分間インキュベートする。カバースリップが完全に公開され、互いの上に積み重ねられていないことを確認します。
- シリコン処理したカバーガラス上のPBS 5μlのドロップ標本を置きます。東洋精巣希望の鋭いメスを用いて精巣を貫通として。優しくPBSを均等にカバーガラスとスライドとの間に分散さになることを可能にすること、カバーガラス上で正に帯電したガラス顕微鏡スライドを配置。カバーガラスとスライドの間に余分なバッファを逃がすために、ろ紙の小片を使用してください。緩衝液を濾紙により除去されるように、圧力の増加は、精巣スカッシュう。いくつかのプロトコルの過程で失われたり、破損する恐れがありますように、多くの検体を同時に準備する必要があります。標本の異なるタイプを同時に調製する場合は、ガラス彫刻スライドを標識するために使用することができる。
- 1 70%エタノール中で1分間ずつ3回に続いて、水に分ごとに、、水に1分間の最後の洗浄のためにカバースリップ3回洗浄します。ヒュームフードの下に空気乾燥シリコン処理カバースリップを許可します。
- 液体窒素中にスライドをドロップすると、試料は5〜10分間凍結することができます。
- Lからスライドを削除する大規模な鉗子を用いて窒素をiquid。すぐにカバースリップを削除するには、メスを使用しています。試料は、スライド上に残るはずです。スライドに沿ってカバーグラスをスライドさせることで、このプロセスの間に検体を塗抹しないように注意してください。
- 15分間-20℃でガラスコプリン染色ジャーに予冷メタノール中でスライドをインキュベートします。
- 30秒-20℃で予備冷却アセトンを含むガラスコプリン染色ジャーにスライドを転送します。
- ガラスコプリン染色ジャーを用いて室温でPBS中で1分間スライドを洗浄します。
- 0.1%トリトン-X100、1%ウシ血清卵白(BSA)を含むPBSを補完することにより、PBST-Bを準備します。 (工程3.14)から二次抗体と同じ宿主種から5%正常血清の非特異的結合二次抗体から産生され、バックグラウンドノイズを低減する代わりにBSAを用いてもよい。
- 非特異的部位をブロックするためのガラスコプリン染色ジャーにPBST-Bで10分間スライドをインキュベートします。
- の井戸を埋める水で水分室。チャンバー内の湿度は、インキュベーション工程の間に試料からの抗体溶液の蒸発を最小化する。
- 100μg/ mlのRNアーゼAをRNase Aを試料中のRNAを分解し、またガラス面に強力に吸収することにより、追加のブロック剤として機能して、PBST-Bを補充することによって、PBST-BRを準備します。
- 均等に抗体溶液を広げて、蒸発する抗体溶液を保護するために、試験片の上にパラフィルムの約1x1のCM作品を配置します。水分室を閉じ、室温で1時間、一次抗体に検体をインキュベートする。
- PBST-Bからスライドを削除します。試料自体を乾燥しないように注意を使用して、試料の周りのスライドの領域を乾燥させるために濾紙を使用する。最後に、試料を上に向けて水分室でスライドを配置します
- 優しくスペックの上に、PBST-BRで希釈した一次抗体を100μlを追加imen(1:200、一般的に特徴づけられていない抗体のための良い出発濃度である)。
- パラフィルムの約1×1cmの片に検体を覆い、水分室を閉じます。室温で1時間、二次抗体で試料をインキュベートする。
- 水分室を開き、ゆっくりとスライドからパラフィルムを除去するために鉗子を使用しています。洗浄するために、室温でガラスコプリン染色ジャーに、PBST中で5分間スライドをインキュベートします。合計3回の洗浄のためにこのプロセスを繰り返します。
- PBST-Bからスライドを外し、試料を上に向けて水分室に配置します。静かに試料の上に、PBST-BR中に希釈した二次抗体を100μlを加える。
- 水分室を開き、ゆっくりとスライドからパラフィルムを除去するために鉗子を使用しています。再び、PBS中で5分間ずつ3回に続くガラスコプリン染色ジャーにPBST中で5分間ずつ試料3回洗う。
- キムワイプ、ろ紙にを使用して、慎重に触れたり、標本を乾燥しないように注意しながら、スライドの表面を乾燥させます。
- 、試料に取り付けメディアの6μlを加え(シリコーンでコーティングされていない)きれいなカバーガラスで覆い、シールはマニキュアとエッジ。
- スライド上の標本を見つけるのを容易にするために精巣の位置を指定し、画像化に進むためにマーカを使用してください。
4。イメージングの注意
イメージングは、直立または逆正規光学顕微鏡または共焦点顕微鏡を用いて達成することができる。これは、顕微鏡は、特にライブ精巣標本(トラックA)のイメージングのため、位相差を装備することが重要である。この機能は、最近になって、共焦点顕微鏡で利用可能となっています。
精巣が自然に(トラックA)をブレークすると、チップは(セル領域幹)は、通常、最初に検索し、向きに使用する優れたマーカーを提供し、そのまま維持され、容易に識別されている。
_content ">中心小体は、かなり小さい構造であり、画像は、したがって、63Xまたは100X目標、4 - 6Xのズーム倍率を使用して撮影する必要があり、可能性は少なくとも512×512ピクセルの解像度。結果
中心体は、精子形成の過程で、複数の形態学的および機能的な変換を受ける。精子形成のこの特性は、精巣中心体生物学のさまざまな側面を研究するための有用なシステムになります。一つのこのような容易に観察プロセスは中心体の伸びである。精原細胞では、centriolarマーカーANA1-GFPは、0.6ミクロン、長中心小体( 図4a)をマークします。この中心小体は、精子形成の間に伸長し、ほぼ成熟した精子細胞中の2.5μmの長さに達する。 ショウジョウバエの精子中心小体が一意に長くしているので、撮影中心体は伸び( 図4b)に関する定量的ステートメントを作成するために使用することができる。中心小体の長さの分析もまた、変異体バックグラウンドで実行することができ、種々の変異体は、中心小体の成長( 図5)を変更することが同定されている。例としては、 常に初期(ALY)とキャノン(CAN)である、突然変異はそのarresTの減数分裂30の開始前に精子形成が、中心小体の伸長をブロックしない。これらの変異体では、成熟した精母細胞の中心小体は、1.8ミクロンの最大値に達し対照細胞の中心小体と比較して約2.4〜程度に成長する。
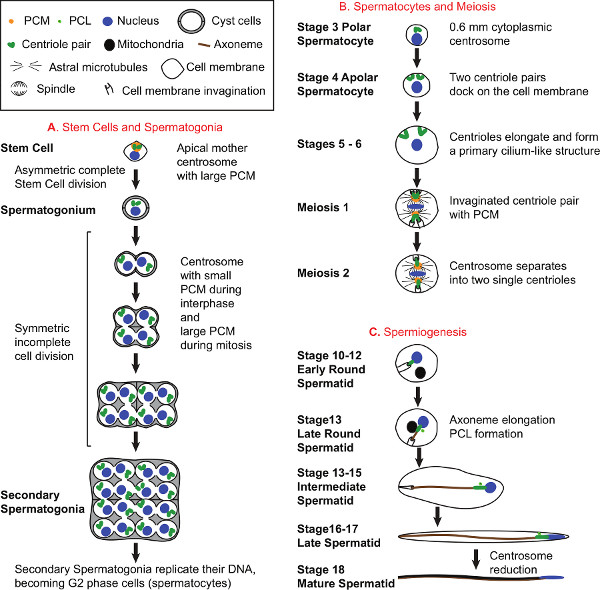
図1。精子形成および中心体生物。幹細胞と精原細胞のA)の開発。すべての精子細胞は精巣の先端チップで発見幹細胞に由来する。各幹細胞は、母中心体と娘中心体31を継承した前駆精原細胞を継承する幹細胞を形成するために、非対称に分割します。精原細胞の形として、彼らは精子形成を通じて精母細胞および精子細胞を取り囲むように続けて2シスト細胞に囲まなる。精母細胞および減数分裂の16精原細胞、2中心小体を含む各を生産する精原細胞の分裂4回。B)の開発。精母細胞の開発中に、中心小体は、セル当たり2組に編成4中心小体と嚢胞あたり64中心小体を生成するために、もう一度複製します。初期の精母細胞発達の間、各中心小体は、それに原形質膜、ドックに移動し、一次繊毛18,32-34に似た構造を形成して伸長する。成熟した精母細胞では、中心小体の長さは、約1.8ミクロンに達する。中心体は減数分裂に重要な役割を果たしている。減数分裂の間、私はまだ、セルの中心に向かって、細胞膜に移動に取り付けられており、その遠位端に細胞膜陥入を作成している中心小体のペア。中心小体の周りのPCMは、成長アストラル微小管を核とし、スピンドルポールと共局在。単一の中心小体が、プレゼンされるように、減数分裂IIへの移行中に、中心小体ペアは分離各紡錘体極。C)精子のT。減数分裂IIの終了時に、初期の円形精子細胞は、陥入細胞膜に結合した単一の中心小体を持っています。大きな丸いミトコンドリア誘導体は、核の近くで発見され、それ以降の後半円形精子の高まり軸糸に沿って細長くし始める。精子形成の間に、細胞質内部の軸糸フォームと長くなる。また、PCL(近中心小体のように)と呼ばれる新しいcentriolar構造は、既存の中心小体1近くに表示されます。精子形成の終了時に、共通の嚢胞を共有する細胞が完全に成熟した精子になるように、互いに分離する。精母細胞の発達、(B)と精子(C)の図は、それぞれ嚢胞あたり、16精母細胞のう ち、唯一の1セルおよび64精子細胞を描写し、嚢胞細胞を描写しないでください。 大型を見るにはここをクリックしてくださいR図。
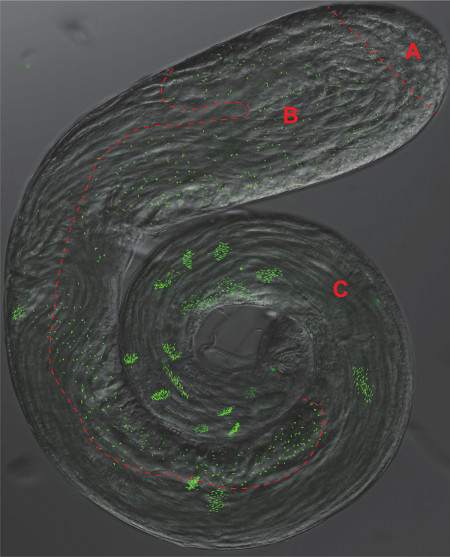
図2。 ショウジョウバエ精巣。汎centriolarマーカーアナ1-GFPを発現する全マウント精巣の位相差とGFP蛍光顕微鏡写真のオーバーレイ。パネル図1の1-3に対応した個別の領域は、細胞および精原細胞、B)は精母細胞と減数分裂、C)の精子幹細胞)赤い点線Aで区切られています。
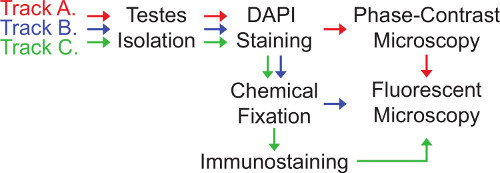
図3。 ショウジョウバエ精巣でのイメージング中心体に向けてトラック。

図4。中心体伸び精子形成の間。 A)各段は位相差画像(左)、蛍光画像(中央)、および中心体の拡大像(右)を示す。位相差画像は、細胞、核、核小体、ミトコンドリアの位置や形態に基づいて、特定の細胞の段階を示しています。蛍光画像は、DAPI(青色)で染色したDNAを示す。中心体の画像はAsterless-GFP(ASL、トップ画像)と、ANA1-GFP(ANA1、一番下の画像)によって標識され中心体を示している。白丸は、位相コントラストおよび蛍光画像の両方で、細胞膜を強調する。破線の白丸と蛍光画像の灰色の円はそれぞれ、核および核小体の位置を強調表示します。 Y-染色体に黄色い矢印いくつかのループ。赤の円は、ミトコンドリアをマーク破線。ステージ1-6は、29と13から17の段階を指し、32の細胞の段階の説明を参照します。ステージ1:一次精母細胞。小細胞精巣のチップとして同定した。ステージ2A:ポーラー精母細胞。核の一方の側のミトコンドリアキャップの存在によって同定した。ステージ3:無極性精母細胞。一次精母細胞とミトコンドリアキャップの欠如よりも、その相対的な大きなサイズで識別。ステージ4:一次精母細胞。すべて3 Y染色体ループ:すべての出現により同定した。ステージ5:成熟した精母細胞。核サイズのさらなる増加により識別精子形成で生産最大の精母細胞、。ステージ6:減数分裂前精母細胞。 Y染色体ループが崩壊し、核が消えます。ステージ13:タマネギステージ精子細胞。等しいサイズの核とミトコンドリアを含む円形細胞。ステージ17:後期精子細胞。 bundlの一部として残る細長い精子細胞と識別精巣のベースの近くで見つけ核を有する64精子細胞のE。、核は精嚢で見つかった、成熟した精子細胞よりわずかに広い。スケールバーは10μmと1μmである。 B)グラフAsterless-GFP(青)とANA1-GFP(緑色)によって測定される各ステージの平均値と標準偏差を示す。ステージ6は、Asterless-GFP(青)とANA1-GFP(緑色)平均と標準偏差が重なっのみAsterless-GFP(青)は明らかである。ステージ13から始まり、Asterless-GFPは、全体の中心小体を飾るず、測定は(ND)決定されなかった。
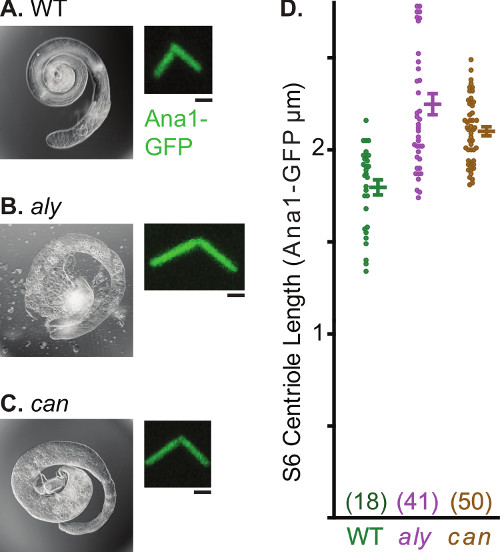
図5。 ALY缶変異体のステージ6精母細胞内の異常に長い中心小体。全体精巣および代表中心体LAの蛍光パネルのAC)の光学顕微鏡写真ANA1-GFPによってbeled。 ALYに精巣の異常な形状に注意してくださいすることができ 、グラフは、平均、標準偏差を示し、野生型中心小体の長さのデータ配信、ALYおよびCAN)減数分裂の停止の結果、Dのように精子細胞の不足に起因する変異体、 。各データ点のサンプル番号を括弧内にある。スケールバーは1μm。
ディスカッション
遺伝的にタグ付けされた中心体マーカーを使用してフライ精巣で中心体生物学を研究することは、野生型と変異型のコンテキストの両方で中心体機能および活性を評価するための有用な方法である。具体的には、トラックAは、奇形、misegregation、不安定性、または新しい変異体を同定するための努力に異常な長さと中心体の異常の迅速なスクリーニングに適しています。さらに、ライブの準備中の精子細胞の繊毛は、解剖後、約15分間の運動性のままであり、トラックAに住んで精巣の使用も容易に対処すべき精子の運動を可能にします。精子運動性繊毛の活性を直接中心体機能に関連するので、アッセイは、繊毛機能上の様々な中心体の変異の効果を決定するために行うことができる。トラックBの統計データは、例えばセルおよびまたは嚢胞当たりの細胞数当たりの中心小体の数をカウントするように要求され、特に、より具体的な観測のために使用することができる。トラックCは最もusefuです抗体を用いて染色を必要とし、詳細な観測のためのL。例としては、幹細胞、例えば、アセチル化チューブリンなどの利用可能なタグがありません、または変異タンパク質が存在しないことや誤局在を確認するために、タンパク質の染色などの特定の細胞型のラベルが含まれています。
中心体と中心体に関連した構造を画像化する際に、遺伝的にタグ付けされたマーカーではなく、抗体を使用することだけではなく、実験的に簡単ですが、また、より堅牢で再現性のある結果を提供します。したがって、遺伝的にタグ付けされた中心体タンパク質の使用は、大規模なデータセットを必要と機構的·定量分析のための信頼できるアプローチです。例えば、遺伝的にタグ付けされた中心体マーカーの使用は、中心小体の長さの定量化のために特に貴重となっている。このような分析は、種々の変異が中心小体の長さの変動に基づいて、二つのカテゴリーに分類することができることを明らかにした。 1つのカテゴリーは、変異を含むそのチャンネルGEの中心小体の長さが、標準偏差1と他のカテゴリには影響しませんが中心小体の長さと長さが11の標準偏差の両方に影響を与える変異を含んでいる。このような定量的なデータは、特定の中心体の遺伝子の機能に有益な洞察を提供することができます。標準偏差の増加に伴い、欠陥中心小体の長さを示す中心体変異体はcentriolar構造の不安定化に起因する可能性がある。しかし、通常の標準誤差、欠陥中心小体の長さは変異が構造的に中心小体を不安定化により、中心小体長さを制御する制御機構の変化にある可能性が高いですしないことを示すことがあります。により免疫染色での不整合が、定量的な分析は、抗体単独マーカーの使用では困難である。
中心体は、大規模で複雑なタンパク質性の構造であり、そのタンパク質の多くは、唯一、その内部に発見された。遺伝的にタグ付けされた中心体を使用した抗体ではなくマーカーは、1が一貫エピトープ抗体マーカーアクセスできない可能性があり、中心体の内部コンポーネントにラベルを付けることができます。 Bld10-GFPは、1より均一な分布を示している、例えば、抗体を用いてBld10の局在化の研究は、タンパク質が中心小体13の遠位端と近位端部に濃縮されていることが見つかった。しかし、これはタンパク質分布に影響を与えることができるように、特定の遺伝的にタグ化タンパク質の発現レベルを考慮することも重要である。 SAS-4-GFPおよびSAS-6-GFPの局在はそれらの内因性下で発現が一方中心小体1,16,35の近位端に制限され、SAS-4-GFPおよびSAS-6-GFPは、下で発現強力なユビキチンプロモーターは、中心小体12,14の全長に沿って局在している。別の重要な考慮事項は、タンパク質機能に対する遺伝的タグの効果である。遺伝的に標識タンパク質が機能的であるかどう分析して、TESことができますテッド変異体背景に遺伝子組換えタンパク質を導入し、トランスジェニック蛋白質が変異体の表現型を救済する場合に検査することによって。
ショウジョウバエ精巣の固定は、化学固定剤の様々な方法を用いて行うことができる。ここでは、ホルムアルデヒド(トラックB)およびメタノール - アセトン(トラックC)の両方で固定を説明します。しかしながら、固定剤のいずれかを交換可能に使用することができ、様々な固定剤は、化学的に天然の抗体のエピトープを破壊する可能性があるため、免疫染色のために適当な固定剤の選択は、実験的に決定されなければならない。次の固定剤およびインキュベーション条件は、一般的に使用される:3.7%ホルムアルデヒド、室温で5分間、メタノール、-20℃で15分間、アセトン、-20℃で10分間、メタノール、15分-20°C.続いてアセトン℃-20℃、30秒、-20℃でのエタノール、20分アセトン、メタノール、エタノールとの固定は、免疫染色、固定WIの拡張透過処理工程を必要としませんが第ホルムアルデヒドは、細胞膜を透過し、細胞内のエピトープへの抗体のアクセスを許可するように、室温でPBST-Bで1時間インキュベートし、続いされるべきである。さらに、特定の固定剤は、特定の抗原に対してより適している。例えば、ホルムアルデヒド機能が十分に小さなタンパク質の固定のためのに対し、メタノール、アセトン、大きな分子複合体36の固定に適している。
ショウジョウバエ精巣の免疫染色は、以前にクロマチン構造及び微小管細胞骨格29,37を観察するために記載されている。ここで、(Cトラック)、手続きは、遺伝的にタグ化タンパク質を含有する中心体の構造を分析するために最適化されている。私たちは、 ショウジョウバエの精巣での作業に不慣れな人々を導くためには、この手順の詳細な説明を提供しています。この手順は、複数を使用して、例えば、精巣、および形態の保存性を向上させる修飾を含むiliconizedカバースリップと正に荷電したガラス顕微鏡スライド。
開示事項
この出版物への自由なアクセスがライカマイクロシステムズによってサポートされていました。
謝辞
この作品は、NIHおよび一般医科学研究所からの助成金(R01GM098394)だけでなく、全米科学財団からの助成金1121176によってサポートされていました。
資料
| Name | Company | Catalog Number | Comments |
| DAPI | Invitrogen | D1306 | |
| Positively Charged Slides | AZER Scientific | EMS200A+ | |
| Feather Microscalpel | Electron Microscopy Sciences | 72045-30 | |
| 37% Formaldehyde or Paraformaldehyde | Fisher Scientific | BP531-500 | |
| Phosphate Buffered Saline (PBS) | Boston Bioproducts | BM-220 | |
| 18x18 mm coverslips number 1.5 | VWR | 48366 205 | |
| Nail Polish | Electron Microscopy Sciences | 72180 | |
| Sigmacote | Sigma-Aldrich | SL2-100 ml | |
| Methanol | Fisher Scientific | A412-4 | |
| Acetone | Fisher Scientific | A949-1 | |
| Triton-X100 | Sigma-Aldrich | T9284-100ML | |
| BSA | Jackson ImmunoResearch | 001-000-162 | |
| RNAse A | 5 prime | 2900142 | |
| Filter paper | Whatman | 1001-055 | |
| Glass engraver | Dremel | 290-01 | |
| TCS SP5 confocal microscope | Leica | ||
| Mounting Media | Electron Microscopy Sciences | 17985-10 | |
| Immuno Stain Moisture Chamber, Black | Electron Microscopy Sciences | 62010-37 | |
| Glass Coplin Staining Jar, Screw Cap | Electron Microscopy Sciences | 70315 |
参考文献
- Blachon, S., et al. A proximal centriole-like structure is present in Drosophila spermatids and can serve as a model to study centriole duplication. Genetics. 182, 133-144 (2009).
- Hennig, W. Spermatogenesis in Drosophila. The International journal of developmental biology. 40, 167-176 (1996).
- Fabian, L., Brill, J. A. Drosophila spermiogenesis: Big things come from little packages. Spermatogenesis. 2, 197-212 (2012).
- White-Cooper, H. Molecular mechanisms of gene regulation during Drosophila spermatogenesis. Reproduction. 139, 11-21 (2010).
- Davies, E. L., Fuller, M. T. Regulation of self-renewal and differentiation in adult stem cell lineages: lessons from the Drosophila male germ line. Cold Spring Harb Symp Quant Biol. 73, 137-145 (2008).
- Belote, J. M., Zhong, L. Duplicated proteasome subunit genes in Drosophila and their roles in spermatogenesis. Heredity. 103, 23-31 (2009).
- Xiao, X., Yang, W. X. Actin-based dynamics during spermatogenesis and its significance. Journal of Zhejiang University. Science. B. 8, 498-506 (2007).
- Hennig, W. Chromosomal proteins in the spermatogenesis of Drosophila. Chromosoma. 111, 489-494 (2003).
- Wakimoto, B. T. Doubling the rewards: testis ESTs for Drosophila gene discovery and spermatogenesis expression profile analysis. Genome research. 10, 1841-1842 (2000).
- Avidor-Reiss, T., Gopalakrishnan, J. Building a centriole. Curr Opin Cell Biol. , (2012).
- Blachon, S., et al. Drosophila asterless and vertebrate Cep152 Are orthologs essential for centriole duplication. Genetics. 180, 2081-2094 (2008).
- Basto, R., et al. Flies without Centrioles. Cell. 125, 1375-1386 (2006).
- Mottier-Pavie, V., Megraw, T. L. Drosophila bld10 is a centriolar protein that regulates centriole, basal body, and motile cilium assembly. Mol Biol Cell. 20, 2605-2614 (2009).
- Rodrigues-Martins, A., et al. DSAS-6 Organizes a Tube-like Centriole Precursor, and Its Absence Suggests Modularity in Centriole Assembly. Curr Biol. 17, 1465-1472 (2007).
- Stevens, N. R., Dobbelaere, J., Brunk, K., Franz, A., Raff, J. W. Drosophila Ana2 is a conserved centriole duplication factor. J Cell Biol. 188, 313-323 (2010).
- Gopalakrishnan, J., et al. Sas-4 provides a scaffold for cytoplasmic complexes and tethers them in a centrosome. Nat Commun. 2, 359 (2011).
- Gopalakrishnan, J., et al. Tubulin nucleotide status controls Sas-4-dependent pericentriolar material recruitment. Nat Cell Biol. 14, 865-873 (2012).
- Riparbelli, M. G., Callaini, G., Megraw, T. L. Assembly and persistence of primary cilia in dividing Drosophila spermatocytes. Dev Cell. 23, 425-432 (2012).
- Maines, J. Z., Wasserman, S. A. Post-transcriptional regulation of the meiotic Cdc25 protein Twine by the Dazl orthologue Boule. Nat Cell Biol. 1, 171-174 (1999).
- Herrmann, S., Amorim, I., Sunkel, C. E. The POLO kinase is required at multiple stages during spermatogenesis in Drosophila melanogaster. Chromosoma. 107, 440-451 (1998).
- Yamashita, Y. M., Jones, D. L., Fuller, M. T. Orientation of asymmetric stem cell division by the APC tumor suppressor and centrosome. Science. 301, 1547-1550 (2003).
- Dix, C. I., Raff, J. W. Drosophila Spd-2 Recruits PCM to the Sperm Centriole, but Is Dispensable for Centriole Duplication. Curr Biol. , (2007).
- Stevens, N. R., Dobbelaere, J., Wainman, A., Gergely, F., Raff, J. W. Ana3 is a conserved protein required for the structural integrity of centrioles and basal bodies. J Cell Biol. 187, 355-363 (2009).
- Giansanti, M. G., Bucciarelli, E., Bonaccorsi, S., Gatti, M. Drosophila SPD-2 Is an Essential Centriole Component Required for PCM Recruitment and Astral-Microtubule Nucleation. Curr Biol. , (2008).
- Januschke, J., Llamazares, S., Reina, J., Gonzalez, C. Drosophila neuroblasts retain the daughter centrosome. Nat Commun. 2, 243 (2011).
- Cheng, J., et al. Centrosome misorientation reduces stem cell division during ageing. Nature. 456, 599-604 (2008).
- Zamore, P. D., Ma, S. Isolation of Drosophila melanogaster testes. J. Vis. Exp. , e2641 (2011).
- Fuller, M. T., Bate, M., Martinez-Arias, A. . The Development of Drosophila melanogaster. , 71-174 (1993).
- Cenci, G., Bonaccorsi, S., Pisano, C., Verni, F., Gatti, M. Chromatin and microtubule organization during premeiotic, meiotic and early postmeiotic stages of Drosophila melanogaster spermatogenesis. J Cell Sci. . 107 (Pt. 12), 3521-3534 (1994).
- White-Cooper, H., Schafer, M. A., Alphey, L. S., Fuller, M. T. Transcriptional and post-transcriptional control mechanisms coordinate the onset of spermatid differentiation with meiosis I in Drosophila. Development. 125, 125-134 (1998).
- Yamashita, Y. M., Mahowald, A. P., Perlin, J. R., Fuller, M. T. Asymmetric inheritance of mother versus daughter centrosome in stem cell division. Science. 315, 518-521 (2007).
- Tates, A. D. . Cytodifferentiation during Spermatogenesis in Drosophila melanogaster: An Electron Microscope Study. , (1971).
- Baker, J. D., Adhikarakunnathu, S., Kernan, M. J. Mechanosensory-defective, male-sterile unc mutants identify a novel basal body protein required for ciliogenesis in Drosophila. Development. 131, 3411-3422 (2004).
- Avidor-Reiss, T., Gopalakrishnan, J., Blachon, S., Polyanovsky, A., Schatten, H. . The Centrosome: Cell and Molecular Mechanisms of Functions and Dysfunctions in Disease. , (2012).
- Gopalakrishnan, J., et al. Self-assembling SAS-6 multimer is a core centriole building block. J Biol Chem. 285, 8759-8770 (2010).
- Hassell, J., Hand, A. R. Tissue fixation with diimidoesters as an alternative to aldehydes. I. Comparison of cross-linking and ultrastructure obtained with dimethylsuberimidate and glutaraldehyde. The journal of histochemistry and cytochemistry : official journal of the Histochemistry Society. 22, 223-229 (1974).
- Pisano, C., Bonaccorsi, S., Gatti, M. The kl-3 loop of the Y chromosome of Drosophila melanogaster binds a tektin-like protein. Genetics. 133, 569-579 (1993).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved