Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
La manipulación genética de las neuronas cerebelosa gránulo
En este artículo
Resumen
Morfogénesis neuronal y la migración son eventos cruciales que subyacen el desarrollo adecuado del cerebro. Aquí se describen los métodos para manipular genéticamente las neuronas granulares de cerebelo en cultivo y el cerebelo en desarrollo para la evaluación de la morfología y las características migratorias de las neuronas.
Resumen
Eventos de desarrollo en el cerebro, incluyendo la morfogénesis neuronal y la migración son altamente orquestados procesos. In vitro e in vivo análisis permite una caracterización en profundidad para identificar las vías que participan en estos eventos. Neuronas granulares de cerebelo (CGCs) que se derivan de la cerebelo en desarrollo son un sistema modelo ideal que permite análisis morfológicos. Aquí se describe un método de cómo manipular genéticamente CGCs y cómo estudiar axono y dendritogénesis de las neuronas individuales. Con este método los efectos de la interferencia de ARN, la sobreexpresión o moléculas pequeñas se pueden comparar para controlar las neuronas. Además, la corteza cerebelosa roedor es un sistema de fácil acceso en vivo debido a su desarrollo postnatal predominante. También presentamos una técnica de electroporación en vivo para manipular genéticamente el cerebelo en desarrollo y describir posterior del cerebelo se analizan para evaluar la morfología neuronal unnd migración.
Introducción
El cerebelo es un excelente sistema para estudiar los mecanismos de crecimiento de los axones y la migración. El cerebelo ha sido objeto de estudios anatómicos desde los albores de la neurociencia 1. Microscopía moderna y las técnicas inmunohistoquímicas han expandido significativamente y perfeccionado los descubrimientos iniciales por Santiago Ramón y Cajal 2-4. La genética del ratón de los estudios moleculares descubrieron los factores de crecimiento y de transcripción esenciales en el control del desarrollo del cerebelo, lo que condujo a una mayor comprensión de los acontecimientos cruciales requeridos para el cableado adecuado de los diferentes tipos de neuronas, incluyendo las neuronas granulares de cerebelo (CGCs) 5-7.
El cerebelo es un derivado de rombómero 1 de la parte posterior del cerebro en desarrollo 8. El labio rómbica, que es parte del techo de la 4 ª ventrículo, da lugar a progenitores neuronales de gránulos cerebelosos, que constituirán la más numerosa población neuronal en elcerebelo adulto 9. A raíz de la migración rostral, se instalan en el esbozo del cerebelo. Aquí, la mitosis de precursores gránulo neuronas conduce a la dramática expansión de la capa granular externa (EGL), que tiene lugar después del nacimiento en roedores. Desde el EGL, las neuronas comienzan a migrar hacia el interior a través de la capa molecular (ML), más allá de la capa de células de Purkinje que tome en última instancia, la residencia en la capa granular interna (IGL 2). Durante este proceso migratorio, adquieren una forma bipolar con dos axones se extiende en el ML. Tras una posterior migración, el cuerpo de la célula migra lejos de los axones y los dos procesos se fusionan para formar un axón bifurcado, en forma de T 10. Posteriormente, estos axones fasciculada y se conocen como fibras paralelas. Habiéndose establecido en el IGL, CGCs crecen dendritas, que forman garras dendríticas para establecer sinapsis con las fibras musgosas. Para examinar los procesos fundamentales en el cerebelo en desarrollo, un combinado in vitro e in vivo approach permite obtener resultados fiables y conclusiones.
CGCs no sólo son las más numerosas neuronas del cerebelo, sino de todo el cerebro y pueden ser cultivadas a gran pureza 11-13. En la cultura, esta población neuronal altamente homogénea se convierte rápidamente postmitotic y adquiere una morfología polar con axones fácilmente identificables y dendritas. CGCs cultivadas han demostrado ser de gran utilidad para estudiar diversos aspectos del desarrollo neuronal, incluyendo la proliferación de progenitores, la diferenciación y el desarrollo axonal dendrita, la migración neuronal, la apoptosis y las propiedades electrofisiológicas (14-19 y muchos otros). El empleo de la manipulación genética ha ampliado la versatilidad de CGCs cultivadas y permitió una mayor comprensión mecanicista de los hechos mencionados. Transfección de neuronas cultivadas utilizando fosfato de calcio de baja eficiencia o métodos lipofílicas seguidos por inmunocitoquímica con marcadores de polaridad o software soportado análisis faciliTates la evaluación de, por ejemplo la morfología de las neuronas individuales en un denso cultivo neuronal. Con este enfoque, el papel de las proteínas de interés en axón o la dendrita de crecimiento puede ser estudiado 20-25,26-28. Este sistema de cultivo sin embargo es menos útil para analizar la migración neuronal como la migración es muy limitada en cultivos de alta densidad y requeriría cocultivos. El análisis in vitro de axón y el crecimiento de dendritas también permite el examen de las proteínas interconectados de una vía de señalización que utilizan combinaciones de interferencia de ARN (i), sobre-expresión o pequeñas moléculas.
Para establecer la relevancia de la proteína de interés en el axón y la regulación del crecimiento de dendritas o la migración neuronal, la electroporación in vivo técnica (IVE) permite el análisis en la corteza cerebelosa desarrollo. Debido al hecho de que el desarrollo del cerebelo en roedores se extiende camino en las dos primeras semanas después del parto, el cerebelo representa un accessibla estructura del cerebro le manipulaciones genéticas para examinar el desarrollo de los axones y dendritas, la migración neuronal, sinaptogénesis y apoptosis 20-24,29,30,26,27,31-34. Además, este sistema modelo es también útil para otros aspectos del desarrollo neuronal que requieren la corteza cerebelosa intacta como pathfinding axón, el cableado y la conectividad de las neuronas y de las interacciones neurona-glía Tomados en conjunto, este protocolo proporciona in vitro y en técnicas in vivo para hacer frente un enfoque complementario con respecto a la morfogénesis neuronal y la migración.
Protocolo
CGCs pueden producir o bien desde el primer día postnatal (P) 5 crías de ratón o de crías de rata P6. Seguimos un protocolo, descrito por Bilimoria y colegas, que utiliza un inhibidor mitótico para seleccionar para CGCs postmitotic 13.
Declaración de Ética:
Todos los experimentos con animales vivos se han realizado de acuerdo con el protocolo de los animales aprobado por el "Verbraucherschutz und Lebensmittelsicherheit" de la Baja Sajonia, Alemania.
Ensayo in vitro:
1. Preparación de ADN plásmido, Medios, y tampones para el fosfato de calcio método de transfección
- Disolver el ADN plásmido en agua libre de endotoxina estériles; DMEM (glucosa alta); hacer CaCl2 2,5 M; hacer 2x HBSS (disolver 4 g NaCl, KCl 0,1775 g, 0,095 g de Na 2 HPO 4 • 7H 2 O, 0,675 g de glucosa y 2,5 g de HEPES en 250 ml de agua ultrapura y ajustar el pH a 7,05, 7,08 y 7,11). Nota: Cuando se preparala solución 2x HBSS, pH de prueba que da mejores resultados en cuanto a la eficacia de transfección de determinada combinación de plásmidos.
2. La transfección de neuronas cultivadas
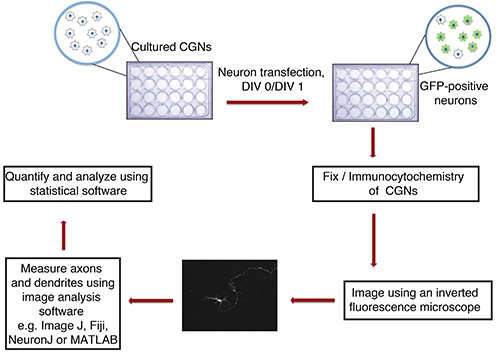
Figura 1. Diagrama de flujo de los axones in vitro y el ensayo de crecimiento de las dendritas. Cultivadas CGCs (placa de 24 pocillos con cubreobjetos de vidrio), aislado de las crías de rata P6, se transfectan en DIV 0 o 1 con precipitado de ADN que contiene un marcador de transfección fluorescente (GFP por ejemplo). Después de la fijación y la inmunocitoquímica, las neuronas son imágenes en una forma ciega. Las imágenes se importan en ImageJ y se miden los procesos. Las mediciones se procesan entonces utilizando un programa estadístico.
- CGCs Semilla (20 x 10 6 por placa de 24 pocillos, BME, suero de ternera al 10%, 2 mM penicilina-Streptomycin-Glutamina (PSG), 25 mM KCl) en ácido-lavado, 12 mm cubreobjetos de vidrio nítrico polyornithine recubierto en una placa de 24 pocillos con 500 l de media por pozo.
- En días in vitro (DIV) 0 (por lo menos 8 horas después de la siembra) o DIV 1, recoge medio de cultivo y mantener a 37 ° C. Lávese las neuronas dos veces con 500 l de DMEM precalentado y añadir 500 l de DMEM.
- Colocar las neuronas en la incubadora (37 ° C, 5% de CO 2) durante 45 min.
- Preparar 40 l de ADN precipitado para cada pozo mezclando: ADN (2-2,5 mg / pocillo, 10% del total de ADN debe ser un marcador de transfección por ejemplo, las buenas prácticas agrarias para visualizar las neuronas transfectadas), agua (hasta 18 l), añadir 2 l de CaCl2 2,5 M, mezclar bien y añadir 20 l de 2x HBSS.
- Incubar precipitado de ADN durante 5 min a TA.
- Añadir precipitado de ADN a cada pocillo e incubar las neuronas durante 18 min en la incubadora.
- Retire la mezcla de DMEM / DNA y lavar dos veces con 500 neuronas l de DM precalentadoEM.
- Añadir medio recogido desde el paso 2.2 de nuevo a las neuronas. Si las neuronas estarán en cultivo durante más de 3 días, suplemento de medios con glucosa 25 mM a DIV 3 para reponer la fuente de carbono.
- Después de 1-5 días, las neuronas sometidas a inmunohistoquímica utilizando anticuerpos GFP.
- Imagen por lo menos 30 neuronas individuales por condición en una forma ciega usando un microscopio de fluorescencia.
3. Mida los axones y dendritas con NeuronJ, un NIH ImageJ Plugin
Importante: Asegúrese de que las imágenes se escalan correctluy utilizando píxeles adecuada: relación micras dependiendo de magnificación y resolución de imagen.
- Convertir imágenes a 8 bits con ImageJ: Abrir imagen, elija 'Imagen' - Guardar Imagen '>' Tipo '- -> '8 bits'> '.
- Ejecute NeuronJ plugin y abrir la imagen de 8 bits.
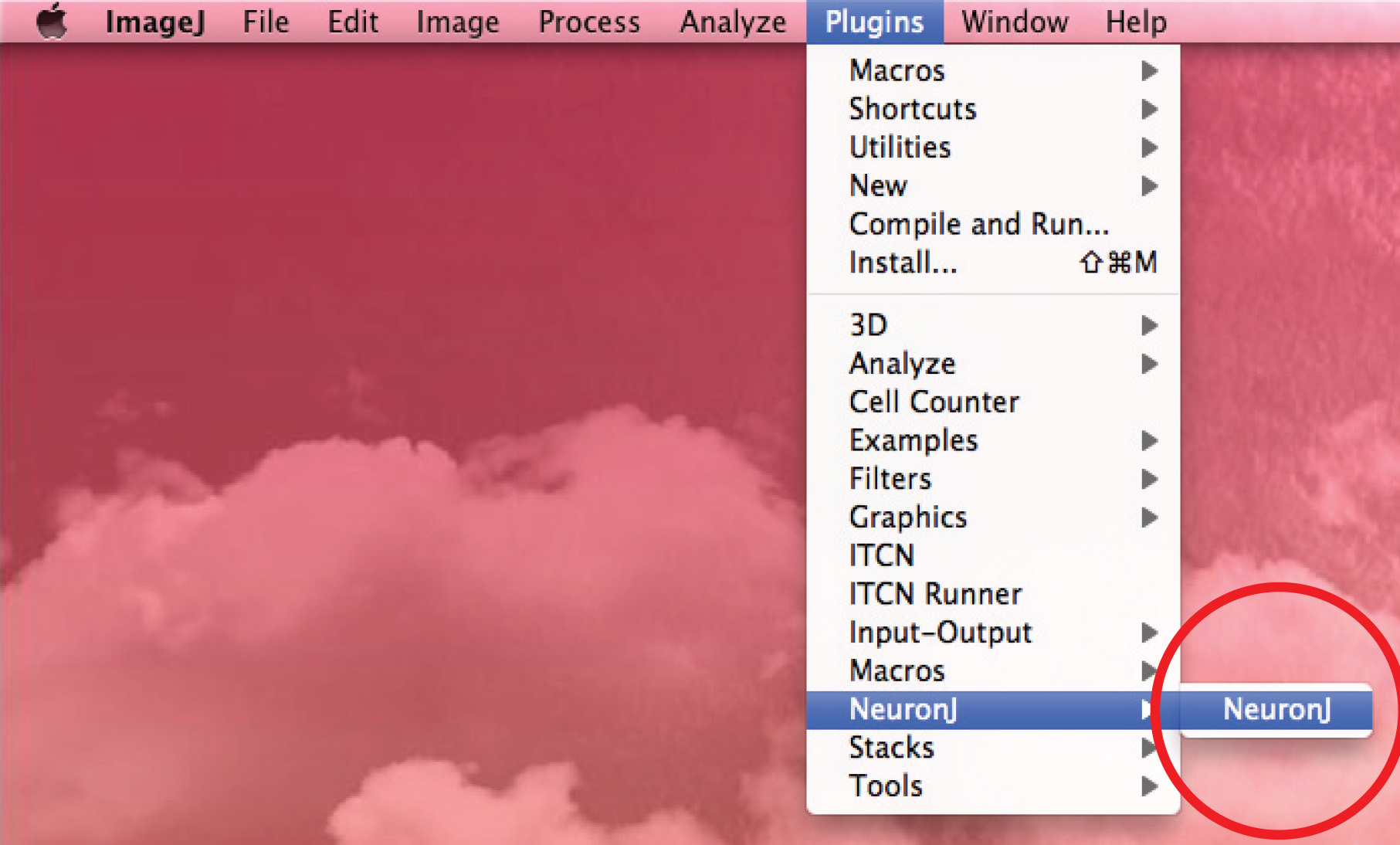
- Utilice la opción 'agregar trazados' para seguir el axón: click el botón izquierdo del ratón una vez al principio del axón y mover el ratón a lo largo del proceso. Doble click en la punta del axón si traza coincide con la forma axonal.
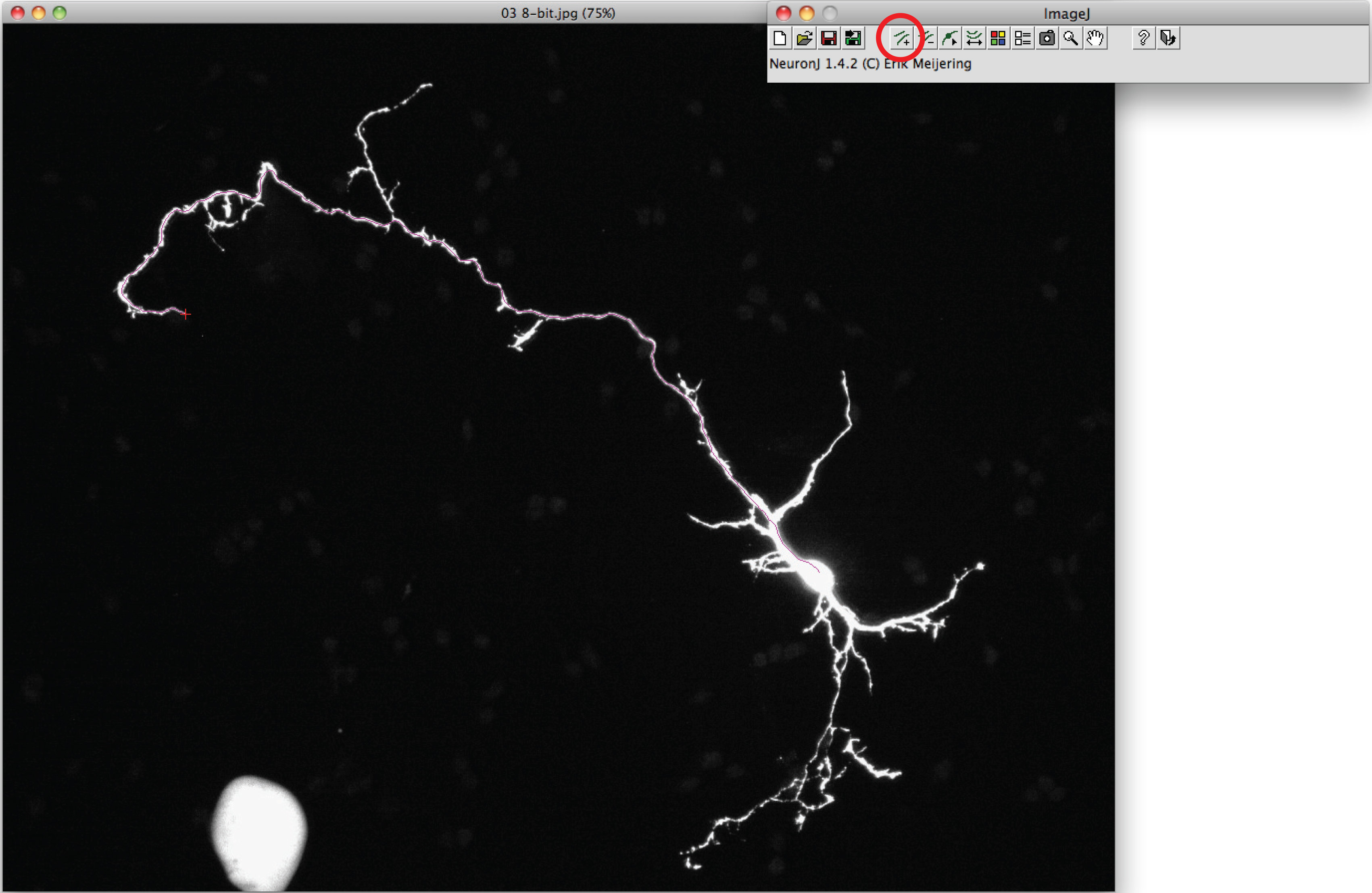
Nota: En caso de que la traza sugerido diferir de forma axonal, haga clic una vez en el proceso axonal anclar traza, haga doble click en la punta del axón. - Haz clic en "trazados medida", elija "Display mediciones rastreo 'opción y pulse" Ejecutar ". Mediciones Axon se visualizan todos de una nueva ventana. Para dendritas, elija la "opción mediciones grupales Pantalla 'y pulse en' Ejecutar '.
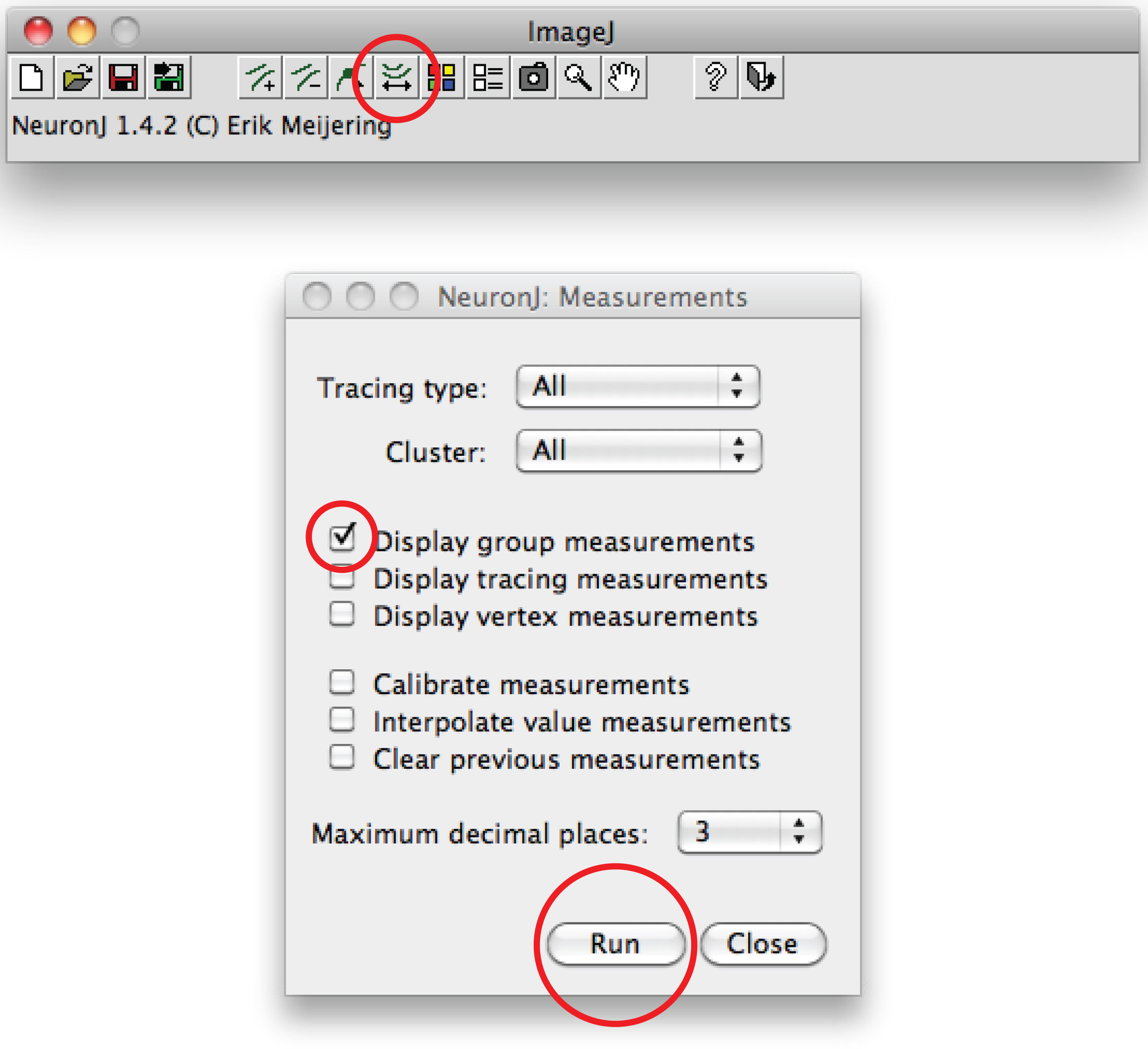
Total de mediciones de dendritas se visualizan todos de una nueva ventana. Guardar como un archivo independiente que se puede abrir en cualquier programa de hoja de cálculo. - Como alternativa para el trazado manual, utilice el software de Fiji: Haga clic derecho en el the opción 'línea recta', seleccione 'línea a mano alzada »,
mantener presionado el botón izquierdo del ratón y trace manualmente el proceso, pulse la tecla "Ctrl + M" a la medida. - Calcule la media la longitud dendrítica / axonal por condición y el uso de la prueba estadística apropiada.
En electroporación in vivo:
1. Equipo y Preparación de los reactivos
- Necesita 30 agujas G, espaciador (1-2 mm), jeringa, reductor de volumen muerto (DVR), electroporador y tweezertrodes, almohadilla térmica o una lámpara de calor infrarrojo, lámpara de cuello de cisne y el isoflurano.
- Ponga DVR en la aguja, luego coloque la aguja a la jeringa, y, finalmente, poner espaciador en la aguja (Figura 2).
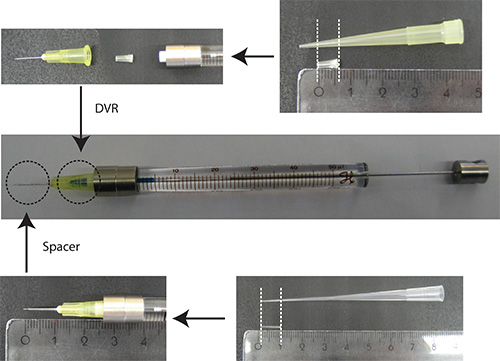
Figura2. Preparación de la aguja. DVR se corta una punta de pipeta de 200 l y se coloca en la aguja para reducir el volumen muerto. Espaciador se deriva de una punta de 200 l de carga y se coloca en el extremo de la aguja para regular la profundidad de penetración en el cerebelo a aproximadamente 2 mm. Unidades de la regla: cm - Disolver ADN en PBS/0.03% Fast Green. Nota: Como un marcador de transfección, es ventajoso usar una proteína fluorescente que se encuentra bajo un promotor específico de neuronas (por ejemplo Synapsin) para visualizar las neuronas sólo. 25% de la cantidad total de plásmido debe ser el plásmido que codifica el marcador de transfección.
- Hacer etanol al 70%.
- Mezclar volúmenes iguales de PTU y, 30% de sacarosa disuelto en PBS.
- Llene la jeringa con 4 l de ADN (4 g / l de ADN plásmido en PBS/0.03% Fast Green).
2. IVE de Ratas
Diagrama de flujo del IVE: véase la Figura 3
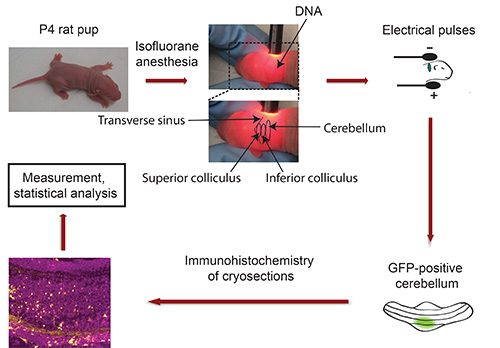
Figura 3. Diagrama de flujo de la electroporación in vivo. Crías de rata P4 se anestesian con isoflurano y el plásmido de ADN que codifica un marcador de transfección fluorescente (por ejemplo, GFP) se inyecta en el cerebelo, seguido por la exposición a 5 pulsos eléctricos. Cinco días más tarde, aislado de GFP-positivas cerebelo se seccionan y se somete a técnicas de inmunohistoquímica. Las imágenes se capturan utilizando un microscopio confocal y analizados utilizando el software Imaris. Los datos se procesan con un programa estadístico.
- Utilice crías de ratas P4 de la cepa albina (Wistar o Long Evans).
- Anestesie cachorros (uno tras otro) con isoflurano en caja pequeña (por ejemplo, cajas de puntas de pipeta P1000) con 200 l de isoflurano (empapado en el tejido) durante 1-2 minutos hasta que las crías ya no está en movimiento. Tenga cuidado de que los cachorros no entrar en contacto with de liquido isoflurano. Vigilar estrechamente el tiempo como cachorros individuales responden de manera diferente a la anestesia.
- Esterilizar parte posterior de la cabeza del cachorro con etanol al 70%.
- Fijar la cabeza del cachorro entre el pulgar y el dedo índice y el uso de la lámpara de cuello de cisne para localizar cerebelo de cachorro albino. El seno transverso delimita de forma pronunciada el cerebro medio (colículo superior e inferior) de los hemisferios corticales (Figura 3). El cerebelo está ubicado adyacente al cerebro medio y aparece en un tono más oscuro. Use un marcador permanente para indicar el cerebelo con un punto. Importante: Mantenga las crías en posición fija! Nota: En caso de anestesia desaparecerá durante este procedimiento, exponga las crías al isoflurano antes de inyectar el ADN.
- Insertar la aguja (Figura 3) e inyecte lentamente 3 l de ADN en el cerebelo.
- Deje que la solución de ADN se difunden durante 30-60 seg.
- Coloque la cabeza del cachorro entre tweezertrodes modo que el polo negativo hace contacto con la parte posterior de la cabeza (cerebelola región r) y que hace contacto con el polo positivo el lado opuesto de la cabeza (Figura 3).
- Asunto cachorro a 5 pulsos eléctricos. Ajuste de tensión con el peso de las crías para asegurar una buena eficiencia de la electroporación sin comprometer su supervivencia (Tabla 1).
Tabla 1. Electroporación de crías de rata P4.Peso Voltaje Pulso Intervalo 8-9 g 160 V 50 mseg 950 ms 9-10 g 165 V 50 mseg 950 ms > 10 g 170 V 50 mseg 950 ms - Deje que los cachorros se recuperan en la almohadilla caliente o debajo de una lámpara de infrarrojos. Volver crías para represar. Importante: Asegúrese de que la fuente de calor no inflige quemaduras.
- Sacrificio cachorros 5 días después de la electroporación mediante la colocación de ellos en CO 2 seguido por decapitación.
- Aislar el cerebelo y la pantalla para las buenas prácticas agrarias-positivas cerebelo utilizando un microscopio de fluorescencia.
- Fijar el cerebelo en el 4% PFA O / N a 4 ° C, y luego incubar en sacarosa al 30% a 4 º C hasta su fregadero cerebelo al fondo del tubo.
- Incrustar cerebelo en OCT/30% de sacarosa y cortar 40 micras secciones coronales utilizando un criostato. Nota: Sección cada cerebelo en una forma ciega.
- Secciones reservamos el derecho de inmunohistoquímica utilizando el anticuerpo GFP. Contrateñir con tinte nuclear (DAPI o Hoechst 33258) y determinar la localización de al menos 200 neuronas transfectadas por animal.
- Para un análisis en profundidad, subdividir el IGL en mitades, lo que resulta en una IGL superior frente al lavado de dinero y una IGL menor frente a la sustancia blanca y contar las neuronas positivas para GFP que residen en cada mitad. Nota: Número de neuronas positivas para GFP de cada sección en una forma ciega.
3. Medición Dendrita Largo, Adquirir las imágenes de la Sección de x, y, z Plane usa un microscopio confocal
Nota: por ejemplo, usar 40 imágenes para una sección de 40 m con un z-STWp de 1 micra.
- Serie de imágenes Abrir en el software, Imaris, para generar una imagen en 3D de las dendritas.
- Haga clic en el modo de 'Supera' para ver la neurona en 3D.
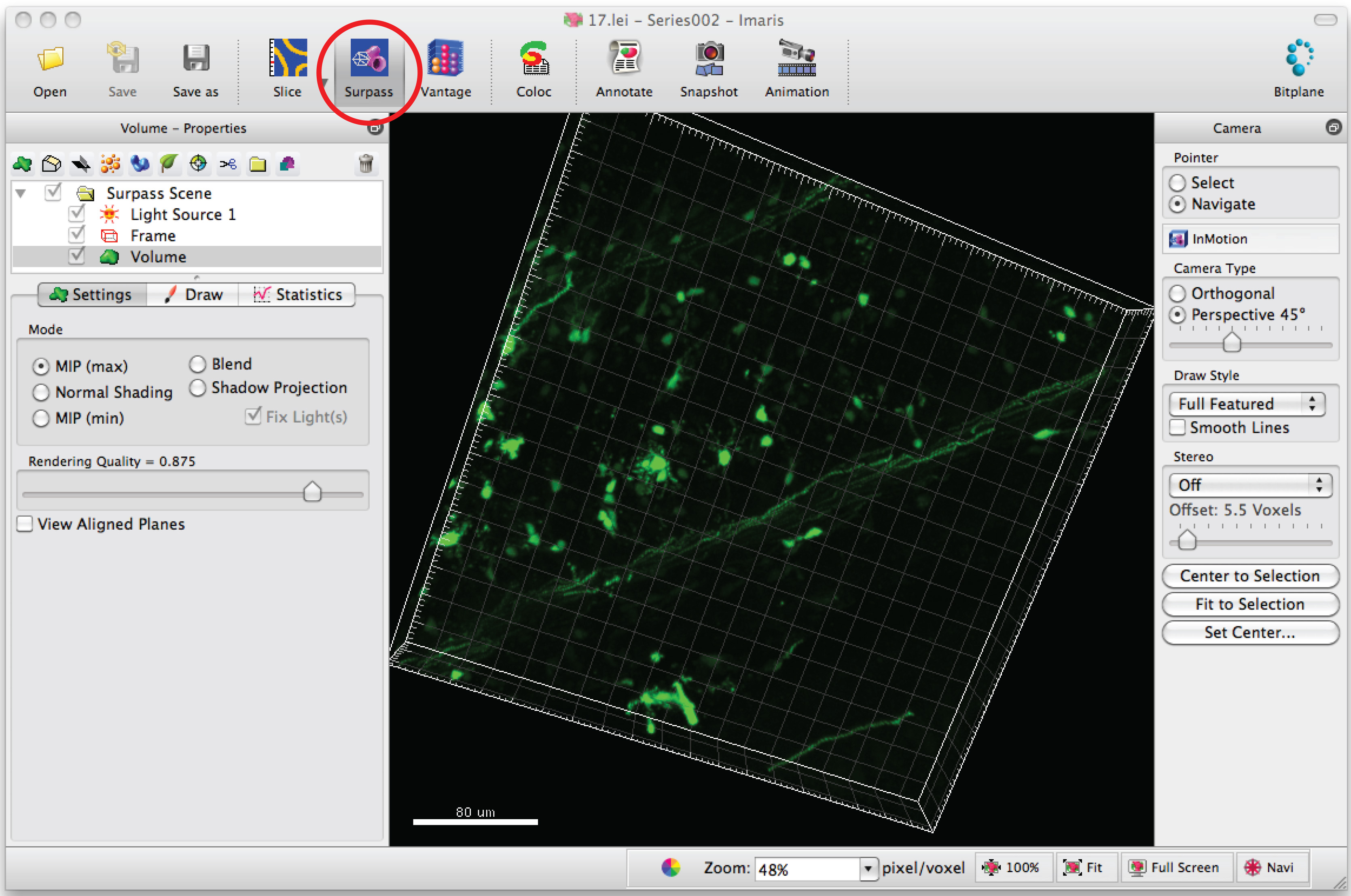
- Seleccione "Añadir nuevo filamento" y haga clic en "Cambiar la creación automática 'para iniciar el rastreo semiautomático.

Nota: Analizar cada imagen en 3D de una forma ciega - Seleccione la pestaña 'Draw' y 'AutoPath'.
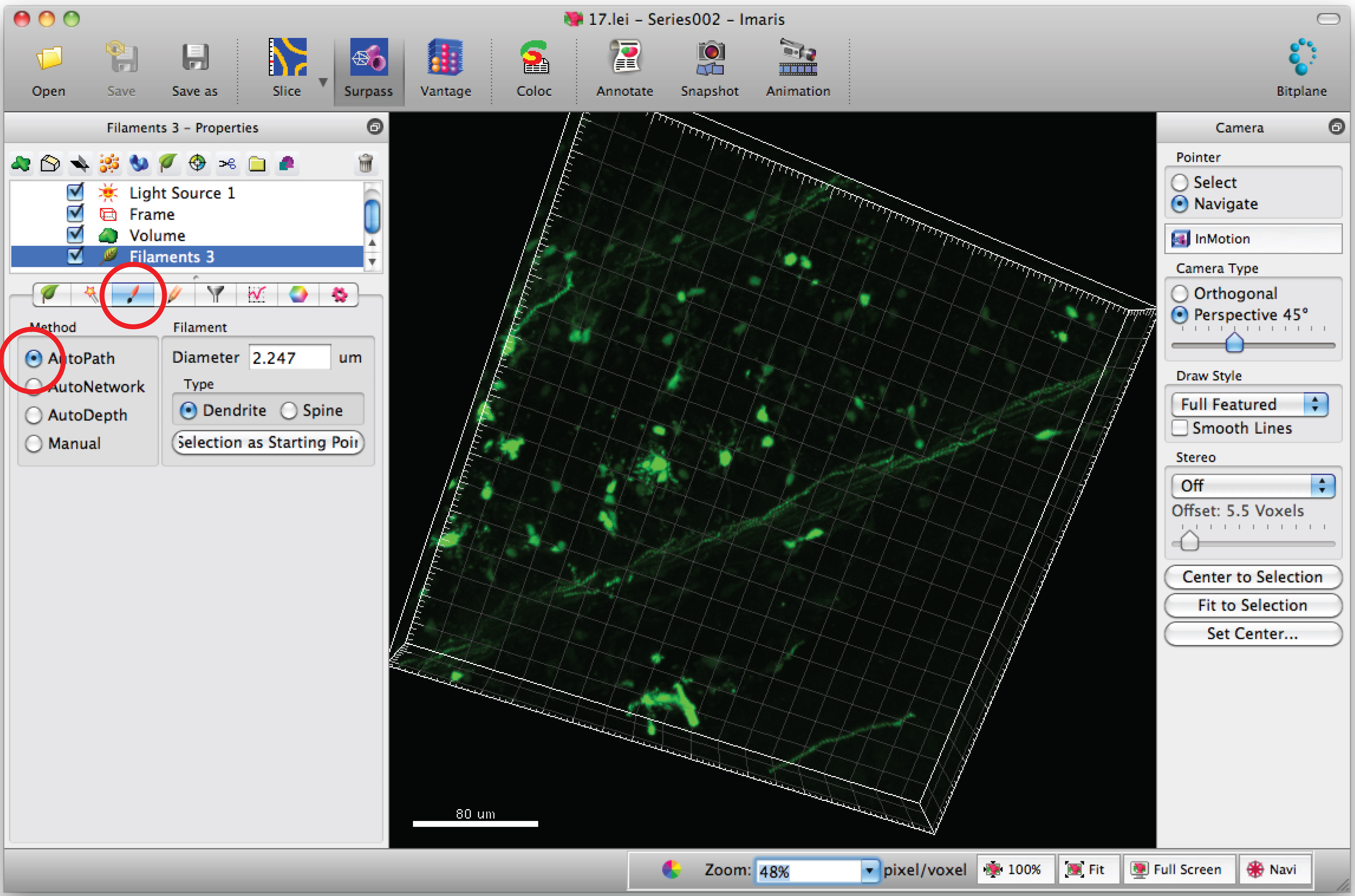
- Mueva el cursor del ratón sobre el ccuerpo ell y Shift + Clic derecho del ratón para seleccionar el cuerpo de la célula. Nota: cálculo automático de software puede requerir unos minutos.

- Añadir caminos al filamento (dendrita) usando Shift + Clic izquierdo del ratón. Nota: Las rutas pueden ser visualizados en tiempo real.
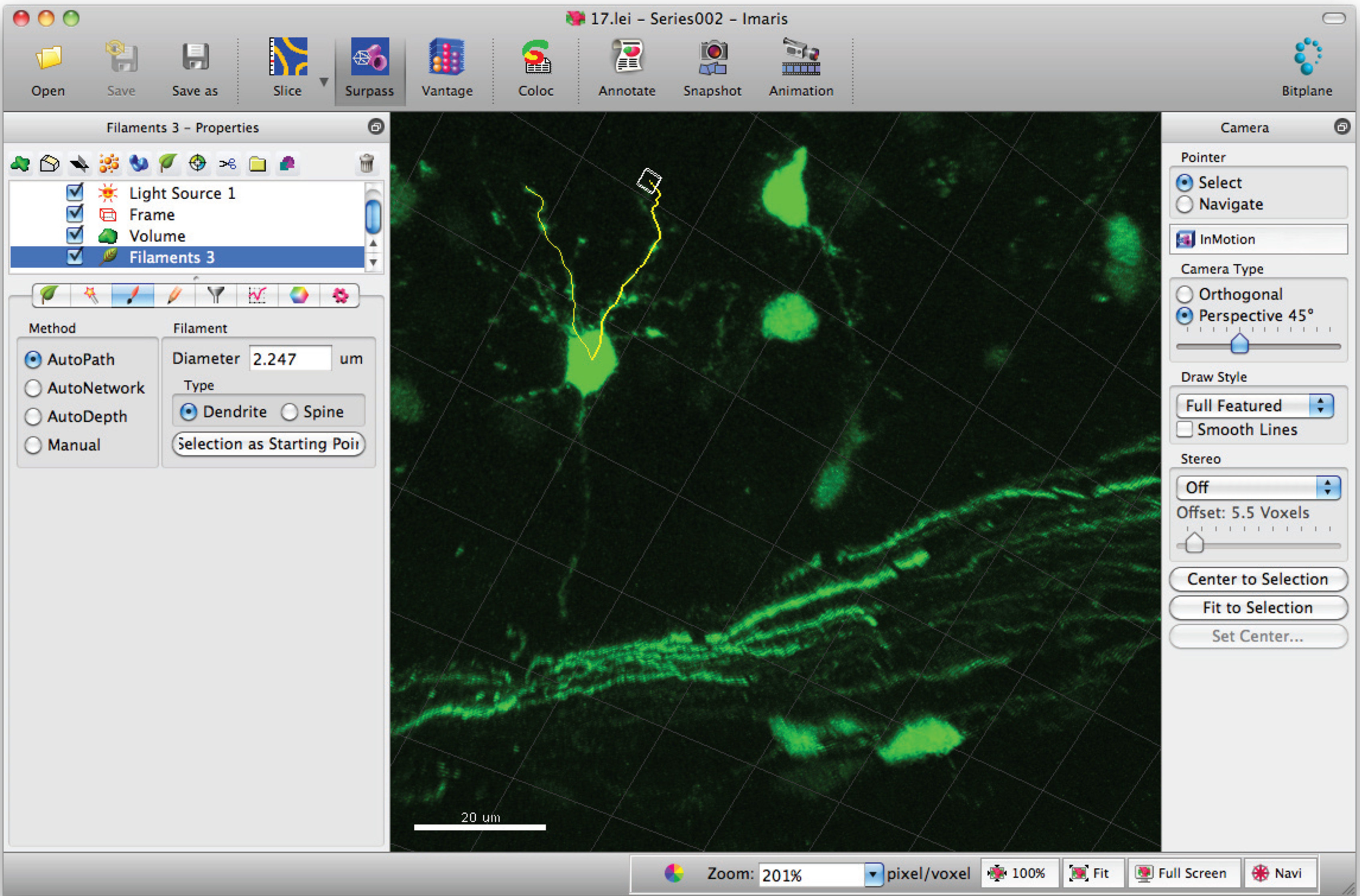
- Ir a la ventana de estadísticas de filamento y haga clic en, "valores específicos '" detalladas "y" longitud de filamento dendrita (suma) "por la suma de la longitud total de la dendrita.
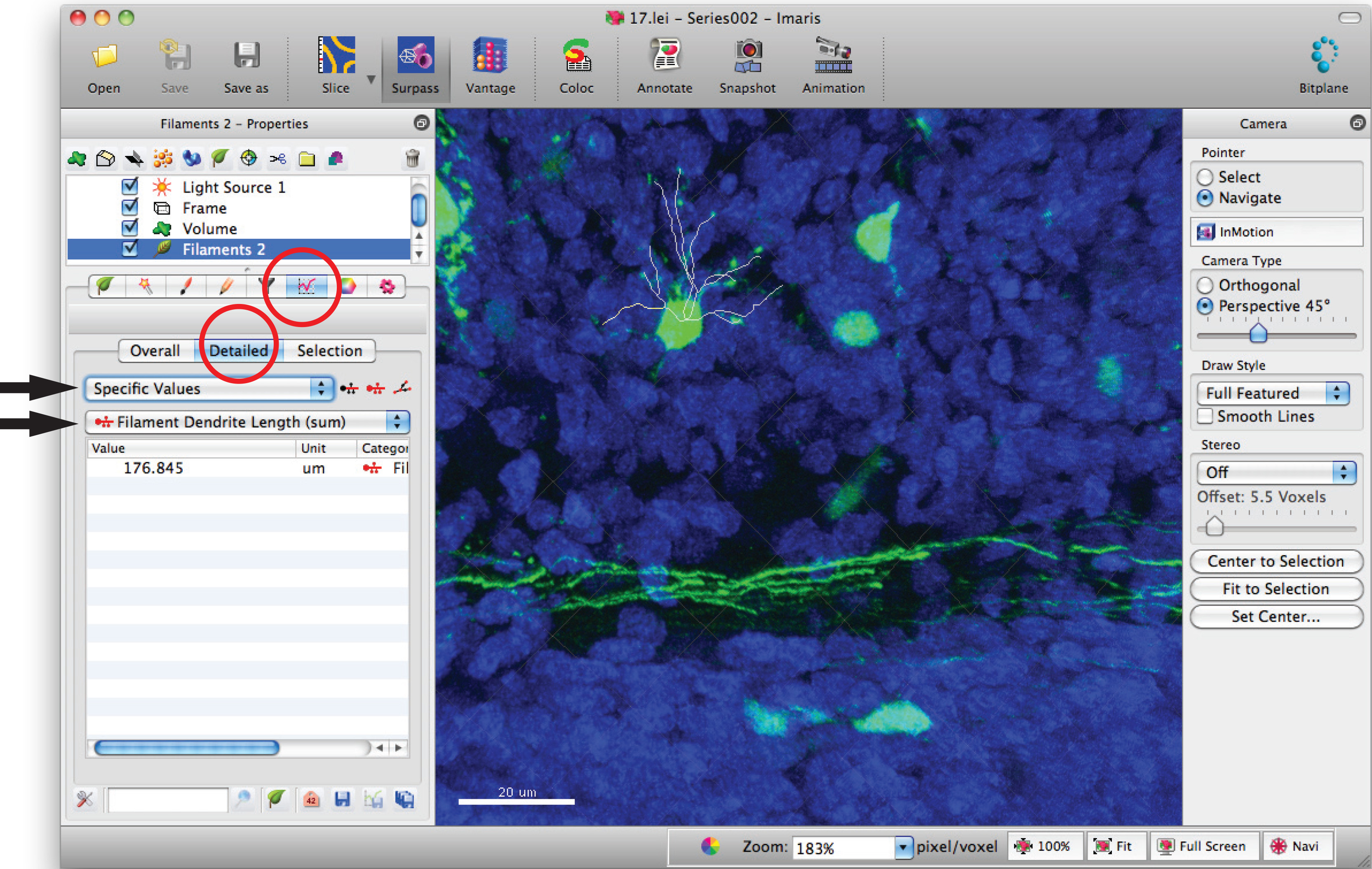
- Utilice las pruebas estadísticas apropiadas para analizar los datos.
Resultados
Para analizar la morfología de las CGCs en respuesta a diferentes condiciones de cultivo, transfectadas las neuronas en DIV 0 como se describió anteriormente. Después de la transfección, colocamos un conjunto de neuronas en un medio completo (BME, suero de ternera al 10%, 2 mM PSG, 25 mM KCl) y otro conjunto en medio mínimo que contiene insulina (BME, glucosa 25 mM, PSG 2, 10 g / ml de insulina). Hemos sometido las neuronas para inmunocitoquímica utilizando el anticuerpo GFP en DIV 1, 2 y 3, seguido por la medici?...
Discusión
Ventajas y limitaciones de la descrita in vitro e in vivo:
CGCs cultivadas de ratón y ratas son igualmente aptas para los análisis morfológicos. Debido al tamaño más grande de un cerebelo de rata, el rendimiento de GCN de crías de rata que excede de crías de ratón 3-4x. Aparte de CGCs, las neuronas corticales y del hipocampo se pueden usar como sistema de cultivo así. El método de fosfato de calcio da como resultado un bajo (0,01-5%) eficiencia de transfección, q...
Divulgaciones
Los autores declaran no tener intereses financieros en competencia.
Agradecimientos
Damos las gracias a N. Schwedhelm-Domeyer por su excelente asistencia técnica, C. y S. Hammer Papiol ayuda con los análisis estadísticos. Nuestro trabajo es financiado por la Sociedad Max Planck, la Deutsche Forschungsgemeinschaft, el Centro de Nanotecnología Microscopía y Fisiología Molecular del Cerebro (CNMPB), Göttingen, Alemania y por la GGNB Grupo Junior Mesada de la Universidad de Göttingen.
Materiales
| Name | Company | Catalog Number | Comments |
| DMEM | Gibco | 11960-044 | |
| BME | Gibco | 41010-026 | |
| Insulin | Sigma-Aldrich | Si-1-4011 | |
| Poly-L-Ornithine | Sigma-Aldrich | P-2533 | |
| CaCl2 | Appli-Chem | A3652 | |
| Isoflurane | Actavis Deutschland | ||
| Tissue-Tek OCT | Sakura | ||
| ECM 830 and tweezertrodes | Harvard Apparatus | ||
| Epifluorescence microscope and camera | Nikon | ||
| SP2 confocal microscope | Leica | ||
| ImageJ | NIH | ||
| Imaris 7.4.2 | Bitplane, Inc. | ||
| GraphPad Prism | GraphPad Software, Inc. | ||
| MS Excel | Microsoft | ||
| Loading tip 1-200 µl | Costar | 4853 | |
| Pipette tip 200 µl | Sarstedt | 70.760.502 | |
| Microlance 3 needle, 30 G | BD | 302200 | |
| 50 µl gastight Syringe 1705 | Hamilton | ||
| Glass coverslips | Thermo Scientific Menzel Glaeser | CB00120RA1 |
Referencias
- Cajal, S. R. . Histology of the nervous system of man and vertebrates. , (1995).
- Altman, J., Bayer, S. A. . Development of the cerebellar system : in relation to its evolution, structure, and functions. , (1997).
- White, J. J., Reeber, S. L., Hawkes, R., Sillitoe, R. V. Wholemount immunohistochemistry for revealing complex brain topography. J. Vis. Exp. , (2012).
- Palay, S. L., Chan-Palay, V. . Cerebellar cortex: cytology and organization. , (1974).
- Hatten, M. E., Alder, J., Zimmerman, K., Heintz, N. Genes involved in cerebellar cell specification and differentiation. Curr. Opin. Neurobiol. 7, 40-47 (1997).
- Hatten, M. E., Heintz, N. Mechanisms of neural patterning and specification in the developing cerebellum. Annu. Rev. Neurosci. 18, 385-408 (1995).
- Sillitoe, R. V., Joyner, A. L. Morphology molecular codes, and circuitry produce the three-dimensional complexity of the cerebellum. Ann. Rev. Dev. Biol. 23, 549-577 (2007).
- Zervas, M., Millet, S., Ahn, S., Joyner, A. L. Cell behaviors and genetic lineages of the mesencephalon and rhombomere 1. Neuron. 43, 345-357 (2004).
- Wingate, R. J. The rhombic lip and early cerebellar development. Curr. Opin. Neurobiol. 11, 82-88 (2001).
- Kawaji, K., Umeshima, H., Eiraku, M., Hirano, T., Kengaku, M. Dual phases of migration of cerebellar granule cells guided by axonal and dendritic leading processes. Mol. Cell Neurosci. 25, 228-240 (2004).
- Hatten, M. E., Gao, W. -. Q., Morrison, M. E., Mason, C. A. Cellular and molecular neuroscience. , 419-41 .
- Lee, H. Y., Greene, L. A., Mason, C. A., Manzini, M. C. Isolation and culture of post-natal mouse cerebellar granule neuron progenitor cells and neurons. J. Vis. Exp. , (2009).
- Bilimoria, P. M., Bonni, A. Cultures of cerebellar granule neurons. CSH Protoc. 2008, (2008).
- Rivas, R. J., Hatten, M. E. Motility and cytoskeletal organization of migrating cerebellar granule neurons. J. Neurosci. 15, 981-989 (1995).
- Kuhar, S. G., et al. Changing patterns of gene expression define four stages of cerebellar granule neuron differentiation. Development. 117, 97-104 (1993).
- Baird, D. H., Hatten, M. E., Mason, C. A. Cerebellar target neurons provide a stop signal for afferent neurite extension in vitro. J. Neurosci. 12, 619-634 (1992).
- Segal, R. A., Pomeroy, S. L., Stiles, C. D. Axonal growth and fasciculation linked to differential expression of BDNF and NT3 receptors in developing cerebellar granule cells. J. Neurosci. 15, 4970-4981 (1995).
- Gallo, V., Ciotti, M. T., Coletti, A., Aloisi, F., Levi, G. Selective release of glutamate from cerebellar granule cells differentiating in culture. Proc. Natl. Acad. Sci. U.S.A. 79, 7919-7923 (1982).
- Smith, T. C., Wang, L. Y., Howe, J. R. Distinct kainate receptor phenotypes in immature and mature mouse cerebellar granule cells. Physiol. 517 (1), 51-58 (1999).
- Konishi, Y., Stegmuller, J., Matsuda, T., Bonni, S., Bonni, A. Cdh1-APC controls axonal growth and patterning in the mammalian brain). Science. 303, 1026-1030 (2004).
- Stegmuller, J., Huynh, M. A., Yuan, Z., Konishi, Y., Bonni, A. TGFbeta-Smad2 signaling regulates the Cdh1-APC/SnoN pathway of axonal morphogenesis. J. Neurosci. 28, 1961-1969 (2008).
- Stegmuller, J., et al. Cell-intrinsic regulation of axonal morphogenesis by the Cdh1-APC target SnoN. Neuron. 50, 389-400 (2006).
- Kannan, M., Lee, S. J., Schwedhelm-Domeyer, N., Nakazawa, T., Stegmuller, J. p250GAP is a novel player in the Cdh1-APC/Smurf1 pathway of axon growth regulation. PLoS One. 7, (2012).
- Kannan, M., Lee, S. J., Schwedhelm-Domeyer, N., Stegmuller, J. The E3 ligase Cdh1-anaphase promoting complex operates upstream of the E3 ligase Smurf1 in the control of axon growth. Development. 139, 3600-3612 (2012).
- Gaudilliere, B., Konishi, Y., de la Iglesia, N., Yao, G., Bonni, A. A. CaMKII-NeuroD Signaling Pathway Specifies Dendritic Morphogenesis. Neuron. 41, 229-241 (2004).
- Yang, Y., et al. A Cdc20-APC ubiquitin signaling pathway regulates presynaptic differentiation. Science. 326, 575-578 (2009).
- Litterman, N., et al. An OBSL1-Cul7Fbxw8 ubiquitin ligase signaling mechanism regulates Golgi morphology and dendrite patterning. PLoS Biol. 9, (2011).
- Kim, A. H., et al. A centrosomal Cdc20-APC pathway controls dendrite morphogenesis in postmitotic neurons. Cell. 136, 322-336 (2009).
- Shalizi, A., et al. A calcium-regulated MEF2 sumoylation switch controls postsynaptic differentiation. Science. 311, 1012-1017 (2006).
- Vadhvani, M., Schwedhelm-Domeyer, N., Mukherjee, C., Stegmuller, J. The Centrosomal E3 Ubiquitin Ligase FBXO31-SCF Regulates Neuronal Morphogenesis and Migration. PLoS One. 8, (2013).
- Puram, S. V., et al. A CaMKIIbeta signaling pathway at the centrosome regulates dendrite patterning in the brain. Nat. Neurosci. , (2011).
- Jia, Y., Zhou, J., Tai, Y., Wang, Y. TRPC channels promote cerebellar granule neuron survival. Nat. Neurosci. 10, 559-567 (2007).
- Huynh, M. A., et al. An isoform-specific SnoN1-FOXO1 repressor complex controls neuronal morphogenesis and positioning in the mammalian brain. Neuron. 69, 930-944 (2011).
- de la Torre-Ubieta, L., Bonni, A. Transcriptional regulation of neuronal polarity and morphogenesis in the mammalian brain. Neuron. 72, 22-40 (2011).
- Calissano, P., et al. Recombinant human insulin-like growth factor I exerts a trophic action and confers glutamate sensitivity on glutamate-resistant cerebellar granule cells. Proc. Natl. Acad. Sci. U.S.A. 90, 8752-8756 (1993).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados