Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Генетических манипуляций мозжечка Granule нейронов
В этой статье
Резюме
Нейронов морфогенез и миграция являются важными события, лежащие в основе правильного развития мозга. Здесь мы описываем методы, чтобы генетически манипулировать культивируемые мозжечка гранул нейронов и развивающийся мозжечок для оценки морфологии и миграционных характеристик нейронов.
Аннотация
Развивающие события в мозге в том числе нейронов формообразования и миграции высоко организованы процессы. В пробирке и в естественных анализирует позволяют для характеризации углубленного выявления путей, вовлеченных в эти события. Мозжечка гранул нейроны (КСГН), которые получены из развивающихся мозжечка являются идеальной моделью системы, которая позволяет морфологического анализа. Здесь мы опишем метод того, как генетически манипулировать КСГН и как учиться axono-и dendritogenesis отдельных нейронов. С помощью этого метода эффекты интерференции РНК, повышенной экспрессией или малых молекул может быть по сравнению с контрольными нейронов. Кроме того, грызун коры мозжечка является доступным в системе естественных условиях в связи с его преимущественным развитием послеродовой. Мы также представляем естественных условиях технику электропорации в генетически манипулировать развивающийся мозжечка и описать последующую мозжечка анализирует оценить нейронов морфологии Aй миграции.
Введение
Мозжечок является отличной системой для изучения механизмов роста аксона и миграции. Мозжечок является предметом анатомических исследований с незапамятных неврологии 1. Современная микроскопия и иммуногистохимические методы значительно расширили и уточнили первоначальные открытия, Сантьяго, Рамон, и Cajal 2-4. Генетика мыши и молекулярные исследования обнаружили существенный рост и транскрипционных факторов в контроле развития мозжечка, что привело к большему пониманию важнейших событий, необходимых для правильного подключения различных типов нейронов в том числе мозжечка гранул нейронов (КСГН) 5-7.
Мозжечок является производным ромбомере 1 развивающегося заднего мозга 8. Ромбическая губа, которая является частью крыши 4-го желудочка, приводит к мозжечка гранул нейронных клеток-предшественников, которые будут составлять самую многочисленную нейронов населения ввзрослых мозжечок 9. После ростральной миграции, они располагаются в коре зачатка. Здесь, митоз гранула нейронных предшественников приводит к резкому расширению внешнего зернистого слоя (EGL), который проходит после рождения у грызунов. Из EGL, нейроны начинают мигрировать внутрь через молекулярного слоя (ML), мимо слой клеток Пуркинье в конечном итоге поселяются во внутреннем зернистого слоя (IGL 2). Во время этого миграционного процесса, они приобретают биполярную форму с двумя аксоны, проходящий в ML. После дальнейшей миграции, тело клетки мигрируют от аксонов и эти два процесса сливаются, образуя один раздвоенный, Т-образные аксон 10. Впоследствии эти аксоны расположенный пучком и называются параллельными волокнами. Поселившись в IGL, КСГН расти дендриты, которые образуют дендритные когти установить синапсы с мшистых волокон. Чтобы исследовать фундаментальные процессы в развивающемся мозжечке, объединены в пробирке и в естественных условиях approacч позволяет надежных результатов и выводов.
КСГН не только самые многочисленные нейроны мозжечка, но из всей мозга и может быть культурным в высокой степени чистоты 11-13. В культуре, однако это весьма однородной нейронов население становится быстро постмитотическими и приобретает полярный морфологию с легко идентифицируемых аксонов и дендритов. Искусственный КСГН оказались чрезвычайно полезными для изучения различных аспектов развития нейронов включая пролиферацию предшественников, дифференциации аксонов и дендритов развития, миграции нейронов, апоптоз и электрофизиологических свойств (14-19 и многие другие). Использование генетических манипуляций расширила универсальность культивируемых КСГН и позволил для дальнейшего механистического понимания вышеупомянутых событий. Трансфекция культивируемых нейронов использованием низким кпд фосфат кальция или липофильные методы следуют иммуноцитохимии с полярностью маркеров или программного обеспечения при поддержке анализа FaciliTates оценку например морфологии отдельных нейронов в плотной нейронов культуры. При таком подходе роль представляющих интерес белков в аксонов или дендритов роста могут быть изучены 20-25,26-28. Эта система культуры, однако, менее полезны для анализа миграцию нейронов, как миграция очень ограничена в культурах с высокой плотностью и потребует совместных культурах. Анализ в пробирке аксона и роста дендритов также позволяет рассмотрении взаимосвязанных белков сигнального пути с использованием комбинации РНК-интерференция (I), сверхэкспрессии или малых молекул.
Для установления актуальность интересующего белка в аксона и регуляции роста дендритов или миграции нейронов, электропорации в естественных условиях (IVE) метод позволяет для анализа в развивающихся коры мозжечка. Благодаря тому, что мозжечковая развитие у грызунов проходит путь в первых двух недель постнатального, мозжечок представляет собой accessibструктура мозга ле для генетических манипуляций с целью рассмотрения развития аксонов и дендритов, миграцию нейронов, синаптогенез и апоптоз 20-24,29,30,26,27,31-34. Кроме того, эта модель системы также полезно для других аспектов развития нейронов, которые требуют неповрежденную коры мозжечка например аксона поиска пути, проводки и подключения нейронов и нейронов-глии взаимодействий, вместе взятых, этот протокол обеспечивает в пробирке и в естественных условиях методы для решения дополнительный подход в отношении нейронов формообразования и миграции.
протокол
КСГН могут быть получены либо из послеродовой день (P) 5 щенков мыши или P6 крысят. Мы следуем протокол, описанный Bilimoria и коллег, в которой используется ингибитор митоза, чтобы выбрать для постмитотических КСГН 13.
Этика заявление:
Все эксперименты с живых животных были проведены в соответствии с протоколом животных, утвержденной "Verbraucherschutz унд Lebensmittelsicherheit" Нижней Саксонии, Германия.
В пробирке анализа:
1. Подготовка ДНК плазмиды, СМИ, и буферов для фосфата кальция трансфекции Method
- Растворите ДНК плазмиды в стерильной, эндотоксинов воде; DMEM (с высоким содержанием глюкозы); сделать 2,5 М CaCl 2; сделать 2x ССРХ (растворить 4 г NaCl, 0,1775 г KCl, 0,095 г Na 2 HPO 4 • 7H 2 O, 0,675 г глюкозы и 2,5 г HEPES в 250 мл воды высокой степени очистки и доведения рН до 7,05, 7,08 и 7,11). Примечание: При подготовкерешение 2x ССРХ, тест, рН дает лучшие результаты в отношении эффективности трансфекции данной комбинации плазмид.
2. Трансфекция культивируемых нейронов
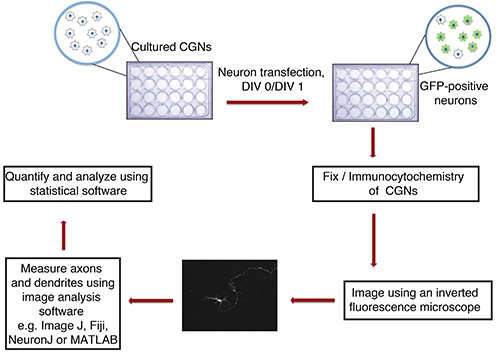
Рисунок 1. Блок-схема аксона в пробирке и дендритов анализе роста. Искусственный КСГН (24-луночный планшет с покровные стекла), изолированный от P6 крысят, трансфицируют в DIV 0 или 1 с осадка ДНК, содержащего флуоресцентный маркер трансфекции (например, GFP). После фиксации и иммуноцитохимии, нейроны изображаются слепым методом. Изображения импортируются в ImageJ и процессы измеряются. Измерения затем обрабатываются с использованием статистической программы.
- Семенной КСГН (20 х 10 6 на 24-луночный планшет; BME, 10% сыворотки теленка, 2 мМ пенициллин-Streptomycin-глютамин (PSG), 25 мМ KCl) на азотной кислоты промывают, полиорнитин покрытием 12 мм покровные стекла в 24-луночный планшет с 500 мкл среды на лунку.
- В день в пробирке (DIV) 0 (по крайней мере 8 часов после нанесения покрытия) или DIV 1, собирать средства массовой роста и держать при температуре 37 ° С. Промыть нейроны дважды 500 мкл DMEM нагретого и добавить 500 мкл DMEM.
- Место нейроны в инкубаторе (37 ° C, 5% CO 2) в течение 45 мин.
- Подготовка 40 мкл осадка ДНК для каждой скважины путем смешивания: ДНК (2-2,5 мкг / лунку, 10% от общего ДНК должна быть трансфекции маркер например GFP визуализировать трансфицированными нейроны), вода (до 18 мкл), добавить 2 мкл 2,5 М CaCl 2, хорошо перемешать и добавить 20 мкл 2х HBSS.
- Инкубировать осадок ДНК в течение 5 мин при комнатной температуре.
- Добавить осадок ДНК в каждую лунку и инкубировать нейроны в течение 18 минут в инкубаторе.
- Удаление смесь DMEM / ДНК и мыть нейроны дважды 500 мкл нагретого DMЕ.М..
- Добавить собранную СМИ, начиная с шага 2.2 обратно в нейронах. Если нейроны будут в культуре в течение более 3 дней, Дополнение СМИ с 25 мМ глюкозы в DIV 3 пополнить источник углерода.
- После 1-5 дней, при условии нейроны в иммуноцитохимии помощью GFP антител.
- Изображение не менее 30 отдельные нейроны в состоянии в слепым методом с использованием флуоресцентного микроскопа.
3. Измерьте аксонов и дендритов с NeuronJ, в NIH ImageJ Plugin
Важно: Убедитесь, что изображения масштабируются correctluy с помощью соответствующего пикселя: соотношение мкм в зависимости от увеличения и разрешения изображения.
- Преобразование изображения в 8-битных с ImageJ: Открытое изображение, выберите «образ» -> «тип» -> '8 немного '->' изображение Save '.
- Запустите NeuronJ плагин и открыть 8-битное изображение.
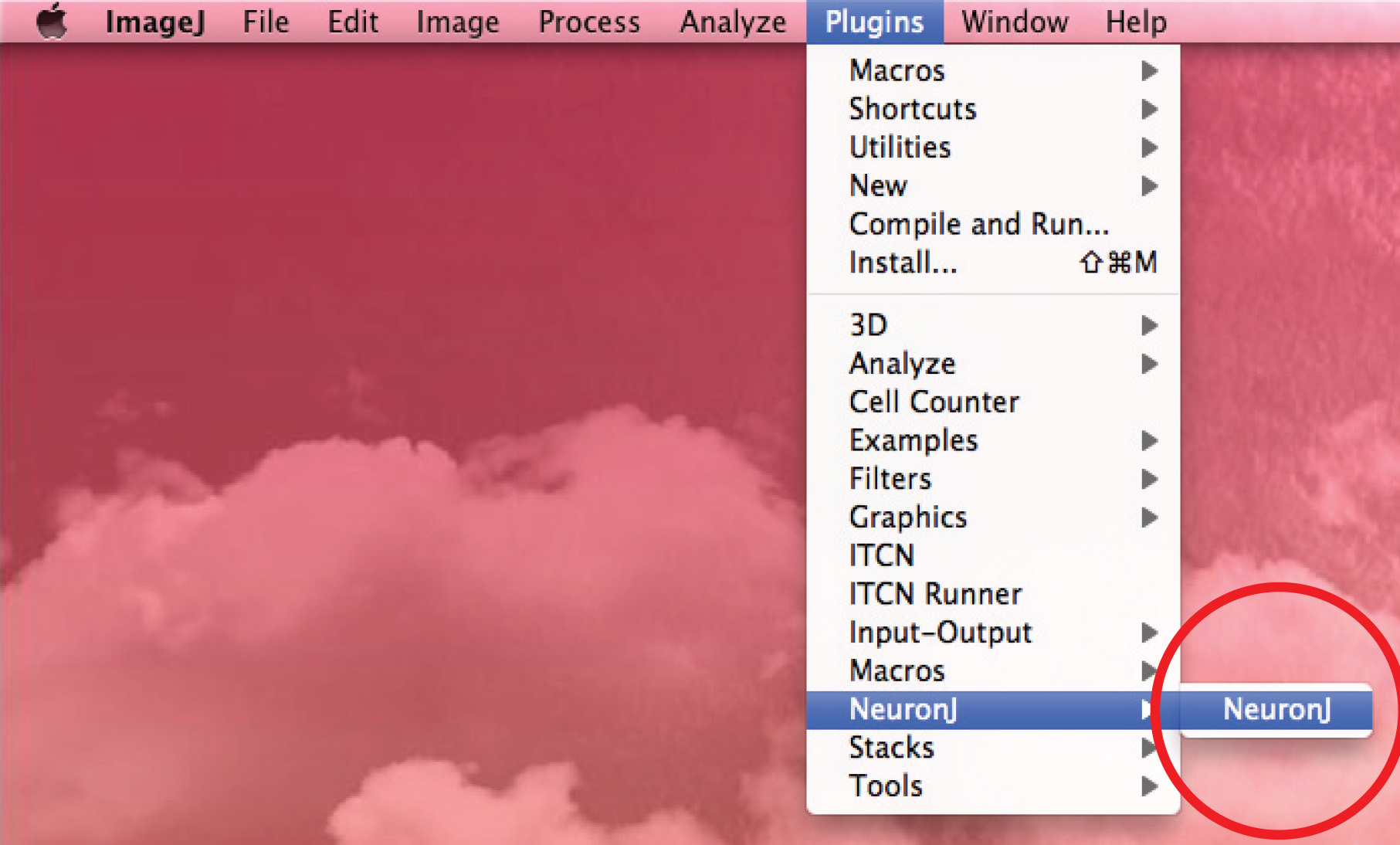
- Используйте опцию "Добавить обводка" для отслеживания аксон: CLИк левую кнопку мыши один раз в начале аксона и переместите мышь вдоль процесса. Дважды щелкните на кончике аксона, если след соответствует аксонов форму.
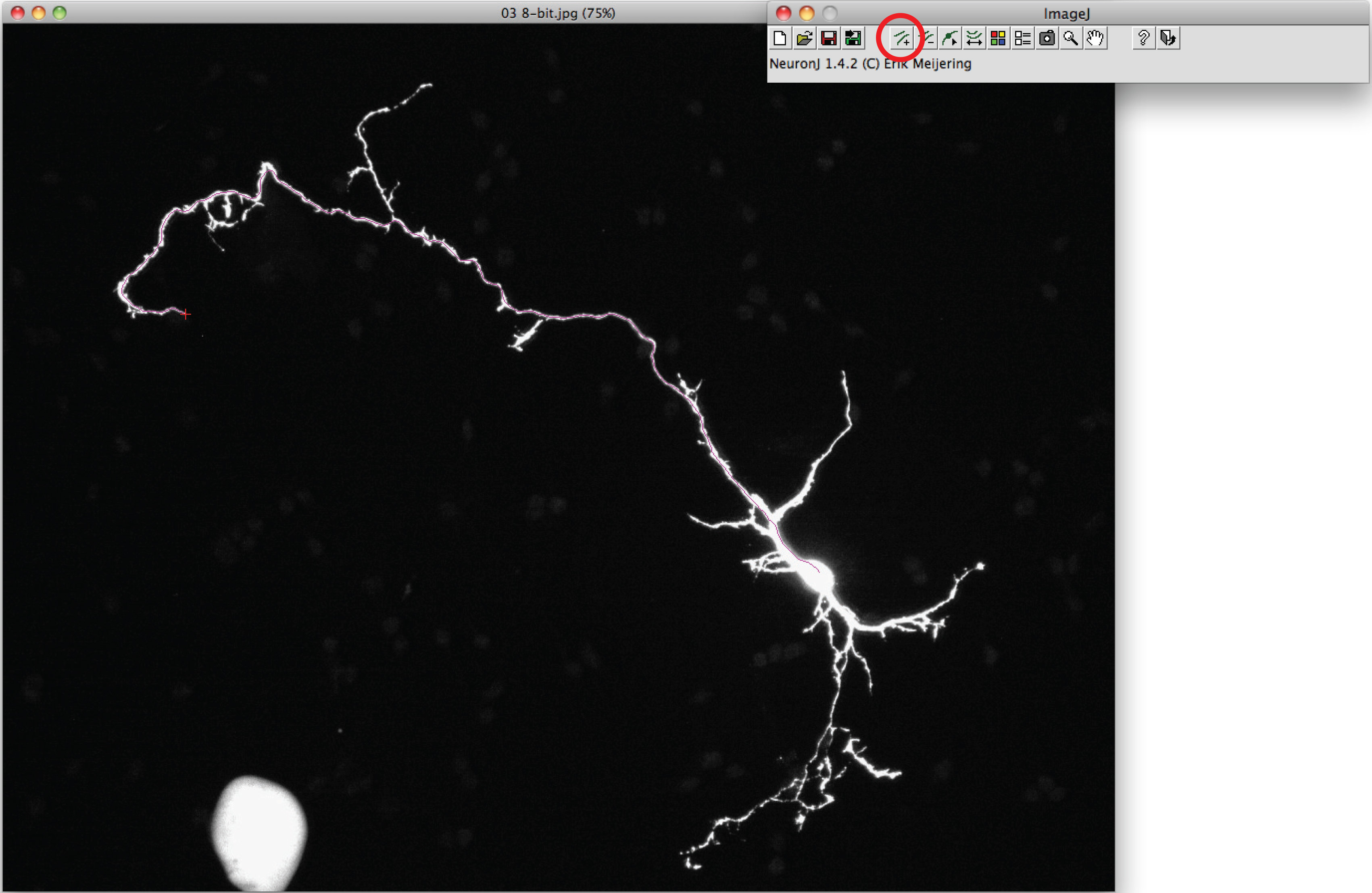
Примечание: В случае, если предложил след отличаться от аксонов форме, один раз нажать на аксонов процесса на якорь след, затем дважды щелкните на кончике аксона. - Нажмите на "Мера начертаний", выбрать "Показать трассировки измерения" пункт и нажмите "Выполнить". Измерения Axon все отображается в новом окне. Для дендритов, выбрать 'измерений Группа индикации опцию' и нажмите 'Run'.
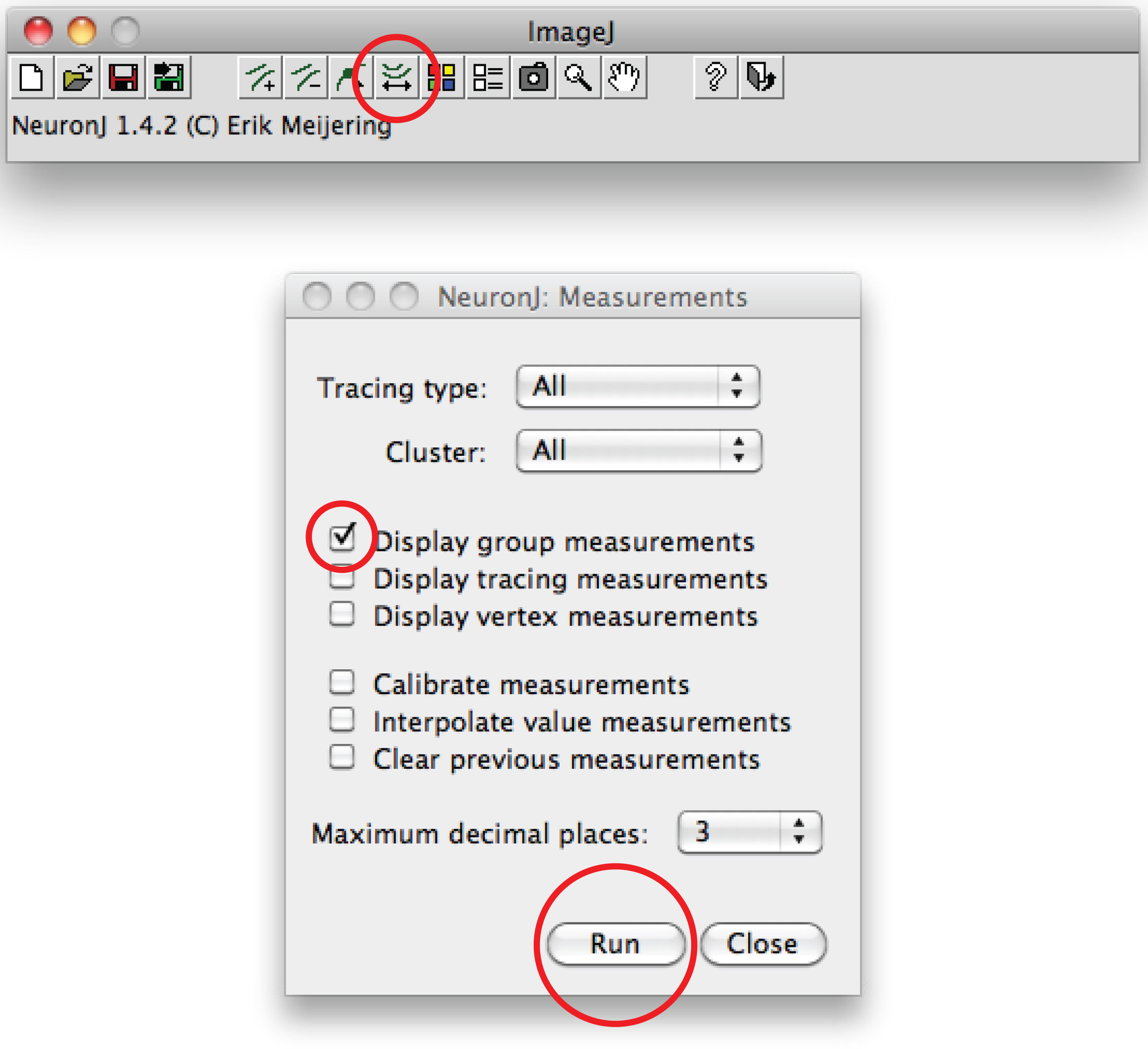
Всего дендритные измерения все отображается в новом окне. Сохранить их в виде отдельного файла, который можно открыть в любой программе электронных таблиц. - В качестве альтернативы для ручной трассировки, использовать программное обеспечение Фиджи: Щелкните правой кнопкой мыши на гоэ опция 'Прямая линия', выберите 'Freehand линию »,
держать левую кнопку мыши и вручную отследить процесс, нажмите 'Ctrl + M "для измерения. - Рассчитать среднюю аксонов / дендритных длину для одного состоянии и использовать соответствующий статистический тест.
В естественных условиях электропорации:
1. Оборудование и Подготовка реагентов
- Вам нужно 30 г иглы, прокладку (1-2 мм), шприц, мертвый объем редуктор (DVR), электропоратора и tweezertrodes, грелку или инфракрасного тепла лампы, гусиная шея лампу и изофлуран.
- Положите DVR в иглу, затем прикрепить иглу в шприц, и, наконец, положить прокладку на иглу (рис. 2).
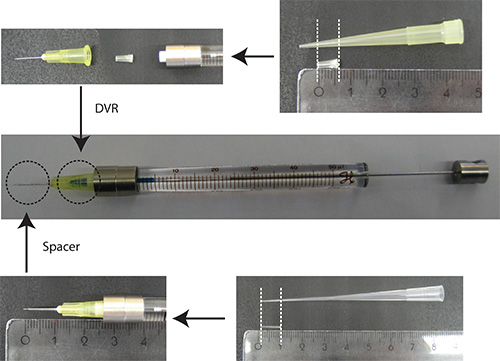
Фигура2. Подготовка иглы. DVR отрезан пипетки 200 мкл и помещают в иглу, чтобы уменьшить мертвое пространство. Spacer получают из 200 мкл наливного наконечника с и помещают на конце иглы, чтобы регулировать глубину проникновения в мозжечке до приблизительно 2 мм. Единиц измерения: см - Растворите ДНК в PBS/0.03% Быстрый зеленый. Примечание: В трансфекции маркера, выгодно использовать флуоресцентный белок, который находится под нейрона-специфического промотора (например, Synapsin) визуализировать только нейроны. 25% от общего количества плазмидной должно быть плазмидой, кодирующей трансфекции маркер.
- Сделать 70% этанола.
- Смешайте равные объемы октября и 30% сахарозы, растворенного в PBS.
- Заполните шприц с 4 мкл ДНК (4 мкг / мкл плазмидной ДНК в PBS/0.03% Быстрый зеленый).
2. IVE крысят
Блок-схема IVE: см. рисунок 3
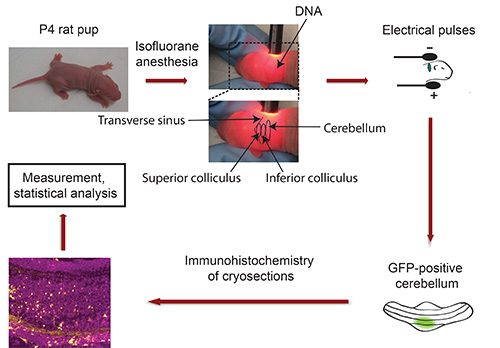
Рисунок 3. Блок-схема в естественных условиях электропорации. Щенков P4 крыс анестезируют изофлураном и плазмидной ДНК, кодирующей флуоресцентный маркер трансфекции (например, GFP) вводят в мозжечке, с последующим воздействием электрических импульсов 5. Пять дней спустя, изолированных GFP-положительных мозжечка подразделяются и подвергали иммуногистохимии. Изображения получены с помощью конфокальной микроскопии и проанализированы с помощью программного обеспечения Imaris. Данные обрабатываются с статистической программы.
- Используйте P4 крысят из альбиноса деформации (Вистар или Long Evans).
- не Обезболить щенков (один за другим) изофлураном в небольшой коробке (например P1000 пипетки коробка) с 200 мкл изофлураном (смоченной в ткани) в течение 1-2 мин, пока щенок больше не движется. Позаботьтесь о том, щенки не попасть в контакте соIth Iiquid изофлурана. Монитор время близко, насколько отдельные щенки-разному реагируют на наркоз.
- Стерилизовать затылок щенка с 70% этанола.
- Fix глава щенка между большим и указательным пальцами и использовать гусиная шея лампу, чтобы найти мозжечка альбиноса щенка. Поперечный синус резко разграничивает средний мозг (верхняя и нижняя бугорок) от корковых полушарий (рис. 3). Мозжечок находится рядом с мозга и появляется в более темный оттенок. Используйте несмываемый маркер для обозначения мозжечок с точкой. Важно: Держите щенка в фиксированном положении! Примечание: Если анестезия стираться во время этой процедуры, подвергать щенка изофлураном до инъекционных ДНК.
- Вставьте иглу (рис. 3) и медленно вдохнуть 3 мкл ДНК в мозжечке.
- Пусть решение ДНК диффузного течение 30-60 сек.
- Поместите голову щенка между tweezertrodes так, чтобы отрицательный полюс вступает в контакт с задней части головы (мозжечкаг область) и, что плюс полюсные контакты в противоположную стенку голову (рис. 3).
- Тема щенок до 5 электрических импульсов. Регулировка напряжения на вес детенышей, чтобы обеспечить хорошую эффективность электропорации без ущерба их выживание (табл. 1).
Таблица 1. Электропорация P4 крысят.Вес Напряжение Импульс Интервал 8-9 г 160 В 50 мс 950 мс 9-10 г 165 В 50 мс 950 мс > 10 г 170 В 50 мс 950 мс - Пусть щенки восстановить на нагретой панели или под инфракрасной лампой. Вернуться щенков в Дам. Важно: Убедитесь, что источник нагрева не наносит никаких ожогов.
- Жертвоприношение щенков через 5 дней после электропорации, помещая их в СО 2 с последующим обезглавливания.
- Изолировать мозжечка и экран для GFP-положительных мозжечка с помощью флуоресцентного микроскопа.
- Исправить мозжечка в 4% PFA O / N при 4 ° С, а затем инкубируют в 30% сахарозы при 4 ° С до мозжечка раковиной в нижней части трубки.
- Вставить мозжечка в OCT/30% сахарозы и сократить 40 мкм корональные разделы, используя криостат. Примечание: Раздел каждый мозжечок в слепым методом.
- Тематические секции для иммуногистохимии с использованием GFP антитела. Контрастирующая с ядерным красителем (DAPI или Hoechst 33258) и определить локализацию не менее 200 трансфектированных нейронов на одно животное.
- Для углубленного анализа, разделить IGL пополам, в результате чего в верхней IGL обращенной к ОД и более низкую IGL с видом на белое вещество и считать GFP-положительных нейронов, проживающих в каждом из таймов. Примечание: графа GFP-положительных нейронов каждого раздела слепым методом.
3. Измерение дендритов Длина, Приобретать Изображения Секции по х, у, г Plane Использование конфокальной микроскопии
Примечание: например, использовать 40 изображений на разделе с г-stwp 1 мкм 40 мкм.
- Открыть серии изображений в программном обеспечении, Imaris, для создания 3D-изображение дендритов.
- Нажмите на режиме "Превзойти ', чтобы посмотреть нейрон в 3D.
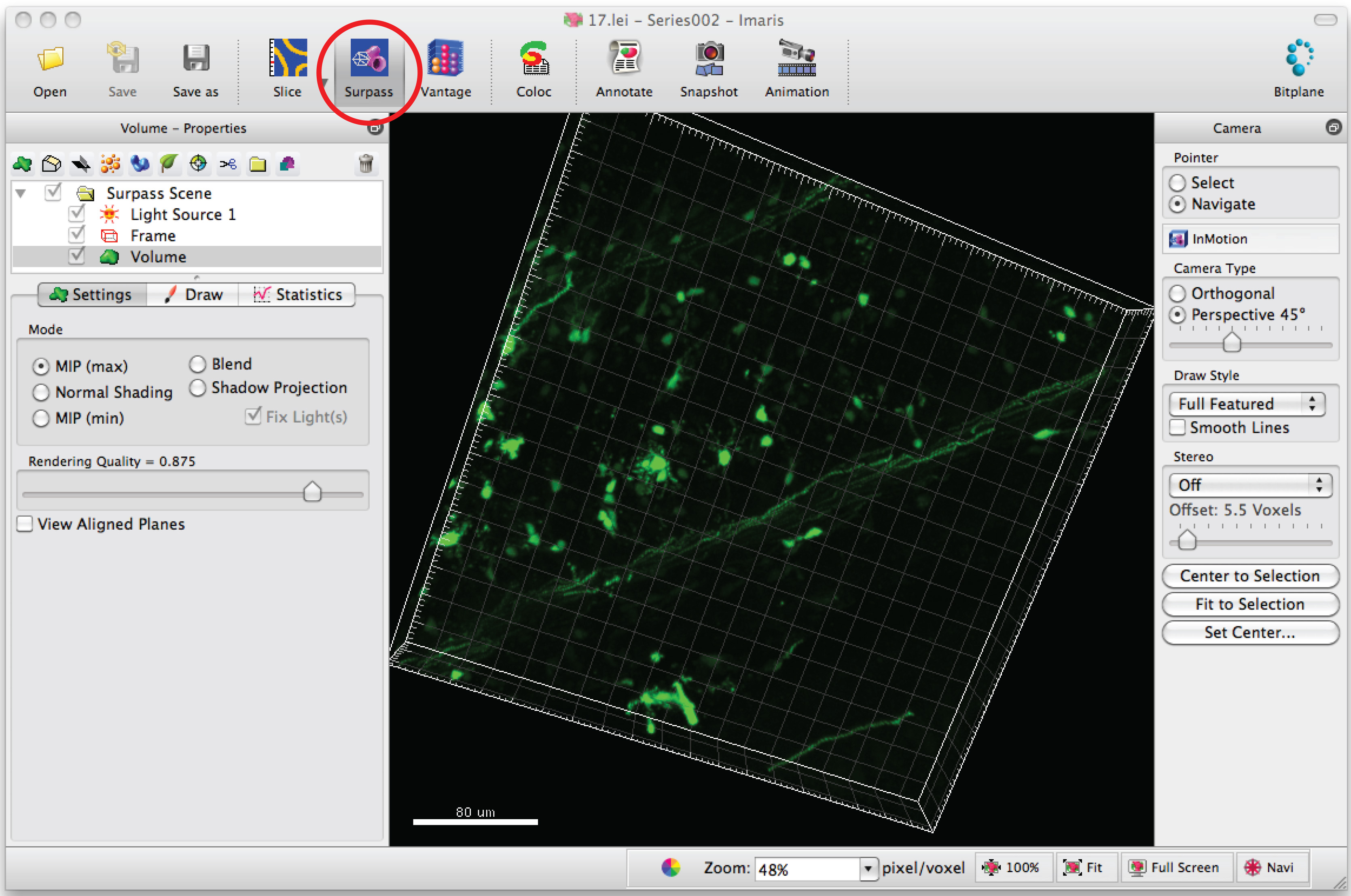
- Выберите "Добавить новый нить" и нажмите "Перейти автоматическое создание", чтобы начать полуавтоматической трассировки.

Примечание: Анализ каждого 3D-изображения в слепым методом - Выберите вкладку "Ничья" и "Автодорожка '.
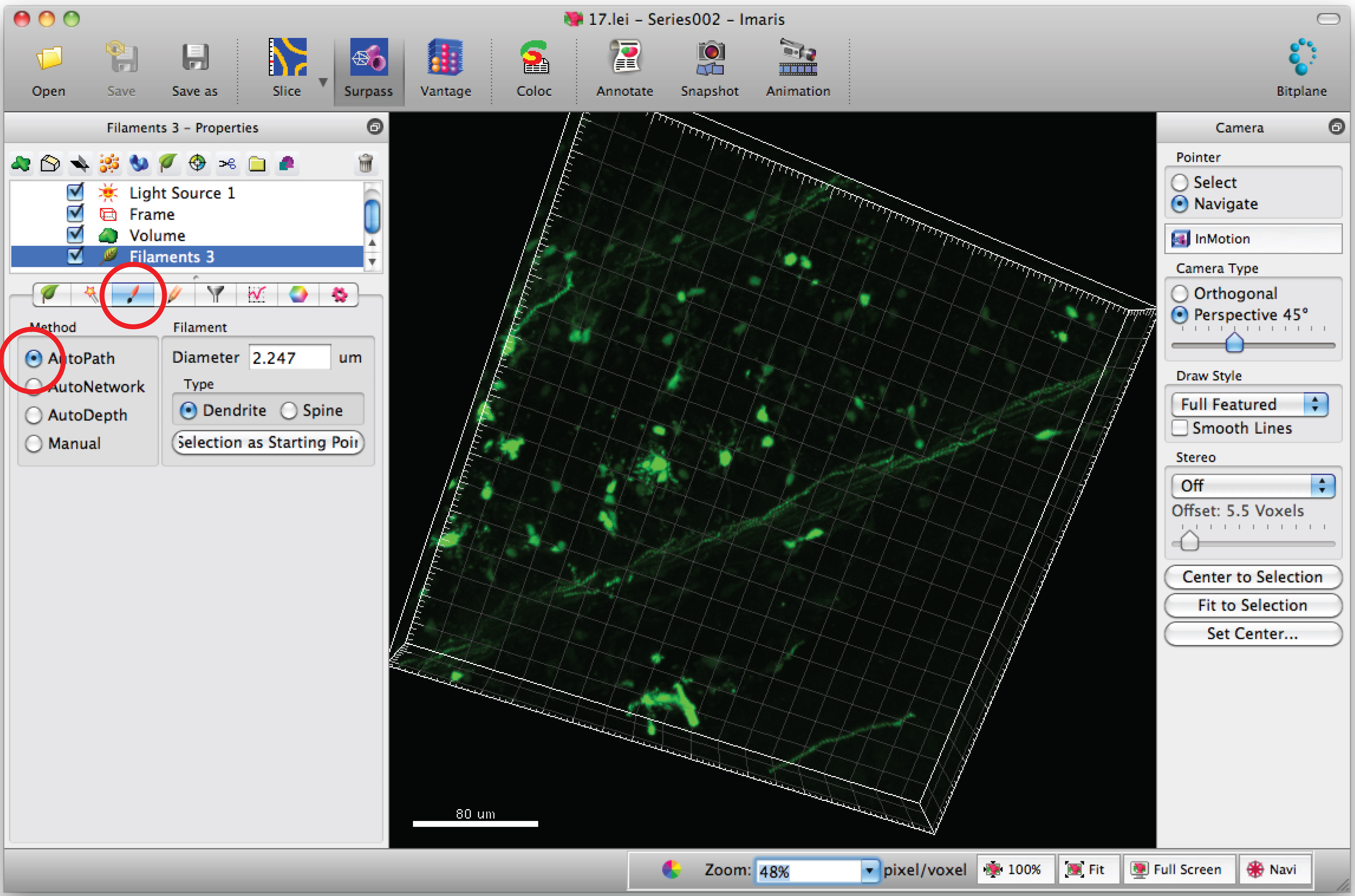
- Наведите курсор мыши на слокоть тело и Shift + Щелчок правой кнопкой мыши, чтобы выбрать тело клетки. Примечание: Autocalculation программным обеспечением может потребоваться несколько минут.

- Добавить пути к нити (дендритов) с помощью Shift + Щелчок левой кнопкой мыши. Примечание: Пути могут быть визуализированы в реальном времени.
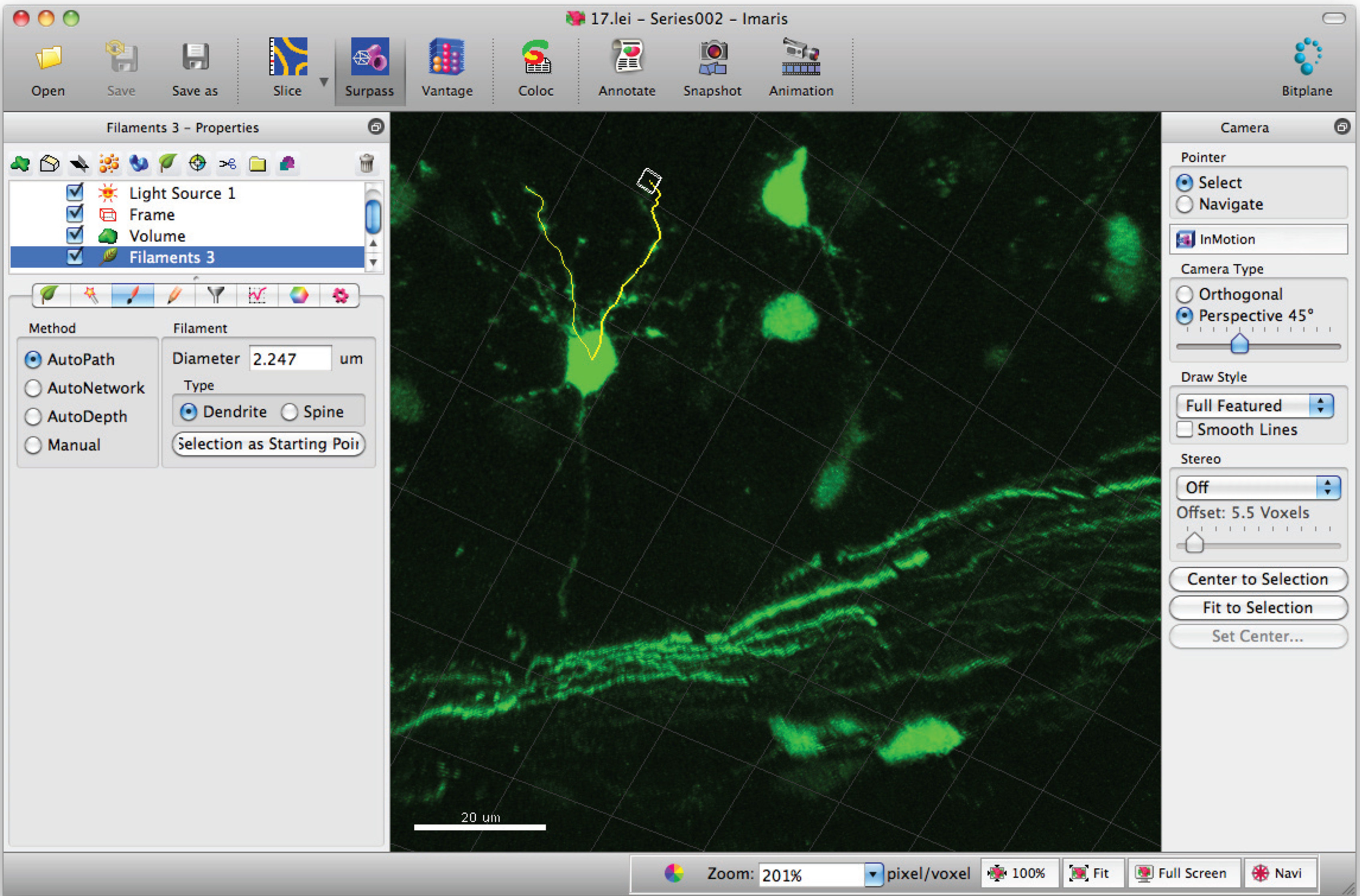
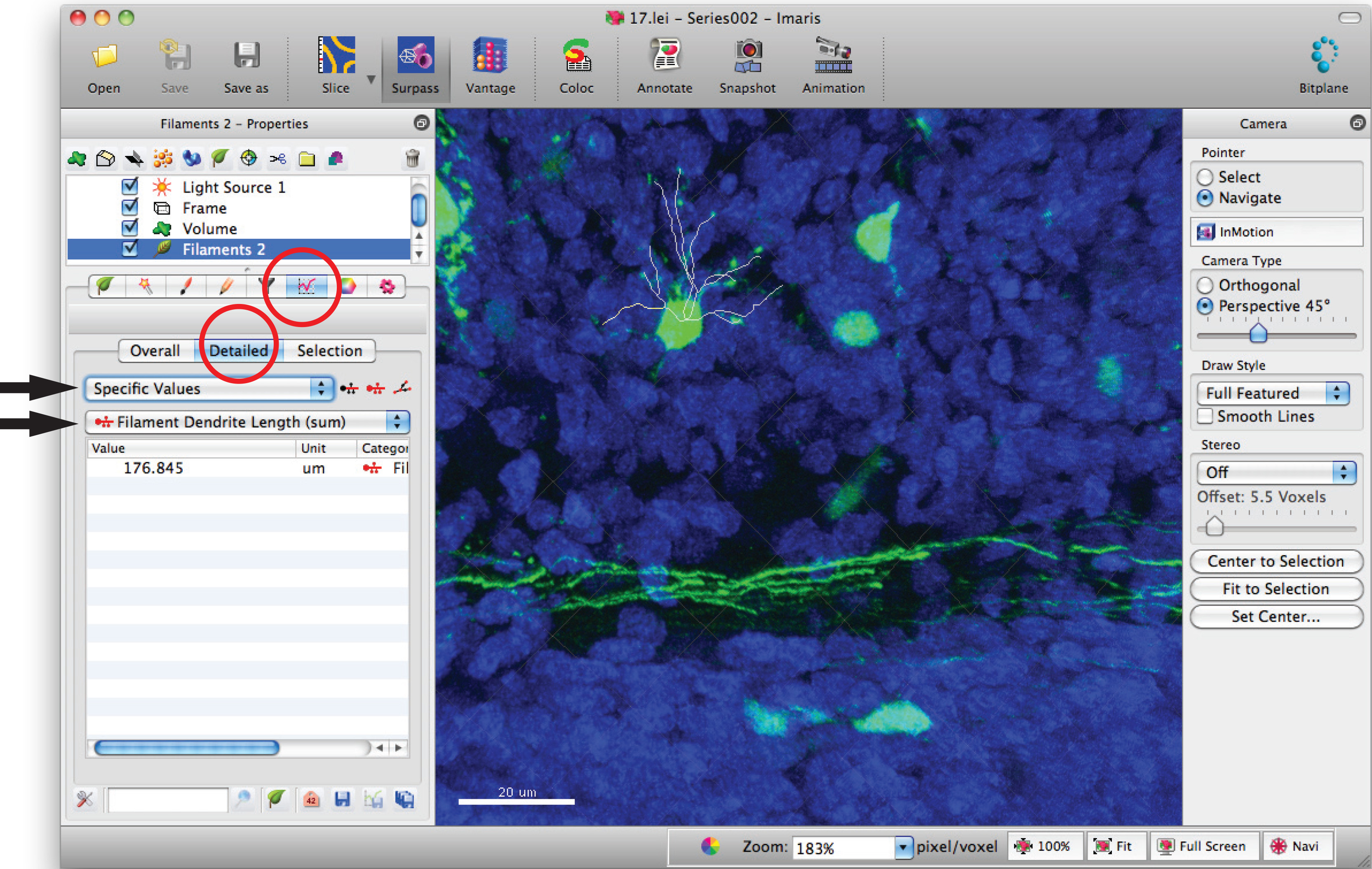
- Перейдите в окно статистики накаливания и нажмите на кнопку "детальной», «конкретные значения» и «нитей длиной дендритов (сумма)» для суммы общей протяженностью дендритов.
- Используйте соответствующие статистические тесты для анализа данных.
Результаты
Для анализа морфологии КСГН в ответ на различных условиях культивирования, мы трансфицировали нейроны на DIV 0, как описано выше. После трансфекции мы поместили один набор нейронов в полный среды (BME, 10% телячьей сыворотки, 2 мМ PSG, 25 мМ KCl) и другой набор в минимальной среде, содержащей инсул?...
Обсуждение
Преимущества и ограничения описаны в пробирке и в естественных условиях методов:
Искусственный КСГН от мыши и крысы одинаково хорошо подходит для морфологического анализа. В связи с большим размером мозжечка крыс, выход АГНКС от крысят превышает щенков мыши 3-...
Раскрытие информации
Авторы заявляют каких конкурирующих финансовых интересов.
Благодарности
Мы благодарим Н. Schwedhelm-Domeyer за отличную техническую помощь, С. Серп и С. Papiol за помощь в статистическом анализе. Наша работа финансируется за счет Общества Макса Планка, в Deutsche Forschungsgemeinschaft, Центра наноразмерных микроскопии и молекулярной физиологии головного мозга (CNMPB), Геттингене, Германия и по GGNB младшая группа стипендию в Геттингенском университете.
Материалы
| Name | Company | Catalog Number | Comments |
| DMEM | Gibco | 11960-044 | |
| BME | Gibco | 41010-026 | |
| Insulin | Sigma-Aldrich | Si-1-4011 | |
| Poly-L-Ornithine | Sigma-Aldrich | P-2533 | |
| CaCl2 | Appli-Chem | A3652 | |
| Isoflurane | Actavis Deutschland | ||
| Tissue-Tek OCT | Sakura | ||
| ECM 830 and tweezertrodes | Harvard Apparatus | ||
| Epifluorescence microscope and camera | Nikon | ||
| SP2 confocal microscope | Leica | ||
| ImageJ | NIH | ||
| Imaris 7.4.2 | Bitplane, Inc. | ||
| GraphPad Prism | GraphPad Software, Inc. | ||
| MS Excel | Microsoft | ||
| Loading tip 1-200 µl | Costar | 4853 | |
| Pipette tip 200 µl | Sarstedt | 70.760.502 | |
| Microlance 3 needle, 30 G | BD | 302200 | |
| 50 µl gastight Syringe 1705 | Hamilton | ||
| Glass coverslips | Thermo Scientific Menzel Glaeser | CB00120RA1 |
Ссылки
- Cajal, S. R. . Histology of the nervous system of man and vertebrates. , (1995).
- Altman, J., Bayer, S. A. . Development of the cerebellar system : in relation to its evolution, structure, and functions. , (1997).
- White, J. J., Reeber, S. L., Hawkes, R., Sillitoe, R. V. Wholemount immunohistochemistry for revealing complex brain topography. J. Vis. Exp. , (2012).
- Palay, S. L., Chan-Palay, V. . Cerebellar cortex: cytology and organization. , (1974).
- Hatten, M. E., Alder, J., Zimmerman, K., Heintz, N. Genes involved in cerebellar cell specification and differentiation. Curr. Opin. Neurobiol. 7, 40-47 (1997).
- Hatten, M. E., Heintz, N. Mechanisms of neural patterning and specification in the developing cerebellum. Annu. Rev. Neurosci. 18, 385-408 (1995).
- Sillitoe, R. V., Joyner, A. L. Morphology molecular codes, and circuitry produce the three-dimensional complexity of the cerebellum. Ann. Rev. Dev. Biol. 23, 549-577 (2007).
- Zervas, M., Millet, S., Ahn, S., Joyner, A. L. Cell behaviors and genetic lineages of the mesencephalon and rhombomere 1. Neuron. 43, 345-357 (2004).
- Wingate, R. J. The rhombic lip and early cerebellar development. Curr. Opin. Neurobiol. 11, 82-88 (2001).
- Kawaji, K., Umeshima, H., Eiraku, M., Hirano, T., Kengaku, M. Dual phases of migration of cerebellar granule cells guided by axonal and dendritic leading processes. Mol. Cell Neurosci. 25, 228-240 (2004).
- Hatten, M. E., Gao, W. -. Q., Morrison, M. E., Mason, C. A. Cellular and molecular neuroscience. , 419-41 .
- Lee, H. Y., Greene, L. A., Mason, C. A., Manzini, M. C. Isolation and culture of post-natal mouse cerebellar granule neuron progenitor cells and neurons. J. Vis. Exp. , (2009).
- Bilimoria, P. M., Bonni, A. Cultures of cerebellar granule neurons. CSH Protoc. 2008, (2008).
- Rivas, R. J., Hatten, M. E. Motility and cytoskeletal organization of migrating cerebellar granule neurons. J. Neurosci. 15, 981-989 (1995).
- Kuhar, S. G., et al. Changing patterns of gene expression define four stages of cerebellar granule neuron differentiation. Development. 117, 97-104 (1993).
- Baird, D. H., Hatten, M. E., Mason, C. A. Cerebellar target neurons provide a stop signal for afferent neurite extension in vitro. J. Neurosci. 12, 619-634 (1992).
- Segal, R. A., Pomeroy, S. L., Stiles, C. D. Axonal growth and fasciculation linked to differential expression of BDNF and NT3 receptors in developing cerebellar granule cells. J. Neurosci. 15, 4970-4981 (1995).
- Gallo, V., Ciotti, M. T., Coletti, A., Aloisi, F., Levi, G. Selective release of glutamate from cerebellar granule cells differentiating in culture. Proc. Natl. Acad. Sci. U.S.A. 79, 7919-7923 (1982).
- Smith, T. C., Wang, L. Y., Howe, J. R. Distinct kainate receptor phenotypes in immature and mature mouse cerebellar granule cells. Physiol. 517 (1), 51-58 (1999).
- Konishi, Y., Stegmuller, J., Matsuda, T., Bonni, S., Bonni, A. Cdh1-APC controls axonal growth and patterning in the mammalian brain). Science. 303, 1026-1030 (2004).
- Stegmuller, J., Huynh, M. A., Yuan, Z., Konishi, Y., Bonni, A. TGFbeta-Smad2 signaling regulates the Cdh1-APC/SnoN pathway of axonal morphogenesis. J. Neurosci. 28, 1961-1969 (2008).
- Stegmuller, J., et al. Cell-intrinsic regulation of axonal morphogenesis by the Cdh1-APC target SnoN. Neuron. 50, 389-400 (2006).
- Kannan, M., Lee, S. J., Schwedhelm-Domeyer, N., Nakazawa, T., Stegmuller, J. p250GAP is a novel player in the Cdh1-APC/Smurf1 pathway of axon growth regulation. PLoS One. 7, (2012).
- Kannan, M., Lee, S. J., Schwedhelm-Domeyer, N., Stegmuller, J. The E3 ligase Cdh1-anaphase promoting complex operates upstream of the E3 ligase Smurf1 in the control of axon growth. Development. 139, 3600-3612 (2012).
- Gaudilliere, B., Konishi, Y., de la Iglesia, N., Yao, G., Bonni, A. A. CaMKII-NeuroD Signaling Pathway Specifies Dendritic Morphogenesis. Neuron. 41, 229-241 (2004).
- Yang, Y., et al. A Cdc20-APC ubiquitin signaling pathway regulates presynaptic differentiation. Science. 326, 575-578 (2009).
- Litterman, N., et al. An OBSL1-Cul7Fbxw8 ubiquitin ligase signaling mechanism regulates Golgi morphology and dendrite patterning. PLoS Biol. 9, (2011).
- Kim, A. H., et al. A centrosomal Cdc20-APC pathway controls dendrite morphogenesis in postmitotic neurons. Cell. 136, 322-336 (2009).
- Shalizi, A., et al. A calcium-regulated MEF2 sumoylation switch controls postsynaptic differentiation. Science. 311, 1012-1017 (2006).
- Vadhvani, M., Schwedhelm-Domeyer, N., Mukherjee, C., Stegmuller, J. The Centrosomal E3 Ubiquitin Ligase FBXO31-SCF Regulates Neuronal Morphogenesis and Migration. PLoS One. 8, (2013).
- Puram, S. V., et al. A CaMKIIbeta signaling pathway at the centrosome regulates dendrite patterning in the brain. Nat. Neurosci. , (2011).
- Jia, Y., Zhou, J., Tai, Y., Wang, Y. TRPC channels promote cerebellar granule neuron survival. Nat. Neurosci. 10, 559-567 (2007).
- Huynh, M. A., et al. An isoform-specific SnoN1-FOXO1 repressor complex controls neuronal morphogenesis and positioning in the mammalian brain. Neuron. 69, 930-944 (2011).
- de la Torre-Ubieta, L., Bonni, A. Transcriptional regulation of neuronal polarity and morphogenesis in the mammalian brain. Neuron. 72, 22-40 (2011).
- Calissano, P., et al. Recombinant human insulin-like growth factor I exerts a trophic action and confers glutamate sensitivity on glutamate-resistant cerebellar granule cells. Proc. Natl. Acad. Sci. U.S.A. 90, 8752-8756 (1993).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены