È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Manipolazione genetica delle cerebellare granuli neuroni
In questo articolo
Riepilogo
Morfogenesi neuronale e la migrazione sono eventi cruciali alla base un corretto sviluppo del cervello. Qui, descriviamo i metodi per manipolare geneticamente colture di neuroni granulari del cervelletto e del cervelletto in via di sviluppo per la valutazione della morfologia e delle caratteristiche migratorie dei neuroni.
Abstract
Eventi dello sviluppo del cervello, tra cui la morfogenesi neuronale e migrazione sono processi altamente orchestrati. In vitro e in vivo analisi consentono di una caratterizzazione approfondita per identificare meccanismi coinvolti in questi eventi. Neuroni granulari cerebellari (CGN) che sono derivati dal cervelletto di sviluppo sono un sistema modello ideale che consente analisi morfologiche. Qui, descriviamo un metodo di come manipolare geneticamente CGN e come studiare axono-e dendritogenesis dei singoli neuroni. Con questo metodo gli effetti dell'interferenza RNA, sovraespressione o piccole molecole possono essere confrontati per controllare neuroni. Inoltre, la corteccia cerebellare roditore è facilmente accessibile in sistema vivo a causa del suo sviluppo postnatale predominante. Vi presentiamo anche una tecnica di elettroporazione in vivo per manipolare geneticamente il cerebella sviluppo e descrivere la successiva cerebellare analisi per valutare la morfologia neuronale unand migrazione.
Introduzione
Il cervelletto è un ottimo sistema per studiare i meccanismi di crescita degli assoni e la migrazione. Il cervelletto è stata oggetto di studi anatomici fin dagli albori delle neuroscienze 1. Microscopia moderna e tecniche di immunoistochimica hanno notevolmente ampliato e perfezionato le scoperte iniziali di Santiago, Ramon e Cajal 2-4. Genetica del topo e studi molecolari scoperti fattori di crescita e di trascrizione essenziali nel controllo dello sviluppo del cervelletto, che ha portato ad una maggiore comprensione degli eventi cruciali necessari per il corretto cablaggio dei diversi tipi di neuroni, tra cui neuroni granulari del cervelletto (CGN) 5-7.
Il cervelletto è un derivato di rhombomere 1 della hindbrain sviluppo 8. Il labbro rombico, che è parte del tetto del 4 ° ventricolo, dà origine a progenitori neuronali dei granuli cerebellari, che costituiranno la più numerosa popolazione neuronale nelcervelletto adulto 9. Dopo la migrazione rostrale, si depositano nel anlage cerebellare. Qui, mitosi di precursori neuronali dei granuli porta alla drammatica espansione dello strato granulare esterno (EGL), che avviene dopo la nascita nei roditori. Dal EGL, i neuroni iniziano la migrazione verso l'interno attraverso lo strato molecolare (ML), oltre lo strato di cellule di Purkinje a prendere in ultima analisi, la residenza nello strato granulare interno (IGL 2). Durante questo processo migratorio, acquisiscono una forma bipolare con due assoni si estende nella ML. Su ulteriore migrazione, il corpo cellulare migra distanti assoni ei due processi fondono per formare uno biforcato, assone forma di T 10. Successivamente, questi assoni fasciculate e sono indicate come fibre parallele. Stabilitosi nel IGL, CGN crescere dendriti, che formano artigli dendritiche stabilire sinapsi con le fibre di muschio. Per esaminare processi fondamentali nel cervelletto sviluppo, un combinato in vitro e in vivo approach consente di ottenere risultati affidabili e conclusioni.
CGN sono non solo più numerosi neuroni del cervelletto ma dell'encefalo e possono essere coltivate a elevata purezza 11-13. Nella cultura, questa popolazione neuronale molto omogenea diventa rapidamente postmitotico e acquisisce una morfologia polare con assoni e dendriti facilmente identificabili. CGN coltura hanno dimostrato di essere estremamente utile per studiare i vari aspetti dello sviluppo neuronale, tra cui la proliferazione progenitore, la differenziazione, assonale e lo sviluppo dei dendriti, migrazione neuronale, l'apoptosi e le proprietà elettrofisiologiche (14-19 e molti altri). L'uso della manipolazione genetica ha ampliato la versatilità di CGN colti e consentito per una visione più meccanicistica nei suddetti eventi. La trasfezione di neuroni in coltura con bassa efficienza fosfato di calcio o metodi lipofile seguiti da immunocitochimica con marcatori polarità o software supportato da analisi di facilitareTATI la valutazione ad esempio la morfologia dei singoli neuroni in coltura neuronale denso. Con questo approccio, il ruolo delle proteine di interesse in assoni e dendriti crescita può essere studiato 20-25,26-28. Questo sistema di coltura però è meno utile per analizzare migrazione neuronale, come la migrazione è molto limitata nelle culture ad alta densità e richiederebbe co-colture. L'analisi in vitro di assoni e dendriti crescita consente anche per l'esame di proteine interconnessi di una via di segnalazione utilizzando combinazioni di RNA interference (i), sovra-espressione o piccole molecole.
Per stabilire la rilevanza della proteina di interesse in assoni e dendriti regolazione della crescita o la migrazione neuronale, l'elettroporazione in vivo (IVE) tecnica permette l'analisi in via di sviluppo corteccia cerebellare. Per il fatto che lo sviluppo cerebellare nei roditori estende strada nelle prime due settimane dopo la nascita, il cervelletto rappresenta un accessibstruttura del cervello per le manipolazioni genetiche per esaminare lo sviluppo di assoni e dendriti, migrazione neuronale, sinaptogenesi e apoptosi 20-24,29,30,26,27,31-34. Inoltre, questo modello di sistema è utile anche per altri aspetti dello sviluppo neuronale che richiedono la corteccia cerebellare intatta come assone pathfinding, il cablaggio e la connettività dei neuroni e delle interazioni neuroni-glia Preso insieme, questo protocollo prevede in vitro e in vivo le tecniche per affrontare un approccio complementare per quanto riguarda la morfogenesi neuronale e la migrazione.
Protocollo
CGN possono essere preparati sia dal primo giorno post-natale (P) 5 cuccioli di topo o cuccioli di ratto P6. Seguiamo un protocollo, descritto da Bilimoria e colleghi, che utilizza un inibitore mitotico per selezionare per CGN postmitotic 13.
Etica dichiarazione:
Tutti gli esperimenti che coinvolgono animali vivi sono stati condotti secondo il protocollo degli animali, approvato dal "Verbraucherschutz und Lebensmittelsicherheit" della Bassa Sassonia, in Germania.
Nel test in vitro:
1. Preparazione di plasmidi DNA, Media e buffer per il fosfato di calcio Metodo Transfezione
- Sciogliere plasmide DNA in acqua privo di endotossine sterile; DMEM (alti livelli di glucosio); fanno 2,5 M CaCl 2; fare 2x HBSS (sciogliere 4 g NaCl, 0,1775 g KCl, 0.095 g di Na 2 HPO 4 • 7H 2 O, 0,675 g di glucosio e 2,5 g HEPES in 250 ml di acqua ultrapura e aggiustare il pH a 7.05, 7.08 e 7.11). Nota: Quando si preparala soluzione HBSS 2x, pH test che dà i migliori risultati per quanto riguarda l'efficienza di trasfezione di data combinazione di plasmidi.
2. Trasfezione di colture di neuroni
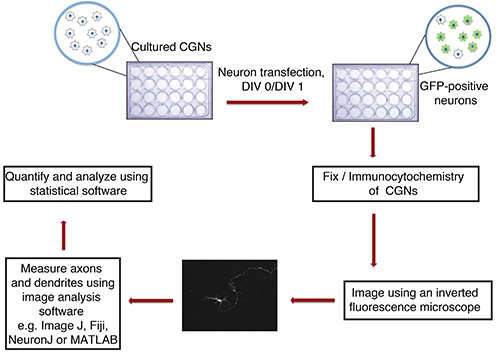
Figura 1. Diagramma di flusso di assoni in vitro e dendrite saggio di crescita. Coltivate CGN (piastra da 24 pozzetti con vetrini), isolato da P6 cuccioli di ratto, sono trasfettati in DIV 0 o 1 con precipitato DNA contenente un marcatore fluorescente trasfezione (es. GFP). Dopo la fissazione e immunocitochimica, i neuroni vengono esposte in modo cieco. Le immagini vengono importati in ImageJ e processi sono misurati. Le misurazioni vengono quindi elaborati utilizzando un programma statistico.
- CGN Seed (20 x 10 6 per 24 pozzetti, BME, siero di vitello al 10%, 2 mM penicillina-Streptomycin-Glutammina (PSG), 25 mM KCl) in acido nitrico-lavato, polyornithine rivestite 12 millimetri vetrini in una piastra da 24 pozzetti con 500 microlitri di media per pozzetto.
- Il giorno in vitro (DIV) 0 (almeno 8 ore dopo la placcatura) o DIV 1, raccogliere i media di crescita e di mantenere a 37 ° C. Lavare i neuroni due volte con 500 ml di DMEM preriscaldata e aggiungere 500 ml di DMEM.
- Inserire neuroni in incubatore (37 ° C, 5% CO 2) per 45 min.
- Preparare 40 ml precipitato di DNA per ogni ben mescolando: DNA (2-2,5 mg / bene, il 10% del DNA totale dovrebbe essere un marcatore di transfezione es GFP per visualizzarne i neuroni trasfettati), acqua (fino a 18 ml), aggiungere 2 ml di 2,5 M CaCl 2, mescolare bene e aggiungere 20 ml di 2x HBSS.
- Incubare DNA precipitato per 5 minuti a temperatura ambiente.
- Aggiungi precipitato DNA a ciascun pozzetto e incubare i neuroni per 18 min in incubatrice.
- Rimuovere mix DMEM / DNA e lavare i neuroni due volte con 500 ml di preriscaldata DMEM.
- Aggiungere raccolta multimediale dal punto 2.2 torna ai neuroni. Se i neuroni saranno in coltura per più di 3 giorni, i media supplemento con glucosio 25 mm a DIV 3 per ricostituire fonte di carbonio.
- Dopo 1-5 giorni, neuroni sottoposti a immunocitochimica utilizzando anticorpi GFP.
- Immagine almeno 30 neuroni individuali a condizione in modo cieco utilizzando un microscopio a fluorescenza.
3. Misurare assoni e dendriti con NeuronJ, un NIH ImageJ Plugin
Importante: Assicurarsi che le immagini vengono ridimensionate correctluy utilizzando appropriate pixel: rapporto micron a seconda di ingrandimento e la risoluzione dell'immagine.
- Converti immagini a 8-bit con ImageJ: Apri immagine, selezionare 'Immagine' -> 'Tipo' -> '8 bit '->' Salva immagine '.
- Eseguire NeuronJ plug-in e aprire l'immagine a 8 bit.
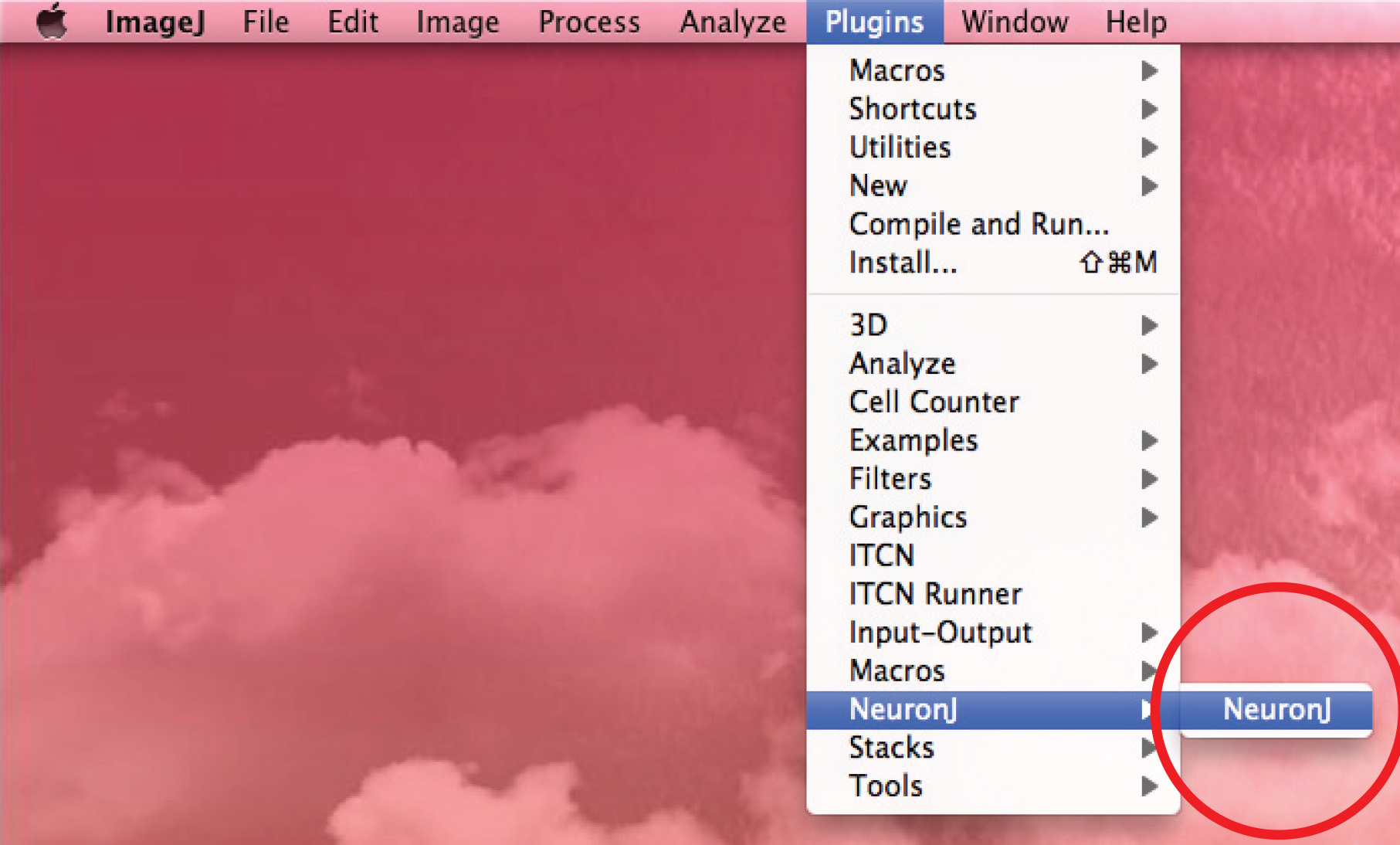
- Utilizzare l'opzione 'Aggiungi' tracciati per monitorare l'assone: click il pulsante sinistro del mouse una volta all'inizio dell'assone e spostare il mouse lungo il processo. Fare doppio click sulla punta dell'assone se traccia corrisponde a forma assonale.
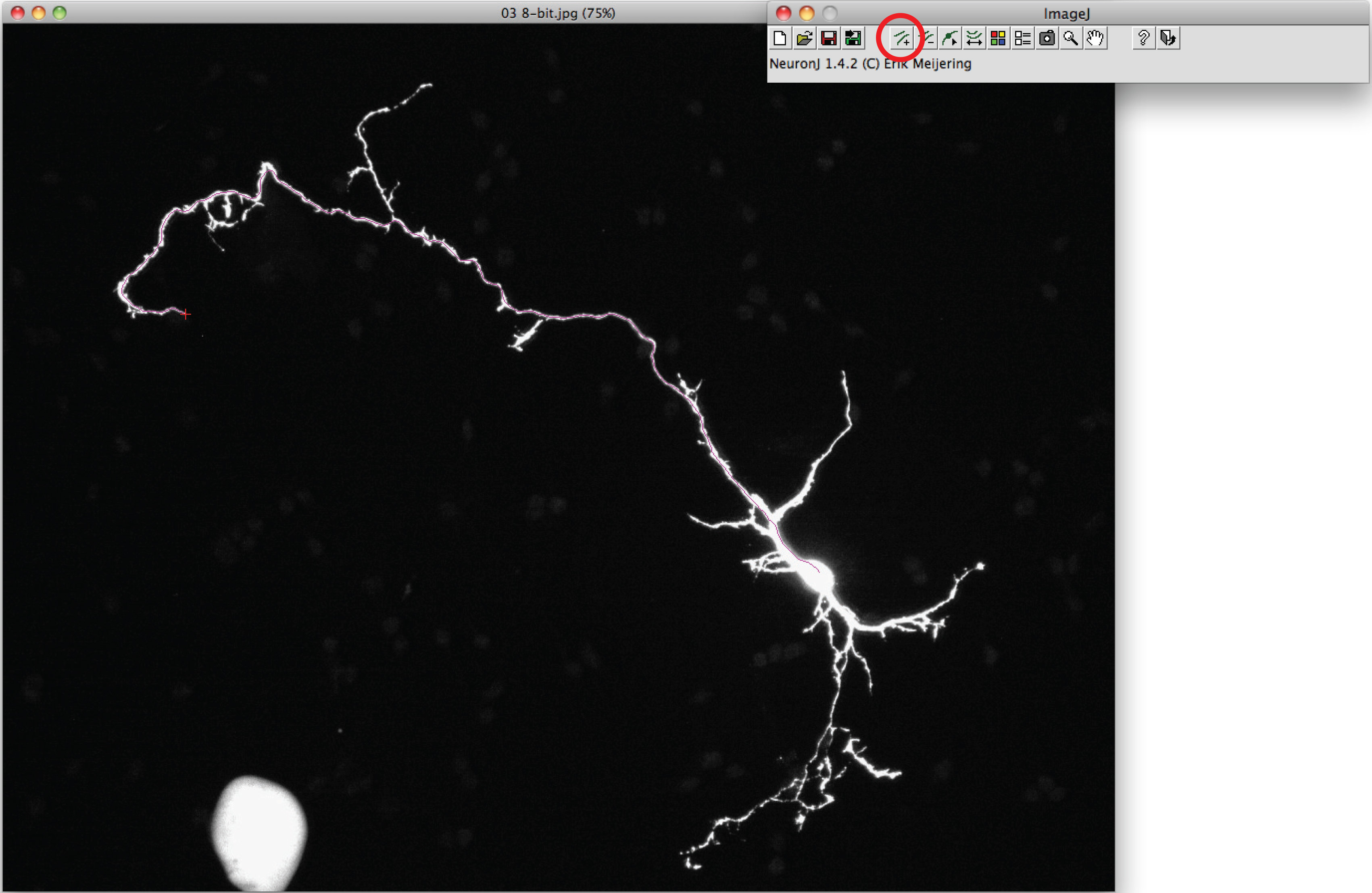
Nota: Se la traccia suggerita differire dalla forma assonale, fare clic una volta sul processo assonale per ancorare traccia, fare doppio clic sulla punta dell'assone. - Clicca su "tracciati misura", scegliere il 'Display misurazioni tracciamento' opzione e premere 'Esegui'. Misurazioni Axon sono tutti visualizzati in una nuova finestra. Per i dendriti, scegliere l'opzione 'misure gruppo di visualizzazione' e premere 'Esegui'.
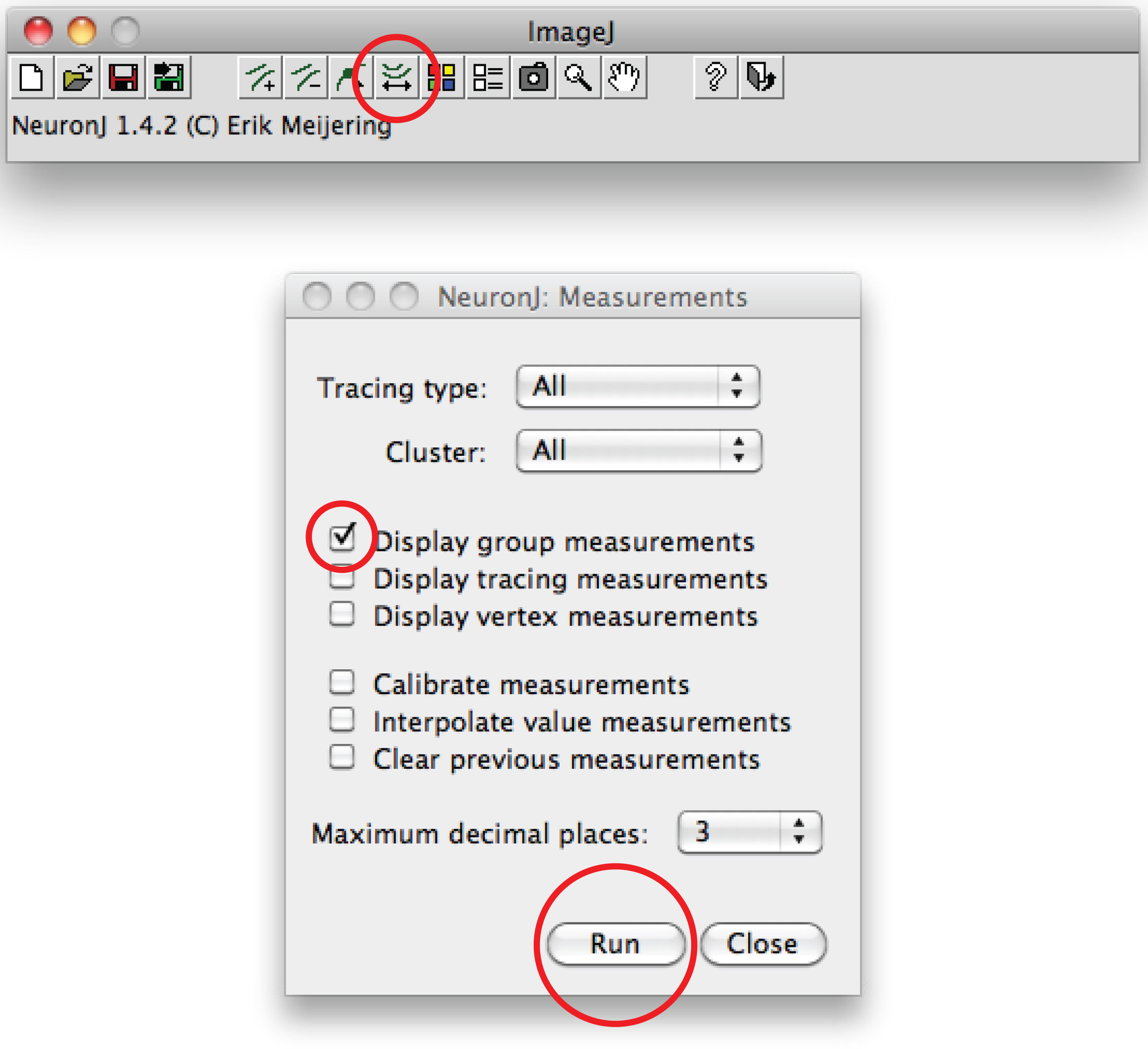
Misurazioni dendriti totali sono tutti visualizzati in una nuova finestra. Salvarli come file separato che può essere aperto in qualsiasi programma di foglio di calcolo. - In alternativa, per il tracciamento manuale, utilizzare il software Fiji: clic destro su °e l'opzione 'retta', scegliere 'la linea a mano libera',
mantenere il tasto sinistro del mouse e tracciare manualmente il processo, premere 'Ctrl + M' per misurare. - Calcola lunghezza / assonale media dendritiche per condizione e utilizzare test statistico appropriato.
In elettroporazione in vivo:
1. Attrezzature e Preparazione dei reagenti
- Avete bisogno di 30 aghi G, distanziale (1-2 mm), siringa, riduttore di volume morto (DVR), elettroporatore e tweezertrodes, piastra elettrica o lampada di calore a raggi infrarossi, lampada a collo d'oca e isoflurano.
- Mettere DVR in dell'ago, quindi collegare l'ago alla siringa, e, infine, mettere distanziale sulla ago (Figura 2).
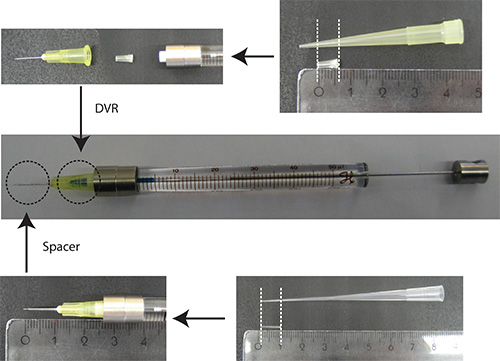
Figura2. Preparazione dell'ago. DVR è tagliata una punta di pipetta 200 microlitri e collocato all'interno dell'ago per ridurre il volume morto. Spaziatore è derivato da una punta di 200 microlitri di carico e viene posizionato sull'estremità dell'ago per regolare la profondità di penetrazione nel cervelletto di circa 2 mm. Unità righello: cm - Sciogliere DNA in PBS/0.03% Verde veloce. Nota: Come marcatore trasfezione, è vantaggioso utilizzare una proteina fluorescente che è sotto un promotore neurone-specifica (ad es Synapsin) per visualizzare solo i neuroni. 25% del totale plasmide dovrebbe essere il plasmide codificante il marcatore trasfezione.
- Effettuare il 70% di etanolo.
- Miscelare volumi uguali di ottobre e del 30% di saccarosio disciolto in PBS.
- Riempire la siringa con 4 ml di DNA (4 mg / mL di DNA plasmidico in PBS/0.03% rapidi verde).
2. IVE di Rat Pups
Diagramma di flusso di IVE: si veda la Figura 3
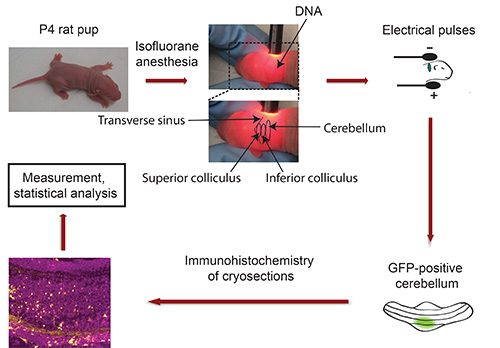
Figura 3. Diagramma di flusso di elettroporazione in vivo. P4 cuccioli di ratto sono anestetizzati con isoflurano e DNA plasmidico codificante un marcatore fluorescente trasfezione (es. GFP) viene iniettato nel cervelletto, seguito da esposizione a 5 impulsi elettrici. Cinque giorni dopo, isolato cerebella GFP-positive sono sezionato e sottoposto a immunoistochimica. Le immagini sono state acquisite utilizzando un microscopio confocale e analizzati utilizzando il software Imaris. I dati sono trattati con un programma statistico.
- Utilizzare P4 cuccioli di ratto dal ceppo albino (Wistar o Long Evans).
- Anestetizzare cuccioli (uno dopo l'altro) con isoflurano in piccola scatola (ad esempio P1000 box puntale) con 200 ml di isoflurano (imbevuto in tessuto) per 1-2 minuti fino a quando cucciolo non è più in movimento. Fate attenzione che i cuccioli non entrare in contatto wesima Iiquido isoflurano. Monitorare il tempo strettamente individuali cuccioli rispondono diversamente ad anestesia.
- Sterilizzare posteriore della testa del cucciolo con il 70% di etanolo.
- Fissare capo del pup tra il pollice e l'indice e utilizzare la lampada a collo d'oca per individuare cervelletto del pup albino. Il seno trasverso delimita nettamente il mesencefalo (collicolo superiore ed inferiore) a partire da emisferi corticali (Figura 3). Il cervelletto si trova adiacente al mesencefalo e appare in una tonalità più scura. Utilizzare un pennarello indelebile per indicare il cervelletto con un punto. Importante: Conservare pup in posizione fissa! Nota: In caso di anestesia indossare durante questa procedura, esporre cucciolo di isoflurano prima di iniettare il DNA.
- Inserire l'ago (figura 3) e iniettare lentamente 3 ml di DNA nel cervelletto.
- Lasciate che la soluzione di DNA diffusa per 30-60 sec.
- Inserire la testa del cucciolo tra tweezertrodes in modo che il polo negativo a contatto con la parte posteriore della testa (cerebellaregione r) e che il polo positivo contro il lato opposto della testa (Figura 3).
- Oggetto pup a 5 impulsi elettrici. Regolare la tensione al peso dei cuccioli di garantire una buona efficienza elettroporazione senza compromettere la loro sopravvivenza (Tabella 1).
Tabella 1. Elettroporazione di P4 cuccioli di ratto.Peso Tensione Impulso Intervallo 8-9 g 160 V 50 msec 950 msec 9-10 g 165 V 50 msec 950 msec > 10 g 170 V 50 msec 950 msec - Lasciate cuccioli recuperare il pad riscaldato o sotto una lampada a raggi infrarossi. Cuccioli di diga di ritorno. Importante: Assicurarsi che fonte di riscaldamento non infliggere ustioni.
- Sacrifica cuccioli 5 giorni dopo l'elettroporazione mettendoli in CO 2, seguita da decapitazione.
- Isolare il cerebella e lo schermo per quelli GFP-positive cerebella utilizzando un microscopio a fluorescenza.
- Fix cerebella in 4% PFA O / N a 4 ° C, poi incubare in saccarosio al 30% a 4 ° C fino cerebella lavello a fondo della provetta.
- Incorpora cerebella in OCT/30% di saccarosio e tagliare 40 micron sezioni coronali utilizzando un criostato. Nota: Tratto ogni cervelletto in modo cieco.
- Sezioni soggette a immunoistochimica con l'anticorpo GFP. Controcolorare con colorante nucleare (DAPI o Hoechst 33258) e determinare la localizzazione di almeno 200 neuroni trasfettati per animale.
- Per un'analisi approfondita, suddividere il IGL in due metà, con un conseguente IGL superiore di fronte alla ML e una IGL minore di fronte alla materia bianca e contare i neuroni GFP-positive che risiedono in ogni tempo. Nota: Count neuroni GFP-positive di ogni sezione in modo cieco.
3. Misurare Dendrite intera, Acquisire le immagini della sezione in x, y, z aereo utilizzando un microscopio confocale
Nota: per esempio, utilizzare 40 immagini per una sezione di 40 micron con una z-stwp di 1 micron.
- Serie di immagini Open in software, Imaris, per generare una immagine 3D di dendriti.
- Clicca su modalità 'Superare' per vedere il neurone in 3D.
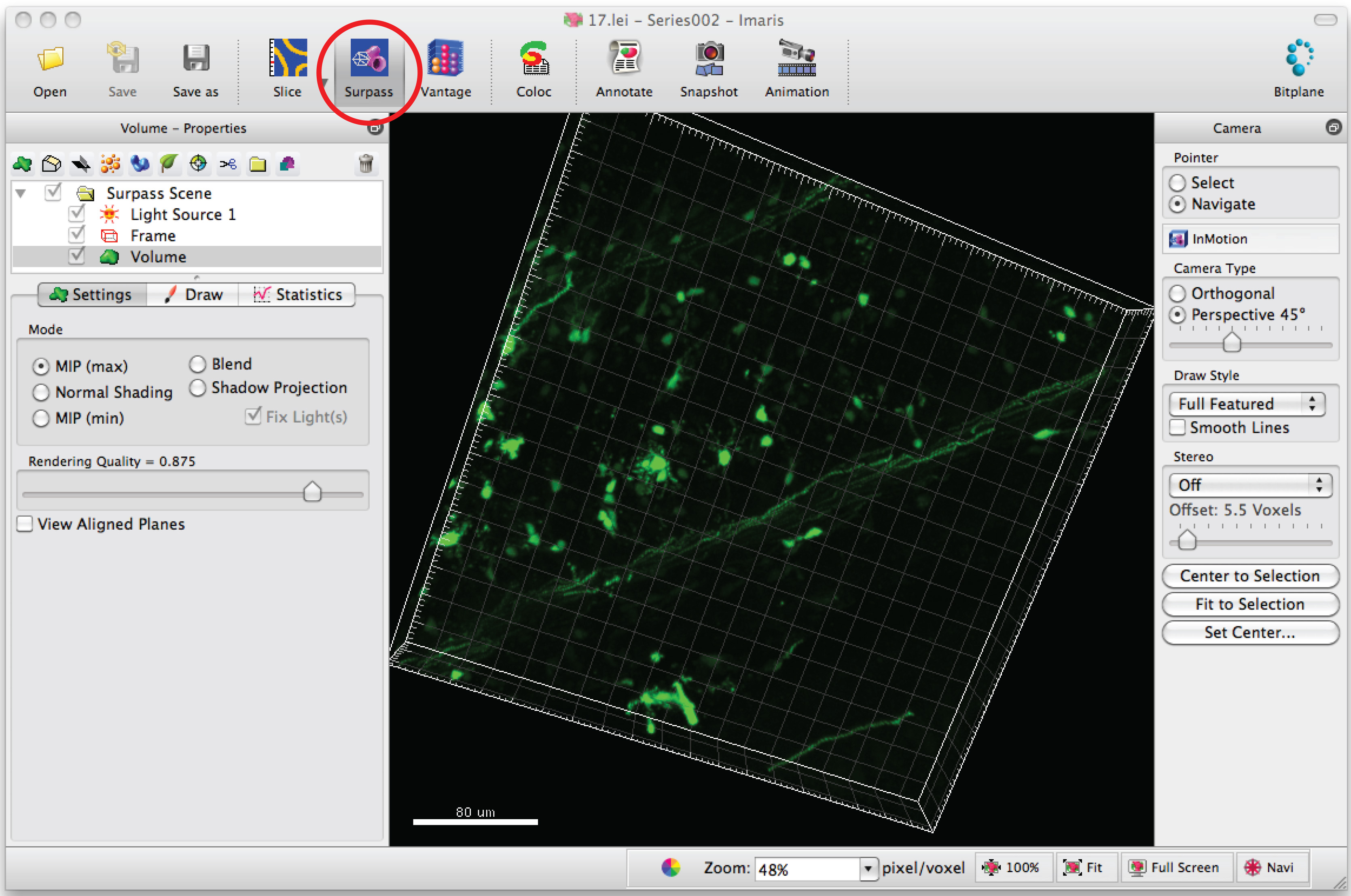
- Selezionare 'Aggiungi nuovo filamento' e cliccare su 'Skip creazione automatica' per avviare l'analisi semiautomatica.

Nota: Analizzare ogni immagine 3D in modo cieco - Selezionare la scheda 'Draw' e 'AutoPath'.
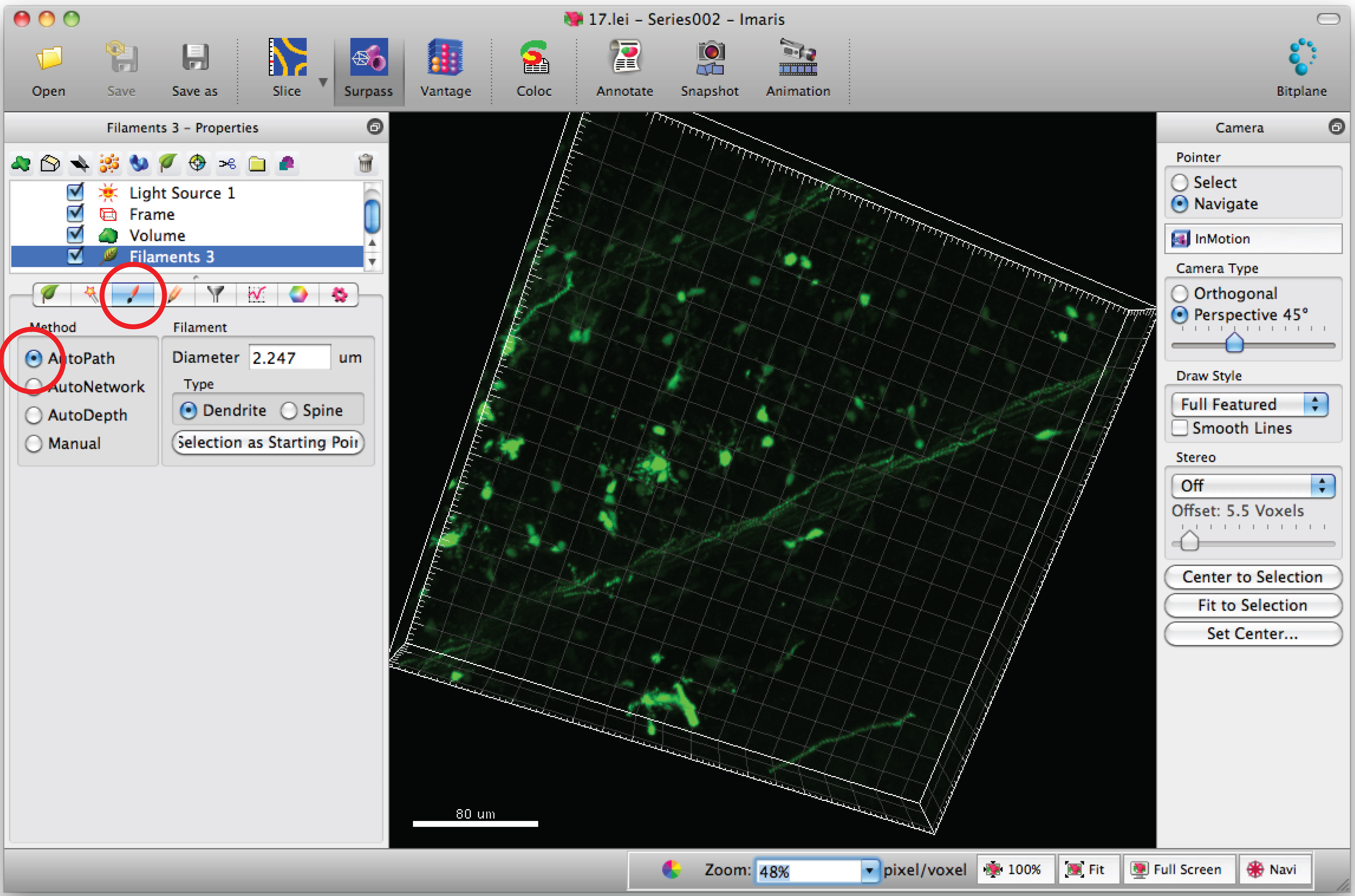
- Spostare il cursore del mouse sul ccorpo ell e Maiusc + tasto destro del mouse per selezionare il corpo cellulare. Nota: autocalculation dal software potrebbe richiedere alcuni minuti.

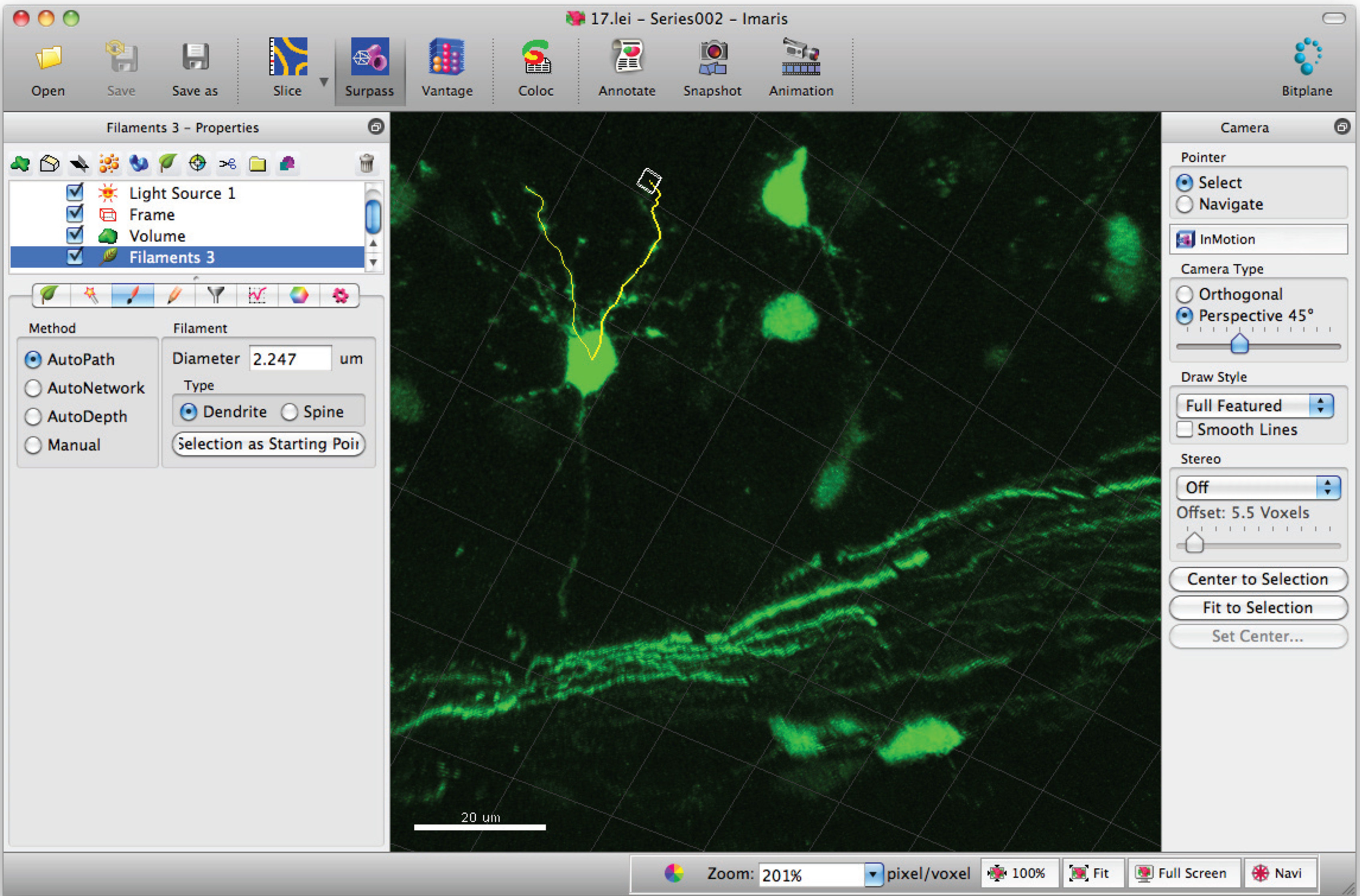
- Aggiungi percorsi per il filamento (dendriti) usando Shift + click del mouse a sinistra. Nota: I percorsi possono essere visualizzati in tempo reale.
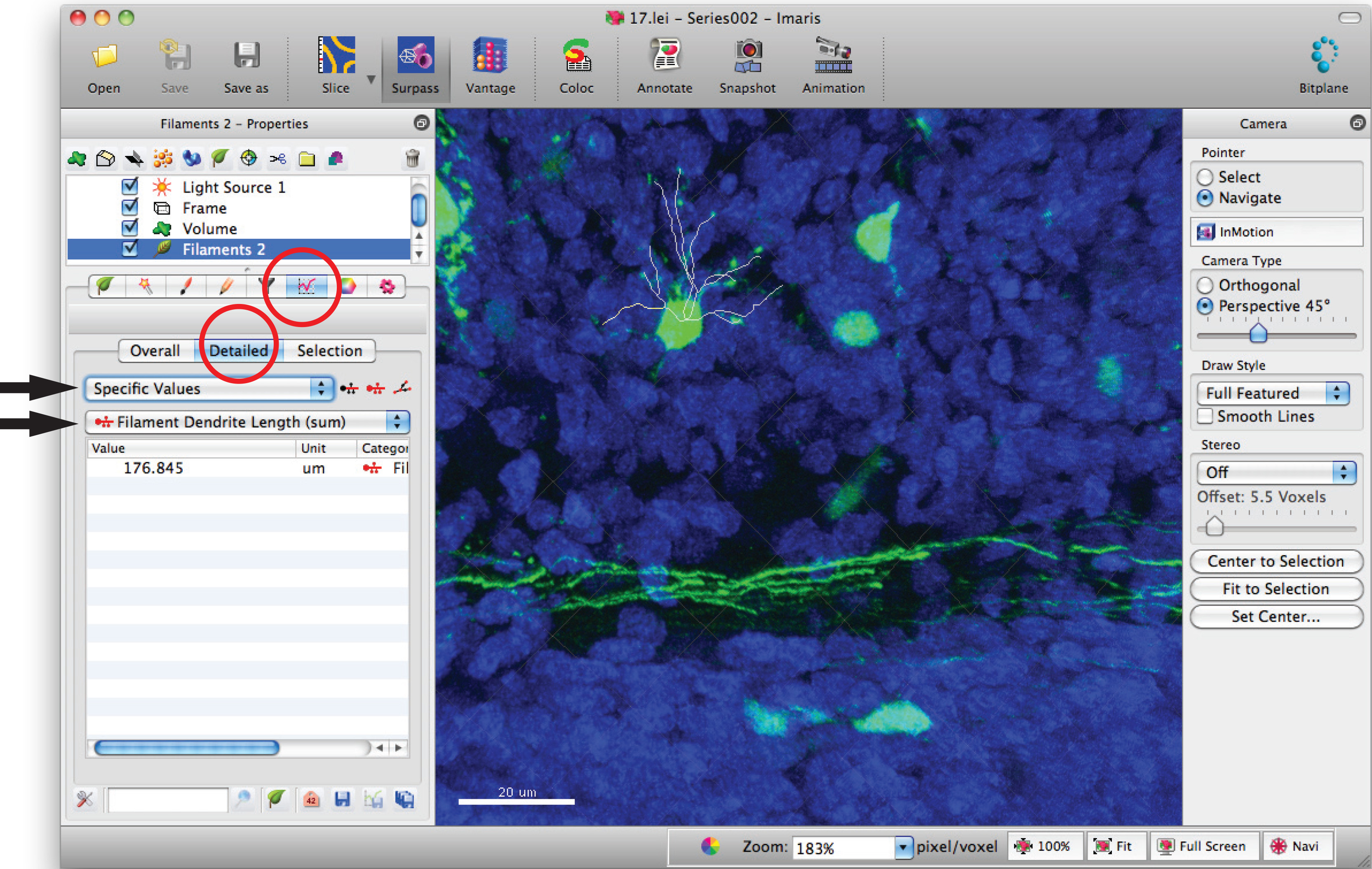
- Vai alla finestra delle statistiche ad incandescenza e clicca su "valori specifici, '' dettagliate 'e' la lunghezza del filamento dendrite (somma) 'per somma di lunghezza totale dendrite.
- Utilizzare appropriati test statistici per analizzare i dati.
Risultati
Per analizzare la morfologia della CGN in risposta a differenti condizioni di coltura, abbiamo trasfettato i neuroni sul DIV 0 come descritto sopra. Dopo trasfezione, abbiamo messo una serie di neuroni in pieno mezzo (BME, siero di vitello al 10%, 2 PSG mM, 25 mM KCl) e un'altra serie in minima quantità di terreno contenente insulina (BME, glucosio 25 mM, 2 PSG mm, 10 mg / insulina ml). Abbiamo sottoposto i neuroni a immunocitochimica utilizzando l'anticorpo GFP a DIV 1, 2, e 3, seguita da assoni e dendriti di ...
Discussione
Vantaggi e limitazioni del descritto in vitro e in vivo:
CGN Colta da mouse e ratti sono ugualmente adatti per le analisi morfologiche. A causa della dimensione più grande di un cervelletto di ratto, la resa di CNGS da cuccioli di ratto supera quello dei cuccioli di topo 3-4x. A parte CGN, neuroni corticali e ippocampali possono essere utilizzati come sistema cultura. Il metodo di fosfato di calcio si traduce in un basso (0,01-5%) efficienza di trasfezione, che è desidera...
Divulgazioni
Gli autori dichiarano interessi finanziari concorrenti.
Riconoscimenti
Ringraziamo N. Schwedhelm-Domeyer per l'eccellente assistenza tecnica, C. Martello e S. Papiol per un aiuto con analisi statistiche. Il nostro lavoro è finanziato dalla Max Planck Society, la Deutsche Forschungsgemeinschaft, il Center for Nanoscale Microscopia e Fisiologia Molecolare del cervello (CNMPB), Göttingen, Germania e dal GGNB Junior Gruppo Stipend dell'Università di Göttingen.
Materiali
| Name | Company | Catalog Number | Comments |
| DMEM | Gibco | 11960-044 | |
| BME | Gibco | 41010-026 | |
| Insulin | Sigma-Aldrich | Si-1-4011 | |
| Poly-L-Ornithine | Sigma-Aldrich | P-2533 | |
| CaCl2 | Appli-Chem | A3652 | |
| Isoflurane | Actavis Deutschland | ||
| Tissue-Tek OCT | Sakura | ||
| ECM 830 and tweezertrodes | Harvard Apparatus | ||
| Epifluorescence microscope and camera | Nikon | ||
| SP2 confocal microscope | Leica | ||
| ImageJ | NIH | ||
| Imaris 7.4.2 | Bitplane, Inc. | ||
| GraphPad Prism | GraphPad Software, Inc. | ||
| MS Excel | Microsoft | ||
| Loading tip 1-200 µl | Costar | 4853 | |
| Pipette tip 200 µl | Sarstedt | 70.760.502 | |
| Microlance 3 needle, 30 G | BD | 302200 | |
| 50 µl gastight Syringe 1705 | Hamilton | ||
| Glass coverslips | Thermo Scientific Menzel Glaeser | CB00120RA1 |
Riferimenti
- Cajal, S. R. . Histology of the nervous system of man and vertebrates. , (1995).
- Altman, J., Bayer, S. A. . Development of the cerebellar system : in relation to its evolution, structure, and functions. , (1997).
- White, J. J., Reeber, S. L., Hawkes, R., Sillitoe, R. V. Wholemount immunohistochemistry for revealing complex brain topography. J. Vis. Exp. , (2012).
- Palay, S. L., Chan-Palay, V. . Cerebellar cortex: cytology and organization. , (1974).
- Hatten, M. E., Alder, J., Zimmerman, K., Heintz, N. Genes involved in cerebellar cell specification and differentiation. Curr. Opin. Neurobiol. 7, 40-47 (1997).
- Hatten, M. E., Heintz, N. Mechanisms of neural patterning and specification in the developing cerebellum. Annu. Rev. Neurosci. 18, 385-408 (1995).
- Sillitoe, R. V., Joyner, A. L. Morphology molecular codes, and circuitry produce the three-dimensional complexity of the cerebellum. Ann. Rev. Dev. Biol. 23, 549-577 (2007).
- Zervas, M., Millet, S., Ahn, S., Joyner, A. L. Cell behaviors and genetic lineages of the mesencephalon and rhombomere 1. Neuron. 43, 345-357 (2004).
- Wingate, R. J. The rhombic lip and early cerebellar development. Curr. Opin. Neurobiol. 11, 82-88 (2001).
- Kawaji, K., Umeshima, H., Eiraku, M., Hirano, T., Kengaku, M. Dual phases of migration of cerebellar granule cells guided by axonal and dendritic leading processes. Mol. Cell Neurosci. 25, 228-240 (2004).
- Hatten, M. E., Gao, W. -. Q., Morrison, M. E., Mason, C. A. Cellular and molecular neuroscience. , 419-41 .
- Lee, H. Y., Greene, L. A., Mason, C. A., Manzini, M. C. Isolation and culture of post-natal mouse cerebellar granule neuron progenitor cells and neurons. J. Vis. Exp. , (2009).
- Bilimoria, P. M., Bonni, A. Cultures of cerebellar granule neurons. CSH Protoc. 2008, (2008).
- Rivas, R. J., Hatten, M. E. Motility and cytoskeletal organization of migrating cerebellar granule neurons. J. Neurosci. 15, 981-989 (1995).
- Kuhar, S. G., et al. Changing patterns of gene expression define four stages of cerebellar granule neuron differentiation. Development. 117, 97-104 (1993).
- Baird, D. H., Hatten, M. E., Mason, C. A. Cerebellar target neurons provide a stop signal for afferent neurite extension in vitro. J. Neurosci. 12, 619-634 (1992).
- Segal, R. A., Pomeroy, S. L., Stiles, C. D. Axonal growth and fasciculation linked to differential expression of BDNF and NT3 receptors in developing cerebellar granule cells. J. Neurosci. 15, 4970-4981 (1995).
- Gallo, V., Ciotti, M. T., Coletti, A., Aloisi, F., Levi, G. Selective release of glutamate from cerebellar granule cells differentiating in culture. Proc. Natl. Acad. Sci. U.S.A. 79, 7919-7923 (1982).
- Smith, T. C., Wang, L. Y., Howe, J. R. Distinct kainate receptor phenotypes in immature and mature mouse cerebellar granule cells. Physiol. 517 (1), 51-58 (1999).
- Konishi, Y., Stegmuller, J., Matsuda, T., Bonni, S., Bonni, A. Cdh1-APC controls axonal growth and patterning in the mammalian brain). Science. 303, 1026-1030 (2004).
- Stegmuller, J., Huynh, M. A., Yuan, Z., Konishi, Y., Bonni, A. TGFbeta-Smad2 signaling regulates the Cdh1-APC/SnoN pathway of axonal morphogenesis. J. Neurosci. 28, 1961-1969 (2008).
- Stegmuller, J., et al. Cell-intrinsic regulation of axonal morphogenesis by the Cdh1-APC target SnoN. Neuron. 50, 389-400 (2006).
- Kannan, M., Lee, S. J., Schwedhelm-Domeyer, N., Nakazawa, T., Stegmuller, J. p250GAP is a novel player in the Cdh1-APC/Smurf1 pathway of axon growth regulation. PLoS One. 7, (2012).
- Kannan, M., Lee, S. J., Schwedhelm-Domeyer, N., Stegmuller, J. The E3 ligase Cdh1-anaphase promoting complex operates upstream of the E3 ligase Smurf1 in the control of axon growth. Development. 139, 3600-3612 (2012).
- Gaudilliere, B., Konishi, Y., de la Iglesia, N., Yao, G., Bonni, A. A. CaMKII-NeuroD Signaling Pathway Specifies Dendritic Morphogenesis. Neuron. 41, 229-241 (2004).
- Yang, Y., et al. A Cdc20-APC ubiquitin signaling pathway regulates presynaptic differentiation. Science. 326, 575-578 (2009).
- Litterman, N., et al. An OBSL1-Cul7Fbxw8 ubiquitin ligase signaling mechanism regulates Golgi morphology and dendrite patterning. PLoS Biol. 9, (2011).
- Kim, A. H., et al. A centrosomal Cdc20-APC pathway controls dendrite morphogenesis in postmitotic neurons. Cell. 136, 322-336 (2009).
- Shalizi, A., et al. A calcium-regulated MEF2 sumoylation switch controls postsynaptic differentiation. Science. 311, 1012-1017 (2006).
- Vadhvani, M., Schwedhelm-Domeyer, N., Mukherjee, C., Stegmuller, J. The Centrosomal E3 Ubiquitin Ligase FBXO31-SCF Regulates Neuronal Morphogenesis and Migration. PLoS One. 8, (2013).
- Puram, S. V., et al. A CaMKIIbeta signaling pathway at the centrosome regulates dendrite patterning in the brain. Nat. Neurosci. , (2011).
- Jia, Y., Zhou, J., Tai, Y., Wang, Y. TRPC channels promote cerebellar granule neuron survival. Nat. Neurosci. 10, 559-567 (2007).
- Huynh, M. A., et al. An isoform-specific SnoN1-FOXO1 repressor complex controls neuronal morphogenesis and positioning in the mammalian brain. Neuron. 69, 930-944 (2011).
- de la Torre-Ubieta, L., Bonni, A. Transcriptional regulation of neuronal polarity and morphogenesis in the mammalian brain. Neuron. 72, 22-40 (2011).
- Calissano, P., et al. Recombinant human insulin-like growth factor I exerts a trophic action and confers glutamate sensitivity on glutamate-resistant cerebellar granule cells. Proc. Natl. Acad. Sci. U.S.A. 90, 8752-8756 (1993).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon