このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
小脳顆粒ニューロンの遺伝子操作
要約
神経細胞の形態形成および移行が適切な脳の発達の基礎となる重要なイベントです。ここでは、遺伝的に培養した小脳顆粒ニューロンおよび形態や神経細胞の遊走特性の評価のための開発小脳を操作する方法を説明します。
要約
神経細胞の形態形成および移行を含む脳の発達のイベントは、高度のプロセスを組織化している。、in vitroおよびin vivoでこれらのイベントに関与する経路を特定するために、詳細な特性評価を可能に分析しています。現像小脳に由来する小脳顆粒ニューロン(CGNを)は、形態学的分析を可能にする理想的なモデル系である。ここでは、遺伝的にCGNを操作する方法の方法とどのように個々のニューロンの軸索と樹状突起を研究するについて説明します。この方法ではRNA干渉、過剰発現または低分子の効果は、ニューロンを制御するために比較することができる。また、齧歯類小脳皮質は、その支配的な出生後の発達により、生体システムにおいて簡単にアクセスできます。我々はまた、遺伝的に開発小脳を操作し、その後の小脳を記述するために、生体内エレクトロポレーション法を提示すると、神経形態aを評価するために分析し、ND移行。
概要
小脳は、軸索の成長と移動のメカニズムを研究するための優れたシステムです。小脳は、脳科学1の黎明期から解剖学の研究の対象となっている。現代の顕微鏡検査および免疫組織化学的技術が大幅に拡大し、サンティアゴ、ラモン、およびカハール2-4初期の発見に磨きをかけてきました。マウス遺伝学と分子の研究では、小脳顆粒ニューロン(CGNを)5-7を含むニューロンの様々なタイプの適切な配線に必要な重要なイベントのより深い理解につながった、小脳発生の制御に必須の増殖および転写因子を発見した。
小脳は、途上後脳8のrhombomere 1の誘導体である。で最も多くニューロン集団を構成する4 番目の心室の屋根の一部である菱形リップ、小脳顆粒ニューロン前駆細胞を生じさせる、大人の小脳9。吻側移行後、彼らは小脳原基に定住。ここで、顆粒ニューロン前駆体の有糸分裂は、げっ歯類において出生後に行われる外顆粒層(EGL)の劇的な拡大をもたらす。 EGLから、神経細胞は、最終的には、内部顆粒層(IGL 2)に居を取るためにプルキンエ細胞層を越えて、分子層(ML)を介して内側への移行を開始。この渡り鳥プロセスの間に、彼らは、ML内に延びる2軸索を有するバイポーラ形を獲得する。さらに、移行の際に、細胞体、軸索から離れて移動し、二つのプロセスは、一分岐した、T字型の軸索10を形成するために融合。その後、これらの軸索は束生のと平行線維と呼ばれている。 IGLに定住した、CGNをは苔状線維とシナプスを確立するために、樹枝状の爪を形成する樹状突起を、育つ。開発小脳において基本的なプロセスを検討するために、in vitroおよびin vivo approac で組み合わせるHは、信頼性の高い結果と結論することができます。
CGNを、小脳のが、脳全体の中で最も数多くの神経細胞であるだけでなく、高純度11月13日に培養することができる。文化では、この非常に均質なニューロン集団は、急速に分裂後になり、容易に識別軸索と樹状突起を有する極性形態を獲得する。培養されたCGNを、前駆増殖、分化、軸索および樹状突起の発達、神経細胞遊走、アポトーシスおよび電気生理学的特性(14-19および多くの他)を含む神経発達の様々な側面を研究することは非常に有用であることが証明されている。遺伝子操作の使用は、培養たCGNの汎用性を拡大し、前述のイベントへのさらなる機械論的な洞察を可能にした。極性マーカーまたはソフトウェアでサポートされている解析設備などで免疫細胞化学、続いて低効率リン酸カルシウムまたは親油性の方法を用いて培養されたニューロンのトランスフェクション密な神経細胞培養液中の個々のニューロンの形態学などの評価をtates。このアプローチでは、軸索または樹状突起成長中の目的のタンパク質の役割は20-25,26-28を研究することができる。移行は、高密度培養では非常に限られており、共培養を必要とするので、この培養系は、しかしながら、ニューロン移動を分析するあまり有用である。軸索と樹状突起成長のインビトロ分析も過剰発現または小分子、RNA干渉(i)の組合せを使用してシグナル伝達経路の相互接続されたタンパク質の調査を可能にする。
軸索と樹状突起の成長制御やニューロン移動における目的のタンパク質の関連性を確立するために、in vivoでのエレクトロポレーション(IVE)技術が発達小脳皮質での分析を可能にする。げっ歯類における小脳開発は最初の2週間、生後に道を拡張するという事実のために、小脳はaccessibを表し軸索と樹状突起、ニューロン移動、シナプス形成およびアポトーシス20-24,29,30,26,27,31-34の開発を検討する遺伝子操作のためのル·脳構造。また、このモデル系はまた、軸索経路探索、配線と合わせて考えると、ニューロンとニューロン-グリア相互作用の接続などそのまま小脳皮質を必要とする神経発達の他の側面に有用であり、このプロトコルは、in vitroおよびin vivo技術は取り組むために提供して神経細胞の形態形成および移行に関する補完的なアプローチ。
プロトコル
CGNをいずれか生後(P)5仔マウスまたはP6仔ラットから調製することができる。私たちは、有糸分裂後CGNを13を選択するために、有糸分裂阻害剤を使用していますBilimoriaらによって記述されたプロトコルを、従ってください。
倫理声明:
生きた動物を含むすべての実験は、ニーダーザクセン州、ドイツの「VerbraucherschutzウントLebensmittelsicherheit」で承認された動物プロトコルに従って行われてきた。
インビトロアッセイ:
1。リン酸カルシウムトランスフェクション法のためのDNAプラスミド、メディア、およびバッファの準備
- 無菌、エンドトキシンを含まない水にプラスミドDNAを溶解させ、DMEM(高グルコース); 2.5Mの塩化カルシウムを加える 。2X HBSSが(4グラムのNaCl、0.1775グラムのKCl、0.095グラム2 HPO 4•7H 2 O、0.675グラムのブドウ糖のNaを溶解させるそして250ミリリットル超純水に2.5グラムのHEPESおよび7.05、7.08、および7.11)にpHを調整する。注:準備するとき2X HBSS溶液、pHはプラスミドの特定の組み合わせのトランスフェクション効率についての最良の結果が得られ、テスト。
2。培養神経細胞のトランスフェクション
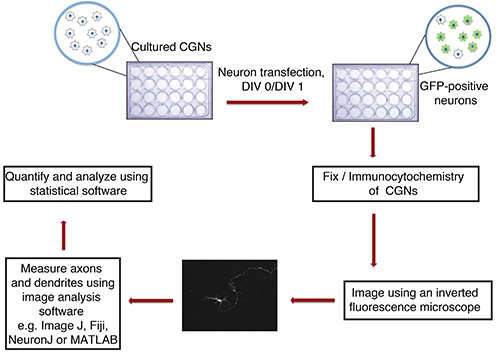
図1。 in vitroでの軸索と樹状突起の成長アッセイのフローチャート。培養CGNを(ガラス製カバースリップした24ウェルプレート)、P6の仔ラットから単離され、( 例えば 、GFP)の蛍光トランスフェクションマーカーを含むDNA沈殿物DIV 0または1でトランスフェクトされる。固定および免疫細胞化学の後、ニューロンは、盲検法で画像化されています。画像はImageJのにインポートされ、プロセスが測定される。測定値は、次に統計プログラムを用いて処理される。
- シードCGNを(24ウェルプレートあたり20×10 6、BME、10%ウシ血清、2mMのペニシリン-Streptomycin-グルタミン(PSG)、25のKCl)メディア500μlで24ウェルプレート中の硝酸洗浄、ポリオルニチンでコーティングされた12ミリメートルのガラス製カバースリップ上、ウェルあたり。
- in vitroでの一日(DIV)0(めっき後少なくとも8時間)またはDIV 1に、増殖培地を収集し、37℃で維持あらかじめ温めておいたDMEM500μlで二回ニューロンを洗浄し、DMEM500μlのを追加します。
- インキュベーターに置きニューロン(37℃、5%CO 2)で45分間。
- 混合することにより、各ウェル40μlのDNA沈殿物を準備したDNAを(2-2.5μgの/ウェル、全DNAの10%がトランスフェクトニューロンを可視化するトランスフェクションマーカー、例えば GFPであるべき)、(18μLまで)水、2μlのを追加2.5MのCaCl 2を 、よく混ぜると2XのHBSS 20μlを加える。
- RTで5分間、DNA沈殿物をインキュベートする。
- 各ウェルにDNA沈殿物を追加し、インキュベーター内で18分間神経細胞を培養する。
- DMEM / DNA混合物を削除し、あらかじめ温めておいたDM500μlで二回ニューロンを洗うEM。
- ニューロンに戻ってステップ2.2から収集されたメディアを追加します。ニューロンは、炭素源を補充するDIV 3において、3日以上培養で25 mMグルコースで補足培地になる場合。
- 1-5日後、免疫細胞化学を受けるニューロンは、GFP抗体を用いた。
- 画像、蛍光顕微鏡を用いて盲検法での条件ごとに少なくとも30個々のニューロン。
3。 NeuronJと軸索と樹状突起を測定し、NIH ImageJのプラグイン
重要:以下の比率が拡大し、画像の解像度に応じて、次の画像が適切なピクセルを使用してcorrectluyスケールされていることを確認します。
- ImageJの8ビットに画像を変換:オープン画像は、「画像」を選択 - > 'タイプ' - > '8ビット ' - >「保存」のイメージを。
- NeuronJプラグインを実行して、8ビットの画像を開きます。
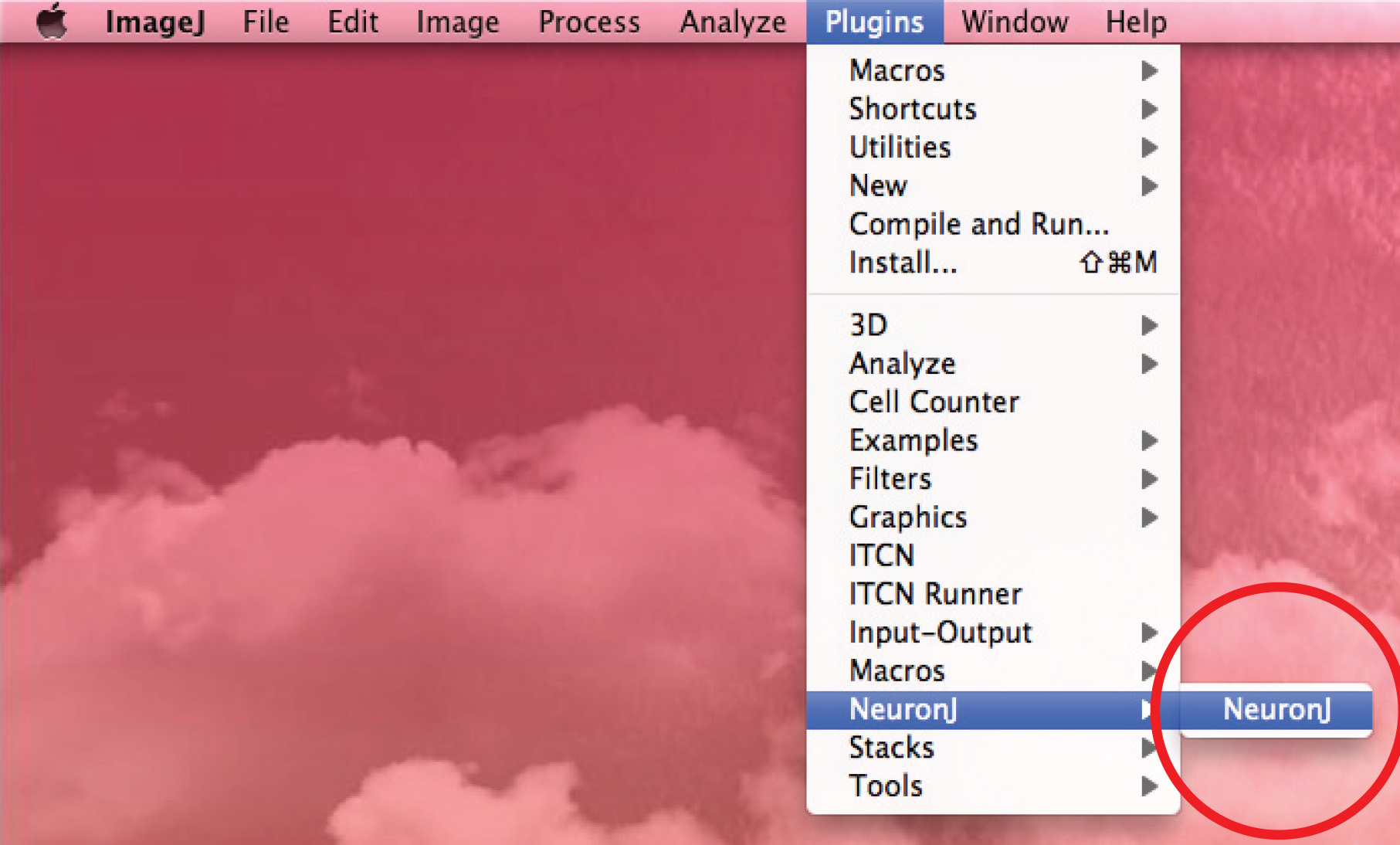
- CL:軸索を追跡するために、「追加の追跡」オプションを使用します軸索の冒頭で一度、マウスの左ボタンをICKし、プロセスに沿ってマウスを移動します。トレースが軸索形状と一致した場合、二重軸索の先端をクリックしてください。
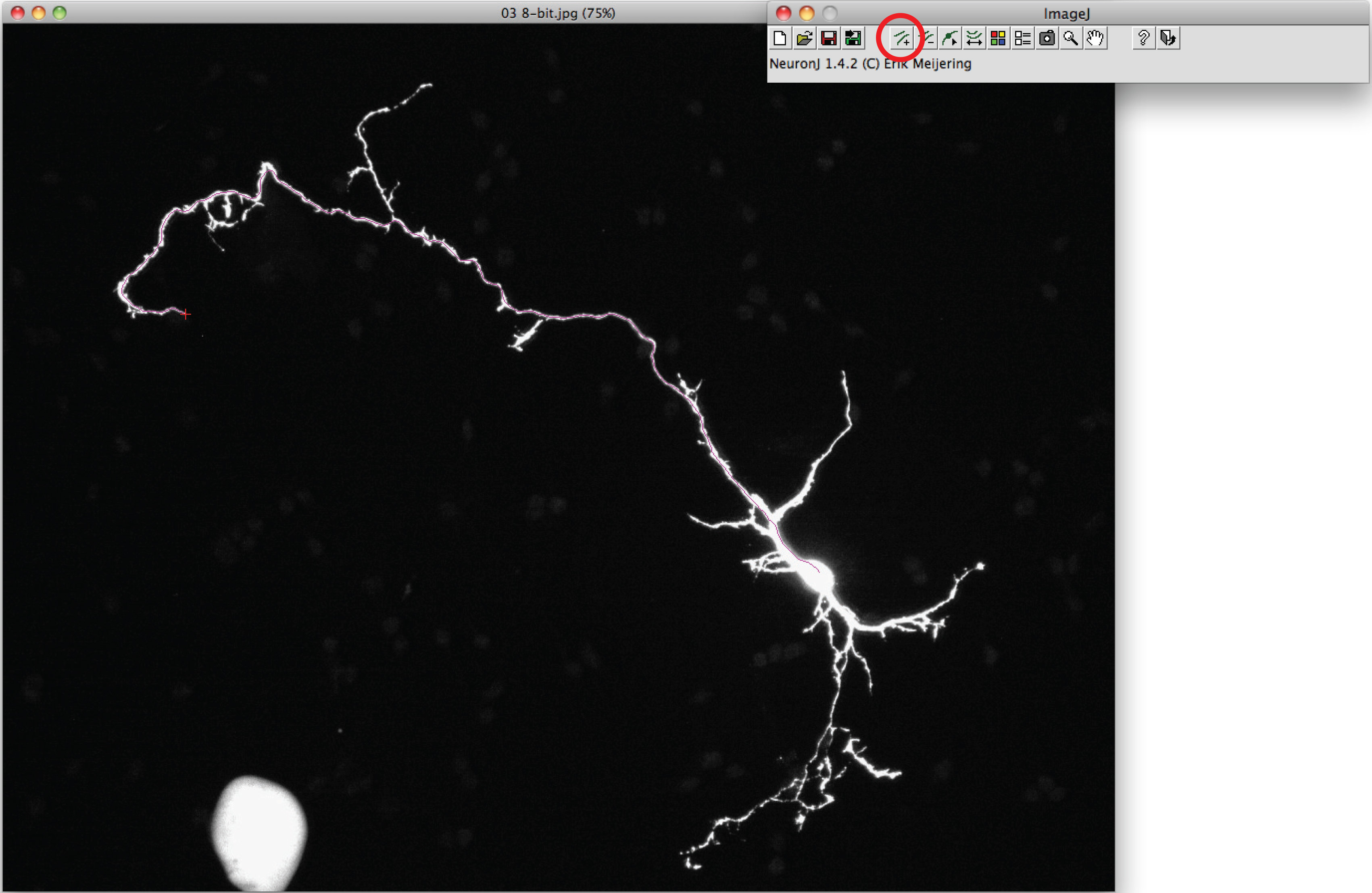
注:提案しトレースする必要が軸索の先端をダブルクリックして、軸索形状と異なる、トレースを固定する軸索のプロセスを一度クリックしてください。 - オプションキーを押し「ファイル名を指定して実行」「測定のトレースの表示」を選択し、「測定トレーシング」をクリックします。軸索の測定は、すべての新しいウィンドウに表示されます。樹状突起の場合は、「表示グループの測定オプション」を押して「ファイル名を指定して実行」を選択します。
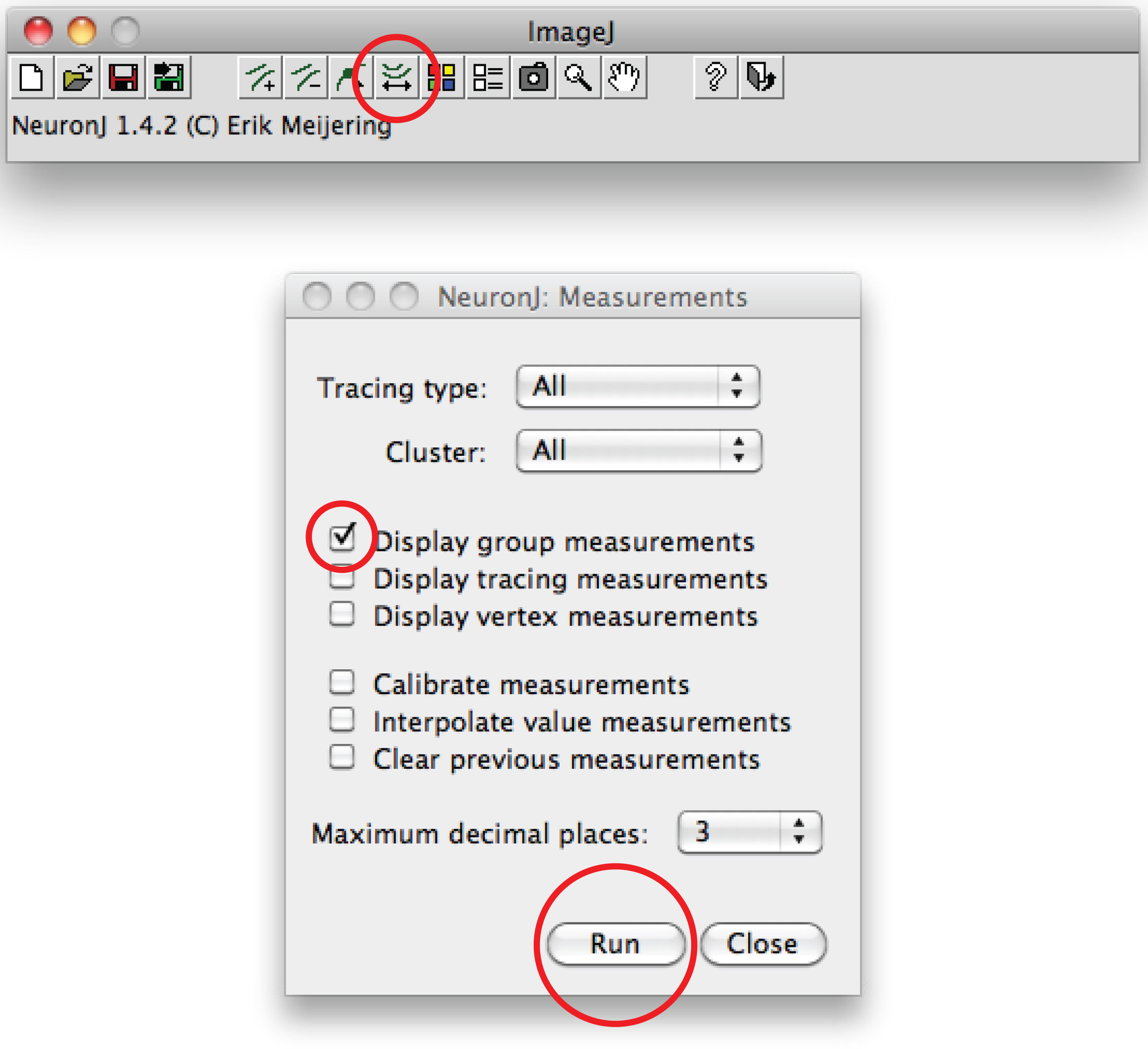
総デンドライト測定は、すべての新規ウィンドウに表示されます。任意のスプレッドシートプログラムで開くことができ、別のファイルとして保存。 - 別の方法として、マニュアルトレースに、フィジーのソフトウェアを使用:右番目をクリックしてくださいE '直線'オプション、 'フリーハンドライン」を選択し、
マウスの左ボタンを押した維持し、手動プロセスをトレース押し「Ctrlキー+ M 'は測定すること。 - 条件ごとの平均軸索/樹状突起の長さを計算し、適切な統計的検定を使用しています。
生体内エレクトロポレーションの場合 :
1。機器や試薬の調製
- あなたが30のG針、スペーサー(1-2 mm)で、注射器、デッドボリューム減速(DVR)、エレクトロ、そしてtweezertrodes、加熱パッドや赤外線加熱ランプ、グースネックランプおよびイソフルランを必要としています。
- 針へのDVRを入れ、シリンジ針を取り付け、最終的には( 図2)針の上にスペーサーを入れた。
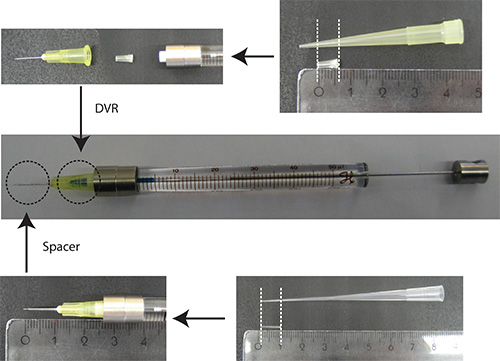
図2。針の調製。DVR 200μlのピペットチップを切断し、デッドボリュームを低減するために針内に配置されている。スペーサーは、200μlのローディング先端から導出され、約2mmの小脳への浸透の深さを調節するために、針の端部に配置されている。ルーラーの単位:センチ - PBS/0.03%ファストグリーンでDNAを溶解する。注:トランスフェクションマーカーとしては、ニューロンのみを可視化するために、ニューロン特異的プロモーター( 例えば、シナプシン)下で蛍光タンパク質を使用することが有利で ある。総プラスミド量の25%は、トランスフェクションマーカーをコードするプラスミドである必要があります。
- 70%エタノールを加えます。
- 同等のOCTボリュームおよびPBSに溶解し、30%スクロースを混合する。
- DNA(PBS/0.03%ファストグリーンでのプラスミドDNA4μgの/μL)の4μlで注射器を埋める。
2。ラット仔のIVE
IVEのフローチャート。図3を参照してください。
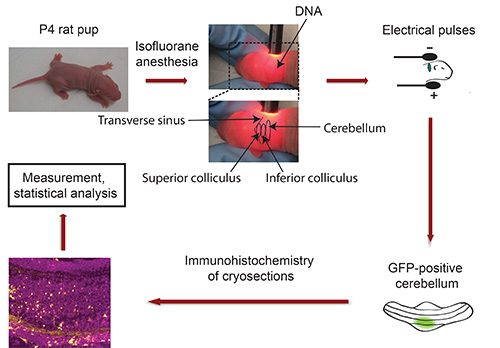
図3。 インビボでのエレクトロポレーションのフローチャート。P4仔ラット( 例えば GFP)蛍光トランスフェクションマーカーをコードするプラスミドDNAおよびイソフルランで麻酔し、5電気パルスへの暴露に続いて、小脳に注入される。 5日後、単離されたGFP陽性小脳を切断し、免疫組織化学に供される。画像は、共焦点顕微鏡を用いて捕捉し、IMARISソフトウェアを用いて分析される。データは統計プログラムで処理される。
- アルビノ株(Wistar系またはロング·エヴァンス)からP4仔ラットを使用してください。
- 子犬は、もはや移動するまで、1〜2分間(組織に浸し)イソフルラン200μlの小箱( 例えば P1000ピペットチップボックス)内のイソフルランで子犬(続)麻酔ません。子犬ワット接触し得ることはありませんように注意してくださいIiquidイソフルラン番目。個々の仔が麻酔に対して異なる反応として近い時間を監視します。
- 70%エタノールでバック子犬の頭の殺菌。
- 親指と人差し指の間で子犬の頭を固定し、アルビノ子犬の小脳を見つけるためにグースネックランプを使用しています。横洞が急激皮質半球から中脳(スーペリア、下丘)( 図3)を画定する。小脳は、脳に隣接して位置しており、暗い影に表示されます。ドットで小脳を示すために、油性マジックを使用しています。重要:固定された位置に子犬をしてください!注:麻酔は、この手順の間、オフ着用しなければならない、前にDNAを注入するイソフルランに子犬を公開します。
- 針( 図3)を挿入し、ゆっくりと小脳へのDNAの3μLを注入。
- DNA溶液を30〜60秒間拡散してみましょう。
- マイナス極が後頭部(小脳と接触するようにtweezertrodes間の子犬の頭を置くR領域)とします( 図3)ヘッドの反対側のプラス極に接触すること。
- 5電気パルスを受ける子犬。彼らの生存率( 表1)を損なうことなく、良好なエレクトロポレーションの効率を確保するために、仔の体重に電圧を調整します。
表1。 P4の仔ラットのエレクトロポレーション。重さ 電圧 パルス インターバル 8〜9グラム 160 V 50ミリ秒 950ミリ秒 9〜10グラム 165 V 50ミリ秒 950ミリ秒 > 10グラム 170 V 50ミリ秒 950ミリ秒 - 子犬が加熱パッドの上に、赤外線ランプ下に回復しましょう。ダムへ子犬を返します。重要:加熱源は、任意の火傷を負わないようにしてください。
- 断頭続いCO 2に配置することにより、5日間エレクトロポレーション後の仔を生け贄に捧げる。
- 蛍光顕微鏡を用いた小脳GFP陽性もののため小脳し、画面を隔離する。
- その後、小脳シンクまで、チューブの底に4℃で、30%スクロース中でインキュベート、4℃で4%PFA O / Nで小脳を修正します。
- OCT/30%ショ糖で小脳を埋め込み、クライオスタットを用いて、40μmの冠状切片を切る。注:盲検的にセクションごとに小脳を。
- テーマのセクションでは、GFP抗体を用いた免疫組織化学する。核色素(DAPIまたはヘキスト33258)と対比し、動物あたり少なくとも200トランスフェクションしたニューロンの局在を決定する。
- 詳細な分析のために、MLおよび白質対向する下部IGLを対向する上部IGLで、その結果、半分にIGLを細分化し、各半分に存在するGFP陽性ニューロンをカウントします。注:盲検的に各セクションのGFP陽性ニューロンをカウントします。
3。デンドライトの長さを測定し、共焦点顕微鏡を使用して、X、Y、Z平面内のセクションの画像を取り込む
注:例えば1μmのz stwpと40μmのセクション40の画像を使用しています。
- ソフトウェアで開く画像シリーズ、IMARIS、樹状突起の3次元画像を生成する。
- 3Dでニューロンを表示するには、「サーパス」モードをクリックします。
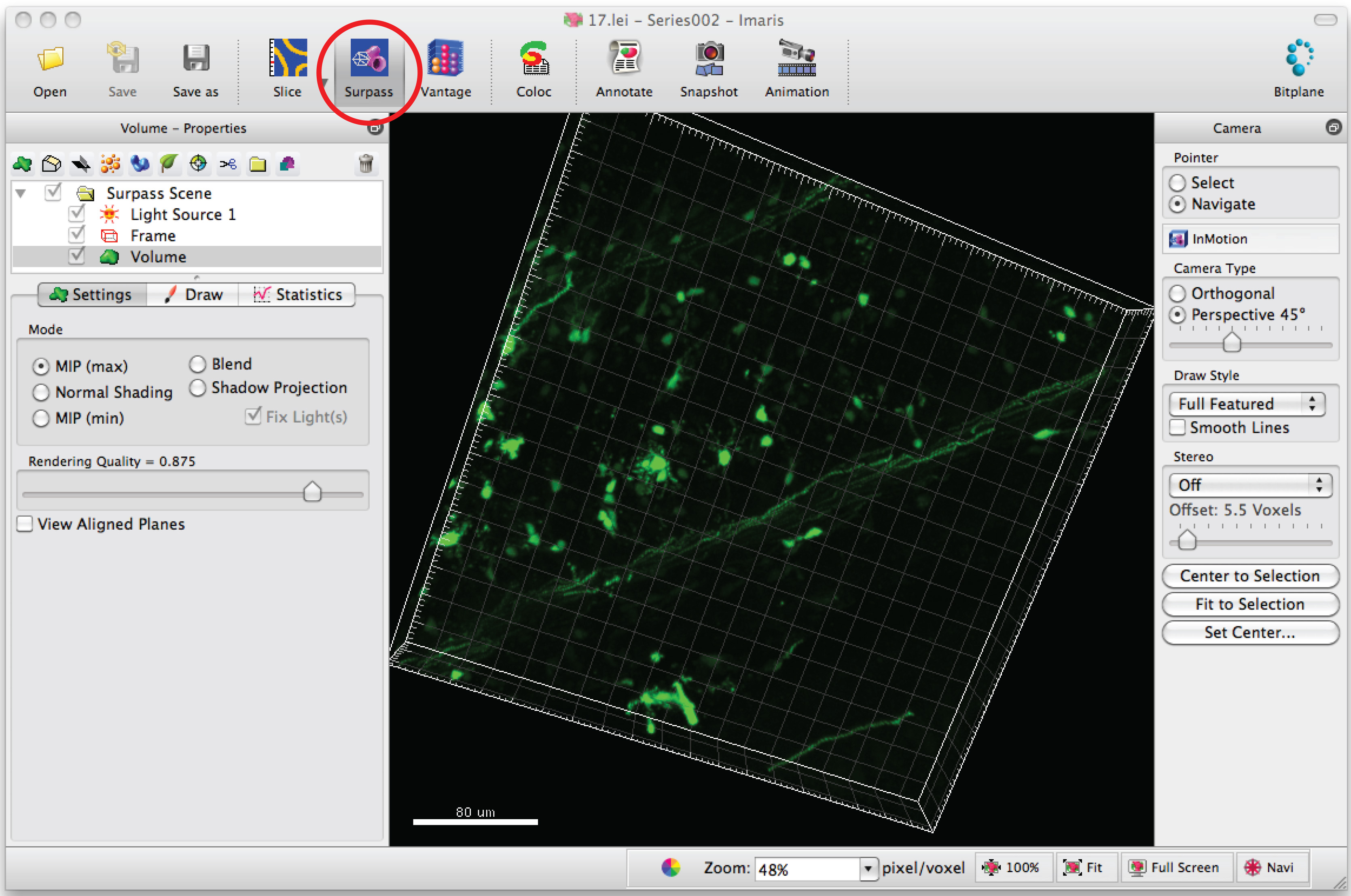
- '新しいフィラメントを追加」を選択し、半自動トレースを開始するには「自動作成をスキップする」をクリックします。

注:盲検様式で各3D画像を分析 - 「ドロー」タブと「てAutoPath」を選択します。
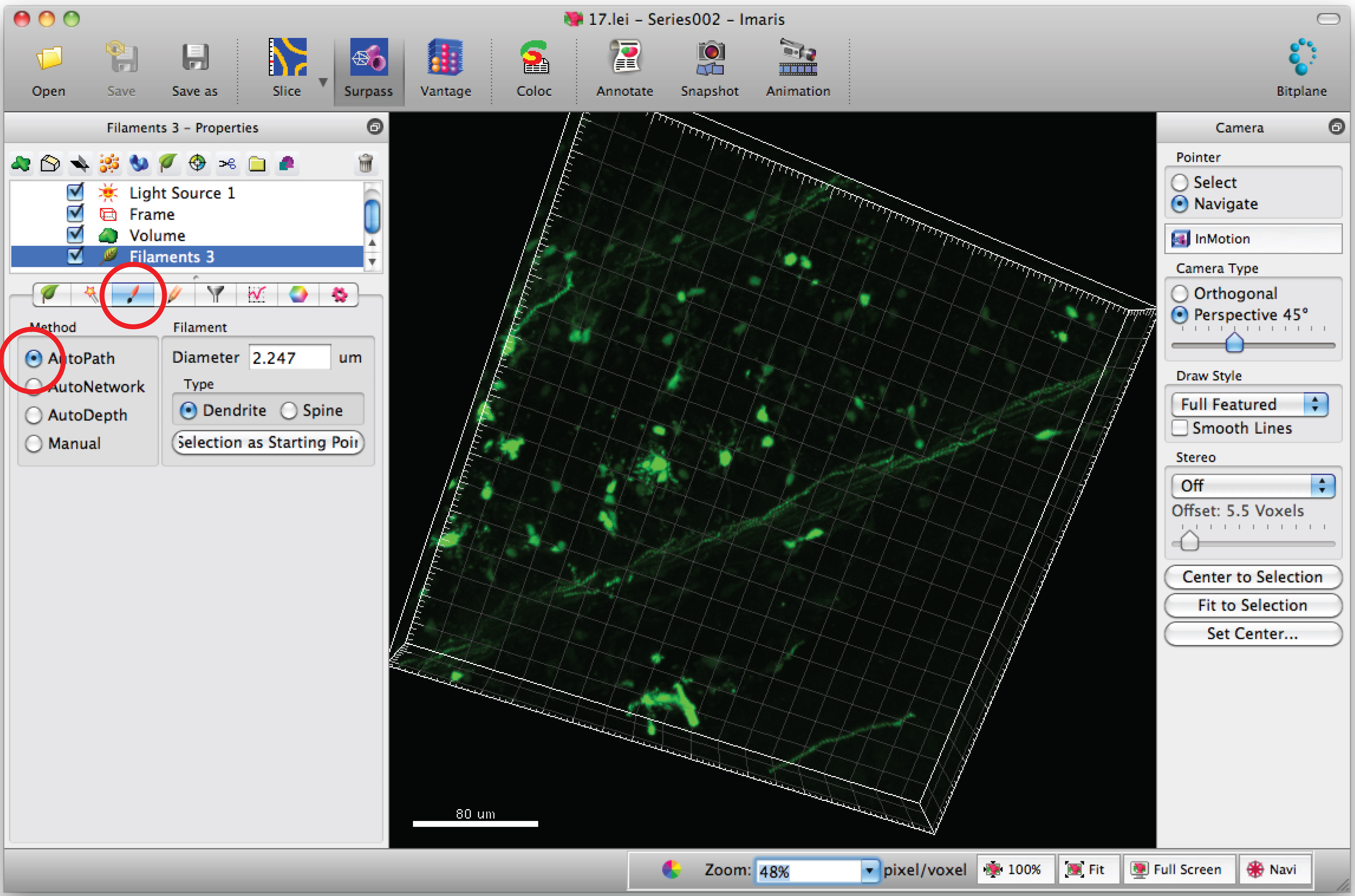
- Cの上にマウスカーソルを移動するエルの体およびShift +マウスの右のセル本体をクリックして選択します。注:ソフトウェアによる自動計算には数分が必要な場合があります。

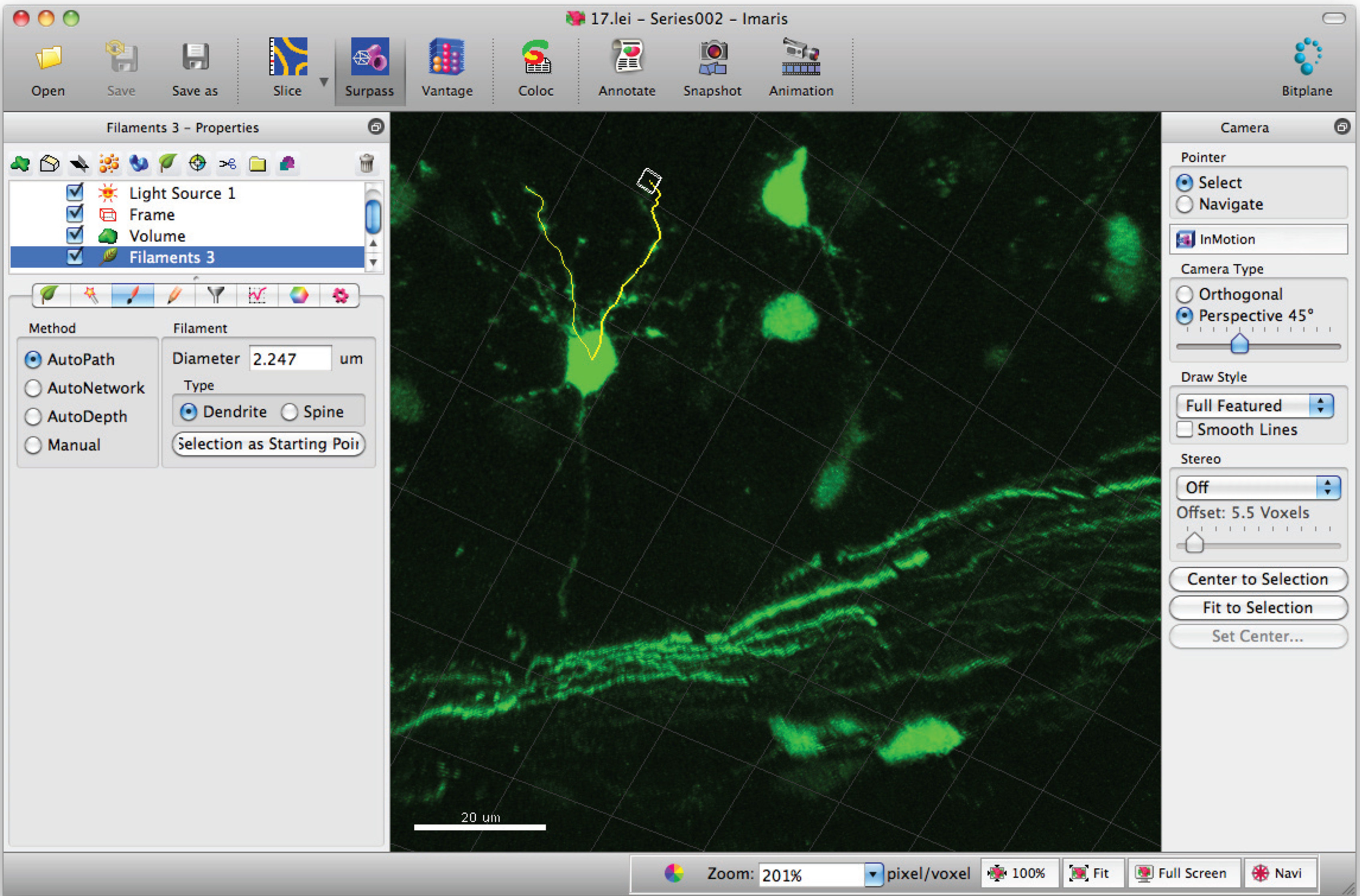
- Shiftキー+マウス左クリックを使用してフィラメント(デンドライト)にパスを追加。注:パスを、即座に可視化することができる。
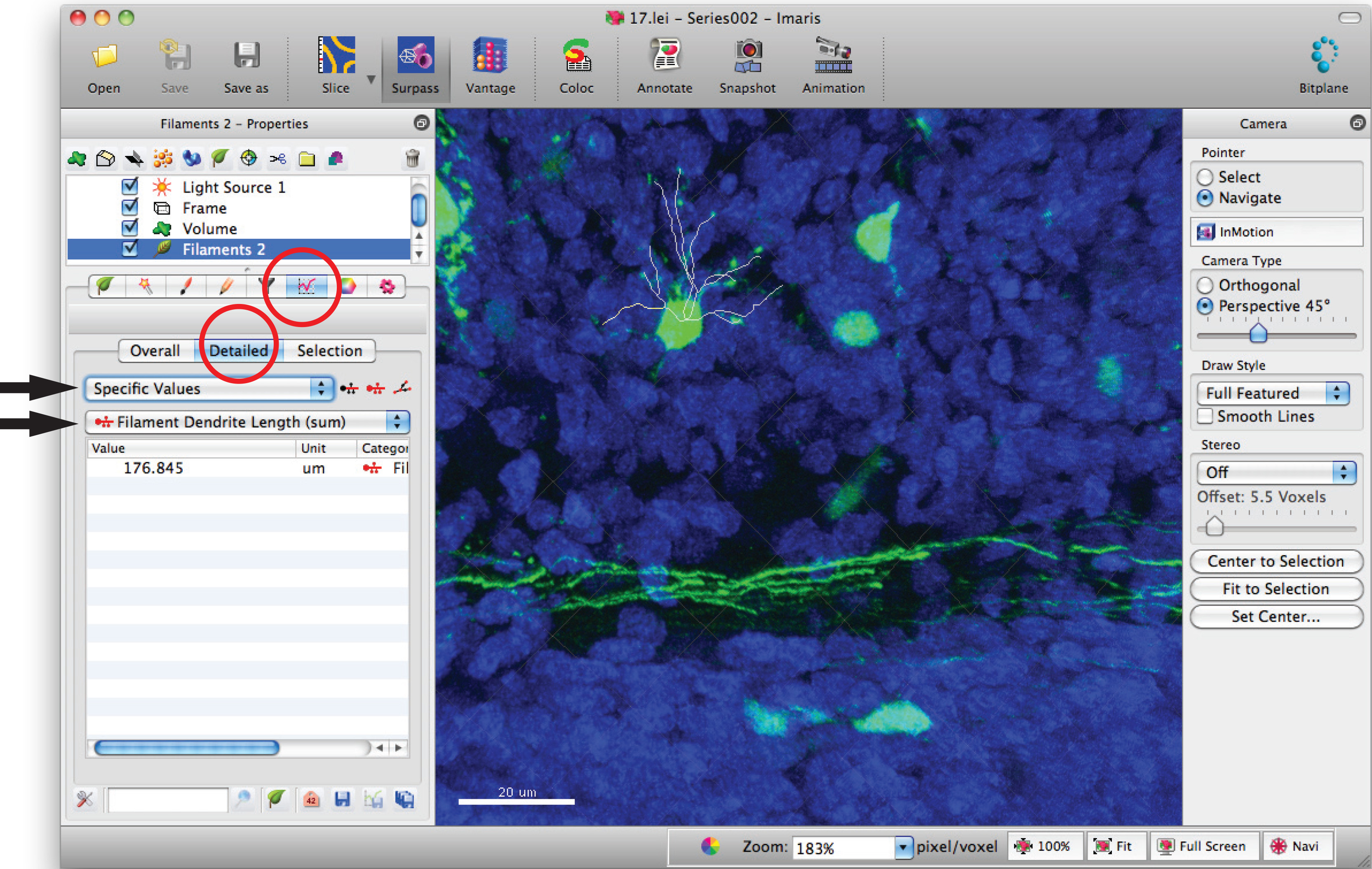
- フィラメント統計ウィンドウに移動し、「詳細」、「特定の値」と総樹状突起の長さの合計のための「フィラメントデンドライトの長さ(合計)」をクリックしてください。
- データを分析するための適切な統計的検定を使用してください。
結果
上記のように、異なる培養条件に応答したCGNの形態を分析するために、我々は、DIV 0でニューロンをトランスフェクトした。トランスフェクションの後、我々は完全培地(BME、10%ウシ血清、2mMのPSG、25のKCl)および最小培地を含有するインスリンへの別のセット(BME、25mMグルコース、2mMのPSG、10μgの/への神経細胞の一組に配置mlのインスリン)。私たちは、ディビジョン1、2のGFP抗体を用い?...
ディスカッション
利点およびインビトロおよびインビボ方法に記載の制限:
マウスやラットから培養CGNを、形態学的分析のために均等に適しています。ラットの小脳の大きいサイズのために、仔ラットからCNGSの収率は、仔マウス3〜4倍のそれを超えています。 CGNを脇から、皮質及び海馬ニューロンは、同様に培養系として使用することができる。リン酸カルシウム法?...
開示事項
著者らは、競合する経済的利益を宣言していません。
謝辞
私たちは、統計分析のヘルプについては、優れた技術支援のために-80ハンマーとS. PapiolをN. Schwedhelm-Domeyerに感謝します。私たちの仕事は、ドイツ学術振興、ナノスケール顕微鏡のためのセンター、脳の分子生理学(CNMPB)、ゲッティンゲン、ドイツ、ゲッティンゲン大学のGGNBジュニアグループ奨学金により、マックス·プランク協会によって資金を供給される。
資料
| Name | Company | Catalog Number | Comments |
| DMEM | Gibco | 11960-044 | |
| BME | Gibco | 41010-026 | |
| Insulin | Sigma-Aldrich | Si-1-4011 | |
| Poly-L-Ornithine | Sigma-Aldrich | P-2533 | |
| CaCl2 | Appli-Chem | A3652 | |
| Isoflurane | Actavis Deutschland | ||
| Tissue-Tek OCT | Sakura | ||
| ECM 830 and tweezertrodes | Harvard Apparatus | ||
| Epifluorescence microscope and camera | Nikon | ||
| SP2 confocal microscope | Leica | ||
| ImageJ | NIH | ||
| Imaris 7.4.2 | Bitplane, Inc. | ||
| GraphPad Prism | GraphPad Software, Inc. | ||
| MS Excel | Microsoft | ||
| Loading tip 1-200 µl | Costar | 4853 | |
| Pipette tip 200 µl | Sarstedt | 70.760.502 | |
| Microlance 3 needle, 30 G | BD | 302200 | |
| 50 µl gastight Syringe 1705 | Hamilton | ||
| Glass coverslips | Thermo Scientific Menzel Glaeser | CB00120RA1 |
参考文献
- Cajal, S. R. . Histology of the nervous system of man and vertebrates. , (1995).
- Altman, J., Bayer, S. A. . Development of the cerebellar system : in relation to its evolution, structure, and functions. , (1997).
- White, J. J., Reeber, S. L., Hawkes, R., Sillitoe, R. V. Wholemount immunohistochemistry for revealing complex brain topography. J. Vis. Exp. , (2012).
- Palay, S. L., Chan-Palay, V. . Cerebellar cortex: cytology and organization. , (1974).
- Hatten, M. E., Alder, J., Zimmerman, K., Heintz, N. Genes involved in cerebellar cell specification and differentiation. Curr. Opin. Neurobiol. 7, 40-47 (1997).
- Hatten, M. E., Heintz, N. Mechanisms of neural patterning and specification in the developing cerebellum. Annu. Rev. Neurosci. 18, 385-408 (1995).
- Sillitoe, R. V., Joyner, A. L. Morphology molecular codes, and circuitry produce the three-dimensional complexity of the cerebellum. Ann. Rev. Dev. Biol. 23, 549-577 (2007).
- Zervas, M., Millet, S., Ahn, S., Joyner, A. L. Cell behaviors and genetic lineages of the mesencephalon and rhombomere 1. Neuron. 43, 345-357 (2004).
- Wingate, R. J. The rhombic lip and early cerebellar development. Curr. Opin. Neurobiol. 11, 82-88 (2001).
- Kawaji, K., Umeshima, H., Eiraku, M., Hirano, T., Kengaku, M. Dual phases of migration of cerebellar granule cells guided by axonal and dendritic leading processes. Mol. Cell Neurosci. 25, 228-240 (2004).
- Hatten, M. E., Gao, W. -. Q., Morrison, M. E., Mason, C. A. Cellular and molecular neuroscience. , 419-41 .
- Lee, H. Y., Greene, L. A., Mason, C. A., Manzini, M. C. Isolation and culture of post-natal mouse cerebellar granule neuron progenitor cells and neurons. J. Vis. Exp. , (2009).
- Bilimoria, P. M., Bonni, A. Cultures of cerebellar granule neurons. CSH Protoc. 2008, (2008).
- Rivas, R. J., Hatten, M. E. Motility and cytoskeletal organization of migrating cerebellar granule neurons. J. Neurosci. 15, 981-989 (1995).
- Kuhar, S. G., et al. Changing patterns of gene expression define four stages of cerebellar granule neuron differentiation. Development. 117, 97-104 (1993).
- Baird, D. H., Hatten, M. E., Mason, C. A. Cerebellar target neurons provide a stop signal for afferent neurite extension in vitro. J. Neurosci. 12, 619-634 (1992).
- Segal, R. A., Pomeroy, S. L., Stiles, C. D. Axonal growth and fasciculation linked to differential expression of BDNF and NT3 receptors in developing cerebellar granule cells. J. Neurosci. 15, 4970-4981 (1995).
- Gallo, V., Ciotti, M. T., Coletti, A., Aloisi, F., Levi, G. Selective release of glutamate from cerebellar granule cells differentiating in culture. Proc. Natl. Acad. Sci. U.S.A. 79, 7919-7923 (1982).
- Smith, T. C., Wang, L. Y., Howe, J. R. Distinct kainate receptor phenotypes in immature and mature mouse cerebellar granule cells. Physiol. 517 (1), 51-58 (1999).
- Konishi, Y., Stegmuller, J., Matsuda, T., Bonni, S., Bonni, A. Cdh1-APC controls axonal growth and patterning in the mammalian brain). Science. 303, 1026-1030 (2004).
- Stegmuller, J., Huynh, M. A., Yuan, Z., Konishi, Y., Bonni, A. TGFbeta-Smad2 signaling regulates the Cdh1-APC/SnoN pathway of axonal morphogenesis. J. Neurosci. 28, 1961-1969 (2008).
- Stegmuller, J., et al. Cell-intrinsic regulation of axonal morphogenesis by the Cdh1-APC target SnoN. Neuron. 50, 389-400 (2006).
- Kannan, M., Lee, S. J., Schwedhelm-Domeyer, N., Nakazawa, T., Stegmuller, J. p250GAP is a novel player in the Cdh1-APC/Smurf1 pathway of axon growth regulation. PLoS One. 7, (2012).
- Kannan, M., Lee, S. J., Schwedhelm-Domeyer, N., Stegmuller, J. The E3 ligase Cdh1-anaphase promoting complex operates upstream of the E3 ligase Smurf1 in the control of axon growth. Development. 139, 3600-3612 (2012).
- Gaudilliere, B., Konishi, Y., de la Iglesia, N., Yao, G., Bonni, A. A. CaMKII-NeuroD Signaling Pathway Specifies Dendritic Morphogenesis. Neuron. 41, 229-241 (2004).
- Yang, Y., et al. A Cdc20-APC ubiquitin signaling pathway regulates presynaptic differentiation. Science. 326, 575-578 (2009).
- Litterman, N., et al. An OBSL1-Cul7Fbxw8 ubiquitin ligase signaling mechanism regulates Golgi morphology and dendrite patterning. PLoS Biol. 9, (2011).
- Kim, A. H., et al. A centrosomal Cdc20-APC pathway controls dendrite morphogenesis in postmitotic neurons. Cell. 136, 322-336 (2009).
- Shalizi, A., et al. A calcium-regulated MEF2 sumoylation switch controls postsynaptic differentiation. Science. 311, 1012-1017 (2006).
- Vadhvani, M., Schwedhelm-Domeyer, N., Mukherjee, C., Stegmuller, J. The Centrosomal E3 Ubiquitin Ligase FBXO31-SCF Regulates Neuronal Morphogenesis and Migration. PLoS One. 8, (2013).
- Puram, S. V., et al. A CaMKIIbeta signaling pathway at the centrosome regulates dendrite patterning in the brain. Nat. Neurosci. , (2011).
- Jia, Y., Zhou, J., Tai, Y., Wang, Y. TRPC channels promote cerebellar granule neuron survival. Nat. Neurosci. 10, 559-567 (2007).
- Huynh, M. A., et al. An isoform-specific SnoN1-FOXO1 repressor complex controls neuronal morphogenesis and positioning in the mammalian brain. Neuron. 69, 930-944 (2011).
- de la Torre-Ubieta, L., Bonni, A. Transcriptional regulation of neuronal polarity and morphogenesis in the mammalian brain. Neuron. 72, 22-40 (2011).
- Calissano, P., et al. Recombinant human insulin-like growth factor I exerts a trophic action and confers glutamate sensitivity on glutamate-resistant cerebellar granule cells. Proc. Natl. Acad. Sci. U.S.A. 90, 8752-8756 (1993).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved