Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Manipulation génétique des neurones du cervelet granules
Dans cet article
Résumé
Morphogenèse neuronale et la migration sont des événements cruciaux qui sous-tendent le développement normal du cerveau. Ici, nous décrivons des méthodes pour manipuler génétiquement les neurones granulaires du cervelet en culture et le cervelet en développement pour l'évaluation de la morphologie et les caractéristiques de migration des neurones.
Résumé
Événements de développement du cerveau, y compris la morphogenèse neuronale et la migration sont des processus très orchestrés. In vitro et in vivo analyses permettre une caractérisation approfondie pour identifier les voies de signalisation impliquées dans ces événements. Neurones granulaires du cervelet (CGN) qui sont dérivées à partir de cervelet de développement sont un système de modèle idéal qui permet des analyses morphologiques. Ici, nous décrivons une méthode de comment manipuler génétiquement CGN et comment étudier axono et dendritogénèse des neurones individuels. Avec cette méthode, les effets de l'interférence de l'ARN, la surexpression ou de petites molécules peuvent être comparées pour contrôler les neurones. En outre, le cortex cérébelleux de rongeur est un endroit facilement accessible dans le système in vivo en raison de son développement postnatal prédominant. Nous présentons également une technique in vivo dans d'électroporation à manipuler génétiquement le cervelet en développement et décrire cérébelleuse analyses ultérieures pour évaluer la morphologie neuronale unee migration.
Introduction
Le cervelet est un excellent système pour étudier les mécanismes de la croissance axonale et la migration. Le cervelet a été l'objet d'études anatomiques depuis l'aube des neurosciences 1. Microscopie moderne et des techniques d'immunohistochimie ont considérablement élargi et affiné les premières découvertes de Santiago, Ramon, et Cajal 2-4. la génétique des souris et des études moléculaires ont découvert des facteurs de croissance et de transcription essentiels dans le contrôle du développement du cervelet, qui a conduit à une meilleure compréhension des événements cruciaux nécessaires au bon câblage des différents types de neurones dont les neurones granulaires du cervelet (SCT) 5-7.
Le cervelet est un dérivé d'une rhombomère du cerveau postérieur développement 8. La lèvre rhombique, qui fait partie de la toiture de la 4 e ventricule, donne naissance à des progéniteurs cérébelleux granule de neurones, qui constitueront les plus nombreux dans la population neuronalecervelet adulte 9. Après la migration rostrale, ils s'installent dans l'ébauche du cervelet. Ici, la mitose de précurseurs granule de neurones conduit à l'expansion spectaculaire de la couche granulaire externe (EGL), qui a lieu après la naissance chez les rongeurs. De l'EGL, les neurones commencent à migrer vers l'intérieur à travers la couche moléculaire (ML), au-delà de la couche des cellules de Purkinje de prendre finalement la résidence dans la couche granulaire interne (IGL 2). Au cours de ce processus migratoire, ils acquièrent une forme bipolaire avec deux axones s'étendant dans le ML. Après poursuite de la migration, le corps de la cellule migre à l'écart des axones et les deux processus fusionnent pour former une forme de fourche, axone en forme de T 10. Par la suite, ces axones fasciculées et sont appelées fibres comme parallèles. S'étant établi à l'IGL, CGN poussent dendrites, qui forment des griffes dendritiques à établir des synapses des fibres moussues. Pour examiner les processus fondamentaux dans le cervelet en développement, un combiné in vitro et in vivo approach permet des résultats fiables et conclusions.
CGN ne sont pas seulement les plus nombreux neurones du cervelet, mais de l'ensemble du cerveau et peuvent être cultivées à haute pureté 11-13. Dans la culture, cette population neuronale très homogène devient rapidement postmitotique et acquiert une morphologie polaire avec axones et des dendrites facilement identifiables. CGN culture se sont avérées extrêmement utiles pour étudier les différents aspects du développement neuronal, y compris ancêtre prolifération, la différenciation, axonale et le développement des dendrites, migration neuronale, l'apoptose et les propriétés électrophysiologiques (14-19 et bien d'autres). L'utilisation de la manipulation génétique a élargi la polyvalence de CGN culture et a permis en outre une approche mécanistique sur les événements mentionnés ci-dessus. La transfection de neurones en culture à l'aide de faible efficacité du phosphate de calcium ou lipophiles méthodes suivies par immunocytochimie avec des marqueurs de polarité ou par logiciel supporté analyse facilitertats de l'évaluation, par exemple de la morphologie des neurones individuels dans une culture neuronale dense. Avec cette approche, le rôle des protéines d'intérêt dans l'axone ou dendrites croissance peut être étudiée 20-25,26-28. Ce système de culture est toutefois moins utile d'analyser la migration neuronale que la migration est très limité dans les cultures à haute densité et exigerait co-cultures. L'analyse in vitro de l'axone et la croissance de dendrites permet également à l'examen des protéines interconnectés d'une voie de signalisation en utilisant les combinaisons de l'interférence ARN (i), la sur-expression ou de petites molécules.
Pour établir l'utilité de la protéine d'intérêt dans l'axone et la régulation de la croissance de la dendrite ou de la migration neuronale, l'électroporation in vivo (IVE) de technique permet l'analyse dans le cortex cérébelleux développement. En raison du fait que le développement cérébelleux chez des rongeurs s'étend chemin dans les deux premières semaines après la naissance, le cervelet représente un AccessiBla structure du cerveau pour le manipulations génétiques pour examiner le développement des axones et des dendrites, la migration neuronale, synaptogenèse et l'apoptose 20-24,29,30,26,27,31-34. En outre, ce système modèle est également utile pour d'autres aspects du développement neuronal qui nécessitent le cortex cérébelleux intact comme des axones, le câblage et la connectivité des neurones et des interactions neurone-glie Pris ensemble, ce protocole prévoit in vitro et des techniques in vivo pour lutter contre une approche complémentaire concernant la morphogenèse neuronale et la migration.
Protocole
CGN peuvent être préparés soit à partir du jour post-natal (P) 5 souriceaux ou P6 de rat pups. Nous suivons un protocole, décrit par Bilimoria et ses collègues, qui utilise un inhibiteur mitotique pour sélectionner les CGN postmitotiques 13.
Déclaration d'éthique:
Toutes les expériences impliquant des animaux vivants ont été menées selon le protocole des animaux approuvée par le "Verbraucherschutz und Lebensmittelsicherheit" de Basse-Saxe, Allemagne.
Test in vitro:
Une. Préparation de l'ADN plasmidique, des médias, et des tampons pour le phosphate de calcium Méthode de transfection
- Dissoudre l'ADN plasmidique dans de l'eau stérile, exempt d'endotoxine; DMEM (taux élevé de glucose); faire 2,5 M CaCl 2; faire 2x HBSS (dissout 4 g de NaCl, 0,1775 g de KCl, 0,095 g Na 2 HPO 4 • 7H 2 O, 0,675 g glucose et 2,5 g HEPES dans 250 ml d'eau ultra-pure et ajuster le pH à 7,05, 7,08 et 7,11). Remarque: Lors de la préparationla solution HBSS 2x, test qui pH donne les meilleurs résultats en ce qui concerne l'efficacité de transfection de combinaison donnée de plasmides.
2. La transfection de neurones de culture
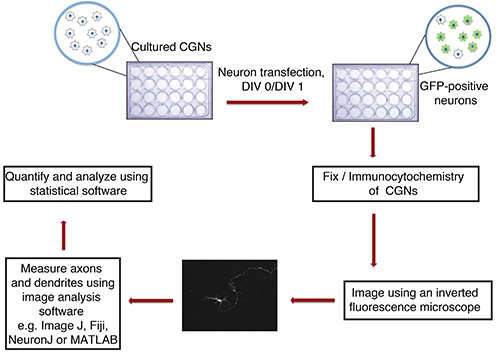
Figure 1. Organigramme de l'axone in vitro et analyse de la croissance des dendrites. Cultivé CGN (de plaque de 24 puits avec des lamelles de verre), isolé à partir de ratons P6, sont transfectées à DIV 0 ou 1 avec précipité d'ADN contenant un marqueur de transfection fluorescent (par exemple GFP). Après fixation et immunocytochimie, les neurones sont imagés de façon aveugle. Les images sont importées dans ImageJ et processus sont évalués. Les mesures sont ensuite traitées à l'aide d'un programme statistique.
- CGN de semences (20 x 10 6 par plaque de 24 puits; BME, le sérum de veau à 10%, 2 mM de pénicilline-Streptomycin-glutamine (PSG), 25 mM de KCl) sur 12 mm, lamelles nitrique lavés à l'acide polyornithine revêtu verre dans une plaque de 24 puits avec 500 pi de milieu par puits.
- Le jour in vitro (DIV) 0 (au moins 8 heures après placage) ou DIV 1, recueillir des milieux de croissance et maintenir à 37 ° C. Laver les neurones deux fois avec 500 ul de DMEM préchauffé et ajouter 500 ul de DMEM.
- Placer les neurones dans l'incubateur (37 ° C, 5% CO 2) pendant 45 min.
- Préparer 40 ul ADN précipité pour chaque puits en mélangeant: ADN (2-2,5 pg / puits, 10% de l'ADN total devrait être un marqueur transfection par exemple GFP pour visualiser les neurones transfectées), l'eau (jusqu'à 18 pi), ajouter 2 pi de 2,5 M CaCl 2, bien mélanger et ajouter 20 ul de HBSS 2x.
- Incuber l'ADN précipité pendant 5 min à température ambiante.
- Ajouter précipité d'ADN dans chaque puits et incuber neurones pendant 18 minutes dans l'incubateur.
- Retirer DMEM / ADN mélange et laver les neurones à deux reprises avec 500 pi de DM préchaufféEM.
- Ajouter un média recueillies à l'étape 2.2 de retour pour les neurones. Si les neurones seront en culture pendant plus de 3 jours, les médias de supplément avec 25 mM de glucose à 3 DIV pour reconstituer source de carbone.
- Après 1-5 jours, les neurones soumis à immunocytochimie en utilisant des anticorps de la GFP.
- Image au moins 30 neurones individuels par l'état d'une manière aveugle utilisant un microscope à fluorescence.
3. Mesurer axones et des dendrites avec NeuronJ, un ImageJ Plugin NIH
Important: Assurez-vous que les images sont redimensionnées correctluy en utilisant pixel approprié: rapport um selon grossissement et la résolution de l'image.
- Convertir des images en 8 bits avec ImageJ: Ouvrir l'image, choisissez "Image" -> "Type" -> '8-bit '->' image Sauvegarder ».
- Exécutez NeuronJ plugin et ouvrir l'image 8 bits.
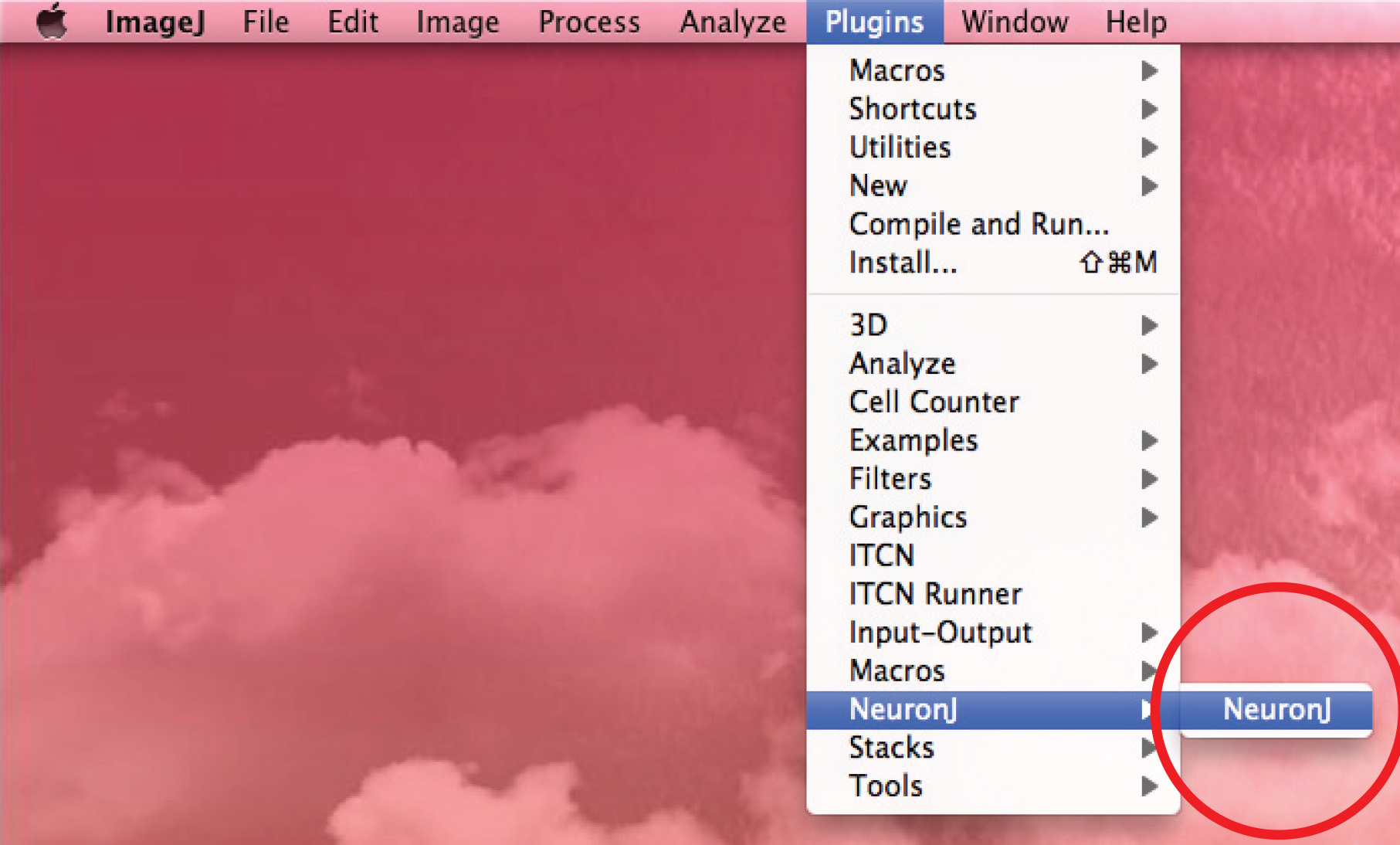
- Utilisez l'option «Ajouter des tracés de suivre l'axone: click le bouton gauche de la souris une fois au début de l'axone et déplacer la souris le long du processus. Double-cliquez sur la pointe de l'axone si trace correspond forme axonale.
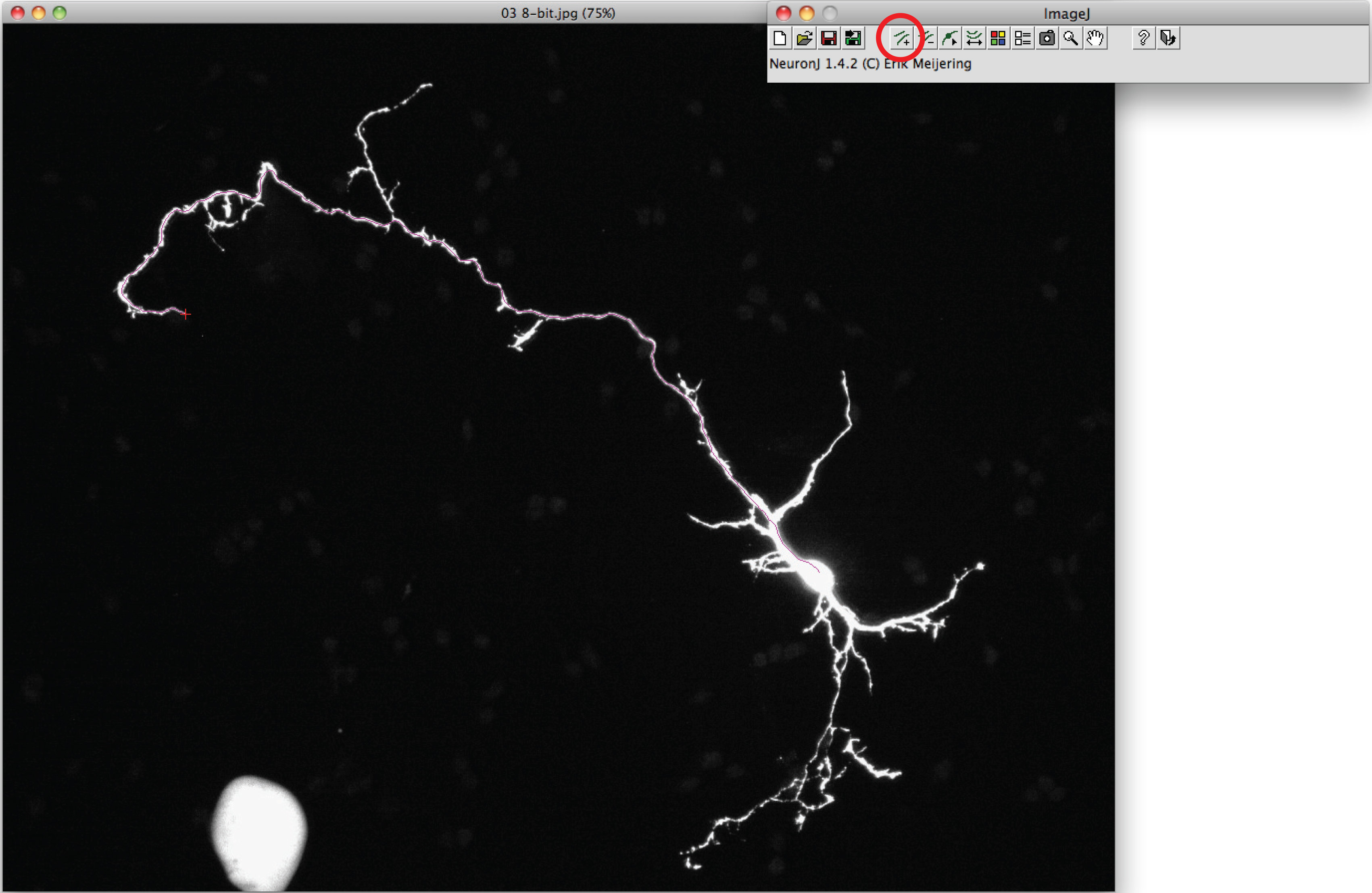
Remarque: Si la trace suggéré différer de forme axonale, cliquez une fois sur le processus axonal pour ancrer trace, puis double-cliquez sur l'extrémité de l'axone. - Cliquez sur «tracés de mesure», choisissez l'option 'Affichage traçage mesures de choix et appuyez sur "Exécuter". Mesures Axon sont tous affichés dans une nouvelle fenêtre. Pour dendrites, choisissez l'option 'des mesures de groupe d'affichage "et appuyez sur" Exécuter ".
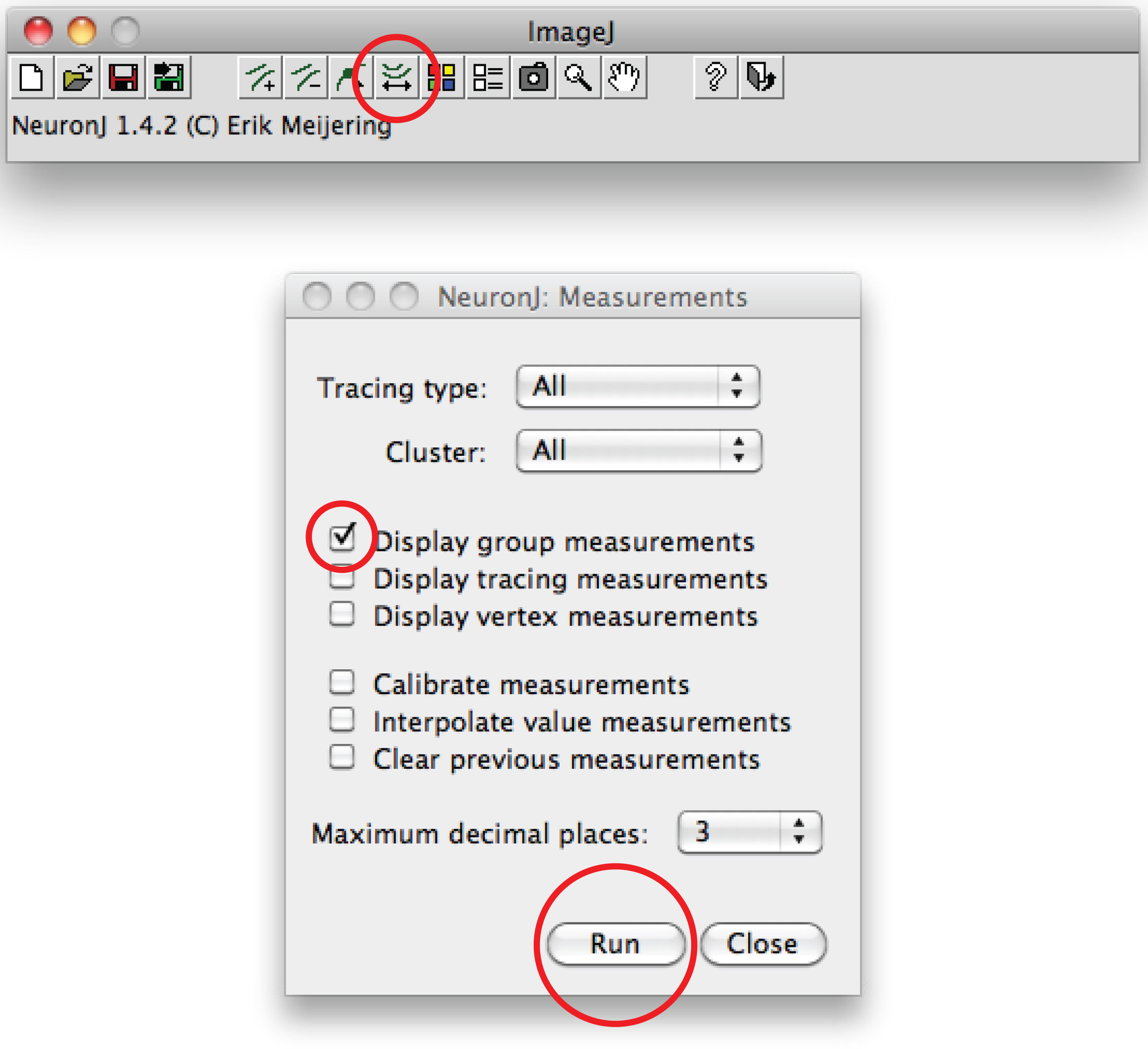
Nombre de mesures dendritiques sont tous affichés dans une nouvelle fenêtre. Conservez-les dans un fichier distinct qui peut être ouvert dans n'importe quel tableur. - Sinon, pour le traçage manuel, utiliser un logiciel Fidji: un clic droit sur ee option 'ligne droite', choisissez 'ligne à main levée »,
maintenez le bouton gauche de la souris enfoncé et tracer manuellement le processus, appuyez sur Ctrl + M 'à mesurer. - Calculer la longueur moyenne dendritique / axonal par état et utiliser le test statistique approprié.
Dans l'électroporation in vivo:
Une. Équipement et Préparation des réactifs
- Vous devez G 30 aiguilles, écartement (1-2 mm), une seringue, mort réducteur de volume (DVR), électroporateur et tweezertrodes, coussin chauffant ou lampe infrarouge, lampe à col de cygne et l'isoflurane.
- Mettez DVR en aiguille, puis fixer l'aiguille à la seringue, et enfin mettre entretoise sur l'aiguille (figure 2).
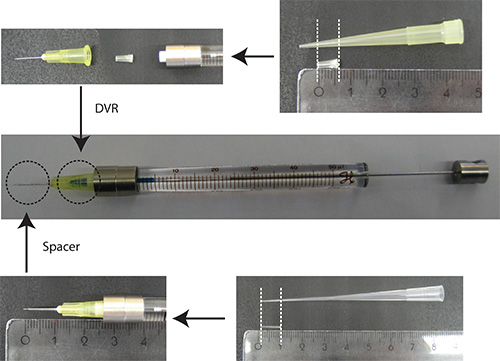
Figure2. Préparation de l'aiguille. DVR est coupée une pointe de pipette 200 ul et placé dans l'aiguille à réduire le volume mort. Entretoise est dérivé d'un embout 200 ul de chargement et est placé sur l'extrémité de l'aiguille pour régler la profondeur de pénétration dans le cervelet à environ 2 mm. unités de la règle: cm - Dissoudre l'ADN dans PBS/0.03% vert rapide. Remarque: En tant que marqueur de transfection, il est avantageux d'utiliser une protéine fluorescente qui est sous un promoteur spécifique des neurones (par exemple Synapsin) pour visualiser les neurones seulement. 25% de la quantité totale de plasmide doit être le plasmide codant pour le marqueur de transfection.
- Assurez-éthanol à 70%.
- Mélanger des volumes égaux d'octobre et 30% de saccharose dissous dans du PBS.
- Remplir la seringue avec 4 ul de l'ADN (4 ug / ul d'ADN plasmidique dans PBS/0.03% Fast Green).
2. IVE du Rat chiots
Organigramme du système IVE: voir la figure 3
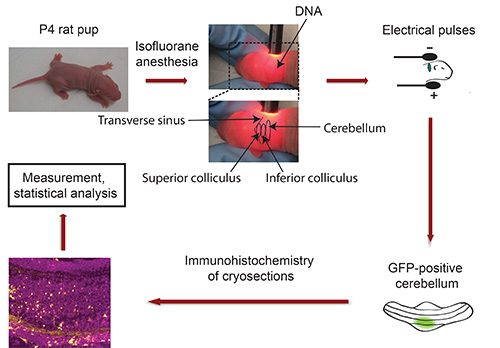
Figure 3. Organigramme des chiots P4 de rat in vivo. Électroporation sont anesthésiés avec de l'isoflurane et de l'ADN plasmidique codant pour un marqueur fluorescent de transfection (par exemple, GFP) est injecté dans le cervelet, suivie d'une exposition à 5 impulsions électriques. Cinq jours plus tard, isolé cervelet GFP-positives sont sectionné et soumis à l'immunohistochimie. Les images sont capturées à l'aide d'un microscope confocal et analysées avec le logiciel Imaris. Les données sont traitées avec un programme statistique.
- Utilisez les ratons P4 de la souche albinos (Wistar ou Long Evans).
- Anesthésier petits (un après l'autre) avec de l'isoflurane dans une petite boîte (par exemple P1000 boîte de pointe de la pipette) avec 200 pi de l'isoflurane (trempés dans le tissu) pour 1-2 min jusqu'à ce chiot n'est plus en mouvement. Veillez à ce que les petits ne reçoivent pas en contact avecvec Iiquide isoflurane. Surveiller le temps près chiots individuels réagissent différemment à l'anesthésie.
- Stériliser arrière de la tête de chien avec 70% d'éthanol.
- Fixer la tête de chiot entre le pouce et l'index et utiliser la lampe à col de cygne pour localiser cervelet de chiot albinos. Le sinus transverse délimite nettement le mésencéphale (colliculus supérieur et inférieur) des hémisphères corticaux (Figure 3). Le cervelet est situé à côté du mésencéphale et apparaît dans une teinte plus foncée. Utilisez un marqueur permanent pour indiquer le cervelet avec un point. Important: Gardez chiot en position fixe! Remarque: Si l'anesthésie s'estomper au cours de cette procédure, exposer chiot à l'isoflurane avant l'injection de l'ADN.
- Insérer l'aiguille (figure 3) et injecter lentement 3 pl de l'ADN dans le cervelet.
- Laissez la solution d'ADN pour diffuser 30-60 sec.
- Placez la tête de chiot entre tweezertrodes de sorte que le pôle négatif est en contact avec l'arrière de la tête (cerveletrégion r) et que les contacts du pôle de plus le côté opposé de la tête (figure 3).
- Chiot soumis à 5 impulsions électriques. Ajuster la tension de masse de petits pour assurer une bonne efficacité de l'électroporation, sans compromettre leur survie (tableau 1).
Tableau 1. Électroporation de ratons P4.Poids Tension Pouls Intervalle 8-9 g 160 V 50 ms 950 ms 9-10 g 165 V 50 ms 950 ms > 10 g 170 V 50 msec 950 ms - Laissez les petits récupérer sur coussin chauffant ou sous une lampe infrarouge. Retour chiots de barrage. Important: Assurez-vous que la source de chauffage n'inflige pas de brûlures.
- Sacrifiez chiots 5 jours après l'électroporation en les plaçant dans le CO 2 suivie par décapitation.
- Isoler le cervelet et d'un écran pour les GFP-positives cervelet en utilisant un microscope à fluorescence.
- Fixer cervelet dans 4% PFA O / N à 4 ° C, puis incuber à 30% de saccharose à 4 ° C jusqu'à ce que cerebella évier à fond du tube.
- Incluez cervelet dans OCT/30% de saccharose et de réduire de 40 um coupes coronales en utilisant un cryostat. Note: L'article chaque cervelet à l'aveugle.
- Sections de immunohistochimie en utilisant l'anticorps de la GFP. Contre-colorer avec un colorant nucléaire (DAPI ou Hoechst 33258) et déterminer la localisation d'au moins 200 neurones transfectées par animal.
- Pour une analyse en profondeur, subdiviser l'IGL en deux moitiés, résultant en une IGL supérieure face à la ML et une IGL inférieure tournée vers la matière blanche et de compter les neurones GFP-positives résidant dans chaque moitié. Note: Comptez neurones GFP-positives de chaque section en aveugle.
3. Mesure Dendrite Longueur, Acquérir les images de la section en x, y, z avion en utilisant un microscope confocal
Remarque: par exemple, utiliser 40 images pour une section de 40 pm avec un z-stwp de 1 um.
- Ouvrir série d'images dans le logiciel, Imaris, pour générer une image 3D des dendrites.
- Cliquez sur le mode «surpasser» pour voir le neurone en 3D.
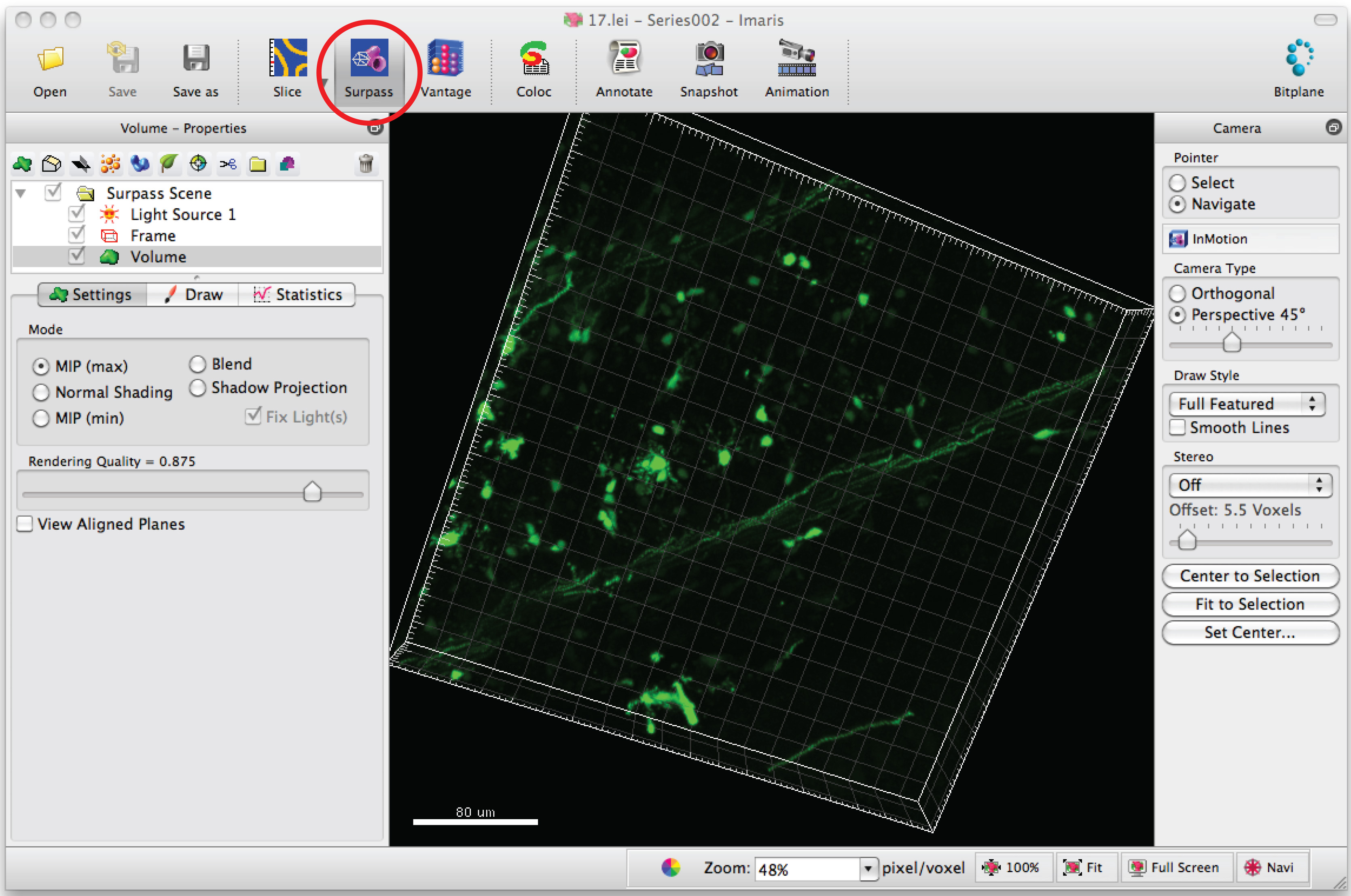
- Sélectionnez «Ajouter un filament" et cliquez sur "Passer la création automatique» pour commencer le traçage semi-automatique.

Remarque: Analyser chaque image 3D d'une manière aveugle - Sélectionnez l'onglet «Dessiner» et «AutoPath.
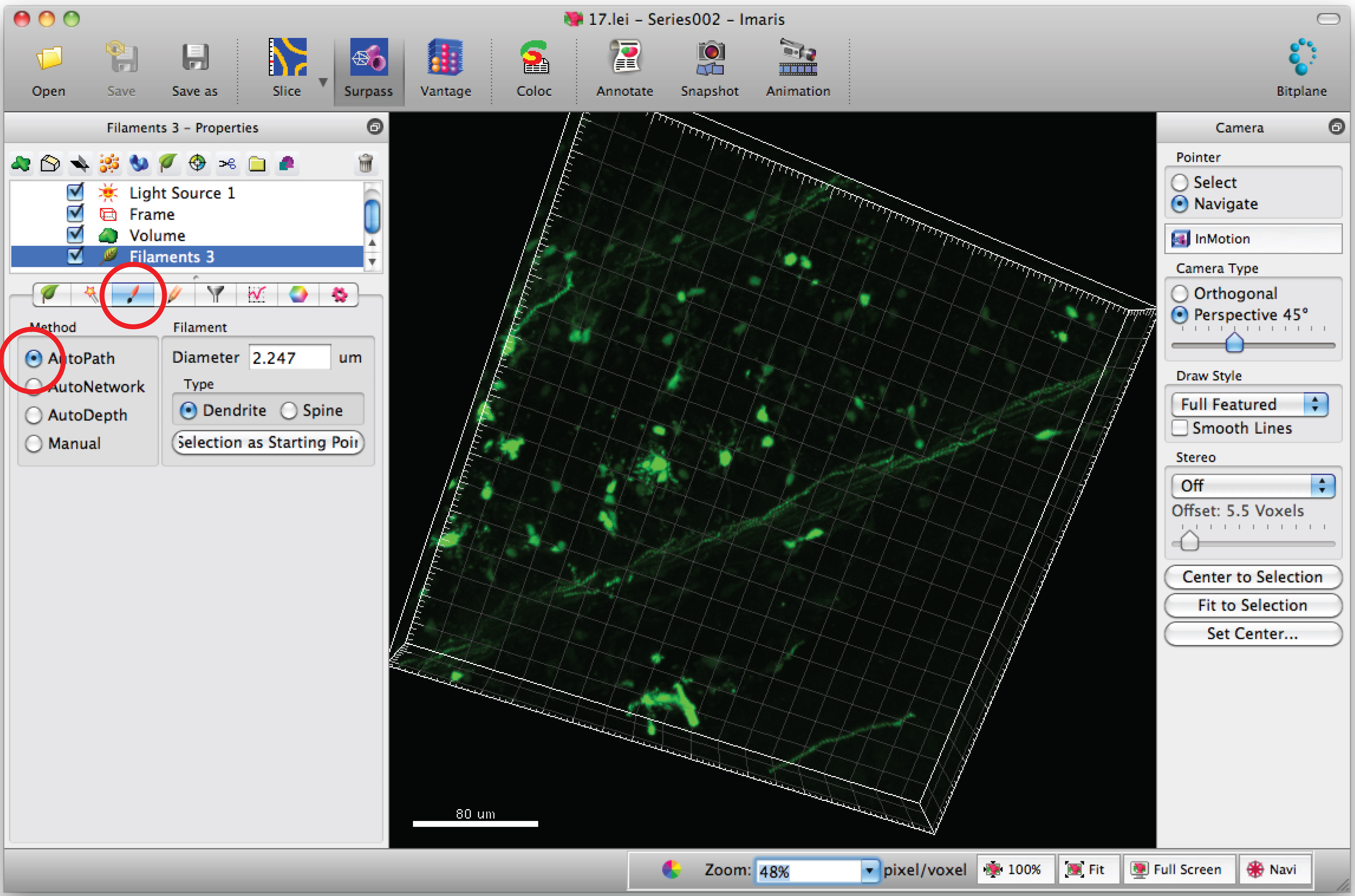
- Déplacez le curseur de la souris sur le ccorps ell et Maj + clic droit pour sélectionner le corps de la cellule. Remarque: Autocalculation par le logiciel peut nécessiter quelques minutes.

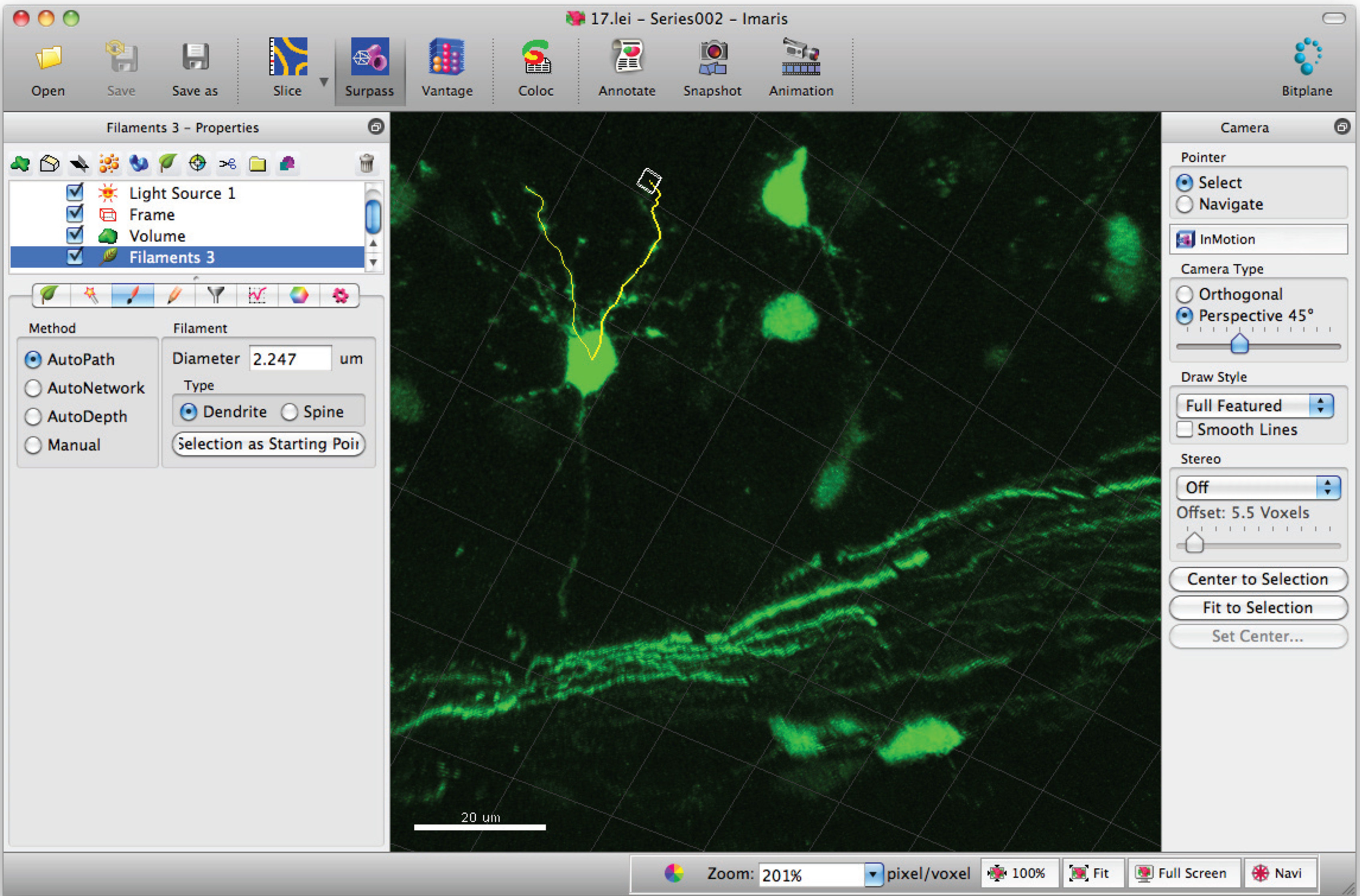
- Ajouter chemins à filament (dendrites) avec Shift + clic gauche. Remarque: Les chemins peuvent être visualisés en temps réel.
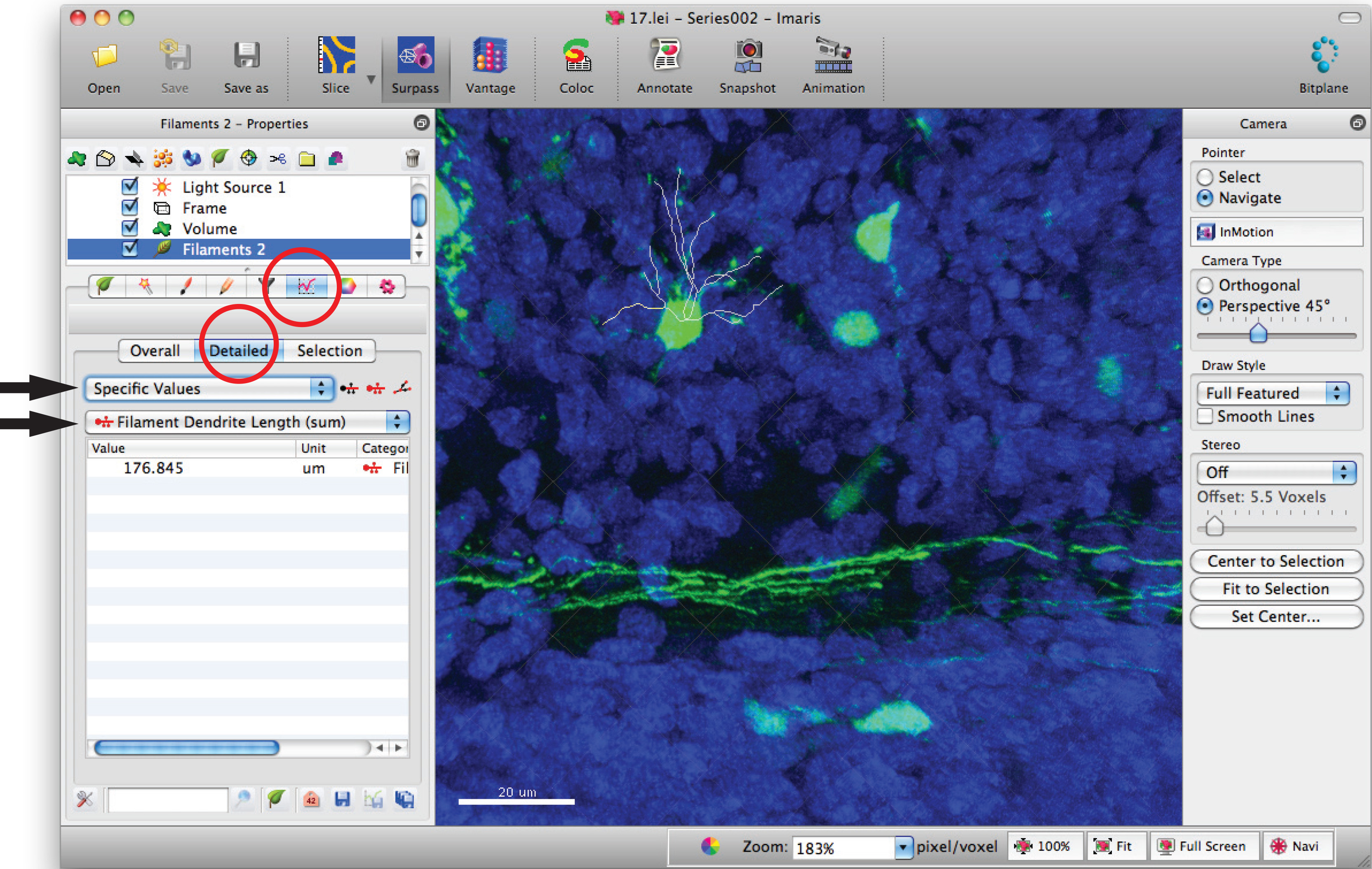
- Allez à la fenêtre de statistiques à incandescence et cliquer sur, les «valeurs spécifiques» «détaillées» et «longueur du filament de dendrites (somme) 'pour somme de la longueur totale de dendrites.
- Utilisez tests statistiques appropriés pour analyser les données.
Résultats
Pour analyser la morphologie de CGN en réponse à différentes conditions de culture, nous avons transfecté des neurones sur DIV 0 comme décrit ci-dessus. Après transfection, nous avons placé une série de neurones dans du milieu complet (BME, 10% de sérum de veau, 2 mM de PSG, 25 mM de KCl) et un autre ensemble dans un milieu contenant de l'insuline minimal (BME, 25 mM de glucose, mM PSG 2, 10 ug / ml d'insuline). Nous avons soumis les neurones à immunocytochimie en utilisant l'anticorps de la GFP au...
Discussion
Avantages et limites de l'décrite in vitro et des méthodes in vivo:
CGN culture de la souris et les rats sont également bien adaptés pour les analyses morphologiques. En raison de la plus grande taille d'un cervelet de rat, le rendement en CNGS de bébés rats est supérieure à celle des souriceaux 3-4x. Mis à part CGN, les neurones corticaux et hippocampiques peuvent être utilisés comme système de culture. La méthode au phosphate de calcium se traduit par...
Déclarations de divulgation
Les auteurs déclarent aucun intérêt financier concurrents.
Remerciements
Nous remercions N. Schwedhelm-Domeyer pour une excellente assistance technique, C. et S. Marteau Papiol l'aide d'analyses statistiques. Notre travail est financé par la Société Max Planck, la Deutsche Forschungsgemeinschaft, le Center for Nanoscale Microscopie et physiologie moléculaire du cerveau (CNMPB), Göttingen, en Allemagne et par la GGNB junior Groupe Allocation de l'Université de Göttingen.
matériels
| Name | Company | Catalog Number | Comments |
| DMEM | Gibco | 11960-044 | |
| BME | Gibco | 41010-026 | |
| Insulin | Sigma-Aldrich | Si-1-4011 | |
| Poly-L-Ornithine | Sigma-Aldrich | P-2533 | |
| CaCl2 | Appli-Chem | A3652 | |
| Isoflurane | Actavis Deutschland | ||
| Tissue-Tek OCT | Sakura | ||
| ECM 830 and tweezertrodes | Harvard Apparatus | ||
| Epifluorescence microscope and camera | Nikon | ||
| SP2 confocal microscope | Leica | ||
| ImageJ | NIH | ||
| Imaris 7.4.2 | Bitplane, Inc. | ||
| GraphPad Prism | GraphPad Software, Inc. | ||
| MS Excel | Microsoft | ||
| Loading tip 1-200 µl | Costar | 4853 | |
| Pipette tip 200 µl | Sarstedt | 70.760.502 | |
| Microlance 3 needle, 30 G | BD | 302200 | |
| 50 µl gastight Syringe 1705 | Hamilton | ||
| Glass coverslips | Thermo Scientific Menzel Glaeser | CB00120RA1 |
Références
- Cajal, S. R. . Histology of the nervous system of man and vertebrates. , (1995).
- Altman, J., Bayer, S. A. . Development of the cerebellar system : in relation to its evolution, structure, and functions. , (1997).
- White, J. J., Reeber, S. L., Hawkes, R., Sillitoe, R. V. Wholemount immunohistochemistry for revealing complex brain topography. J. Vis. Exp. , (2012).
- Palay, S. L., Chan-Palay, V. . Cerebellar cortex: cytology and organization. , (1974).
- Hatten, M. E., Alder, J., Zimmerman, K., Heintz, N. Genes involved in cerebellar cell specification and differentiation. Curr. Opin. Neurobiol. 7, 40-47 (1997).
- Hatten, M. E., Heintz, N. Mechanisms of neural patterning and specification in the developing cerebellum. Annu. Rev. Neurosci. 18, 385-408 (1995).
- Sillitoe, R. V., Joyner, A. L. Morphology molecular codes, and circuitry produce the three-dimensional complexity of the cerebellum. Ann. Rev. Dev. Biol. 23, 549-577 (2007).
- Zervas, M., Millet, S., Ahn, S., Joyner, A. L. Cell behaviors and genetic lineages of the mesencephalon and rhombomere 1. Neuron. 43, 345-357 (2004).
- Wingate, R. J. The rhombic lip and early cerebellar development. Curr. Opin. Neurobiol. 11, 82-88 (2001).
- Kawaji, K., Umeshima, H., Eiraku, M., Hirano, T., Kengaku, M. Dual phases of migration of cerebellar granule cells guided by axonal and dendritic leading processes. Mol. Cell Neurosci. 25, 228-240 (2004).
- Hatten, M. E., Gao, W. -. Q., Morrison, M. E., Mason, C. A. Cellular and molecular neuroscience. , 419-41 .
- Lee, H. Y., Greene, L. A., Mason, C. A., Manzini, M. C. Isolation and culture of post-natal mouse cerebellar granule neuron progenitor cells and neurons. J. Vis. Exp. , (2009).
- Bilimoria, P. M., Bonni, A. Cultures of cerebellar granule neurons. CSH Protoc. 2008, (2008).
- Rivas, R. J., Hatten, M. E. Motility and cytoskeletal organization of migrating cerebellar granule neurons. J. Neurosci. 15, 981-989 (1995).
- Kuhar, S. G., et al. Changing patterns of gene expression define four stages of cerebellar granule neuron differentiation. Development. 117, 97-104 (1993).
- Baird, D. H., Hatten, M. E., Mason, C. A. Cerebellar target neurons provide a stop signal for afferent neurite extension in vitro. J. Neurosci. 12, 619-634 (1992).
- Segal, R. A., Pomeroy, S. L., Stiles, C. D. Axonal growth and fasciculation linked to differential expression of BDNF and NT3 receptors in developing cerebellar granule cells. J. Neurosci. 15, 4970-4981 (1995).
- Gallo, V., Ciotti, M. T., Coletti, A., Aloisi, F., Levi, G. Selective release of glutamate from cerebellar granule cells differentiating in culture. Proc. Natl. Acad. Sci. U.S.A. 79, 7919-7923 (1982).
- Smith, T. C., Wang, L. Y., Howe, J. R. Distinct kainate receptor phenotypes in immature and mature mouse cerebellar granule cells. Physiol. 517 (1), 51-58 (1999).
- Konishi, Y., Stegmuller, J., Matsuda, T., Bonni, S., Bonni, A. Cdh1-APC controls axonal growth and patterning in the mammalian brain). Science. 303, 1026-1030 (2004).
- Stegmuller, J., Huynh, M. A., Yuan, Z., Konishi, Y., Bonni, A. TGFbeta-Smad2 signaling regulates the Cdh1-APC/SnoN pathway of axonal morphogenesis. J. Neurosci. 28, 1961-1969 (2008).
- Stegmuller, J., et al. Cell-intrinsic regulation of axonal morphogenesis by the Cdh1-APC target SnoN. Neuron. 50, 389-400 (2006).
- Kannan, M., Lee, S. J., Schwedhelm-Domeyer, N., Nakazawa, T., Stegmuller, J. p250GAP is a novel player in the Cdh1-APC/Smurf1 pathway of axon growth regulation. PLoS One. 7, (2012).
- Kannan, M., Lee, S. J., Schwedhelm-Domeyer, N., Stegmuller, J. The E3 ligase Cdh1-anaphase promoting complex operates upstream of the E3 ligase Smurf1 in the control of axon growth. Development. 139, 3600-3612 (2012).
- Gaudilliere, B., Konishi, Y., de la Iglesia, N., Yao, G., Bonni, A. A. CaMKII-NeuroD Signaling Pathway Specifies Dendritic Morphogenesis. Neuron. 41, 229-241 (2004).
- Yang, Y., et al. A Cdc20-APC ubiquitin signaling pathway regulates presynaptic differentiation. Science. 326, 575-578 (2009).
- Litterman, N., et al. An OBSL1-Cul7Fbxw8 ubiquitin ligase signaling mechanism regulates Golgi morphology and dendrite patterning. PLoS Biol. 9, (2011).
- Kim, A. H., et al. A centrosomal Cdc20-APC pathway controls dendrite morphogenesis in postmitotic neurons. Cell. 136, 322-336 (2009).
- Shalizi, A., et al. A calcium-regulated MEF2 sumoylation switch controls postsynaptic differentiation. Science. 311, 1012-1017 (2006).
- Vadhvani, M., Schwedhelm-Domeyer, N., Mukherjee, C., Stegmuller, J. The Centrosomal E3 Ubiquitin Ligase FBXO31-SCF Regulates Neuronal Morphogenesis and Migration. PLoS One. 8, (2013).
- Puram, S. V., et al. A CaMKIIbeta signaling pathway at the centrosome regulates dendrite patterning in the brain. Nat. Neurosci. , (2011).
- Jia, Y., Zhou, J., Tai, Y., Wang, Y. TRPC channels promote cerebellar granule neuron survival. Nat. Neurosci. 10, 559-567 (2007).
- Huynh, M. A., et al. An isoform-specific SnoN1-FOXO1 repressor complex controls neuronal morphogenesis and positioning in the mammalian brain. Neuron. 69, 930-944 (2011).
- de la Torre-Ubieta, L., Bonni, A. Transcriptional regulation of neuronal polarity and morphogenesis in the mammalian brain. Neuron. 72, 22-40 (2011).
- Calissano, P., et al. Recombinant human insulin-like growth factor I exerts a trophic action and confers glutamate sensitivity on glutamate-resistant cerebellar granule cells. Proc. Natl. Acad. Sci. U.S.A. 90, 8752-8756 (1993).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon