JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
소뇌 과립 신경 세포의 유전자 조작
요약
신경 세포의 형태 형성 및 마이그레이션 적절한 두뇌 발달의 기초가 중요 이벤트입니다. 여기서 우리는 유 전적으로 배양 소뇌 과립 뉴런과 형태와 신경 세포의 이동성 특성의 평가를위한 개발 소뇌를 조작하는 방법을 설명합니다.
초록
신경 세포의 형태 형성 및 마이그레이션을 포함하여 뇌의 발달 이벤트는 높은 체외. 프로세스를 조율하고 생체 내에서 이러한 이벤트에 참여 경로를 식별하기 위해 심도있는 특성을 허용 분석된다. 개발 소뇌에서 파생 된 소뇌 과립 뉴런 (CGNs)의 형태 학적 분석을 위해 수있는 이상적인 모델 시스템이다. 다음, 우리는 유전자 CGNs를 조작하는 방법에 대한 방법과 방법을 개별 뉴런의 axono 및 dendritogenesis를 공부하는 방법에 대해 설명한다. 이 방법으로 RNA 간섭, 과발현 또는 작은 분자의 효과는 신경 세포를 제어하는 비교 될 수있다. 또한, 쥐의 소뇌 피질은 지배적 인 출생의 개발로 인해 생체 시스템에 쉽게 액세스 할 수 있습니다. 우리는 또한 유 전적으로 조작을 소뇌 현상 및 후속 소뇌를 설명하는 생체 전기 천공 기법을 제시하는 것은 신경 세포 모폴로지를 평가하는 분석ND 마이그레이션.
서문
소뇌는 축삭의 성장과 이동의 메커니즘을 연구 할 수있는 훌륭한 시스템입니다. 소뇌는 신경 과학 (1)의 새벽부터 해부학 적 연구의 대상이되고있다. 현대 현미경과 면역 조직 화학 기술은 크게 확대와 산티아고, 라몬,과를 Cajal 2-4으로 초기 발견을 정제했다. 마우스 유전학과 분자 연구는 소뇌 과립 뉴런 (CGNs) 5-7를 포함하여 신경 세포의 다른 유형의 적절한 배선에 필요한 중요 사건의 더 큰 이해를 주도, 소뇌 개발의 제어에 필수적인 성장과 전사 인자를 발견.
소뇌는 개발 후뇌 8 rhombomere 1의 유도체이다. 제 4 뇌실의 지붕 부분 마름모꼴 립은에서 대부분의 수많은 신경 세포 집단을 구성하는 것이다 소뇌 과립 신경 전구 세포로 일으킨다성인 소뇌 9. 주동이의 이동에 따라, 그들은 소뇌 anlage에 정착. 여기에, 과립 신경 세포 전구체의 유사 분열은 설치류에서 출생 후에 일어나는 외부 세분화 층 (EGL)의 극적인 확장으로 이어집니다. EGL에서 뉴런은 조롱박 세포 층이 궁극적으로 내부 과립 층 (IGL 2)에 거주를 데리고 과거, 분자 층 (ML)를 통해 안쪽으로 마이그레이션을 시작. 이 이주 과정에서, 그들은 두 개의 축색 돌기는 ML로 확장과 양극성 모양을 취득. 상기 이동시에, 전지 본체 멀리 축삭에서 마이그레이션 및이 프로세스는 하나의 분기 된, T 자형 축삭 (10)를 형성하도록 융합. 그 후,이 축삭은 총생하고 병렬 섬유라고합니다. IGL에 정착하는 데, CGNs 이끼 섬유와 시냅스를 확립 돌기 발톱을 형성 수상 돌기를, 성장한다. , 현상 소뇌 근본적인 과정을 검토하는 시험 관내 및 생체 내에서 결합 approacH는 신뢰할 수있는 결과와 결론 수 있습니다.
CGNs뿐만 아니라 소뇌하지만 뇌 전체에서 가장 많은 뉴런하고 높은 순도 11 ~ 13까지 배양 할 수있다. 문화,이 매우 균일 한 신경 세포의 인구는 빠르게 postmitotic되고, 쉽게 식별 축삭과 수상 돌기 극의 형태를 취득한다. 배양 CGNs은 조상의 증식, 분화, 축삭과 수상 돌기의 개발, 신경 세포 이동, 세포 사멸 및 전기 생리학 속성 (14-19 및 많은 다른 사람) 등의 신경 발달의 다양한 측면을 연구하는 것이 매우 유용하다는 것을 입증했다. 유전자 조작의 사용은 배양 CGNs의 다양성을 확대하고 상기 이벤트에 추가 기계론의 통찰력을 허용하고 있습니다. 저효율 인산 칼슘 또는 극성 마커 또는 소프트웨어 지원 분석 facili과 면역 세포 화학 다음에 친 유성 방법을 사용하여 배양 된 신경 세포의 형질조밀 한 신경 세포의 문화에서 개별 뉴런의 예를 들면 형태의 평가를 테이 츠. 이 방법을 사용 축삭 또는 수상 돌기의 성장에 대한 관심의 단백질의 역할은 20-25,26-28를 공부하실 수 있습니다. 이 배양 시스템은 그러나 마이그레이션이 매우 고밀도 배양에 한정되기 때문에 신경 마이그레이션을 분석하기 위해 덜 유용하고 공 배양을 필요로한다. 축삭 및 덴 드라이트 성장의 시험 관내 분석은 또한 RNA 방해 (I)의 조합을 통해 신호 경로의 상호 연결된 단백질의 검사를 허용, 과발현 또는 작은 분자.
축삭과 수상 돌기의 성장을 조절하거나 연결을 마이 그 레이션에 대한 관심의 단백질의 관련성을 확립하기 위해, 생체 전기 천공 (IVE) 기술은 개발 소뇌 피질에서 분석 할 수 있습니다. 설치류 소뇌 개발이 제 생후 주으로 이어져 있다는 사실로 인해, 소뇌 accessib를 의미축삭과 수상 돌기, 신경 세포의 이동, 시냅스와 세포 사멸 20-24,29,30,26,27,31-34을 개발하고 시험하는 유전자 조작에 대한 르 뇌 구조. 또한,이 모델 시스템은 또한 축삭 길 찾기, 배선과 함께 찍은 뉴런과 신경 세포 - glia의 상호 작용의 연결로 그대로 소뇌 피질을 필요로 신경 발달의 다른 측면에 유용합니다,이 프로토콜은 시험 관내 및 생체 기술을 해결하기에 제공 신경 세포의 형태 형성 및 마이그레이션에 대한 보완 방법.
프로토콜
CGNs 어느 생후 (P) 5 마우스 새끼 또는 P6 래트 새끼로부터 제조 할 수있다. 우리는 postmitotic CGNs (13)를 선택하는 유사 분열 억제제를 사용 Bilimoria 및 동료에 의해 기술 된 프로토콜을 따르십시오.
윤리 문 :
살아있는 동물을 포함한 모든 실험은 낮은 작센, 독일의 "Verbraucherschutz 싶게 Lebensmittelsicherheit"의 승인을 동물의 프로토콜에 따라 수행되었다.
시험 관내 분석에서 :
1. 칼슘 인산염 형질 방법에 대한 DNA 플라스미드, 미디어 및 버퍼의 준비
- 무균, 내 독소가없는 물에 플라스미드 DNA를 녹이고 DMEM (높은 혈당), 2.5 M 염화칼슘을, 배 HBSS는 (4g의 NaCl, 0.1775 g의 KCl, 0.095 g 2 HPO 4 • 7H 2 O, 0.675 g의 포도당 나 용해합니다 2.5 g을 250 ㎖의 초순수의 HEPES 및 7.05, 7.08, 7.11)로 산도를 조정합니다. 참고 : 준비 할 때배 HBSS 용액, pH가 플라스미드의 특정 조합의 형질 효율 관한 가장 좋은 결과를 얻을 테스트입니다.
2. 배양 된 신경 세포의 형질
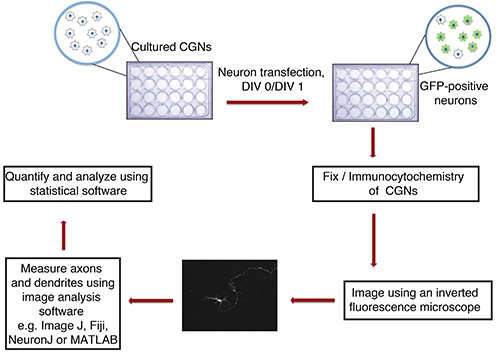
그림 1. 체외 축삭과 수상 돌기의 성장 분석의 흐름도. 교양 CGNs P6 쥐 새끼에서 격리 (유리 커버 슬립과 24 웰 플레이트), 형광 형질 마커 (예 : GFP)를 포함하는 DNA의 침전물 DIV 0 또는 1로 형질 전환됩니다. 고정 및 면역 세포 후 뉴런은 눈을 멀게 방식으로 몇 군데 있습니다. 이미지는 ImageJ에로 가져 및 프로세스 측정한다. 측정은 다음의 통계 프로그램을 사용하여 처리됩니다.
- 씨 CGNs (20 × 10 6 24 - 웰 플레이트 당, BME, 10 %의 혈청, 2 mM의 페니실린-Streptomycin-글루타민 (PSG), 25 밀리미터의 KCl) 미디어 500 μL와 24 - 웰 플레이트에 질산 산 세척, 폴리 오르니 틴 코팅 12mm 유리 커버 슬립에 잘 당.
- 체외 날 (DIV) 0 (최소 8 시간 도금 후) 또는 DIV 1, 성장 배지를 수집하고 37 ℃에서 보관 데워진 DMEM 500 μL로 두 번 뉴런을 씻고 DMEM 500 μl를 추가합니다.
- 인큐베이터에있는 장소의 뉴런 (37 ° C, 5 % CO 2) 45 분.
- 을 혼합하여 각 우물 40 μL의 DNA 침전물을 준비 DNA (2 ~ 2.5 μg이 / 잘, 전체 DNA의 10 %가 형질 신경을 시각화하는 형질 마커, 예를 들면 GFP 있어야한다), 물 (최대 18 μL)을, 2 μL의 추가 2.5 M 염화칼슘 잘 혼합 배 HBSS의 20 μl를 추가합니다.
- RT에서 5 분 동안 DNA 침전물을 품어.
- 물론 각 DNA 침전물을 추가하고 인큐베이터에 18 분 동안 뉴런을 배양한다.
- DMEM / DNA 믹스를 제거하고 데워진 DM 500 μL로 두 번 뉴런을 씻어EM.
- 신경 세포에 다시 2.2 단계에서 수집 된 미디어를 추가합니다. 신경 세포는 3 일 이상, 탄소원을 보충하는 DIV 3에서 25 mM의 포도당과 보충 미디어 문화에있을 것이다.
- 1-5일 후, GFP 항체를 면역 세포에 따라 신경 세포를 사용.
- 형광등의 현미경을 이용하여 눈을 멀게 방식으로 조건 당 이미지 적어도 30 개별 뉴런.
3. NeuronJ, NIH ImageJ에 플러그인을 측정 축삭 및 Dendrites에서
중요 : μm의 비율은 확대하고 이미지의 해상도에 따라 : 이미지가 해당 화소를 사용하여 correctluy 조정되어 있는지 확인하십시오.
- ImageJ에 8 비트 변환 이미지 : 오픈 화상은 "화상"을 선택 -> '유형 "-> '8 비트"->'저장 '영상입니다.
- NeuronJ 플러그인을 실행하고 8 비트 이미지를 엽니 다.
- CL : 축삭을 추적하는 '추가 경시'옵션을 사용하여축삭의 시작 부분에 한 번 마우스 왼쪽 버튼을 ICK 프로세스를 따라 마우스를 이동합니다. 축삭의 끝을 두 번 클릭 추적이 축삭 모양과 일치하는 경우가.
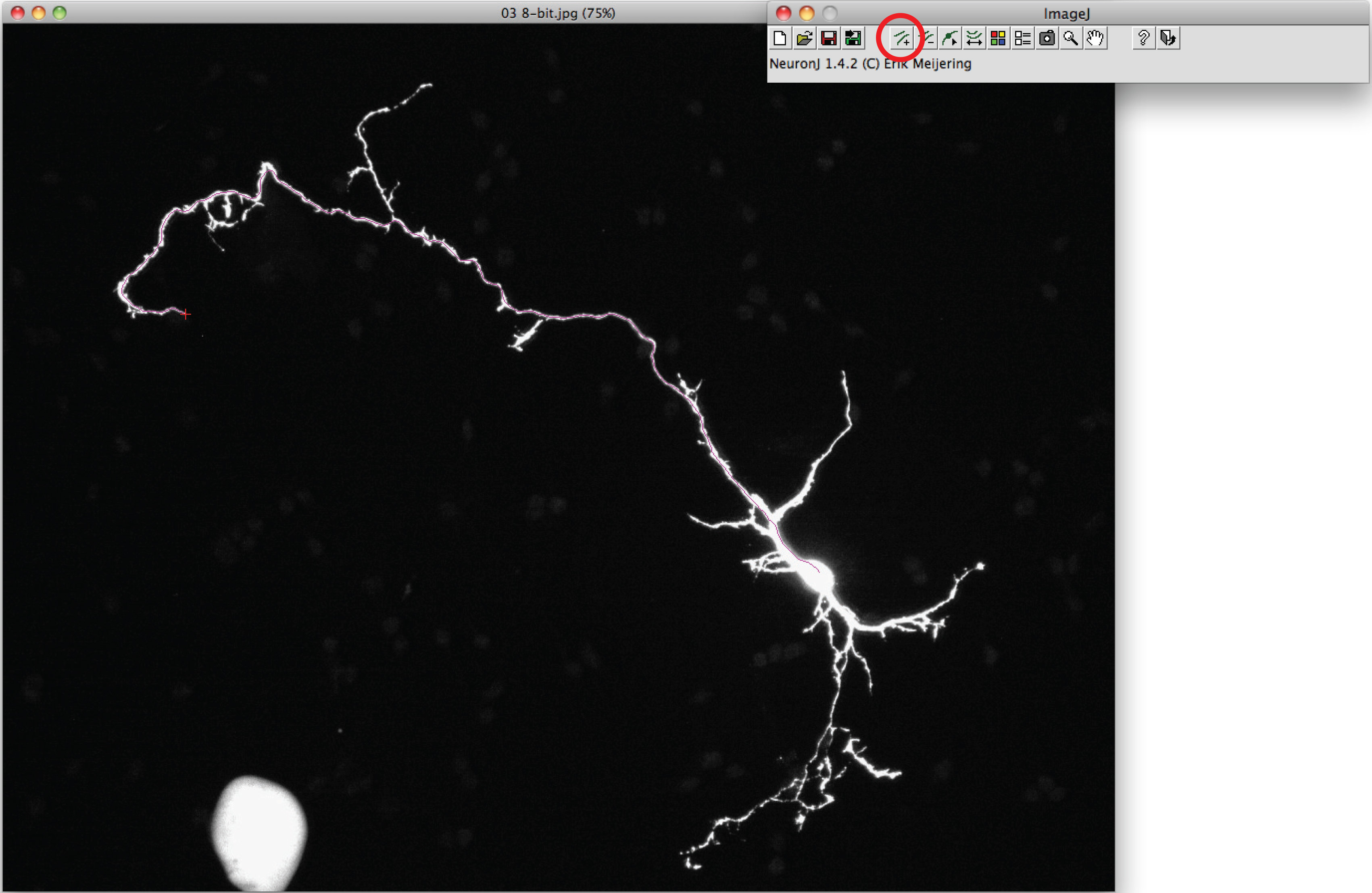
참고 : 제안 된 추적이 축삭의 형태와 다르면,, 축색 돌기의 끝을 더블 클릭 추적을 고정하는 축삭 프로세스를 한 번 클릭합니다. - 옵션을 선택하고 키를 눌러 '실행' '측정 추적 표시'를 선택, '측정 경시'를 클릭합니다. 축삭의 측정은 모든 새 창에 표시됩니다. 수상 돌기를 들어, '디스플레이 그룹 측정 옵션'을 눌러 '실행'을 선택합니다.
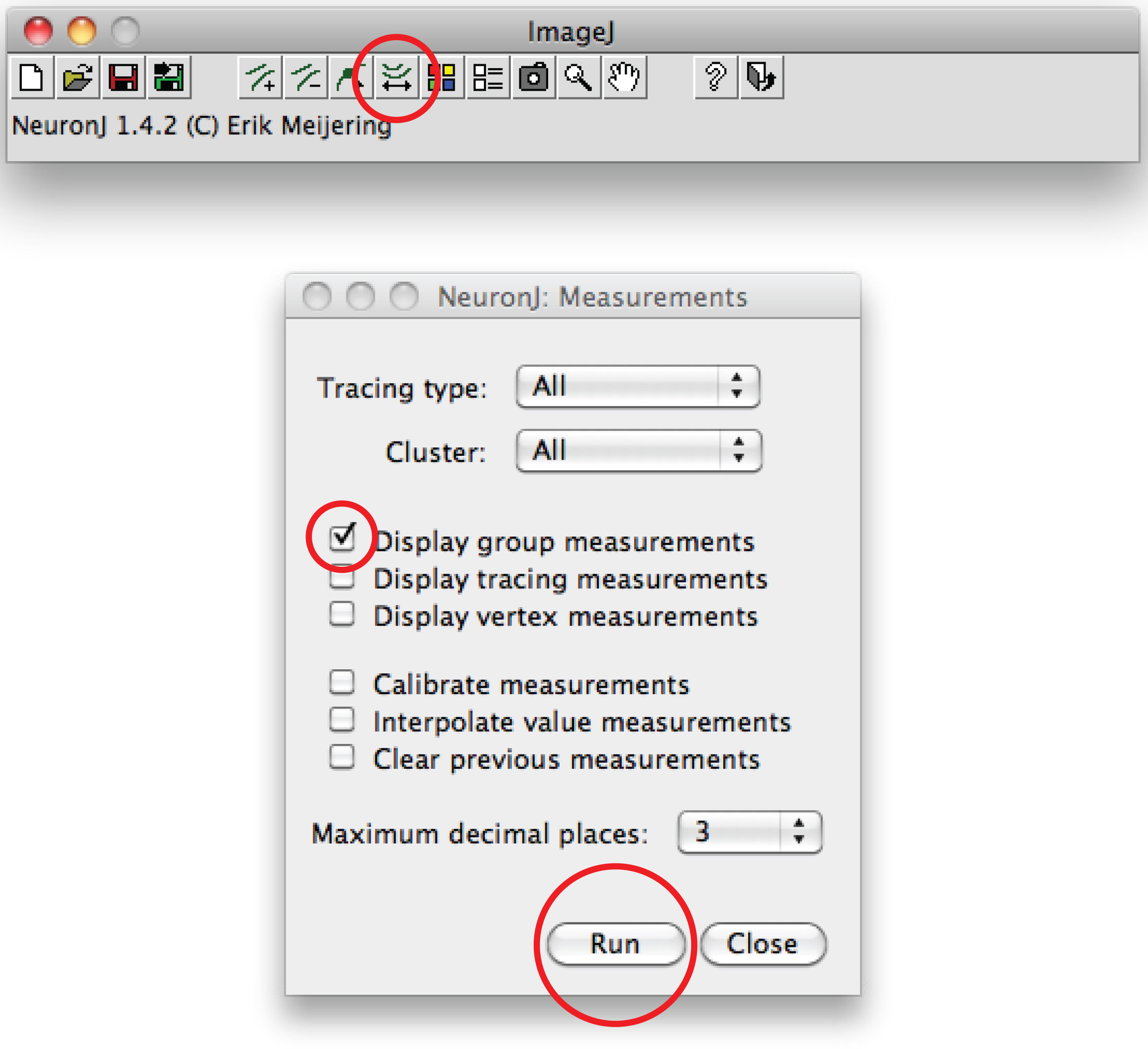
총 덴 드라이트 측정은 모든 새 창에 표시됩니다. 스프레드 시트 프로그램에서 열 수있는 별도의 파일로 저장할 수 있습니다. - 또는 수동 추적에, 피지 소프트웨어를 사용 : 마우스 오른쪽 번째 클릭E '직선'옵션 '프리 핸드 라인'을 선택,
마우스 왼쪽 버튼을 누른 유지하고 프로세스를 수동으로 추적을 눌러 'Ctrl 키 + M'을 측정 할 수 있습니다. - 조건 당 평균 축삭 / 돌기의 길이를 계산하고 적절한 통계 테스트를 사용합니다.
생체 일렉트로의 :
1. 장비 및 시약의 준비
- 당신은 30 G 바늘, 스페이서 (1 ~ 2 ㎜), 주사기, 죽은 볼륨 흡진기 (DVR), electroporator 및 tweezertrodes, 전기 패드 나 적외선 열 램프, 구즈넥 램프와 이소 플루 란을 필요로한다.
- 바늘에 DVR를 넣고, 다음 주사기 바늘을 부착하고, 마지막으로 (그림 2) 바늘에 스페이서를 넣어.
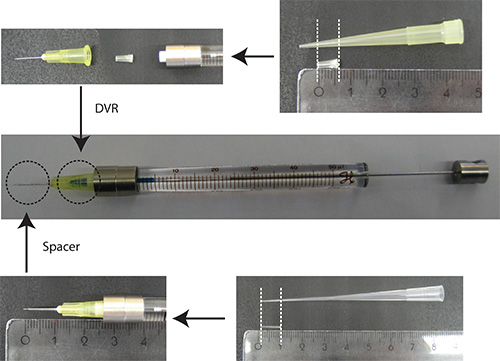
그림2. 바늘. DVR의 제조 200 μL 피펫 팁을 잘라 죽은 양을 줄이기 위해 바늘에 배치됩니다. 간격은 200 μL 로딩 팁에서 파생 약 2mm로 소뇌로의 침투 깊이를 조절하기 위해 바늘의 단부에 배치된다. 눈금자 단위 : cm - PBS/0.03 % 빠른 그린에서 DNA를 녹인다. 참고 : 형질 마커로, 그것은 단지 신경 세포를 시각화하는 신경 세포 특이 적 프로모터 (예 Synapsin) 아래에 형광 단백질을 사용하는 것이 유리하다. 총 플라스미드 금액의 25 %는 형질 마커를 코딩하는 플라스미드해야한다.
- 70 % 에탄올을 확인합니다.
- 동일의 OCT 볼륨과 PBS에 용해 30 % 자당을 혼합.
- DNA (PBS/0.03 % 빠른 그린에서 플라스미드 DNA의 4 ㎍ / μL)의 4 μL 주사기를 채우십시오.
2. 쥐 새끼 IVE
IVE의 순서도 : 그림 3 참조
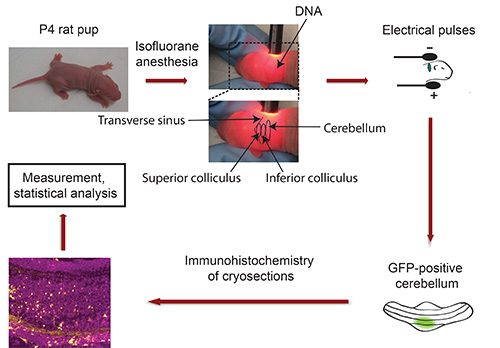
그림 3. 생체 일렉트로. P4 쥐 새끼의 흐름도는 소뇌에 주입 5 전기 펄스에 노출 한 후, 아이소 플루 란과 형광 형질 마커 (예 : GFP)를 코딩하는 플라스미드 DNA와 마취. 5 일 후, 고립 된 GFP 양성 소뇌는 단면 및 면역 조직 화학 염색을 실시한다. 이미지는 공 초점 현미경을 사용하여 캡처 및 Imaris 소프트웨어를 사용하여 분석 하였다. 데이터는 통계 프로그램으로 처리됩니다.
- 흰둥이 변형 (위 스타 또는 긴 에반스)에서 P4 쥐 새끼를 사용합니다.
- 강아지가 움직 더 이상 때까지 1 ~ 2 분 동안 이소 플루 란 (조직에 배어) 200 ㎕ 씩 작은 상자 (예 : P1000 피펫 팁 박스)에 이소 플루 란과 새끼 (잇달아) 마취 없습니다. 새끼 승 접촉하지 않도록주의하십시오i 번째는 이소 플루 란을 Iiquid. 각각의 새끼는 마취에 다르게 반응과 밀접하게 시간을 모니터링합니다.
- 70 % 에탄올로 다시 강아지의 머리의 소독.
- 엄지 손가락과 검지 손가락 사이의 강아지의 머리를 수정하고 흰둥이 강아지의 소뇌를 찾습니다 구즈넥 램프를 사용합니다. 가로 동은 크게 대뇌 피질 반구에서 중뇌 (우수하고 열등 둔덕) (그림 3) demarcates. 소뇌 중뇌 인접 해 있으며 어두운 그늘에서 나타납니다. 점이있는 소뇌를 표시하기 위해 영구 마커를 사용합니다. 중요 : 고정 된 위치에서 강아지를 유지! 주 : 마취가이 절차를 수행하는 동안 깨어나 경우, 이전에 DNA를 주입에 이소 플루에 강아지를 노출합니다.
- 바늘 (그림 3)를 삽입하고 천천히 소 뇌에 DNA의 3 μl를 주입.
- DNA 용액을 30 ~ 60 초 동안 확산 보자.
- 마이너스 극이 머리 뒤쪽 (소뇌와 접촉 할 수 있도록 tweezertrodes 사이의 강아지의 머리를 배치R 영역)과 플러스 극 연락처 머리의 반대쪽 (그림 3)이.
- 5 전기 펄스에 따라 강아지. 생존 (표 1) 손상없이 좋은 일렉트로 효율성을 보장하기 위해 강아지의 무게에 전압을 조정합니다.
표 1. P4 쥐 새끼의 일렉트로.무게 전압 펄스 간격 8-9그램 160 V 50 밀리 초 950 밀리 초 9-10g 165 V 50 밀리 초 950 밀리 초 > 10g 170 V 50 밀리 초 950 밀리 초 - 새끼 가열 패드 나 적외선 램프 아래에 복구 할 수 있습니다. 댐 새끼를 반환합니다. 중요 : 가열 소스에 화상을 입힐하지 않는다는 것을 확인하십시오.
- CO 잘린 2를 다음에 배치함으로써 오일 일렉트로 후 새끼를 제물로 바친다.
- 형광 현미경을 사용하여 소뇌 GFP - 긍정적 인 사람의 소뇌와 화면을 분리합니다.
- 다음 소뇌 싱크까지 튜브의 바닥에 4 ° C에서 30 % 자당에 품어, 4 ° C에서 4 % PFA O / N에서 소뇌를 고정합니다.
- OCT/30 % 자당에서 소뇌를 포함하고 저온 유지 장치를 사용하여 40 μm의 코로나 섹션을 잘라. 주 : 눈을 멀게 방식으로 제 각각의 소뇌.
- 제목 섹션에서는 GFP 항체를 이용하여 면역 조직 화학 염색합니다. 핵 염색 (DAPI 또는 훽스트 33258)와 Counterstain 동물 당 적어도 200 형질 전환 된 뉴런의 지역화를 결정합니다.
- 에 대한 심층적 인 분석을 위해, ML과 흰색 문제에 직면 낮은 IGL에 직면 상위 IGL의 결과, 절반에 IGL를 세분화하고 각 반에 거주하는 GFP - 신경 세포를 계산합니다. 주 : 눈을 멀게 방식으로 각 섹션의 GFP 양성 신경 세포를 계산합니다.
3. 모 수석의 길이를 측정, 공 촛점 현미경을 사용하여 X, Y, Z 평면의 섹션의 이미지 획득
참고 : 예를 들어, 1 ㎛의 Z-stwp와 40 μm의 섹션 (40) 이미지를 사용합니다.
- 수상 돌기의 3D 이미지를 생성하는 소프트웨어 Imaris에 열려있는 이미지 시리즈.
- 3D로 신경 세포를 볼 수 '능가'모드를 클릭합니다.
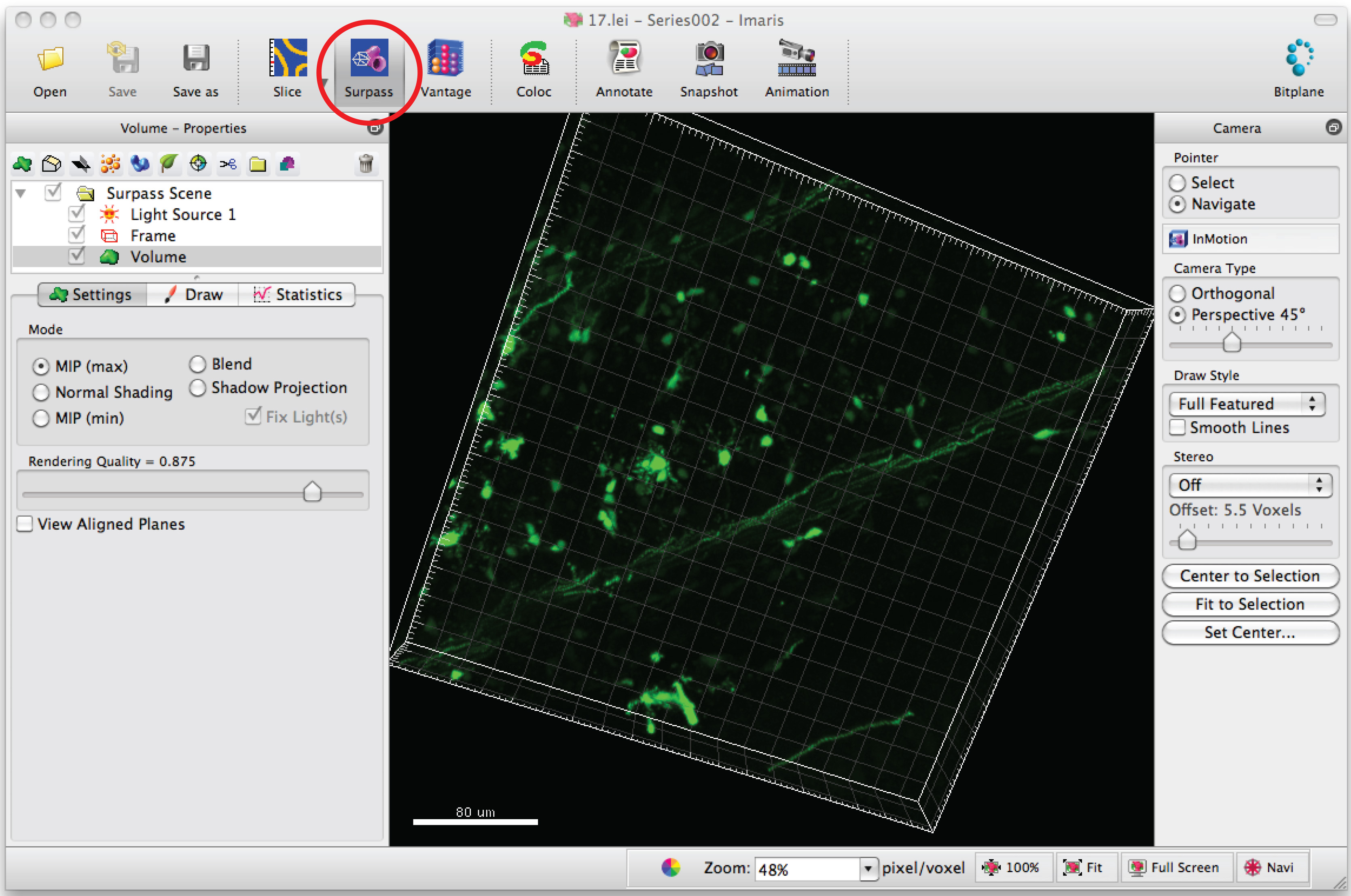
- '새로운 필라멘트 추가'를 선택하고, 반자동 추적을 시작하는 '자동 생성을 건너 뛰기'를 클릭합니다.

주 : 눈을 멀게 방식으로 각 3D 이미지 분석 - '그리기'탭과 'AutoPath'를 선택합니다.
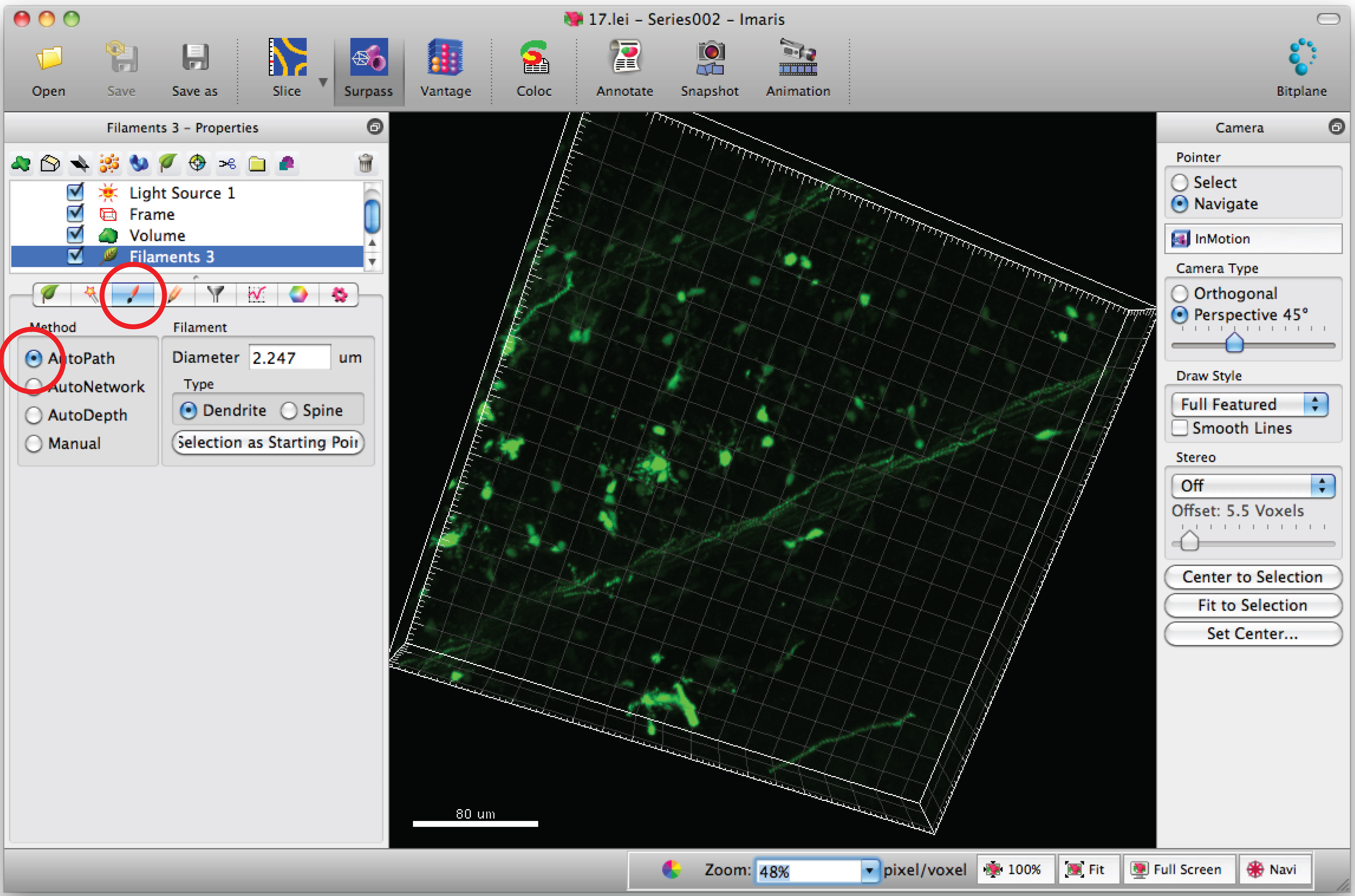
- C에 마우스 커서를 이동엘 바디와 Shift + 마우스 오른쪽 세포체를 선택합니다. 참고 : 소프트웨어에 의해 자동 계산이 몇 분을 필요로 할 수있다.

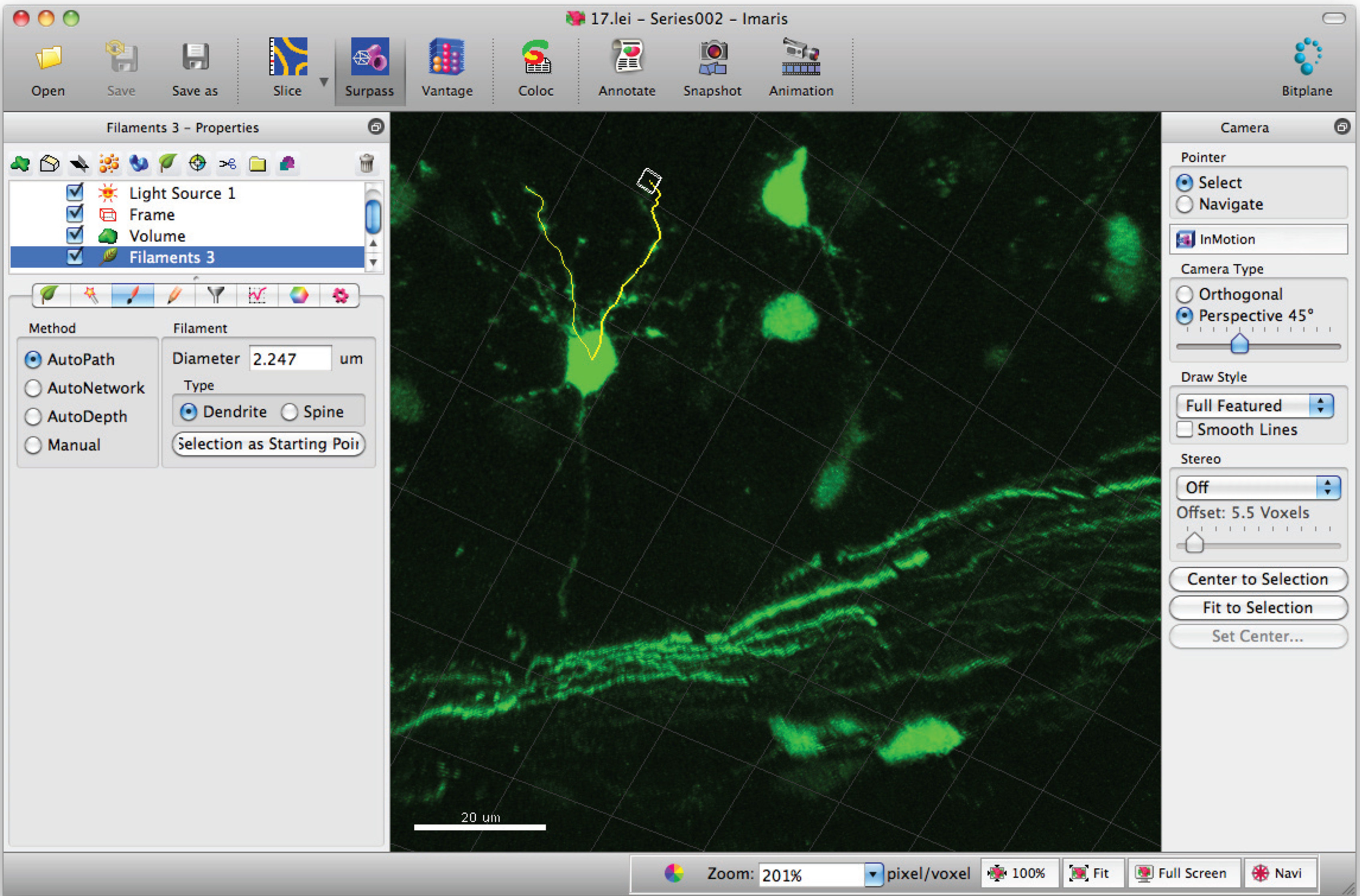
- Shift + 마우스 왼쪽 클릭을 사용하여 필라멘트 (수상 돌기)에 경로를 추가합니다. 참고 : 경로를 실시간으로 시각화 할 수 있습니다.
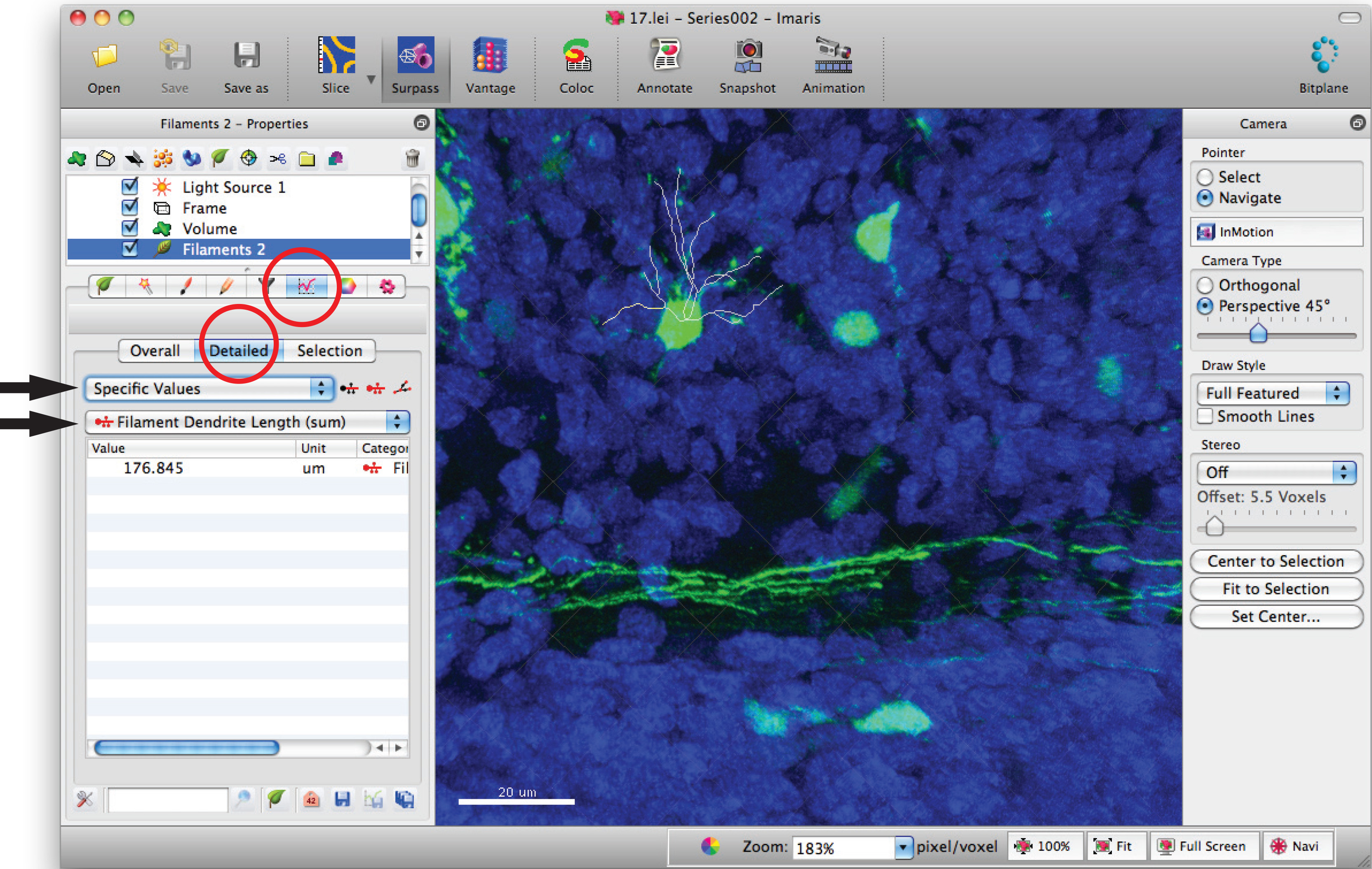
- 필라멘트 통계 창으로 이동하고 '상세', '특정 값'총 덴 드라이트 (dendrite)의 길이의 합에 대한 '필라멘트 수상 돌기의 길이 (화)'를 클릭합니다.
- 데이터를 분석하기위한 적절한 통계 테스트를 사용합니다.
결과
상술 한 바와 같이 서로 다른 배양 조건에 따라 CGNs의 형태를 분석하기 위해, 우리는 DIV 0에 신경을 형질 전환. 형질 전환 후, 우리는 전체 매체 (BME, 10 %의 혈청, 2 mM의 PSG, 25 밀리미터의 KCl) 및 최소 배지 포함 인슐린에 또 다른 세트 (BME, 25 mM의 포도당, 2 ㎜ PSG, 10 ㎍ /로 뉴런의 한 세트를 배치 ML 인슐린). 우리는 DIV 1, 2에서 GFP의 항체를 이용한 면역 세포 화학에 신경을 실시, 3 만 세트 2 세트 1 축삭?...
토론
장점 및 시험 관내 및 생체 내 방법에 기술의 한계 :
마우스와 쥐에서 배양 CGNs은 동일하게 형태 학적 분석을 위해 적합합니다. 쥐의 소뇌의 큰 크기 때문에, 쥐 새끼에서 CNGs의 수율은 마우스 새끼 3 배의 초과합니다. 이외에도 CGNs에서, 대뇌 피질 및 해마 뉴런뿐만 아니라 배양 시스템으로 사용될 수있다. 인산 칼슘 방법은 개별 뉴런의 형태를 분석하기 위해 요구되는 ?...
공개
저자는 더 경쟁 재정적 이익을 선언하지 않습니다.
감사의 말
우리는 통계 분석과 도움, 우수한 기술 지원을 C. 망치와 S. Papiol를 N. Schwedhelm-Domeyer 감사합니다. 우리의 작업은 막스 플랑크 협회, 도이치 Forschungsgemeinschaft, 나노 현미경을위한 센터, 뇌의 분자 생리학 (CNMPB), 괴팅겐, 독일 괴팅겐 대학의 GGNB 주니어 그룹 장학금으로 후원된다.
자료
| Name | Company | Catalog Number | Comments |
| DMEM | Gibco | 11960-044 | |
| BME | Gibco | 41010-026 | |
| Insulin | Sigma-Aldrich | Si-1-4011 | |
| Poly-L-Ornithine | Sigma-Aldrich | P-2533 | |
| CaCl2 | Appli-Chem | A3652 | |
| Isoflurane | Actavis Deutschland | ||
| Tissue-Tek OCT | Sakura | ||
| ECM 830 and tweezertrodes | Harvard Apparatus | ||
| Epifluorescence microscope and camera | Nikon | ||
| SP2 confocal microscope | Leica | ||
| ImageJ | NIH | ||
| Imaris 7.4.2 | Bitplane, Inc. | ||
| GraphPad Prism | GraphPad Software, Inc. | ||
| MS Excel | Microsoft | ||
| Loading tip 1-200 µl | Costar | 4853 | |
| Pipette tip 200 µl | Sarstedt | 70.760.502 | |
| Microlance 3 needle, 30 G | BD | 302200 | |
| 50 µl gastight Syringe 1705 | Hamilton | ||
| Glass coverslips | Thermo Scientific Menzel Glaeser | CB00120RA1 |
참고문헌
- Cajal, S. R. . Histology of the nervous system of man and vertebrates. , (1995).
- Altman, J., Bayer, S. A. . Development of the cerebellar system : in relation to its evolution, structure, and functions. , (1997).
- White, J. J., Reeber, S. L., Hawkes, R., Sillitoe, R. V. Wholemount immunohistochemistry for revealing complex brain topography. J. Vis. Exp. , (2012).
- Palay, S. L., Chan-Palay, V. . Cerebellar cortex: cytology and organization. , (1974).
- Hatten, M. E., Alder, J., Zimmerman, K., Heintz, N. Genes involved in cerebellar cell specification and differentiation. Curr. Opin. Neurobiol. 7, 40-47 (1997).
- Hatten, M. E., Heintz, N. Mechanisms of neural patterning and specification in the developing cerebellum. Annu. Rev. Neurosci. 18, 385-408 (1995).
- Sillitoe, R. V., Joyner, A. L. Morphology molecular codes, and circuitry produce the three-dimensional complexity of the cerebellum. Ann. Rev. Dev. Biol. 23, 549-577 (2007).
- Zervas, M., Millet, S., Ahn, S., Joyner, A. L. Cell behaviors and genetic lineages of the mesencephalon and rhombomere 1. Neuron. 43, 345-357 (2004).
- Wingate, R. J. The rhombic lip and early cerebellar development. Curr. Opin. Neurobiol. 11, 82-88 (2001).
- Kawaji, K., Umeshima, H., Eiraku, M., Hirano, T., Kengaku, M. Dual phases of migration of cerebellar granule cells guided by axonal and dendritic leading processes. Mol. Cell Neurosci. 25, 228-240 (2004).
- Hatten, M. E., Gao, W. -. Q., Morrison, M. E., Mason, C. A. Cellular and molecular neuroscience. , 419-41 .
- Lee, H. Y., Greene, L. A., Mason, C. A., Manzini, M. C. Isolation and culture of post-natal mouse cerebellar granule neuron progenitor cells and neurons. J. Vis. Exp. , (2009).
- Bilimoria, P. M., Bonni, A. Cultures of cerebellar granule neurons. CSH Protoc. 2008, (2008).
- Rivas, R. J., Hatten, M. E. Motility and cytoskeletal organization of migrating cerebellar granule neurons. J. Neurosci. 15, 981-989 (1995).
- Kuhar, S. G., et al. Changing patterns of gene expression define four stages of cerebellar granule neuron differentiation. Development. 117, 97-104 (1993).
- Baird, D. H., Hatten, M. E., Mason, C. A. Cerebellar target neurons provide a stop signal for afferent neurite extension in vitro. J. Neurosci. 12, 619-634 (1992).
- Segal, R. A., Pomeroy, S. L., Stiles, C. D. Axonal growth and fasciculation linked to differential expression of BDNF and NT3 receptors in developing cerebellar granule cells. J. Neurosci. 15, 4970-4981 (1995).
- Gallo, V., Ciotti, M. T., Coletti, A., Aloisi, F., Levi, G. Selective release of glutamate from cerebellar granule cells differentiating in culture. Proc. Natl. Acad. Sci. U.S.A. 79, 7919-7923 (1982).
- Smith, T. C., Wang, L. Y., Howe, J. R. Distinct kainate receptor phenotypes in immature and mature mouse cerebellar granule cells. Physiol. 517 (1), 51-58 (1999).
- Konishi, Y., Stegmuller, J., Matsuda, T., Bonni, S., Bonni, A. Cdh1-APC controls axonal growth and patterning in the mammalian brain). Science. 303, 1026-1030 (2004).
- Stegmuller, J., Huynh, M. A., Yuan, Z., Konishi, Y., Bonni, A. TGFbeta-Smad2 signaling regulates the Cdh1-APC/SnoN pathway of axonal morphogenesis. J. Neurosci. 28, 1961-1969 (2008).
- Stegmuller, J., et al. Cell-intrinsic regulation of axonal morphogenesis by the Cdh1-APC target SnoN. Neuron. 50, 389-400 (2006).
- Kannan, M., Lee, S. J., Schwedhelm-Domeyer, N., Nakazawa, T., Stegmuller, J. p250GAP is a novel player in the Cdh1-APC/Smurf1 pathway of axon growth regulation. PLoS One. 7, (2012).
- Kannan, M., Lee, S. J., Schwedhelm-Domeyer, N., Stegmuller, J. The E3 ligase Cdh1-anaphase promoting complex operates upstream of the E3 ligase Smurf1 in the control of axon growth. Development. 139, 3600-3612 (2012).
- Gaudilliere, B., Konishi, Y., de la Iglesia, N., Yao, G., Bonni, A. A. CaMKII-NeuroD Signaling Pathway Specifies Dendritic Morphogenesis. Neuron. 41, 229-241 (2004).
- Yang, Y., et al. A Cdc20-APC ubiquitin signaling pathway regulates presynaptic differentiation. Science. 326, 575-578 (2009).
- Litterman, N., et al. An OBSL1-Cul7Fbxw8 ubiquitin ligase signaling mechanism regulates Golgi morphology and dendrite patterning. PLoS Biol. 9, (2011).
- Kim, A. H., et al. A centrosomal Cdc20-APC pathway controls dendrite morphogenesis in postmitotic neurons. Cell. 136, 322-336 (2009).
- Shalizi, A., et al. A calcium-regulated MEF2 sumoylation switch controls postsynaptic differentiation. Science. 311, 1012-1017 (2006).
- Vadhvani, M., Schwedhelm-Domeyer, N., Mukherjee, C., Stegmuller, J. The Centrosomal E3 Ubiquitin Ligase FBXO31-SCF Regulates Neuronal Morphogenesis and Migration. PLoS One. 8, (2013).
- Puram, S. V., et al. A CaMKIIbeta signaling pathway at the centrosome regulates dendrite patterning in the brain. Nat. Neurosci. , (2011).
- Jia, Y., Zhou, J., Tai, Y., Wang, Y. TRPC channels promote cerebellar granule neuron survival. Nat. Neurosci. 10, 559-567 (2007).
- Huynh, M. A., et al. An isoform-specific SnoN1-FOXO1 repressor complex controls neuronal morphogenesis and positioning in the mammalian brain. Neuron. 69, 930-944 (2011).
- de la Torre-Ubieta, L., Bonni, A. Transcriptional regulation of neuronal polarity and morphogenesis in the mammalian brain. Neuron. 72, 22-40 (2011).
- Calissano, P., et al. Recombinant human insulin-like growth factor I exerts a trophic action and confers glutamate sensitivity on glutamate-resistant cerebellar granule cells. Proc. Natl. Acad. Sci. U.S.A. 90, 8752-8756 (1993).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유