Method Article
In vivo optogenético la estimulación del sistema nervioso central de roedores
En este artículo
Resumen
Optogenetics has become a powerful tool for use in behavioral neuroscience experiments. This protocol offers a step-by-step guide to the design and set-up of laser systems, and provides a full protocol for carrying out multiple and simultaneous in vivo optogenetic stimulations compatible with most rodent behavioral testing paradigms.
Resumen
The ability to probe defined neural circuits in awake, freely-moving animals with cell-type specificity, spatial precision, and high temporal resolution has been a long sought tool for neuroscientists in the systems-level search for the neural circuitry governing complex behavioral states. Optogenetics is a cutting-edge tool that is revolutionizing the field of neuroscience and represents one of the first systematic approaches to enable causal testing regarding the relation between neural signaling events and behavior. By combining optical and genetic approaches, neural signaling can be bi-directionally controlled through expression of light-sensitive ion channels (opsins) in mammalian cells. The current protocol describes delivery of specific wavelengths of light to opsin-expressing cells in deep brain structures of awake, freely-moving rodents for neural circuit modulation. Theoretical principles of light transmission as an experimental consideration are discussed in the context of performing in vivo optogenetic stimulation. The protocol details the design and construction of both simple and complex laser configurations and describes tethering strategies to permit simultaneous stimulation of multiple animals for high-throughput behavioral testing.
Introducción
La optogenética ha revolucionado la neurociencia a nivel de sistemas en la búsqueda de los elementos del circuito neural que impulsan los estados de comportamiento normales y relevantes de la enfermedad. El descubrimiento de que las opsinas microbianas sensibles a la luz 1 podrían expresarse funcionalmente en células de mamíferos proporcionó la plataforma para el uso de la luz para obtener el control sin precedentes de la actividad neuronal con alta precisión espacial y temporal 2. A diferencia de los enfoques electrofisiológicos o farmacológicos tradicionales a la manipulación de la actividad neuronal, la optogenética permite el control de tipos de células específicas (basado en la proyección genética identificar o espacial) dentro de las poblaciones heterogéneas y en escalas de tiempo fisiológicamente relevantes. La posterior introducción de una interfaz neural óptica proporciona una herramienta práctica para la entrega de la luz a comportarse animales 3. Esto ha permitido a la modulación en tiempo real de los circuitos neuronales definidas en roedores comportándose despierto con el fin de probar la causalpapel de estos circuitos neuronales en el gobierno de los estados de comportamiento relacionados con la enfermedad neurológica y psiquiátrica 4-6. La optogenética, por lo tanto, representa una poderosa herramienta para la introducción en cualquier laboratorio interesado en investigar la relación funcional entre la actividad cerebral y medidas conductuales o fisiológicos en modelos animales.
El éxito del diseño y la realización de un experimento optogenética implica varios pasos y consideraciones (ver Figura 1). El objetivo del protocolo actual es proporcionar a las personas con las herramientas y componentes, junto con los conocimientos teóricos y prácticos, necesarios para llevar a cabo la estimulación optogenética en roedores comportándose despierto. Actualmente, existen dos rangos de longitud de onda predominante utilizado para activar los canales de opsina microbianos: en los espectros azul (comúnmente 473 nm) y los espectros de color amarillo-verde (comúnmente 532 o 591 nm). Ambos láseres y diodos emisores de luz (LED) se pueden utilizar como fuentes de luz para dEliver longitudes de onda específicas de la luz en el tejido cerebral. La luz no coherente emitida por los LEDs, sin embargo, hace que la transmisión eficaz de la difícil luz cuando el acoplamiento en las pequeñas fibras básicas requeridas para la estimulación in vivo de los roedores. Decidir sobre el conjunto de láser apropiado es un paso inicial crucial y dependerá del uso previsto de la optogenética en el laboratorio. El protocolo actual se describen dos configuraciones básicas que difieren en su facilidad de montaje y uso: láseres pre-acoplado individuales y sistemas de doble láser (ver Figura 2). Sistemas láser individuales que están pre-acoplados por el fabricante son esencialmente listos para ir a su llegada con poca o ninguna configuración requerida, pero tienen el inconveniente de un mínimo de personalización del usuario final. Un sistema láser dual permite la entrega de dos longitudes de onda diferentes por la misma fibra. Esto será cada vez más importante con el advenimiento de la optogenética combinatoria mediante el cual diferentes longitudes de onda se pueden utilizar para activar / inhibir la distincióntipos de células T que son espacialmente co-localizado. Este es también esencial para el uso con opsinas función de paso bi-estables donde se inician y se termina por la luz azul y amarillo, respectivamente, el 7,8 fotocorrientes. Sistemas de láser dual también son personalizables como el usuario puede agregar o quitar componentes (por ejemplo, persianas exteriores, filtros de haz, medidores de energía en línea) de la trayectoria del haz como se requiere. Debido a su versatilidad, se recomienda el láser dual configuración si la optogenética va a ser una herramienta continua utilizada en el laboratorio. El acoplamiento de los láseres, sin embargo, puede presentar un reto y así un mecanismo de acoplamiento rápido, fácil y fiable es proporcionado en este protocolo. Nota, este protocolo se detalla el conjunto de componentes ópticos y utiliza cables de conexión y componentes que están optimizados para fibras multimodo salto de índice con un núcleo de 200 micras y una apertura numérica (AN) de 0,22. Diferentes tamaños de núcleo y NA están a la venta, sin embargo todos los componentes idealmente deben coincidir en términos de núcleotamaño y NA para evitar la pérdida de luz en los puntos de conexión de fibra. Alternativamente, en una conexión de fibra, la luz puede pasar de una pequeña a una testigos de mayor tamaño; y / o de un menor-NA a una fibra de alto NA sin pérdida adicional.
Tethering se proporcionan estrategias que permiten la estimulación simultánea de múltiples ratones para las pruebas de comportamiento de alto rendimiento. Los protocolos proporcionados asumen uso de fibras implantables crónicas para las pruebas de comportamiento, pero pueden ser modificadas para protocolos de estimulación agudos. Fibras aguda implantados son ventajosos para combinar la estimulación optogenético con la manipulación farmacológica, ya que la misma cánula se puede utilizar para administrar fármacos y la punta de una fibra óptica en la misma ubicación. El uso de fibras crónicamente implantados-es, sin embargo, muy recomendable para los de varios días las pruebas de comportamiento, ya que reduce el daño tisular asociado a la inserción repetida y la eliminación de las fibras y aumenta la exactitud de la colocación consistente de fibra parailuminación tejido 3. Cuando se combina con las configuraciones de inmovilización descritos aquí, el comportamiento se puede grabar de forma fiable a través de múltiples días. Mes De hecho, la transmisión de luz fiable ha informado después de la implantación de la fibra 9 de tal manera que la estimulación crónica y paradigmas de pruebas de comportamiento pueden, en teoría, se llevarán a cabo a través de múltiples días y semanas. Notas adicionales sobre los componentes de hardware se han añadido al protocolo para permitir la elección lector en el mejor producto que se adapte a sus necesidades individuales, incluyendo alternativas rentables y productos que se pueden hacer en casa. También se proporcionan consejos importantes que son útiles durante la instalación e implementación.
Protocolo
! ATENCIÓN: Este protocolo implica el uso de rayos láser de clase 3B y requerirá directrices de formación y de seguridad adecuadas a seguir. Las gafas de seguridad deben ser usados en todo momento cuando se opera el láser, con los procedimientos de alineación que presenta un riesgo especialmente alto. Póngase en contacto con el proveedor de láser para determinar las gafas que proporcionará una atenuación máxima para un láser determinado. Si está disponible, inscribirse en un curso de capacitación en seguridad láser institucional. Nunca utilice un láser sin las gafas de seguridad adecuado y la formación.
1. Los aparatos láser Set-up
En su caso, pasos en la Sección 1 se designan como (A) o (B) para diferenciar entre sistemas de láser único o doble, respectivamente.
- Coloque y asegure el láser para la placa. Breadboards son excelentes conductores de calor y actúan como un disipador de calor para evitar daños a los componentes internos de láser con el uso prolongado.
- (A) Asegure el las-pre acopladoer a un 10 "x 12" breadboard (o según se requiera) mediante ¼-20 "tornillos y arandelas (Figura 2). Si los agujeros breadboard no se alinean con los agujeros de montaje de láser, use pequeñas 'pinzas de mesa' para asegurar láser para cortar el pan.
- (B) Si los 2 láseres para ser utilizados tienen muy diferentes alturas de los haces (> ~ 1 cm), utilice los pequeños de 4 "x 6" placas universales para crear una plataforma para que uno de los láseres. Coloque estas tablas con los principales grandes de 12 "x 18" tablero usando ¼-20 tornillos de cabeza "con arandelas, luego coloque el láser a los tableros más pequeños usando tornillos o abrazaderas de mesa como se muestra en la Figura 2B. Conecte el otro láser directamente al tablero usando tornillos de cabeza o una pinza para mesa de altura variable.
Paso Crítico: Breadboards, tornillos y componentes ópticos se pueden comprar como imperial o métrico así que sea consistente en la compra de artículos; las preferencias para este protocolo es imperial. - (A)Adjuntar una gruesa con camisa-Cleave plana / contacto físico (FC / PC) cable de conexión al acoplador (referido como un cable de acoplador; véase la Figura 3) que está conectado físicamente a la parte delantera del láser (Figura 2A).
- (B) Enrosque el acople a un ¾ "post óptica, entonces epoxi la articulación entre el acoplador y la parte superior del poste utilizando JB Kwik, o epoxi similares, para evitar que se afloje y desalineación durante el uso. Conecte el correo a la protoboard (como los agujeros breadboard no siempre se alinean con la colocación necesaria de componentes ópticos, un titular del puesto, adaptador de la base del pedestal, y sujetar tenedor se utiliza para asegurar posterior óptico del acoplador en su lugar). Fije un cable de conexión de espesor encamisado (cable de acoplador) a la parte posterior del acoplador.
- (B) Inserte el primer espejo de orientación para el láser azul en el soporte de cinemática, y adjuntarlo a la mesa óptica utilizando un ¾ "post óptica. Conecte esta entrada a una base de ADAPter y tenedor de sujeción. Coloque el tenedor de sujeción y Publicación de montaje directamente en frente del láser azul con espejo un ángulo de 45 ° para dirigir el láser hacia el espejo dicroico. Utilice el patrón de rejilla de agujeros en el tablero como guía alineación aproximada. Una vez colocado más o menos, utilizar un tornillo de ¼ "-20 tapa para asegurar el tenedor de sujeción de la mesa óptica (ver Figuras 2B, C).
- (B) Inserte el espejo dicroico en un soporte cinemático y adjuntarlo a un "post óptica 1 y segura directamente a la placa. Coloque el espejo dicroico en el extremo izquierdo de, y en línea con el espejo del laser azul. Ángulo del espejo dicroico en un ángulo de 45 ° de tal manera que la luz azul se reflejaba en el primer espejo se refleja en el acoplador y apriete el tornillo que sujeta el soporte cinemática al poste (véase las figuras 2B, C).
- (B) Una el primer espejo de dirección para el láser de color amarillo a un ¾ "post óptica. Conecte el optipuesto de cal a un adaptador de base y tenedor de sujeción. Coloque el tenedor de sujeción y post-ensemble directamente delante del láser de color amarillo y el ángulo del espejo en un ángulo de 45 ° de tal manera que la luz amarilla se dirige hacia el segundo espejo de dirección. Asegure el tenedor de sujeción en su lugar con un ¼ "-20 tornillo y una arandela.
- (B) Conecte el segundo espejo de orientación para el láser de color amarillo a un "post óptica 1. Ángulo del espejo de tal manera que el haz de luz amarilla de la primera espejo se refleja a través de la dicroico y en el acoplador (Figura 2C). Asegure el puesto directamente al tablero y apretar el tornillo de montaje una vez que el espejo es en ángulo de manera apropiada. Ajustes de los espejos Bellas se realizarán utilizando los soportes de los espejos cinemáticos en un paso posterior.
- (B) Coloque una rueda de filtros de densidad neutra a un ¾ "post óptica y coloque el poste en un soporte posterior unida a una base de montaje. Fije el conjunto de la protoboard entre la primera y la seespejos amarillos cond utilizando un solo ¼ "-20 tornillo. Esta rueda se utiliza para ajustar la potencia de la luz láser de color amarillo alcanzar el acoplador.
Consejo: Individualmente apretar todos los componentes (como los tornillos que sujetan los titulares espejo cinemáticas a la parte superior de los postes, y los hilos que sostienen adaptadores de base para el final de las entradas) antes de conectar a la base. Use un eje de una pequeña llave hexagonal en los orificios pasantes previstos en mensajes ópticos para obtener suficiente torque. Esto evitará que los componentes se aflojen durante el uso, lo que exige la realineación. - Adjunte una FC / PC al adaptador soporte en L / PC FC a la placa.
- Opcional: Asegurar un 1 x 2 50/50 Mini divisor de fibra de cubo directamente a la mesa óptica para la estimulación simultánea in vivo de dos o más animales. Además, los mangos se pueden agregar para ayudar en el movimiento del conjunto de tablero (como se ve en la Figura 2A).
2. láser Coupling (Acoplamiento Estilo sin contacto)
Esta sección se refiere a la de doble láser configuración (Figura 2B). Alinear la ruta de láser azul interior antes de la alineación de la trayectoria de láser de color amarillo exterior.
! PRECAUCIÓN: Use un acoplamiento de potencia de luz baja (~ 1 mW) para garantizar la seguridad de los ojos. Use gafas de seguridad para encender el láser y hasta que la intensidad de luz se mide y se considerará seguro.
- Ajuste los interruptores en la parte posterior del láser para "Curr" (actual) y el modo de lógica transistor-transistor (TTL) + para la iluminación constante (en oposición al modo analógico). Asegúrese de que el botón de encendido en la parte frontal del conductor se fija en cero. Encienda el láser activando el controlador antes de la llave de láser.
- Ajuste lentamente la perilla de encendido situado en la parte frontal del controlador de láser de manera que se está emitiendo la luz láser ~ 1 mW. Espere 10 a 15 minutos (o según lo especificado por el fabricante) para el láser para calentar.
- Conecte el probador de cable de fibra óptica directamente a la frefinal e de la cuerda de remiendo acoplador y encienda el analizador de cables (Figura 3A). Ajuste el ángulo del acoplador de manera que el haz de luz roja se desplaza hacia atrás hacia el centro del espejo dicroico. La trayectoria de los rayos de la luz roja emitida por el analizador de cables es la ruta exacta que tendrá la luz de láser entrante a seguir para ser acoplado en el láser.
- Realizar una alineación aproximada: Utilice los mandos laterales y horizontales en los espejos cinemáticas para dirigir el haz de luz láser en el acoplador. Las abrazaderas de pedestal pueden necesitar ser aflojado para reposicionar ligeramente los espejos y el acoplador. Los soportes cinemáticos todavía deben tener un cierto recorrido disponible para más ajustes finos. No se preocupe si no hay luz azul es que se emite fuera del patch cord acoplador conectado en este momento.
- Coloque una sola hoja de papel semi-transparente directamente en frente del espejo dicroico, entre la dicroica y acoplador. Habrá tanto un azul y ared punto en este documento desde el láser y el comprobador de cable, respectivamente. Utilice papel que esté transparente suficiente para ver tanto los puntos rojos y azules simultáneamente desde el mismo lado del papel.
- Realiza ajustes precisos en el primer espejo de dirección (es decir, la más cercana al láser, no la dicroica) ajustando cuidadosamente los mandos laterales y horizontales para alinear el centro del punto rojo con el punto azul.
- Mover el papel hacia el acoplador de modo que está directamente en frente del acoplador y ajustar las perillas en la segunda (es decir, dicroico) espejo para alinear el haz láser con el haz de luz roja.
- Iterar sobre los pasos 2.6 y 2.7 hasta que el centro de las vigas de color azul / amarillo y rojo están alineados exactamente en ambas posiciones (es decir, hasta que los rayos rojos y azules son colineales).
- Retire el analizador de cables del cable del acoplador. La luz del láser debe ahora ser emitida desde el extremo del cable de conexión acoplador.
- DETERMIeficiencia de acoplamiento ne mediante la medición de la potencia de luz emitida desde la punta de la fibra del cable de conexión acoplador usando un medidor de potencia. Use el ajuste de 500 mW en fotodiodo del medidor de potencia y cambie la configuración (λ) de longitud de onda a azul (473 nm) o amarillo pálido (635 nm) del espectro en función del láser que se utiliza.
- Coloque la punta de la fibra perpendicular al fotodiodo para obtener una lectura de la potencia. Comparación de la potencia de luz que entra en el acoplador a la potencia de la luz emitida desde el extremo de la fibra. Una eficiencia de acoplamiento de> 80% se considera muy bueno. Muy pequeños ajustes adicionales del segundo espejo de dirección puede mejorar a veces un poco de acoplamiento. En general, cuando el patrón del haz desde el extremo de la fibra de acoplamiento es un lugar pequeño, apretado, central (sin anillos que lo rodean), el acoplamiento de la eficiencia en el núcleo de la fibra es óptima.
- Repita los pasos 2.1 a 2.11 para el acoplamiento láser de color amarillo, excepto usar los dos espejos de orientación para el láser de color amarillo (ver Figura 2C). No hacert ajuste se perderá la posición del espejo dicroico o alineación del láser azul.
3. En vivo optogenético Estimulación
Asegúrese de que cualquier procedimiento que implique el uso de animales se realicen de conformidad con las directrices locales y nacionales y aprobados por el correspondiente Institucional Cuidado de Animales y el empleo Comisión.
- Fibra óptica de configuración (véase la Figura 3B para la identificación de los diferentes tipos de cables de conexión hace referencia más adelante). Para estimular un solo ratón, conecte el cable de conexión del acoplador a un cable de conexión de espesor con camisa usando la FC / FC adaptador de soporte en L que dependerá directamente del tablero (véase la Figura 4A). Estimular dos animales de un láser, conecte el cable de conexión de acoplamiento a dos latiguillos de espesor con camisa con el 1 x 2 50/50 Mini cubo (ver Figura 4B). Estimular tres o más animales, conecte el cable del acoplador a un divisor de fibra multimodo con el 1 x 2 mcubo ini ya unida al tablero (ver Figura 4C).
- Adjuntar un / junta rotativa colector a los extremos libres del divisor parche cable / fibra gruesa camisa. Conmutadores son esenciales, ya que permiten la rotación de la fibra con el movimiento del roedor, que previene la acumulación de torsión en el cable de conexión. El exceso de torque puede torcer los cables, conducir a la rotura, e interferir con el movimiento natural del animal durante la prueba.
- Conecte el cable de conexión de los animales para el colector.
- Adjuntar un manguito hendido que conecta al extremo libre virola metálica del cable de conexión de los animales (Figura 5). No fuerce la manga de todo el camino hasta la férula; dejan ~ 0,5 cm de la manga expuestos como esto es lo que se conecta a la fibra óptica implantado colocada en el animal (Figura 6).
Paso Crítico: comprar siempre mangas que contienen una fracción para permitir la expansión de la manga sobre férula de fibra implantado durante la conexión yremoción. Demasiado apretado de un ajuste puede causar trauma severo al animal si el implante se desplaza desde el cráneo al intentar desconectar el manguito del implante. Si esto ocurre, el animal debe ser retirado del estudio y recibir atención veterinaria inmediata. Del mismo modo, antes de usar un nuevo manguito por primera vez, "romper en 'conectar y desconectar por un casquillo hasta que se desconecte con la cantidad deseada de la fuerza.
Consejo: Es fácil de romper una fibra mientras se quita un manguito que está estrechamente unido a un casquillo. Para evitar esto, empujar la férula a cabo mediante la inserción de una pequeña varilla de madera en el extremo abierto del manguito (el mango de un hisopo de algodón estándar es el tamaño adecuado). - Conectar el controlador de láser azul para un generador de impulsos mediante un cable BNC y gire el generador de impulsos en.
- Poner gafas de seguridad apropiadas en. Ajuste los interruptores en la parte posterior del láser y a modo de "Curr" "TTL +". Asegúrese de That el botón de encendido en la parte frontal del conductor está en cero andturn el láser (gire el conductor en primer lugar y luego la tecla láser).
- Ajuste el botón de encendido en la parte frontal del láser de modo que de 5 - 10 mW está siendo emitido desde la punta de fibra cable de conexión de los animales como se mide usando un medidor de potencia de luz. De 5 - 10 mW es una pauta general - la intensidad de la potencia exacta requerida para afectar a un determinado volumen de tejido debe ser calculada antes del inicio del experimento, como en Aravanis et al 3.
- Encienda el láser azul en el modo "analógico" para la estimulación in vivo. Nota: Los láseres de DPSS amarillas son operados en TTL + modo de iluminación constante. Espere 10-15 minutos para que el láser se caliente.
- Frenar suavemente el ratón y conecte el split-manga en el cable de conexión de los animales a la fibra implantable crónica (ver Figura 6). Asegúrese de que los extremos de ambas fibras hacen contacto físico uno con el otro. Utilice la división en el manguito de conexión comoventana para visualizar el contacto directo entre los dos Paso crítico:. A veces, los desechos pueden acumularse en el casquillo de metal de la fibra implantable del animal e interferir con la conexión apropiada. En este caso, utilice una mezcla de etanol toallita para limpiar suavemente la férula en la cabeza del animal antes de la fijación. Nunca fuerce un manguito de conexión sobre el casquillo ya que esto puede causar un golpe severo en el animal. Si una conexión física entre extremos de las fibras no se puede hacer después de la limpieza, retire el animal del estudio.
Consejo: fugas de luz puede ocurrir en el punto de conexión entre el cable de conexión de fibra implantado y animal. La visualización de esta luz por los roedores puede presentar un factor de confusión experimental 10. Tubo de contracción por calor se puede conectar a los cables de conexión y se deslizó sobre el punto de conexión para reducir al mínimo la luz extraña. - Permitir que el ratón para recuperar durante unos minutos antes del inicio de las pruebas de comportamiento.
Consejo: Degún la prueba de comportamiento para ser administrada, lo mejor es habituar a los ratones el proceso de conexión y tethering 2-3 días antes, como el manejo necesario para conectar el animal puede inducir estrés y confundir a las pruebas de comportamiento. - Coloque el ratón en el aparato de pruebas de comportamiento asegurar que el cable conector está libre de obstáculos. Nunca deje a un animal sin vigilancia durante la estimulación. Incluso con el uso de conmutadores, cables de conexión no tienen una tendencia a torcer durante largos períodos de tiempo y pueden interferir con las pruebas de comportamiento.
- Utilice un generador de impulso a impulso del láser azul a una frecuencia predeterminada que activará la opsina de elección. Para el uso del láser de color amarillo: el pulso del láser de color amarillo con persianas exteriores o simplemente bloqueando la trayectoria del haz con un no reflexivo objeto opaco, y no inflamable.
4. Publicar en vivo Consideraciones de estimulación
Esta sección no pretende ser una proto completacol, pero se ofrece como una guía para los procedimientos adicionales que deben ser considerados siguiente en vivo estimulación optogenética.
- Al término de un experimento, confirmar viral y fibra histológicamente colocación para una interpretación precisa de los resultados conductuales. La eutanasia a los animales según las directrices institucionales y perfundir el animal con solución salina helada tamponada con fosfato (PBS) y 4% (w / v) de paraformaldehído en PBS.
- Retire implantado fibra óptica sujetando firmemente el casquillo de metal expuesta con alicates o pinzas. Tire hacia arriba en un suave, pero rápido, movimiento. Es importante para probar la integridad de la fibra implantado mediante la medición de la salida de luz al final de cada experimento.
- Post-fijar los cerebros en paraformaldehído durante al menos 24 - 48 h antes de seccionar a través de la región de interés. (Si usa un micrótomo de congelación, incubar cerebros en una solución de sacarosa al 30% durante varios días antes de seccionamiento). Realizar inmunohistoquímica utilizando standaRd protocolos para la detección de los fluoróforos opsina de etiquetado apropiados, es decir, proteína verde fluorescente (GFP), el aumento de la proteína fluorescente amarilla (eYFP) o mCherry.
- Visite el sitio de expresión de opsina y de implantación de fibras bajo el microscopio y confirmar visualmente la colocación apropiada de la inyección de virus e implante basado en coordenadas elegidas.
Resultados
Comportamiento resultados obtenidos in vivo con estimulación optogenética dependen por completo en el circuito neural ser blanco, el modelo animal utilizado, los parámetros de modulación. Para los propósitos demostrativos actuales, las neuronas de dopamina en el área tegmental ventral, o VTA, de la tirosina hidroxilasa :: Cre ratones fueron transducidas con un opsina-función de paso estable (SSFO) 8, o el virus de control (eYFP), y un implante de fibra era crónicamente implantado. El uso de TH :: Cre ratones transgénicos asegura que opsina expresión está restringida a las células TH + (dopamina) en el VTA. La Figura 7 representa los resultados de comportamiento representativos obtenidos usando la corriente de láser configuración descrita para la estimulación simultánea de múltiples ratones. Aquí, los ratones fueron atados y estimulados al mismo tiempo utilizando láseres separados (3 ratones / láser como en la figura 4C) y el comportamiento locomotor se registró durante 1 hr. La estimulación repetida de las neuronas de dopamina en el VTA resultó en unafenotipo hiperactivo que persistió durante toda la duración de la estimulación. No hay cambios en el comportamiento locomotor se observó en ratones eYFP (ver video 1). Después de las pruebas de comportamiento, se realizó inmunohistoquímica para verificar la orientación precisa viral a las neuronas de dopamina VTA y colocación de fibras se confirmó visualmente (véase la Figura 7).
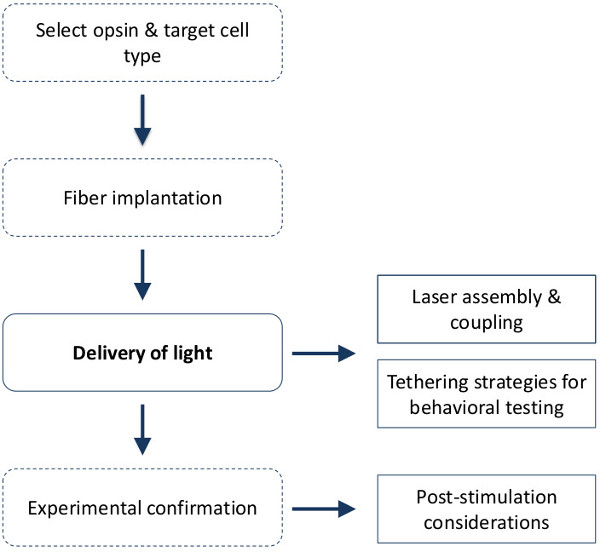
Figura 1. pasos experimentales in vivo para la estimulación optogenética. Hay cuatro pasos generales involucrados en el diseño y la realización en vivo estimulación optogenética. Este protocolo se detallan específicamente los pasos involucrados en la entrega de luz de una fuente de luz láser a las estructuras cerebrales profundos en el roedor comportarse e incluye 1) montaje del sistema láser y de acoplamiento de luz; 2) estrategias de inmovilización para conexión varios animales a una fuente de luz para las pruebas de comportamiento de alto rendimiento y 3) proporciona directrices para confirmar la estrategia de focalización para la entrega de luz - un paso que es esencial para la interpretación de los datos. Nota: aunque este protocolo no es exclusiva de fibras implantables crónicas con fines inmovilización, se recomienda y asumió al combinar la estimulación optogenética con las pruebas de comportamiento. Ver tanto Ung y Arenkiel, 2012 18 y Esparta et al., 2012 9 para la producción e implantación de fibras ópticas crónicas de la casa. Las líneas continuas = pasos cubiertos en este protocolo.

2. Sistemas Figura láser utilizados para la estimulación in vivo optogenética. (A) sistema láser único para la estimulación in vivo. Este láser es ph ysically pre-acoplados por fabricante y requiere poca usuario final set-up. (B) Sistema de láser dual. Dos láseres están acopladas en una sola fibra a través del uso de espejos que actúan para dirigir cada trayectoria del haz en un acoplador de estilo no-contacto. Esta es la configuración como componentes ópticos pueden eliminarse o añadirse según sea necesario, pero presenta más de un desafío en términos de acoplamiento láser eficiente. (C) Esquema más versátil de sistema láser dual se muestra en (B) indica la colocación de rayos láser y espejos con la trayectoria del haz de luz láser correspondiente (flechas) se representa. Aquí, el espejo dicroico "D" se utiliza para desviar las longitudes de onda azules de la luz, mientras que la transmisión de longitudes de onda de color amarillo hasta el acoplador de "C" y en el acoplador de cable de conexión adjunto. B = láser azul; C = acoplador tipo sin contacto; D = espejo dicroico; FW rueda = filtro; M = Espejo; Y = láser de color amarillo.conseguir = "_ blank"> Haga clic aquí para ver una versión más grande de esta figura.

Figura 3. probador (A) Cable utilizado en el protocolo de acoplamiento no físico inferior:. Probador de cable conectado directamente a un cable de conexión. Insertar representa el punto de conexión del tester al cable cables (B) de parches mencionados a lo largo de protocolo De externa a interna:.. Multimodo divisor de fibra, cable de conexión animal negro con camisa blanca con manga zirconia división unida al-pegue plana final (FC), cable de conexión de espesor con camisa (también referido como un "cable de acoplador"). Latiguillos de espesor con camisa están recubiertos con cloruro de polivinilo (PVC) tubo para mayor protección. Para estos cables, códigos de color estándar de la industria se utilizan para distinguir entre los diferentes tipos de fibras, donde naranja = fibra multimodo. Latiguillos Animal son más delgada camisa para mayor flexibilidad en el movimiento de los animales durante las pruebas de comportamiento. Tenga en cuenta que el polvo tapas se colocan en los extremos FC / PC cuando los cables no están en uso. Haga clic aquí para ver una versión más grande de esta figura.

Figura 4. Estrategias para Tethering en vivo estimulación optogenética de (A) un solo animal, (B) dos animales; . (C) tres o cuatro animales configuraciones posibles no se limitan a los mostrados arriba - varias configuraciones son posibles a través de la combinación única de adaptadores, divisores de fibra, y la ramificación cables de conexión que están disponibles comercialmente o por orden de encargo. Nota: Los cables de conexión y los divisores de fibra contienen conectores FC / PC en ambos extremos (sólo uno de los extremos se representa).ww.jove.com/files/ftp_upload/51483/51483fig4large.jpg "target =" _ blank "> Haga clic aquí para ver una versión más grande de esta figura.

Figura 5. Conexión correcta e incorrecta (rojo x) de un cable de conexión a una fibra óptica implantable utilizando una manga dividida. (Panel izquierdo) Un zirconia split-manga se utiliza para conectar un cable de conexión a la férula de una fibra óptica implantable (que se muestra aquí no fijada a un animal). Flecha apunta al punto de conexión entre el cable de conexión y implantable de fibra óptica. Comparar con (panel derecho), donde existe una brecha entre el cable de conexión y implantable de fibra óptica, como se visualiza a través de la división del manguito de conexión. Tenga en cuenta la fuga de luz que puede ocurrir con una conexión incorrecta (inferior derecha). Pieza de fondo en upper panel de la izquierda muestra los componentes individuales utilizados. De arriba a abajo de inserción: cánula de fibra óptica implantable dórico, blanco zirconia split-manga, al final cleeve plana (FC) de un cable de conexión animal negro con camisa (cable de conexión completa se muestra en la Figura 3B). En todos los paneles, tenga en cuenta que el manguito de conexión no está a ras con el extremo del FC cable de conexión. Deja ~ 0.5 cm de un exceso de colgar para la conexión a la fibra óptica implantable colocada en el animal. Haga clic aquí para ver una versión más grande de esta figura.

Figura 6. lateral (izquierda) y frontal (derecha) vista de un ratón con una fibra óptica implantada conectado a un cable de conexión. Utilice la división en el manguito de conexión para ayudar a visualizar la conexión correcta del cable de conexión to el casquillo de la fibra óptica implantado. El punto de conexión se destaca por un cuadro de trazos de color rojo y también se representa en el inserto superior. Haga clic aquí para ver una versión más grande de esta figura.
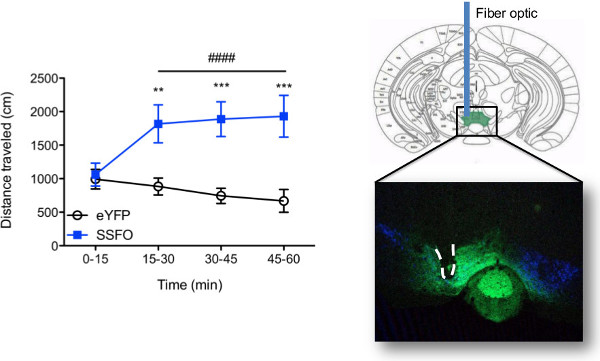
Figura 7. Los resultados representativos. (Izquierda) lectura del comportamiento in vivo de estimulación optogenética. Ejemplo de comportamiento que se puede obtener usando el láser descrito set-up y el protocolo de inmovilización. La actividad locomotora se grabó durante la estimulación optogenético del área tegmental ventral (VTA) en la tirosina hidroxilasa (TH) :: Cre ratones (n = 7 - 8 / grupo) transducidas ya sea con una opsina paso a función (AAV5-DIO-SSFO-eYFP ) o el control de virus (AAV5-DIO-eYFP) en el VTA. Grupos de tres ratones fueron atados simultáneamente a un sololáser tal como se representa en la Figura 4C y se estimularon con un pulso de 5 seg de 447 o 473 nm de luz entregada una vez cada 15 min. Medidas repetidas de dos vías ANOVA reveló una interacción significativa grupo x tiempo (F 3,39 = 15,27, p <0,0001) y un efecto principal significativo de tiempo (F 3,39 = 4,67, p = 0,007) por el cual la estimulación optogenética aumentó la actividad locomotora sólo en ratones SSFO (post-hoc de Bonferroni p <0,0001, relativa a t = 0 - 15 bin tiempo) resultando en un aumento global en la actividad locomotora en comparación con los ratones EYFP (efecto principal de grupo: F 1,39 = 10,69, p = 0,0061; Bonferroni post hoc p <0,01 en t = 15 - 30 y p <0,001 en t = 30 - 45 y t = 45 - 60). Ficha de fibra: 200 micras centrales, 0,22 NA. Luz irradiancia = 6-66 mW / mm 2, que corresponde a la distancia de punta de fibra de 0,1 - 0,6 mm desde el sitio viral de la inyección con el poder de la luz 5 mW emitida a punta de fibra antes de la inmovilización. Las barras de error representan el error estándar de la media. eYFPvs. SSFO: ** p <0,01; *** P <0,001; efecto del tiempo: #### p <0,0001 (Derecho) confirmación histológica de colocación viral y de fibra óptica.. Imagen de fluorescencia confocal adquirida en un microscopio láser de barrido Leica TCS SP5 se utiliza para visualizar la colocación de la fibra (de línea de puntos) y la expresión mediada por virus (verde) en el área tegmental ventral del ratón después de la estimulación in vivo optogenético. Las neuronas de dopamina (TH +) se ven en azul. Por favor, haga clic aquí para ver una versión más grande de esta figura.
Vídeo 1. En vivo estimulación optogenética:. Hiperactividad durante VTA estimulación utilizando SSFO en ratones TH :: Cre Por favor haga clic aquí para ver el vídeo.
| Tabla 1. irradiaciones de luz requerida para activar opsinas de uso común. | ||||
| Opsin Variant | λ | Densidad de Potencia (/ mm 2) | Propiedades | |
| Encendido / Apagado Cinética | ||||
| Excitación óptica: channelrhodopsins de acción rápida | ||||
| ChR2 2 | 470 | 1 - 5 mW | 1.21 / 12 ms | Los incendios de hasta 40 Hz |
| Cheta 19 | 490 | 5 mW | 0,86 / 8,5 ms | Los incendios de hasta 200 Hz |
| JEFE 20 | 450 | 1,65 mW | 1.62 / 12 ms | Forma no desensibilizante de ChR2 |
| C1V 18 | 540-630 | 8 mW (540 nm) | 5/34 ms a 540nm | Desplazado-Red |
| 3,2 mW (630 nm) | 67 ms (on) a 630 nm | |||
| Excitación óptica: acción lenta rodopsinas canal | ||||
| Estable función escalón opsina (SFO) 8 | 470/590 | 8 mW (470nm) | 20 mseg / 29 min | Nueva variante OFS; Estado ya abierto. Inaugurado por 470 nm, con cierre de 590 nm |
| Inhibición óptico | ||||
| eNpHR3.0 21 | 560-630 | 3-5 mW | 2,5 ms / <10 ms | Inhibición sostenida durante 30 min 22 con luz constante * |
| ArchT3.0 11, 23 | 520-560 | 1 - 5 mW | 2 / <10 ms | Más sensible con fotocorrientes más grandes que eNpHR3.0 |
| Esta tabla se ofrece sólo como una guía; irradiaciones de luz específicas que se requieren para la modulación neural deben ser confirmados de manera independiente. | ||||
| Validación experimental es importante verificar que la opsina, estrategia de focalización, y parámetros de estimulación de luz modulan actividad neuronal en la forma prevista 5. | ||||
| La densidad de potencia (mW / mm 2) se refiere a la potencia de la luz de iluminación en un área dada de tejido cerebral y no se refiere a la potencia de la luz emitida desde la punta de la fibra. | ||||
| * Utilice siempre la intensidad de luz más baja posible, sobre todo con la estimulación de luz prolongado. | ||||
Tabla 1. irradiaciones de luz requerida para activar opsinas de uso común.
Abreviaturas
AAV = virus adeno-asociado
DPSS = estado sólido bombeado por diodos
EYFP = mayor proteína fluorescente de color amarillo
FC / PC = pegue plana contacto físico /
GFP = proteína fluorescente verde
PBS = salina tamponada con fosfato
PVC = cloruro de polivinilo
mW = milivatios
NA = apertura numérica
SSFO = estable paso a la función opsina
TH = tirosina hidroxilasa
TTL lógica = transistor-transistor
V = voltaje
VTA = área tegmental ventral
Discusión
Los actuales láser descrito set-ups y estrategias inmovilización son compatibles con una amplia gama de pruebas de comportamiento de roedores. De hecho, una variedad de pruebas de comportamiento han sido utilizados siguiendo, o que la acompañan, en vivo estimulación optogenética que incluyen tareas emotivos conducta, condicionamiento de la conducta, aprendizaje y paradigmas de memoria, el sueño, la excitación y las tareas del apetito por nombrar algunos (ver Nieh et al. 6 para un examen exhaustivo). La optogenética ha cambiado la forma de las pruebas tradicionales de comportamiento se realizan en que los estudios de varios días ahora se puede condensar en una sola sesión en la que se compara el comportamiento, dentro de los temas, durante distintas épocas de la luz 'sobre' versus 'off' 5. Compartimentos de destacar que los aparatos de comportamiento que contienen puertas, cerradas u otros obstáculos pueden tener que ser modificado para acomodar el paso de fibras atadas.
La estrategias de inmovilización permiso si se describesimul- estimulación de los ratones múltiple a partir de un único láser. Por lo tanto, las pruebas de comportamiento de alto rendimiento optogenético se puede lograr mediante el uso de múltiples láseres y equipos de prueba. El número de animales que pueden ser estimulados simultáneamente, sin embargo, estará limitada por la potencia de luz máxima que se puede alcanzar en cada punta de la fibra. La salida máxima de potencia en la punta de la fibra depende de la 1) potencia de arranque del láser; 2) eficiencia de acoplamiento y 3) el número de divisiones de haz. Para un láser azul de 100 mW con ~ 80% de eficiencia de acoplamiento y hasta 4 divisiones de haz (como se representa en la Figura 4C), la potencia media en la punta de la fibra puede oscilar entre 5-10 mW cuando se utiliza 200 micras núcleo, 0,22 NA cables de conexión de fibra (nb esperar que la pérdida de transmisión de juntas rotativas para ser <15%). Medición de la producción de luz en la punta de la fibra es esencial para la determinación de potencia de la luz adecuada para la activación opsina como opsinas difieren en su sensibilidad a la luz y por lo tanto la densidad de potencia de luz (mW/ Mm 2) requerida para la activación 11. Por ejemplo, la opsina-función de paso estable (SSFO) actúa como un acumulador de fotones y por lo tanto requiere muy poca densidad de potencia de luz para la activación (<8 mW / mm 2) 8. Compare esto con la rodopsina canal tradicional (ChR2) que requiere un mínimo de 1 mW / mm 2 de la luz para obtener los potenciales de acción 2. Tabla 1 se ofrece como una referencia rápida para conocidos irradiancias mínimas de luz necesarios para activar las opsinas más comunes actualmente en usar. Por último, hay que considerar que la luz se dispersa y absorbe a medida que viaja a través del tejido cerebral de tal manera que se requiere más potencia de luz para las estructuras cerebrales profundas 3. Un recurso útil en línea está disponible en http://www.stanford.edu/group/dlab/cgi-bin/graph/chart.php que calcula la intensidad de la luz a diferentes profundidades a través de tejido cerebral, teniendo encuenta el tamaño del núcleo de la fibra, apertura numérica, longitud de onda de la luz utilizada y la potencia de la luz a partir de la punta de la fibra. Para una excelente revisión de los principios teóricos que subyacen a estos cálculos, consulte Foutz et al. (2012) 12. Ejemplos de cómo aplicar estos principios y cálculos para el diseño experimental se demuestran en Aravanis et al. (2007) 3 y Tye et al. (2012) 13. Realizar estos cálculos antes del inicio de un experimento es crucial para asegurar la irradiación de luz adecuada para la activación opsina. Teniendo en cuenta estas consideraciones, es ventajoso para comprar láseres de mayor potencia para asegurar la potencia adecuada. Los láseres con una potencia entre 100 a 200 mW son generalmente suficientes para compensar las fibras del núcleo pequeños, la división de fibra múltiple, la ineficiencia de acoplamiento y transmisión pierde 7. Si el uso de láseres de alta potencia, sin embargo, se debe tener cuidado para evitar daños en los nervios o el calor y la luz-asociadod artefactos que pueden ocurrir con prolongada y / o alta iluminación luz accionada 7. Un rango seguro para los experimentos in vivo es de hasta 75 mW / mm 2. 14
La decisión sobre el tipo de láser para la compra puede ser un asunto complicado, ya que hay muchos factores a considerar. Por ejemplo, los láseres de diodo directos proporcionan salida pulsada más estable y repetible de hacer de estado sólido (DPSS) láseres de diodo-bombeado, y son más fiables en el tiempo en un entorno de laboratorio. En algunos casos, sin embargo, los láseres de diodo directos pueden emiten una potencia de la luz inferior, ~ 0,1 mW, incluso cuando la tensión de comando es 0 V debido a un sesgo de corriente constante de ser enviado al diodo por la electrónica de control del láser. Esta emisión "espontánea" tiene un espectro más amplio que hace emisión láser desde el mismo láser, por lo que se puede reducir específicamente mediante la instalación de un paso de banda estrecha (o 'limpieza') filtro entre el láser y el acoplador (véase lista de piezas). Este filtro tambiénreducir la producción de energía por ~ 50% cuando la acción láser, por lo que la compra de un láser de mayor potencia en consecuencia. Cabe señalar que los láseres de DPSS amarillas son extremadamente sensibles y pueden comportarse de forma errática y han reducido vida útil si rápidamente modulada por un generador de impulsos. El ajuste de la potencia del láser de color amarillo se debe hacer a través de ruedas de filtros de densidad externos colocados en la trayectoria del rayo (sección 1.7) mientras opera el láser en modo TTL +. Por otra parte, la compra de un verde 532 nm láser DPSS es una alternativa rentable que puede activar ambas halorhodopsins y archaerhodopsins.
La apertura numérica (NA) de una fibra es importante considerar en el diseño y la compra de componentes de fibra de conjunto de láser puesta a punto. El NA de una fibra óptica determina los ángulos de los rayos de luz que pueden ser aceptados y se emite en el extremo de una fibra. Si una fibra de alto NA está acoplado a una fibra inferior-NA, pérdida significativa ocurrirá en dicha interfaz, por lo que es importante ser consistente wi º fibra NA dentro de una sola configuración (o para asegurar que NA aumenta a lo largo de la trayectoria de la luz). El efecto de la fibra NA en el volumen de tejido cerebral de iluminación es menos importante, ya que el tejido cerebral es altamente dispersante, y puesto que la luz acoplada a partir de una fuente de láser tenderá a elevada AN fibras underfill ''; Sin embargo fibras ópticas con una NA de 0,22 y 0,37 se utilizan comúnmente. Del mismo modo, el acoplamiento de un mayor núcleo de una fibra más pequeño núcleo también se traducirá en pérdidas significativas, por lo que siempre asegúrese de usar diámetros de núcleo cada vez mayores o iguales al progresar desde la fuente de láser para el implante animal. En términos generales, extremos de la fibra siempre deben estar tapados cuando no esté en uso para evitar que el polvo y acumulación de partículas. Es una buena idea para regular extremos de las fibras limpias y conectores (70% de alcohol isopropílico funciona bien) para asegurar la salida de potencia de luz máxima, y para probar la salida de potencia de la luz a través de un "implante simulado 'antes de comenzar los experimentos de cada día.
"> Durante las pruebas de comportamiento, es imperativo que se tomen medidas para controlar los efectos de la infección viral, expresión de la proteína exógena, la luz visible, y los posibles efectos de calentamiento de tejidos y artefactos sobre el comportamiento animal. Por lo tanto, el grupo de control adecuado debe consistir en animales transducidas con un virus de control (por ejemplo, GFP, eYFP, mCherry) que reciben parámetros de estimulación luz idénticas. La verificación experimental es un paso final crucial ya que los datos de comportamiento utilizados para el análisis es totalmente dependiente de la opsina y la colocación de fibra óptica en la región de interés . Específicamente, en los animales cuando se detecta ninguna señal de inmunohistoquímica, o donde la colocación de la señal o de fibra no está en la región de interés, los datos a continuación de comportamiento para que los animales deben ser retirados de el experimento. Además, es esencial para probar la salida de luz en la punta de fibra, tanto antes de la implantación quirúrgica y de nuevo post mortem para asegurar potencia de luz adecuada para la activación opsina. En ánimals donde se ha producido la pérdida de luz severa a través de la fibra después de la experimentación (> 30%) 9, los datos para que los animales deben ser considerados para la eliminación. Criterios para la eliminación se deben establecer a priori. Por último, hay que considerar la frecuencia de impulsos requerida para modular actividad neuronal, que dependerá de la estructura del cerebro y neuronales sub-tipos como objetivo. Publicado existen parámetros de estimulación de luz optogenética para múltiples subtipos neuronales, sin embargo, la capacidad de modular la actividad neuronal debe ser confirmado de forma independiente a través in vivo o de sección de cerebro registros electrofisiológicos.Como uno se convierte en adepto con el uso de láser y modificación de láser set-ups, las combinaciones de diferentes longitudes de onda pueden ser atados a múltiples fibras en un solo animal o entregados por la misma fibra de la optogenética combinatoria 8. Estimulación multi-longitud de onda será cada vez más importante dado el rápido desarrollo de desplazamiento al rojoed channelrhodopsins 8, la ingeniería de opsinas de hiperpolarización desplazada al azul 15, el uso de biestables opsinas paso de función 8,16,17, y la ampliación de la lista general de opsinas con los espectros de activación distinta 11. Esta expansión de la caja de herramientas optogenética permitirá un control sin precedentes de múltiples subtipos neuronales dentro y fuera de las regiones del cerebro para determinar su papel en el gobierno de los estados de comportamiento complejos.
Divulgaciones
The authors have no conflicts of interest to report.
Agradecimientos
These studies were funded by grants received from the NIH (MH082876, DA023988).
Materiales
| Name | Company | Catalog Number | Comments |
| 1. Laser Set-up | |||
| 100 mW 473nm or 488nm Diode Laser System , <2% Stability (quantity: 1) | Omicron | Luxx/Phoxx 473/488-100 | Optional accessory includes a remote control box with key switch and LED Display |
| 100 mW 594nm DPSS laser (quantity: 1) | Colbolt | 0594-04-01-0100-300 | 04-01 series yellow laser; sensitive to back reflection from fibers |
| 200 mW 532 nm DPSS laser; 5% power stability (quantity: 1) | Shanghai Lasers | GL532T3-200 | Cost-effective alternative to yellow DPSS laser for activation of halorhodopsins and archaerhodopsins |
| Non-contact style laser to multimode fiber coupler (quantity: 1) | OZ Optics | HPUC-23-400/700-M-20AC-11 | For use with dual laser set-up; Specs: 33 mm OD for 400 - 700 nm; FC receptacle, f = 20 mm lens with post mount laser head adapter #11 |
| Aluminum breadboard, 12" x 18" x 1/2", 1/4"-20 Threaded (quantity: 1) | Thorlabs | MB1213 | For dual laser system |
| Aluminum breadboard, 10" x 12" x 1/2". 1/4"-20 Threaded (quantity: 1) | Thorlabs | MB1012 | For single laser system |
| Aluminum breadboard, 4" x 6" x 1/2", 1/4"-20 Threaded (quantity: 2) | Thorlabs | MB4 | For blue laser; dual laser system |
| Compact variable height clamp, 1/4"-20 Tapped (quantity: 4) | Thorlabs | CL3 | |
| 3/4" stainless post (quantity: 1) | Thorlabs | TR075 | |
| 1" stainless post (quantity: 4) | Thorlabs | TR1 | |
| Post holder with spring-loaded hex-locking thumbscrew (quantity: 2) | Thorlabs | PH1 | |
| Pedestal Base Adapter (quantity: 3) | Thorlabs | BE1 | |
| Small Clamping Fork (quantity: 3) | Thorlabs | CF1253 | |
| Kinematic mount for 1" optics with visible laser quality mirror (quantity: 3) | Thorlabs | KM100-E02 | |
| Neutral filter density wheel (quantity: 1) | Thorlabs | NDC-50C-2M | |
| 1" Longpass dichroic mirror 50% (quantity: 1) | Thorlabs | DMLP505 | |
| Kinematic mount for 1" optics (quantity: 1) | Thorlabs | KM100 | For dichroic mirror |
| 20-piece hex wrench kit with stand (quantity: 1) | Thorlabs | TC2 | |
| 1/4"-20 cap screw and hardware kit (quantity: 1) | Thorlabs | HW-KIT2 | |
| Mounting base 1" x 2.3" x 3/8" (quantity: 1) | Thorlabs | BA1S | |
| FC/PC to FC/PC L-Bracket mating sleeve (quantity: 2) | Thorlabs | ADAFCB1 | Dual FC/PC L-bracket also available |
| Breadboard lifting handles (quantity: 3) | Thorlabs | BBH1 | |
| Ø1" Bandpass Filter, CWL = 450 ± 2 nm, FWHM = 10 ± 2 nm (quantity: 1) | Thorlabs | FB450-10 | For use with diode lasers that spontaneously emit |
| 2. Laser Coupling | |||
| ! Laser protective eyewear (quantity: 1 for every user at each wavelength) | Various | ! Consult with laser provider to ensure proper selection of eyewear that will provide maximal light attenuation for the purchased laser | |
| Fiber optic cable tester (quantity: 1) | Eclipse | 902-186N | |
| One-step fiber connector cleaner (quantity: 1) | Thorlabs | FBC1 | |
| Coupler patch cord (0.75 meter) (quantity: 1) | Thorlabs | 0.75 m 200 μm core, 0.22 NA, FC/PC connectors multimode fibers; for dual laser system | |
| Coupler patch cord (0.5 meter) (quantity: 1) | Thorlabs | 0.5 m 200 μm core, 0.22 NA, FC/PC connectors, multimode; for single laser system | |
| Doric mini cube (quantity: 2) | DORIC | DMC_1x2_FC-2FC | |
| Compact power and energy meter console (quantity: 1) | Thorlabs | PM100D | Digital 4" LCD |
| C-series slim power sensor 5 - 500 mW (quantity: 1) | Thorlabs | S130C | Multiple detectors types are available; check with vendor |
| 3. In vivo Optogenetic Stimulation | |||
| Multimode fiber splitters (quantity: 2) | FONT Canada | Large core fiber optic 1 x 2 splitter, 50/50 ratio, FC connectors, ruggedized. Length, core size and numerical aperture can be specified when ordering; cost-effective smaller core sizes available | |
| Arbitrary waveform function generator (2 channel) (quantity: 1) | Rigol | DG1022 | Can control up to 2 lasers at once |
| Fiber optic rotary joint (commutator) (quantity: 6 - 8) | DORIC* | FRJ_1X1_FC-FC | *Also available through Thorlabs and Prizmatix |
| Animal patch cords (Custom Mono Fiberoptic Cannula with 10mm ferrules, FC/PC connector) (quantity: 8) | DORIC | MFP_200/240/900-0.22_2m_FC-MF2.5 | Length, core size and numerical aperture can be specified when ordering; alternatively, these can be made custom made in-house (see Sparta et al. 2012)9. |
| PFP ceramic split sleeve, 2.5mm ID, 11.40mm length (25/pkg) (quantity: 1) | Precision fiber Products | SM-CS1140S1 | Used for attaching implanted fiber optic on animal to a light-delivering fiber patch cord with flat cleeve (FC) end |
| Clear dust caps for Ø2.5 mm ferrules (25/pkg) (quantity: 1) | Thorlabs | CAPF | |
| Metal cap for FC/PC and FC/APC mating sleeves (quantity: 1) | Thorlabs | CAPF1 | |
| Thick-jacketed patch cords (custom order) (quantity: 4) | Thorlabs | 200 μm core, 0.22 NA, FC/PC connectors multimode fibers; length, core size, and numerical aperture can be specified when ordering | |
Referencias
- Zhang, F., et al. The microbial opsin family of optogenetic tools. Cell. 147, 1446-1457 (2011).
- Boyden, E. S., Zhang, F., Bamberg, E., Nagel, G., Deisseroth, K. Millisecond-timescale genetically targeted optical control of neural activity. Nat Neurosci. 8, 1263-1268 (2005).
- Aravanis, A. M., et al. An optical neural interface: in vivo control of rodent motor cortex with integrated fiberoptic and optogenetic technology. J Neural Eng. 4, S143-156 (2007).
- Sidor, M. M. Psychiatry's age of enlightenment: optogenetics and the discovery of novel targets for the treatment of psychiatric disorders. J Psychiatry Neurosci. 37, 4-6 (2012).
- Tye, K. M., Deisseroth, K. Optogenetic investigation of neural circuits underlying brain disease in animal models. Nat Rev Neurosci. 13, 251-266 (2012).
- Nieh, E. H., Kim, S. Y., Namburi, P., Tye, K. M. Optogenetic dissection of neural circuits underlying emotional valence and motivated behaviors. Brain Res. 1511, 73-92 (2013).
- Yizhar, O., Fenno, L. E., Davidson, T. J., Mogri, M., Deisseroth, K. Optogenetics in neural systems. Neuron. 71, 9-34 (2011).
- Yizhar, O., et al. Neocortical excitation/inhibition balance in information processing and social dysfunction. Nature. 477, 171-178 (2011).
- Sparta, D. R., et al. Construction of implantable optical fibers for long-term optogenetic manipulation of neural circuits. Nat Protoc. 7, 12-23 (2012).
- Kravitz, A. V., Owen, S. F., Kreitzer, A. C. Optogenetic identification of striatal projection neuron subtypes during in vivo recordings. Brain Res. 1511, 21-32 (2013).
- Mattis, J., et al. Principles for applying optogenetic tools derived from direct comparative analysis of microbial opsins. Nat Methods. 9, 159-172 (2012).
- Foutz, T. J., Arlow, R. L., McIntyre, C. C. Theoretical principles underlying optical stimulation of a channelrhodopsin-2 positive pyramidal neuron. J Neurophysiol. 107, 3235-3245 (2012).
- Tye, K. M., et al. Amygdala circuitry mediating reversible and bidirectional control of anxiety. Nature. 471, 358-362 (2011).
- Cardin, J. A., et al. Targeted optogenetic stimulation and recording of neurons in vivo using cell-type-specific expression of Channelrhodopsin-2. Nat Protoc. 5, 247-254 (2010).
- Chow, B. Y., et al. High-performance genetically targetable optical neural silencing by light-driven proton pumps. Nature. 463, 98-102 (2010).
- Diester, I., et al. An optogenetic toolbox designed for primates. Nat Neurosci. 14, 387-397 (2011).
- Berndt, A., Yizhar, O., Gunaydin, L. A., Hegemann, P., Deisseroth, K. Bi-stable neural state switches. Nat Neurosci. 12, 229-234 (2009).
- Ung, K., Arenkiel, B. R. Fiber-optic implantation for chronic optogenetic stimulation of brain tissue. J Vis Exp. , e50004 (2012).
- Gunaydin, L. A., et al. Ultrafast optogenetic control. Nat Neurosci. 13, 387-392 (2010).
- Lin, J. Y., Lin, M. Z., Steinbach, P., Tsien, R. Y. Characterization of engineered channelrhodopsin variants with improved properties and kinetics. Biophys J. 96, 1803-1814 (2009).
- Gradinaru, V., et al. Molecular and cellular approaches for diversifying and extending optogenetics. Cell. 141, 154-165 (2010).
- Goshen, I., et al. Dynamics of retrieval strategies for remote memories. Cell. 147, 678-689 (2011).
- Han, X., et al. A high-light sensitivity optical neural silencer: development and application to optogenetic control of non-human primate cortex. Front Syst Neurosci. 5 (18), (2011).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados