Method Article
בoptogenetic גירוי vivo של מערכת העצבים המרכזית מכרסם
In This Article
Summary
Optogenetics has become a powerful tool for use in behavioral neuroscience experiments. This protocol offers a step-by-step guide to the design and set-up of laser systems, and provides a full protocol for carrying out multiple and simultaneous in vivo optogenetic stimulations compatible with most rodent behavioral testing paradigms.
Abstract
The ability to probe defined neural circuits in awake, freely-moving animals with cell-type specificity, spatial precision, and high temporal resolution has been a long sought tool for neuroscientists in the systems-level search for the neural circuitry governing complex behavioral states. Optogenetics is a cutting-edge tool that is revolutionizing the field of neuroscience and represents one of the first systematic approaches to enable causal testing regarding the relation between neural signaling events and behavior. By combining optical and genetic approaches, neural signaling can be bi-directionally controlled through expression of light-sensitive ion channels (opsins) in mammalian cells. The current protocol describes delivery of specific wavelengths of light to opsin-expressing cells in deep brain structures of awake, freely-moving rodents for neural circuit modulation. Theoretical principles of light transmission as an experimental consideration are discussed in the context of performing in vivo optogenetic stimulation. The protocol details the design and construction of both simple and complex laser configurations and describes tethering strategies to permit simultaneous stimulation of multiple animals for high-throughput behavioral testing.
Introduction
Optogenetics יש מהפכה במדעי מוח ברמת מערכות בחיפוש שלה לרכיבי מעגל העצביים נהיגה מדינות התנהגות נורמלית ומחלה-רלוונטית. הגילוי שopsins חיידקים רגיש לאור 1 יכול לבוא לידי ביטוי מבחינה תפקודית בתאי יונקים סיפק את הפלטפורמה לשימוש באור כדי לקבל שליטה חסרת תקדים של פעילות עצבית בדייקנות מרחב ובזמן גבוהה 2. שלא כמו גישות אלקטרו או תרופתיות מסורתיות למניפולציה של פעילות עצבית, optogenetics מאפשר שליטה של סוגי תאים מסוימים (על פי תחזית גנטית לזהות או מרחבית) בתוך אוכלוסיות הטרוגניות ובלוחות זמנים רלוונטיים מבחינה פיזיולוגית. המבוא הבא של ממשק עצבי-אופטי הניתן כלי מעשי למסירה של אור למתנהג בעלי חיים 3. זו אפשרה לאפנון של מעגלים עצביים מוגדרים במכרסמים מתנהגים ער בזמן אמת על מנת לבדוק קשר סיבתיתפקיד של מעגלים העצביים אלה בממשל של מדינות התנהגות רלוונטיות למחלה נוירולוגית והפסיכיאטרית 4-6. Optogenetics, לכן, מהווה כלי רב עוצמה להקדמה לכל מעבדה מעוניינת לחקור את הקשר הפונקציונלי בין פעילות המוח ואמצעים התנהגותיים או פיסיולוגיים במודלים של בעלי חיים.
עיצוב והשלמה מוצלחים של ניסוי optogenetic כרוך בפעולות שונות ושיקולים (ראה איור 1). המטרה של הפרוטוקול הנוכחי היא לספק לאנשים את הכלים והרכיבים, יחד עם הידע התיאורטי ומעשי, יש צורך לבצע גירוי optogenetic במכרסמים מתנהגים ער. נכון לעכשיו, יש שני טווחי אורך גל דומיננטיים המשמשים להפעלת ערוצי opsin חיידקים: בספקטרום הכחול (בדרך כלל 473 ננומטר) וספקטרום ירוק-צהוב (בדרך כלל 532 או 591 ננומטר). לייזרים ודיודות פולטות אור (LEDs) שניהם יכולים לשמש כמקורות אור לדeliver אורכי גל מסוים של אור לרקמת מוח. האור שאינו קוהרנטית הנפלט על ידי נוריות, לעומת זאת, עושה העברת יעילה של אור קשה כאשר צימוד לתוך סיבי ליבה הקטנים הנדרשים לin vivo גירוי מכרסמים. החלטה על ההרכבה הלייזר המתאימה היא צעד ראשון חיוני ויהיו תלויה בשימוש המיועד של optogenetics במעבדה. הפרוטוקול הנוכחי מתאר שתי תצורות בסיסיות שונות בקלותם של הרכבה ושימוש: לייזרים מצמידים מראש אחת ומערכות לייזר כפול (ראה איור 2). מערכות לייזר יחידים שהם מצמידים מראש על ידי היצרן הן בעצם מוכנות לללכת עם הגעה עם לא מעט הגדרה הנדרשת, אבל יש לי החסרון של התאמה אישית של משתמש הקצה מינימאלית. מערכת לייזר כפולה מאפשרת משלוח של שני אורכי גל שונים במורד אותו הסיב. זה יהיה חשוב יותר ויותר עם כניסתו של optogenetics קומבינטורית לפי ניתן להשתמש באורכי גל שונים כדי להפעיל / לעכב distincסוגי תאי T שהם מרחבית-מקומי במשותף. זה חיוני גם לשימוש עם opsins פונקציה דו-יציב צעד שבו photocurrents הם יזמו והופסק על ידי אור כחול וצהוב, בהתאמה 7,8. מערכות לייזר כפולה הן גם להתאמה אישית כמשתמש יכול להוסיף או להסיר רכיבים (לדוגמא, תריסים חיצוניים, מסנני קרן, מטרים כוח מוטבע) מנתיב הקרן כנדרש. בשל צדדיות שלה, הגדרת הלייזר הכפול מומלצת אם optogenetics הולכת להיות כלי המשיך בשימוש במעבדה. צימוד של הלייזרים, לעומת זאת, יכול להוות אתגר וכך מנגנון צימוד מהיר, קל, ואמין מסופק בפרוטוקול זה. שים לב, פרוטוקול זה מפרט את ההרכבה של רכיבים אופטיים ומנצל מיתרי תיקון ורכיבים שאינם מותאמים לסיבי multimode צעד-מדד עם ליבה 200 מיקרומטר וצמצם מספרי (NA) של 0.22. גדלי ליבה שונים וNA זמינים לרכישה, אולם כל הרכיבים רצוי להתאים במונחים של ליבהגודל וNA כדי למנוע אובדן אור בנקודות חיבור סיב. לחלופין, בחיבור סיב, אור יכול לעבור מקטן לגודל ליבה גדול יותר; ו / או מנמוך-NA לסיבי NA-גבוהים ללא הפסד נוסף.
אסטרטגיות קשירה מסופקות המאפשרות גירוי בו זמנית של עכברים מרובים עבור בדיקות התנהגותיות תפוקה גבוהה. הפרוטוקולים הניתנים להניח שימוש בסיבים מושתלים כרוניים לבדיקות התנהגותיות אבל יכולים להיות שונה עבור פרוטוקולי גירוי חריפים. סיבים מושתלים בחריפות הם יתרון לשילוב גירוי optogenetic עם מניפולציה תרופתית, מאז אותו הצינורית יכולה לשמש כדי לספק תרופות וקצה סיב אופטי לאותו מיקום. השימוש בסיבים כרוניים מושתלים הוא, עם זאת, מומלץ מאוד לבדיקות התנהגותיות מרובה-יום כפי שהיא מקטינה את ניזק לרקמות הקשורים להכנסה וההסרה חוזרות ונשנות של סיבים, ומגבירה את דיוק במונחים של מיקום העקבי של סיבים לרקמת תאורה 3. בשילוב עם תצורות הקשירה המתוארות כאן, התנהגות יכולה להיות מוקלטת באופן מהימן על פני מספר ימים. חודשים ואכן, העברת אור אמינה דווחה לאחר השתלת סיבים 9 כך שגירוי כרוני ופרדיגמות בדיקות התנהגותיות יכולים, באופן תיאורטי, יבוצעו על פני ימים ושבועות רבים. הערות נוספות על רכיבי חומרה נוספו לפרוטוקול, כדי לאפשר בחירת הקורא במוצר הטוב ביותר שיתאים לצרכימים האישיים שלהם, כוללים חלופות חסכוניות ומוצרים שניתן לעשות בבית. טיפים חשובים כי הם שימושיים במהלך התקנה והיישום גם מסופקים.
Protocol
! זהירות: פרוטוקול זה כרוך בשימוש בלייזרים ב 3 כיתה וידרוש הנחיות הדרכה ובטיחות נאותות להיות אחריו. משקפי בטיחות חייבים להיות משוחק בכל העת בעת הפעלת לייזרים, עם נהלי יישור הצגת סיכון גבוה במיוחד. צור קשר עם ספק הלייזר כדי לקבוע את משקפי שיספק הנחתה מקסימלי לליזר נתון. אם זמין, להירשם לקורס בטיחות אימון לייזר מוסדי. אין להפעיל לייזר ללא משקפי בטיחות וההכשרה המתאימים.
1. מכשירי לייזר Set-עד
מקום שמתאים, צעדים בסעיף 1 יועדו כ( א) או (ב) כדי להבדיל בין מערכות לייזר יחידים או כפולים, בהתאמה.
- צרף ולאבטח לייזרים לקרש החיתוך. Breadboards הם מוליכי חום מצוינים ולפעול כגוף קירור כדי למנוע נזק לרכיבים פנימיים לייזר עם שימוש ממושך.
- () Secure las מצמידים מראשאה ל-10 "x 12" קרש חיתוך (או לפי הצורך) באמצעות ¼-20 "ברגי כובע ומכונה כביסה (איור 2 א). אם חורי קרש חיתוך לא ליישר עם חורי לייזר הרכבה, השתמש 'מהדק שולחן "קטן כדי לאבטח לייזר לקרש חיתוך.
- (ב) אם לשימוש 2 הלייזרים יש גבהים שונים מאוד קורה (סנטימטר> ~ 1), השתמשו 4 "x 6" breadboards הקטן כדי ליצור פלטפורמה לאחד מהלייזרים. צרף לוחות אלה כדי 12 הגדולים הראשי "x 18" קרש חיתוך באמצעות ¼-20 ברגי כובע "עם מנקי, לאחר מכן לצרף את הלייזר ללוחות הקטנים יותר באמצעות ברגי כובע או מהדק שולחן כפי שמוצג באיור 2. צרף הלייזר האחר ישירות לקרש החיתוך באמצעות ברגי כובע או מהדק שולחן בגובה משתנה.
שלב קריטי: Breadboards, ברגים, ורכיבים אופטיים ניתן לרכוש כקיסרי או מטרי כדי להיות עקבי בעת רכישת פריטים; ברירת המחדל עבור פרוטוקול זה הוא קיסרי. - ()צרף שטוח ידבק במעייל עבה / מגע פיזי כבל (FC / PC) תיקון למצמד (המכונה כבל מצמד; ראה איור 3) שמצורף פיזית לחלק הקדמי של הלייזר (איור 2 א).
- (ב) השחל את המצמד על ¾ "פוסט אופטי, אז אפוקסי המשותף בין המצמד והחלק העליון של ההודעה באמצעות JB Kwik, או אפוקסי דומה, כדי למנוע התרופפות וחוסר תיאום בעת השימוש. צרף את הפוסט לקרש החיתוך (כמו חורי קרש החיתוך לא תמיד בקנה אחד עם המיקום הנדרש של רכיבים אופטיים, הודעה בעל, מתאם בסיס הכן, ומהדקים מזלג משמשים כדי לאבטח הודעה האופטית של המצמד במקום). צרף כבל עבה במעייל תיקון (כבל מצמד) לחלק האחורי של המצמד.
- (ב) הכנס את מראה ההיגוי הראשון לליזר הכחול לבעל kinematic, ולצרף אותו לקרש החיתוך באמצעות ¾ "פוסט אופטי. צרף הודעה זו לADAP בסיסter ומזלג הידוק. מקם את מזלג ההידוק ולפרסם הרכבה ישירות מול הלייזר הכחול עם מראה בזווית על 45 מעלות כדי לנווט את הלייזר אל מראה dichroic. השתמש בתבנית הרשת של חורים על קרש החיתוך כמדריך יישור גס. ברגע שבערך מיקום, השתמש בורג ¼ "-20 כובע כדי לאבטח את מזלג ההידוק לקרש החיתוך (ראה 2B דמויות, C).
- (ב) הכנס את מראה dichroic לבעל kinematic ולצרף אותו ל" פוסט אופטי 1 ולהבטיח ישירות לקרש החיתוך. מקם את מראה dichroic לקצה השמאלי של, ועולה בקנה אחד עם, במראה הלייזר הכחול. זווית מראה dichroic בזווית 45 מעלות כך שאור הכחול משתקף מהמראה הראשון בא לידי הביטוי במצמד, ואז להדק את בורג חיבור למחזיק kinematic לתפקיד (ראה 2B דמויות, C).
- (ב) חבר את מראה ההיגוי הראשון לליזר הצהוב ל¾ "פוסט אופטי. צרף optiההודעה cal למתאם בסיס ומזלג מהדק. מקם את מזלג ההידוק ופוסט-אנסמבל ישירות מול הלייזר הצהוב וזווית המראה בזווית של 45 מעלות כך שאור צהוב יופנה לעבר מראה ההיגוי השני. אבטח את מזלג ההידוק במקום עם ¼ "-20 בורג כובע ומכונת כביסה.
- (ב) חבר את מראה ההיגוי השני לליזר הצהוב ל" פוסט אופטי 1. זווית המראה כך שקרן האור הצהובה מהמראה הראשון תבוא לידי ביטוי באמצעות dichroic ולמצמד (איור 2 ג). אבטח את ההודעה ישירות לקרש החיתוך ולהדק את בורג ההרכבה פעם אחת במראה היא בזווית מתאימה. התאמות מראה עדינות תיעשה באמצעות mounts מראה kinematic בשלב מאוחר יותר.
- (ב) צרף גלגל מסנן צפיפות ניטראלי ל¾ "פוסט אופטי ולמקם את ההודעה להודעה בעל מחובר לבסיס הרכבה. אבטח את ההרכב לקרש החיתוך בין הראשון וseמראות צהובות מנצח באמצעות "בורג כובע אחד ¼ -20. גלגל זה משמש כדי להתאים את כוחו של אור הלייזר צהוב הגיע למצמד.
טיפ: בנפרד להדק את כל הרכיבים (כגון ברגים שמחזיקים בעלי מראה kinematic לחלק העליון של הודעות, והנושאים שמחזיקים מתאמי בסיס לחלק התחתון של הודעות) לפני מצרף אותם לבסיס. השתמש במוט של מפתח ברגים hex קטן בדרך החורים-ניתנים בהודעות אופטיות כדי לקבל מספיק מומנט. זה ימנע רכיבים רופפים במהלך שימוש, המחייב היערכות מחודשת. - צרף FC / PC למתאם L-הסוגר / PC FC לקרש החיתוך.
- אופציונאלי: Secure מפצל קוביית סיבי 1 x 2 50/50 מיני ישירות לקרש החיתוך לגירוי בו זמנית in vivo של שניים או יותר בעלי חיים. בנוסף, ניתן להוסיף ידיות לסייע בתנועה של הרכבה קרש חיתוך (כפי שניתן לראות באיור 2 א).
2. לייזר צימוד (Coupling סגנון ללא מגע)
סעיף זה מתייחס להגדרה הכפול לייזר (איור 2). יישר את דרך הלייזר הכחולה הפנימית לפני יישור נתיב הלייזר הצהוב החיצוני.
! זהירות: השתמש בכוח צימוד אור נמוך (~ 1 mW) כדי להבטיח את בטיחות העין. לחבוש משקפי מגן בטיחות לשלטון בליזר ועד עוצמת אור נמדדת ונחשבת לבטוחים.
- הגדר את המתגים על גביו של הלייזר ל" Curr "(נוכחי) ומצב טרנזיסטור-טרנזיסטור היגיון (TTL) + לתאורה קבועה (בניגוד למצב אנלוגי). ודא שהכח הידית בחזיתו של הנהג מוגדרת על אפס. הפעל את הלייזר על ידי הפעלת הנהג ראשונה ולאחר מכן על מקש הלייזר.
- לאט לאט להתאים את ידית הכח ממוקמת בחלק הקדמי של נהג הלייזר כך שאור הלייזר ~ mW 1 הוא להיות נפלטים. חכה 10 - 15 דקות (או כפי שנקבע על ידי יצרן) לליזר כדי להתחמם.
- חבר את בוחן כבל סיב האופטי ישירות לfreסוף הדואר של תיקון כבל המצמד ולהפעיל את בודק הכבל (איור 3 א). כוון את הזווית של המצמד כך שהקרן האדומה נוסעת ישר חזרה לכיוון המרכז של מראה dichroic. נתיב הקרן של האור האדום הנפלט מבודק הכבל הוא הדרך המדויקת שאור הלייזר הנכנס יצטרך לעקוב כדי להיות יחד לליזר.
- לבצע יישור גס: השתמש בכפתורים לרוחב ואופקיים על מראות kinematic לנווט את האלומה של אור הלייזר למצמד. מלחציים הדום ייתכן שיצטרכו להיות משוחררים כדי למקם מעט מראות והמצמד. Mounts kinematic צריך עדיין יש כמה נסיעות זמינות עבור התאמות קנס נוספות. אל תהיה מודאג אם אין אור כחול נפלט אל מחוץ לתיקון הכבל מצורף המצמד בשלב זה.
- מניחים פיסת נייר שקוף למחצה יחידה ישירות מול מראה dichroic, בין dichroic והמצמד. יהיו כחול וar שנינקודת ed על נייר זה מהליזר ובודק כבל, בהתאמה. להשתמש בנייר שקוף מספיק כדי לראות את שני הכתמים האדומים והכחולים בו זמנית מאותו הצד של נייר.
- לבצע התאמות עדינות למראה ההיגוי הראשון (כלומר, אחד קרוב יותר לליזר, לא dichroic) על ידי ההתאמה בזהירות את הכפתורים לרוחב ואופקיים כדי ליישר את מרכז הנקודה האדומה עם הנקודה הכחולה.
- הזז את הנייר חזרה לכיוון המצמד כך שזה ישירות מול המצמד ולהתאים את הידיות במראה השני (כלומר, dichroic) כדי ליישר את קרן הלייזר עם הקורה האדום.
- לחזר על צעדים 2.6 & 2.7 עד מרכז הקורות הכחולות / צהובות ואדומות מיושרים בדיוק בשני העמדות (כלומר, עד הקורות האדומות וכחולה הן colinear).
- הסר את בודק כבל מכבל המצמד. אור הלייזר צריך עכשיו להיות נפלט בסופו של תיקון כבל מצמד.
- Determiיעילות צימוד ne על ידי מדידת כוח האור הנפלט מקצה הסיב של תיקון כבל המצמד באמצעות מד כוח. השתמש בהגדרת 500 mW על photodiode של מד הכח ולשנות את הגדרת אורך הגל (λ) לכחול (473 ננומטר) או ספקטרום אור צהוב (635 ננומטר) בהתאם לליזר בשימוש.
- הנח את קצה הסיב בניצב לphotodiode להשיג כוח רידינג. השווה את כוח האור שנכנס המצמד לכוח האור הנפלט מקצה הסיב. יעילות צימוד של> 80% נחשבת טובה מאוד. התאמות נוספות קטנות מאוד של מראה ההיגוי השני יכולות לפעמים מעט לשפר את הצימוד. באופן כללי, כאשר דפוס הקורה מסוף סיבי הצימוד היא נקודה קטנה, הדוקה, מרכזית (ללא טבעות המקיפות אותו), צימוד יעילות לתוך ליבת הסיבים הוא אופטימלי.
- חזור על שלבים 2.1-2.11 לצימוד לייזר צהוב, מלבד להשתמש במראות היגוי שני לליזר הצהוב (ראה איור 2 ג). האם לאt להתאים את המיקום של מראה dichroic או יישור של הלייזר הכחול יאבד.
3. בvivo optogenetic גירוי
ודא כי כל הליכים כרוכים בשימוש בבעלי חיים מתבצעים בהתאם להנחיות לאומיות ומקומיות ואושרו על ידי בעלי החיים המוסדיים הטיפול המתאים ושימוש הוועדה.
- סיבים אופטיים הגדרה (ראה איור 3 ב לזיהוי הסוגים השונים של מיתרי תיקון מכונים להלן). כדי לעורר עכבר אחת, לחבר את כבל מצמד תיקון לתיקון כבל עבה במעייל באמצעות FC / מתאם L-הסוגר FC מחובר ישירות לקרש החיתוך (ראה איור 4 א). כדי לעורר שני בעלי חיים מליזר אחד, לחבר את כבל תיקון המצמד לשני מיתרי תיקון עבה במעייל באמצעות קוביית 1 x 2 50/50 המיני (ראה איור 4). כדי לעורר שלוש או יותר בעלי חיים, לצרף את כבל המצמד למפצל סיבים רבים באמצעות 1 מ 'x 2קוביית ini כבר מחוברת לקרש החיתוך (ראה איור 4C).
- צרף מחלף / משותף סיבובית לקצוות חופשיים של מפצל כבל / סיבי תיקון העבה במעייל. מרכזיות חיוניות מאחר שהם מאפשרים סיבוב של הסיבים עם התנועה של המכרסמים, המונעת הצטברות של מומנט על תיקון הכבל. יותר מדי מומנט יכול לסובב מיתרים, להוביל לשבירה, ולהפריע לתנועה הטבעית של בעלי החיים במהלך בדיקה.
- צרף את תיקון כבל חיה למחלף.
- צרף שרוול מפוצל התחברות לסוף טבעת חזוק המתכת ללא כבל תיקון בעלי החיים (איור 5). אל תכריח את השרוול כל הדרך עד הטבעת חזוק; לעזוב ~ 0.5 סנטימטר של שרוול חשוף כמו זה מה מתחבר לסיבים האופטיים מושתל מודבקים בעלי החיים (איור 6).
שלב קריטי: תמיד לרכוש שרוולים המכילים מפוצל כדי לאפשר הרחבה של שרוול על טבעת חזוק סיבים המושתל במהלך חיבור וההסרה. הדוקים מדי של כושר יכול לגרום לטראומה קשה לבעלי החיים אם השתל dislodges מהגולגולת כאשר מנסים לנתק את השרוול מהשתל. אם זה אכן קורה, בעלי החיים יש להוציא מהמחקר ולקבל טיפול וטרינר מיידי. באופן דומה, לפני השימוש בשרוול חדש בפעם הראשונה, "לשבור אותו ב'על ידי חיבור וניתוק טבעת חזוק עד שמתנתק עם הכמות הרצויה של כוח.
טיפ: זה קל לשבור סיבים תוך הסרת שרוול מחובר היטב לטבעת חזוק. כדי להימנע מכך, לדחוף את הטבעת חזוק על ידי החדרת מוט עץ קטן לקצה הפתוח של השרוול (הידית של מקלון צמר גפן סטנדרטי היא בגודל הנכון). - חבר את נהג הלייזר הכחול למחולל פעימות באמצעות כבל BNC ולהפוך את מחולל פעימות ב.
- שים משקפי בטיחות מתאימים ב. הגדר את המתגים על גביו של הלייזר ו" + TTL "מצב ל" Curr". הפוך tha בטוחt כוח הידית בחזיתו של הנהג מוגדר באפס andturn הלייזר ב( להפוך את מנהל ההתקן בראשון ולאחר מכן על מקש הלייזר).
- התאם את כוח הידית בחזית הלייזר כך ש5-10 mW הוא להיות נפלטים מקצה כבל סיב תיקון בעלי החיים, כפי שנמדד באמצעות מד כוח אור. 5 - 10 mW הוא קו מנחה כללי - עוצמת הכח המדויקת הנדרשת כדי להשפיע על נפח נתון של רקמה צריך להיות מחושב לפני תחילת הניסוי, כמו בAravanis et al 3.
- לעבור את הלייזר הכחול במצב "אנלוגי" לגירוי in vivo. הערה: לייזרי DPSS Yellow מופעלים בTTL + מצב לתאורה קבועה. חכה 10-15 דקות לליזר כדי להתחמם.
- בעדינות לרסן את העכבר ולחבר את מפוצל השרוול על תיקון כבל חיה לסיבים מושתלים כרוניים (ראה איור 6). ודא שהקצוות של שני הסיבים ליצור מגע פיזי עם אחד את השני. השתמש בפיצול על שרוול חיבור כחלון לדמיין מגע ישיר בין שני שלב קריטי:. לפעמים פסולת יכולה לאסוף על טבעת חזוק המתכת של הסיבים מושתלים של בעלי החיים ומפריעה לחיבור מתאים. במקרה זה, להשתמש באתנול לנגב לנקות בעדינות את הטבעת חזוק על ראשו של בעל החיים לפני קובץ מצורף. אל תשתמש בכוח שרוול חיבור על הטבעת חזוק כמו זה יכול לגרום לטראומה קשה לבעלי החיים. אם חיבור פיזי בין קצות סיבים לא יכול להתבצע לאחר הניקוי, להסיר את החיה מהמחקר.
טיפ: דליפת אור יכול להתרחש בנקודת החיבור בין תיקון כבל סיבים ובעלי החיים המושתל. ויזואליזציה של האור הזה על ידי מכרסמים עשויה להציג ניסיוני לבלבל 10. צינורות חום להתכווץ יכולים להיות מחוברים למייתרי תיקון והחליקו על נקודת חיבור כדי למזער אור חיצוני. - אפשר העכבר כדי להתאושש במשך כמה לפני תחילת בדיקות התנהגותיות דקות.
טיפ: Depending במבחן ההתנהגות להינתן, עדיף להרגיל עכברים לתהליך החיבור והקשירה 2-3 ימים לפני, כטיפול הנדרש כדי להתחבר בעלי החיים עלולים לגרום ללחץ ולבלבל את הבדיקות התנהגותיות. - מניחים את העכבר במנגנון בדיקת ההתנהגות להבטיח שכבל המחבר הוא ללא קשיים. אין להשאיר בעלי חיים ללא השגחה בזמן הגירוי. אפילו עם השימוש במרכזיות, יש לי מיתרי תיקון נטייה לעוות במהלך פרקי זמן ממושכים ועלולים להפריע לבדיקות התנהגותיות.
- השתמש במחולל פעימות לדופק הלייזר הכחול בתדירות קבועה מראש שתפעיל opsin של בחירה. לשימוש בלייזר צהוב: דופק הלייזר הצהוב עם תריסים חיצוניים או פשוט על ידי חסימת נתיב הקרן עם אובייקט אטום, שאינו רעיוני, שאינו דליק.
4. בvivo שיקולי גירוי הודעה
סעיף זה אינו מיועד להיות פרוטו מלאcol אבל מוצע כהדרכה לנהלים נוספים שיש לשקול הבאים in vivo גירוי optogenetic.
- עם השלמת ניסוי, לאשר בהיסטולוגיה מיקום נגיפית וסיבים לפרשנות מדויקת של תוצאות התנהגות. להרדים בעלי חיים על פי הנחיות מוסדיות וינקב את החיה עם מי מלח קר כקרח פוספט שנאגרו (PBS) ו- 4% (w / v) paraformaldehyde בPBS.
- הסר סיבים אופטיים מושתל על ידי תקיפות לתפוס את טבעת חזוק המתכת החשופה עם פלייר או hemostats. משוך ב, תנועה אחת חלקה, עדיין מהירה. חשוב לבדוק את תקינות הסיבים המושתלים על ידי מדידת תפוקת האור בסוף כל ניסוי.
- פוסט לתקן את המוח בparaformaldehyde לפחות 24-48 שעות לפני חתך דרך האזור של עניין. (אם באמצעות microtome הקפאה, דגירה מוח בתמיסת סוכרוז 30% במשך כמה ימים לפני חתך). בצע אימונוהיסטוכימיה באמצעות standaפרוטוקולי rd לגילוי של fluorophores מתויג opsin המתאים, כלומר, חלבון ירוק ניאון (GFP), חלבוני ניאון צהובים משופרים (EYFP) או mCherry.
- בדוק את האתר של ביטוי opsin ושתל סיבים תחת מיקרוסקופ וחזותי לאשר מיקום מתאים של הזרקת וירוס ושתל המבוסס על קואורדינטות שנבחרו.
תוצאות
תוצאות התנהגות שהושגו עם in vivo גירוי optogenetic הן תלויות לחלוטין במעגלים העצביים ממוקדים, מודל החיה בשימוש, ופרמטרי האפנון. למטרות הנוכחיות הפגנתיות, נוירונים דופאמין באזור tegmental הגחון, או VTA, של hydroxylase טירוזין :: עכברי Cre היו transduced עם opsin צעד פונקציה יציבה (SSFO) 8, או וירוס שליטה (EYFP), ושתל סיבים היה כרוני מושתל. השימוש בעכברים הטרנסגניים TH :: Cre מבטיח כי opsin ביטוי מוגבל לTH + תאים (דופמין) בVTA. איור 7 מציגים תוצאות התנהגות נציג שהושגו באמצעות הגדרת הלייזר תיארה הנוכחית לגירוי בו זמנית של עכברים מרובים. כאן, עכברים היו קשורים ומגורה באותו הזמן באמצעות לייזרים נפרדים (3 עכברים / לייזר כמו באיור 4C) והתנהגות של תנועה נרשמה עבור שעה 1. גירוי חוזר ונשנה של תאי עצב דופמין בVTA הביאפנוטיפ היפראקטיבי שנמשך לאורך זמן גירוי. אין שינוי בהתנהגות של תנועה נתפס בעכברי EYFP (ראה וידאו 1). בעקבות בדיקות התנהגותיות, אימונוהיסטוכימיה בוצעה כדי לוודא מיקוד נגיפי מדויק לנוירונים VTA דופמין ומיקום סיבים חזותי אושרו (ראה איור 7).
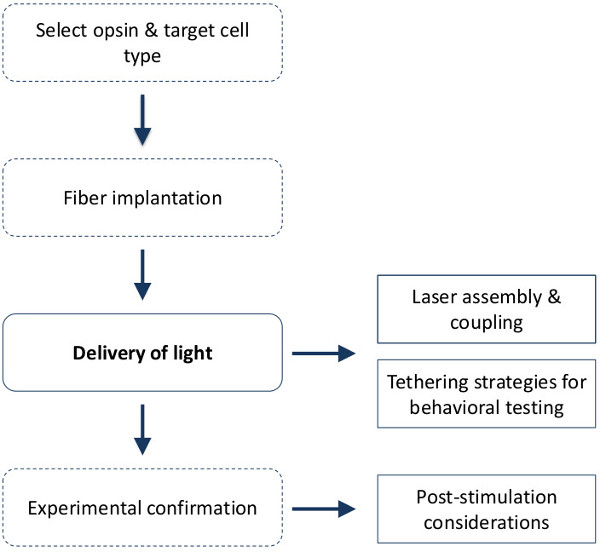
איור 1. צעדים ניסיוניים עבור in vivo גירוי optogenetic. יש מעורבים בעת תכנון וביצוע בגירוי optogenetic vivo ארבעה צעדים כלליים. פרוטוקול זה במיוחד מפרט את השלבים כרוכים במשלוח של אור ממקור אור הלייזר למבני מוח עמוקים במכרסם מתנהג וכולל 1) הרכבה מערכת לייזר וצימוד אור; 2) אסטרטגיות קשירה לגonnecting בעלי חיים רבים למקור אור לבדיקת התנהגות תפוקה גבוהה ו 3) מספק הנחיות כדי לאשר את אסטרטגית מיקוד למסירת אור - צעד חיוני לפרשנות הנתונים. הערה: למרות שפרוטוקול זה אינו בלעדי לסיבים מושתלים כרוניים למטרות קשירה, מומלץ והניח בעת שילוב גירוי optogenetic עם בדיקות התנהגותיות. ראה גם Ung & Arenkiel, 2012 18 וספרטה et al., 2012 9 לייצור והשתלה של סיבים אופטיים כרוניים בבית. קווים מוצקים = צעדים מכוסים בפרוטוקול זה.

2. מערכות איור לייזר המשמשות לin vivo גירוי optogenetic. () מערכת לייזר יחידה לגירוי in vivo. לייזר זה ph ysically מראש בשילוב על ידי יצרן ודורש הגדרת משתמש קצה קטנה. מערכת לייזר (B) כפולה. שני לייזרים הם מצמידים לסיב בודד באמצעות מראות הפועלות לנווט כל נתיב קרן למצמד סגנון ללא מגע. זה הגדרה כפי שניתן להסיר רכיבים אופטיים או להוסיף לפי צורך, אבל מציג יותר אתגר במונחים של צימוד לייזר יעיל. (ג) סכמטי ביותר צדדי של מערכת לייזר כפולה מוצגת ב( B) המיקום המציין של לייזרים ומראות עם נתיב קרן אור הלייזר המקביל (חיצים) מתואר. הנה, ראי dichroic "D" משמש כדי להסיט אורכי גל כחולים של אור תוך העברת אורכי גל צהוב ועד ל" C "המצמד ולתיקון כבל מצמד המצורף. B = לייזר כחול; C = מצמד סגנון ללא מגע; D = מראה dichroic; גלגל = מסנן FW; M = Mirror; Y = לייזר צהוב.תקבל = "_ blank"> לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.

איור 3. בודק כבל () משמש בפרוטוקול הצימוד שאינו פיזי תחתון:. בודק כבל מחובר ישירות לכבל תיקון. הכנס מתאר נקודת הבוחן לכבל חיבור חוטי תיקון (B) המכונים בכל פרוטוקול מחיצוני לפנימיים:.. מפצל סיבי Multimode, סוף החוט השחור במעייל בעלי החיים תיקון שרוול zirconia פיצול לבן הצמוד לדירה-קליב (FC), כבל עבה במעייל תיקון (המכונה גם "כבל מצמד"). מיתרי תיקון עבים במעייל מצופים בפוליוויניל כלוריד צינורות (PVC) עבור הגנה נוספת. לכבלים אלה, קודי צבע סטנדרטיים בתעשייה משמשים להבחין בין סוגי סיבים שונים, שבו כתומים = סיבים רבים. מיתרי תיקון בעלי החיים הם במעייל דק יותר, כדי לאפשר גמישות לתנועת בעלי החיים במהלך בדיקות התנהגותיות. הערה אבק שכובעים מונחים על FC / PC מסתיים כאשר כבלים אינם בשימוש. אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.

איור 4. אסטרטגיות קשירה לגירוי optogenetic in vivo של () חיה אחת, (ב) שני בעלי חיים; . תצורות אפשריות (C) שלושה או ארבעה בעלי חיים אינן מוגבלות לאלה שהוצגו לעיל - תצורות מרובות אפשריות באמצעות שילוב הייחודי של מתאמים, מפצלי סיבים, וחוטי תיקון הסתעפות כי הם זמינים באופן מסחרי או על ידי סדר מותאם אישית. הערה: מיתרי תיקון ומפצלי סיבים מכילים מחברים / PC FC בשני הקצוות (רק אחד הסוף מתואר)."Target =" ww.jove.com/files/ftp_upload/51483/51483fig4large.jpg _ blank "> לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.

איור 5. חיבור נכון ולא נכון (x האדום) של תיקון כבל לסיבים אופטיים להשתלה באמצעות מפוצל שרוול. (פנל משמאל) zirconia מפוצל השרוול משמש לחיבור כבל תיקון לטבעת חזוק של אופטי מושתל סיבים (שמוצג כאן לא מודבקת בעלי חיים). מצביע חץ נקודת החיבור בין כבל התיקון וסיבים האופטיים להשתלה. השוואה ל( פנל מימין) שבו קיים פער בין תיקון הכבל וסיבים האופטיים מושתל, כמו דמיינו באמצעות הפיצול של שרוול החיבור. שים לב לזליגת האור שעלול להתרחש עם חיבור לא תקין (מימין למטה). הכנס תחתון על upper פנל מהשמאל מתאר רכיבים בודדים בשימוש. מלמעלה עד למטה של כנס: צינורית סיבים אופטי מושתלת דוריים, zirconia מפוצל שרוול לבן, (כבל מלא תיקון מתואר באיור 3) סוף שטוח Cleeve (FC) של תיקון כבל בעלי חיים במעיילים שחור. בכל הלוחות, לציין כי שרוול החיבור הוא לא מיושר עם קצה FC של תיקון הכבל. השאר ~ 0.5 סנטימטר של לחיבור לסיבים האופטיים להשתלה מודבקת לחיה-לתלות מעל. אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.

צד איור 6. (משמאל) וקדמי תצוגה (מימין) של עכבר עם סיבים אופטיים מושתל מחובר לכבל תיקון. השתמש בפיצול על שרוול חיבור כדי לעזור לדמיין חיבור נכון של t תיקון הכבלo טבעת חזוק של סיבים אופטיים שהושתל. נקודת החיבור מודגשת על ידי תיבה מקווקות אדומה וגם מתוארת בעלון העליון. אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
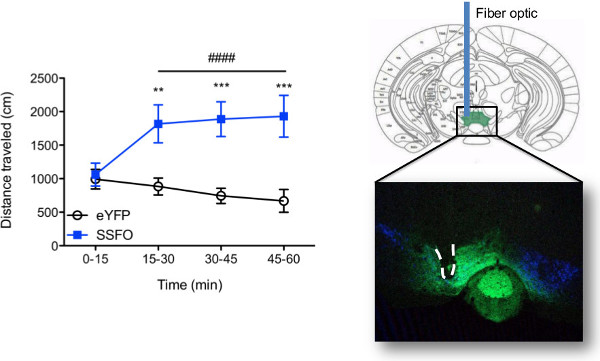
איור 7. נציגי תוצאות. (משמאל) קריאת התנהגות של in vivo גירוי optogenetic. דוגמא להתנהגות שניתן להשיג באמצעות הגדרת הלייזר תאר ופרוטוקול קשירה. הפעילות של תנועה נרשמה במהלך גירוי optogenetic של אזור tegmental הגחון (VTA) בhydroxylase טירוזין (TH) :: עכברי Cre (n = 7-8 / קבוצה) transduced עם או opsin צעד-פונקציה (AAV5-DIO-SSFO-EYFP ) או וירוס שליטה (AAV5-DIO-EYFP) בVTA. קבוצות של שלושה עכברים קשורים בו-זמנית ליחידלייזר כמתואר באיור 4C ומגורה עם דופק 5 שניות של 447 או 473 ננומטר אור מועבר פעם אחת כל 15 דקות. מדידות חוזרות דו-כיווניות ANOVA גילו אינטראקציה קבוצה משמעותית זמן x (F = 3,39 15.27, p <0.0001) והשפעה העיקרית משמעותית של זמן (F 3,39 = 4.67, p = 0.007) לפיה גירוי optogenetic מוגבר פעילות של התנועה רק בעכברי SSFO (עמ 'פוסט הוק-Bonferroni <0.0001, ביחס לt = 0-15 בן זמן) וכתוצאה מכך גידול הכולל בפעילות של תנועה בהשוואה לעכברי EYFP (השפעה העיקרית של קבוצה: F = 1,39 10.69, p = .0061; P Bonferroni פוסט הוק-<0.01 בt = 15-30 וp <0.001 בזמן t = 30 - 45 וt = 45 - 60). מפרט סיבים: 200 מיקרומטר ליבה, 0.22 NA. irradiance = 6 אור - 66 mW / 2 מ"מ, מתאים למרחק קצה סיב של 0.1-0.6 מ"מ מאתר הזרקה נגיפי עם כוח אור 5 mW נפלט בקצה סיב לפני הקשירה. ברים שגיאה מייצגים סטיית התקן של הממוצע. EYFP לעומת SSFO: ** p <0.01; *** P <0.001; השפעת זמן: p #### <0.0001 (מימין) אישור היסטולוגית של מיקום נגיפי וסיבים אופטיים.. תמונת הקרינה Confocal נרכשה על מיקרוסקופ לייזר סריקת SP5 Leica TCS שימשה לדמיין מיקום סיבים (מקווקו-line) וביטוי בתיווך נגיפי (ירוקה) באזור tegmental הגחון העכבר הבא in vivo גירוי optogenetic. נוירונים דופאמין (TH +) נראים בכחול. אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
וידאו 1. בגירוי optogenetic vivo:. היפראקטיביות במהלך גירוי VTA באמצעות SSFO בעכברי TH :: Cre אנא לחצו כאן כדי לצפות בסרטון זה.
| 1. irradiances אור השולחן יידרש להפעיל opsins נפוץ. | ||||
| Opsin Variant | λ | צפיפות הספק (/ 2 מ"מ) | מאפיינים | |
| הפעלה / הכיבוי קינטיקס | ||||
| עירור אופטי: channelrhodopsins המהיר-משחק | ||||
| ChR2 2 | 470 | 1 - 5mW | 1.21 אלפיות שניים / 12 | שריפות עד 40 הרץ |
| ChETA 19 | 490 | 5 mW | 0.86 / 8.5 msec | שריפות עד 200 הרץ |
| ראש 20 | 450 | 1.65 mW | 1.62 אלפיות שניים / 12 | צורה הלא מרדים של ChR2 |
| C1V 18 | 540-630 | 8 mW (540nm) | 5/34 אלפיות שניים על 540nm | עבר-אדום |
| 3.2 mW (630nm) | 67 אלפיות שני (על) ב630nm | |||
| עירור אופטי: rhodopsins ערוץ איטי-הפועל | ||||
| opsin פונקצית צעד היציב (SFO) 8 | 470/590 | 8 μW (470nm) | 20 msec דקות / 29 | גרסת SFO חדשה; מדינה כבר פתוחה. נפתח על-ידי 470 ננומטר, נסגר על ידי 590 ננומטר |
| עיכוב אופטי | ||||
| eNpHR3.0 21 | 560-630 | 3 - 5 mW | 2.5 msec / <10 אלפיות שני | עיכוב מתמשך למשך 30 דקות 22 עם אור קבוע * |
| 11 ArchT3.0, 23 | 520-560 | 1 - 5 mW | 2 / <10 אלפיות שניים | יותר רגיש עם photocurrents גדול מeNpHR3.0 |
| לוח זה ניתן כמדריך בלבד; irradiances אור הספציפי הנדרש לאפנון עצבי צריך להיות מאושר באופן עצמאי. | ||||
| אימות ניסיוני חשוב לוודא שopsin, אסטרטגית מיקוד, ופרמטרי גירוי אור לווסת ירי עצבי באופן שהתכוון 5. | ||||
| צפיפות הספק (mW / 2 מ"מ) מתייחסת לכוחו של האור האיר על שטח נתון של רקמת המוח ואינו מתייחסת לכוח האור הנפלט מקצה הסיב. | ||||
| * תמיד להשתמש בעוצמת האור הנמוכה ביותר האפשרי, במיוחד עם גירוי אור ממושך. | ||||
1. irradiances אור השולחן יידרש להפעיל opsins נפוץ.
קיצורים
AAV = וירוס adeno הקשורים
= DPSS מצב מוצק-נשאב דיודה
חלבון ניאון צהוב EYFP = משופר
FC / PC = תדבק שטוח / מגע פיזי
GFP = חלבון ניאון ירוק
מלח = פוספט שנאגרו PBS
PVC = פוליוויניל כלוריד
mW = milliwatt
NA = צמצם מספרי
SSFO = opsin צעד פונקציה היציב
TH = hydroxylase טירוזין
היגיון = טרנזיסטור-טרנזיסטור TTL
V = מתח
VTA = אזור tegmental הגחון
Discussion
בחרו הקופצים הלייזר תאר הנוכחי ואסטרטגיות קשירה תואמות עם מגוון רחב של בדיקות התנהגותיות מכרסמים. ואכן, מגוון רחב של בדיקות התנהגותיות היה בשימוש הבא, או נלווה, in vivo גירוי optogenetic הכוללים משימות רגשיות התנהגותיים, אוויר התנהגות, בלמידה ובזכרון פרדיגמות, שינה, התעוררות, ומשימות תיאבון עד כמה שם (ראה אל Nieh et. 6 לסקירה מקיפה). Optogenetics שינה את הדרך בי בדיקות התנהגותיות מסורתיות שנערכו במחקרים רב-יום שעכשיו אפשר לתמצת פגישה אחת שבה התנהגות היא בהשוואה, בתוך-נושאים, בתקופות שונות של אור 'על' לעומת 'off' 5. תאים של לב, מנגנונים התנהגותיים המכילים פתחים, סגורים או מכשולים אחרים עשויים להיות שונה כדי להכיל מעבר של סיבים קשורים.
Si היתר אסטרטגיות קשירה תארגירוי multaneous של עכברים מרובים מליזר יחיד. בדיקות התנהגותיות optogenetic תפוקה גבוהה ולכן יכולות להיות מושגות באמצעות השימוש בלייזר מרובה וציוד בדיקה. מספר בעלי החיים שיכולים להיות מגורה בו-זמנית, לעומת זאת, יהיה מוגבל על ידי כוח האור המקסימאלי שניתן להשיג בכל קצה סיב. כוח תפוקה מקסימלית בקצה הסיב תלויה 1 הכח מתחיל) של הלייזר; 2) יעילות צימוד ו 3) מספר פיצולי קורה. לליזר כחול 100 mW עם ~ 80% יעילות צימוד ועד 4 פיצולי קרן (כמתואר באיור 4C), הספק ממוצע בקצה הסיב יכול לנוע בין 5-10 mW בעת שימוש 200 מיקרומטר ליבה, 0.22 מיתרי תיקון סיבי NA (Nb מצפה אובדן הולכה ממפרקים סיבוביים להיות <15%). מדידת תפוקת אור בקצה הסיב היא חיונית לקביעת כוח אור מספיק להפעלת opsin כopsins שונה ברגישותם לאור ולכן צפיפות הספק האור (mW/ 2 מ"מ) הנדרש להפעלה 11. לדוגמא, opsin צעד הפונקציה היציבה (SSFO) פועל כמצברי פוטון ולכן דורש כוח צפיפות מעט מאוד אור להפעלה (<8 μW / מ"מ 2) 8. תשווה את זה לרודופסין הערוץ המסורתי (ChR2) שדורש מינימום של 1 mW / 2 מ"מ של אור כדי לעורר פוטנציאל פעולה 2. טבלת 1 מסופקת כהתייחסות מהירה לirradiances אור המינימום ידוע יידרש להפעיל opsins הנפוץ ביותר כיום ב להשתמש. לבסוף, יש לקחת בחשבון שמפזרים אור וסופג כשהוא עובר דרך רקמת המוח כך שהכח אור יותר נדרש למבנים מוחיים עמוקים יותר 3. משאב מקוון שימושי זמין בhttp://www.stanford.edu/group/dlab/cgi-bin/graph/chart.php אשר לחשב את עוצמת האור בעומקים שונים באמצעות רקמת מוח על ידי לקיחה בחשבון את גודל ליבת סיבים, צמצם מספרי, אורך גל של אור המשמש, וכוח האור מתחיל בקצה הסיב. לסקירה מצוינת של העקרונות התיאורטיים שבבסיס חישובים אלה, ראו אל Foutz et. (2012) 12. דוגמאות כיצד ליישם עקרונות אלה וחישובים לעיצוב ניסיוני הם הפגינו באל Aravanis et. (2007) 3 וטיי et al. (2012) 13. ביצוע חישובים אלה לפני תחילת ניסוי הוא חיוני כדי להבטיח irradiance אור מספיק להפעלת opsin. בהתחשב בשיקולים אלה, זה יתרון לרכוש לייזרים מופעלים גבוהה יותר כדי להבטיח פלט כוח מתאים. לייזרים עם תפוקת חשמל בין 100-200 mW הם בדרך כלל מספיק כדי לפצות על סיבים קטנים ליבה, פיצול סיבים מרובה, חוסר יעילות צימוד ושידור מאבד 7. אם אתם משתמשים בלייזרים בהספק גבוהים, לעומת זאת, יש להקפיד כדי למנוע נזק עצבי או חום והאור-עמיתממצאי ד שעלול להתרחש עם ממושכת ו / או גבוהה תאורת אור מופעל 7. טווח בטוח לניסויי in vivo הוא עד 75 mW / 2 מ"מ. 14
החלטה על הסוג של לייזר לרכישה יכולה להיות עניין מסובך כמו שיש גורמים שצריכים להתחשב. לדוגמא, דיודות לייזר ישיר לספק פלט פעם יותר יציב ודיר מאשר מצב מוצק לייזרים-נשאב דיודה (DPSS), ובם אמינות יותר לאורך הזמן בסביבת מעבדה. בחלק מהמקרים, עם זאת, לייזרי דיודה פולטים ישירים עלולים כוח אור נמוך, ~ 0.1 mW, גם כאשר מתח הפקודה הוא 0 V בשל הטיה קבועה נוכחית שנשלחו לדיודה על ידי האלקטרוניקה השליטה של הלייזר. יש פליטה 'ספונטנית' זה ספקטרום רחב יותר מאשר פליטת לייזר מאותה הלייזר, כך ניתן לצמצם באופן ספציפי על ידי התקנת להקה עוברת צר (או 'ניקוי') מסנן בין הלייזר והמצמד (ראה רשימת חלקים). מסנן זה גם יהיהלהפחית את תפוקת חשמל על ידי ~ 50% כאשר lasing, כך לרכוש לייזר מופעל גבוהה יותר בהתאם. יש לציין כי לייזרי DPSS צהובים רגישים במיוחד ועשויים להתנהג באופן לא סדיר וצמצמו את תוחלת חיים אם מווסת במהירות על ידי מחולל פעימות. התאמה של כוח הלייזר צהוב צריך להיעשות באמצעות גלגלי מסנן צפיפות חיצוניים ממוקמים בנתיב הקרן (סעיף 1.7) בעת הפעלת הלייזר בTTL + מצב. לחלופין, רכישת לייזר DPSS ננומטר ירוק 532 היא חלופה חסכונית שניתן להפעיל את שניהם halorhodopsins וarchaerhodopsins.
הצמצם המספרי (NA) של סיבים חשוב לשקול בעת תכנון ורכישת רכיבי סיבים להגדרת הרכבה לייזר. NA של סיבים אופטיים קובע את הזוויות של קרני אור שיכול להתקבל ונפלט בקצה סיב. אם סיבים גבוהים-NA הוא הזדווגו לסיבים תחתון NA, אובדן משמעותי יתרחש בממשק ש, ולכן חשוב להיות עקבי wi סיבי ה NA בתוך הגדרה אחת (או כדי להבטיח שNA מגדיל לאורך נתיב האור). ההשפעה של הסיבים NA בנפח של רקמת המוח המוארת היא פחות חשובה, שכן רקמת המוח היא מאוד פיזור, ומאחר שהאור בשילוב ממקור לייזר נוטה גבוהים NA סיבים 'underfill'; סיבים אופטיים ואולם עם NA של 0.22 ו0.37 נמצאים בשימוש נפוץ. בדומה לכך, צימוד מגדול-ליבה לסיבים קטנות יותר ליבות יהיו גם לגרום להפסדים ניכרים, כך שתמיד הקפידו להשתמש בקטרי ליבת הגדלת או שווים כאשר מתקדמים ממקור הלייזר לשתל בעלי החיים. בנימה כללית, תמיד צריכים להיות כתרים קצות סיבים כאשר אינו בשימוש כדי למנוע אבק והצטברות חלקיקים. זה רעיון טוב באופן קבוע קצות סיבים נקיים ומחברים (70% אלכוהול איזופרופיל עובד היטב) כדי להבטיח פלט כוח האור מקסימאלי, וכדי לבדוק את כוח תפוקת אור באמצעות 'שתל דמה' לפני תחילת הניסויים של כל יום.
"> במהלך בדיקות התנהגותיות, קיים הכרח כי יש לנקוט בצעדים כדי לשלוט על ההשפעות של זיהום ויראלי, ביטוי חלבון אקסוגני, אור הנראה, ואת השפעות אפשריות חימום רקמות וחפצים על התנהגות בעלי חיים. לכן, קבוצת הבקרה הנאותה צריכה להיות מורכבת של בעלי חיים transduced עם וירוס שליטה (לדוגמא, GFP, EYFP, mCherry) שמקבל פרמטרים גירוי אור זהים. אימות ניסיוני היא שלב סופי מכריע כנתונים התנהגותיים המשמשים לניתוח תלוי לחלוטין בopsin הנכון ומיקום סיבים אופטי באזור של עניין . באופן ספציפי, בבעלי חיים שבו אין אות immunohistochemical מזוהה, או שבו מיקום של אות או סיבים הוא לא באזור של עניין, נתונים אז התנהגות לבעלי החיים שיש להסיר מהניסוי. בנוסף, זה הכרחי כדי לבדוק את תפוקת אור ב טיפ הסיבים הן לפני השתלה כירורגית ושוב שלאחר המוות, כדי להבטיח כוח האור מספיק להפעלת opsin. באנימהls שבו אובדן אור חמור התרחש באמצעות הסיבים לאחר ניסויים (> 30%) 9, נתונים לבעלי החיים שיש לשקול להסרה. קריטריונים להסרת יש לקבוע מראש. לבסוף, יש לקחת בחשבון את תדירות הדופק נדרשת לווסת ירי עצבי, אשר יהיו תלויה במבנה המוח ותת-סוגים עצביים ממוקדים. פרמטרים גירוי אור פורסם optogenetic קיימים תת-סוגים עצביים מרובים, עם זאת, את היכולת לווסת את הירי עצבי צריכה להיות מאושר באופן עצמאי באמצעות in vivo או קלטות אלקטרו פרוסת המוח.כאחד הופך מיומן בשימוש בלייזר ושינוי של הגדרה קופצים לייזר, שילובים של אורכי גל שונים יכולים להיות קשורים לסיבים מרובים על בעלי חיים בודדים או נמסרו במורד אותו הסיב לoptogenetics קומבינטורית 8. גירוי רב-גל יהפוך חשוב יותר ויותר בהתחשב בהתפתחות המהירה של אדום-משמרתed channelrhodopsins 8, ההנדסה של opsins hyperpolarizing העביר הכחול 15, השימוש בopsins צעד פונקצית bistable 8,16,17, ורשימת הרחבת הכללית של opsins עם ספקטרום הפעלה שונה 11. הרחבה זו של ארגז הכלים optogenetic תאפשר שליטה חסרת תקדים של תת-סוגים עצביים מרובים בתוך ועל פני אזורים במוח כדי לקבוע את תפקידם בשלטון מדינות התנהגות מורכבת.
Disclosures
The authors have no conflicts of interest to report.
Acknowledgements
These studies were funded by grants received from the NIH (MH082876, DA023988).
Materials
| Name | Company | Catalog Number | Comments |
| 1. Laser Set-up | |||
| 100 mW 473nm or 488nm Diode Laser System , <2% Stability (quantity: 1) | Omicron | Luxx/Phoxx 473/488-100 | Optional accessory includes a remote control box with key switch and LED Display |
| 100 mW 594nm DPSS laser (quantity: 1) | Colbolt | 0594-04-01-0100-300 | 04-01 series yellow laser; sensitive to back reflection from fibers |
| 200 mW 532 nm DPSS laser; 5% power stability (quantity: 1) | Shanghai Lasers | GL532T3-200 | Cost-effective alternative to yellow DPSS laser for activation of halorhodopsins and archaerhodopsins |
| Non-contact style laser to multimode fiber coupler (quantity: 1) | OZ Optics | HPUC-23-400/700-M-20AC-11 | For use with dual laser set-up; Specs: 33 mm OD for 400 - 700 nm; FC receptacle, f = 20 mm lens with post mount laser head adapter #11 |
| Aluminum breadboard, 12" x 18" x 1/2", 1/4"-20 Threaded (quantity: 1) | Thorlabs | MB1213 | For dual laser system |
| Aluminum breadboard, 10" x 12" x 1/2". 1/4"-20 Threaded (quantity: 1) | Thorlabs | MB1012 | For single laser system |
| Aluminum breadboard, 4" x 6" x 1/2", 1/4"-20 Threaded (quantity: 2) | Thorlabs | MB4 | For blue laser; dual laser system |
| Compact variable height clamp, 1/4"-20 Tapped (quantity: 4) | Thorlabs | CL3 | |
| 3/4" stainless post (quantity: 1) | Thorlabs | TR075 | |
| 1" stainless post (quantity: 4) | Thorlabs | TR1 | |
| Post holder with spring-loaded hex-locking thumbscrew (quantity: 2) | Thorlabs | PH1 | |
| Pedestal Base Adapter (quantity: 3) | Thorlabs | BE1 | |
| Small Clamping Fork (quantity: 3) | Thorlabs | CF1253 | |
| Kinematic mount for 1" optics with visible laser quality mirror (quantity: 3) | Thorlabs | KM100-E02 | |
| Neutral filter density wheel (quantity: 1) | Thorlabs | NDC-50C-2M | |
| 1" Longpass dichroic mirror 50% (quantity: 1) | Thorlabs | DMLP505 | |
| Kinematic mount for 1" optics (quantity: 1) | Thorlabs | KM100 | For dichroic mirror |
| 20-piece hex wrench kit with stand (quantity: 1) | Thorlabs | TC2 | |
| 1/4"-20 cap screw and hardware kit (quantity: 1) | Thorlabs | HW-KIT2 | |
| Mounting base 1" x 2.3" x 3/8" (quantity: 1) | Thorlabs | BA1S | |
| FC/PC to FC/PC L-Bracket mating sleeve (quantity: 2) | Thorlabs | ADAFCB1 | Dual FC/PC L-bracket also available |
| Breadboard lifting handles (quantity: 3) | Thorlabs | BBH1 | |
| Ø1" Bandpass Filter, CWL = 450 ± 2 nm, FWHM = 10 ± 2 nm (quantity: 1) | Thorlabs | FB450-10 | For use with diode lasers that spontaneously emit |
| 2. Laser Coupling | |||
| ! Laser protective eyewear (quantity: 1 for every user at each wavelength) | Various | ! Consult with laser provider to ensure proper selection of eyewear that will provide maximal light attenuation for the purchased laser | |
| Fiber optic cable tester (quantity: 1) | Eclipse | 902-186N | |
| One-step fiber connector cleaner (quantity: 1) | Thorlabs | FBC1 | |
| Coupler patch cord (0.75 meter) (quantity: 1) | Thorlabs | 0.75 m 200 μm core, 0.22 NA, FC/PC connectors multimode fibers; for dual laser system | |
| Coupler patch cord (0.5 meter) (quantity: 1) | Thorlabs | 0.5 m 200 μm core, 0.22 NA, FC/PC connectors, multimode; for single laser system | |
| Doric mini cube (quantity: 2) | DORIC | DMC_1x2_FC-2FC | |
| Compact power and energy meter console (quantity: 1) | Thorlabs | PM100D | Digital 4" LCD |
| C-series slim power sensor 5 - 500 mW (quantity: 1) | Thorlabs | S130C | Multiple detectors types are available; check with vendor |
| 3. In vivo Optogenetic Stimulation | |||
| Multimode fiber splitters (quantity: 2) | FONT Canada | Large core fiber optic 1 x 2 splitter, 50/50 ratio, FC connectors, ruggedized. Length, core size and numerical aperture can be specified when ordering; cost-effective smaller core sizes available | |
| Arbitrary waveform function generator (2 channel) (quantity: 1) | Rigol | DG1022 | Can control up to 2 lasers at once |
| Fiber optic rotary joint (commutator) (quantity: 6 - 8) | DORIC* | FRJ_1X1_FC-FC | *Also available through Thorlabs and Prizmatix |
| Animal patch cords (Custom Mono Fiberoptic Cannula with 10mm ferrules, FC/PC connector) (quantity: 8) | DORIC | MFP_200/240/900-0.22_2m_FC-MF2.5 | Length, core size and numerical aperture can be specified when ordering; alternatively, these can be made custom made in-house (see Sparta et al. 2012)9. |
| PFP ceramic split sleeve, 2.5mm ID, 11.40mm length (25/pkg) (quantity: 1) | Precision fiber Products | SM-CS1140S1 | Used for attaching implanted fiber optic on animal to a light-delivering fiber patch cord with flat cleeve (FC) end |
| Clear dust caps for Ø2.5 mm ferrules (25/pkg) (quantity: 1) | Thorlabs | CAPF | |
| Metal cap for FC/PC and FC/APC mating sleeves (quantity: 1) | Thorlabs | CAPF1 | |
| Thick-jacketed patch cords (custom order) (quantity: 4) | Thorlabs | 200 μm core, 0.22 NA, FC/PC connectors multimode fibers; length, core size, and numerical aperture can be specified when ordering | |
References
- Zhang, F., et al. The microbial opsin family of optogenetic tools. Cell. 147, 1446-1457 (2011).
- Boyden, E. S., Zhang, F., Bamberg, E., Nagel, G., Deisseroth, K. Millisecond-timescale genetically targeted optical control of neural activity. Nat Neurosci. 8, 1263-1268 (2005).
- Aravanis, A. M., et al. An optical neural interface: in vivo control of rodent motor cortex with integrated fiberoptic and optogenetic technology. J Neural Eng. 4, S143-156 (2007).
- Sidor, M. M. Psychiatry's age of enlightenment: optogenetics and the discovery of novel targets for the treatment of psychiatric disorders. J Psychiatry Neurosci. 37, 4-6 (2012).
- Tye, K. M., Deisseroth, K. Optogenetic investigation of neural circuits underlying brain disease in animal models. Nat Rev Neurosci. 13, 251-266 (2012).
- Nieh, E. H., Kim, S. Y., Namburi, P., Tye, K. M. Optogenetic dissection of neural circuits underlying emotional valence and motivated behaviors. Brain Res. 1511, 73-92 (2013).
- Yizhar, O., Fenno, L. E., Davidson, T. J., Mogri, M., Deisseroth, K. Optogenetics in neural systems. Neuron. 71, 9-34 (2011).
- Yizhar, O., et al. Neocortical excitation/inhibition balance in information processing and social dysfunction. Nature. 477, 171-178 (2011).
- Sparta, D. R., et al. Construction of implantable optical fibers for long-term optogenetic manipulation of neural circuits. Nat Protoc. 7, 12-23 (2012).
- Kravitz, A. V., Owen, S. F., Kreitzer, A. C. Optogenetic identification of striatal projection neuron subtypes during in vivo recordings. Brain Res. 1511, 21-32 (2013).
- Mattis, J., et al. Principles for applying optogenetic tools derived from direct comparative analysis of microbial opsins. Nat Methods. 9, 159-172 (2012).
- Foutz, T. J., Arlow, R. L., McIntyre, C. C. Theoretical principles underlying optical stimulation of a channelrhodopsin-2 positive pyramidal neuron. J Neurophysiol. 107, 3235-3245 (2012).
- Tye, K. M., et al. Amygdala circuitry mediating reversible and bidirectional control of anxiety. Nature. 471, 358-362 (2011).
- Cardin, J. A., et al. Targeted optogenetic stimulation and recording of neurons in vivo using cell-type-specific expression of Channelrhodopsin-2. Nat Protoc. 5, 247-254 (2010).
- Chow, B. Y., et al. High-performance genetically targetable optical neural silencing by light-driven proton pumps. Nature. 463, 98-102 (2010).
- Diester, I., et al. An optogenetic toolbox designed for primates. Nat Neurosci. 14, 387-397 (2011).
- Berndt, A., Yizhar, O., Gunaydin, L. A., Hegemann, P., Deisseroth, K. Bi-stable neural state switches. Nat Neurosci. 12, 229-234 (2009).
- Ung, K., Arenkiel, B. R. Fiber-optic implantation for chronic optogenetic stimulation of brain tissue. J Vis Exp. , e50004 (2012).
- Gunaydin, L. A., et al. Ultrafast optogenetic control. Nat Neurosci. 13, 387-392 (2010).
- Lin, J. Y., Lin, M. Z., Steinbach, P., Tsien, R. Y. Characterization of engineered channelrhodopsin variants with improved properties and kinetics. Biophys J. 96, 1803-1814 (2009).
- Gradinaru, V., et al. Molecular and cellular approaches for diversifying and extending optogenetics. Cell. 141, 154-165 (2010).
- Goshen, I., et al. Dynamics of retrieval strategies for remote memories. Cell. 147, 678-689 (2011).
- Han, X., et al. A high-light sensitivity optical neural silencer: development and application to optogenetic control of non-human primate cortex. Front Syst Neurosci. 5 (18), (2011).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved