Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Desarrollo y mantenimiento de un tumor del paciente preclínicos Derivado modelo de xenoinjerto para la Investigación de Novela Anti-Cancer Therapies
En este artículo
Resumen
La utilización de los tumores derivados del paciente en un modelo preclínico subcutánea es una manera excelente para estudiar la eficacia de nuevas terapias, el descubrimiento de biomarcadores predictivos y vías resistentes a los fármacos. Este modelo, en el proceso de desarrollo de fármacos, es fundamental para determinar el destino de muchas nuevas terapias contra el cáncer antes de la investigación clínica.
Resumen
Patient derived tumor xenograft (PDTX) models provide a necessary platform in facilitating anti-cancer drug development prior to human trials. Human tumor pieces are injected subcutaneously into athymic nude mice (immunocompromised, T cell deficient) to create a bank of tumors and subsequently are passaged into different generations of mice in order to maintain these tumors from patients. Importantly, cellular heterogeneity of the original tumor is closely emulated in this model, which provides a more clinically relevant model for evaluation of drug efficacy studies (single agent and combination), biomarker analysis, resistant pathways and cancer stem cell biology. Some limitations of the PDTX model include the replacement of the human stroma with mouse stroma after the first generation in mice, inability to investigate treatment effects on metastasis due to the subcutaneous injections of the tumors, and the lack of evaluation of immunotherapies due to the use of immunocompromised mice. However, even with these limitations, the PDTX model provides a powerful preclinical platform in the drug discovery process.
Introducción
El cáncer colorrectal (CCR) es un importante contribuyente a las muertes por cáncer en los Estados Unidos. En 2015, había un estimado de 132.700 nuevos casos de CCR con 49.700 muertes 1. Aunque el pronóstico en pacientes con enfermedad localizada es excelente, los pacientes con enfermedad avanzada tienen resultados pobres, haciendo de esta una de las principales prioridades en el desarrollo de nuevas terapias. A pesar de los regímenes estándar de cuidado quimioterapéuticos y biológicos más nuevos que se implementan contra esta enfermedad, sólo ha habido un aumento gradual en la supervivencia global. En consecuencia, hay un esfuerzo significativo en la comprensión de las vías conductor implicado en facilitar el crecimiento del tumor en esta enfermedad. La Red Atlas del Genoma del Cáncer ha identificado recientemente numerosas vías principales que están implicados en la desregulación y CRC incluyen: WNT, fosfoinosítido 3-quinasa (PI3K), RAS, factor de crecimiento transformante-β (TGF-β) y TP53 2. Juntos, con la descripción de las investigaciones otsus vías que potencien el crecimiento en el CCR han encendido el desarrollo de nuevas terapias destinadas a mejorar significativamente la supervivencia en esta población de pacientes 3-5. Utilizando modelos preclínicos en el desarrollo de fármacos oncológicos han sido esenciales en este proceso en la predicción de la actividad clínica de estos nuevos compuestos.
Varios modelos preclínicos se han utilizado en el proceso de desarrollo de fármacos. Teniendo en cuenta que los modelos animales preclínicos transgénicas y líneas celulares inmortalizadas no han tenido éxito en la determinación de la actividad clínica de nuevas terapias de oncología, en gran parte debido a su incapacidad para reflejar la complejidad de los tumores humanos, se han establecido derivado del paciente de xenoinjertos de tumores (PDTX) modelos. La mayor ventaja de este modelo es que la heterogeneidad del tumor se mantiene intacto y refleja fielmente las características moleculares y clonalidad del tumor del paciente 6-9 originario. PDTX modelos proporcionan una excelente in vivoplataforma preclínico para el estudio de nuevos agentes, las vías de resistencia a fármacos, estrategias combinatorias, y la biología de células madre del cáncer 10.
Una visión general del proceso de PDTX se ilustra en la Figura 1. Se inicia en la clínica, consintiendo pacientes para permitir que parte de su exceso de tejido tumoral que se utilizará para esta investigación. A continuación, en la cirugía, un pedazo del tumor se ganó en total por un patólogo y puesto en los medios de comunicación para ser transportado a personal de investigación. Inmediatamente después de esto, una sección del tumor se corta en trozos pequeños y trasplantado en ratones inmunodeficientes subcutáneamente. Una vez que el tumor crece, es pasado en diferentes generaciones de ratones con el fin de mantener el tumor 10. Normalmente, después de la generación F3 del tumor se puede ampliar en un estudio de tratamiento donde se evalúan nuevos compuestos y / o terapias combinadas. Utilizando Next Gen SEQ (Exoma Seq, ARN SEQ y SNP array) potenciales biomarcadores predictivos son descubrired que ayudan en la selección de pacientes que podrían beneficiarse de la de un tratamiento particular.
Los objetivos generales de la utilización de modelos PDTX son los siguientes: 1) evaluar la eficacia de las terapias innovadoras como agente único o en combinación y 2) identificar biomarcadores predictivos de sensibilidad o resistencia antes de la investigación clínica. En este manuscrito, proporcionamos la metodología en la iniciación y mantenimiento de un banco CRC PDTX y proporcionar las ventajas y limitaciones de este modelo de desarrollo descubrimiento de fármacos.
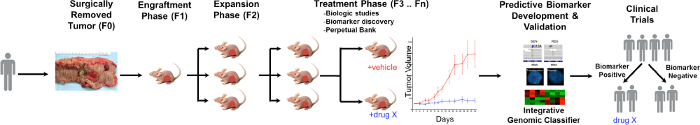
Figura 1. Descripción general del modelo de protocolo CRC PDTX. Un tumor derivado del paciente se recibe de la cirugía e inmediatamente se inyecta en ratones desnudos atímicos por vía subcutánea. Una vez que el tumor crece, se expande en las generaciones posteriores y, finalmente, se expandió por los estudios de tratamiento. tratamiento RESPOns son evaluados y biomarcadores predictivos son identificados que pueden ayudar en la selección de los pacientes. Haga clic aquí para ver una versión más grande de esta figura.
Protocolo
Declaración de Ética: las muestras de tumor de adenocarcinoma colorrectal derivados de los pacientes se obtuvieron de pacientes que consienten en la Universidad de Colorado Hospital, de acuerdo con un protocolo aprobado por la Junta de Revisión Institucional múltiple Colorado (08 a 0439). Todo el trabajo de los animales se realizó en animales protocolos aprobados por la Universidad de Colorado en Denver Institucional Cuidado de Animales y el empleo Comisión (IACUC, Protocolo # 51412 (06) 1E y 96813 (04) 1E).
1. Recepción y Preparación de la sangre del paciente
- Recoger 1 - 2 ml de sangre en un tubo de separación de sangre / célula que contiene citrato de sodio (fases tubo incluidos son plasma, linfocitos y monocitos banda, líquido de gradiente de densidad, la barrera de gel, y los eritrocitos y neutrófilos). Precaución, siga las pautas transmitidos por la sangre con el patógeno de la sangre o tejido.
Nota: Las PBMC y plasma podrían ser utilizados para estudios futuros que pueden incluir: la comparación de la variación genética de la línea germinal con mutaciones tumorales, aislando Circulalas células tumorales Ting, que evaluaron el ADN celular gratis (cfDNA), que examinan las proteínas y los microARNs, etc. - Centrifugar el tubo de separación / glóbulos en 2500 xg durante 15 min sin freno a temperatura ambiente.
- Recoger las células mononucleares de sangre periférica (CMSP en linfocitos y la banda de los monocitos del tubo) y puesto en un tubo de 1.5 ml (claro, autoclave, DNasa, RNasa y libre de pirógenos), y llene hasta la parte superior del tubo con tamponada con fosfato estéril Saline (PBS).
- Centrifugar a 2300 xg durante 3 min a temperatura ambiente para formar un sedimento de PBMC en la parte inferior del tubo. A continuación, eliminar el sobrenadante con cuidado. Añadir 1 ml de PBS estéril para lavar el sedimento y se centrifuga a 3.000 g durante 30 segundos y luego eliminar el sobrenadante.
- Utilizar una pipeta para recoger el plasma del tubo de separación de sangre / célula (en fase de plasma del tubo) en un vial criogénico de 1,5 ml estéril (DNasa y RNasa libre, ningún ADN humano, libre de endotoxinas) y poner el plasma y el sedimento de PBMC de en una -80 ° C freezer para el almacenamiento.
2. Recepción y Preparación del Paciente muestra de tumor
- Preparar ya sea RPMI o medio DMEM con 1: 100 (10%) de penicilina-estreptomicina y no esenciales aminoácidos, 1: 1000 (1%) Plasmocin, y 10% inactivado suero bovino fetal (medio completo) y añadir 20 a 25 ml a un recipiente de recolección estéril para el espécimen.
- Recuperar muestra de tumor en un recipiente estéril que contiene un medio completo sobre hielo o mantener a 4 ° C.
Nota: La muestra de tumor es una pieza de un exceso de tejido tumoral del paciente que se elimina por un cirujano, procesada por un patólogo, y se coloca en un recipiente de recolección estéril con medio completo. Precaución, siga las pautas transmitidos por la sangre con el patógeno de la sangre o tejido. Además, idealmente para inyectar cinco ratones, el tumor debe ser de aproximadamente 1 cm $ ³ $. - Llevar la muestra tumoral para la instalación de animales para inyectar en ratones inmunodeprimidos.
Nota: Es mejor para procesar la muestra de tumor tan pronto como sea posible.- En una campana de flujo laminar, colocar la muestra de tumor en un plato de corte de plástico estéril de la copa del tumor. Con unas tijeras en autoclave-pequeñas y pinzas para cortar en 10 - 12 piezas de aproximadamente 3 x 3 x 3 mm y colocar en un tubo de microcentrífuga de 1,5 ml en autoclave llena con 300 l de solución de mezcla de proteína gelatinosa. Mantener el tubo en hielo.
- Como prioridad inyectar tumoral en ratones, pero si hay cualquier tumor que queda, recoger los viales se congelaron rápidamente (FF) tazas, fijados con formol y embebidos en parafina (FFPE), y un vial de tumor viable.
- Para FF, recoger pequeños trozos de tejidos tumorales de un vial criogénico estéril para su posterior análisis como la proteína, el ARN, o el aislamiento de ADN. Coloque FF inmediatamente en un termo de nitrógeno líquido y almacenar a largo plazo en un congelador a -80ºC.
- Para FFPE, si hay suficiente tumor, el lugar 3 pequeños trozos en una taza de formalina 10 ml 10% y el proceso en bloques incrustados de parafina una vez tumor ha sido en formalina durante al menos 24 h.
Nota: 24 h se basafuera de nuestras sugerencias Histología 11 de núcleo. - Por último, colocar el tumor restante en un tubo criogénico. Hacer medios viables mediante la adición de 10% sulfóxido de dimetilo (DMSO) para completar los medios de comunicación. A continuación, añadir 1 ml a un tubo criogénico y almacenar en hielo. Nota: No mantener en hielo durante largos períodos de tiempo.
- Cortar cualquier tumor en pequeños trozos sobrantes que idealmente será suficiente para 10 tumores que se inyecta en 5 ratones en el futuro. A continuación, colocar el tubo de tumor viable en hielo hasta que se puede colocar en un recipiente de congelación alcohol isopropílico (lentamente congela el tumor 1 ° C a la vez) y se pone en -80 ° C congelador para asegurarse de que los tumores no mueren durante el proceso de congelación.
Nota: Para el almacenamiento a largo plazo los tumores se extirpan (después de 2 - 3 días) y se colocaron en un gran vaso Dewar de nitrógeno líquido. Tenga en cuenta que los tubos viables no se debe permitir que se descongele a no ser que se está tomando a cabo para inyectar en ratones.
- Cortar cualquier tumor en pequeños trozos sobrantes que idealmente será suficiente para 10 tumores que se inyecta en 5 ratones en el futuro. A continuación, colocar el tubo de tumor viable en hielo hasta que se puede colocar en un recipiente de congelación alcohol isopropílico (lentamente congela el tumor 1 ° C a la vez) y se pone en -80 ° C congelador para asegurarse de que los tumores no mueren durante el proceso de congelación.
3.La inyección de derivados de los pacientes xenoinjertos de tumores
- Utilice cinco 6 - 8 semanas de edad macho y / o ratones desnudos atímicos hembra (de células T deficientes) para cada tumor derivado del paciente por separado. Inyectar un total de 10 tumores (2 inyecciones por ratón) por vía subcutánea (SQ).
Nota: El tumor humano original es designado como F0 y luego una vez inyectado en ratones la próxima generación es F1. Además, el uso de fórceps, tijeras, tratado al autoclave y trócares para cada explante única. - piezas de carga de tumor de la solución de la mezcla de proteína gelatinosa en tratados en autoclave 12 trócares G y asegurar que el tumor está completamente introducido en el trocar.
- En una campana de flujo laminar estéril, coloque 5 ratones en una caja de la anestesia que está conectado a una máquina de isoflurano anestesia (iniciado en la velocidad inicial de 5% de isoflurano, 3-4% de oxígeno, y 2-3% de isoflurano para el mantenimiento de la anestesia) y el filtro de carbón (absorbe el exceso de gas).
Nota: Un técnico experimentado debe ser capaz de realizar todo el procedimiento deuna jaula de 5 ratones dentro de aproximadamente 5 min (aproximadamente 30 segundos por ratón). Por lo tanto el apoyo térmica adicional y la lubricación del ojo no se utilizan generalmente. Para las personas con menos experiencia o durante el entrenamiento, es muy recomendable que los individuos, ya sea realizar el procedimiento en menos de animales al mismo tiempo y / o utilizan una almohadilla de lubricación / ojo calentamiento durante el procedimiento si los animales se anestesiaron más de 5 minutos. Procedimiento se basa en las normas del IACUC en nuestra universidad.
- En una campana de flujo laminar estéril, coloque 5 ratones en una caja de la anestesia que está conectado a una máquina de isoflurano anestesia (iniciado en la velocidad inicial de 5% de isoflurano, 3-4% de oxígeno, y 2-3% de isoflurano para el mantenimiento de la anestesia) y el filtro de carbón (absorbe el exceso de gas).
- Pinch un dedo del pie ratón para garantizar el ratón ya no responde, a continuación, tomar el ratón fuera de la caja isoflurano. Coloca el ratón sobre un campo limpio para inyectar tumores en la región dorsal del cuello media y arrastrando hacia abajo el trocar por vía subcutánea hasta la región del flanco se alcanza con 12 tratados en autoclave trócares G.
- Entregar subcutáneamente un tumor a cada lado de flanco del ratón. Pellizcar el tumor cuando el trocar se extrae, asegurando que el tumor permanece en la región de flanco deseado. el gemezcla de proteínas latinous se endurece con la temperatura corporal del ratón y encapsula el tumor durante aproximadamente 1 semana para ayudar al crecimiento del tumor y fijarlo al tejido conectivo SQ. La lesión hecha por el trocar no es mayor que 4 mm y no hay necesidad de cerrar la piel con grapas.
Nota: Nuestros veterinarios determinaron ningún cierre se necesita basa en muy pequeño tamaño de la lesión, el tiempo de curación rápida (región dorsal del cuello media reduce cualquier tensión de la piel o el aseo de la lesión), no hay infecciones observadas, y un estrecho seguimiento de los animales durante este período de tiempo .
- Entregar subcutáneamente un tumor a cada lado de flanco del ratón. Pellizcar el tumor cuando el trocar se extrae, asegurando que el tumor permanece en la región de flanco deseado. el gemezcla de proteínas latinous se endurece con la temperatura corporal del ratón y encapsula el tumor durante aproximadamente 1 semana para ayudar al crecimiento del tumor y fijarlo al tejido conectivo SQ. La lesión hecha por el trocar no es mayor que 4 mm y no hay necesidad de cerrar la piel con grapas.
- Antes de que el ratón está totalmente despierto inject Meloxicam 2 mg / kg SQ (medicamentos para el dolor) de distancia del sitio de la inyección del tumor. A continuación, colocar el puntero del ratón en la jaula y monitorear hasta que el ratón está despierto y en movimiento.
Nota: No deje desatendida la recuperación de los animales hasta que esté completamente despierto. la dosis de meloxicam se basa en las normas del IACUC en nuestra universidad.- A continuación, repita el mismo procedimiento con el 4restante ratones y controlar su respiración.
Nota: Tenga en cuenta que este es un procedimiento muy rápido y los ratones se despierta muy pronto después de la inyección Meloxicam, pero isoflurano ajustar según sea necesario. Cada vez que un ratón se saca, baje el isoflurano. El meloxicam tendrá una duración de 24 horas y las lesiones de los trócares se cura totalmente en 1 semana.
- A continuación, repita el mismo procedimiento con el 4restante ratones y controlar su respiración.
4. Mantenimiento de los derivados de los pacientes xenoinjertos de tumores Banco
- Controlar el crecimiento y la salud de los ratones al menos una vez por semana. Use una hoja de cálculo (u otro sistema de seguimiento) para realizar un seguimiento del tamaño del tumor, la generación del cáncer, la fecha de la inyección del tumor, y la salud de los ratones.
Nota: Si los ratones han perdido 15% de su peso corporal original, condición corporal baja (≥ 2), han ulceraciones tumorales, tumores alcanzando 2,000 mm 3 o tumores total de 3.000 mm3, o están enfermos (encorvada, frío, letargo, etc. .) de cualquier forma, los ratones son sacrificados a través de CO₂ o anestesiados seguido por dislocación cervical como comoecondary método. La eutanasia a través de la anestesia y la dislocación cervical si la recogida del tumor, de lo contrario los ratones son sacrificados a través de CO₂ y dislocación cervical. - Cuando un tumor es de aproximadamente 1,500-2,000 mm 3 anestesiar a los ratones como se describe arriba y luego realizar la dislocación cervical para la eutanasia.
- Compruebe que el ratón sin latido. Extirpar el tumor SQ con tijeras y pinzas tratadas en autoclave.
NOTA: Permitir que los tumores crezcan hasta por 1 año y si no se observa tumor continuación, la eutanasia a los ratones a través de CO 2, seguido por dislocación cervical como método secundario. - Pasaje el mejor tumor que está creciendo en la próxima generación (también conocido como un nuevo conjunto de 5 ratones). Use las instrucciones de arriba para recoger 10 - 12 para el paso de los tumores y luego recoger el tumor de sobra como también se ha descrito anteriormente.
Nota: El cobro de numerosos tubos viables es muy importante en las primeras generaciones (F1 - F8); Por lo tanto, recoger varios tubos, tubos viables FF, y 1 FFPE por geion. - Mantener a los ratones restantes hasta que una nueva generación de ratones tiene el crecimiento del tumor de aproximadamente 300 mm3. Cuando los ratones restantes tienen tumores que son grandes, continuar para recoger como se describe anteriormente.
- Compruebe que el ratón sin latido. Extirpar el tumor SQ con tijeras y pinzas tratadas en autoclave.
- Continuar con los tumores de paso y recoger en cada etapa hasta F15. En este punto, tome un tubo viable de la primera generación posible de nitrógeno líquido y dejar descongelar en hielo y siga los procedimientos de inyección de tumores descritos anteriormente.
Nota: Los tumores que crecen a partir de tubos viables toman más tiempo para crecer en comparación con los ratones que pasa de generación en generación, así que tenlo en cuenta al planificar. Si un modelo PDTX particular, ya no es necesario en cualquier pasaje, la eutanasia y recoger el tumor, para garantizar numerosos tubos viables se recogen para su uso futuro.
5. Desarrollo Terapéutica con derivados de los pacientes xenoinjertos de tumores
Nota: La mayoría de los tumores en la generación F3 tienen una buena cinética de crecimiento (crecen más rápido y más consistent), por lo tanto, proceder a PDTX estudios de eficacia de los medicamentos.
- Cuando el tumor deseado es muy grande (1500 - 2000 mm 3), siga los procedimientos de arriba para recoger tumor para expandirse en cantidad deseada de ratones.
- Dependiendo de la hipótesis que está siendo probado determinar el número de tumores por grupo de tratamiento necesarios.
Nota: 1 ml de solución mezcla de proteína gelatinosa puede aproximadamente ajuste 30 piezas tumorales pequeñas (en función de la morfología del tumor) para inyectar en ratones.
- Dependiendo de la hipótesis que está siendo probado determinar el número de tumores por grupo de tratamiento necesarios.
- Verificar los ratones con tumores semanales y cuando la mayoría de los tumores son visiblemente pequeña (aproximadamente entre 50 a 300 mm $ ³ $) medir los tumores con calibradores para determinar el volumen del tumor. El volumen del tumor = [width² (medición más pequeño) x longitud (medida más grande)] x 0,52.
Nota: La solución de la mezcla de proteína gelatinosa rodea las piezas tumorales inyectadas por una semana, a continuación, después del crecimiento del tumor una semana será exacta. - Usa los volúmenes tumorales entre 50 - 300 mm $ ³ $ y lan promediar la tumores izquierdo y derecho. A continuación, selecciona aleatoriamente en grupos de tratamiento con 10 tumores por grupo y una media de grupo dentro de un par de números de diferencia. A continuación, ordenar los ratones en grupos y comenzar el estudio de tratamiento deseado.
- La dosis a los ratones con el fármaco (horario depende de la droga), pesar y medir (tumor) dos veces por semana. Al final del estudio, la eutanasia a los ratones a través de la anestesia y la dislocación cervical y recoger tumor para el análisis farmacodinámico futuro en el laboratorio.
Nota: El estudio tiene una duración de 30 días, dependiendo del tamaño del tumor vehículo y la salud de los ratones.
6. Organización de un banco PDTX
- Mantener una forma bien documentada para prevenir la repetición de la investigación y el uso apropiado de los animales.
NOTA: Esto es clave para un banco PDTX éxito.- Utilizar hojas de cálculo para realizar un seguimiento de un tumor del paciente en la clínica humana, a los ratones en el banco PDTX, tratamientos de datos, y lo que se recoge. Nota: esto incluye congelador, termos de nitrógeno líquidoY almacenamiento FFPE también.
Resultados
Similitudes de mutaciones comunes en los modelos CRC PDTX y el TCGA
Hemos investigado si el porcentaje de mutaciones comunes (KRAS, las ANR, BRAF, PIK3CA, APC, CTNNB1 y TP53) en el banco CRC PDTX eran representativas de la frecuencia de mutación se observa en la población de pacientes de CRC. Como se muestra en la Figura 2A (TCGA) y B (CRC banco PDTX), la frecuencia...
Discusión
La plataforma de descubrimiento de fármacos PDTX ofrece un modelo mejorado de las deficiencias de otros modelos preclínicos que son poco fiables para predecir la actividad clínica de nuevos compuestos. Es importante destacar que los tumores en este modelo son biológicamente estable, retener potencial metastásico, y muestran la capacidad de respuesta droga similar de generación en generación. En este modelo, los tumores de pacientes derivada se inyectan en ratones desnudos atímicos, pases, y posteriormente utiliz...
Divulgaciones
The authors have nothing to disclose.
Agradecimientos
This work was supported by grant 1R01CA152303-01.
Materiales
| Name | Company | Catalog Number | Comments |
| RPMI or DMEM | Corning | 10-040-CV | |
| Penicillin-Streptomycin | Corning | 30-002-CI | |
| Non-essential Amino Acids | Corning | 25-025-CI | |
| Fetal Bovine Serum | Corning | 35-010-CV | Thaw in -4 °C, then activate for 30 min at 60 °C water bath |
| CPT blood tube | BD vacutainer | 362761 | |
| Microcentrifuge tube | Surelock | A-7002 | |
| Phosphate-Buffered Saline | Corning | 21-040-CV | |
| Cyrogenic vials | Cyroking | C0732901 | |
| Plastic tumor cutting dish | Trueline | TR4001 | |
| Scissors | Roboz | RS-5881 | |
| Forceps | Roboz | RS-5135 | |
| Matrigel (gelatinous protein mixture) | Corning | 354234 | Store at -20 or -80 °C, then thaw on ice, do not leave at RT |
| 10% Formalin cups | Protocol | 032-059 | |
| Liquid Nitrogen Dewar Storage | Thermolyne | CY50900 | |
| Portable liquid nitrogen dewar | Nalgene | 4150-2000 | |
| Dimethyl Sulfoxide | Fischer | 67-68-5 | |
| Freezing container: Mr Frosty | Nalgene | 5100-0001 | |
| Isopropyl Alcohol | Decon | 64-17-5 | |
| Trocars | Innovative Research of America | MP-182 | |
| Anesthesia machine | Patterson Veterinary | ||
| Anesthesia box | Patterson Veterinary | ||
| Isoflurane | Vet one | 1038005 | |
| F-Air Canister | Bickford Omnicon | 80120 | |
| Meloxicam | Vet one | 5182-90C | |
| Calipers | Fowler | 54-100-167 | |
| Weight scale | Ohaus | Scout Pro SP601 |
Referencias
- Siegel, R. L., Miller, K. D., Jemal, A. Cancer statistics. 2015. CA Cancer J Clin. 65 (1), 5-29 (2015).
- . Comprehensive molecular characterization of human colon and rectal cancer. Nature. 487 (7407), 330-337 (2012).
- Arcaroli, J. J., et al. Tumours with elevated levels of the Notch and Wnt pathways exhibit efficacy to PF-03084014, a gamma-secretase inhibitor, in a preclinical colorectal explant model. Br J Cancer. 109 (3), 667-675 (2013).
- Hubbard, J., Grothey, A. Antiangiogenesis agents in colorectal cancer. Curr Opin Oncol. 22 (4), 374-380 (2010).
- van Es, J. H., et al. Notch/gamma-secretase inhibition turns proliferative cells in intestinal crypts and adenomas into goblet cells. Nature. 435 (7044), 959-963 (2005).
- Cassidy, J. W., Caldas, C., Bruna, A. Maintaining Tumor Heterogeneity in Patient-Derived Tumor Xenografts. Cancer Res. 75 (15), 2963-2968 (2015).
- Jin, K., et al. Patient-derived human tumour tissue xenografts in immunodeficient mice: a systematic review. Clin Transl Oncol. 12 (7), 473-480 (2010).
- Julien, S., et al. Characterization of a large panel of patient-derived tumor xenografts representing the clinical heterogeneity of human colorectal cancer. Clin Cancer Res. 18 (19), 5314-5328 (2012).
- Siolas, D., Hannon, G. J. Patient-derived tumor xenografts: transforming clinical samples into mouse models. Cancer Res. 73 (17), 5315-5319 (2013).
- Tentler, J. J., et al. Patient-derived tumour xenografts as models for oncology drug development. Nat Rev Clin Oncol. 9 (6), 338-350 (2012).
- Carson, F. L. . Histotechnology: A Self-Assessment Workbook. , (1996).
- Arcaroli, J. J., et al. Common PIK3CA mutants and a novel 3' UTR mutation are associated with increased sensitivity to saracatinib. Clin Cancer Res. 18 (9), 2704-2714 (2012).
- Arcaroli, J. J., et al. A NOTCH1 gene copy number gain is a prognostic indicator of worse survival and a predictive biomarker to a Notch1 targeting antibody in colorectal cancer. Int J Cancer. 138 (1), 195-205 (2016).
- Arcaroli, J. J., et al. Gene array and fluorescence in situ hybridization biomarkers of activity of saracatinib (AZD0530), a Src inhibitor, in a preclinical model of colorectal cancer. Clin Cancer Res. 16 (16), 4165-4177 (2010).
- Lieu, C. H., et al. Antitumor activity of a potent MEK inhibitor, TAK-733, against colorectal cancer cell lines and patient derived xenografts. Oncotarget. 6 (33), 34561-34572 (2015).
- Pitts, T. M., et al. Association of the epithelial-to-mesenchymal transition phenotype with responsiveness to the p21-activated kinase inhibitor, PF-3758309, in colon cancer models. Front Pharmacol. 4, 35 (2013).
- Song, E. K., et al. Potent antitumor activity of cabozantinib, a c-MET and VEGFR2 inhibitor, in a colorectal cancer patient-derived tumor explant model. Int J Cancer. 136 (8), 1967-1975 (2015).
- Tentler, J. J., et al. Identification of predictive markers of response to the MEK1/2 inhibitor selumetinib (AZD6244) in K-ras-mutated colorectal cancer. Mol Cancer Ther. 9 (12), 3351-3362 (2010).
- Bardelli, A., et al. Amplification of the MET receptor drives resistance to anti-EGFR therapies in colorectal cancer. Cancer Discov. 3 (6), 658-673 (2013).
- Bertotti, A., et al. A molecularly annotated platform of patient-derived xenografts ("xenopatients") identifies HER2 as an effective therapeutic target in cetuximab-resistant colorectal cancer. Cancer Discov. 1 (6), 508-523 (2011).
- Davis, S. L., et al. Combined inhibition of MEK and Aurora A kinase in KRAS/PIK3CA double-mutant colorectal cancer models. Front Pharmacol. 6, 120 (2015).
- Morelli, M. P., et al. Preclinical activity of the rational combination of selumetinib (AZD6244) in combination with vorinostat in KRAS-mutant colorectal cancer models. Clin Cancer Res. 18 (4), 1051-1062 (2012).
- Pitts, T. M., et al. Dual pharmacological targeting of the MAP kinase and PI3K/mTOR pathway in preclinical models of colorectal cancer. PLoS One. 9 (11), e113037 (2014).
- Spreafico, A., et al. Rational combination of a MEK inhibitor, selumetinib, and the Wnt/calcium pathway modulator, cyclosporin A, in preclinical models of colorectal cancer. Clin Cancer Res. 19 (15), 4149-4162 (2013).
- Arcaroli, J. J., et al. ALDH+ tumor-initiating cells exhibiting gain in NOTCH1 gene copy number have enhanced regrowth sensitivity to a gamma-secretase inhibitor and irinotecan in colorectal cancer. Mol Oncol. 6 (3), 370-381 (2012).
- Hoey, T., et al. DLL4 blockade inhibits tumor growth and reduces tumor-initiating cell frequency. Cell Stem Cell. 5 (2), 168-177 (2009).
- Ikebuchi, F., et al. Dissociation of c-Met phosphotyrosine sites in human cells in response to mouse hepatocyte growth factor but not human hepatocyte growth factor: the possible roles of different amino acids in different species. Cell Biochem Funct. 31 (4), 298-304 (2013).
- Zhang, Y. W., et al. Enhanced growth of human met-expressing xenografts in a new strain of immunocompromised mice transgenic for human hepatocyte growth factor/scatter factor. Oncogene. 24 (1), 101-106 (2005).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados