Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Bir Klinik öncesi Hasta Türetilmiş Tümör Roman Anti-Kanser Tedaviler Soruşturma Xenograftlarında Modeli Geliştirilmesi ve Bakımı
Bu Makalede
Özet
deri altı klinik öncesi modelde hasta kaynaklı tümörler kullanarak yeni tedavilerin, öngörü biyomarker keşif ve ilaca dirençli yolların etkinliğini incelemek için mükemmel bir yoldur. Bu model, ilaç geliştirme sürecinde, klinik araştırma önce birçok yeni anti-kanser terapisi kaderini belirlemede önemlidir.
Özet
Patient derived tumor xenograft (PDTX) models provide a necessary platform in facilitating anti-cancer drug development prior to human trials. Human tumor pieces are injected subcutaneously into athymic nude mice (immunocompromised, T cell deficient) to create a bank of tumors and subsequently are passaged into different generations of mice in order to maintain these tumors from patients. Importantly, cellular heterogeneity of the original tumor is closely emulated in this model, which provides a more clinically relevant model for evaluation of drug efficacy studies (single agent and combination), biomarker analysis, resistant pathways and cancer stem cell biology. Some limitations of the PDTX model include the replacement of the human stroma with mouse stroma after the first generation in mice, inability to investigate treatment effects on metastasis due to the subcutaneous injections of the tumors, and the lack of evaluation of immunotherapies due to the use of immunocompromised mice. However, even with these limitations, the PDTX model provides a powerful preclinical platform in the drug discovery process.
Giriş
Kolorektal kanser (KRK) Amerika Birleşik Devletleri'nde kanser ölümlerinin önemli bir katkıda bulunmaktadır. 2015 yılında, 49.700 ölüm 1 ile ÇHS tahmini 132.700 yeni vaka vardı. lokalize hastalığı olan hastalarda prognoz mükemmel olmasına rağmen, ilerlemiş hastalığı olan hastalarda yeni tedavilerin geliştirilmesinde bu önemli bir öncelik haline kötü sonuçlar var. bakım kemoterapötik rejimleri ve bu hastalığa karşı konuşlandırılmış yeni biyolojik standart olmasına rağmen, genel sağkalım sadece bir artan bir artış olmuştur. Buna göre, bu hastalıkta tümör büyümesini kolaylaştırmak katılan sürücü yollarının anlaşılmasında önemli bir çaba var. Kanser Genom Atlas ağ en son sayıda ana CRC bozukluğunun karıştığı ve bunlar yolları belirlemiştir: WNT, fosfoinositid 3-kinaz (PI3K), RAS, dönüştürücü büyüme faktörü-β (TGF-β) ve TP53 2. Birlikte, araştırmalar ot nitelendirdiCRC büyümeyi güçlendirir onun yollar önemli ölçüde bu hasta popülasyonunda 3-5 sağkalımı iyileştirmeyi amaçlayan yeni tedavilerin gelişimini başlatmıştır. Onkoloji ilaç geliştirilmesinde kullanılması klinik öncesi modellerde, bu yeni bileşiklerin klinik aktivite tahmin bu süreçte temel olmuştur.
Çeşitli klinik öncesi modellerde ilaç geliştirme sürecinde kullanılmıştır. Preklinik transgenik hayvan modelleri ve hücre hatları büyük ölçüde insan tümörlerinin karmaşıklığını yansıtacak şekilde yetersizlik, yeni onkoloji tedavilerin klinik etkinliğini belirlemede başarısız olmuştur ölümsüzleştirdi göz önüne alındığında, hasta kaynaklı tümör xenograft (PDTX) modelleri kurulmuştur. Bu modelin en büyük avantajı, tümör heterojen bozulmadan kalır ve yakından menşeli hastanın tümör 6-9 moleküler özelliklerini ve klonalite yansıtır olmasıdır. PDTX modelleri, in vivo bir harikalarını sağlamakpreklinik bir platform yeni ajanlar, ilaç direnci yolları, kombinasyonel stratejileri ve kanser kök hücre biyolojisi 10 incelemek için.
PDTX işleminin genel bir bakış, Şekil 1 'de gösterilmiştir. Bu klinik başlar onların aşırı tümör dokusunun bir kısmı, bu araştırma için kullanılan izin vermek için hasta rızası. Sonraki, ameliyatta tümörün bir parça bir patolog tarafından hasılat ve araştırma personeline taşınacak ortama koydu. Bunun hemen ardından, tümör bölümü, küçük parçalar halinde kesilmiş ve deri altından bağışıklık yetersizliği olan farelere transplante edilir. Tümör büyüdükçe sonra, tümör 10 muhafaza edilmesi amacıyla farelerin farklı kuşaklar içine geçirilerek edilir. Tipik haliyle, F3 nesil sonra tümör yeni bileşikler ve / veya kombinasyonel tedaviler değerlendirilir tedavi çalışmaya genişletilebilir. Kullanan Next Gen Dizi (exome Seq, RNA Seq ve SNP dizi) potansiyel öngörü biyolojik belirteçler keşfetmek vardırBelirli bir tedaviden fayda görebilecek hastaların seçiminde yardımcı ed.
1) tek ajan olarak veya kombinasyon halinde yeni tedavilerin etkinliğini değerlendirmek ve 2) öncesinde klinik araştırma duyarlılık veya direnç tahmin biyobelirteçlerini tespit: PDTX modelleri kullanarak kapsayıcı hedefleri şunlardır. Bu yazıda, bir CRC PDTX bankanın başlatılması ve bakım metodoloji sağlamak ve ilaç geliştirme keşfi bu modelin avantajları ve sınırlamaları sağlamaktadır.
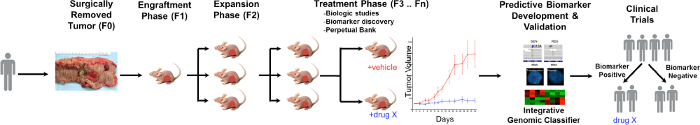
CRC PDTX Modeli Protokolü Şekil 1. Genel. Hasta edilen tümör cerrahisi alınan hemen deri altından atimik çıplak farelere enjekte edilir. Tümör büyüdükçe kez sonraki nesillere genişletilir ve sonuçta tedavi çalışmaları için genişletilir. Tedavi RESPOnses değerlendirilir ve tahmini biyomarkerlar. Hasta seçiminde yardımcı olabilir belirlenmiştir , bu rakamın büyük halini görmek için lütfen buraya tıklayınız.
Protokol
Etik Beyanı: Hasta kaynaklı kolorektal adenokarsinom tümör örnekleri Colorado Çoklu Kurumsal Değerlendirme Kurulu (08-0439) tarafından onaylanmış bir protokol uyarınca Colorado Üniversitesi Hastanesi hastaları rıza elde edilmiştir. Tüm hayvan çalışmaları Colorado Denver Kurumsal Hayvan Bakımı ve Kullanımı Komitesi Üniversitesi tarafından onaylanan hayvan protokol çerçevesinde gerçekleştirildi (IACUC, Protokol # 51412 (06) 1E ve 96813 (04) 1E).
1. Alma ve Hasta Kan hazırlanması
- 1 toplayın - 2 sodyum sitrat içeren bir kan / hücre ayırma tüp kan ml (plazma, lenfosit ve monosit bandı, yoğunluk gradyan sıvı, jel bariyer, ve eritrositler ve nötrofiller dahil boru aşamalarını vardır). Dikkat, kan ya da doku ile kan Bazlı Patojen yönergeleri izleyin.
Not: PBMC'ler ve plazma içerebilir gelecek çalışmalar için kullanılan olabilir: tümör mutasyonları ile germline genetik varyasyonu karşılaştıran, dolaşımına izolevb hücre serbest DNA (cfDNA) incelenmesi proteinler ve microRNA, değerlendirilmesi ting tümör hücreleri. - Oda sıcaklığında hiçbir frenli 15 dakika 2500 xg'de kan / hücre ayırma tüp santrifüj.
- periferal kan tek-çekirdekli hücreleri (lenfosit ve borunun monosit bandında PBMC'ler) toplayın ve 1.5 ml mikrosantrifüj tüpü (net, otoklav, DNase, RNase ve pirojen serbest) koymak ve steril fosfat-tamponlu tüpün üst dolgu tuz (PBS).
- Oda sıcaklığında 3 dakika boyunca 2300 x g'de santrifüj tüpünün dibinde PBMC'ler bir tablet oluşturulur. Sonra, dikkatle süpernatant kaldırmak. 30 saniye boyunca 3.000 xg'de pelet ve santrifüj yıkamak için steril PBS 1 ml ekleyin ve sonra süpernatant kaldırmak.
- 1.5 ml steril kriyojenik şişede (tüp plazma aşamasında) kan / hücre ayırma tüpten plazma toplamak için bir pipet kullanın (DNaz ve RNaz ücretsiz, hiçbir insan DNA'sı, endotoksin ücretsiz) ve bir içine PMBV en ve plazma ve pelet koymak -80 ° C Fdepolama reezer.
2. Alma ve Hasta Tümör Numune Hazırlama
- Hazırlama RPMI ya da DMEM ortamı 1 ya da: Penisilin-Streptomisin ve temel olmayan amino asitler, 100 (% 10), 1: 1000 (1%) Plasmocin, ve% 10 cenin öküz serumu inaktifleştirilmiş, (tam ortam) ve ekleme 20-25 tümör örnek için steril bir toplama kabına ml.
- Buz üzerinde tam bir ortam ihtiva eden bir steril kap içinde, tümör örneğinin almak ya da 4 ° C'de tutun.
Not: Tümör örneği, bir cerrah ile ayrılmış bir patolog tarafından işlenir ve tam ortam steril bir toplama kabına yerleştirilir fazla hastanın tümör dokusu parçası. Dikkat, kan ya da doku ile kan Bazlı Patojen yönergeleri izleyin. Ayrıca, ideal olarak, beş fare enjekte tümör, yaklaşık 1 cm³ olmalıdır. - immün bozukluk farelere enjekte edilmesi için bir hayvan tesisine, tümör örneğinin getirin.
Not: en kısa sürede tümör örneği işlemek için en iyisidir.- bir laminar akış başlığı içinde, tümör fincan steril plastik kesme kabı içine, tümör numuneyi. jelatinimsi Protein karışımı çözeltisi 300 ul ile dolu bir otoklava 1.5 ml mikrosantrifüj tüpü içine 12 yaklaşık 3 x 3 x 3 mm parçalar ve yeri - 10 kesmek için otoklav küçük makas ve forseps. buz üzerinde tüp tutun.
- Öncelikli olarak farelere tümörü enjekte ancak arta kalan herhangi bir tümör, varsa flaş dondurulmuş şişeleri (FF), formalin ile sabitlenmiş parafine gömülü (FFPE) bardak ve canlı tümör şişe toplamak.
- FF, bu tür bir protein, RNA ya da DNA izolasyonu, daha fazla analiz için steril kriyojenik şişeden tümör dokularında küçük parçaları toplamak. sıvı azot Dewar içine hemen FF yerleştirin ve uzun vadeli saklamak -80 ° C derin dondurucuda.
- FFPE için yeterli tümör, yer tümör en az 24 saat süreyle formalin olmuştur kez parafin bloklar halinde 10 ml% 10 formalin fincan ve sürecine 3 küçük parçalar varsa.
Not: 24 saat dayanırBizim Histoloji Çekirdek önerileri 11 kapatır. - Son olarak, çok düşük bir tüp içine, geri kalan tümör yerleştirin. ortamı tamamlamak için% 10 dimetil sülfoksit (DMSO) eklenerek uygulanabilir Ortamın. Daha sonra, bir kriyojenik tüpüne 1 ml ilave edilir ve buz üzerinde muhafaza edin. Not: uzun süre boyunca buz üzerinde tutmayın.
- 10 tümörleri gelecek 5 fareye enjekte edilmesi için ideal yeterli olacaktır küçük parçalar halinde herhangi bir artık tümör kesin. bir İzopropil Alkol dondurma kabının (yavaş bir defada tümör 1 ° C donar) yerleştirilir ve -80 ° C derin dondurucuda içine konabilir kadar Sonra, tümörler sırasında ölme emin olmak için buz üzerinde canlı tümör tüp yeri dondurma işlemi.
Not: Uzun süreli saklama için tümörler çıkarılır (2 sonra - 3 gün) ve büyük bir sıvı azot Dewar yerleştirilir. canlı tüpler o farelere enjekte dışarı atılıyor sürece çözülmeye izin verilmemesi gerektiğini lütfen unutmayın.
- 10 tümörleri gelecek 5 fareye enjekte edilmesi için ideal yeterli olacaktır küçük parçalar halinde herhangi bir artık tümör kesin. bir İzopropil Alkol dondurma kabının (yavaş bir defada tümör 1 ° C donar) yerleştirilir ve -80 ° C derin dondurucuda içine konabilir kadar Sonra, tümörler sırasında ölme emin olmak için buz üzerinde canlı tümör tüp yeri dondurma işlemi.
3..Hasta elde edilen tümör ksenograftlarının Enjeksiyon
- her bir ayrı hastanın edilen tümör 8 haftalık erkek ve / veya dişi atimik çıplak fare (eksikliği T-hücresi) - Beş 6 kullanın. 10 tümörlerin toplam (fare başına 2 enjeksiyon) subkütan (SQ) enjekte edilir.
Not: Orijinal insan tümör F0 olarak belirlenmiş ve daha sonra bir kez nesil F1 farelere enjekte edilir. Ayrıca, her benzersiz eksplant için otoklavlanmış forseps, makas, ve trokarları kullanın. - otoklavlanmış 12 G trokarlardan içine jelatinimsi bir protein karışımı çözeltisinden tümörün yük parçaları ve tümör tamamen delici içine itilir emin olun.
- (Anestezi bakımı için% 3 İsofluranın - -% 4 oksijen ve 2% 5 başlangıç hızı İsofluranın başladı, 3) steril bir laminer akış kaputu, bir İsofluranın anestezi makinesine bağlı bir anestezi kutunun içine 5 fareler yerleştirin ve karbon filtre (aşırı gaz emer).
Not: deneyimli bir teknisyen üzerindeki tüm yordamı gerçekleştirmek gerekirYaklaşık 5 dakika toplam (fare başına yaklaşık 30 sn) içinde 5 farelerin bir kafes. Bu nedenle, ek termal destek ve göz yağlama genellikle kullanılmaz. Daha az deneyimli kişiler için veya eğitim sırasında, son derece bireylerin tek seferde daha az hayvanlar üzerinde yordamı gerçekleştirmek ve / veya hayvan 5 dakika daha uzun anestezi olması durumunda işlem sırasında bir ısınma ped / göz yağlama kullanmak ya önerilir. Prosedür Üniversitemizde IACUC standartlarına dayanmaktadır.
- (Anestezi bakımı için% 3 İsofluranın - -% 4 oksijen ve 2% 5 başlangıç hızı İsofluranın başladı, 3) steril bir laminer akış kaputu, bir İsofluranın anestezi makinesine bağlı bir anestezi kutunun içine 5 fareler yerleştirin ve karbon filtre (aşırı gaz emer).
- fare artık duyarlı olmasını sağlamak için bir fare ayak tutup İsofluranın kutudan fareyi alır. yan bölge otoklavlanmış 12 G trokarlardan ile ulaşılana kadar orta sırt boyun bölgesinde ve aşağı subkutan trokar sürgülü tümörleri enjekte etmek için temiz bir alan üzerine fare yerleştirin.
- Farenin kanadını her tarafında bir tümör subkutan sunun. trokar tümör istenen yan bölgede kalmasını sağlar, çekildiğinde tümörü sıkıştırın. gelatinous protein karışımı farenin vücut sıcaklığı ile sertleşir ve tümör büyümesine yardımcı ve SQ bağ dokusu sabitlemek için yaklaşık 1 hafta tümörü kapsüller. trokar tarafından yapılan lezyon 4 mm daha büyük ve zımba ile cilt kapatmak için gerek yoktur.
Not: Bizim veterinerler hiçbir kapatma lezyonun çok küçük boyutuna göre gerektiğinde bellidir hızlı iyileşme süresi, bu süre zarfında, not hiçbir zaman enfeksiyon ve hayvanların yakından izlenmesini (orta dorsal boyun bölgesinde herhangi bir cilt gerginliği ya da lezyonun tımar azaltır) .
- Farenin kanadını her tarafında bir tümör subkutan sunun. trokar tümör istenen yan bölgede kalmasını sağlar, çekildiğinde tümörü sıkıştırın. gelatinous protein karışımı farenin vücut sıcaklığı ile sertleşir ve tümör büyümesine yardımcı ve SQ bağ dokusu sabitlemek için yaklaşık 1 hafta tümörü kapsüller. trokar tarafından yapılan lezyon 4 mm daha büyük ve zımba ile cilt kapatmak için gerek yoktur.
- Fare uzakta tümör enjeksiyon sitesinden tamamen uyanık enjekte Meloksikam 2 mg / kg SQ (ağrı kesici) önce. Sonra, kafesin içine fare koyun ve fare uyanık ve hareketli kadar izler.
Not: tamamen uyanık kadar sahipsiz hayvanları kurtarma bırakmayın. Meloksikam dozaj Üniversitemizde IACUC standartlarına dayanmaktadır.- Sonraki 4 ile aynı prosedürü tekrarlayınfareler kalan ve nefes izlemek.
Not: Bu çok hızlı bir işlemdir ve fareler Meloksikam enjeksiyonundan sonra çok kısa bir süre uyanmak unutmayın ama gerektiği gibi İsofluranın ayarlayın. Fare dışarı alınır her zaman, izofluran aşağı çevirin. Meloksikam 24 saat sürecek ve trokarlardan gelen lezyonlar tamamen 1 hafta içinde iyileşir.
- Sonraki 4 ile aynı prosedürü tekrarlayınfareler kalan ve nefes izlemek.
Hasta Türetilmiş Tümör Xenograftlarında Bankası 4. Bakım
- En az haftada bir kez farelerin büyüme ve sağlığını izlemek. Tümör boyutları, tümör oluşumunu, tümör enjeksiyonundan tarihini ve farelerin sağlığını izlemek için bir elektronik tablo (veya başka bir izleme sistemi) kullanın.
Not: Fareler 15 orijinal vücut ağırlığının%, düşük vücut kondisyon puanları (≥ 2) kaybettiyseniz, tümör ülserleri, tümörleri 2,000 mm 3 veya toplam tümörler 3.000 mm 3 veya eğilmiş (hastalıklı olan, soğuk, uyuşukluk, vb ulaşan var .) herhangi bir şekilde, farenin CO₂ ile ötenazi veya servikal dislokasyon anestezi sağlarüzere ikincil bir yöntem. tümör toplama aksi farenin CO₂ ve servikal dislokasyon ile ötenazi, anestezi ve servikal dislokasyon ile öldürülür. - Bir tümör yukarıda açıklanan ve daha sonra euthanize servikal dislokasyon gerçekleştirmek yaklaşık olarak 1,500-2,000 mm 3 anestezisi fareler olduğunda.
- Fare hiçbir kalp atışı olup olmadığını kontrol edin. otoklava makas ve forseps ile SQ tümörü tüketim.
NOT: İzin tümörler 1 yıla kadar büyümeye ve tümör görülür ise o zaman ikinci bir yöntem olarak servikal dislokasyon tarafından takip CO 2 üzerinden fareler, euthanize. - Passage (5 farelerin yeni bir dizi aka) bir sonraki kuşağa iyi büyüyen tümör. geçen 12 tümörler ve ayrıca yukarıda tarif edildiği gibi daha sonra artık tümörün toplamak - Kullanım talimatları yukarıda 10 toplamak için.
Not: Çok sayıda canlı tüpler Toplama erken nesillerin (F1 - F8) çok önemlidir; Bu nedenle, pek çok canlı tüpler, FF tüpler ve generat için 1 FFPE toplamakiyon. - Farelerin yeni nesil yaklaşık 300 mm 3 tümör büyümesini sahip kadar kalan fareler tutun. Geriye kalan farelerin büyük tümörler olduğunda, yukarıda tarif edildiği gibi toplama devam etmektedir.
- Fare hiçbir kalp atışı olup olmadığını kontrol edin. otoklava makas ve forseps ile SQ tümörü tüketim.
- geçit tümörleri devam edin ve F15 kadar her aşamada toplamak. Bu noktada, sıvı azot dışında en erken nesil uygulanabilir bir tüp alıp buz üzerinde çözülme izin ve yukarıda açıklanan tümör enjekte prosedürlerini izleyin.
canlı tüplerden büyümek tümörler nesilden nesile geçen kıyasla farelerde büyümeye daha uzun sürer, bu yüzden planlarken akılda tutmak Not:. Belirli PDTX modeli artık herhangi bir geçit gerekiyorsa, ötenazi ve çok sayıda canlı borular ileride kullanılmak üzere toplanır sağlamak için, tümör toplar.
Hasta Türetilmiş tümör ksenograftlarının 5. Developmental Therapeutics
Not: F3 nesil Çoğu tümörler iyi büyüme kinetiği (daha hızlı ve daha co büyümek zorundansistent), bu nedenle, ilaç etkinlik çalışmaları PDTX geçin.
- İstenilen tümör çok büyük olduğunda (1,500 - 2,000 mm 3), farelerin istenilen miktarda haline dönüşmeye tümörün toplamak için yukarıdaki prosedürleri takip edin.
- hipoteze göre tedavi grubu başına gerekli tümörlerin sayısını belirlemek denenmektedir.
Not: jelatinimsi bir protein karışımı, çözeltinin 1 ml farelere enjekte edilmesi için yaklaşık uygun 30 küçük tümör parçaları (tümör morfolojisine bağlı olarak) olabilir.
- hipoteze göre tedavi grubu başına gerekli tümörlerin sayısını belirlemek denenmektedir.
- Haftalık tümörleri ve fareler kontrol çoğu tümörler (50 arasında yaklaşık - 300 mm³) gözle küçük olduğunda tümör hacmini belirlemek için kaliperler ile tümör ölçmek. Tümör hacmi = [width² (küçük ölçümü) x uzunluk (en büyük ölçüm)] 0.52 x.
Not: jelatinimsi bir protein karışımı, çözelti, bir haftalık tümör büyümesi doğru ise sonra, bir hafta süreyle enjekte tümör parçaları çevreler. - 300 mm³ ve - 50 arasında tümör hacimleri kullanınn sol ve sağ tümörleri ortalama. Sonra birbirinden Birkaç sayı içinde bir grup ve bir grup başına ortalama 10 tümörleri tedavi gruplarına rastgele. Sonra, gruplar halinde fareler sıralamak ve arzu edilen tedavi çalışmaya başlar.
- İlaç (ilaca bağlı programa) haftada iki kez, tartmak ve ölçmek (tümör) ile fareler Doz. Çalışmanın sonunda, anestezi ve servikal dislokasyon yoluyla fareler euthanize ve laboratuarda gelecek farmakodinamik analizi için tümör toplamak.
Not: Çalışma araç tümör boyutu ve farelerin sağlığına bağlı 30 gün sürer.
Bir PDTX bankanın 6. organizasyonu
- araştırma ve hayvanların uygun kullanım yinelenen önlemek için bir iyi belgelenmiş bir form tutun.
NOT: Bu, başarılı bir PDTX bankaya anahtarıdır.- PDTX bankada fareler, tedavi, veri, klinikte insan hastada bir tümörün izlemek için elektronik tablolar kullanın ve ne toplanır. Not: Bu dondurucu, sıvı azot Dewars içeriryanı sıra, ve FFPE depolama.
Sonuçlar
CRC PDTX Modelleri ve TCGA Ortak Mutasyonlarının Benzerlikler
Biz CRC PDTX bankada ortak mutasyonlar (KRAS, NRAS, BRAF, PIK3CA, APC, CTNNB1 ve TP53) yüzdesi CRC hasta popülasyonunda görülen mutasyon sıklığı temsilcisi olup olmadığını araştırdık. Şekil 2A (TCGA) ve B (CRC PDTX Bankası) 'de gösterildiği gibi, bu genlerdeki mutasyonların sıklı...
Tartışmalar
PDTX ilaç keşif platformu yeni bileşiklerin klinik etkinliğini öngörmede güvenilmez diğer preklinik modellerin eksiklikleri gelişmiş bir model sunuyor. Önemli olarak, bu modelde, tümörler, biyolojik olarak kararlı, metastatik potansiyelini korumak ve kuşaktan içindeki ilaç tepki gösterirler. Bu modelde, hastanın türevli tümörler, atimik çıplak farelere enjekte geçişli ve daha sonra tedavi değerlendirmesinde kullanılır. içeren başarılı bir PDTX banka için birkaç kritik adımlar vardır:...
Açıklamalar
The authors have nothing to disclose.
Teşekkürler
This work was supported by grant 1R01CA152303-01.
Malzemeler
| Name | Company | Catalog Number | Comments |
| RPMI or DMEM | Corning | 10-040-CV | |
| Penicillin-Streptomycin | Corning | 30-002-CI | |
| Non-essential Amino Acids | Corning | 25-025-CI | |
| Fetal Bovine Serum | Corning | 35-010-CV | Thaw in -4 °C, then activate for 30 min at 60 °C water bath |
| CPT blood tube | BD vacutainer | 362761 | |
| Microcentrifuge tube | Surelock | A-7002 | |
| Phosphate-Buffered Saline | Corning | 21-040-CV | |
| Cyrogenic vials | Cyroking | C0732901 | |
| Plastic tumor cutting dish | Trueline | TR4001 | |
| Scissors | Roboz | RS-5881 | |
| Forceps | Roboz | RS-5135 | |
| Matrigel (gelatinous protein mixture) | Corning | 354234 | Store at -20 or -80 °C, then thaw on ice, do not leave at RT |
| 10% Formalin cups | Protocol | 032-059 | |
| Liquid Nitrogen Dewar Storage | Thermolyne | CY50900 | |
| Portable liquid nitrogen dewar | Nalgene | 4150-2000 | |
| Dimethyl Sulfoxide | Fischer | 67-68-5 | |
| Freezing container: Mr Frosty | Nalgene | 5100-0001 | |
| Isopropyl Alcohol | Decon | 64-17-5 | |
| Trocars | Innovative Research of America | MP-182 | |
| Anesthesia machine | Patterson Veterinary | ||
| Anesthesia box | Patterson Veterinary | ||
| Isoflurane | Vet one | 1038005 | |
| F-Air Canister | Bickford Omnicon | 80120 | |
| Meloxicam | Vet one | 5182-90C | |
| Calipers | Fowler | 54-100-167 | |
| Weight scale | Ohaus | Scout Pro SP601 |
Referanslar
- Siegel, R. L., Miller, K. D., Jemal, A. Cancer statistics. 2015. CA Cancer J Clin. 65 (1), 5-29 (2015).
- . Comprehensive molecular characterization of human colon and rectal cancer. Nature. 487 (7407), 330-337 (2012).
- Arcaroli, J. J., et al. Tumours with elevated levels of the Notch and Wnt pathways exhibit efficacy to PF-03084014, a gamma-secretase inhibitor, in a preclinical colorectal explant model. Br J Cancer. 109 (3), 667-675 (2013).
- Hubbard, J., Grothey, A. Antiangiogenesis agents in colorectal cancer. Curr Opin Oncol. 22 (4), 374-380 (2010).
- van Es, J. H., et al. Notch/gamma-secretase inhibition turns proliferative cells in intestinal crypts and adenomas into goblet cells. Nature. 435 (7044), 959-963 (2005).
- Cassidy, J. W., Caldas, C., Bruna, A. Maintaining Tumor Heterogeneity in Patient-Derived Tumor Xenografts. Cancer Res. 75 (15), 2963-2968 (2015).
- Jin, K., et al. Patient-derived human tumour tissue xenografts in immunodeficient mice: a systematic review. Clin Transl Oncol. 12 (7), 473-480 (2010).
- Julien, S., et al. Characterization of a large panel of patient-derived tumor xenografts representing the clinical heterogeneity of human colorectal cancer. Clin Cancer Res. 18 (19), 5314-5328 (2012).
- Siolas, D., Hannon, G. J. Patient-derived tumor xenografts: transforming clinical samples into mouse models. Cancer Res. 73 (17), 5315-5319 (2013).
- Tentler, J. J., et al. Patient-derived tumour xenografts as models for oncology drug development. Nat Rev Clin Oncol. 9 (6), 338-350 (2012).
- Carson, F. L. . Histotechnology: A Self-Assessment Workbook. , (1996).
- Arcaroli, J. J., et al. Common PIK3CA mutants and a novel 3' UTR mutation are associated with increased sensitivity to saracatinib. Clin Cancer Res. 18 (9), 2704-2714 (2012).
- Arcaroli, J. J., et al. A NOTCH1 gene copy number gain is a prognostic indicator of worse survival and a predictive biomarker to a Notch1 targeting antibody in colorectal cancer. Int J Cancer. 138 (1), 195-205 (2016).
- Arcaroli, J. J., et al. Gene array and fluorescence in situ hybridization biomarkers of activity of saracatinib (AZD0530), a Src inhibitor, in a preclinical model of colorectal cancer. Clin Cancer Res. 16 (16), 4165-4177 (2010).
- Lieu, C. H., et al. Antitumor activity of a potent MEK inhibitor, TAK-733, against colorectal cancer cell lines and patient derived xenografts. Oncotarget. 6 (33), 34561-34572 (2015).
- Pitts, T. M., et al. Association of the epithelial-to-mesenchymal transition phenotype with responsiveness to the p21-activated kinase inhibitor, PF-3758309, in colon cancer models. Front Pharmacol. 4, 35 (2013).
- Song, E. K., et al. Potent antitumor activity of cabozantinib, a c-MET and VEGFR2 inhibitor, in a colorectal cancer patient-derived tumor explant model. Int J Cancer. 136 (8), 1967-1975 (2015).
- Tentler, J. J., et al. Identification of predictive markers of response to the MEK1/2 inhibitor selumetinib (AZD6244) in K-ras-mutated colorectal cancer. Mol Cancer Ther. 9 (12), 3351-3362 (2010).
- Bardelli, A., et al. Amplification of the MET receptor drives resistance to anti-EGFR therapies in colorectal cancer. Cancer Discov. 3 (6), 658-673 (2013).
- Bertotti, A., et al. A molecularly annotated platform of patient-derived xenografts ("xenopatients") identifies HER2 as an effective therapeutic target in cetuximab-resistant colorectal cancer. Cancer Discov. 1 (6), 508-523 (2011).
- Davis, S. L., et al. Combined inhibition of MEK and Aurora A kinase in KRAS/PIK3CA double-mutant colorectal cancer models. Front Pharmacol. 6, 120 (2015).
- Morelli, M. P., et al. Preclinical activity of the rational combination of selumetinib (AZD6244) in combination with vorinostat in KRAS-mutant colorectal cancer models. Clin Cancer Res. 18 (4), 1051-1062 (2012).
- Pitts, T. M., et al. Dual pharmacological targeting of the MAP kinase and PI3K/mTOR pathway in preclinical models of colorectal cancer. PLoS One. 9 (11), e113037 (2014).
- Spreafico, A., et al. Rational combination of a MEK inhibitor, selumetinib, and the Wnt/calcium pathway modulator, cyclosporin A, in preclinical models of colorectal cancer. Clin Cancer Res. 19 (15), 4149-4162 (2013).
- Arcaroli, J. J., et al. ALDH+ tumor-initiating cells exhibiting gain in NOTCH1 gene copy number have enhanced regrowth sensitivity to a gamma-secretase inhibitor and irinotecan in colorectal cancer. Mol Oncol. 6 (3), 370-381 (2012).
- Hoey, T., et al. DLL4 blockade inhibits tumor growth and reduces tumor-initiating cell frequency. Cell Stem Cell. 5 (2), 168-177 (2009).
- Ikebuchi, F., et al. Dissociation of c-Met phosphotyrosine sites in human cells in response to mouse hepatocyte growth factor but not human hepatocyte growth factor: the possible roles of different amino acids in different species. Cell Biochem Funct. 31 (4), 298-304 (2013).
- Zhang, Y. W., et al. Enhanced growth of human met-expressing xenografts in a new strain of immunocompromised mice transgenic for human hepatocyte growth factor/scatter factor. Oncogene. 24 (1), 101-106 (2005).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır