Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Entwicklung und Wartung eines Präklinische Patienten gewonnen Tumorxenotransplantates Modell für die Untersuchung von neuartigen Anti-Krebs-Therapien
In diesem Artikel
Zusammenfassung
Unter Verwendung Patienten stammenden Tumoren in einem subkutanen präklinischen Modell ist eine hervorragende Möglichkeit, die Wirksamkeit neuer Therapien, prädiktive Biomarker Entdeckung und arzneimittelresistente Wege zu untersuchen. Dieses Modell, das in der Arzneimittelentwicklung wesentlich ist, das Schicksal vieler neuartiger Krebstherapien vor der klinischen Untersuchung zu bestimmen.
Zusammenfassung
Patient derived tumor xenograft (PDTX) models provide a necessary platform in facilitating anti-cancer drug development prior to human trials. Human tumor pieces are injected subcutaneously into athymic nude mice (immunocompromised, T cell deficient) to create a bank of tumors and subsequently are passaged into different generations of mice in order to maintain these tumors from patients. Importantly, cellular heterogeneity of the original tumor is closely emulated in this model, which provides a more clinically relevant model for evaluation of drug efficacy studies (single agent and combination), biomarker analysis, resistant pathways and cancer stem cell biology. Some limitations of the PDTX model include the replacement of the human stroma with mouse stroma after the first generation in mice, inability to investigate treatment effects on metastasis due to the subcutaneous injections of the tumors, and the lack of evaluation of immunotherapies due to the use of immunocompromised mice. However, even with these limitations, the PDTX model provides a powerful preclinical platform in the drug discovery process.
Einleitung
Das kolorektale Karzinom (CRC) ist ein wichtiger Faktor für die Todesfälle durch Krebs in den Vereinigten Staaten. Im Jahr 2015 gab es schätzungsweise 132.700 neue Fälle von CRC mit 49.700 Todesfälle 1. Obwohl die Prognose bei Patienten mit lokalisierter Erkrankung ausgezeichnet ist, Patienten mit fortgeschrittener Erkrankung schlechte Ergebnisse haben, ist dies eine wichtige Priorität in der Entwicklung neuartiger Therapien zu machen. Trotz Standard der Versorgung Chemotherapien und neueren Biologics, die gegen diese Krankheit eingesetzt werden, hat es nur eine inkrementelle Erhöhung des Gesamtüberlebens. Dementsprechend gibt es einen signifikanten Aufwand die Treiber Wege zum Verständnis des Tumorwachstums bei dieser Krankheit zu erleichtern. Cancer Genome Atlas Network hat kürzlich zahlreiche Hauptpfade identifiziert , die in CRC Dysregulation beteiligt sind und umfassen: WNT, Phosphoinositid - 3-Kinase (PI3K), RAS, transformierenden Wachstumsfaktor-β (TGF- β) und TP53 2. Zusammen mit den Untersuchungen beschreibt otihre Wege , die das Wachstum in CRC potenzieren haben die Entwicklung der neueren bei deutlich verbessert das Überleben in dieser Patientenpopulation 3-5 richtet Therapien gezündet. Unter Verwendung präklinischen Modellen in Entwicklung onkologischer Arzneimittel haben in diesem Prozess die klinische Wirksamkeit dieser neuen Verbindungen bei der Vorhersage wesentlich gewesen.
Verschiedene präklinische Modelle wurden in der Arzneimittelentwicklung eingesetzt. Bedenkt man, dass die präklinische transgenen Tiermodellen und wurden Zelllinien bei der Bestimmung der klinischen Aktivität von neuen Krebstherapien erfolglos unsterblich gemacht, vor allem wegen ihrer Unfähigkeit, gegründet, um die Komplexität der menschlichen Tumoren, Patienten stamm Tumorxenotransplantates (PDTX) Modelle wurden zu reflektieren. Der größte Vorteil dieses Modells ist , dass die Tumorheterogenität intakt bleibt und spiegelt genau die molekularen Eigenschaften und der Klonalität des Ursprungspatiententumor 6-9. PDTX Modelle bieten eine ausgezeichnete in vivopräklinische Plattform neue Mittel, Arzneimittelresistenzpfade, kombinatorische Strategien und Krebs Stammzellbiologie 10 zu studieren.
Eine allgemeine Übersicht über die PDTX Verfahren ist in Abbildung 1 veranschaulicht. Es beginnt in der Klinik, zustimmenden Patienten einige ihrer überschüssigen Tumorgewebe zu ermöglichen , für diese Untersuchung verwendet werden. Als nächstes wird bei der Operation wird ein Stück des Tumors durch einen Pathologen und in Medien einspielte zu Forschungspersonal transportiert werden. Unmittelbar danach wird ein Abschnitt des Tumors in kleine Stücke geschnitten und subkutan in immundefiziente Mäuse transplantiert. Sobald der Tumor wächst, wird es in verschiedene Generationen von Mäusen , um agierten den Tumor 10 aufrechtzuerhalten. Typischerweise wird nach dem F3-Generation kann der Tumor in eine Behandlungsstudie erweitert werden, wenn neue Verbindungen und / oder Kombinationstherapien bewertet werden. Unter Verwendung Next Gen Seq (Exome Seq, RNA Seq und SNP-Array) potentielle prädiktive Biomarker zu entdeckened, die bei der Auswahl von Patienten helfen, die Nutzen aus einer bestimmten Behandlung ableiten kann.
Die übergeordneten Ziele der PDTX Modellen sind: 1) Bewertung der Wirksamkeit neuer Therapien als Monotherapie oder in Kombination und 2) identifizieren prädiktive Biomarker der Empfindlichkeit oder Resistenz vor der klinischen Untersuchung. In diesem Manuskript, bieten wir die Methodik bei der Initiierung und Aufrechterhaltung einer Bank CRC PDTX und bieten die Vorteile und Grenzen dieses Modells in der Medikamentenentwicklung Entdeckung.
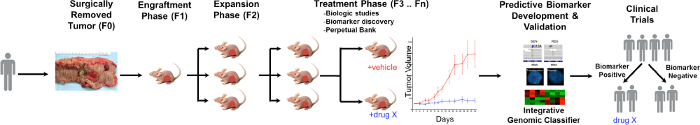
Figure 1. Überblick über das CRC PDTX Modell Protocol. Ein Patient abgeleiteten Tumor wird von der Operation erhalten und sofort in athymischen Nacktmäusen subkutan injiziert. Sobald der Tumor wächst wird es in den nachfolgenden Generationen erweitert und schließlich für Therapiestudien erweitert. Die Behandlung respoNSEs werden bewertet und prädiktive Biomarker identifiziert werden, die in die Auswahl der Patienten helfen können. Bitte klicken Sie hier um eine größere Version dieser Figur zu sehen.
Protokoll
Ethikerklärung: Patient abgeleiteten Proben kolorektalen Adenokarzinom Tumor wurden von mündigen Patienten an der University of Colorado Hospital in Übereinstimmung mit einem Protokoll, das von der Colorado Multiple Institutional Review Board (08-0439) genehmigt erhalten. Alle Tier Arbeit wurde im Rahmen der Tier Protokolle, die von der University of Colorado Denver Institutional Animal Care und Use Committee (IACUC, Protokoll # 51412 (06) 1E und 96813 (04) 1E) genehmigt durchgeführt.
1. Entgegennahme und Vorbereitung Patientenblut
- Sammeln Sie 1 bis 2 ml Blut in einer Blut / Zellseparation Röhrchen mit Natriumcitrat (Rohr Phasen enthalten sind Plasma, Lymphozyten und Monozyten Band, Dichtegradienten Flüssigkeit, Gel-Schranke und Erythrozyten und Neutrophile). Achtung, Blut Borne Pathogen-Richtlinien mit Blut oder Gewebe folgen.
Hinweis: PBMCs und Plasma könnte für zukünftige Studien verwendet werden, können umfassen: Keimbahn genetische Variation mit Tumor-Mutationen zu vergleichen, circula IsolierungZellen ting Tumor, Auswertung zellfreie DNA (cfDNA), untersuchen Proteine und microRNAs usw. - Zentrifugieren Sie das Blut / Zelltrennrohr bei 2.500 × g für 15 min ohne Bremse bei RT.
- Sammeln Sie einkernigen peripheren Blutzellen (PBMCs in Lymphozyten und Monozyten Band von Rohr) und in ein 1,5 ml Mikrozentrifugenröhrchen (klar, autoklavierbar, DNase, RNase und pyrogenfrei), und füllen Sie an die Spitze des Rohrs mit steriler phosphatgepufferter Kochsalzlösung (PBS).
- Zentrifuge bei 2.300 × g für 3 min bei RT ein Pellet von PBMCs am Boden des Röhrchens zu bilden. Dann entfernen Sie vorsichtig den Überstand. 1 ml sterilem PBS, das Pellet und zentrifugieren bei 3.000 xg für 30 sec zu waschen und dann Überstand zu entfernen.
- Verwenden Sie eine Pipette zu sammeln Plasma aus dem Blut / Zelltrennrohr (in Plasmaphase von Rohr) in einem 1,5 ml sterile Kryoröhrchen (DNase und RNase frei, keine menschliche DNA, Endotoxin-frei) und legte das Plasma und Pellet von PBMC der in ein -80 ° C freezer für die Lagerung.
2. Empfangen und Vorbereitung Patient Tumorprobe
- Bereiten Sie entweder RPMI oder DMEM-Medium mit 1: 100 (10%) von Penicillin-Streptomycin und nicht essentielle Aminosäuren, 1: 1000 (1%) Plasmocin und 10% inaktiviertes fötales Rinderserum (vollständige Medien) und fügen Sie 20 bis 25 ml in ein steriles Sammelbecher für die Tumorprobe.
- Abrufen Tumorprobe in einem sterilen Becher mit vollständigen Medien auf Eis oder halten bei 4 ° C.
Hinweis: Das Tumorprobe ein Stück von überschüssigem Patienten Tumorgewebe, das von einem Chirurgen entfernt wird, durch einen Pathologen verarbeitet und in ein steriles Sammelbecher mit komplettem Medium gegeben. Achtung, Blut Borne Pathogen-Richtlinien mit Blut oder Gewebe folgen. Auch idealerweise fünf Mäuse zu injizieren, sollte der Tumor ungefähr 1 cm³ sein. - Bringen Sie die Tumorprobe an die Tieranlage für in immunsupprimierten Mäusen injiziert wird.
Hinweis: Es ist am besten, die Tumorprobe so schnell wie möglich zu bearbeiten.- In einer Laminarströmungsabzug, legen Sie die Tumorprobe in eine sterile Kunststoff-Schneideschale aus dem Tumor Tasse. Verwenden Sie autoklaviert-kleine Schere und Pinzette in 10 zu schneiden - 12 ca. 3 x 3 x 3 mm große Stücke aufnehmen und in einem Autoklaven behandelt 1,5 ml Mikrozentrifugenröhrchen mit 300 ul gallertartig Proteinmischung Lösung gefüllt. Halten Sie Röhrchen auf Eis.
- Als Priorität Tumor in Mäuse injiziert, aber wenn es einen Tumor übrig ist, sammeln schockgefroren Fläschchen (FF), Formalin fixierten und in Paraffin eingebetteten (FFPE) Tassen und einen lebensfähigen Tumor Fläschchen.
- Für FF, sammeln kleine Stücke von Tumorgewebe aus einem sterilen Fläschchen kryogenen zur weiteren Analyse, wie beispielsweise Protein, RNA oder DNA-Isolierung. Legen Sie FF sofort in einen flüssigen Stickstoff Dewar und speichern Langzeit in eine -80 ° C Gefrierschrank.
- Für FFPE, wenn es genug Tumor, Platz 3 kleine Stücke in einem 10 ml 10% Formalin Tasse und Verfahren in Paraffin eingebettete Blöcke einmal Tumor für mindestens 24 Stunden in Formalin wurde.
Hinweis: 24-Stunden-basiertUnsere Histologie Kernvorschläge 11. - Schließlich legen Sie die restlichen Tumors in einem kryogenen Rohr. Machen tragfähige Medien durch Zugabe von 10% Dimethylsulfoxid (DMSO) Medien zu vervollständigen. Als nächstes wird 1 ml auf eine kryogene Rohr hinzufügen und auf Eis lagern. Hinweis: Bewahren Sie keine auf Eis für lange Zeiträume.
- Schneiden alle übrig gebliebenen Tumor in kleine Stücke, die idealerweise ausreichen wird für 10 Tumoren in 5 Mäuse in der Zukunft zu injizieren. Dann den vitalen Tumor Röhrchen auf Eis, bis sie in einen Isopropyalkohol Gefrierbehälter platziert werden kann (langsam friert den Tumor 1 ° C zu einem Zeitpunkt) und in die -80 ° C Gefrierschrank, um sicherzustellen, dass die Tumoren nicht sterben während der Gefrierverfahren.
Hinweis: Für die langfristige Lagerung sind die Tumoren entfernt (nach 2 - 3 Tage) und in eine große flüssigem Stickstoff Dewar gegeben. Bitte beachten Sie, dass lebensfähige Schläuche nicht auftauen werden, wenn es in Mäuse injiziert entnommen wird.
- Schneiden alle übrig gebliebenen Tumor in kleine Stücke, die idealerweise ausreichen wird für 10 Tumoren in 5 Mäuse in der Zukunft zu injizieren. Dann den vitalen Tumor Röhrchen auf Eis, bis sie in einen Isopropyalkohol Gefrierbehälter platziert werden kann (langsam friert den Tumor 1 ° C zu einem Zeitpunkt) und in die -80 ° C Gefrierschrank, um sicherzustellen, dass die Tumoren nicht sterben während der Gefrierverfahren.
3.Die Injektion von Patienten Tumorxenografte Abgeleitet
- Verwenden fünf 6 - 8 Wochen alte männliche und / oder weibliche athymische Nacktmäuse (T-Zell-defizient) für jeden einzelnen Patienten abgeleiteten Tumor. Injizieren insgesamt 10 Tumoren (2 Injektionen pro Maus) subkutan (SQ).
Hinweis: Der ursprüngliche menschliche Tumor wird als F0 bezeichnet und dann einmal in Mäuse injiziert ist die nächste Generation F1. Verwenden Sie auch autoklavierten Zangen, Scheren und Trokare für jede eindeutige Explantation. - Laststücke Tumor aus der gelatinösen Proteingemisch Lösung in autoklaviert 12 G Trokare und sicherzustellen, dass der Tumor vollständig in den Trokar geschoben wird.
- In einem sterilen Laminar-Flow-Haube, legen 5 Mäuse in eine Anästhesie-Box, die mit einer Isofluran-Narkose Maschine angeschlossen ist (in der Anfangssatz von 5% gestartet Isofluran, 3 bis 4% Sauerstoff und 2 - 3% Isofluran für die Aufrechterhaltung der Anästhesie) und Kohlefilter (absorbiert überschüssiges Gas).
Hinweis: Ein erfahrener Techniker sollten in der Lage, das gesamte Verfahren durchführen zuein Käfig von 5 Mäusen innerhalb von ca. 5 min Gesamt (ca. 30 sec pro Maus). Daher ist eine zusätzliche thermische Unterstützung und Augenschmierung ist im Allgemeinen nicht verwendet. Für weniger erfahrene Personen oder während des Trainings, wird dringend empfohlen, dass Personen entweder das Verfahren auf weniger Tiere auf einmal durchführen und / oder eine Schmierung Erwärmung pad / Auge während des Eingriffs verwendet werden, wenn Tiere länger als 5 Minuten narkotisiert werden. Vorgehensweise wird an unserer Universität auf IACUC Standards.
- In einem sterilen Laminar-Flow-Haube, legen 5 Mäuse in eine Anästhesie-Box, die mit einer Isofluran-Narkose Maschine angeschlossen ist (in der Anfangssatz von 5% gestartet Isofluran, 3 bis 4% Sauerstoff und 2 - 3% Isofluran für die Aufrechterhaltung der Anästhesie) und Kohlefilter (absorbiert überschüssiges Gas).
- Pinch eine Maus Zehe die Maus, um sicherzustellen, ist nicht mehr ansprechbar, dann nehmen Sie die Maus aus dem Isofluran-Box. Platzieren Sie die Maus auf ein sauberes Feld Tumoren auf der mittleren Rückenhalsbereich zu injizieren und den Trokar Abrutschen subkutan, bis der Flankenbereich mit autoklaviert 12 G Trokare erreicht ist.
- ein Tumor subkutan an jeder Seite der Maus in die Flanke zu liefern. Einklemmen des Tumors, wenn der Trokar herausgezogen wird, um sicherzustellen, dass der Tumor in der gewünschten Flankenbereich bleibt. Die gelatinous Proteinmischung härtet mit der Körpertemperatur des Maus und kapselt den Tumor für ca. 1 Woche Tumor wachsen und sichern Sie es mit dem SQ Bindegewebe zu helfen. Die Läsion durch den Trokar hergestellt ist nicht größer als 4 mm, und es gibt keine Notwendigkeit, die Haut mit Klammern zu schließen.
Anmerkung: Unsere Tierärzte bestimmt keine Schließung auf sehr geringe Größe der Läsion auf Basis erforderlich ist, eine schnelle Heilung Zeit (Mitte dorsalen Halsbereich reduziert jede Hautspannung oder Pflege der Läsion), keine Infektionen festgestellt und eine ständige Überwachung der Tiere während dieser Zeit .
- ein Tumor subkutan an jeder Seite der Maus in die Flanke zu liefern. Einklemmen des Tumors, wenn der Trokar herausgezogen wird, um sicherzustellen, dass der Tumor in der gewünschten Flankenbereich bleibt. Die gelatinous Proteinmischung härtet mit der Körpertemperatur des Maus und kapselt den Tumor für ca. 1 Woche Tumor wachsen und sichern Sie es mit dem SQ Bindegewebe zu helfen. Die Läsion durch den Trokar hergestellt ist nicht größer als 4 mm, und es gibt keine Notwendigkeit, die Haut mit Klammern zu schließen.
- Bevor die Maus ist vollständig wach Inject Meloxicam 2 mg / kg SQ (Schmerzmittel) entfernt von der Stelle der Tumorinjektion. Als nächstes legen Sie die Maus in den Käfig und zu überwachen, bis die Maus wach und bewegt.
Hinweis: Lassen Sie keine Tiere unbeaufsichtigt, bis sie vollständig wach zu erholen. Meloxicam Dosierung wird an unserer Universität auf IACUC Standards.- Als nächstes wiederholen Sie den Vorgang mit der 4verbleibenden Mäuse und ihre Atmung überwachen.
Hinweis: Bitte beachten Sie, das ein sehr schnelles Verfahren und Mäuse aufwachen sehr bald nach Meloxicam Injektion, aber Isofluran nach Bedarf anpassen. Jedes Mal, wenn eine Maus herausgenommen wird, schalten Sie die Isofluran nach unten. Die Meloxicam wird 24 Stunden dauern und die Läsionen der Trokare werden vollständig in 1 Woche zu heilen.
- Als nächstes wiederholen Sie den Vorgang mit der 4verbleibenden Mäuse und ihre Atmung überwachen.
4. Wartung von Patienten gewonnen Tumorxenotransplantates Bank
- Überwachen Sie das Wachstum und die Gesundheit der Mäuse mindestens einmal pro Woche. Verwenden Sie eine Tabelle (oder andere Tracking-System) zu Tumorgrößen, Tumor Generation, das Datum der Tumorinjektion und die Gesundheit der Mäuse zu verfolgen.
Hinweis: Wenn Mäuse 15% ihres ursprünglichen Körpergewichts, niedrige Körperzustand Scores verloren haben (≥ 2) haben Tumor Ulzerationen, Tumoren erreicht 2.000 mm 3 oder insgesamt Tumoren 3.000 mm 3 oder kränklich sind (krümmte, Kälte, Lethargie, usw. in keiner Weise.), Mäuse werden über CO₂ oder anästhesiert , gefolgt durch zervikale Dislokation euthanisiert wieecondary Verfahren. Euthanize über Anästhesie und Genickbruch, wenn Tumor sammeln, sonst Mäuse über CO₂ und Genickbruch eingeschläfert werden. - Wenn ein Tumor ist etwa 1.500-2.000 mm 3 Anesthetize die Mäuse wie oben beschrieben und dann Zervikaldislokation ausführen einschläfern.
- Überprüfen Sie, ob die Maus keinen Herzschlag hat. Excise die SQ Tumor mit autoklaviert Schere und Pinzette.
HINWEIS: Lassen Sie Tumoren für bis zu 1 Jahr zu wachsen und wenn kein Tumor gesehen wird dann einschläfern die Mäuse über CO 2, gefolgt von Zervikaldislokation als sekundäre Methode. - Passage der beste wachsenden Tumor in die nächste Generation (auch bekannt als einen neuen Satz von 5 Mäusen). Verwenden Sie Anweisungen oben zu sammeln 10 bis 12 Tumoren zum Weiterleiten und dann die übrig gebliebenen Tumor sammeln, wie auch oben beschrieben.
Hinweis: zahlreiche tragfähige Röhren Sammeln in den frühen Generationen sehr wichtig ist (F1 - F8); Daher sammeln mehrere tragfähige Rohre, FF Rohre und 1 FFPE pro generatIon. - Halten die verbleibenden Mäuse , bis eine neue Generation von Mäusen Tumorwachstums von etwa 300 mm 3 aufweist. Wenn verbleibenden Mäuse Tumoren haben, die groß sind, weiter wie oben beschrieben zu sammeln.
- Überprüfen Sie, ob die Maus keinen Herzschlag hat. Excise die SQ Tumor mit autoklaviert Schere und Pinzette.
- Weiter zur Passage Tumoren und sammeln bis F15 in jeder Phase. An diesem Punkt nehmen eine tragfähige Rohr der frühesten Generation möglich aus flüssigem Stickstoff und tauen auf Eis und folgen Tumor-Injektion oben beschriebenen Verfahren.
Hinweis: Tumore, die von lebenden Röhren wachsen länger dauern, bei Mäusen wachsen im Vergleich zu von Generation zu Generation weitergegeben, so halten, dass, bei der Planung. Wenn ein bestimmtes PDTX Modell wird nicht mehr bei jedem Durchgang benötigt, einschläfern und Tumor sammeln, zahlreiche tragfähige Rohre zu gewährleisten, sind für die zukünftige Verwendung gesammelt.
5. Developmental Therapeutics mit Tumorxenografte Patient Abgeleitet
Hinweis: Die meisten Tumoren bei F3 Generation haben ein gutes Wachstum Kinetik (wachsen schneller und Consistent), daher gehen die Arzneimittelwirksamkeit Untersuchungen PDTX.
- Wenn die gewünschte Tumor sehr groß ist (1,500 - 2,000 mm 3) folgen Verfahren oben Tumor zu sammeln in die gewünschte Menge an Mäuse zu erweitern.
- Je nach der Hypothese getestet wird, um die Anzahl von Tumoren pro Behandlungsgruppe erforderlich bestimmen.
Anmerkung: 1 ml gelatinöser Proteingemisch-Lösung kann etwa fit 30 kleine Tumorstücke (je nach Tumormorphologie) zum Injizieren in Mäuse.
- Je nach der Hypothese getestet wird, um die Anzahl von Tumoren pro Behandlungsgruppe erforderlich bestimmen.
- Überprüfen Mäuse mit Tumoren wöchentlich und bei den meisten Tumoren sind sichtbar klein (etwa zwischen 50 bis 300 mm³) messen die Tumoren mit einer Schieblehre das Tumorvolumen zu bestimmen. Das Tumorvolumen = [width² (kleinste Mess) x Länge (größte Messung)] x 0,52.
Hinweis: Die gallertartig Proteinmischung Lösung umgibt die injizierten Tumorstücke für eine Woche, dann nach einer Woche das Tumorwachstum genau sein wird. - Verwenden Sie die Tumorvolumina zwischen 50 bis 300 mm³ und dieim Durchschnitt n der linken und rechten Tumoren. Dann Randomisierung in Behandlungsgruppen mit 10 Tumoren pro Gruppe und eine Gruppe durchschnittlich innerhalb von wenigen Zahlen voneinander. Als nächstes sortieren Sie die Mäuse in Gruppen und beginnen, die Behandlungsstudie gewünscht.
- Dosis die Mäuse mit Drogen (Zeitplan abhängig von Droge), wiegen und messen (Tumor) zweimal pro Woche. Am Ende der Studie, einschläfern Mäuse über Anästhesie und Genickbruch und sammeln Tumor für zukünftige pharmakodynamischen Analyse im Labor.
Hinweis: Die Studie für 30 Tage dauert, je nach Fahrzeugtumorgröße und die Gesundheit der Mäuse.
6. Organisation eines PDTX Bank
- Halten Sie eine gut dokumentierte Form zu verhindern, der Forschung und der entsprechenden Verwendung von Tieren zu wiederholen.
HINWEIS: Dies ist der Schlüssel zu einer erfolgreichen PDTX Bank.- Verwenden Tabellen Spur eines Tumors aus dem menschlichen Patienten in der Klinik zu halten, an Mäuse in der PDTX Bank, Behandlungen, Daten und was gesammelt wird. Hinweis: Dazu gehören Gefrierschrank, flüssigem Stickstoff DewarUnd FFPE Lagerung als auch.
Ergebnisse
Ähnlichkeiten von gemeinsamen Mutationen in den CRC PDTX Modelle und der TCGA
Wir untersuchten , ob der Anteil der gemeinsamen Mutationen (KRAS, NRB, BRAF, PIK3CA, APC, CTNNB1 und TP53) in der CRC PDTX Bank repräsentativ waren auf die Frequenz Mutation in dem CRC - Patientenpopulation festgestellt. Wie in 2A (TCGA) und B (CRC PDTX Bank) gezeigt, wurden die Häufigke...
Diskussion
Die PDTX Drug Discovery-Plattform bietet ein verbessertes Modell auf die Unzulänglichkeiten anderer präklinischen Modellen, die bei der Vorhersage der klinischen Aktivität von neuen Verbindungen unzuverlässig sind. Wichtig ist biologisch stabil sind, Tumoren in diesem Modell behalten metastatischen Potential und zeigen ähnliche Droge Ansprechbarkeit von Generation zu Generation weitergegeben. In diesem Modell Patienten abgeleiteten Tumoren in athymische Nacktmäuse injiziert, passagiert und anschließend in therape...
Offenlegungen
The authors have nothing to disclose.
Danksagungen
This work was supported by grant 1R01CA152303-01.
Materialien
| Name | Company | Catalog Number | Comments |
| RPMI or DMEM | Corning | 10-040-CV | |
| Penicillin-Streptomycin | Corning | 30-002-CI | |
| Non-essential Amino Acids | Corning | 25-025-CI | |
| Fetal Bovine Serum | Corning | 35-010-CV | Thaw in -4 °C, then activate for 30 min at 60 °C water bath |
| CPT blood tube | BD vacutainer | 362761 | |
| Microcentrifuge tube | Surelock | A-7002 | |
| Phosphate-Buffered Saline | Corning | 21-040-CV | |
| Cyrogenic vials | Cyroking | C0732901 | |
| Plastic tumor cutting dish | Trueline | TR4001 | |
| Scissors | Roboz | RS-5881 | |
| Forceps | Roboz | RS-5135 | |
| Matrigel (gelatinous protein mixture) | Corning | 354234 | Store at -20 or -80 °C, then thaw on ice, do not leave at RT |
| 10% Formalin cups | Protocol | 032-059 | |
| Liquid Nitrogen Dewar Storage | Thermolyne | CY50900 | |
| Portable liquid nitrogen dewar | Nalgene | 4150-2000 | |
| Dimethyl Sulfoxide | Fischer | 67-68-5 | |
| Freezing container: Mr Frosty | Nalgene | 5100-0001 | |
| Isopropyl Alcohol | Decon | 64-17-5 | |
| Trocars | Innovative Research of America | MP-182 | |
| Anesthesia machine | Patterson Veterinary | ||
| Anesthesia box | Patterson Veterinary | ||
| Isoflurane | Vet one | 1038005 | |
| F-Air Canister | Bickford Omnicon | 80120 | |
| Meloxicam | Vet one | 5182-90C | |
| Calipers | Fowler | 54-100-167 | |
| Weight scale | Ohaus | Scout Pro SP601 |
Referenzen
- Siegel, R. L., Miller, K. D., Jemal, A. Cancer statistics. 2015. CA Cancer J Clin. 65 (1), 5-29 (2015).
- . Comprehensive molecular characterization of human colon and rectal cancer. Nature. 487 (7407), 330-337 (2012).
- Arcaroli, J. J., et al. Tumours with elevated levels of the Notch and Wnt pathways exhibit efficacy to PF-03084014, a gamma-secretase inhibitor, in a preclinical colorectal explant model. Br J Cancer. 109 (3), 667-675 (2013).
- Hubbard, J., Grothey, A. Antiangiogenesis agents in colorectal cancer. Curr Opin Oncol. 22 (4), 374-380 (2010).
- van Es, J. H., et al. Notch/gamma-secretase inhibition turns proliferative cells in intestinal crypts and adenomas into goblet cells. Nature. 435 (7044), 959-963 (2005).
- Cassidy, J. W., Caldas, C., Bruna, A. Maintaining Tumor Heterogeneity in Patient-Derived Tumor Xenografts. Cancer Res. 75 (15), 2963-2968 (2015).
- Jin, K., et al. Patient-derived human tumour tissue xenografts in immunodeficient mice: a systematic review. Clin Transl Oncol. 12 (7), 473-480 (2010).
- Julien, S., et al. Characterization of a large panel of patient-derived tumor xenografts representing the clinical heterogeneity of human colorectal cancer. Clin Cancer Res. 18 (19), 5314-5328 (2012).
- Siolas, D., Hannon, G. J. Patient-derived tumor xenografts: transforming clinical samples into mouse models. Cancer Res. 73 (17), 5315-5319 (2013).
- Tentler, J. J., et al. Patient-derived tumour xenografts as models for oncology drug development. Nat Rev Clin Oncol. 9 (6), 338-350 (2012).
- Carson, F. L. . Histotechnology: A Self-Assessment Workbook. , (1996).
- Arcaroli, J. J., et al. Common PIK3CA mutants and a novel 3' UTR mutation are associated with increased sensitivity to saracatinib. Clin Cancer Res. 18 (9), 2704-2714 (2012).
- Arcaroli, J. J., et al. A NOTCH1 gene copy number gain is a prognostic indicator of worse survival and a predictive biomarker to a Notch1 targeting antibody in colorectal cancer. Int J Cancer. 138 (1), 195-205 (2016).
- Arcaroli, J. J., et al. Gene array and fluorescence in situ hybridization biomarkers of activity of saracatinib (AZD0530), a Src inhibitor, in a preclinical model of colorectal cancer. Clin Cancer Res. 16 (16), 4165-4177 (2010).
- Lieu, C. H., et al. Antitumor activity of a potent MEK inhibitor, TAK-733, against colorectal cancer cell lines and patient derived xenografts. Oncotarget. 6 (33), 34561-34572 (2015).
- Pitts, T. M., et al. Association of the epithelial-to-mesenchymal transition phenotype with responsiveness to the p21-activated kinase inhibitor, PF-3758309, in colon cancer models. Front Pharmacol. 4, 35 (2013).
- Song, E. K., et al. Potent antitumor activity of cabozantinib, a c-MET and VEGFR2 inhibitor, in a colorectal cancer patient-derived tumor explant model. Int J Cancer. 136 (8), 1967-1975 (2015).
- Tentler, J. J., et al. Identification of predictive markers of response to the MEK1/2 inhibitor selumetinib (AZD6244) in K-ras-mutated colorectal cancer. Mol Cancer Ther. 9 (12), 3351-3362 (2010).
- Bardelli, A., et al. Amplification of the MET receptor drives resistance to anti-EGFR therapies in colorectal cancer. Cancer Discov. 3 (6), 658-673 (2013).
- Bertotti, A., et al. A molecularly annotated platform of patient-derived xenografts ("xenopatients") identifies HER2 as an effective therapeutic target in cetuximab-resistant colorectal cancer. Cancer Discov. 1 (6), 508-523 (2011).
- Davis, S. L., et al. Combined inhibition of MEK and Aurora A kinase in KRAS/PIK3CA double-mutant colorectal cancer models. Front Pharmacol. 6, 120 (2015).
- Morelli, M. P., et al. Preclinical activity of the rational combination of selumetinib (AZD6244) in combination with vorinostat in KRAS-mutant colorectal cancer models. Clin Cancer Res. 18 (4), 1051-1062 (2012).
- Pitts, T. M., et al. Dual pharmacological targeting of the MAP kinase and PI3K/mTOR pathway in preclinical models of colorectal cancer. PLoS One. 9 (11), e113037 (2014).
- Spreafico, A., et al. Rational combination of a MEK inhibitor, selumetinib, and the Wnt/calcium pathway modulator, cyclosporin A, in preclinical models of colorectal cancer. Clin Cancer Res. 19 (15), 4149-4162 (2013).
- Arcaroli, J. J., et al. ALDH+ tumor-initiating cells exhibiting gain in NOTCH1 gene copy number have enhanced regrowth sensitivity to a gamma-secretase inhibitor and irinotecan in colorectal cancer. Mol Oncol. 6 (3), 370-381 (2012).
- Hoey, T., et al. DLL4 blockade inhibits tumor growth and reduces tumor-initiating cell frequency. Cell Stem Cell. 5 (2), 168-177 (2009).
- Ikebuchi, F., et al. Dissociation of c-Met phosphotyrosine sites in human cells in response to mouse hepatocyte growth factor but not human hepatocyte growth factor: the possible roles of different amino acids in different species. Cell Biochem Funct. 31 (4), 298-304 (2013).
- Zhang, Y. W., et al. Enhanced growth of human met-expressing xenografts in a new strain of immunocompromised mice transgenic for human hepatocyte growth factor/scatter factor. Oncogene. 24 (1), 101-106 (2005).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten