É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Desenvolvimento e manutenção de um tumor do paciente pré-clínica Derivado Xenoenxerto Modelo de Investigação de Novel Anti-Cancer Therapies
Neste Artigo
Resumo
Utilizando tumores derivados do paciente em um modelo pré-clínico subcutânea é uma excelente maneira de estudar a eficácia de novas terapias, a descoberta de biomarcadores preditivos, e vias resistentes aos medicamentos. Este modelo, no processo de desenvolvimento de medicamentos, é essencial para determinar o destino de muitas terapias anti-cancro novos antes da investigação clínica.
Resumo
Patient derived tumor xenograft (PDTX) models provide a necessary platform in facilitating anti-cancer drug development prior to human trials. Human tumor pieces are injected subcutaneously into athymic nude mice (immunocompromised, T cell deficient) to create a bank of tumors and subsequently are passaged into different generations of mice in order to maintain these tumors from patients. Importantly, cellular heterogeneity of the original tumor is closely emulated in this model, which provides a more clinically relevant model for evaluation of drug efficacy studies (single agent and combination), biomarker analysis, resistant pathways and cancer stem cell biology. Some limitations of the PDTX model include the replacement of the human stroma with mouse stroma after the first generation in mice, inability to investigate treatment effects on metastasis due to the subcutaneous injections of the tumors, and the lack of evaluation of immunotherapies due to the use of immunocompromised mice. However, even with these limitations, the PDTX model provides a powerful preclinical platform in the drug discovery process.
Introdução
O câncer colorretal (CRC) é um contributo significativo para as mortes por câncer nos Estados Unidos. Em 2015, havia uma estimativa de 132,700 novos casos de CRC com 49.700 mortes 1. Embora o prognóstico em pacientes com doença localizada é excelente, os pacientes com doença avançada tem resultados pobres, tornando esta uma das principais prioridades no desenvolvimento de novas terapias. Apesar padrão de esquemas quimioterápicos cuidados e produtos biológicos mais recentes que são implantados contra esta doença, houve apenas um aumento incremental na sobrevida global. Deste modo, existe um esforço significativo na compreensão dos percursos do controlador envolvidos na facilitação do crescimento do tumor nesta doença. O Cancer Genome Atlas rede recentemente identificados numerosos caminhos principais que estão implicados no CRC desregulação e incluem: WNT, fosfatidilinositol 3-quinase (PI3K), RAS, factor de crescimento transformante-β (TGF- β) e TP53 2. Juntos, com as investigações descrever otos caminhos que potenciam o crescimento no CRC ter inflamado o desenvolvimento de novas terapias que visem melhorar significativamente a sobrevivência nesta população de pacientes 3-5. Utilizando modelos pré-clínicos no desenvolvimento de medicamentos de oncologia têm sido essenciais neste processo em predizer a atividade clínica destes novos compostos.
Vários modelos pré-clínicos têm sido utilizados no processo de desenvolvimento de drogas. Considerando-se que pré-clínicos e modelos animais transgénicos linhas de células imortalizadas não têm tido sucesso na determinação da actividade clínico de novas terapias de oncologia, em grande parte devido à sua incapacidade para reflectir a complexidade de tumores humanos, os modelos derivados de xenoenxerto de tumor do paciente (PDTX) foram estabelecidas. A maior vantagem deste modelo é que a heterogeneidade do tumor permanece intacta e reflete de perto as características moleculares e clonalidade de tumor do paciente 6-9 originários. Modelos PDTX fornecer uma excelente in vivoplataforma pré-clínico para estudar novos agentes, vias de resistência a drogas, estratégias de combinações, e da biologia de células-tronco do câncer 10.
Uma visão geral do processo PDTX é ilustrado na Figura 1. Ela começa na clínica, consentindo pacientes para permitir que alguns dos seus tecidos do tumor em excesso para ser usada para esta pesquisa. Em seguida, no momento da cirurgia, um pedaço do tumor é extrapolados por um patologista e colocados em meios de comunicação para ser transportados para o pessoal de investigação. Imediatamente depois disto, uma secção do tumor é cortado em pequenos pedaços e transplantadas em ratinhos imunodeficientes subcutaneamente. Uma vez que o tumor cresce, ele é passadas para gerações diferentes de ratinhos, a fim de manter o tumor 10. Tipicamente, após a geração F3 o tumor pode ser expandido para um estudo de tratamento em que os novos compostos e / ou terapias de combinações são avaliadas. Utilizando Next Gen Seq (exome Seq, RNA Seq e SNP array) potenciais biomarcadores preditivos são descobrirEd que ajudar na selecção de pacientes que podem derivar beneficiar de um tratamento em particular.
Os objectivos globais do uso de modelos PDTX são: 1) avaliar a eficácia de novas terapias como agente único ou em combinação e 2) identificar biomarcadores preditivos de sensibilidade ou resistência antes da investigação clínica. Neste artigo, nós fornecemos a metodologia na iniciação e manutenção de um banco CRC PDTX e proporcionar as vantagens e as limitações deste modelo na descoberta desenvolvimento de medicamentos.
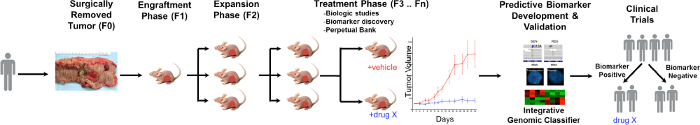
Figura 1. Visão geral do CRC PDTX Protocolo Modelo. Um tumor derivado do paciente é recebido de uma cirurgia e imediatamente injetadas em ratos pelados atímicos por via subcutânea. Uma vez que o tumor cresce, ela é expandido em gerações subseqüentes e eventualmente ampliado para estudos de tratamento. respo tratamentoNSES são avaliados e biomarcadores preditivos são identificados que podem ajudar na seleção dos pacientes. Por favor clique aqui para ver uma versão maior desta figura.
Protocolo
Declaração de Ética: amostras de tumor de adenocarcinoma colorrectal derivadas de pacientes foram obtidos a partir de pacientes que consentiram na Universidade do Colorado Hospital em conformidade com um protocolo aprovado pelo Institutional Colorado múltipla Review Board (08-0439). Todo o trabalho animal foi realizada no âmbito de protocolos de animais aprovados pela University of Colorado Denver Institutional Animal Care e Use Committee (IACUC, Protocolo # 51412 (06) 1E e 96813 (04) 1E).
1. Receber e Preparando sangue do paciente
- Recolhe 1 - 2 ml de sangue num tubo de separação do sangue / células contendo citrato de sódio (fases de tubo são incluídos no plasma, de linfócitos e de monócitos banda, fluido com gradiente de densidade, barreira de gel, e os eritrócitos e neutrófilos). Cuidado, seguir as orientações transmitidas pelo sangue patogénico com sangue ou tecidos.
Nota: Os PBMC e plasma poderiam ser usados para estudos futuros que podem incluir: comparando a variação genética da linha germinal com mutações de tumor, isolando circulacélulas tumorais Ting, avaliando DNA da célula livre (cfDNA), proteínas examinando e microRNAs, etc. - Centrifuga-se o tubo de separação / célula de sangue a 2.500 xg durante 15 min sem travão à RT.
- Recolher as células mononucleares do sangue periférico (PBMC em linfócitos e banda de monócitos do tubo) e colocado num tubo de microcentrífuga de 1,5 ml (claro, esterilizável em autoclave, DNase, RNase e isenta de pirogénios), e encher a parte superior do tubo com estéril tamponada com fosfato Salino (PBS).
- Centrifugar a 2.300 xg durante 3 minutos à temperatura ambiente para formar um sedimento de PBMC na parte inferior do tubo. Em seguida, remover o sobrenadante com cuidado. Adicionar 1 ml de PBS estéril para lavar o pellet e centrifugar a 3000 xg durante 30 segundos e, em seguida, remover o sobrenadante.
- Usar uma pipeta para recolher o plasma a partir do tubo de separação do sangue / células (na fase de plasma do tubo) num criotubo de 1,5 ml estéril (DNase e RNase livre, sem ADN humano, endotoxina livre) e colocar o plasma e sedimento de PBMC de numa -80 ° C freezer para armazenamento.
2. Receber e Preparação do Paciente Tumor Amostra
- Prepare qualquer meio RPMI ou meios DMEM com 1: 100 (10%) de Penicilina-Estreptomicina e não-aminoácidos essenciais, 1: 1000 (1%) Plasmocin, e 10% inactivado Soro Fetal de Bovino (meio completo) e adicionar de 20 - 25 ml para um copo de colheita estéril para o espécime de tumor.
- Recuperar amostra de tumor em um copo estéril contendo meio completo em gelo ou manter a 4 ° C.
Nota: A amostra de tumor é um pedaço de tecido de tumor do paciente em excesso que é removido por um cirurgião, processada por um patologista, e colocados num copo de colheita estéril com meio completo. Cuidado, seguir as orientações transmitidas pelo sangue patogénico com sangue ou tecidos. Além disso, idealmente para injectar cinco murganhos, o tumor deve ser de aproximadamente 1 cm. - Levar a amostra de tumor com a instalação para animais para a injecção em ratinhos imunocomprometidos.
Nota: É melhor para processar a amostra do tumor, logo que possível.- Em uma câmara de fluxo laminar, colocar a amostra de tumor em um prato de corte de plástico estéril a partir do copo de tumor. Use autoclavado-pequenas tesouras e pinças para cortar em 10 - 12 partes a cerca de 3 x 3 x 3 mm, e colocar num tubo de microcentrífuga de 1,5 ml autoclavado cheias com 300 uL de solução de proteína mistura gelatinosa. Mantenha o tubo em gelo.
- Como prioridade injetar tumor em ratos, mas se houver qualquer tumor que sobraram, recolher frascos flash congelado (FF) copos, fixados em formalina embebidos em parafina (FFPE), e um frasco de tumor viável.
- Para FF, recolher pequenos pedaços de tecidos de tumor a partir de um criotubo esterilizado para posterior análise, tais como proteína, ARN, ADN ou isolamento. Coloque FF imediatamente num vaso Dewar de azoto líquido e armazenar a longo prazo num -80 ° C congelador.
- Para FFPE, se houver suficiente do tumor, local 3 pequenas peças para um copo de 10 ml de formalina a 10% e embebidos em blocos de processo de parafina do tumor uma vez que tem sido em formol durante pelo menos 24 h.
Nota: 24 horas é baseadooff nossas sugestões Histologia do núcleo 11. - Por fim, colocar o tumor remanescente num tubo criogénico. Adicione meios viáveis por adição de 10% de dimetilsulfóxido (DMSO) para completar meios. Em seguida, adicione 1 ml a um tubo criogénico e armazenar no gelo. Nota: Não manter em gelo durante longos períodos de tempo.
- Cortar qualquer tumor restante em pedaços pequenos que, idealmente, será suficiente para 10 tumores para ser injectada em 5 ratos no futuro. Em seguida, colocar o tubo tumorais viáveis em gelo até que ele pode ser colocado dentro de um recipiente de congelamento de álcool isopropílico (congela-se lentamente a um tumor ° C de cada vez) e colocado em -80 ° C congelador para assegurar que os tumores não morrem durante o processo de congelamento.
Nota: Para armazenamento a longo prazo, os tumores são removidos (depois de 2 - 3 dias) e colocados num grande vaso Dewar de azoto líquido. Por favor, note que os tubos viáveis não devem ser autorizados a descongelar, a menos que ele está sendo levado para injetar camundongos.
- Cortar qualquer tumor restante em pedaços pequenos que, idealmente, será suficiente para 10 tumores para ser injectada em 5 ratos no futuro. Em seguida, colocar o tubo tumorais viáveis em gelo até que ele pode ser colocado dentro de um recipiente de congelamento de álcool isopropílico (congela-se lentamente a um tumor ° C de cada vez) e colocado em -80 ° C congelador para assegurar que os tumores não morrem durante o processo de congelamento.
3.A injecção de doentes Derivado xenoenxertos de tumores
- Use cinco 6 - do sexo masculino 8 semanas de idade e / ou ratos pelados atímicos fêmea (de células T deficiente) para cada tumor derivado paciente separado. Injectar um total de 10 tumores (2 injecções por rato) por via subcutânea (SQ).
Nota: O tumor humana original é designada como F0 e, em seguida, uma vez injectada em ratos é a próxima geração F1. Além disso, use uma pinça autoclavada, tesouras e trocartes para cada explante único. - peças de carga de tumor a partir da solução gelatinosa mistura proteica em autoclavados trocartes 12 G e assegurar que o tumor é completamente empurrado para dentro do trocarte.
- Em uma câmara de fluxo laminar estéril, colocar 5 ratinhos em uma caixa de anestesia que é ligado a uma máquina de isoflurano anestesia (iniciada a uma taxa inicial de 5% de isoflurano, 3-4% de oxigénio, e 2-3% de isoflurano para manutenção da anestesia) e filtro de carvão (absorve o excesso de gás).
Nota: Um técnico experiente deve ser capaz de executar todo o procedimento sobreuma gaiola de 5 ratinhos dentro de aproximadamente 5 minutos total (cerca de 30 segundos por ratinho). Portanto, o apoio térmico adicional e lubrificação do olho não é geralmente usado. Para os indivíduos menos experientes ou durante o treino, é altamente recomendado que os indivíduos quer realizar o procedimento em menos animais de uma só vez e / ou usar um aquecimento de lubrificação pad / olho durante o procedimento se os animais serão anestesiados mais de 5 min. Procedimento é baseado em padrões IACUC em nossa universidade.
- Em uma câmara de fluxo laminar estéril, colocar 5 ratinhos em uma caixa de anestesia que é ligado a uma máquina de isoflurano anestesia (iniciada a uma taxa inicial de 5% de isoflurano, 3-4% de oxigénio, e 2-3% de isoflurano para manutenção da anestesia) e filtro de carvão (absorve o excesso de gás).
- Beliscar um dedo do pé mouse para assegurar o mouse não é mais responsivo, em seguida, tomar o mouse para fora da caixa isoflurano. Posicione o mouse sobre um campo limpo para injetar tumores na região do pescoço média dorsal e deslizando a trocar-se por via subcutânea, até região do flanco é alcançado com autoclavados 12 trocartes G.
- Entregar por via subcutânea um tumor para cada lado de flanco do rato. Comprima o tumor, quando o trocarte é puxada para fora, garantindo que o tumor permanece na região flanco desejado. a GEmistura de proteína latinous endurece com a temperatura corporal do mouse e encapsula o tumor durante aproximadamente 1 semana para ajudar o tumor crescer e prendê-lo para o tecido conjuntivo SQ. A lesão feita pela trocarte é não maior do que 4 mm e não há necessidade de fechar a pele com agrafos.
Nota: Os nossos veterinários determinada sem fechamento é necessário com base em tamanho muito pequeno da lesão, tempo de cura rápido (região do pescoço média dorsal reduz toda a tensão da pele ou aliciamento de lesão), não há infecções observadas e acompanhar de perto os animais durante este período de tempo .
- Entregar por via subcutânea um tumor para cada lado de flanco do rato. Comprima o tumor, quando o trocarte é puxada para fora, garantindo que o tumor permanece na região flanco desejado. a GEmistura de proteína latinous endurece com a temperatura corporal do mouse e encapsula o tumor durante aproximadamente 1 semana para ajudar o tumor crescer e prendê-lo para o tecido conjuntivo SQ. A lesão feita pela trocarte é não maior do que 4 mm e não há necessidade de fechar a pele com agrafos.
- Antes de o mouse está totalmente acordado injetar Meloxicam 2 mg / kg SQ (analgésicos) de distância do local da injeção tumor. Em seguida, coloque o rato na gaiola e monitorar até que o mouse está acordado e em movimento.
Nota: Não deixe recuperando animais sem vigilância até que esteja totalmente acordado. dosagem meloxicam é baseada em padrões IACUC em nossa universidade.- Em seguida, repetir o mesmo procedimento com o 4restantes ratos e monitorar a sua respiração.
Nota: Por favor note que este é um procedimento muito rápido e ratos acordar muito logo após a injecção meloxicam, mas ajustar isoflurano, conforme necessário. Cada vez que um rato é retirado, abaixe o isoflurano. O meloxicam vai durar 24 horas e as lesões dos trocartes vai curar totalmente em 1 semana.
- Em seguida, repetir o mesmo procedimento com o 4restantes ratos e monitorar a sua respiração.
4. Manutenção de Paciente Derivado Tumor de Xenoenxerto Banco
- Monitorizar o crescimento e saúde dos ratos, pelo menos, uma vez por semana. Use uma planilha (ou outro sistema de rastreamento) para controlar tamanhos tumorais, geração de tumor, data da injecção do tumor, e saúde de ratos.
Nota: Se os ratos perderam 15% do seu peso corporal original, escore corporal baixo (≥ 2), ter ulcerações tumor, tumores atingindo 2.000 mm3 ou tumores no total 3.000 mm3, ou estejam doentes (curvado, frio, letargia, etc .) de qualquer forma, os ratos são sacrificados por meio de COp ou anestesiados, seguido por deslocamento cervical quantoMétodo operadores secundários. Eutanásia através de anestesia e deslocamento cervical se recolher tumor, caso contrário, os ratos são sacrificados através de CO₂ e deslocamento cervical. - Quando um tumor é de cerca de 1.500-2.000 mm 3 Anestesiar os ratos tal como descrito acima e, em seguida, executar o deslocamento cervical a eutanásia.
- Verifique se o mouse não tem batimento cardíaco. Extirpar o tumor SQ com tesouras e fórceps autoclavados.
NOTA: Permitir que os tumores crescer durante até 1 ano e, se nenhum tumor é visto em seguida, a eutanásia ratos através de CO 2, seguida por deslocamento cervical como método secundário. - Passagem a melhor tumor em crescimento para a próxima geração (aka um novo conjunto de 5 ratinhos). Use instruções acima para coletar 10 - 12 tumores de passagem e, em seguida, recolher o tumor residual como também descrito acima.
Nota: Coletando inúmeros tubos viáveis é muito importante nas primeiras gerações (F1 - F8); portanto, recolher vários tubos viáveis, tubos de FF, e 1 FFPE per generatíon. - Manter os ratinhos restantes até que uma nova geração de ratinhos tem o crescimento do tumor de cerca de 300 mm 3. Quando os ratinhos restantes têm tumores que são grandes, continuar a recolher, conforme descrito acima.
- Verifique se o mouse não tem batimento cardíaco. Extirpar o tumor SQ com tesouras e fórceps autoclavados.
- Continue a tumores de passagem e recolher em cada fase até F15. Neste ponto, pegue um tubo viável dos primeiros geração possível de nitrogênio líquido e deixe descongelar em gelo e seguir os procedimentos de injeção de tumor descritos acima.
Nota: Os tumores que crescem a partir de tubos viáveis levar mais tempo para crescer em ratinhos comparada com passando de geração em geração, de modo manter isso em mente ao planejar. Se um modelo PDTX particular, já não é necessária em qualquer passagem, eutanásia e recolher tumor, para assegurar inúmeros tubos viáveis são coletadas para uso futuro.
5. Developmental Therapeutics com o paciente Derivado xenoenxertos de tumores
Nota: A maioria dos tumores na geração F3 tem boa cinética de crescimento (crescer mais rápido e mais consistent), portanto, proceder à PDTX estudos de eficácia de drogas.
- Quando o tumor desejado é muito grande (1.500 - 2.000 mm3), seguir os procedimentos acima, para recolher o tumor a expandir-se para a quantidade desejada de ratinhos.
- Dependendo da hipótese de que está sendo testada determinar o número de tumores por grupo de tratamento necessários.
Nota: 1 ml de solução de mistura de proteína gelatinosa pode se ajustar aproximadamente 30 pequenos pedaços de tumor (dependendo da morfologia do tumor) para a injecção em ratinhos.
- Dependendo da hipótese de que está sendo testada determinar o número de tumores por grupo de tratamento necessários.
- Verificar ratinhos com tumores semanais e quando a maioria dos tumores são visivelmente pequena (aproximadamente entre 50-300 mm ³) medir os tumores com compassos de calibre para determinar o volume do tumor. O volume do tumor = [width² (menor medida) x comprimento (a maior medição)] x 0,52.
Nota: A mistura de solução de proteína gelatinosa rodeia as peças de tumor injectadas durante uma semana, em seguida, após o crescimento do tumor uma semana será preciso. - Use os volumes dos tumores entre 50 - 300 mm ³ ean a média tumores esquerdo e direito. Em seguida, aleatoriamente em grupos de tratamento com 10 tumores por grupo e um grupo médio dentro de alguns números de cada outro. Em seguida, classificar os ratos em grupos e começar o estudo de tratamento desejado.
- Dose os ratos com drogas (horário de dependentes de drogas), pesar e medir (tumor) duas vezes por semana. No final do estudo, os ratinhos eutanásia através de deslocação cervical e anestesia e recolher tumor para futura análise farmacodinâmica no laboratório.
Nota: O estudo tem a duração de 30 dias, dependendo do tamanho do tumor veículo e da saúde dos ratos.
6. Organização de um banco PDTX
- Mantenha uma forma bem documentado para evitar a repetição da pesquisa e uso adequado dos animais.
NOTA: Esta é a chave para um banco PDTX bem sucedido.- Usar planilhas para manter o controle de um tumor do paciente humano na clínica, a ratinhos no banco PDTX, tratamentos de dados, e que é coletado. Nota: isto inclui freezer, vasos dewar nitrogênio líquido, E armazenamento, bem FFPE.
Resultados
Semelhanças de mutações comuns nos modelos CRC PDTX eo TCGA
Nós investigamos se a percentagem de mutações comuns (KRAS, ARN, BRAF, PIK3CA, APC, CTNNB1 e TP53) no banco CRC PDTX eram representativas para a frequência de mutação observada na população paciente CRC. Como mostrado na Figura 2A (TCGA) e B (CRC PDTX banco), a frequência de mutações nestes gene...
Discussão
A plataforma de descoberta de medicamentos PDTX oferece um modelo melhorado para as deficiências de outros modelos pré-clínicos que não são confiáveis na previsão de atividade clínica de novos compostos. Importante, tumores neste modelo são biologicamente estável, reter potencial metastático, e exibem a capacidade de resposta droga semelhante de geração em geração. Neste modelo, derivado do paciente tumores são injectados em ratinhos nus atímicos, passadas, e subsequentemente usados na avali...
Divulgações
The authors have nothing to disclose.
Agradecimentos
This work was supported by grant 1R01CA152303-01.
Materiais
| Name | Company | Catalog Number | Comments |
| RPMI or DMEM | Corning | 10-040-CV | |
| Penicillin-Streptomycin | Corning | 30-002-CI | |
| Non-essential Amino Acids | Corning | 25-025-CI | |
| Fetal Bovine Serum | Corning | 35-010-CV | Thaw in -4 °C, then activate for 30 min at 60 °C water bath |
| CPT blood tube | BD vacutainer | 362761 | |
| Microcentrifuge tube | Surelock | A-7002 | |
| Phosphate-Buffered Saline | Corning | 21-040-CV | |
| Cyrogenic vials | Cyroking | C0732901 | |
| Plastic tumor cutting dish | Trueline | TR4001 | |
| Scissors | Roboz | RS-5881 | |
| Forceps | Roboz | RS-5135 | |
| Matrigel (gelatinous protein mixture) | Corning | 354234 | Store at -20 or -80 °C, then thaw on ice, do not leave at RT |
| 10% Formalin cups | Protocol | 032-059 | |
| Liquid Nitrogen Dewar Storage | Thermolyne | CY50900 | |
| Portable liquid nitrogen dewar | Nalgene | 4150-2000 | |
| Dimethyl Sulfoxide | Fischer | 67-68-5 | |
| Freezing container: Mr Frosty | Nalgene | 5100-0001 | |
| Isopropyl Alcohol | Decon | 64-17-5 | |
| Trocars | Innovative Research of America | MP-182 | |
| Anesthesia machine | Patterson Veterinary | ||
| Anesthesia box | Patterson Veterinary | ||
| Isoflurane | Vet one | 1038005 | |
| F-Air Canister | Bickford Omnicon | 80120 | |
| Meloxicam | Vet one | 5182-90C | |
| Calipers | Fowler | 54-100-167 | |
| Weight scale | Ohaus | Scout Pro SP601 |
Referências
- Siegel, R. L., Miller, K. D., Jemal, A. Cancer statistics. 2015. CA Cancer J Clin. 65 (1), 5-29 (2015).
- . Comprehensive molecular characterization of human colon and rectal cancer. Nature. 487 (7407), 330-337 (2012).
- Arcaroli, J. J., et al. Tumours with elevated levels of the Notch and Wnt pathways exhibit efficacy to PF-03084014, a gamma-secretase inhibitor, in a preclinical colorectal explant model. Br J Cancer. 109 (3), 667-675 (2013).
- Hubbard, J., Grothey, A. Antiangiogenesis agents in colorectal cancer. Curr Opin Oncol. 22 (4), 374-380 (2010).
- van Es, J. H., et al. Notch/gamma-secretase inhibition turns proliferative cells in intestinal crypts and adenomas into goblet cells. Nature. 435 (7044), 959-963 (2005).
- Cassidy, J. W., Caldas, C., Bruna, A. Maintaining Tumor Heterogeneity in Patient-Derived Tumor Xenografts. Cancer Res. 75 (15), 2963-2968 (2015).
- Jin, K., et al. Patient-derived human tumour tissue xenografts in immunodeficient mice: a systematic review. Clin Transl Oncol. 12 (7), 473-480 (2010).
- Julien, S., et al. Characterization of a large panel of patient-derived tumor xenografts representing the clinical heterogeneity of human colorectal cancer. Clin Cancer Res. 18 (19), 5314-5328 (2012).
- Siolas, D., Hannon, G. J. Patient-derived tumor xenografts: transforming clinical samples into mouse models. Cancer Res. 73 (17), 5315-5319 (2013).
- Tentler, J. J., et al. Patient-derived tumour xenografts as models for oncology drug development. Nat Rev Clin Oncol. 9 (6), 338-350 (2012).
- Carson, F. L. . Histotechnology: A Self-Assessment Workbook. , (1996).
- Arcaroli, J. J., et al. Common PIK3CA mutants and a novel 3' UTR mutation are associated with increased sensitivity to saracatinib. Clin Cancer Res. 18 (9), 2704-2714 (2012).
- Arcaroli, J. J., et al. A NOTCH1 gene copy number gain is a prognostic indicator of worse survival and a predictive biomarker to a Notch1 targeting antibody in colorectal cancer. Int J Cancer. 138 (1), 195-205 (2016).
- Arcaroli, J. J., et al. Gene array and fluorescence in situ hybridization biomarkers of activity of saracatinib (AZD0530), a Src inhibitor, in a preclinical model of colorectal cancer. Clin Cancer Res. 16 (16), 4165-4177 (2010).
- Lieu, C. H., et al. Antitumor activity of a potent MEK inhibitor, TAK-733, against colorectal cancer cell lines and patient derived xenografts. Oncotarget. 6 (33), 34561-34572 (2015).
- Pitts, T. M., et al. Association of the epithelial-to-mesenchymal transition phenotype with responsiveness to the p21-activated kinase inhibitor, PF-3758309, in colon cancer models. Front Pharmacol. 4, 35 (2013).
- Song, E. K., et al. Potent antitumor activity of cabozantinib, a c-MET and VEGFR2 inhibitor, in a colorectal cancer patient-derived tumor explant model. Int J Cancer. 136 (8), 1967-1975 (2015).
- Tentler, J. J., et al. Identification of predictive markers of response to the MEK1/2 inhibitor selumetinib (AZD6244) in K-ras-mutated colorectal cancer. Mol Cancer Ther. 9 (12), 3351-3362 (2010).
- Bardelli, A., et al. Amplification of the MET receptor drives resistance to anti-EGFR therapies in colorectal cancer. Cancer Discov. 3 (6), 658-673 (2013).
- Bertotti, A., et al. A molecularly annotated platform of patient-derived xenografts ("xenopatients") identifies HER2 as an effective therapeutic target in cetuximab-resistant colorectal cancer. Cancer Discov. 1 (6), 508-523 (2011).
- Davis, S. L., et al. Combined inhibition of MEK and Aurora A kinase in KRAS/PIK3CA double-mutant colorectal cancer models. Front Pharmacol. 6, 120 (2015).
- Morelli, M. P., et al. Preclinical activity of the rational combination of selumetinib (AZD6244) in combination with vorinostat in KRAS-mutant colorectal cancer models. Clin Cancer Res. 18 (4), 1051-1062 (2012).
- Pitts, T. M., et al. Dual pharmacological targeting of the MAP kinase and PI3K/mTOR pathway in preclinical models of colorectal cancer. PLoS One. 9 (11), e113037 (2014).
- Spreafico, A., et al. Rational combination of a MEK inhibitor, selumetinib, and the Wnt/calcium pathway modulator, cyclosporin A, in preclinical models of colorectal cancer. Clin Cancer Res. 19 (15), 4149-4162 (2013).
- Arcaroli, J. J., et al. ALDH+ tumor-initiating cells exhibiting gain in NOTCH1 gene copy number have enhanced regrowth sensitivity to a gamma-secretase inhibitor and irinotecan in colorectal cancer. Mol Oncol. 6 (3), 370-381 (2012).
- Hoey, T., et al. DLL4 blockade inhibits tumor growth and reduces tumor-initiating cell frequency. Cell Stem Cell. 5 (2), 168-177 (2009).
- Ikebuchi, F., et al. Dissociation of c-Met phosphotyrosine sites in human cells in response to mouse hepatocyte growth factor but not human hepatocyte growth factor: the possible roles of different amino acids in different species. Cell Biochem Funct. 31 (4), 298-304 (2013).
- Zhang, Y. W., et al. Enhanced growth of human met-expressing xenografts in a new strain of immunocompromised mice transgenic for human hepatocyte growth factor/scatter factor. Oncogene. 24 (1), 101-106 (2005).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados