A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
פיתוח ותחזוקה של גידול נגזר החולה פרה xenograft דגם לחקירת Novel טיפולים נגד סרטן
In This Article
Summary
ניצול גידולים שמקורם המטופל במודל פרה-קליני תת עורית הוא דרך מצוינת ללמוד את היעילות של טיפולים חדשניים, גילוי סמן ביולוגי חזוי, ושבילי סמים עמידים. מודל זה, בתהליך פיתוח התרופות, יש חשיבות רבה לקביעת גורלו של טיפולים חדשניים נגד סרטן רבים לפני למחקר קליני.
Abstract
Patient derived tumor xenograft (PDTX) models provide a necessary platform in facilitating anti-cancer drug development prior to human trials. Human tumor pieces are injected subcutaneously into athymic nude mice (immunocompromised, T cell deficient) to create a bank of tumors and subsequently are passaged into different generations of mice in order to maintain these tumors from patients. Importantly, cellular heterogeneity of the original tumor is closely emulated in this model, which provides a more clinically relevant model for evaluation of drug efficacy studies (single agent and combination), biomarker analysis, resistant pathways and cancer stem cell biology. Some limitations of the PDTX model include the replacement of the human stroma with mouse stroma after the first generation in mice, inability to investigate treatment effects on metastasis due to the subcutaneous injections of the tumors, and the lack of evaluation of immunotherapies due to the use of immunocompromised mice. However, even with these limitations, the PDTX model provides a powerful preclinical platform in the drug discovery process.
Introduction
סרטן מעי גס (CRC) הוא תורם משמעותי מקרי מוות מסרטן בארצות הברית. בשנת 2015, היו כ 132,700 מקרים חדשים של CRC עם 49,700 מקרי מוות 1. למרות הפרוגנוזה בחולים עם מחלה מקומית מצוין, חולים עם מחלה מתקדמת יש תוצאות עניות, מה שהופך בעדיפות עליונה זו בפיתוח טיפולים חדשניים. למרות רמת משטר כימותרפיות טיפול ביולוגיות חדשות יותר שנפרסות נגד מחלה זו, חל רק גידול מצטבר בהישרדות כוללת. בהתאם לכך, ישנו מאמץ משמעותי בהבנת מסלולי הנהג המעורב בקידום צמיחת גידול במחלה זו. רשת אטלס הגנום הסרטן זיהתה לאחרונה מסלולים עיקריים רבים מעורבים dysregulation CRC וכוללים: Wnt, phosphoinositide 3-kinase (PI3K), RAS,-β גורם גדילה ההפיכה (β TGF-) ו TP53 2. יחד, עם חקירות מתאר otמסלולים לה להגביר הצמיחה CRC היה להצית את הפיתוח של טיפולים חדשים שנועדו לשפר את ההישרדות משמעותית באוכלוסיית חולים זו 3-5. במודלים פרה ניצול בפיתוח התרופה האונקולוגית היו חיוניים בתהליך זה בחיזוי העשייה הקלינית של תרכובות חדשות אלה.
במודלים פרה שונים כבר נוצלו בתהליך פיתוח תרופות. בהתחשב בכך במודלים של בעלי חיים מהונדסים פרה הנציחו שורות תאים לא הצליחו בקביעת הפעילות הקלינית של טיפולים אונקולוגיים רומן, בעיקר בשל החוסר יכל על מנת לשקף את המורכבות של גידולים אנושיים, xenograft גידול נגזר חולה (PDTX) מודלים הוקמו. היתרון הגדול של מודל זה הוא כי ההטרוגניות גידול נשארו שלמות וללא משקפות היטב את המאפיינים המולקולריים clonality של שמקורם בחולת גידול 6-9. מודלים PDTX לספק מעולה in vivoפלטפורמה פרה ללמוד סוכני רומן, שבילים עמידים לתרופות, אסטרטגיות combinational, ביולוגיה של תא גזע סרטני 10.
סקירה כללית של תהליך PDTX מתוארת באיור 1. זה מתחיל במרפאת, הסכמה חולה כדי לאפשר כמה רקמת הגידול העודפת שלהם כדי לשמש למחקר זה. לאחר מכן, בעת הניתוח, פיסת הגידול גולם על ידי פתולוג והכניסה תקשורת להיות מועברת אנשי מחקר. מיד אחרי זה, קטע של הגידול הוא חתך לחתיכות קטנות מושתלים לעכברים immunodeficient תת עורי. לאחר הגידול גדל, הוא passaged לתוך דורות שונים של עכברים כדי לשמור על גידול 10. בדרך כלל, לאחר שדור F3 הגידול ניתן להרחיב לתוך מחקר טיפול שבו תרכובות חדשות ו / או טיפולים קומבינטוריים מוערכים. Next Gen Seq (Exome Seq, RNA Seq ו SNP מערך) ניצול סמנים חזוי פוטנציאליים לגלותed המסייעים בבחירת חולים שעשויים להפיק תועלת מטיפול מסוים.
מטרות העל של שימוש במודלי PDTX הן: 1) להעריך את היעילות של טיפולים חדשניים כסוכן יחיד או בשילוב ו -2) לזהות סמנים חזויים של רגישות או התנגדות לפני למחקר קליני. בכתב היד הזה, אנו מספקים את המתודולוגיה בייזום ואחזקה של בנק CRC PDTX ולספק את היתרונות והמגבלות של מודל זה גילוי ופיתוח תרופות.
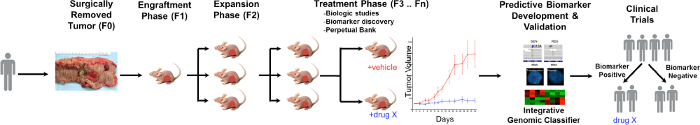
סקירה כללית באיור 1. לפרוטוקול דגם CRC PDTX. גידול נגזר חולה מתקבלת מניתוח והזריק מייד לעכברים בעירום athymic תת עורי. לאחר הגידול גדל היא מורחבת לתוך הדורות הבאים, ובסופו של דבר הרחיב ללימודי טיפול. respo טיפולnses מוערך וביומרקרים חזויים מזוהים שעשויים לסייע בבחירה חולה. אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
Protocol
משפט ואתיקה: דגימות גידול אדנוקרצינומה גס נגזרות חולה התקבלו בהסכמה חולה באונ' קולורדו החולים בהתאם לפרוטוקול שאושר על ידי דירקטוריון הסקירה המוסדי מרובה קולורדו (08-0439). כל עבודת החיה בוצעה תחת פרוטוקולי חיה אושרו על ידי האוניברסיטה של טיפול בבעלי החיים המוסדי קולורדו בדנוור ועדת שימוש (IACUC, פרוטוקול # 51,412 (06) 1E ו 96,813 (04) 1E).
קבלת 1. הכנת דם החולה
- אסוף 1 - 2 מיליליטר של דם בתוך שפופרת הפרדת דם / תא המכילה נתרן ציטרט (שלבי צינור נכלל פלזמה, לימפוציטים להקה מונוציטים, נוזל שיפוע צפיפות, מחסום ג'ל, אריתרוציטים ו נויטרופילים). זהירות, פעל בהתאם להנחיות פתוגן שמקורו בדם עם דם או רקמות.
הערה: PBMCs ופלזמה יוכל לשמש למחקרים עתידיים שעשויים לכלול: השוואת שונות גנטית germline עם מוטציות הגידול, לבודד circulaתאים סרטניים טינג, הערכת DNA חופשי התא (cfDNA), חלבונים לבחון מיקרו-רנ"א, וכו. - צנטריפוגה צינור הפרדת הדם / תא ב 2500 XG במשך 15 דקות ללא בלם ב RT.
- איסוף תאים דם היקפיים mononuclear (PBMCs ב לימפוציטים הלהקה מונוציטים של הצינור) ולשים לתוך צינור 1.5 מ"ל microcentrifuge (ברור, autoclavable, DNase, RNase, ו pyrogen חינם), ולמלא את החלק העליון של הצינור עם שנאגרו פוספט סטרילי מלוח (PBS).
- צנטריפוגה ב 2,300 XG 3 דקות ב RT כדי צורה כדורית של PBMCs בתחתית של התחתית. בשלב הבא, להסיר את supernatant בזהירות. הוסף 1 מ"ל של סטרילית PBS כדי לשטוף את הכדור צנטריפוגות ב 3,000 XG במשך 30 שניות ולאחר מכן להסיר supernatant.
- השתמש פיפטה לאסוף פלזמה מהצינור ההפרדה דם / תא (בשלב פלזמה של שפופרת) בבקבוקון קריוגני 1.5 מ"ל סטרילי (DNase ו RNase בחינם, ללא דנ"א אנושי, רעלן פנימי חינם) וקבע פלזמה גלולה של PMBC של לתוך -80 ° C וreezer לאחסון.
קבלת 2. הכנת מדגם גידול חולה
- כן או RPMI או DMEM תקשורת עם 1: 100 (10%) של פניצילין-סטרפטומיצין שאינו חיוניות חומצות אמינו, 1: 1000 (1%) Plasmocin, ו -10% בסרום שור העוברי מומת (מדיה מלאה) ולהוסיף 20 - 25 מיליליטר לכוס אוסף סטרילי עבור דגימת הגידול.
- תחזור מדגם גידול בתוך כוס סטרילית המכילה מדיה מלאה על קרח או לשמור על 4 מעלות צלזיוס.
הערה: מדגם הגידול הוא חתיכת רקמת גידול מטופלת עודפת הוסרה על ידי מנתח, מעובדת על ידי פתולוג, והניח לתוך כוס אוסף סטרילי עם מדיה מלאה. זהירות, פעל בהתאם להנחיות פתוגן שמקורו בדם עם דם או רקמות. כמו כן, רצוי להזריק חמישה עכברים, הגידול צריך להיות כ 1 cm³. - להביא את מדגם הגידול למתקן החיה להזרקה לעכברים בעלי דיכוי חיסוני.
הערה: עדיף לעבד מדגם הגידול בהקדם האפשרי.- במנדף זרימה למינרית, מניח את מדגם הגידול לתוך צלחת חיתוך פלסטיק סטרילי מגביע הגידול. השתמש במספרי autoclaved-קטנים מלקחיים לחתוך לתוך 10 - 12 כ חתיכות 3 x 3 x 3 מ"מימ ומניחים לתוך צינור 1.5 autoclaved מיליליטר microcentrifuge מלא 300 μl של פתרון תערובת חלבונים דביק. שמור צינור על הקרח.
- כעדיפות להזריק גידול לעכברים, אבל אם יש כל גידול שנשאר, לאסוף בקבוקונים קפוא פלאש (FF), מוטבע פרפין קבוע פורמלין (FFPE) כוסות, בקבוקון גידול קיימא.
- עבור FF, לאסוף חתיכות קטנות של רקמות גידול מבקבוקון קריוגני סטרילית לניתוח נוסף כגון חלבון, RNA, או בידוד DNA. מניחים FF מיד לתוך דיואר חנקן נוזלי ולאחסן לטווח ארוך בתוך מקפיא -80 מעלות צלזיוס.
- לקבלת FFPE, אם יש מספיק גידול, מקום 3 חתיכות קטנות לתוך 10 מיליליטר 10% פורמלין כוס ותהליך לגושי פרפין מוטבעים פעם גידול כבר בפורמלין לפחות 24 שעות.
הערה: 24 hr מבוססאת הצעות Core היסטולוגיה שלנו 11. - לבסוף, להציב החלק הנותר של הגידול לתוך צינור קריוגני. הפוך מדיה קיימא על ידי הוספת 10% דימתיל sulfoxide (DMSO) כדי להשלים התקשורת. לאחר מכן, הוסף 1 מ"ל לצינור קריוגני ולאחסן על הקרח. הערה: אל תשמור על קרח למשך פרקי זמן ארוכים.
- חותכים כל גידול שאריות לחתיכות קטנות כי באופן אידיאלי יהיה מספיק עבור 10 גידולים להיות מוזרק לתוך 5 עכברים בעתיד. ואז, במקום צינור גידול הקיימא על קרח עד זה ניתן להציב לתוך מיכל הקפאת אלכוהול איזופרופיל (לאט מקפיא את C ° 1 גידול בכל פעם) והכניס מקפיא -80 מעלות צלזיוס על מנת להבטיח כי הגידולים לא למות במהלך תהליך ההקפאה.
הערה: האחסון לטווח ארוך הגידולים מוסרים (לאחר 2 - 3 ימים) והניחו לתוך חנקן נוזל דיואר גדול. שימו לב: צינורות קיימא לא צריך להיות מותר להפשיר אלא אם כן הוא נלקח החוצה להזריק לעכברים.
- חותכים כל גידול שאריות לחתיכות קטנות כי באופן אידיאלי יהיה מספיק עבור 10 גידולים להיות מוזרק לתוך 5 עכברים בעתיד. ואז, במקום צינור גידול הקיימא על קרח עד זה ניתן להציב לתוך מיכל הקפאת אלכוהול איזופרופיל (לאט מקפיא את C ° 1 גידול בכל פעם) והכניס מקפיא -80 מעלות צלזיוס על מנת להבטיח כי הגידולים לא למות במהלך תהליך ההקפאה.
3.הזרקה של xenografts הגידול נגזר החולה
- השתמש five 6 - זכר 8 שבוע ישן ו / או עכברים בעירום athymic נקבה (T-cell הלקוי) עבור כל גידול נגזר חולה נפרד. להזריק סך של 10 גידולים (2 זריקות לכל עכבר) תת עורי (SQ).
הערה: הגידול האנושי המקורי הוא יועד F0 ולאחר מכן פעם הזריקו לעכברים הדור הבא הוא F1. כמו כן, להשתמש במלקחיים autoclaved, מספריים, ואת trocars לכל explant ייחודי. - חתיכות טענו של גידול מפתרון תערובת חלבונים הדביק לתוך trocars autoclaved 12 G ולהבטיח שהגידול נדחף לגמרי לתוך הנקז.
- במנדף זרימה למינרית סטרילי, מקום 5 עכברים לתוך תיבת הרדמה מחוברת למכונת הרדמת Isoflurane (התחילה בשיעור הראשוני של 5% Isoflurane, 3 - 4% חמצן, ו 2 - 3% Isoflurane לצורך התחזוקה של הרדמה) ולסנן פחם (סופג גז עודף).
הערה: טכנאי מנוסה אמור להיות מסוגל לבצע את ההליך כולו עלכלוב של 5 עכברים בתוך סה"כ 5 דקות בערך (בערך 30 שניות לכל עכבר). לכן תמיכת תרמית נוספת ושימון עין אינה משמשים בדרך כלל. עבור אנשים מנוסים פחות או אימון, מומלץ מאוד כי אנשים או לבצע את ההליך על חיות פחות בבת אחת ו / או להשתמש סיכת עין כרית חימום / במהלך הליך אם חיות תהיינה מורדמות יותר מ -5 דקות. נוהל מבוססת על סטנדרטים IACUC באוניברסיטה שלנו.
- במנדף זרימה למינרית סטרילי, מקום 5 עכברים לתוך תיבת הרדמה מחוברת למכונת הרדמת Isoflurane (התחילה בשיעור הראשוני של 5% Isoflurane, 3 - 4% חמצן, ו 2 - 3% Isoflurane לצורך התחזוקה של הרדמה) ולסנן פחם (סופג גז עודף).
- קמצוץ בוהן בעכבר כדי להבטיח את העכבר כבר לא מגיב, ואז לקחת את העכבר מקופסא Isoflurane. מניחים את העכבר על שדה נקי להזריק גידולים על באזור הצוואר הגב באמצע החלקת נקז למטה מתחת לעור, עד שהאזור האגף הוא הגיע עם 12 trocars G autoclaved.
- Deliver תת עורית אחת גידול בכל צד של כסל העכבר. לצבוט את הגידול כאשר הנקז הוא שלף, על מנת להבטיח כי הגידול נשאר באזור האגף הרצוי. ג 'נרל אלקטריקתערובת חלבונים latinous מתקשה עם טמפרטורת הגוף של העכבר מתמצת את הגידול כ 1 בשבוע כדי לעזור הגידול לגדול לאבטח אותו אל הרקמה החיבורית SQ. הנגע שבצע הנקז אינו עולה על 4 מ"מ ואין צורך לסגור את העור עם סיכות.
הערה: הווטרינרים שלנו נקבעו לא סגר צורך בהתבסס על גודל קטן מאוד של הנגע, זמן החלמה מהיר (באזור הצוואר גב באמצע מפחית את מתח עור או טיפוח של נגע), אין זיהומים ציינו, ומעקב צמוד של החיות במהלך פרק זמן זה .
- Deliver תת עורית אחת גידול בכל צד של כסל העכבר. לצבוט את הגידול כאשר הנקז הוא שלף, על מנת להבטיח כי הגידול נשאר באזור האגף הרצוי. ג 'נרל אלקטריקתערובת חלבונים latinous מתקשה עם טמפרטורת הגוף של העכבר מתמצת את הגידול כ 1 בשבוע כדי לעזור הגידול לגדול לאבטח אותו אל הרקמה החיבורית SQ. הנגע שבצע הנקז אינו עולה על 4 מ"מ ואין צורך לסגור את העור עם סיכות.
- לפני העכבר הוא 2 Meloxicam להזריק ער לחלוטין מ"ג / ק"ג SQ (משככי כאבים) הרחק ההזרקה הגידול. הבא, במקום את העכבר אל תוך הכלוב לפקח עד שהעכבר הוא ער ומרגש.
הערה: אל תשאירו מחל חיות ללא השגחה עד ער לחלוטין. המינון meloxicam מבוססת על סטנדרטים IACUC באוניברסיטה שלנו.- לאחר מכן, לחזור על אותו התהליך עם 4הנותרים עכברים לפקח הנשימה שלהם.
הערה: שימו לב שמדובר בהליך מהיר מאוד ועכברים להתעורר בקרוב מאוד לאחר ההזרקה Meloxicam, אבל להתאים Isoflurane לפי הצורך. בכל פעם עכבר נלקח החוצה, להנמיך את Isoflurane. Meloxicam תימשך 24 שעות ואת הנגעים מן trocars לא יחלימו לגמרי ב 1 בשבוע.
- לאחר מכן, לחזור על אותו התהליך עם 4הנותרים עכברים לפקח הנשימה שלהם.
4. תחזוקה של בנק xenograft גידול החולה נגזר
- צג גדילה של עכברים לפחות פעם בשבוע. השתמש גיליון אלקטרוני (או מערכת מעקב אחר) כדי לעקוב אחר גדלים גידולים, דור הגידול, מועד הזרקת הגידול, והבריאות של עכברים.
הערה: אם עכברים אבדו 15% ממשקל הגוף המקורי שלהם, ציוני מצב גוף נמוכים (≥ 2), יש כיבים סרטניים, גידולים לכת 2,000 מ"מ 3 או גידולים הכוללים 3,000 מ"מ 3, או חולניים (כפוף, קרה, עייפות, וכו .) בכל דרך, עכברים מומתים באמצעות CO₂ או בהרדמה ואחריו נקע בצוואר הרחם כמושיטת econdary. להרדים באמצעות הרדמה ו נקע בצוואר הרחם אם איסוף הגידול, אחרת עכברים מומתים באמצעות CO₂ ו נקע בצוואר הרחם. - כאשר הגידול הוא כ 1,500-2,000 מ"מ 3 להרדים את העכברים כמתואר לעיל ולאחר מכן לבצע פריקה צוואר הרחם כדי להרדים.
- בדוק את העכבר אין דופק. ובלו גידול SQ עם מספרי מלקחי autoclaved.
הערה: אפשר גידולים לגדול עד 1 שנה ואם לא גידול נתפס אז להרדים את העכברים באמצעות CO 2, ואחריו נקע בצוואר רחם כשיטה משנית. - מעבר הגידול גדל הטוב ביותר לתוך הדור הבא (aka סט חדש של 5 עכברים). השתמש הוראות לעיל כדי לאסוף 10 - 12 גידולים עקב הפטירה ולאחר מכן לאסוף את גידול השאריות כמו גם שתוארו לעיל.
הערה: איסוף צינורות רבים קיימא חשוב מאוד הדורות הראשונים (F1 - F8); ולכן לאסוף כמה צינורות קיימא, צינורות FF, ו -1 FFPE לכל generatיוֹן. - שמור על העכברים שנותרו עד דור חדש של עכברים יש צמיחת גידול של כ 300 מ"מ 3. כאשר עכברים הנותרים יש גידולים כי הם גדולים, ממשיכים לאסוף כמתואר לעיל.
- בדוק את העכבר אין דופק. ובלו גידול SQ עם מספרי מלקחי autoclaved.
- המשך לגידולים מעבר ולאסוף בכל שלב עד F15. בשלב זה, לקחת את רכבת תחתית קיימא של הדור המוקדם ביותר האפשרי מתוך חנקן נוזלי ולתת הפשרה על קרח ופעל נהלי הזרקת גידול שתוארו לעיל.
הערה: גידולים הגדלים משפופרות קיימא להימשך זמן רב יותר כדי לגדול בעכברים לעומת עובר מדור לדור, כדי לשמור את זה בחשבון בעת תכנון. אם מודל PDTX מסוים כבר לא היה צריך בכל מעבר, להרדים ולאסוף גידול, על מנת להבטיח צינורות קיימא רבים נאספים לשימוש עתידי.
5. התפתחותית Therapeutics עם xenografts הגידול נגזר החולה
הערה: רוב הגידולים על דור F3 יש קינטיקה צמיחה טובה (לגדול מהר ושיתוף יותרnsistent), ולכן, המשך PDTX מחקרים יעילות התרופה.
- כאשר הגידול הרצוי הוא גדול מאוד (1,500 - 2,000 מ"מ 3), בצע את תהליך מתואר לעיל כדי לאסוף גידול להתרחב כמות רצויה של עכברים.
- בהתאם להשערה נבדקת לקבוע את מספר הגידולים הצורכים לכל קבוצת טיפול.
הערה: 1 מיליליטר של תמיסת תערובת חלבונים דביקה יכולות כ בכושר 30 חתיכות גידול קטנות (תלוי מורפולוגיה גידול) להזרקה לעכברים.
- בהתאם להשערה נבדקת לקבוע את מספר הגידולים הצורכים לכל קבוצת טיפול.
- בדוק עכברים עם גידולים שבועיים וכאשר רוב הגידולים הם קטנים בעליל (כ בין 50 - 300 mm³) למדוד את הגידולים עם מחוגה כדי לקבוע את נפח הגידול. נפח גידול = [width² (המדידה הקטנה ביותר) אורך x (מדידה גדולה)] x 0.52.
הערה: פתרון תערובת חלבונים הדביק המקיף את חתיכות גידול המוזרקות למשך שבוע, ואז אחרי צמיחת גידול של שבוע תהיה מדויקת. - השתמש כרכי גידול של בין 50 - 300 mm³ ואתn ממוצע שמאל וגידולים תקינים. ואז באקראי לקבוצות טיפול עם 10 גידולים לכל קבוצה, ובהשוואה לממוצע קבוצה בתוך כמה מספרים של אחד את השני. לאחר מכן, למיין את העכברים לקבוצות ולהתחיל במחקר הטיפול הרצוי.
- מנת העכברים עם תרופה (לוח זמנים תלוי סמים), לשקול ולמדוד (גידולים) פעמים בשבוע. בסוף המחקר, להרדים עכברים באמצעות הרדמה ו נקע בצוואר הרחם ולאסוף הגידול לניתוח pharmacodynamic בעתיד במעבדה.
הערה: המחקר נמשך 30 ימים, תלוי בגודל גידול רכב ובריאות של עכברים.
6. ארגון של בנק PDTX
- שמור טופס מתועד היטב כדי למנוע חזרה של מחקר שימוש הולם של חיות.
הערה: זהו מפתח בנק PDTX מוצלח.- השתמש בגיליונות אלקטרוניים כדי לעקוב אחר גידול מהחולה האנושי במרפאה, לעכברים בבנק PDTX, טיפולים, נתונים, ומה נאסף. הערה: זה כולל במקפיא, Dewars חנקן נוזליוכן, ואחסון FFPE.
תוצאות
הדמיון של מוטציות נפוצות במודלים CRC PDTX ואת TCGA
חקרנו אם אחוז המוטציות השכיחות (KRAS, NRAS, BRAF, PIK3CA, APC, CTNNB1 ו TP53) בבנק CRC PDTX היה נציג לתדר המוטציה לראות באוכלוסיית חולי CRC. כפי שניתן לראות
Discussion
פלטפורמת גילוי תרופות PDTX מציעה מודל משופר לחסרונות של במודלים פרה אחרים כי הם אמינים בחיזוי עשייה קלינית של תרכובות חדשות. חשוב לציין, גידולים במודל זה מהבחינה ביולוגית יציבים, שומר על פוטנציאל גרורתי, ולהציג היענות תרופה דומה מדור לדור. במודל זה, גידולים שמקורם בחול...
Disclosures
The authors have nothing to disclose.
Acknowledgements
This work was supported by grant 1R01CA152303-01.
Materials
| Name | Company | Catalog Number | Comments |
| RPMI or DMEM | Corning | 10-040-CV | |
| Penicillin-Streptomycin | Corning | 30-002-CI | |
| Non-essential Amino Acids | Corning | 25-025-CI | |
| Fetal Bovine Serum | Corning | 35-010-CV | Thaw in -4 °C, then activate for 30 min at 60 °C water bath |
| CPT blood tube | BD vacutainer | 362761 | |
| Microcentrifuge tube | Surelock | A-7002 | |
| Phosphate-Buffered Saline | Corning | 21-040-CV | |
| Cyrogenic vials | Cyroking | C0732901 | |
| Plastic tumor cutting dish | Trueline | TR4001 | |
| Scissors | Roboz | RS-5881 | |
| Forceps | Roboz | RS-5135 | |
| Matrigel (gelatinous protein mixture) | Corning | 354234 | Store at -20 or -80 °C, then thaw on ice, do not leave at RT |
| 10% Formalin cups | Protocol | 032-059 | |
| Liquid Nitrogen Dewar Storage | Thermolyne | CY50900 | |
| Portable liquid nitrogen dewar | Nalgene | 4150-2000 | |
| Dimethyl Sulfoxide | Fischer | 67-68-5 | |
| Freezing container: Mr Frosty | Nalgene | 5100-0001 | |
| Isopropyl Alcohol | Decon | 64-17-5 | |
| Trocars | Innovative Research of America | MP-182 | |
| Anesthesia machine | Patterson Veterinary | ||
| Anesthesia box | Patterson Veterinary | ||
| Isoflurane | Vet one | 1038005 | |
| F-Air Canister | Bickford Omnicon | 80120 | |
| Meloxicam | Vet one | 5182-90C | |
| Calipers | Fowler | 54-100-167 | |
| Weight scale | Ohaus | Scout Pro SP601 |
References
- Siegel, R. L., Miller, K. D., Jemal, A. Cancer statistics. 2015. CA Cancer J Clin. 65 (1), 5-29 (2015).
- . Comprehensive molecular characterization of human colon and rectal cancer. Nature. 487 (7407), 330-337 (2012).
- Arcaroli, J. J., et al. Tumours with elevated levels of the Notch and Wnt pathways exhibit efficacy to PF-03084014, a gamma-secretase inhibitor, in a preclinical colorectal explant model. Br J Cancer. 109 (3), 667-675 (2013).
- Hubbard, J., Grothey, A. Antiangiogenesis agents in colorectal cancer. Curr Opin Oncol. 22 (4), 374-380 (2010).
- van Es, J. H., et al. Notch/gamma-secretase inhibition turns proliferative cells in intestinal crypts and adenomas into goblet cells. Nature. 435 (7044), 959-963 (2005).
- Cassidy, J. W., Caldas, C., Bruna, A. Maintaining Tumor Heterogeneity in Patient-Derived Tumor Xenografts. Cancer Res. 75 (15), 2963-2968 (2015).
- Jin, K., et al. Patient-derived human tumour tissue xenografts in immunodeficient mice: a systematic review. Clin Transl Oncol. 12 (7), 473-480 (2010).
- Julien, S., et al. Characterization of a large panel of patient-derived tumor xenografts representing the clinical heterogeneity of human colorectal cancer. Clin Cancer Res. 18 (19), 5314-5328 (2012).
- Siolas, D., Hannon, G. J. Patient-derived tumor xenografts: transforming clinical samples into mouse models. Cancer Res. 73 (17), 5315-5319 (2013).
- Tentler, J. J., et al. Patient-derived tumour xenografts as models for oncology drug development. Nat Rev Clin Oncol. 9 (6), 338-350 (2012).
- Carson, F. L. . Histotechnology: A Self-Assessment Workbook. , (1996).
- Arcaroli, J. J., et al. Common PIK3CA mutants and a novel 3' UTR mutation are associated with increased sensitivity to saracatinib. Clin Cancer Res. 18 (9), 2704-2714 (2012).
- Arcaroli, J. J., et al. A NOTCH1 gene copy number gain is a prognostic indicator of worse survival and a predictive biomarker to a Notch1 targeting antibody in colorectal cancer. Int J Cancer. 138 (1), 195-205 (2016).
- Arcaroli, J. J., et al. Gene array and fluorescence in situ hybridization biomarkers of activity of saracatinib (AZD0530), a Src inhibitor, in a preclinical model of colorectal cancer. Clin Cancer Res. 16 (16), 4165-4177 (2010).
- Lieu, C. H., et al. Antitumor activity of a potent MEK inhibitor, TAK-733, against colorectal cancer cell lines and patient derived xenografts. Oncotarget. 6 (33), 34561-34572 (2015).
- Pitts, T. M., et al. Association of the epithelial-to-mesenchymal transition phenotype with responsiveness to the p21-activated kinase inhibitor, PF-3758309, in colon cancer models. Front Pharmacol. 4, 35 (2013).
- Song, E. K., et al. Potent antitumor activity of cabozantinib, a c-MET and VEGFR2 inhibitor, in a colorectal cancer patient-derived tumor explant model. Int J Cancer. 136 (8), 1967-1975 (2015).
- Tentler, J. J., et al. Identification of predictive markers of response to the MEK1/2 inhibitor selumetinib (AZD6244) in K-ras-mutated colorectal cancer. Mol Cancer Ther. 9 (12), 3351-3362 (2010).
- Bardelli, A., et al. Amplification of the MET receptor drives resistance to anti-EGFR therapies in colorectal cancer. Cancer Discov. 3 (6), 658-673 (2013).
- Bertotti, A., et al. A molecularly annotated platform of patient-derived xenografts ("xenopatients") identifies HER2 as an effective therapeutic target in cetuximab-resistant colorectal cancer. Cancer Discov. 1 (6), 508-523 (2011).
- Davis, S. L., et al. Combined inhibition of MEK and Aurora A kinase in KRAS/PIK3CA double-mutant colorectal cancer models. Front Pharmacol. 6, 120 (2015).
- Morelli, M. P., et al. Preclinical activity of the rational combination of selumetinib (AZD6244) in combination with vorinostat in KRAS-mutant colorectal cancer models. Clin Cancer Res. 18 (4), 1051-1062 (2012).
- Pitts, T. M., et al. Dual pharmacological targeting of the MAP kinase and PI3K/mTOR pathway in preclinical models of colorectal cancer. PLoS One. 9 (11), e113037 (2014).
- Spreafico, A., et al. Rational combination of a MEK inhibitor, selumetinib, and the Wnt/calcium pathway modulator, cyclosporin A, in preclinical models of colorectal cancer. Clin Cancer Res. 19 (15), 4149-4162 (2013).
- Arcaroli, J. J., et al. ALDH+ tumor-initiating cells exhibiting gain in NOTCH1 gene copy number have enhanced regrowth sensitivity to a gamma-secretase inhibitor and irinotecan in colorectal cancer. Mol Oncol. 6 (3), 370-381 (2012).
- Hoey, T., et al. DLL4 blockade inhibits tumor growth and reduces tumor-initiating cell frequency. Cell Stem Cell. 5 (2), 168-177 (2009).
- Ikebuchi, F., et al. Dissociation of c-Met phosphotyrosine sites in human cells in response to mouse hepatocyte growth factor but not human hepatocyte growth factor: the possible roles of different amino acids in different species. Cell Biochem Funct. 31 (4), 298-304 (2013).
- Zhang, Y. W., et al. Enhanced growth of human met-expressing xenografts in a new strain of immunocompromised mice transgenic for human hepatocyte growth factor/scatter factor. Oncogene. 24 (1), 101-106 (2005).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved