Method Article
Montaje entero horizontal: un nuevo protocolo de procesamiento e imágenes para tejidos gruesos y tridimensionales Secciones transversales de la piel
En este artículo
Resumen
Este trabajo presenta un nuevo protocolo de procesamiento e imagen para el análisis transversal transversal de tejido tridimensional denso que permite la plena explotación de las modalidades de imagen confocal. Este protocolo preserva la antigenicidad y representa un sistema robusto para analizar la histología de la piel y potencialmente otros tipos de tejidos.
Resumen
Procesar un tejido de interés para generar una imagen microscópica que apoye un argumento científico puede ser un desafío. La adquisición de imágenes microscópicas de alta calidad no depende enteramente de la calidad del microscopio, sino también de los métodos de procesamiento de tejidos, que a menudo implican múltiples acciones o pasos críticos. Además, los tipos de células mesenquimales en la piel y otros tejidos representan un nuevo desafío para la preparación de tejidos y la formación de imágenes. Aquí, presentamos un proceso completo, desde la cosecha de tejidos hasta la microscopía. Nuestra técnica, llamada "montaje horizontal completo", es una que los principiantes pueden convertirse rápidamente en competentes y que permite la preservación y detección de antígenos en secciones de 60-300 μm de grosor cortadas con un criostato. Secciones de este espesor proporcionan una mejor visualización de la microarquitectura de tejidos en un entorno tridimensional. Además, el protocolo preserva las células mesenquimales de una manera que mejora la calidad de imagen cuandoEn comparación con las secciones estándar de criostato o parafina, aumentando con ello la eficacia y fiabilidad de la inmunotinción. Creemos que este protocolo beneficiará a todos los laboratorios que visualizan la piel, y posiblemente otros tejidos y órganos.
Introducción
La revolución del equipo de imágenes microscópicas proporciona sofisticados instrumentos de imágenes de alta resolución. Sin embargo, al adquirir una imagen microscópica de una sección transversal de tejido tridimensional (3D) completa, la preparación de la muestra presenta desafíos considerables y puede ser el factor limitante para definir la calidad de la imagen. Cada paso por separado merece una consideración cuidadosa a fin de preservar la morfología del tejido y la antigenicidad de las proteínas diana, minimizar los artefactos inducidos por el proceso y maximizar la calidad de la imagen final. Por ejemplo, el análisis tradicional de la piel requiere una imagen con una vista de la epidermis y la dermis, con folículos pilosos que están adecuadamente orientados, lo que permite el análisis anatómico de las contribuciones del compartimiento de células madre a la homeostasis de la piel 1 , 2 . Esto requiere una concentración profunda en cómo la piel se incrusta y secciona. Es importante destacar que los folículos pilosos pueden ser más gruesosDe 100 μm, lo que supera en gran medida el grosor estándar de la parafina o de la sección congelada, lo que resulta en un nivel de análisis más bajo comparado con montajes enteros o secciones transversales gruesas 3 , 4 , 5 .
Tomados en conjunto, cada paso de la preparación del espécimen para el análisis microscópico es un determinante crítico que afectará al análisis de la imagen. Aquí, se presenta un nuevo protocolo de procesamiento para el análisis de sección transversal de tejido grueso, 3D, que denominamos "soporte horizontal completo". El protocolo conserva altamente la antigenicidad y permite la explotación completa de secciones gruesas de la piel usando el equipo confocal estándar de la proyección de imagen. Esta es una guía completa para el uso de la piel para el procesamiento de cortes transversales de tejidos gruesos y la obtención de imágenes, incluyendo la cosecha de tejidos y la criopreservación con paraformaldehído (etapa 1), la generación de secciones transversales de tejidos de 100 μm con un criostato 2), Y marcado y montaje inmunofluorescentes (etapas 3 y 4). Los resultados representativos comparan imágenes confocales de dos técnicas distintas de preparación histológica: criosección clásica y corte transversal grueso de tejido 3D, resaltando las ventajas de los "montajes horizontales enteros" para el usuario potencial de este protocolo.
Protocolo
Todos los experimentos con animales estaban sujetos a la aprobación ética local y se realizaban bajo los términos de una licencia del Ministerio del Interior del Reino Unido.
1. Cosecha de la piel y crioconservación
- Preparativos.
- Preparar un plato de cultivo de 100 mm con 25 ml de PFA al 4% y dos placas de cultivo de 100 mm con 25 ml de solución salina tamponada con fosfato 1x (PBS).
- Llenar los criomoldos rectangulares despegables por dos tercios con el compuesto óptimo de temperatura de corte (OCT).
- Coloque una placa de metal, en la que los cryoblocks se puede colocar en un paso posterior, en el congelador de -80 ° C.
- Cosecha de piel, fijación y crioconservación.
- Clip de la región dorsal del cadáver de animales con una máquina de afeitar eléctrica seca.
NOTA: En este ejemplo, se usaron ratones wildtype del día 21 postnatal. - Cosecha las áreas de interés en la piel.
NOTA: La región dorsomedial de la piel del ratón ( - Recortar la piel cosechada en piezas rectangulares de tamaño adecuado para encajar en la parte inferior de la cryomold, teniendo en cuenta el crecimiento direccional del grano del folículo piloso.
NOTA: Las rebanadas de piel más pequeñas pueden ser más fáciles de manejar para los principiantes, ya que tienen menos probabilidades de enredarse durante el proceso de incubación y montaje. El ejemplo que se muestra aquí es un ~ 1 cm 2 área de la piel dorsal, que encaja en un 22 x 30 x 20 mm criomolde (Figura 2a). - Fijar la piel a temperatura ambiente en 25 mL de PFA al 4% durante 10-30 min, dependiendo del grosor de las muestras de piel ( Figura 1b ).
- Lavar las muestras de piel dos veces en 25 ml de PBSDurante al menos 5 min cada uno ( Figura 1b ).
- Dab las muestras de piel en una toalla de papel para drenar cuidadosamente el tejido de exceso de PBS, que puede dar lugar a la cristalización durante el proceso de congelación y puede afectar a cryosectioning resultados.
NOTA: No se requiere un gradiente estándar de sacarosa. Sin embargo, esto también se puede incorporar en el protocolo a discreción del usuario. - Tenga en cuenta la orientación de los folículos pilosos para cada muestra de piel. Utilice un microscopio de disección para la asistencia visual (especialmente cualquier persona que realice el protocolo por primera vez). Insertar la muestra de piel en el criomold lleno de OCT y equilibrar todas las áreas de la piel con OCT eliminando cualquier burbuja de aire adherida a la superficie del cabello recortado usando pinzas ( Figuras 2a y 2b ).
- Empuje la piel hasta la parte inferior del bloque lleno de OCT para que quede al ras con el fondo.
NOTA: La piel puede orientarse en cualquier dirección,Mientras que el grano del folículo del pelo se observa para los procedimientos apropiados del corte. Los criomoldos serán reorientados cuando los bloques se unan al criostato para la criosección. Marque la orientación del folículo piloso en el criomolde, ya que este paso determina la posterior orientación del corte del criostato. - Transfiera los cryoblocks a la placa de metal en el congelador de -80 ° C para evitar la flotación y la dislocación del tejido.
- Monitorear el proceso de congelación para mantener la orientación de la piel en la parte inferior del criomolde, ya que las burbujas de aire no vistas pueden hacer que la piel suba a la superficie del criomolde.
NOTA: Los Cryomolds con tejido congelado pueden ser almacenados por más de un año a -80 ° C y pueden ser reutilizados para secciones adicionales.
- Clip de la región dorsal del cadáver de animales con una máquina de afeitar eléctrica seca.
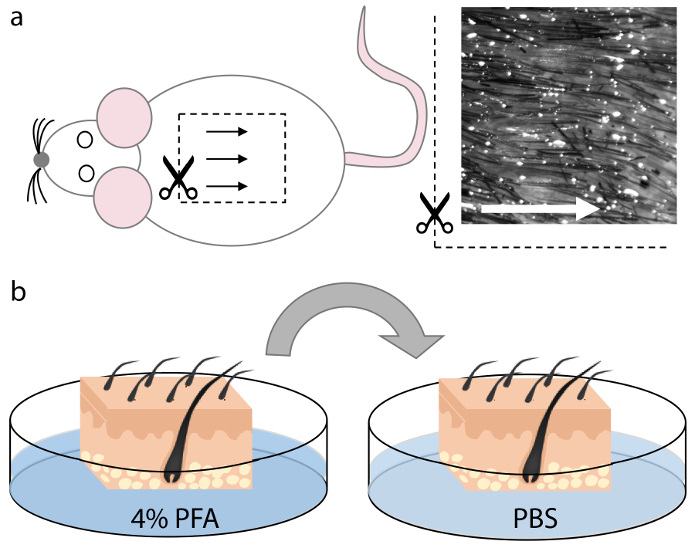
Figura 1. Cosecha y fijación de la piel del ratón.
(A) el tejido de la piel se recogió de la región dorsomedial del cadáver animal. Los folículos pilosos en esta región están uniformemente espaciados y alineados y por lo tanto permiten una orientación óptima durante la sección, como se indica mediante las flechas. ( B ) Después de cortar cuadrados de un tamaño apropiado que encaja en el criomolde, el tejido de la piel se fijó en PFA al 4% durante 15 minutos y se lavó dos veces en PBS durante 5 min cada uno. Haga clic aquí para ver una versión más grande de esta figura.
2. Sección transversal del tejido grueso
- Preparación y orientación de los tejidos para montar en el criostato.
- Preparar un plato de cultivo de 100 mm con 15 ml de PBS. Colóquelo en una zona de fácil acceso en el criostato. Además, preparar una placa de 12 pocillos con 2,5 ml de PBS por pocillo; De acuerdo con las muestras para el almacenamiento a largo plazoCiones a 4 ° C. Utilice fórceps para manejar las secciones.
- Ajustar la temperatura del criostato a -20 ° C.
NOTA: La temperatura puede afectar a la sección, pero una buena guía es comenzar a -20 ° C. - Para obtener secciones de aproximadamente dos folículos pilosos de espesor, ajustar el criostato para cortar secciones de 150 μ m de espesor.
NOTA: El espesor de la sección puede variarse, dependiendo de las necesidades del usuario y de las limitaciones del microscopio que se utilizará para el análisis.
NOTA: La orientación de la muestra es crítica para obtener secciones de piel con folículos pilosos en la orientación apropiada. Esto se consigue montando correctamente en el bloque criostato. Asegúrese de que el plano de sección es paralelo a la orientación del folículo piloso ( Figura 2c ). Como se ha mencionado anteriormente, la orientación correcta del plano de sección en la muestra de piel es un paso crucial para determinar la calidad de las imágenes que se adquirirán enUn paso posterior.

Figura 2. Incrustación, crioconservación y seccionamiento.
(A) La marcación de la dirección del folículo piloso (HF) en el criomolde, indicada por las flechas negras, es importante para la correcta orientación durante la criosección. ( B ) El plano de sección tiene que estar alineado con la orientación del folículo capilar para generar secciones en las que la longitud completa de los folículos pilosos permanece intacta ( c ) Se cortaron secciones según la orientación del folículo piloso indicada por las flechas negras en el Cryomold ( D ) Las secciones transversales de tejido grueso se recogieron con fórceps metálicos y ( e ) se transfirieron a una placa de cultivo de 100 mm que contenía 1x PBS. ( F ) A temperatura ambiente, el PBS disuelve el OC.T. Compuesto que rodea las secciones transversales de tejido grueso, como se indica por las flechas blancas. Las secciones luego flotan libremente en el PBS. Haga clic aquí para ver una versión más grande de esta figura.
- Cryosectioning.
- Corte una sección usando el criostato. Utilice un fórceps para recoger el OCT que contiene la pieza incrustada de la piel ( Figura 2d ).
NOTA: Utilice un criostato que permita un movimiento y ajuste independientes a lo largo de los ejes X, Y y Z para un posicionamiento óptimo de la muestra. Esto permite la generación de secciones transversales de tejido idealmente alineadas. - Transfiera la sección del criostato a la placa de cultivo de 100 mm llena de PBS y continúe con la siguiente porción. No recoja las muestras en una diapositiva ( Figura 2e ).
NOTA: A temperatura ambiente, el PBS se disolveráLa OCT, dejando rebanadas de piel que son fáciles de manejar con fórceps ( Figura 2f ).
NOTA: Se puede necesitar PBS fresco en el plato de cultivo de 100 mm después de disolver muchas secciones de tejido de 100 μm de grosor y se puede cambiar en consecuencia. - Utilice fórceps para transferir las secciones de piel flotante al pocillo marcado correctamente en una placa de 12 pocillos llena de 2,5 ml de PBS ( Figura 3a , izquierda).
NOTA: A 4 ° C, las muestras pueden almacenarse durante al menos dos días. Para el almacenamiento a largo plazo de los bloques OCT que contienen la piel después de seccionar, sellar la superficie de corte con una gotita de OCT fresco. Después de congelar la gotita OCT, envolver el bloque OCT usado en parafilm y colocarlo de nuevo en el congelador de -80 ° C .
- Corte una sección usando el criostato. Utilice un fórceps para recoger el OCT que contiene la pieza incrustada de la piel ( Figura 2d ).
3. Etiquetado inmunofluorescente.
- Preparar el tampón PB (PBS suplementado con 0,5% de leche desnatada en polvo, 0,25% de gelatina de piel de pescado y 0,5% de Triton X-100) al menosT 2 h de antelación, tal como se ha descrito anteriormente 5 .
NOTA: Se puede añadir azida sódica al tampón PB para la preservación del anticuerpo para el uso repetido del tampón de tinción. - Etiquetar los tubos de microcentrífuga de 1,5 ml y agregar 500 μl de tampón PB por tubo. Utilice con cuidado fórceps para transferir las rebanadas de piel del PBS en tubos separados que contengan el tampón de PB para el bloqueo ( Figura 3a , derecha). Asegúrese de que todas las rebanadas de piel estén completamente sumergidas. Coloque los tubos de microcentrífuga sobre un balancín see-saw a velocidades no superiores a 10 oscilaciones por minuto, lo que no debe interrumpir la integridad del tejido, durante 1 h a temperatura ambiente.
NOTA: Es fundamental que la velocidad no supere las 10 oscilaciones por minuto en el balancín de see-saw, ya que inducirá enredos.- Si bien es posible agregar más de una rebanada por tubo de microcentrífuga, para ahorrar anticuerpos, sólo coloque una rebanada por tubo. Para disminuir el uso de anticuerpos, utilice un volumenDe 250 μl.
NOTA: Si es necesario, sustituya los tubos de microcentrífuga con, por ejemplo, placas de 96 pocillos. Sin embargo, la colocación de las secciones transversales de tejido espeso en tubos de microcentrífuga de 1,5 ml permite la penetración de anticuerpos más eficaz en el tejido debido a la perturbación de líquido mejorada.
- Si bien es posible agregar más de una rebanada por tubo de microcentrífuga, para ahorrar anticuerpos, sólo coloque una rebanada por tubo. Para disminuir el uso de anticuerpos, utilice un volumenDe 250 μl.
- Etiquetar los tubos de microcentrífuga separados de 1,5 ml para cada rebanada de piel y agregar 500 μL de tampón PB y la cantidad apropiada de anticuerpo primario. Después de 1 h de bloqueo, transferir las rodajas de piel a los tubos recién preparados que contienen los anticuerpos. Incubar las rebanadas a 4 ° C durante la noche.
NOTA: En este ejemplo, se usaron los siguientes anticuerpos primarios: FITC rata anti-CD49f humana a una concentración de 1:50 y cabra anti-ratón / rata integrina alfa 8 a una concentración de 1: 100. - Al día siguiente, preparar dos tubos de microcentrífuga de 1,5 mL separados que contengan 500 μl de PBS por muestra. Lave las rodajas de piel dos veces durante 1 h a temperatura ambientemi.
- Preparar tubos de microcentrífuga separados de 1,5 ml que contengan 500 μL de tampón PB con la concentración apropiada de anticuerpos secundarios aplicables y 4 ', 6-diamidino-2-fenilindol (DAPI).
NOTA: Los anticuerpos secundarios usados en este ejemplo son Alexa Fluor 488 burro anti-IgG de rata y Alexa Fluor 555 burro anti-cabra IgG a una concentración de 1: 500. Se usó DAPI a una concentración de 1: 100. - Transferir cuidadosamente las muestras de piel en el tampón PB, que contiene el anticuerpo secundario y DAPI, e incubar las rodajas de piel a temperatura ambiente durante 1 h a baja velocidad en un rotador o agitador.
- Guarde las rodajas a 4 ° C en el tampón PB que contiene el anticuerpo secundario y DAPI durante un máximo de cuatro días, y posiblemente más si se agrega azida sódica al PBS.
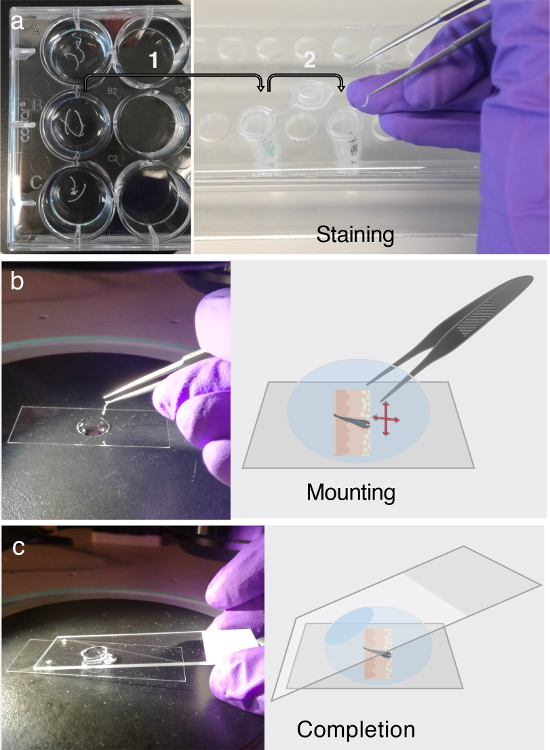
Figura 3. InmunofluorescEtiquetado y montaje.
(A) Las secciones transversales de tejido flotante pueden ser almacenados en placas de 12 pocillos durante al menos dos días a 4 ° C. Antes del etiquetado inmunofluorescente (IF), transfiera las secciones transversales del tejido de interés en tubos de microcentrífuga de 1,5 ml que contengan tampón PB para el bloqueo, como se indica mediante la flecha 1. Para el etiquetado IF, siga el procedimiento multietapas detallado en el paso 3. Cada Parte del paso 3 requiere la transferencia cuidadosa de las secciones transversales de tejido en tubos de microcentrífuga recién preparados que contienen solución de anticuerpo primario, solución de anticuerpo secundaria o tampón de lavado, que se indica mediante la flecha 2. ( b ) Después del marcado IF, Las secciones se deshilachan y aplanan en una gotita de glicerol, utilizando la ayuda de un microscopio de disección. ( C ) Una vez que la sección transversal del tejido está completamente aplanada sobre el fondo de un deslizamiento de la cubierta, se utiliza una corredera de microscopio regular para montar la sección. Haga clic aquí para ver una versión más grande de esta figura.
4. Montaje para Visualización Microscópica
- Antes de la obtención de imágenes, transfiera las rebanadas de piel a tubos de microcentrífuga separados que contengan 500 μl de PBS para lavar los anticuerpos secundarios y DAPI.
- Utilice una pipeta de 1.000 μl, pero corte los primeros 0,5 cm de la punta de la pipeta para permitir el pipeteado apropiado del glicerol altamente viscoso. Coloque un cubreobjetos de 22 x 50 mm sobre un fondo oscuro bajo un microscopio de disección ( Figura 3b ).
- Añadir una gotita de glicerol al 100% sobre la cubierta ( Figura 3b ). Transferir el trozo de piel del tubo de microcentrífuga sobre la gotita de glicerol. Utilice el microscopio de disección y pinzas puntiagudas para desenrollar cuidadosamente las rebanadas de piel que están acurrucadas.
NOTA: A medida que la rebanada flota en elCerol, puede ser desenredado persuadiendo la propensión natural del tejido a volver a su forma normal. No fuerce el enderezamiento artificial de la rebanada, ya que esto podría causar daño al tejido. - Montar el tejido una vez que toda la longitud de la sección de la piel está correctamente orientada y aplanada en el cubreobjetos; Utilice un portaobjetos de microscopio regular. Este paso enderezará aún más la porción de la piel.
NOTA: Evite el atrapamiento de aire ( Figura 3c ). - Image en las secciones de piel de glicerol en los próximos dos días.
NOTA: El almacenamiento prolongado influirá negativamente en el tejido y en la calidad de la imagen. En este ejemplo, todas las imágenes se adquirieron con un microscopio confocal derecho usando un objetivo de 20x.
Resultados
Para enfatizar las ventajas de nuestra técnica, comparamos nuestra técnica de corte transversal de tejido grueso, 3D, "montaje horizontal completo", a secciones congeladas clásicas. Las secciones congeladas clásicas se cortaron como se ha descrito previamente 5 . Para proporcionar una estructura visual de la epidermis en las imágenes microscópicas, que immunostained para integrina alfa-6 (Itga6), que es un componente que ancla las células epidérmicas a la membrana subyacente subyacente [ 6] . También se etiquetó el músculo arrector pili (APM), que es responsable de piloerection (también conocido como "goosebumps"), con integrina alfa-8 7 . En las clásicas secciones congeladas, la mayoría de los folículos pilosos visualizados con Itga6 no fueron seccionados a lo largo de toda la longitud, generando folículos pilosos predominantemente incompletos por sección, en comparación con los montajes horizontales enteros ( Figura 4a -4d ). Las secciones transversales de tejido grueso permiten adquirir más capas de Z-pila en comparación con las secciones convencionales de 10 μm, lo que permite una imagen 3D más completa. Esto se hace aún más evidente cuando se estudia la integridad de APMs, que están asociados con los folículos pilosos y la membrana basal superpuesta. En clásica cryosections, la gran parte de APMs fueron fraccionados ( Figura 4a -4d ). Además, la integridad de los tejidos del compartimiento hipodérmico se conserva en montajes horizontales enteros, en comparación con la destrucción de adipocitos cuando las criosecciones se unen a diapositivas de vidrio caliente, que es un artefacto de congelación-descongelación bien conocido ( Figura 4a -b , Regiones) 8 .
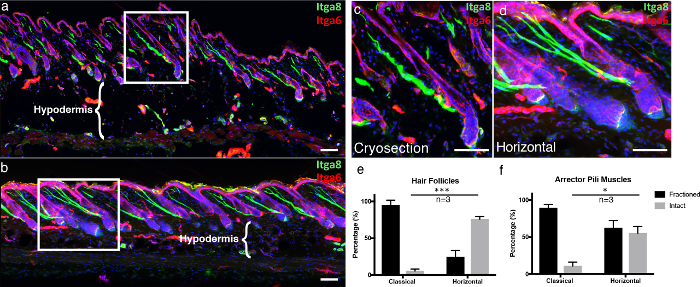
Figura 4. Molde horizontal enteroNt en comparación con una criosección clásica.
(A) piel obtenido Clásicamente criosecciones 10 micras y (b) 100 micras de espesor de tejido 3D secciones transversales se marcaron con integrina alfa-6 (ITGA6) y la integrina alfa-8 (ITGA8) para visualizar los músculos pili compartimento epidérmico y erector gruesas , Respectivamente. Las imágenes de las secciones transversales de tejido grueso se representan como proyecciones máximas de una pila Z grande. Los marcos blancos indican las áreas que se agrandan, mostradas en ( c ) las secciones clásicas y ( d ) horizontales de montaje completo. ( E ) Los folículos pilosos intactos y ( f ) los músculos píticos intactos se cuantificaron tanto en la sección clásica como en la horizontal. Las barras de escala indican 100 μm. Los datos se representan como Media ± Error Estándar de la Media (SEM). Se cuantificó una sección por repetición biológica ( n = 3). Prueba t no emparejada * P <0,05, *** P <0,0005. Haga clic aquí para ver una versión más grande de esta figura.
Discusión
Here, we present the "horizontal whole mount" technique, which has several advantages over classical frozen sections. One advantage of our technique is that it can easily be performed with standard histology equipment and a confocal microscope. Second, the tissue integrity is preserved in a superior manner when compared to standard cryosections. For example, adipocytes within the hypodermal layer (i.e., dermal white adipocytes (DWAT))9 are severely disrupted in standard cryosections, which makes studying tissues that are adipose-laden impossible. Our technique allows for the full analysis of the adipocytes in this layer and may be adapted to other tissues with high adipocyte contents. Furthermore, this allows for the improved detection of mesenchymal cells in lineage-tracing studies 2,10.
Standard cryosections, by their very nature, can never reveal the true 3D aspects of a tissue through confocal microscopy. This means that thicker sections are advantageous in the analysis of skin, since hair follicles, as well as their substructures, can traverse a depth that exceeds the standard thickness of 10 µm used in classical crysosections. We are intrigued that other tissues, such as the intestine and brain, for example, possess similar challenges with regard to viewing the tissue as a 3D structure2,7,11,12,13. Intriguingly, our technique has already been shown to be beneficial for use in certain applications in the intestines14. We believe that our horizontal whole-mount protocol has the potential be applied to any other tissue requiring 3D analysis.
Divulgaciones
Los autores desean revelar que la publicación de este manuscrito fue financiada por Thermo-Fisher Scientific Inc.
Agradecimientos
Los autores reconocen el patrocinio de Thermo-Fisher Scientific y agradecen al Nikon Imaging Center de Kings College de Londres por su apoyo durante la adquisición de imágenes confocales.
Materiales
| Name | Company | Catalog Number | Comments |
| PBS | homemade | ||
| Gelatin, from cold water fish skin | Sigma | G7765 | 250ML |
| Glycerol | BDH Laboratory Supplies | 444482V | |
| O.C.T. compound | VWR chemicals | 361603E | |
| Peel-A-Way embedding molds | Sigma | E6032-1CS | Square S-22 |
| Non-Fat Powdered Milk | Bio Basic Inc. | NB0669 | |
| Triton X-100 | Sigma | T9284 | 500ML |
| 4′,6-Diamidino-2-phenylindole, dilactate (DAPI) | Invitrogen | D3571 | |
| FITC Rat Anti-Human CD49f | BD Pharmingen | 555735 | |
| Mouse/Rat Integrin alpha 8 Antibody | R&D Systems | AF4076 | |
| Alexa Fluor 488 donkey anti-rat IgG | Life Technologies | A21208 | |
| Alexa Fluor 555 donkey anti-goat IgG | Life Technologies | A21432 | |
| CryoStar NX70 | Thermo Fisher Scientific | ||
| 100mm Culture dishes | |||
| Disposable scalpels | Swann-Morton | Ref 0501 | |
| pointed metal forceps | |||
| 1.5 ml microcentrifuge tubes | VWR | 211-2130 | |
| 12 Well plates | Sigma | CLS3513 | |
| Dissecting microscope | Nikon | ||
| 20 ul and 1000 ul Pipette | Gilson | ||
| 1000µl XL Graduated TipOne Filter Tip (Sterile) | Star Lab | S1122-1830 | |
| 20µl Bevelled TipOne Filter Tip (Sterile) | Star Lab | S1120-1810 | |
| Rocking shaker plate | |||
| Microscope slides, menzel Glaeser | Thermos Scientific | 631-9483 | Superfrost Plus |
| Cover Glasses, Menzel Glaeser | Thermos Scientific | MENZBB024060AB | 24 x 60 mm |
| Confocal microscope | Nikon |
Referencias
- Plikus, M. V., et al. Cyclic dermal BMP signalling regulates stem cell activation during hair regeneration. Nature. 451 (7176), 340-344 (2008).
- Zhang, Y. V., Cheong, J., Ciapurin, N., McDermitt, D. J., Tumbar, T. Distinct self-renewal and differentiation phases in the niche of infrequently dividing hair follicle stem cells. Cell Stem Cell. 5 (3), 267-278 (2009).
- Jensen, U. B., Lowell, S., Watt, F. M. The spatial relationship between stem cells and their progeny in the basal layer of human epidermis: a new view based on whole-mount labelling and lineage analysis. Development. 126 (11), 2409-2418 (1999).
- Braun, K. M., et al. Manipulation of stem cell proliferation and lineage commitment: visualisation of label-retaining cells in wholemounts of mouse epidermis. Development. 130 (21), 5241-5255 (2003).
- Driskell, R. R., Giangreco, A., Jensen, K. B., Mulder, K. W., Watt, F. M. Sox2-positive dermal papilla cells specify hair follicle type in mammalian epidermis. Development. 136 (16), 2815-2823 (2009).
- Niculescu, C., et al. Conditional ablation of integrin alpha-6 in mouse epidermis leads to skin fragility and inflammation. Eur J Cell Biol. 90 (2-3), 270-277 (2011).
- Fujiwara, H., et al. The basement membrane of hair follicle stem cells is a muscle cell niche. Cell. 144 (4), 577-589 (2011).
- Desciak, E. B., Maloney, M. E. Artifacts in frozen section preparation. Dermatol Surg. 26 (5), 500-504 (2000).
- Driskell, R., Jahoda, C. A., Chuong, C. M., Watt, F., Horsley, V. Defining dermal adipose tissue. Exp Dermatol. 23 (9), 629-631 (2014).
- Driskell, R. R., et al. Distinct fibroblast lineages determine dermal architecture in skin development and repair. Nature. 504 (7479), 277-281 (2013).
- Snippert, H. J., Schepers, A. G., Delconte, G., Siersema, P. D., Clevers, H. Slide preparation for single-cell-resolution imaging of fluorescent proteins in their three-dimensional near-native environment. Nat Protoc. 6 (8), 1221-1228 (2011).
- Sada, A., et al. Defining the cellular lineage hierarchy in the interfollicular epidermis of adult skin. Nat Cell Biol. 18 (6), 619-631 (2016).
- Chung, K., Deisseroth, K. CLARITY for mapping the nervous system. Nat Methods. 10 (6), 508-513 (2013).
- Tetteh, P. W., et al. Replacement of Lost Lgr5-Positive Stem Cells through Plasticity of Their Enterocyte-Lineage Daughters. Cell Stem Cell. 18 (2), 203-213 (2016).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados