Method Article
水平全マウント:皮膚の厚い3次元組織断面のための新規処理および画像化プロトコール
要約
この研究は、共焦点イメージングモダリティの完全な利用を可能にする、厚い3次元組織断面分析のための新規な処理およびイメージングプロトコルを提示する。このプロトコールは抗原性を保持し、皮膚組織学および潜在的に他の組織型を分析するための堅牢なシステムを表す。
要約
科学的議論を支持する顕微鏡画像を生成する目的の組織を処理することは困難であり得る。高品質の顕微鏡画像の取得は、顕微鏡の品質だけでなく、しばしば複数の重要な動作またはステップを伴う組織処理の方法にも依存する。さらに、皮膚および他の組織における間葉系細胞タイプは、組織調製および画像化のための新たな課題を提示する。ここでは、組織収穫から顕微鏡検査までの完全なプロセスを提示します。 「水平マウント」と呼ばれる私たちの技術は、初心者がすばやく熟練することができ、クリオスタットで切断された厚さ60〜300μmの切片での抗原の保存と検出を可能にする技術です。この厚さのセクションは、3次元環境における組織のマイクロアーキテクチャの視覚化を向上させます。さらに、このプロトコールは、間葉細胞を、標準的なクライオスタットまたはパラフィン切片と比較して、それにより免疫染色の有効性および信頼性を増加させる。我々は、このプロトコールが、皮膚、おそらく他の組織および器官を視覚化するすべての実験室に有益であると考えている。
概要
顕微鏡撮像装置の革命は、洗練された高解像度撮像装置を提供する。しかしながら、完全な三次元(3D)組織断面の顕微鏡画像を取得する場合、標本調製はかなりの課題を提示し、画像品質を限定する上での制約要因となり得る。個々のステップは、組織形態および標的タンパク質の抗原性を維持し、プロセシングに起因するアーティファクトを最小限にし、最終的な画像品質を最大にするために慎重に考慮する必要がある。例えば、皮膚の伝統的な分析は、皮膚のホメオスタシス1、2への幹細胞区画の貢献の解剖学的な解析を可能にし、適切に配向された毛包で、表皮と真皮の景色をイメージする必要があります。これは、皮膚がどのように埋め込まれ、切断されるかについて徹底的な集中を必要とする。重要なことに、毛包はより厚くなり得る大幅ホールマウントまたは厚い断面3、4、5と比較分析の低い標準をもたらす、標準パラフィンまたは凍結切片の厚さを超え100μm以下、。
総合すると、顕微鏡分析のための試料調製の各ステップは、画像分析に影響する重要な決定要因である。ここでは、「水平全面マウント」と呼ばれる、厚い3次元組織断面解析のための新しい処理プロトコルを紹介します。プロトコールは抗原性を高く保ち、標準的な共焦点イメージング装置を用いて皮膚の厚い部分の完全な利用を可能にする。これは、組織採取およびパラホルムアルデヒド(PFA)に基づく凍結保存(ステップ1)、クライオスタットによる厚さ100μmの組織断面の生成(ステップ1)を含む、厚い組織断面処理およびイメージングのための皮膚の使用に関する完全なガイドである。 2)、および免疫蛍光ラベリングおよびマウント(ステップ3および4)。代表的な結果は、このプロトコールの潜在的ユーザのための「水平全マウント」の利点を強調する2つの異なる組織学的調製技術(古典的な凍結切開および厚い3D組織横断)の共焦点画像を比較する。
プロトコル
すべての動物実験は、地元の倫理的承認の対象となり、英国政府のホームオフィスライセンスの条件で実施されました。
1.スキンハーベストと凍結保存
- 準備。
- 1%リン酸緩衝化生理食塩水(PBS)25 mLを含む25 mLの4%PFAと2つの100 mm培養皿で100 mm培養皿1枚を調製します。
- 最適切断温度化合物(OCT)を用いて長方形のピールアウェイクライオールドを3分の2で満たす。
- クライオブロックを後のステップに置くことができる金属板を-80°Cの冷凍庫に置きます。
- 皮膚収穫、固定および凍結保存。
- 乾燥した電気シェーバーで動物の死体の背部をクリップする。
注:この例では、生後21日の野生型マウスを使用した。 - 皮膚の関心領域を収穫します。
注:マウス皮膚の背側領域( - 収穫した皮膚をクライオモールドの底に収まるように適切な大きさの長方形の部分に切り取って、毛包穀物の方向性の成長を考慮してください。
注:小さなスキンスライスは、インキュベーションやマウントプロセス中につまずく可能性が少ないため、初心者にとっては扱いやすいかもしれません。ここに示されている例は、背部皮膚の約1cm 2の領域であり、22×30×20mmのクライオブラッドに収まる( 図2a )。 - 皮膚サンプルの厚さに応じて、室温で4%PFA 25 mLで10-30分間固定します( 図1b )。
- 25mLのPBSで皮膚サンプルを2回洗浄するそれぞれ少なくとも5分間( 図1b )。
- 凍結過程で結晶化を起こし、凍結切片の結果に影響を与える可能性のある余分なPBSの組織を慎重に排水するために、ペーパータオル上で皮膚サンプルを拭く。
注:標準スクロース勾配は必要ありません。しかし、これはユーザーの裁量でプロトコルに組み込むこともできます。 - 各皮膚サンプルの毛包の向きに注意してください。視覚援助のために解剖顕微鏡を使用してください(特にプロトコールを最初に行う人は誰でも)。 OCTで満たされたクライオブラントに皮膚サンプルを挿入し、鉗子を使用してクリッピングされた髪の表面に付着した気泡を除去することによって、皮膚のすべての領域をOCTで平衡させる( 図2aおよび2b )。
- OCTで満たされたブロックの底にスキンを押して、底と同じ面になるようにします。
注:皮膚は任意の方向に向けることができます。適切な切断手順のために毛包の穀粒が注目されている限り。ブロックが凍結切除のためにクライオスタットに取り付けられると、クライオチップは再配向される。クライオモールド上の毛包の向きをマークする。このステップは、クライオスタットカットのその後の向きを決定するためである。 - 組織の浮遊と脱落を避けるため、クライオブロックを-80°Cフリーザーの金属板に移します。
- 目に見えない気泡が皮膚をクライオブラントの表面に浮かせる原因となる可能性があるため、冷凍プロセスを監視してクライオブラッドの底にある皮膚の向きを維持します。
注:冷凍組織を含むクライオモールドは、-80℃で1年以上保存することができ、追加のセクションで再使用することができます。
- 乾燥した電気シェーバーで動物の死体の背部をクリップする。
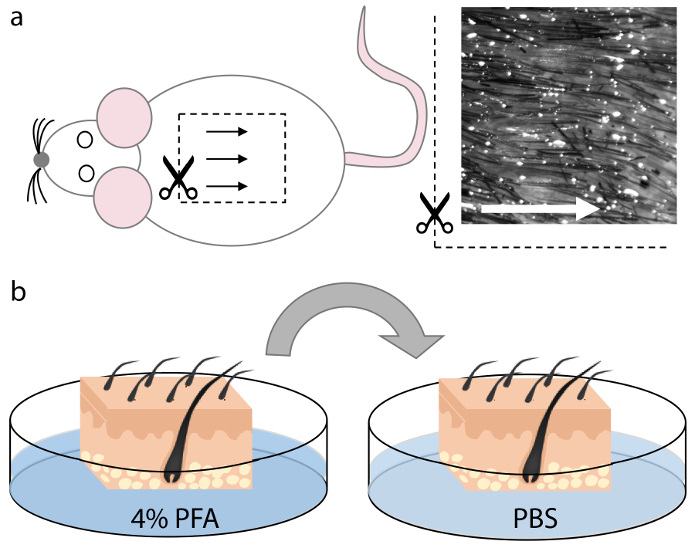
図1.マウスの皮膚の収穫と固定。
( a )動物の死体の背側領域から皮膚組織を採取した。この領域の毛包は、均等に間隔を置いて整列しているため、矢印で示すように、切開中の最適な向きを可能にする。 ( b )クライオドールドに適合する適切なサイズの四角形を切断した後、皮膚組織を4%PFAで15分間固定し、PBSで5分間それぞれ2回洗浄した。 この図の拡大版を見るには、ここをクリックしてください。
2.厚い組織断面
- クライオスタットにマウントする準備と組織の向き。
- 100mLの培養皿に15mLのPBSを調製する。クライオスタットの簡単にアクセス可能な領域に置きます。さらに、1ウェルあたり2.5mLのPBSを含む12ウェルプレートを調製する;の長期保存のためのサンプルに従ってラベル4℃でインキュベートする。セクションを処理するには、鉗子を使用します。
- クライオスタットの温度を-20℃に調整する。
注記:温度はセクショニングに影響することがありますが、-20℃で始めるのが良いガイドです。 - 約2つの毛包の厚い切片を得るために、クライオスタットを150μm厚の切片を切断するように調節する。
注:セクションの厚さは、ユーザーのニーズと分析に使用される顕微鏡の限界に応じて変更できます。
注:サンプルの向きは、毛包が適切な向きである皮膚切片を得るために重要です。これは、クライオスタットブロックに適切に取り付けることによって達成される。セクション平面が毛包の向きと平行であることを確認します ( 図2c )。前述のように、皮膚サンプル中の断面の正しい向きは、取得される画像の品質を決定する重要なステップです後のステップ。

図2.埋め込み、凍結保存、および切片化。
( a ) クライオモールド上の毛包(HF)方向を黒い矢印で示していることは、凍結切片作製中の正しい配向のために重要である。 ( b )毛包の完全な長さが損なわれていない区画を生成するために、区画平面を毛包の配向と整列させる必要がある( c )区画を毛包の方向ごとに切断した。クライオモールド。 ( d )厚い組織断面を金属鉗子で収集し、( e )1×PBSを含む100mm培養皿に移した。 ( f )室温で、PBSはOCを溶解させる.T。白い矢印によって示されるように、厚い組織断面を囲む化合物。セクションは、PBS内で自由に浮遊します。 この図の拡大版を見るには、ここをクリックしてください。
- 凍結切除。
- クライオスタットを使用して切片を切る。鉗子を使用して、埋め込まれた皮膚を含むOCTを収集します( 図2d )。
注:最適な標本の位置決めのために、X、Y、およびZ軸に沿った独立した移動および調整が可能なクライオスタットを使用してください。これにより、理想的に位置合わせされた組織断面の生成が可能になる。 - クライオスタットから切片をPBSで満たした100mm培養皿に移し、次のスライスを続ける。サンプルをスライド上に集めないでください( 図2e )。
注:室温では、PBSは溶解しますOCTは、鉗子で扱いやすい皮膚スライスを残す( 図2f )。
注:厚さ100μmの多くの組織切片を溶解した後、新鮮なPBSが100mm培養皿に必要となり、それに応じて変更することができます。 - 2.5mLのPBS( 図3a 、左)で満たされた12ウェルプレートで浮遊皮膚切片を正確に標識されたウェルに移すために鉗子を使用する。
注:4℃では、サンプルを少なくとも2日間保存することができます。切断後の皮膚含有OCTブロックの長期保存のために、新しいOCTの液滴で切断面をシールする。OCT液滴を凍結させた後、使用したOCTブロックをパラフィルムに包んで-80℃冷凍庫に戻す。
- クライオスタットを使用して切片を切る。鉗子を使用して、埋め込まれた皮膚を含むOCTを収集します( 図2d )。
3.免疫蛍光標識。
- PBSバッファー(0.5%脱脂粉乳、0.25%フィッシュスキンゼラチン、0.5%Triton X-100を補充したPBS)を調製する予めT 2時間、先に5記載の方法。
注:アジ化ナトリウムは、染色バッファーの繰り返し使用のための抗体保存のためにPBバッファーに添加することができます。 - 1.5 mLのマイクロ遠心チューブにラベルを貼り、チューブあたり500μLのPBバッファーを加えます。注意深く鉗子を使用して、PBSからの皮膚切片をPBS緩衝液を含む別々のチューブに移して遮断する( 図3a 、右)。すべてのスキンスライスが完全に水没していることを確認してください。マイクロ遠心チューブを室温で1時間、組織の完全性を破壊しないで、毎分10回の振動以下の速度でシーソーロッカー上に置く。
注:シーソーロッカーでは、速度が絡まりを引き起こすため、毎分10回の振動を超えないことが重要です。- マイクロ遠心チューブごとに複数のスライスを追加することは可能ですが、抗体を保存するにはチューブごとにスライスを1つだけ配置します。抗体の使用を減らすには、ボリュームを使用してください250μLであった。
注:必要に応じて、マイクロ遠心チューブを、例えば96穴プレートに交換してください。しかしながら、1.5mLのマイクロ遠心チューブに厚い組織断面を配置することにより、液体の乱れが増強されたため、組織内への最も効果的な抗体の浸透が可能になる。
- マイクロ遠心チューブごとに複数のスライスを追加することは可能ですが、抗体を保存するにはチューブごとにスライスを1つだけ配置します。抗体の使用を減らすには、ボリュームを使用してください250μLであった。
- 各皮膚スライスのために別々の1.5mLのマイクロ遠心チューブに標識し、500μLのPB緩衝液および適切な量の一次抗体を加える。ブロッキングの1時間後、抗体を含有する新たに調製したチューブに皮膚切片を移す。スライスを4℃で一晩インキュベートする。
注:この実施例では、以下の一次抗体を使用した:1:50の濃度のFITCラット抗ヒトCD49fおよび1:100の濃度のヤギ抗マウス/ラットインテグリンα8。 - 翌日、試料あたり500μLのPBSを含む2つの別々の1.5mL微量遠心管を用意する。室温で1時間、皮膚切片を2回洗浄する。e。
- 適用可能な二次抗体および4 '、6-ジアミジノ-2-フェニルインドール(DAPI)の適切な濃度のPB緩衝液500μLを含む別々の1.5mL微量遠心チューブを調製する。
注:この例で使用した二次抗体は、1:500の濃度のAlexa Fluor 488ロバ抗ラットIgGおよびAlexa Fluor 555ロバ抗ヤギIgGです。 DAPIを1:100の濃度で使用した。 - 注意深く、皮膚サンプルを二次抗体およびDAPIを含有するPB緩衝液に移し、ローテーターまたはシェーカー上で室温で1時間、低速で皮膚切片をインキュベートする。
- 2次抗体とDAPIを含むPBバッファーに4℃で4℃で保存し、アジ化ナトリウムをPBSに加えた場合にはさらに長くしてください。
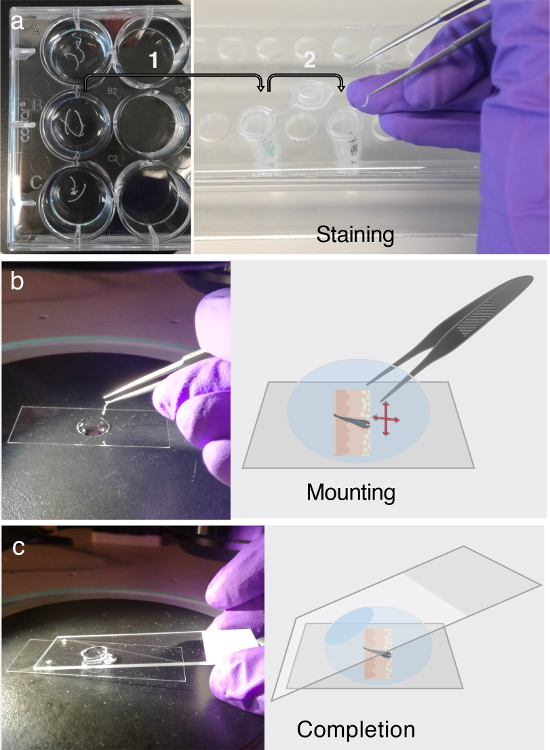
図3.免疫蛍光entラベリングとマウント。
( a )浮遊組織の断面は、4℃で少なくとも2日間12ウェルプレートに保存することができます。免疫蛍光(IF)ラベリングの前に、矢印1で示されるように、ブロッキングのためにPB緩衝液を含む1.5mLマイクロ遠心チューブに目的の組織断面を移す.IF標識のために、ステップ3で詳述された複数ステップ手順に従う。ステップ3の一部は、矢印2で示される、一次抗体溶液、二次抗体溶液、または洗浄バッファーを含有する新たに調製されたマイクロ遠心チューブに組織断面を注意深く移すことを必要とする。( b )IF標識後、解剖顕微鏡の助けを借りて、グリセロールの液滴中で切片を解き平滑化する。 ( c )組織の断面がカバースリップの底に完全に平坦になると、通常の顕微鏡スライドを使用してセクションが取り付けられる。 この図の拡大版を見るには、ここをクリックしてください。
4.顕微鏡視覚化のための取り付け
- イメージングする前に、二次抗体およびDAPIを洗い流すために、500μLのPBSを含む別々のマイクロ遠心チューブに皮膚切片を移す。
- 1,000μLのピペットを使用しますが、ピペットチップの最初の0.5cmを切り、高粘度のグリセロールを適切にピペッティングできるようにします。解剖顕微鏡( 図3b )の下に暗い背景に22 x 50 mmカバースリップを置きます。
- 100%グリセロールの1滴をカバースリップに添加する( 図3b )。マイクロ遠心チューブから皮膚切片をグリセロール液滴に移す。解剖顕微鏡と尖った鉗子を使用して、きつく巻いた皮膚のスライスを注意深く巻き戻します。
注:スライスがグリフ内で浮動するとそれは、正常な形状に戻るための組織の自然な傾向を癒すことによって絡み合うことができます。組織の損傷を引き起こす可能性があるので、スライスを不自然にまっすぐにしないでください。 - カバー部分には、皮膚部分の全長が適切に向き合って平坦になったら、ティッシュを取り付けます。通常の顕微鏡スライドを使用してください。このステップは、スキンスライスをさらにまっすぐにします。
注記:空気の閉じ込めを避けてください( 図3c )。 - 次の2日以内に、グリセロールにマウントされた皮膚切片をイメージします。
注記:長時間の保管は、組織とイメージングの品質に悪影響を及ぼします。この例では、すべての画像を、20倍対物レンズを用いて直立共焦点顕微鏡で取得した。
結果
我々の技術の利点を強調するために、我々は、我々の太い3D組織横断技術「水平全体マウント」を古典的な凍結切片と比較した。古典的な凍結切片を前述のように切断した( 5) 。顕微鏡画像における表皮の視覚的構造を提供するために、本発明者らは、基底膜6に表皮細胞を固定する成分であるインテグリンα6(Itga6)について免疫染色した。我々はまた、インテグリンアルファ-8 7で、(も「鳥肌」として知られている)立毛を担当して立毛筋(APM)を、ラベルされました。古典的な凍結切片では、Itga6で視覚化されたほとんどの毛包は、全体の長さに沿って切片化されず、横断全体のマウントと比較して、切片あたり主に不完全な毛包を生成した( 図 4a〜4d )。厚い組織断面は、従来の10μm断面と比較してより多くのZスタック層を獲得することを可能にし、より完全な3D画像を可能にする。これは、毛包および上層の基底膜に関連するAPMの完全性を研究するときにさらに明らかになる。古典的な凍結切片では、APMの膨大な部分が分画された( 図 4a〜4d )。さらに、低温保存区画の組織完全性は、凍結切片を暖かいガラススライドに付着させたときの脂肪細胞の破壊と比較して、水平な全体のマウントで保存されており(これは周知の凍結融解アーチファクトである( 図4a - b 、領域) 8 。
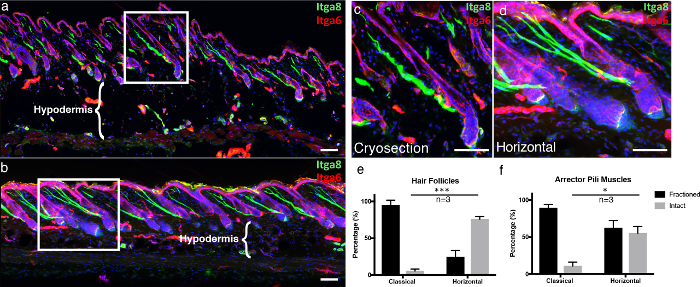
図4.水平全体のモウ従来の凍結切片と比較してnt。
( a )厚さ10μmの古典的に得られた皮膚凍結切片および( b )厚さ100μmの3D組織断面を、インテグリンα-6(Itga6)およびインテグリンα-8(Itga8)で標識して、表皮区画および後肢筋肉を視覚化したそれぞれ、厚い組織断面の画像は、大きなZスタックの最大投影として表される。白い枠は、拡大された領域、( c )古典的な( d )水平のマウント部に表示されます。 ( e )インタクトな毛包および( f )無傷の脱毛筋を、古典的および水平的な全マウント切片の両方で定量化した。スケールバーは100μmを示す。データは、平均値±標準誤差平均(SEM)として表される。生物学的反復( n = 3)あたり1つのセクションを定量した。対になっていないt検定* P <0.05、*** P <0.0005。 この図の拡大版を見るには、ここをクリックしてください。
ディスカッション
Here, we present the "horizontal whole mount" technique, which has several advantages over classical frozen sections. One advantage of our technique is that it can easily be performed with standard histology equipment and a confocal microscope. Second, the tissue integrity is preserved in a superior manner when compared to standard cryosections. For example, adipocytes within the hypodermal layer (i.e., dermal white adipocytes (DWAT))9 are severely disrupted in standard cryosections, which makes studying tissues that are adipose-laden impossible. Our technique allows for the full analysis of the adipocytes in this layer and may be adapted to other tissues with high adipocyte contents. Furthermore, this allows for the improved detection of mesenchymal cells in lineage-tracing studies 2,10.
Standard cryosections, by their very nature, can never reveal the true 3D aspects of a tissue through confocal microscopy. This means that thicker sections are advantageous in the analysis of skin, since hair follicles, as well as their substructures, can traverse a depth that exceeds the standard thickness of 10 µm used in classical crysosections. We are intrigued that other tissues, such as the intestine and brain, for example, possess similar challenges with regard to viewing the tissue as a 3D structure2,7,11,12,13. Intriguingly, our technique has already been shown to be beneficial for use in certain applications in the intestines14. We believe that our horizontal whole-mount protocol has the potential be applied to any other tissue requiring 3D analysis.
開示事項
著者らは、この原稿の刊行物がThermo-Fisher Scientific Inc.によって資金提供されたことを開示したいと考えている
謝辞
著者らはThermo-Fisher Scientificのスポンサーシップを認め、共焦点画像取得中のサポートのためにKings College LondonのNikon Imaging Centerに感謝しています。
資料
| Name | Company | Catalog Number | Comments |
| PBS | homemade | ||
| Gelatin, from cold water fish skin | Sigma | G7765 | 250ML |
| Glycerol | BDH Laboratory Supplies | 444482V | |
| O.C.T. compound | VWR chemicals | 361603E | |
| Peel-A-Way embedding molds | Sigma | E6032-1CS | Square S-22 |
| Non-Fat Powdered Milk | Bio Basic Inc. | NB0669 | |
| Triton X-100 | Sigma | T9284 | 500ML |
| 4′,6-Diamidino-2-phenylindole, dilactate (DAPI) | Invitrogen | D3571 | |
| FITC Rat Anti-Human CD49f | BD Pharmingen | 555735 | |
| Mouse/Rat Integrin alpha 8 Antibody | R&D Systems | AF4076 | |
| Alexa Fluor 488 donkey anti-rat IgG | Life Technologies | A21208 | |
| Alexa Fluor 555 donkey anti-goat IgG | Life Technologies | A21432 | |
| CryoStar NX70 | Thermo Fisher Scientific | ||
| 100mm Culture dishes | |||
| Disposable scalpels | Swann-Morton | Ref 0501 | |
| pointed metal forceps | |||
| 1.5 ml microcentrifuge tubes | VWR | 211-2130 | |
| 12 Well plates | Sigma | CLS3513 | |
| Dissecting microscope | Nikon | ||
| 20 ul and 1000 ul Pipette | Gilson | ||
| 1000µl XL Graduated TipOne Filter Tip (Sterile) | Star Lab | S1122-1830 | |
| 20µl Bevelled TipOne Filter Tip (Sterile) | Star Lab | S1120-1810 | |
| Rocking shaker plate | |||
| Microscope slides, menzel Glaeser | Thermos Scientific | 631-9483 | Superfrost Plus |
| Cover Glasses, Menzel Glaeser | Thermos Scientific | MENZBB024060AB | 24 x 60 mm |
| Confocal microscope | Nikon |
参考文献
- Plikus, M. V., et al. Cyclic dermal BMP signalling regulates stem cell activation during hair regeneration. Nature. 451 (7176), 340-344 (2008).
- Zhang, Y. V., Cheong, J., Ciapurin, N., McDermitt, D. J., Tumbar, T. Distinct self-renewal and differentiation phases in the niche of infrequently dividing hair follicle stem cells. Cell Stem Cell. 5 (3), 267-278 (2009).
- Jensen, U. B., Lowell, S., Watt, F. M. The spatial relationship between stem cells and their progeny in the basal layer of human epidermis: a new view based on whole-mount labelling and lineage analysis. Development. 126 (11), 2409-2418 (1999).
- Braun, K. M., et al. Manipulation of stem cell proliferation and lineage commitment: visualisation of label-retaining cells in wholemounts of mouse epidermis. Development. 130 (21), 5241-5255 (2003).
- Driskell, R. R., Giangreco, A., Jensen, K. B., Mulder, K. W., Watt, F. M. Sox2-positive dermal papilla cells specify hair follicle type in mammalian epidermis. Development. 136 (16), 2815-2823 (2009).
- Niculescu, C., et al. Conditional ablation of integrin alpha-6 in mouse epidermis leads to skin fragility and inflammation. Eur J Cell Biol. 90 (2-3), 270-277 (2011).
- Fujiwara, H., et al. The basement membrane of hair follicle stem cells is a muscle cell niche. Cell. 144 (4), 577-589 (2011).
- Desciak, E. B., Maloney, M. E. Artifacts in frozen section preparation. Dermatol Surg. 26 (5), 500-504 (2000).
- Driskell, R., Jahoda, C. A., Chuong, C. M., Watt, F., Horsley, V. Defining dermal adipose tissue. Exp Dermatol. 23 (9), 629-631 (2014).
- Driskell, R. R., et al. Distinct fibroblast lineages determine dermal architecture in skin development and repair. Nature. 504 (7479), 277-281 (2013).
- Snippert, H. J., Schepers, A. G., Delconte, G., Siersema, P. D., Clevers, H. Slide preparation for single-cell-resolution imaging of fluorescent proteins in their three-dimensional near-native environment. Nat Protoc. 6 (8), 1221-1228 (2011).
- Sada, A., et al. Defining the cellular lineage hierarchy in the interfollicular epidermis of adult skin. Nat Cell Biol. 18 (6), 619-631 (2016).
- Chung, K., Deisseroth, K. CLARITY for mapping the nervous system. Nat Methods. 10 (6), 508-513 (2013).
- Tetteh, P. W., et al. Replacement of Lost Lgr5-Positive Stem Cells through Plasticity of Their Enterocyte-Lineage Daughters. Cell Stem Cell. 18 (2), 203-213 (2016).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved