Method Article
Horizontal Whole Mount: um protocolo de processamento e imagem de Novel para secções transversais grossas de tecidos tridimensionais
Neste Artigo
Resumo
Este trabalho apresenta um novo protocolo de processamento e imagem para análises de seção transversal de tecido grosso e tridimensional que permitem a exploração completa das modalidades de imagem confocal. Este protocolo preserva a antigenicidade e representa um sistema robusto para analisar histologia da pele e potencialmente outros tipos de tecido.
Resumo
Processar um tecido de interesse para gerar uma imagem microscópica que suporte um argumento científico pode ser um desafio. A aquisição de imagens microscópicas de alta qualidade não depende inteiramente da qualidade do microscópio, mas também dos métodos de processamento de tecidos, que muitas vezes envolvem múltiplas ações ou passos críticos. Além disso, os tipos de células mesenquimais na pele e outros tecidos representam um novo desafio para a preparação e a formação de tecidos. Aqui, apresentamos um processo completo, desde a colheita de tecidos até a microscopia. Nossa técnica, chamada "montagem horizontal todo", é aquela em que os noviços podem rapidamente se tornar proficientes e que permitem a preservação e detecção de antígenos em secções de 60-300 μm de espessura cortadas com um criostato. As seções desta espessura proporcionam uma visualização melhorada da microarquitetura de tecidos em um ambiente tridimensional. Além disso, o protocolo preserva as células mesenquimais de uma maneira que melhora a qualidade da imagem quandoEm comparação com as secções padrão de criostato ou parafina, aumentando assim a eficácia e a confiabilidade da imunocoloração. Acreditamos que este protocolo beneficiará todos os laboratórios que visualizam a pele e possivelmente outros tecidos e órgãos.
Introdução
A revolução do equipamento de imagem microscópica fornece instrumentos de imagem sofisticados e de alta resolução. No entanto, ao adquirir uma imagem microscópica de uma seção transversal de tecido tridimensional (3D) completa, a preparação da amostra apresenta desafios consideráveis e pode ser o fator limitante na definição da qualidade da imagem. Cada passo separado merece uma análise cuidadosa para preservar a morfologia do tecido e a antigenicidade das proteínas alvo, minimizar os artefatos induzidos pelo processamento e maximizar a qualidade final da imagem. Por exemplo, a análise tradicional da pele requer uma imagem com vista da epiderme e da derme, com folículos pilosos adequadamente orientados, permitindo a análise anatômica das contribuições do compartimento das células estaminais para a homeostase da pele 1 , 2 . Isso requer uma concentração minuciosa sobre como a pele está embutida e seccionada. Importante, os folículos capilares podem ser mais espessosDo que 100 μm, o que ultrapassa largamente a espessura padrão de parafina ou seção congelada, resultando em um padrão de análise mais baixo em comparação com montagens inteiras ou secções transversais grossas 3 , 4 , 5 .
Em conjunto, cada passo da preparação de amostras para análise microscópica é um determinante crítico que afetará a análise de imagem. Aqui, é apresentado um protocolo de processamento de novelo para análise de seção transversal de tecido 3D grosso, que chamamos de "montagem inteira horizontal". O protocolo preserva altamente a antigenicidade e permite a exploração completa de secções espessas da pele usando equipamentos de imagem confocal padrão. Este é um guia completo para usar a pele para processamento e imagem em tela transversal de tecido espesso, incluindo colheita de tecidos e criopreservação assistida com paraformaldeído (PFA) (passo 1), a geração de secções transversais de tecido de 100 μm de espessura com um criostato (passo 2) E rotulagem e montagem imunofluorescentes (passos 3 e 4). Os resultados representativos comparam as imagens confocais de duas técnicas distintas de preparação histológica: crioquecagem clássica e espessura, seção transversal de tecido 3D, destacando as vantagens de "montagens inteiras horizontais" para o usuário potencial desse protocolo.
Protocolo
Todas as experiências com animais foram sujeitas à aprovação ética local e realizadas nos termos de uma licença do governo do governo do Reino Unido.
1. Colheita de Pele e Criopreservação
- Preparativos.
- Prepare um prato de cultura de 100 mm com 25 mL de PFA a 4% e dois pratos de cultura de 100 mm com 25 mL de 1x solução salina tamponada com fosfato (PBS).
- Preencha os gemidos rectangulares em dois terços com o composto ótimo de temperatura de corte (OCT).
- Coloque uma placa de metal, em que os bloqueios crios podem ser colocados em um passo posterior, no congelador de -80 ° C.
- Colheita de pele, fixação e criopreservação.
- Aperte a região dorsal do cadáver de animais com uma máquina de barbear elétrica seca.
NOTA: Neste exemplo, utilizaram-se ratos Wildnot do dia 21 pós-natal. - Colher as áreas de interesse na pele.
NOTA: A região dorsomedial da pele do mouse ( Figura 1a) contém a maior porcentagem de folículos capilares uniformemente espaçados e alinhados, o que permite uma orientação ideal para seccionamento. A remoção do tecido não dérmico subjacente não é necessária, mas pode ser realizada se necessário. - Corte a pele colhida em pedaços retangulares de tamanho apropriado para se encaixar no fundo do criomold, levando em conta o crescimento direcional do grão folicular do cabelo.
NOTA: fatias de pele menores podem ser mais fáceis de manusear para noviços, uma vez que eles são menos propensos a emaranhar durante o processo de incubação e montagem. O exemplo mostrado aqui é uma área de ~ 1 cm 2 de pele dorsal, que se encaixa em um criomold de 22 x 30 x 20 mm ( Figura 2a ). - Corrija a pele à temperatura ambiente em 25 mL de PFA a 4% durante 10-30 min, dependendo da espessura das amostras de pele ( Figura 1b ).
- Lave as amostras de pele duas vezes em 25 mL de PBSDurante pelo menos 5 minutos cada ( Figura 1b ).
- Dab as amostras de pele em uma toalha de papel para drenar cuidadosamente o tecido de PBS em excesso, o que pode resultar em cristalização durante o processo de congelamento e pode afetar resultados de crioesecção.
NOTA: Não é necessário um gradiente de sacarose padrão. No entanto, isso também pode ser incorporado no protocolo, a critério do usuário. - Esteja ciente da orientação dos folículos capilares para cada amostra de pele. Use um microscópio de dissecação para assistência visual (especialmente qualquer pessoa que realize o protocolo pela primeira vez). Insira a amostra de pele no lombô cheio de OCT e equilibre todas as áreas da pele com a OCT, removendo as bolhas de ar anexadas à superfície do cabelo cortado usando fórceps ( Figuras 2a e 2b ).
- Empurre a pele até a parte inferior do bloco preenchido OCT de modo que fique nivelado com a parte inferior.
NOTA: A pele pode ser orientada em qualquer direção, umaEnquanto o grão do folículo capilar for observado para procedimentos de corte adequados. Os cryomolds serão re-orientados quando os blocos são anexados ao criostato para crioesecção. Marque a orientação do folículo capilar no cryomold, uma vez que este passo determina a orientação subsequente do corte do criostato. - Transfira os crioblos na placa de metal no congelador de -80 ° C para evitar flutuação e deslocamento do tecido.
- Monitore o processo de congelamento para manter a orientação da pele no fundo do criomold, uma vez que as bolhas de ar não vistas podem fazer com que a pele se eleve à superfície do cryomold.
NOTA: Cryomolds com tecido congelado podem ser armazenados por mais de um ano a -80 ° C e podem ser reutilizados para seções adicionais.
- Aperte a região dorsal do cadáver de animais com uma máquina de barbear elétrica seca.
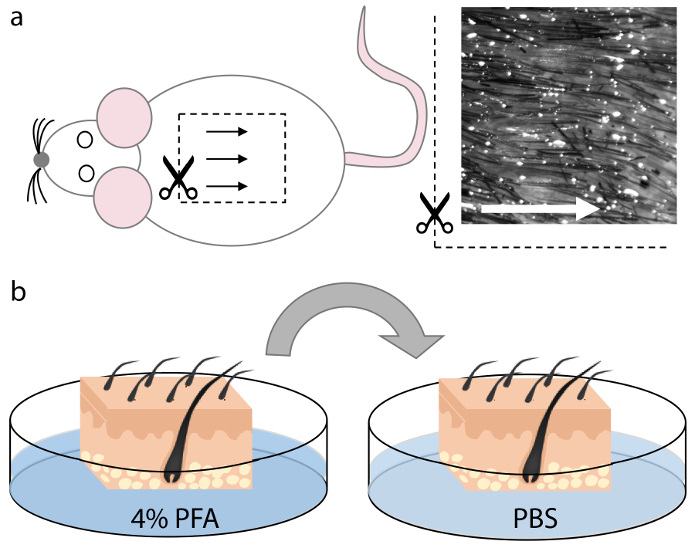
Figura 1. Colheita e fixação da pele do mouse.
(A) O tecido da pele foi removida da região dorsomedial do cadáver animal. Os folículos pilosos nesta região são uniformemente espaçados e alinhados e, portanto, permitem uma orientação ideal durante a seção, conforme indicado pelas setas. ( B ) Depois de cortar quadrados de um tamanho apropriado que se encaixa no criomol, o tecido da pele foi fixado em PFA a 4% durante 15 min e lavado duas vezes em PBS por 5 minutos cada. Clique aqui para ver uma versão maior desta figura.
2. Corte transversal de tecido grosso
- Preparação e orientação de tecido para montar no criostato.
- Prepare um prato de cultura de 100 mm com 15 mL de PBS. Coloque-o em uma área facilmente acessível no criostato. Além disso, prepare uma placa de 12 poços com 2,5 mL de PBS por poço; Etiqueta de acordo com as amostras para o armazenamento a longo prazo do seCortes a 4 ° C. Use fórceps para lidar com as seções.
- Ajuste a temperatura do criostato para -20 ° C.
NOTA: A temperatura pode afetar a seção, mas um bom guia é começar a -20 ° C. - Para obter seções aproximadamente dois folículos pilosos grossos, ajuste o criostato para cortar secções de 150 μm de espessura.
NOTA: A espessura da seção pode ser variada, dependendo das necessidades do usuário e das limitações do microscópio que serão usadas para análise.
NOTA: A orientação da amostra é fundamental para a obtenção de secções cutâneas com folhetos capilares na orientação apropriada. Isso é conseguido montando corretamente no bloco criostático. Certifique-se de que o plano de seção é paralelo à orientação do folículo capilar ( Figura 2c ). Como mencionado anteriormente, a orientação correta do plano de seção na amostra de pele é um passo crucial para determinar a qualidade das imagens que serão adquiridas emUm passo posterior.

Figura 2. Incorporação, criopreservação e seccionamento.
(A) A marcação da direção do folículo piloso (HF) no cryomold, indicada pelas setas pretas, é importante para a orientação adequada durante a criosecção. ( B ) O plano de seção precisa ser alinhado com a orientação do folículo capilar para gerar seções em que o comprimento completo dos folículos capilares permanece intacto. ( C ) As seções foram cortadas pela orientação do folículo capilar que foi indicada pelas setas pretas na Cryomold. ( D ) As secções transversais de tecido espesso foram coletadas com fórceps de metal e ( e ) transferidas para um prato de cultura de 100 mm contendo 1x PBS. ( F ) À temperatura ambiente, o PBS dissolve o OC.T. Composto que envolve as secções transversais espessas do tecido, conforme indicado pelas setas brancas. As seções então flutuam livremente no PBS. Clique aqui para ver uma versão maior desta figura.
- Crioesecção.
- Corte uma seção usando o criostato. Use fórceps para coletar o OCT que contém o pedaço de pele incorporado ( Figura 2d ).
NOTA: Use um criostato que permita movimentos e ajustes independentes ao longo dos eixos X, Y e Z para o posicionamento ideal da amostra. Isso permite a geração de secções transversais de tecido idealmente alinhadas. - Transfira a seção do criostato para o prato de cultura de 100 mm preenchido com PBS e continue com a próxima fatia. Não colete as amostras em um slide ( Figura 2e ).
NOTA: À temperatura ambiente, o PBS vai se dissolverO OCT, deixando fatias de pele fáceis de manusear com fórceps ( Figura 2f ).
NOTA: PBS fresco pode ser necessário no prato de cultura de 100 mm depois de dissolver muitas secções de tecido de 100 μm de espessura e pode ser alterada de acordo. - Use fórceps para transferir as secções de pele flutuante para o poço corretamente rotulado em uma placa de 12 poços preenchida com 2,5 mL de PBS ( Figura 3a , esquerda).
NOTA: A 4 ° C, as amostras podem ser armazenadas por pelo menos dois dias. Para o armazenamento a longo prazo de blocos OCT contendo a pele após a seccionação, selar a superfície de corte com uma gota de OCT fresco. Após o congelamento da gota de OCT, enrole o bloco OCT usado no parafilme e volte a colocá-lo no congelador -80 ° C .
- Corte uma seção usando o criostato. Use fórceps para coletar o OCT que contém o pedaço de pele incorporado ( Figura 2d ).
3. Rotulagem imunofluorescente.
- Prepare o tampão de PB (PBS suplementado com 0,5% de leite em pó desnatado, 0,25% de gelatina de pele de peixe e 0,5% de Triton X-100), leasT 2 h antecipadamente, como descrito anteriormente 5 .
NOTA: A azida de sódio pode ser adicionada ao tampão PB para a preservação do anticorpo para o uso repetido do tampão de coloração. - Escreva 1,5 mL de tubos de microcentrífuga e adicione 500 μL de tampão PB por tubo. Use cuidadosamente fórceps para transferir as fatias de pele do PBS para tubos separados contendo o tampão PB para bloqueio ( Figura 3a , direita). Certifique-se de que todas as fatias de pele estão totalmente submersas. Coloque os tubos de microcentrífuga em um balancim de serra de visão a velocidades não superiores a 10 oscilações por minuto, o que não deve interromper a integridade do tecido, durante 1 h à temperatura ambiente.
NOTA: É fundamental que a velocidade não exceda 10 oscilações por minuto na roda-viu, já que induzirá emaranhamento.- Embora seja possível adicionar mais de uma fatia por tubo de microcentrífuga, para economizar anticorpos, coloque apenas uma fatia por tubo. Para diminuir o uso de anticorpos, use um volumeDe 250 μL.
NOTA: Se necessário, substitua os tubos de microcentrífuga com, por exemplo, placas de 96 poços. No entanto, a colocação das secções transversais de tecido espesso em tubos de microcentrífuga de 1,5 mL permite a penetração de anticorpos mais efetiva no tecido devido à maior perturbação do líquido.
- Embora seja possível adicionar mais de uma fatia por tubo de microcentrífuga, para economizar anticorpos, coloque apenas uma fatia por tubo. Para diminuir o uso de anticorpos, use um volumeDe 250 μL.
- Rotule separadamente tubos de microcentrífuga de 1,5 mL para cada fatia de pele e adicione 500 μL de tampão PB e a quantidade apropriada de anticorpo primário. Após 1 h de bloqueio, transfira as fatias da pele para os tubos recém-preparados contendo os anticorpos. Incubar as fatias a 4 ° C durante a noite.
NOTA: Neste exemplo, foram utilizados os seguintes anticorpos primários: CD49f anti-humano de rato FITC a uma concentração de 1:50 e integrina alfa 8 de rato e ratazana de cabra a uma concentração de 1: 100. - No dia seguinte, prepare dois tubos de microcentrífuga separados de 1,5 mL contendo 500 μL de PBS por amostra. Lave as fatias da pele duas vezes por 1 h à temperatura do quartoE.
- Prepare tubos de microcentrífuga separados de 1,5 mL contendo 500 μL de tampão PB com a concentração apropriada de anticorpos secundários aplicáveis e 4 ', 6-diamidino-2-fenilindole (DAPI).
NOTA: Os anticorpos secundários utilizados neste exemplo são a IgG anti-ratazana Alexa Fluor 488 IgG e a IgG anti-cabra Alexa Fluor 555 a uma concentração de 1: 500. DAPI foi utilizado a uma concentração de 1: 100. - Transfira cuidadosamente as amostras de pele no tampão PB, que contém o anticorpo secundário e DAPI, e incuba as fatias da pele à temperatura ambiente durante 1 h a baixa velocidade em um rotador ou agitador.
- Armazene as fatias a 4 ° C no tampão PB contendo o anticorpo secundário e DAPI por até quatro dias, e possivelmente mais tempo se a azida de sódio for adicionada ao PBS.
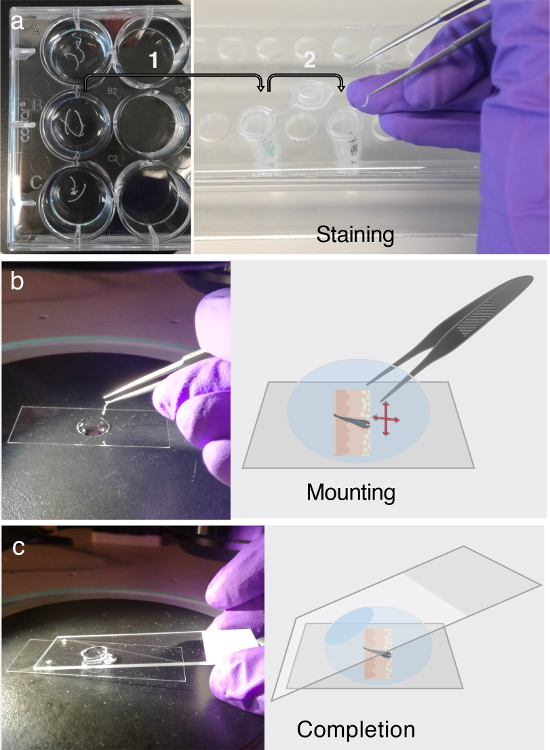
Figura 3. ImunofluorescRotulagem e montagem.
(A) As secções transversais de tecido flutuante pode ser armazenado em placas de 12 poços, durante pelo menos dois dias a 4 ° C. Antes da rotulagem imunofluorescente (IF), transfira as secções transversais do tecido de interesse para tubos de microcentrífuga de 1,5 mL contendo tampão PB para bloqueio, como indicado pela seta 1. Para a rotulagem IF, aderir ao procedimento multi-passo elaborado no passo 3. Cada Parte do passo 3 requer a transferência cuidadosa das secções transversais do tecido em tubos de microcentrífuga preparados recentemente contendo solução de anticorpo primário, solução de anticorpo secundário ou tampão de lavagem, o que é indicado pela seta 2. ( b ) Após a marcação IF, As secções são desratizadas e achatadas em uma gota de glicerol, usando a ajuda de um microscópio de dissecação. ( C ) Uma vez que a seção transversal do tecido é totalmente achatada na parte inferior de um deslizamento da tampa, uma lâmina de microscópio normal é usada para montar a seção. Clique aqui para ver uma versão maior deste número.
4. Montagem para visualização microscópica
- Antes da imagem, transfira as fatias de pele para tubos de microcentrífuga separados contendo 500 μL de PBS para lavar os anticorpos secundários e DAPI.
- Use uma pipeta de 1000 μL, mas corte os primeiros 0,5 cm da ponta da pipeta para permitir a pipetagem adequada do glicerol altamente viscoso. Coloque um lamínula de 22 x 50 mm sobre um fundo escuro sob um microscópio de dissecação ( Figura 3b ).
- Adicione uma gota de 100% de glicerol na folha de cobertura ( Figura 3b ). Transfira a fatia de pele do tubo de microcentrífuga para a gota de glicerol. Use o microscópio de dissecação e pinça pontiaguda para desenrolar cuidadosamente as fatias de pele que estão enroladas.
NOTA: À medida que a fatia flutua no glyGotícula de cerol, pode ser desenredada por persuadir a propensão natural do tecido para retornar à sua forma normal. Não force o alisamento não natural da fatia, pois isso pode causar danos ao tecido. - Monte o tecido uma vez que todo o comprimento da seção da pele esteja devidamente orientado e aplainado na tampa deslizante; Use um slide de microscópio normal. Este passo irá endireitar ainda mais a fatia da pele.
NOTA: Evite o aprisionamento de ar ( Figura 3c ). - Imagem na seção de pele montada em glicerol nos próximos dois dias.
NOTA: armazenamento prolongado influenciará negativamente a qualidade de tecido e imagem. Neste exemplo, todas as imagens foram adquiridas com um microscópio confocal vertical usando um objetivo de 20x.
Resultados
Para enfatizar as vantagens da nossa técnica, comparamos nossa espessa técnica de corte transversal de tecido 3D, "montagem inteira horizontal", para seções congeladas clássicas. Secções congeladas clássicas foram cortadas como descrito anteriormente 5 . Para fornecer uma estrutura visual para a epiderme nas imagens microscópicas, nós immunostained para integrina alfa-6 (Itga6), que é um componente que ancora células epidérmicas para a membrana basal subjacente 6 . Nós também rotulamos o músculo arrepiante pili (APM), responsável por piloerecção (também conhecida como "arrepios"), com integrina alfa-8 7 . Nas seções congeladas clássicas, a maioria dos folículos capilares visualizados com Itga6 não foram seccionados ao longo de todo o comprimento, gerando folículos pilosos predominantemente incompletos por seção, em comparação com montagens inteiras horizontais ( Figura 4a -4d ). As secções transversais de tecido espesso permitem adquirir mais camadas de pilha Z em comparação com seções convencionais de 10 μm, permitindo uma imagem 3D mais completa. Isso se torna ainda mais evidente ao estudar a integridade das APMs, que estão associadas aos folículos capilares e à membrana basal subjacente. Nas criosecções clássicas, a grande parcela das APMs foi fracionada ( Figura 4a -4d ). Além disso, a integridade tecidual do compartimento hipodérmico é preservada em montagens inteiras horizontais, em comparação com a destruição de adipócitos quando as criosecções são anexadas a lâminas de vidro quentes, que é um artefato de congelamento e descongelação bem conhecido ( Figura 4a -b , compare hipodérmico Regiões) 8 .
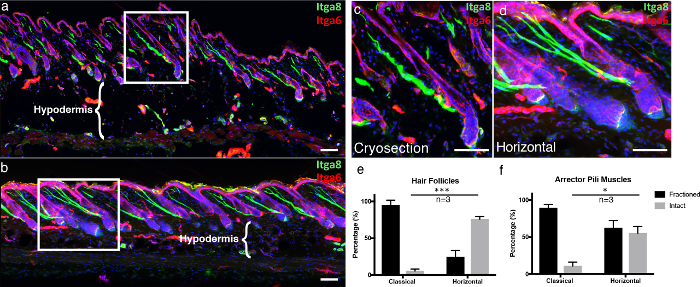
Figura 4. Manga inteira horizontalNt em comparação com uma criosecção clássica.
(A) pele Classicamente obtido criocortes 10? M e (b) 100? M de espessura de tecido 3D secções transversais foram marcadas com integrina alfa-6 (ITGA6) e integrina alfa-8 (Itga8) para visualizar os músculos grossas pili compartimento epidérmico e arrector , Respectivamente. As imagens das secções transversais do tecido espesso são representadas como projeções máximas de uma grande pilha Z. Os quadros brancos indicam as áreas que são ampliadas, exibidas em ( c ) as seções de montagem clássica e ( d ) horizontais inteiras. ( E ) folículos pilosos intactos e ( f ) os músculos pili intactos do arrecitador foram quantificados nas seções de montagem total clássica e horizontal. As barras de escala indicam 100 μm. Os dados são representados como média ± erro padrão da média (SEM). Uma seção por replicação biológica ( n = 3) foi quantificada. Teste t desempregado * P <0,05, *** P <0,0005. Clique aqui para ver uma versão maior desta figura.
Discussão
Here, we present the "horizontal whole mount" technique, which has several advantages over classical frozen sections. One advantage of our technique is that it can easily be performed with standard histology equipment and a confocal microscope. Second, the tissue integrity is preserved in a superior manner when compared to standard cryosections. For example, adipocytes within the hypodermal layer (i.e., dermal white adipocytes (DWAT))9 are severely disrupted in standard cryosections, which makes studying tissues that are adipose-laden impossible. Our technique allows for the full analysis of the adipocytes in this layer and may be adapted to other tissues with high adipocyte contents. Furthermore, this allows for the improved detection of mesenchymal cells in lineage-tracing studies 2,10.
Standard cryosections, by their very nature, can never reveal the true 3D aspects of a tissue through confocal microscopy. This means that thicker sections are advantageous in the analysis of skin, since hair follicles, as well as their substructures, can traverse a depth that exceeds the standard thickness of 10 µm used in classical crysosections. We are intrigued that other tissues, such as the intestine and brain, for example, possess similar challenges with regard to viewing the tissue as a 3D structure2,7,11,12,13. Intriguingly, our technique has already been shown to be beneficial for use in certain applications in the intestines14. We believe that our horizontal whole-mount protocol has the potential be applied to any other tissue requiring 3D analysis.
Divulgações
Os autores desejam divulgar que a publicação deste manuscrito foi financiada pela Thermo-Fisher Scientific Inc.
Agradecimentos
Os autores reconhecem o patrocínio da Thermo-Fisher Scientific e agradecem ao Nikon Imaging Center no Kings College London pelo apoio durante a aquisição de imagens confocais.
Materiais
| Name | Company | Catalog Number | Comments |
| PBS | homemade | ||
| Gelatin, from cold water fish skin | Sigma | G7765 | 250ML |
| Glycerol | BDH Laboratory Supplies | 444482V | |
| O.C.T. compound | VWR chemicals | 361603E | |
| Peel-A-Way embedding molds | Sigma | E6032-1CS | Square S-22 |
| Non-Fat Powdered Milk | Bio Basic Inc. | NB0669 | |
| Triton X-100 | Sigma | T9284 | 500ML |
| 4′,6-Diamidino-2-phenylindole, dilactate (DAPI) | Invitrogen | D3571 | |
| FITC Rat Anti-Human CD49f | BD Pharmingen | 555735 | |
| Mouse/Rat Integrin alpha 8 Antibody | R&D Systems | AF4076 | |
| Alexa Fluor 488 donkey anti-rat IgG | Life Technologies | A21208 | |
| Alexa Fluor 555 donkey anti-goat IgG | Life Technologies | A21432 | |
| CryoStar NX70 | Thermo Fisher Scientific | ||
| 100mm Culture dishes | |||
| Disposable scalpels | Swann-Morton | Ref 0501 | |
| pointed metal forceps | |||
| 1.5 ml microcentrifuge tubes | VWR | 211-2130 | |
| 12 Well plates | Sigma | CLS3513 | |
| Dissecting microscope | Nikon | ||
| 20 ul and 1000 ul Pipette | Gilson | ||
| 1000µl XL Graduated TipOne Filter Tip (Sterile) | Star Lab | S1122-1830 | |
| 20µl Bevelled TipOne Filter Tip (Sterile) | Star Lab | S1120-1810 | |
| Rocking shaker plate | |||
| Microscope slides, menzel Glaeser | Thermos Scientific | 631-9483 | Superfrost Plus |
| Cover Glasses, Menzel Glaeser | Thermos Scientific | MENZBB024060AB | 24 x 60 mm |
| Confocal microscope | Nikon |
Referências
- Plikus, M. V., et al. Cyclic dermal BMP signalling regulates stem cell activation during hair regeneration. Nature. 451 (7176), 340-344 (2008).
- Zhang, Y. V., Cheong, J., Ciapurin, N., McDermitt, D. J., Tumbar, T. Distinct self-renewal and differentiation phases in the niche of infrequently dividing hair follicle stem cells. Cell Stem Cell. 5 (3), 267-278 (2009).
- Jensen, U. B., Lowell, S., Watt, F. M. The spatial relationship between stem cells and their progeny in the basal layer of human epidermis: a new view based on whole-mount labelling and lineage analysis. Development. 126 (11), 2409-2418 (1999).
- Braun, K. M., et al. Manipulation of stem cell proliferation and lineage commitment: visualisation of label-retaining cells in wholemounts of mouse epidermis. Development. 130 (21), 5241-5255 (2003).
- Driskell, R. R., Giangreco, A., Jensen, K. B., Mulder, K. W., Watt, F. M. Sox2-positive dermal papilla cells specify hair follicle type in mammalian epidermis. Development. 136 (16), 2815-2823 (2009).
- Niculescu, C., et al. Conditional ablation of integrin alpha-6 in mouse epidermis leads to skin fragility and inflammation. Eur J Cell Biol. 90 (2-3), 270-277 (2011).
- Fujiwara, H., et al. The basement membrane of hair follicle stem cells is a muscle cell niche. Cell. 144 (4), 577-589 (2011).
- Desciak, E. B., Maloney, M. E. Artifacts in frozen section preparation. Dermatol Surg. 26 (5), 500-504 (2000).
- Driskell, R., Jahoda, C. A., Chuong, C. M., Watt, F., Horsley, V. Defining dermal adipose tissue. Exp Dermatol. 23 (9), 629-631 (2014).
- Driskell, R. R., et al. Distinct fibroblast lineages determine dermal architecture in skin development and repair. Nature. 504 (7479), 277-281 (2013).
- Snippert, H. J., Schepers, A. G., Delconte, G., Siersema, P. D., Clevers, H. Slide preparation for single-cell-resolution imaging of fluorescent proteins in their three-dimensional near-native environment. Nat Protoc. 6 (8), 1221-1228 (2011).
- Sada, A., et al. Defining the cellular lineage hierarchy in the interfollicular epidermis of adult skin. Nat Cell Biol. 18 (6), 619-631 (2016).
- Chung, K., Deisseroth, K. CLARITY for mapping the nervous system. Nat Methods. 10 (6), 508-513 (2013).
- Tetteh, P. W., et al. Replacement of Lost Lgr5-Positive Stem Cells through Plasticity of Their Enterocyte-Lineage Daughters. Cell Stem Cell. 18 (2), 203-213 (2016).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados