Method Article
Supporto orizzontale intero: un protocollo di elaborazione e imaging novello per le sezioni trasversali tessute spesse e tridimensionali della pelle
In questo articolo
Riepilogo
Questo lavoro presenta un nuovo protocollo di elaborazione e di imaging per un'analisi trasversale di tessuto tridimensionale che consente di sfruttare appieno le modalità di imaging confocale. Questo protocollo conserva l'antigenicità e rappresenta un sistema robusto per analizzare l'istologia cutanea e potenzialmente altri tipi di tessuti.
Abstract
L'elaborazione di un tessuto di interesse per generare un'immagine microscopica che supporta un argomento scientifico può essere impegnativa. L'acquisizione di immagini microscopiche di alta qualità non dipende interamente dalla qualità del microscopio, ma anche dai metodi di elaborazione dei tessuti, che spesso comportano azioni o passi multipli. Inoltre, i tipi di cellule mesenchimali nella pelle e negli altri tessuti rappresentano una nuova sfida per la preparazione e l'imaging dei tessuti. Qui presentiamo un processo completo, dalla raccolta dei tessuti alla microscopia. La nostra tecnica, chiamata "montatura orizzontale", è quella che i novizi possono rapidamente diventare competenti e che consente la conservazione e la rilevazione di antigeni in sezioni di spessore di 60-300 μm tagliate con un criostato. Le sezioni di questo spessore forniscono una migliore visualizzazione della microarchitettura del tessuto in un ambiente tridimensionale. Inoltre, il protocollo conserva le cellule mesenchimali in modo da migliorare la qualità dell'immagine quandoRispetto alle sezioni di criostato o paraffina standard, aumentando così l'efficacia e l'affidabilità dell'immunodellazione. Crediamo che questo protocollo beneficerà di tutti i laboratori che visualizzano la pelle e possibilmente altri tessuti e organi.
Introduzione
La rivoluzione dell'apparecchiatura di imaging microscopica prevede sofisticati strumenti di imaging ad alta risoluzione. Tuttavia, quando acquisisce un'immagine microscopica di una sezione trasversale del tessuto tridimensionale (3D) completa, la preparazione del campione presenta notevoli sfide e può essere il fattore limitante nella definizione della qualità dell'immagine. Ogni passo separato merita una considerazione attenta per preservare la morfologia del tessuto e l'antigenicità delle proteine bersaglio, per ridurre al minimo gli artefatti derivanti dalla trasformazione e per massimizzare la qualità dell'immagine finale. Ad esempio, l'analisi tradizionale della pelle richiede un'immagine in vista dell'epidermide e del derma, con follicoli piliferi che sono correttamente orientati, consentendo l'analisi anatomica dei contributi del compartimento delle cellule staminali all'omeostasi cutanea 1 , 2 . Ciò richiede una concentrazione approfondita su come la pelle sia incorporata e sezionata. Importante, i follicoli piliferi possono essere più spessoDi 100 μm, che supera notevolmente lo spessore della paraffina o dello spessore congelato, determinando uno standard inferiore di analisi rispetto ai montanti interi o alle sezioni trasversali 3 , 4 , 5 .
Considerati insieme, ogni fase di preparazione del campione per l'analisi microscopica è un determinante critico che influenzerà l'analisi delle immagini. Qui viene presentato un nuovo protocollo di elaborazione per l'analisi trasversale del tessuto 3D, che noi chiamiamo "montaggio orizzontale intero". Il protocollo altamente conserva l'antigenicità e consente il pieno sfruttamento di spessori della pelle usando apparecchiature standard per la formazione di immagini confocali. Questa è una guida completa per l'utilizzo della pelle per la lavorazione e l'imaging della sezione trasversale del tessuto spesso, inclusa la criopreservazione assistita da paraformaldehide (PFA) (fase 1), la generazione di sezioni trasversali di 100 μm con un criostato (passo 2) E l'etichettatura e il montaggio immunofluorescenti (punti 3 e 4). I risultati rappresentativi confrontano le immagini confocali di due distinte tecniche di preparazione istologica: la criocondazione classica e la sezione trasversale di tessuto 3D, spesso evidenziando i vantaggi di "montanti interni orizzontali" per il potenziale utente di questo protocollo.
Protocollo
Tutti gli esperimenti su animali sono stati sottoposti all'approvazione etica locale e sono stati eseguiti in base a una licenza Home Office del governo del Regno Unito.
1. Raccolta della pelle e criopreservazione
- I preparativi.
- Preparare un piatto di coltura da 100 mm con 25 ml di PFA al 4% e due piatti da 100 mm di coltura con 25 ml di soluzione salina con tampone fosfato (PBS).
- Riempire i criomodelli rettangolari di scorrimento per due terzi con composto ottimale della temperatura di taglio (OCT).
- Posizionare una piastra metallica, su cui i crioblocchi possono essere posizionati in una fase successiva, nel congelatore -80 ° C.
- Raccolta della pelle, fissazione e crioconservazione.
- Clip la regione dorsale del cadavere animale con un rasoio elettrico asciutto.
NOTA: In questo esempio sono stati utilizzati i topi selvatici tipo 21 del giorno postnatale. - Raccogli le aree di interesse sulla pelle.
NOTA: la regione dorsomediale della pelle del topo ( - Tagliare la pelle raccolta in pezzi rettangolari di dimensione appropriata per inserire nel fondo del criomolo, prendendo in considerazione la crescita direzionale del grano del follicolo pilifero.
NOTA: Le fette della pelle più piccole potrebbero essere più facili da gestire per i novizi, in quanto sono meno probabili confondere durante l'incubazione e il processo di montaggio. L'esempio mostrato qui è una superficie di circa 1 cm 2 di pelle dorsale, che si inserisce in un criomodo da 22 x 30 x 20 mm ( Figura 2a ). - Fissare la pelle a temperatura ambiente in 25 mL di 4% PFA per 10-30 minuti, a seconda dello spessore dei campioni della pelle ( Figura 1b ).
- Lavare i campioni della pelle due volte in 25 ml di PBSPer almeno 5 minuti ciascuno ( Figura 1b ).
- Sfilare i campioni di pelle su un tovagliolo di carta per scaricare con cautela il tessuto dell'eccesso di PBS, che può provocare la cristallizzazione durante il processo di congelamento e può influenzare i risultati della crisi.
NOTA: Non è richiesto un gradiente standard di saccarosio. Tuttavia, questo può anche essere incorporato nel protocollo a discrezione dell'utente. - Sii consapevole dell'orientamento dei follicoli piliferi per ogni campione di pelle. Utilizzare un microscopio di dissezione per l'assistenza visiva (in particolare chi esegue il protocollo per la prima volta). Inserire il campione della pelle nel criomolo riempito con OCT e bilanciare tutte le zone della pelle con OCT rimuovendo le bolle d'aria collegate alla superficie dei capelli tagliati con le pinze ( figure 2a e 2b ).
- Spingere la pelle nella parte inferiore del blocco OCT riempito in modo che si trovi in filo con il fondo.
NOTA: la pelle può essere orientata in qualsiasi direzione, aS lungo come il grano del follicolo pilifero è notato per le procedure di taglio corrette. I criomogeni saranno riorientati quando i blocchi sono attaccati al criostato per crioconservazione. Segnare l'orientamento del follicolo pilifero sul criomolo, poiché questo passo determina l'orientamento successivo del taglio del criosta. - Trasferire i criolablotti sulla piastra metallica nel congelatore -80 ° C per evitare galleggiamenti e dislocazione del tessuto.
- Monitorare il processo di congelamento per mantenere l'orientamento della pelle nella parte inferiore del criomolo, in quanto le bolle d'aria invisibili possono causare la pelle a salire sulla superficie del crioacollo.
NOTA: I cryomolds con tessuto congelato possono essere conservati per più di un anno a -80 ° C e possono essere riutilizzati per ulteriori sezioni.
- Clip la regione dorsale del cadavere animale con un rasoio elettrico asciutto.
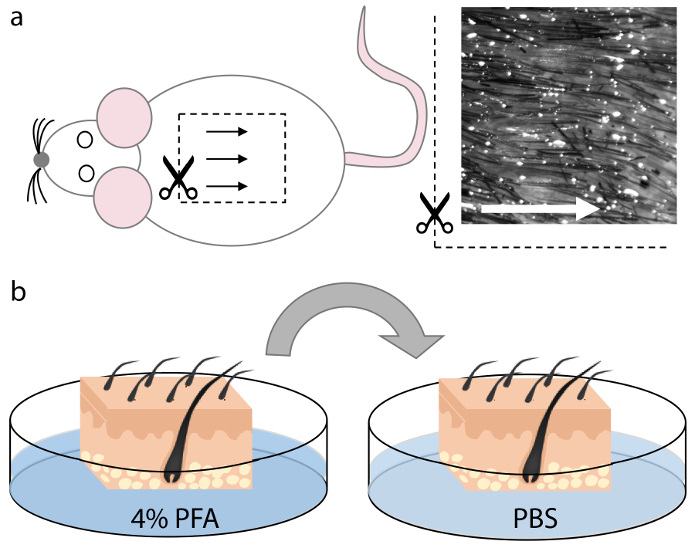
Figura 1. Raccolta e fissazione della pelle del mouse.
(A) tessuto cutaneo è stato raccolto dalla regione dorsomediale del cadavere dell'animale. I follicoli dei capelli in questa regione sono uniformemente distanziati e allineati e quindi consentono un orientamento ottimale durante la sezione, come indicato dalle frecce. B ) Dopo aver tagliato quadrati di una dimensione appropriata che si inserisce nel criomolo, il tessuto cutaneo è stato fissato in PFA al 4% per 15 minuti e lavato due volte in PBS per 5 minuti ciascuno. Clicca qui per visualizzare una versione più grande di questa figura.
2. Sezione trasversale del tessuto spessore
- Preparazione e orientamento del tessuto per montare sul criostato.
- Preparare un piatto di coltura da 100 mm con 15 ml di PBS. Mettere su un'area facilmente accessibile sul criostato. Inoltre, preparare una piastra da 12 pozzetti con 2,5 ml di PBS per pozzetto; Etichetta secondo i campioni per l'immagazzinamento a lungo termine del seA 4 ° C. Utilizzare pinze per gestire le sezioni.
- Regolare la temperatura del criostato a -20 ° C.
NOTA: La temperatura può influenzare la sezione, ma una buona guida deve iniziare a -20 ° C. - Per ottenere sezioni di circa due follicoli follicoli spessi, regolare il criostato per tagliare sezioni 150 μm di spessore.
NOTA: Lo spessore della sezione può essere variato, in funzione delle esigenze dell'utente e delle limitazioni del microscopio che verrà utilizzato per l'analisi.
NOTA: L'orientamento del campione è fondamentale per ottenere sezioni di pelle con follicoli piliferi nell'orientamento appropriato. Ciò è ottenuto montando correttamente sul blocco criostato. Assicurarsi che il piano di sezione sia parallelo all'orientamento del follicolo pilifero ( Figura 2c ). Come accennato in precedenza, l'orientamento corretto del piano di sezione nel campione della pelle è un passo cruciale per determinare la qualità delle immagini che saranno acquisite inUn passaggio successivo.

Figura 2. Embedding, cryopreservation e sectioning.
(A) La marcatura della direzione del follicolo pilifero (HF) sul criomodello, indicata dalle frecce nere, è importante per un corretto orientamento durante la criocondensazione. ( B ) Il piano di sezione deve essere allineato con l'orientamento del follicolo pilifero per generare sezioni in cui la lunghezza totale dei follicoli piliferi rimane intatta ( c ) Le sezioni sono state tagliate per orientamento del follicolo pilifero indicato dalle frecce nere sul cryomold. ( D ) Le sezioni trasversali del tessuto sono state raccolte con pinze metalliche e ( e ) trasferite in un piatto di coltura da 100 mm contenente 1x PBS. ( F ) A temperatura ambiente, il PBS si dissolve l'OC.T. Composto che circonda le sezioni trasversali del tessuto spesso, come indicato dalle frecce bianche. Le sezioni poi galleggiano liberamente nel PBS. Clicca qui per visualizzare una versione più grande di questa figura.
- Criosezionamento.
- Tagliare una sezione usando il criostato. Utilizzare pinze per raccogliere l'OCT che contiene il pezzo di pelle incorporato ( Figura 2d ).
NOTA: utilizzare un criostato che consente movimenti e regolazioni indipendenti lungo gli assi X, Y e Z per il posizionamento ottimale del campione. Ciò consente la generazione di sezioni trasversali del tessuto idealmente allineate. - Trasferire la sezione dal criostato nel piatto di coltura da 100 mm riempito con PBS e proseguire con la fetta successiva. Non raccogliere i campioni su una diapositiva ( Figura 2e ).
NOTA: a temperatura ambiente, il PBS si dissolveràIl PTOM, lasciando fette di pelle che sono facili da gestire con pinze ( Figura 2f ).
NOTA: PBS fresco può essere necessario nel piatto di coltura da 100 mm dopo aver dissolto molte sezioni di tessuto 100 μm e può essere modificato di conseguenza. - Utilizzare pinze per trasferire le sezioni di pelle galleggianti al pozzetto correttamente etichettato in una piastra a 12 pozzetti riempiti di 2,5 ml di PBS ( figura 3a , sinistra).
NOTA: a 4 ° C i campioni possono essere conservati per almeno due giorni. Per la conservazione a lungo termine di blocchi OCT contenenti pelle dopo la sezionatura, sigillare la superficie di taglio con una gocciolina di fresco OCT. Dopo il congelamento della gocce OCT, avvolgere il blocco OCT utilizzato in parafilm e riporlo nel congelatore -80 ° C .
- Tagliare una sezione usando il criostato. Utilizzare pinze per raccogliere l'OCT che contiene il pezzo di pelle incorporato ( Figura 2d ).
3. Etichettatura immunofluorescenti.
- Preparare il buffer PB (PBS integrato con 0,5% di latte scremato in polvere, 0,25% di gelatina di pesce e 0,5% di Triton X-100)T 2 h in anticipo, come descritto in precedenza 5 .
NOTA: L'azido di sodio può essere aggiunto al buffer PB per la conservazione degli anticorpi per l'uso ripetuto del tampone di colorazione. - Etichetta 1,5 ml di tubi di microcentrifuga e aggiungere 500 μl di buffer PB per tubo. Utilizzare attentamente le pinze per trasferire le fette della pelle dal PBS in tubi separati contenenti il buffer PB per bloccare ( Figura 3a , a destra). Assicurarsi che tutte le fette della pelle siano completamente sommerse. Posizionare i tubi di microcentrifuga su un bilanciere a sega a velocità non superiori a 10 oscillazioni al minuto, che non devono disturbare l'integrità dei tessuti, per 1 ora a temperatura ambiente.
NOTA: È fondamentale che la velocità non superi le 10 oscillazioni al minuto sul bilanciere della visiera, poiché indurirà la rottura.- Mentre è possibile aggiungere più di una fetta per tubo di microcentrifuga, per salvare gli anticorpi, inserire solo una fetta per tubo. Per diminuire l'utilizzo di anticorpi, utilizzare un volumeDi 250 μL.
NOTA: se necessario, sostituire i tubi di microcentrifuga con, ad esempio, piatti a 96 pozzetti. Tuttavia, il posizionamento delle sezioni trasversali di tessuto spesso in tubi di microcentrifuga da 1,5 ml consente la penetrazione più efficace nel tessuto a causa della maggiore perturbazione del liquido.
- Mentre è possibile aggiungere più di una fetta per tubo di microcentrifuga, per salvare gli anticorpi, inserire solo una fetta per tubo. Per diminuire l'utilizzo di anticorpi, utilizzare un volumeDi 250 μL.
- Etichettare separare i tubi da 1,5 ml di microcentrifuga per ogni fetta della pelle e aggiungere 500 μl di PB buffer e la quantità appropriata di anticorpi primari. Dopo 1 ora di blocco, trasferire le fette della pelle nei tubi appena preparati contenenti gli anticorpi. Incubare le fette a 4 ° C per una notte.
NOTA: In questo esempio sono stati utilizzati i seguenti anticorpi primari: FITC ratto anti-umano CD49f ad una concentrazione di 1:50 e capsula anti-mouse / ratto integrin alfa 8 ad una concentrazione di 1: 100. - Il giorno dopo, preparare due piccoli tubi di microcentrifuga da 1,5 ml contenenti 500 μL di PBS per campione. Lavare le fette della pelle due volte per 1 h a temperatura ambientee.
- Preparare separati tubi di microcentrifuga da 1,5 ml contenenti 500 μl di PB tampone con la concentrazione appropriata di anticorpi secondari applicabili e 4 ', 6-diammino-2-fenilindolo (DAPI).
NOTA: Gli anticorpi secondari utilizzati in questo esempio sono Alexa Fluor 488 asino anti-rat IgG e Alexa Fluor 555 asino anti-capra IgG a una concentrazione di 1: 500. DAPI è stato utilizzato ad una concentrazione di 1: 100. - Trasferire con cura i campioni della pelle nel tampone PB, che contiene l'anticorpo secondario e DAPI e incubare le fette della pelle a temperatura ambiente per 1 ora a bassa velocità su un rotatore o scuotitore.
- Memorizzare le fette a 4 ° C nel buffer PB contenente l'anticorpo secondario e DAPI per un massimo di quattro giorni e forse più a lungo se l'azide di sodio viene aggiunto al PBS.
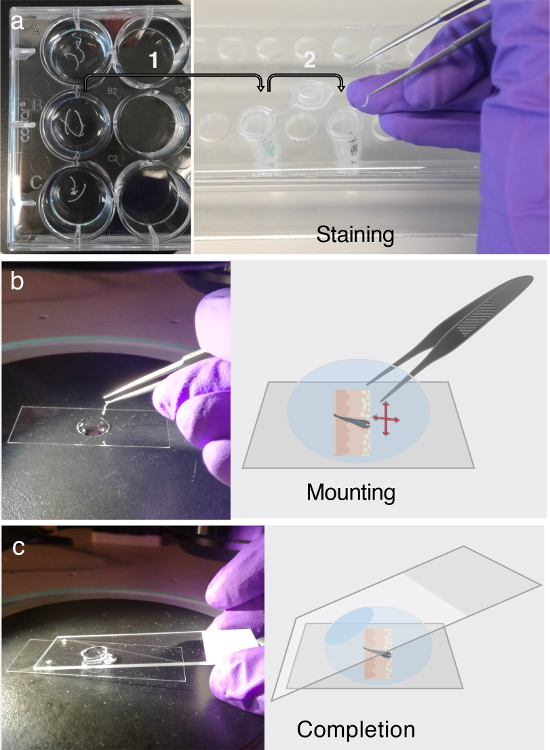
Figura 3. ImmunofluorescL'etichettatura e il montaggio.
(A) Le sezioni di tessuto galleggiante possono essere memorizzati in piastre da 12 pozzetti per almeno due giorni a 4 ° C. Prima dell'etichettatura immunofluorescenti (IF), trasferire le sezioni tissutali di interesse interessate in 1,5 mL di microcentrifuga contenenti tampone PB per il blocco, come indicato dalla freccia 1. Per l'etichettatura IF, attenersi alla procedura a più fasi elaborata al punto 3. Ogni Parte del passaggio 3 richiede l'attento trasferimento delle sezioni di tessuto in tubi di microcentrifuga appena preparati contenenti soluzione anticorpale primaria, soluzione anticorpale secondaria o tampone di lavaggio indicata dalla freccia 2. b ) Dopo l'etichettatura IF, Le sezioni vengono distrutte e appiattite in una gocciolina di glicerolo, utilizzando l'assistenza di un microscopio di dissezione. ( C ) Una volta che la sezione trasversale del tessuto è interamente appiattita sul fondo di una sfoglia di copertura, viene utilizzata una scorrevole normale del microscopio per montare la sezione. Fare clic qui per visualizzare una versione più grande di questa figura.
4. Montaggio per la visualizzazione microscopica
- Prima dell'immagine, trasferire le fette della pelle in tubi microcentrifuga separati contenenti 500 μL di PBS per lavare gli anticorpi secondari e DAPI.
- Usare una pipetta da 1000 μL ma tagliare i primi 0,5 cm della punta della pipetta per consentire la corretta pipettazione del glicerolo altamente viscoso. Posizionare una copertura di 22 x 50 mm su uno sfondo scuro sotto un microscopio di dissezione ( Figura 3b ).
- Aggiungere una gocciolina al glicerolo al 100% sullo scorrimento della copertura ( figura 3b ). Trasferire la fetta della pelle dal tubo di microcentrifuga sulla gocce di glicerolo. Utilizzare il microscopio di dissezione e le punte appuntite per disinnestare con attenzione le fette della pelle che sono arricciate.
NOTA: quando la fetta galleggia nell'aggCerolo, può essere incastrato dal coassificare la naturale propensione del tessuto per ritornare alla sua forma normale. Non forzare il raddrizzamento innaturale della fetta, in quanto ciò potrebbe causare danni al tessuto. - Montare il tessuto una volta che l'intera lunghezza della sezione della pelle sia correttamente orientata e appiattita sullo scivolo della copertura; Utilizzare una diapositiva normale del microscopio. Questa fase consente di raddrizzare ulteriormente la fetta della pelle.
NOTA: Evitare l'entrapimento dell'aria ( Figura 3c ). - Inserire le sezioni della pelle in glicerolo nei prossimi due giorni.
NOTA: L'archiviazione prolungata influenzerà negativamente la qualità del tessuto e dell'immagine. In questo esempio, tutte le immagini sono state acquisite con un microscopio confocale verticale usando un obiettivo di 20x.
Risultati
Per sottolineare i vantaggi della nostra tecnica, abbiamo confrontato la nostra tecnica di crociatura 3D, "montatura orizzontale intera", a sezioni classiche congelate. Le sezioni congelate classiche sono state tagliate come descritto in precedenza 5 . Per fornire una struttura visiva per l'epidermide in immagini microscopiche, abbiamo immaginato per l'integrin alfa-6 (Itga6), che è un componente che ancora le cellule epidermiche alla membrana basale sottostante 6 . Abbiamo anche etichettato l'arretro pili muscle (APM), che è responsabile della piloerection (conosciuta anche come "goosebumps"), con integrin alpha-8 7 . Nelle sezioni congelate classiche, la maggior parte dei follicoli piliferi visualizzati con Itga6 non sono stati tagliati lungo tutta la lunghezza, generando follicoli piliferi prevalentemente incompleti per sezione, rispetto ai montanti interni orizzontali ( Figura 4a- 4d ). Le sezioni trasversali del tessuto spesso consentono di acquisire ulteriori livelli di Z-stack rispetto ai tradizionali sezioni di 10 μm, consentendo un'immagine 3D più completa. Ciò diventa ancora più evidente quando si studia l'integrità di APM, associati ai follicoli piliferi e alla membrana sovrastante. Nelle criose classiche, la vasta parte di APM è stata frazionata ( Figura 4a- 4d ). Inoltre, l'integrità tissutale del compartimento ipodermico è conservata in montanti orizzontali, rispetto alla distruzione degli adipociti, quando le criose sono collegate a vetrate calde, che è un noto artefatto di congelamento e scongelamento ( Figura 4a- b , confronta ipodermica Regioni) 8 .
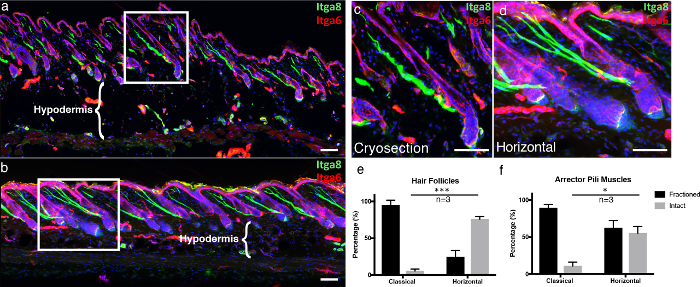
Figura 4. Mou orizzontale interoNt rispetto ad una crisi classica.
(A) rivestimento classico ottenuto criosezioni 10 um (b) 100 um di spessore del tessuto 3D sezioni sono state marcate con integrina alfa-6 (Itga6) e integrina alfa-8 (Itga8) per visualizzare le vano epidermica e arrector muscoli spessi e Pili , Rispettivamente. Le immagini delle sezioni trasversali del tessuto spesso sono rappresentate come proiezioni massime di un grande stack Z. I fotogrammi bianchi indicano le aree ingrandite, visualizzate in ( c ) le sezioni di montaggio classiche e ( d ) orizzontali. ( E ) i follicoli dei capelli intatti e ( f ) i muscoli intestinali del pili sono stati quantificati sia nelle sezioni classiche che orizzontali. Le barre di scala indicano 100 μm. I dati sono rappresentati come Medio ± errore standard del valore medio (SEM). Una sezione per replicazione biologica ( n = 3) è stata quantificata. T-test non accoppiato * P <0,05, *** P <0,0005. Clicca qui per visualizzare una versione più grande di questa figura.
Discussione
Here, we present the "horizontal whole mount" technique, which has several advantages over classical frozen sections. One advantage of our technique is that it can easily be performed with standard histology equipment and a confocal microscope. Second, the tissue integrity is preserved in a superior manner when compared to standard cryosections. For example, adipocytes within the hypodermal layer (i.e., dermal white adipocytes (DWAT))9 are severely disrupted in standard cryosections, which makes studying tissues that are adipose-laden impossible. Our technique allows for the full analysis of the adipocytes in this layer and may be adapted to other tissues with high adipocyte contents. Furthermore, this allows for the improved detection of mesenchymal cells in lineage-tracing studies 2,10.
Standard cryosections, by their very nature, can never reveal the true 3D aspects of a tissue through confocal microscopy. This means that thicker sections are advantageous in the analysis of skin, since hair follicles, as well as their substructures, can traverse a depth that exceeds the standard thickness of 10 µm used in classical crysosections. We are intrigued that other tissues, such as the intestine and brain, for example, possess similar challenges with regard to viewing the tissue as a 3D structure2,7,11,12,13. Intriguingly, our technique has already been shown to be beneficial for use in certain applications in the intestines14. We believe that our horizontal whole-mount protocol has the potential be applied to any other tissue requiring 3D analysis.
Divulgazioni
Gli autori vorrebbero rivelare che la pubblicazione di questo manoscritto è stata finanziata da Thermo-Fisher Scientific Inc.
Riconoscimenti
Gli autori riconoscono la sponsorizzazione da Thermo-Fisher Scientific e ringraziano il Centro Imaging Nikon di Kings College London per il supporto durante l'acquisizione di immagini confocali.
Materiali
| Name | Company | Catalog Number | Comments |
| PBS | homemade | ||
| Gelatin, from cold water fish skin | Sigma | G7765 | 250ML |
| Glycerol | BDH Laboratory Supplies | 444482V | |
| O.C.T. compound | VWR chemicals | 361603E | |
| Peel-A-Way embedding molds | Sigma | E6032-1CS | Square S-22 |
| Non-Fat Powdered Milk | Bio Basic Inc. | NB0669 | |
| Triton X-100 | Sigma | T9284 | 500ML |
| 4′,6-Diamidino-2-phenylindole, dilactate (DAPI) | Invitrogen | D3571 | |
| FITC Rat Anti-Human CD49f | BD Pharmingen | 555735 | |
| Mouse/Rat Integrin alpha 8 Antibody | R&D Systems | AF4076 | |
| Alexa Fluor 488 donkey anti-rat IgG | Life Technologies | A21208 | |
| Alexa Fluor 555 donkey anti-goat IgG | Life Technologies | A21432 | |
| CryoStar NX70 | Thermo Fisher Scientific | ||
| 100mm Culture dishes | |||
| Disposable scalpels | Swann-Morton | Ref 0501 | |
| pointed metal forceps | |||
| 1.5 ml microcentrifuge tubes | VWR | 211-2130 | |
| 12 Well plates | Sigma | CLS3513 | |
| Dissecting microscope | Nikon | ||
| 20 ul and 1000 ul Pipette | Gilson | ||
| 1000µl XL Graduated TipOne Filter Tip (Sterile) | Star Lab | S1122-1830 | |
| 20µl Bevelled TipOne Filter Tip (Sterile) | Star Lab | S1120-1810 | |
| Rocking shaker plate | |||
| Microscope slides, menzel Glaeser | Thermos Scientific | 631-9483 | Superfrost Plus |
| Cover Glasses, Menzel Glaeser | Thermos Scientific | MENZBB024060AB | 24 x 60 mm |
| Confocal microscope | Nikon |
Riferimenti
- Plikus, M. V., et al. Cyclic dermal BMP signalling regulates stem cell activation during hair regeneration. Nature. 451 (7176), 340-344 (2008).
- Zhang, Y. V., Cheong, J., Ciapurin, N., McDermitt, D. J., Tumbar, T. Distinct self-renewal and differentiation phases in the niche of infrequently dividing hair follicle stem cells. Cell Stem Cell. 5 (3), 267-278 (2009).
- Jensen, U. B., Lowell, S., Watt, F. M. The spatial relationship between stem cells and their progeny in the basal layer of human epidermis: a new view based on whole-mount labelling and lineage analysis. Development. 126 (11), 2409-2418 (1999).
- Braun, K. M., et al. Manipulation of stem cell proliferation and lineage commitment: visualisation of label-retaining cells in wholemounts of mouse epidermis. Development. 130 (21), 5241-5255 (2003).
- Driskell, R. R., Giangreco, A., Jensen, K. B., Mulder, K. W., Watt, F. M. Sox2-positive dermal papilla cells specify hair follicle type in mammalian epidermis. Development. 136 (16), 2815-2823 (2009).
- Niculescu, C., et al. Conditional ablation of integrin alpha-6 in mouse epidermis leads to skin fragility and inflammation. Eur J Cell Biol. 90 (2-3), 270-277 (2011).
- Fujiwara, H., et al. The basement membrane of hair follicle stem cells is a muscle cell niche. Cell. 144 (4), 577-589 (2011).
- Desciak, E. B., Maloney, M. E. Artifacts in frozen section preparation. Dermatol Surg. 26 (5), 500-504 (2000).
- Driskell, R., Jahoda, C. A., Chuong, C. M., Watt, F., Horsley, V. Defining dermal adipose tissue. Exp Dermatol. 23 (9), 629-631 (2014).
- Driskell, R. R., et al. Distinct fibroblast lineages determine dermal architecture in skin development and repair. Nature. 504 (7479), 277-281 (2013).
- Snippert, H. J., Schepers, A. G., Delconte, G., Siersema, P. D., Clevers, H. Slide preparation for single-cell-resolution imaging of fluorescent proteins in their three-dimensional near-native environment. Nat Protoc. 6 (8), 1221-1228 (2011).
- Sada, A., et al. Defining the cellular lineage hierarchy in the interfollicular epidermis of adult skin. Nat Cell Biol. 18 (6), 619-631 (2016).
- Chung, K., Deisseroth, K. CLARITY for mapping the nervous system. Nat Methods. 10 (6), 508-513 (2013).
- Tetteh, P. W., et al. Replacement of Lost Lgr5-Positive Stem Cells through Plasticity of Their Enterocyte-Lineage Daughters. Cell Stem Cell. 18 (2), 203-213 (2016).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon