Method Article
Péptidos antimicrobianos producidos por presión selectiva incorporación de aminoácidos no-canónico
* Estos autores han contribuido por igual
En este artículo
Resumen
El protocolo presenta la Escherichia coli-basado presión selectiva incorporación de aminoácidos no-canónico (ncAAs) el lactococcal péptidos antimicrobianos nisina. Sus propiedades pueden cambiarse durante la expresión recombinante mediante sustitución con ncAAs deseado en medios de crecimiento definido. Cambios resultantes en la bioactividad se asignan por ensayos de inhibición de crecimiento y microscopía de fluorescencia.
Resumen
La naturaleza tiene una gran variedad de posibilidades para crear nuevas funciones de la proteína modificando la secuencia de los bloques de aminoácidos individuales. Sin embargo, todas las variaciones se basan en los 20 aminoácidos canónicos (cAAs). Como una manera de introducir propiedades físico-químicas adicionales en polipéptidos, la incorporación de los aminoácidos no-canónico (ncAAs) se utiliza cada vez más en ingeniería de proteínas. Debido a su longitud relativamente corta, la modificación de los péptidos ribosomally sintetizadas y postraduccional modificados por ncAAs es particularmente atractiva. Nuevas funcionalidades y manijas química pueden ser generados por modificaciones específicas de los residuos. El método de incorporación (SPI) de la presión selectiva utiliza cepas host auxotrófica que carecen de un aminoácido esencial en medios de cultivo químicamente definido. Varios análogos de aminoácidos estructuralmente y químicamente similares entonces pueden ser activados por el correspondiente aminoacil-tRNA sintetasa y proporcionan residuos específicos cAA(s) sustituciones de ncAA(s) → en la secuencia del péptido o proteína objetivo. Aunque, en el contexto del método SPI, ncAAs también se incorporan en el proteoma de anfitrión durante la fase de expresión de genes recombinantes, la mayoría de los recursos de la célula se asigna a la expresión del gen objetivo. Esto permite la eficiente incorporación de residuos específicos de ncAAs acompañadas con altas cantidades de blanco modificado. El trabajo presentado describe la incorporación en vivo de seis análogos de prolina en el péptido antimicrobianos nisina, un lantibiotic natural producido por Lactococcus lactis. Propiedades antimicrobianas de la nisina se pueden cambiar y ampliados durante su fermentación y expresión en auxotrófica Escherichia coli cepas en medios de crecimiento definido. Por lo tanto, los efectos de la sustitución de residuo específico de cAAs con ncAAs pueden ofrecer cambios en especificidad y actividad antimicrobiana. Ensayos de actividad antimicrobiana y microscopía de fluorescencia se utilizan para probar las nuevas variantes de nisina para la inhibición del crecimiento de una cepa de indicador grampositivas Lactococcus lactis . Espectroscopía de masas se utiliza para confirmar la incorporación de la ncAA en variantes de nisina bioactivos.
Introducción
El descubrimiento de los antibióticos en el siglo XX y el desarrollo paralelo de nuevos compuestos antimicrobianos frente a microorganismos patógenos activados concentrado en tratamientos de infecciones bacterianas. Sin embargo, debido a la aparición de patógenos multirresistentes como resistente a la meticilina Staphylococcusaureus (MRSA), enterococos resistentes a vancomicina (VRE), MDR (multirresistente) Salmonella typhimurium fago tipo 10 (DT10 ), y Klebsiella pneumoniae, es urgentemente necesario generar nuevos agentes antimicrobianos1. Péptidos antimicrobianos (AMPs) son compuestos versátiles, a menudo altamente específicos que son candidatos promisorios para el desarrollo de nuevos fármacos, gracias a sus propiedades fisicoquímicas, flexibilidad, tamaño, hidrofobicidad y modo de acción2. Amplificadores son pequeños péptidos de aminoácidos 7-100. A menudo, tienen una estructura catiónica rica en residuos arginina y lisina cargados positivamente, que interactúan con la membrana celular microbiana específica, que es3con carga opuesta. Un subgrupo particular de amperios son péptidos sintetizados ribosomally y posttranslationally modificado (RiPPs)4. Estos son producidos por muchos de los organismos del Reino de los hongos y el dominio de las bacterias. Uno de los RiPPs más conocido y ampliamente utilizado es la nisina, producida naturalmente por la bacteria del ácido láctico Lactococcus lactis (L. lactis). Activo frente a un grupo de bacterias Gram-positivas, la nisina se ha utilizado como bioconservante alimentario durante más de 50 años debido a sus propiedades antimicrobianas y la ausencia de evolucionado resistencia en las cepas microbianas específicas5. Estudios han demostrado que la nisina desestabiliza y genera poros en membranas de la célula bacterianas, una actividad antimicrobiana contra ambos patógenos grampositivos y gramnegativos6. Por Unión al lípido II, síntesis de la pared celular bacteriana es inhibido7. La nisina es codificada por nisA como un péptido precursor lineal, que se compone de un líder y una región del péptido del núcleo (figura 1). Después de síntesis ribosomal, prenisin en primer lugar modifica la deshidratasa NisB. Aquí, residuos de serina y treonina en la región de la base prepeptide se deshidratan a dehydroalanine (Dha) y dehydrobutyrine (Dhb)8. Posteriormente, se juntan los residuos deshidratados con cisteína a anillos de lanthionine forma (de ahí el nombre "lantibiotic" de antibióticos que contienen anillo de lanthionine) por una adición de Michael catalizada por la enzima. Esta modificación postraduccional (PTM) es catalizada por la ciclasa NisC. En L. lactis, el prenisin modificado es transportado fuera de la célula por el transportador de NisT, y el péptido líder es hendido por la proteinasa NisP para liberar la nisina maduro y activo formulario9. La peptidasa del líder responsable NisP tiene una especificidad de sustrato alta, puesto que sólo los procesos modificación nisina eficientemente10.
En general, RiPPs activadas resultado de la acción de enzimas PTM (por ejemplo NisBC), que aumentan drásticamente el espacio químico de péptidos cortos, por ejemplo, mediante acetilación, glicosilación, metilación o fosforilación. Este nivel de complejidad puede ser ampliado por la incorporación directa de ncAAs. Mientras que a menudo es factible, síntesis química de amperios es un desafío para la producción a gran escala debido a su complejidad estructural. Por ejemplo, se logró la síntesis química total de lo lactosin lantibiotic S en 71 pasos de reacción con un rendimiento final del 10% y la de nisina con una producción bruta de sólo 0.003%11,12. Por lo tanto, la producción biológica ofrece una alternativa viable, debido a la generación de estereocentros correcto y producto de alta concentración.
Hasta hoy, ncAAs más de 150, por ejemplo, con grupos funcionales que contengan flúor o azidas, se han incorporado a proteínas recombinantes, y varios ejemplos de ncAA-modificado AMPs han reportado13,14, 15,16. Con la introducción de ncAAs, pueden generarse nuevas propiedades fisicoquímicas comparado con mutagénesis convencional. La diversidad de los péptidos puede ser aumentada, posiblemente llevando a nuevos antibióticos.
Un método para la incorporación de ncAAs péptidos recombinantes es incorporación de presión selectiva (SPI) basado en el uso de cepas bacterianas auxotrófica17. Estas cepas no son capaces de sintetizar el correspondiente análogo de la cAA de la ncAA. La metodología utiliza la especificidad de sustrato relajado observada con frecuencia, una característica de muchos naturales de aminoacil-tRNA sintetasas (aaRSs)18. Aparte de sus substratos naturales de cAA, estas enzimas suelen ser capaces de reconocer y activar la ncAA deseada y para cargar a sus cognado tRNA(s). Esto conduce a incorporación ribosomal de la ncAA en el producto del gene blanco de una manera específica de residuos (es decir, sustitución de ncAA de cAA →). Esto por supuesto sólo es posible cuando la ncAA deseada es estructural y químicamente similar a los aminoácidos canónicos y tolerado por la fisiología de la célula, la maquinaria de traducción y la secuencia de péptidos o proteínas de destino. En una particular configuración experimental, las células hospedadoras auxotrófica se cultivan en medio definido suministrado con una concentración limitante del aminoácido nativo a sustituirse. El crecimiento celular o intercambio por medio sin cAA conduce a depleción intracelular de la cAA. En el siguiente paso, se agrega la ncAA y se induce la expresión del gen objetivo. Inevitablemente, ncAAs son ahora también incorporadas en muchas otras proteínas en la célula huésped durante esta fase de la expresión del gen objetivo. Sin embargo, la toxicidad de la configuración del SPI se mantiene en un nivel bajo ya que la cepa de Escherichia coli (e. coli) es transformada con un plásmido portador del gen de destino bajo el control de un promotor fuerte (comúnmente el promotor T7 altamente competitivo / Sistema de la polimerasa del RNA)19. Inmediatamente después de la inducción (generalmente cuando se agota la cAA), el anfitrión las células dejan de crecer y su maquinaria enzimática citoplasmática se utilizan principalmente para la expresión del gen objetivo basado en el plásmido. Mutagénesis sitio-dirigida puede utilizarse para definir el sitio de instalación de ncAA de residuos específicos en el gen blanco del20.
Como un péptido de modelo para la incorporación de ncAAs, ha elegido la pentacíclicos AMP nisina A. Es 34 aminoácidos de largo y tiene solamente un residuo de prolina solo en la secuencia del péptido de base (figura 1). Subtilisin, ericin A y S y epidermin, así como en la nisina Z y Q la nisina, la prolina conservada parece ser esencial para la actividad9,21. La prolina cAA desempeña un papel particularmente importante en peptidil-prolil amida rotación y estabilización de la estructura secundaria. Su cadena lateral del anillo conformaciones (exo / endo arrugas) son responsables de una estabilización termodinámica del enlace amida. Modificaciones químicas específicas (como hydroxylations, fluorinations, metilaciones) de prolil arrugas influyen a menudo críticamente la plegable estabilidad, rigidez del andamio y funciones de muchas estructuras biológicas22. Por lo tanto, es plausible esperar que la sustitución analógica Pro→ prolina dotará anillo B, el segundo anillo de la nisina, con propiedades inusuales y novela.
Aquí, una prolina auxotrófica cepa de e. coli se utilizó para la producción de nisina recombinante. Esto requiere la expresión de la gen prepeptide nisA así como la modificación de genes enzima nisBC. El producto de péptido genéticamente codificada lleva un N-terminal su etiquetado líder para cromatografía de purificación por afinidad. Para la determinación de la actividad, L. lactis expresar y secretar NisPT se utiliza para activar las variantes recombinantes nisina de lysates de la célula de e. coli o péptido purificado muestras (figura 1). La AMP madura es liberada después de hendidura del líder por NisP. En este método de difusión en agar, la muestra de AMP se difunde en el medio de crecimiento sólido y puede inhibir el crecimiento de los microorganismos gram-positivos. Después de la incubación, eso puede ser observado visualmente por halos de inhibición de crecimiento. Además de L. lactis como indicador, modificado nisina variantes demostradas actividad antimicrobiana frente a Enterococcus faecalis, Staphylococcus aureus y Bacillus cereus, Lactobacillus johnsonii 21,23.
Un método alternativo y experimental diferente incorporar ncAAs en RiPPs es el codón de stop supresión (SCS)24. Para esto, un tRNA ortogonal par de aminoacil-tRNA sintetasa (aaRS) se requiere para la ncAA correspondiente. Idealmente, estos tres componentes son bioorthogonal, es decir, no interactúan con los tRNAs y aaRSs endógena. Un aaRS ncAA-específica puede ser generada por la modificación del sitio activo de enzima y de la investigación de bibliotecas genéticas de sintetasas mutante25. Además, la introducción de un ncAA requiere un codón que es reasignado y que no codifica para la cAA. Comúnmente, el codón ámbar es utilizado24,26.
Recientemente, el SPI fue establecido para la incorporación de ncAAs que contiene α-chloroacetamide y haga clic en química compatible con NisA27. Por ejemplo, Nε- alloc-lisina fue incorporado a la captistruin de péptido de lasso con site-specific (SCS) y métodos de incorporación de residuos específicos (SPI) y posteriormente modificado in vitro por metátesis de rutenio-catalizada28 . En comparación con el SPI, el método SCS es más complicado desde un tRNA ortogonal / aaRS par tiene que ser expresada conjuntamente. Hasta la fecha, pares o para la incorporación de prolina han desarrollado29, pero a lo mejor de nuestro conocimiento, ningún ejemplo de incorporación análogos de prolina se ha divulgado.
Cabe señalar que no todos ncAAs puede incorporar la metodología SPI. En primer lugar, la captación de ncAAs en el citoplasma está regulada por una multitud de proteínas de transporte que están incrustados en la membrana citoplasmática, que es la membrana interna de bacterias gramnegativas como e. coli. Normalmente, e. coli es capaz de transportar una amplia gama de análogos de aminoácidos en la célula con cadenas laterales estructuralmente y químicamente similar a los aminoácidos canónicos. Segundo, muchos ncAAs químicamente reactivas o inestables puede actuar como un inhibidor de crecimiento celular, ya que son tóxicos para el metabolismo y la fisiología del anfitrión célula30. Por lo tanto, la absorción y la toxicidad de la ncAA para el host de producción deben probarse previamente. Para evitar la inactivación de la maquinaria de la PTM como efecto secundario, una configuración de estricto control de la expresión de los genes responsables se puede utilizar para incorporar el aminoácido natural de las enzimas de modificación (por ejemplo, nisBC) y la ncAA en el gene de la blanco ( por ejemplo, nisA). Esto puede lograrse usando dos diferentes promotores y la inducción de la expresión de genes blanco, como se demuestra en de protocolos SPI diseñadas31. Como se indicó anteriormente, el método SPI se basa en la especificidad de sustrato relajado de la aaRS, que permite activación de ncAA y los Tarn cognado de carga. Posteriormente, el tRNA se entrega al ribosoma seguida por la formación de enlace amida y plegable del péptido de destino (poly). En estos procesos, los mecanismos de edición y corrección de textos pueden convertirse en relevantes32. Por estas razones, es de gran importancia tener un objetivo de ncAA que es estructural y químicamente similar a la cAA. Otros puntos cruciales son suficiente estabilidad (tanto en los medios de crecimiento y el metabolismo celular) y la solubilidad de la ncAA. Además, debe ser comercialmente disponibles o fáciles de ser sintetizados químicamente.
Aquí, describimos un protocolo para SPI, permitiendo la incorporación de residuos específicos de ncAAs en RiPPs recombinante. Particularmente, análogos de prolina diferentes se incorporan a la péptidos antimicrobianos nisina A utilizando e. coli como organismo anfitrión. Espectrometría de masas se utiliza para comprobar la sustitución de aminoácidos y péptidos productos son analizados para bioactividad mediante ensayos de inhibición de crecimiento y microscopia de fluorescencia utilizando cepas microbianas indicador.
El requisito básico para la expresión de éxito nisina recombinante con ncAAs definido requiere una prolina conveniente auxotrófica cepa de e. coli . Para ello auxotrophy, proA tiene que ser disfuncional, por ejemplo mediante la genómica nocaut. Las células completamente privan de biosíntesis intracelular de Pro (es decir, eliminación de proABC) sin posibilidad de reversión son auxotrophs estables. Ampliamente utilizado gene knockout métodos son transducción fago o knockout del gen único según Datsenko & Wanner33. Además, las cepas de nocaut de proA pueden obtenerse de repositorios públicos como Addgene, CGSC o la colección de Keio. Puesto que la expresión recombinante nisABC que se muestra a continuación se basa en el uso de promotores de la T7, la cepa de expresión host tiene que llevar un gene inducible para T7 ARN polimerasa. Esto puede lograrse por la introducción de la prophage λDE3 en el genoma del anfitrión, por ejemplo utilizando el kit comercial. Como alternativa, pueden hacer cepas como el BL21(DE3) auxotrófica como se describió anteriormente.
Protocolo
1. clonación de vectores de expresión y transformación de una cepa de producción auxotrófica
Aquí, los genes para la biosíntesis de la nisina, es decir, nisABC, han sido tomados de L. lactis y transferido en vectores plásmido T7-basado de la expresión. Completas secuencias de ADN de nisABC se pueden encontrar en GenBank entrada X6830734. El gen del péptido precursor (nisA) ha sido colocado en un vector pET-3a que confiere resistencia a la ampicilina. Genes de la dehidratasa (nisB) y ciclasa (nisC) se han colocado en vector pRSFDuet-1, como divulgado anterior35, que confiere resistencia a la kanamicina.
Nota: Para nisA, fueron mutados los codones de los últimos cuatro aminoácidos (ASPR) de la secuencia líder para codificar VSLRS36 para procesar el residuo de la prolina en el péptido de núcleo único y para prepeptide correcto procesamiento por NisP. En el N-terminal, una etiqueta de hexa-histidina flanqueada por residuos de vinculador fue agregada para fines de purificación (véase figura 1).

Figura 1 . Representación esquemática de la biosíntesis y la PTM de NisA en e. coli y escote de líder por la cepa de indicador de L. lactis en un análisis posterior de la actividad. En el primer paso, el prenisin lineal inactivo (compuesto por un líder y una región de péptido de núcleo que contiene una única prolina (rosa) en la posición 9) codificada por nisA ribosomally es sintetizada. A continuación, prenisin es posttranslationally modificado por deshidratación de residuos de serina y treonina dehydroalanine (Dha) y dehydrobutyrine (Dhb) como catalizada por NisB. La ciclasa NisC forma el thioether puentes por medio de adición de Michael de grupos sulfidrilo de la cisteína con Dha o Dhb. La prenisin modificada inactivo es purificado de la e. coli y ensayada su actividad antimicrobiana. Aquí, se transporta en la célula de la cepa indicadora de Gram L. lactis . El líder es dividido por el protease NisP (según lo indicado por una punta de flecha) para liberar totalmente activa nisina. También puede ser quitado en vitro por tratamiento con tripsina (*). Haga clic aquí para ver una versión más grande de esta figura.
- Utilizar protocolo de shock térmico estándar37 o electroporación38 para transformar la prolina auxotrófica cepa de e. coli (véase arriba) con los plásmidos pET-3a nisA(VSLRS) y pRSFDuet-1 nisBC.
- Pipetear 25-100 μl de suspensión celular transformada en placas de agar que contiene ampicilina, kanamicina y glucosa 1% (p/v). Utilice un esparcidor de placa o perlas de vidrio para distribuir la solución uniformemente sobre las placas.
- Incubar las placas durante la noche a 37 ° C.
- La tarde siguiente, use una sola Colonia para inocular 10 mL LB medio que contiene ampicilina, kanamicina y glucosa de 1% (p/v) en un matraz de 50 mL.
- Sacudir la cultura durante la noche (12-16 h) a 37 ° C y 200 rpm.
- Tomar 250 μl estériles 80% glicerol y cultura 550 μl, mezclar bien en un tubo de 2 mL y almacenar como stock de células congeladas a 80 ° C.
2. nueva preparación de medio mínimo (NMM)
Nota: Este protocolo utiliza NMM20 como un medio de crecimiento bacteriano líquido químicamente definido. También, se recomienda seguir estrictamente el orden de realización. De lo contrario, puede ocurrir precipitación. Formas de aminoácidos diferentes a los enumerados en la tabla de materiales (por ejemplo, clorhidratos), Compruebe la solubilidad. NMM19 contiene 19 aminoácidos excepto el cAA para ser reemplazado (aquí, prolina) por el análogo de la ncAA. Vea la tabla 1 para las concentraciones de ingrediente final. Dependiendo de la cepa bacteriana utilizada para la producción, la biotina y la tiamina pueden ser opcionales.
- Preparación de la mezcla de aminoácidos
- Disolver 0,5 g de Phe, Trp y Tyr en 100 mL ddH2O con la adición de unas gotas de HCl concentrado hasta disolución.
- Pesar 0.5 g de cada uno de los restantes 16 aminoácidos. Mezclar con 22 mL de 1 M de KH2PO4 y 48 mL de 1 M K2HPO4. Añadir ddH2O a ~ 800 mL. Revolver hasta que la solución llega a estar clara.
- Añadir el disuelto Phe, Trp y Tyr y ajustar el volumen de la solución a 1 L con ddH2O.
- Esterilizar la mezcla del aminoácido por filtración de vacío con una unidad de filtro de botella.
- Soluciones para NMM19
- En primer lugar, preparar 1 M soluciones stock de los siguientes componentes: (NH4)2para4, KH2PO4, K2HPO4, MgSO4 y 5 M stock solución de NaCl. Esterilice en autoclave.
- Preparar acciones de 50 mL de D-glucosa (1 M), CaCl2 (1 g/L), FECLAS2 (1 g/L), tiamina (10 g/L), biotina (10 g/L) y oligoelementos (CuSO4vivencias2MnCl2, (NH4)2MoO4; 1 mg/L ). Esterilizar por filtración con un filtro de jeringa.
- Preparación de NMM19
- Mezclar todas las soluciones stock para obtener una concentración final de 7,5 mM (NH4)2SO4, 1,7 mM NaCl, 50 mM K2HPO4, 1 mM de MgSO4 , 22 m m KH2PO4y 20 mM D-glucosa, aminoácido de 50 mg/L mezclar, 1 μg/L CaCl2, 1 μg/L FECLAS2, tiamina μg/L 10, biotina 10 mg/L y 0,01 μg/mL oligoelementos.
3. expresión de la nisina recombinante con la incorporación de análogos de prolina por SPI
En esta sección, expresión recombinante de la prepeptide (aquí: nisA) y genes PTM (aquí: nisBC) se lleva a cabo. En primer lugar, las células se cultivan en presencia de todos los cAAs, puesto que se utiliza medio complejo LB. La glucosa se añade a reprimir la expresión de genes objetivo a nivel de fondo, que podría originar la producción de péptidos de tipo salvaje (aquí: nisina) debido a la filtración de los promotores. Sólo después de la meta cAA (aquí: prolina) está agotado, se agrega la ncAA y expresión del gen objetivo es inducida en medio químicamente definido. Incubación de los cultivos líquidos se debe realizar en frascos adecuados con aireación (p. ej., 500 mL en un matraz de Erlenmeyer de 2 L a 200 rpm).
- Utilizando una pipeta estéril, a partir de un cultivo fresco de la noche acción congelada de la célula o Colonia fresca (ver paso 1). Uso medio de 25 mL LB con ampicilina, kanamicina y 1% (p/v) de glucosa e incubar durante la noche (12-16 h) a 37 ° C y 200 rpm.
- Inocular 1 L de medio fresco estéril con cultura noche 10 mL (1% v/v) e incubar a 37 ° C y 200 rpm hasta OD600 = 0,5.
- Centrifugar a 4 ° C durante 15 min a 4.500 x g.
- Retirar el sobrenadante y resuspender el precipitado con 20 mL NMM19 (preparado en el paso 2.3) que contienen antibióticos y 1% (p/v) de glucosa. Centrifugar a 4 ° C por 10 min a 4.500 x g.
- Resuspender el precipitado de células en 500 mL del mismo medio e incubar a 30 ° C y 200 rpm durante 1 hora.
Nota: En este paso, el agotamiento de la cAA (aquí, prolina) ocurre. - La cultura se dividen en partes iguales (una para cada ncAA). Inducir a cada cultura con 1 mM isopropílico β-D-1-tiogalactopiranósido (IPTG) y análogos de prolina de 1 mM de la fuente (4S/R- fluoroproline, 4S/R- hidroxiprolina o 4S/R- methanoproline).
Nota: Como control, una cultura puede suministrarse con prolina 1 mM, resultando en la producción de péptidos de tipo salvaje. - Incubar durante la noche (12-16 h) a 28 ° C y 200 rpm.
- Centrifugue la célula cultivos en tubos de 50 mL a 4 ° C por 20 min a 5.000 x g. retirar el sobrenadante y almacenan pellets a-80 ° C hasta purificación.
4. aislamiento y purificación de su etiquetado nisina análogos
Péptidos son purificados bajo desnaturalizar condiciones con guanidina clorhidrato (GuHCl)39, un fuerte desnaturalizante.
PRECAUCIÓN: GuHCl es dañino si se ingiere o inhala y causa irritación grave en los ojos y piel. Use guantes y protección para los ojos.
- Preparar 250 mL de binding buffer (GuHCl de 5 M, 300 mM NaCl, 25 mM Tris, pH 7.4), tampón de lavado (300 mM NaCl, 25 mM Tris, imidazol de 25 mM, pH 7,4) y tampón de elución (300 mM NaCl, 25 mM Tris, imidazol de 250 mM, pH 7,4). Para éstos, la transferencia de los sólidos en una botella de 250 mL y llenar hasta 200 mL con ddH2O. mezcla bien y ajustar el pH a 7.4 con 1 M NaOH o HCl. Entonces, llene hasta 250 mL con ddH2O. filtro todas las soluciones tampón utilizando una unidad de filtro de botella.
- Lisis de la célula
Aquí, se utiliza un sonicador (con 200 W salida de alta frecuencia (HF)); Tenga en cuenta que los valores de energía necesarios para la interrupción de la célula pueden ser diferente para otros instrumentos. Todos los pasos se realizan en el hielo. Alternativamente, puede utilizarse la lisis química celular, un homogeneizador líquido o una prensa francesa.- Agregar 12 mL de tampón de unión a cada tubo de centrífuga (desde el paso 3.8) y agite con un vórtex.
- Sumerja la punta de la sonda del sonicador en la suspensión de células. Establecer sonicador en amplitud 40% con pulso de 1 s a / 5 s apagado durante 15 minutos.
Nota: Limpie la punta del sonicador entre muestras para evitar la contaminación cruzada. Limpie la sonda sonicador con etanol al 70%. - Centrifugue la suspensión de células sometidas a lisis a 4 ° C por 40 min a 15.000 x g de pellets de restos celulares. Transferir el sobrenadante a un nuevo tubo de reacción.
- Cromatografía de afinidad
Para iones metálicos inmovilizados afinidad cromatografía (IMAC)40, puede utilizarse una bomba peristáltica o un sistema FPLC con un cartucho de 1 mL (aquí llenado de resina Ni-NTA). Para la preparación de buffers, consulte el paso 4.1.
Nota: Purificación del IMAC es factible puesto que el péptido recombinante producido lleva un N-terminal etiquetadas con su líder, que es quitado en el paso 6 por la peptidasa del líder NisP, liberación de nisina madura. Realizar depuración a temperatura ambiente o a 4 ° C. Utilizar un caudal de 1 mL por minuto si es aplicable para el cartucho IMAC.- En primer lugar, lavar el cartucho con 5 volúmenes de columna (cv) de ddH2O para eliminar el buffer de almacenamiento.
- Equilibrar con 10 cv de tampón de Unión.
- Proceso celular lisado (paso 4.2) usando una jeringa filtro de particulas, entonces aplica al cartucho.
- Lavar con 15 cv de tampón de lavado para remover material no específico y no consolidado.
- Procederá a la elución con 10 cv de tampón de elución y fracciones recoge 1 mL en tubos de 1,5 mL. Almacenar las fracciones en 4 ° C para el corto plazo (hasta 3 días) o a-20 ° C por períodos más largos.
- Para el almacenamiento, lavar el cartucho con 10 cv de ddH2O seguida de 5 cv de 20% de etanol.
5. LC-ESI-TOF espectrometría de masa análisis de análogos de la licina
Nota: Tabla de materiales véase por ejemplo instrumentación para cromatografía de líquidos acompañada con electrospray ionización tiempo de vuelo espectrometría de masas (LC-ESI-TOF-MS).
- Realizar separación HPLC de 15-20 μl péptido solución (preparada en el paso 4.3) en una columna C5 con una fase móvil de agua (A) y acetonitrilo (B) ambos suplementados con 0,1% de ácido fórmico y un gradiente de 5-80% B más de 20 minutos. Para espectrometría de masas (MS), usar elución después de 5 minutos.
Nota: Dependiendo del contenido del péptido y afinidad a la columna HPLC, volúmenes de muestra y separación necesite optimización. - Utilizar software apropiado para deconvolucionar las medición espectrométricos y calcular que la carga de péptidos diferentes Estados41. Comparar la masa de especies observadas del péptido a la masa calculada de tipo salvaje alterada por la sustitución de ncAA → cAA. Tener en cuenta que la prepeptide lineal es posttranslationally modificado por ocho dehydrations (-8 H2O) y cinco cyclizations (ver figura 1).
Nota: Usar tampones que contengan sodio, análisis de MS en modo positivo puede mostrar aductos de sodio. Estos se hacen visibles como picos adicionales con mayor masa deconvoluted (para cada sodio aducción, la masa observada deconvoluted es 22,99 Da mayor). Para quitar estos aductos, HPLC purificación42 o diálisis extensa43 se puede realizar.
6. prueba de actividad antimicrobianos
- Preparación de placas con agar GM17 bajo condiciones estériles
- Preparar un cultivo durante la noche de la glucosa de la cepa NZ9000 de L. lactis con plásmido pNG nisPT44 a 30 ° C en M17 caldo45 con 1% (p/v) de indicador (= GM17) y 5 μg/mL cloranfenicol.
- Medir OD600, inocular el medio fresco a OD600 = 0.1 e incubar hasta OD600 = 0.4-0.6. Luego coloque el matraz en el hielo.
Nota: Cada medición de OD600 consume volumen de cultura. Tenga en cuenta que para cada placa de agar de ensayo, se necesitarán cultivo bacteriano 1 mL. Si es necesario, ampliar por consiguiente el volumen de cultivo líquido. - Para agar al 1.5%, pesar agar 4,5 g en una botella de vidrio medio. Añadir 300 mL ddH2O mezcla y autoclave.
- Preparar el caldo x M17 2 (doble concentración) en 300 mL ddH2O y autoclave.
- Mezclar 25 mL de caldo de x M17 2 que contiene 10 μg/mL cloranfenicol y glucosa de 2% con 1 mL de L. lactis planas (4% v/v).
- Añadir 25 mL fundido 1.5% de agar (recién esterilizado o calentada en el microondas).
Nota: Antes de esto, deje que el frasco se enfríe al tacto (alrededor de 50 ° C). Esto es necesario ya que L. lactis es un Organismo mesófilo sensible a altas temperaturas. - Verter la solución en una placa de Petri grande. Secar las placas durante 10-15 minutos.
- Esterilice los extremos de un pipeta Pasteur de vidrio en la llama. Espere que se enfríe, luego use el extremo ancho para crear agujeros en el agar solidificado de GM17.
- Preparación de la muestra
- Tomar 1 mL de las culturas de expresión de e. coli (creado en el paso 3.7) en un tubo con 1,5 mL y centrifugar durante 3 minutos a 7.000 x g. Aspire el medio restante y resuspender el precipitado de células en 500 μl (50 mM de tampón fosfato de sodio Na-P pH 7.4 de dihidrógenofosfato de sodio de 0,5 M y fosfato de hidrógeno disódico de 0,5 M).
- Someter a ultrasonidos las muestras en hielo (Comparar paso 4.2.2). Sumerja la punta de la sonda del sonicador en la suspensión de células. Establecer sonicador en el 30% de amplitud con impulsos de 1 s s on y 5 apagado durante 3 minutos.
- Centrifugue el lisado por 10 min a 13.000 x g de pellets de restos celulares de la célula. Transferir el sobrenadante a un tubo nuevo de reacción sobre hielo.
- Diluir y normalizar los sobrenadantes de extracto celular 1 mL OD600 = 0.6, en relación con la densidad de células cosechadas, con Na-P.
- Prueba de actividad
- Agregar 40 μl de cada muestra normalizada en un agujero de la placa de agar indicador (figura 3). Utilizar cloranfenicol en 400 μg/mL como control antibacteriano compuesto. Uso de tampón de elución como control negativo. Espere hasta que todas las muestras se difunden en el agar. Incube la placa durante la noche a 30 ° C.
- Tomar fotografías de las placas de agar con un escáner o cámara digital. Tamaños de halo de inhibición de crecimiento pueden ser medido con la mano o con ImageJ46.
7. fluorescencia microscopía
Para observar el efecto de amperios en las células bacterianas, se puede utilizar microscopía de luz y fluorescencia. Tenga en cuenta que el modo de acción de la nisina se basa en la desestabilización y la formación de poros en las membranas bacterianas6. Aquí, Nilo rojo se utiliza para la membrana celular bacteriana, que se convierte en lisis celular dispersa y agregada a la mancha.
Nota: Tabla de materiales véase por ejemplo instrumentación. Cantidad de solución agregada de AMP puede ajustarse dependiendo de la concentración de péptido y bioactividad.
- Preparación de la célula
- Preparar la solución madre del Nilo rojo en dimetil sulfóxido (DMSO) de 10 mM.
- Crecer la cepa de L. lactis indicador OD600 = 1.0 como en 6.1.1-6.1.2 de paso.
- Centrifugar 1 cultura de mL por 3 min a 4 ° C y 5.000 x g.
- Descarte el sobrenadante, resuspender en 1 mL de tampón fosfato salino (PBS)47.
- Centrifugar y resuspender nuevamente.
- Añadir 1 μl del Nilo rojo solución, mezclar suavemente.
- Adquisición de imágenes microscópicas
- Añadir 30 μl de la preparación de la célula en una diapositiva de cubierta mientras que emocionante a 520 nm.
- Programar adquisición tiempo 0.2 s, serie cinética 0.1 Hz, imágenes de la serie 200 de longitud.
- Añadir 0,3 - 1,5 μl de lisado de células o muestra IMAC (de paso 6.2.4 o 4.3.5, respectivamente). Para las muestras de la IMAC, tampón de elución puede utilizarse como un control negativo.
- Monitor y registro de emisión de fluorescencia a λ ≥ 560 nm.
- Análisis de datos
- Secuencias de imágenes de microscopía se almacenan como archivos de película (.avi). Imágenes individuales se analizan con ImageJ46.
Resultados
Este protocolo está diseñado para permitir la producción de variantes de nisina modificado de ncAA con incorporación de residuos específicos de análogos de prolina por el método SPI. Para la producción recombinante de nisina totalmente modificada de tipo salvaje39fueron divulgado previamente, la viabilidad y rendimiento de 24 mg/L. Usando el método SPI, los rendimientos de péptido de la proteína objetivo son con frecuencia buenos y pueden alcanzar cantidades cerca de tipo salvaje producción48. Como primeros experimentos, producción de RiPP de tipo recombinante debe analizarse en el host auxotrófica solicitado. Aquí, la prolina auxotrófica e. coli MG1655 ΔproBA:: frt ΔproC:: frt (DE3) se utilizó como cepa de host. Para la incorporación de ncAAs, cultivo e inducción pueden optimizarse hacia producción de péptido máxima temperatura y composición de sincronización como medio.
Ensayo de actividad antimicrobiana
Purificación y producción de nisina recombinante tipo salvaje fueron realizadas siguiendo el protocolo anterior. En este caso, la prolina fue utilizada en vez de sus derivados de la ncAA en paso 3.6. Un ensayo de actividad antimicrobiana se utilizó para comprobar la producción de RiPP y comparar la actividad antimicrobiana antes y después de la purificación. Para el análisis de la actividad, fracciones elución paso IMAC fueron utilizados directamente y probado contra la cepa de indicador de L. lactis de gram-positivos (figura 2). Esta tensión expresa NisP, las variantes de nisina en los lysates de la célula de e. coli o péptido purificado muestras, respectivamente, se activan por clivaje proteolítico del péptido líder. Evidentemente, el flujo a través demostraron actividad inhibitoria de crecimiento. Esto puede explicarse por el material bioactivo no vinculante a la columna IMAC. Las fracciones elución probada todos mostraron mayor actividad en comparación con la muestra no purificada, que indica una concentración de la péptido su etiquetado por IMAC. Tenga en cuenta que el tampón de elución (como control negativo) no influyó en el crecimiento de L. lactis en este ensayo.
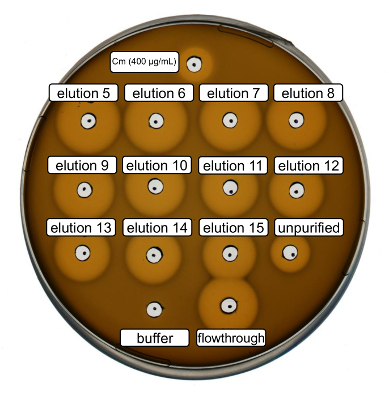
Figura 2 . Actividad antimicrobiana de prueba después de purificación de IMAC de producido por vía recombinante tipo salvaje nisina. Fracciones elución 5 a 15 y el flujo a través de la purificación de la IMAC se analizaron en comparación con la célula lisada (diluida para la normalización de OD600 ) contra la cepa de L. lactis indicador. El tamaño de los halos de inhibición de crecimiento indica que la actividad antimicrobiana. Cloranfenicol en una concentración de 400 μg/mL fue utilizado como control positivo y el tampón de elución de IMAC como control negativo. Haga clic aquí para ver una versión más grande de esta figura.
Para probar la actividad antimicrobiana de por vía recombinante producido variantes que contiene seis análogos de prolina diferentes, un análisis de la actividad se realizó para comprobar la inhibición de la cepa de L. lactis indicador de nisina. La figura 3 muestra la inhibición del crecimiento de cinco de las seis muestras mediante análogos de prolina. Los mejores resultados (según lo juzgado de tamaños de halo) fueron observados para los experimentos de incorporación de análogo (4R) - fluoroproline (4R) - hidroxiprolina y 4S-methanoproline. Comparando el tamaño de halo de inhibición de crecimiento a la nisina de tipo salvaje producido y probado en paralelo, todas las tres variantes de nisina demostraron fuerza de inhibición similar. Sin embargo, el tamaño del halo solo no puede ser utilizado para evaluar una actividad específica, ya que no se determinó la concentración de AMP. Por lo tanto, las pruebas sólo sirven para comprobar cualitativamente la actividad antimicrobiana de las variantes resultantes de nisina conservada o perdida. Para determinar la actividad específica, la concentración de las variantes de nisina debe ser cuantificada (ver discusión).
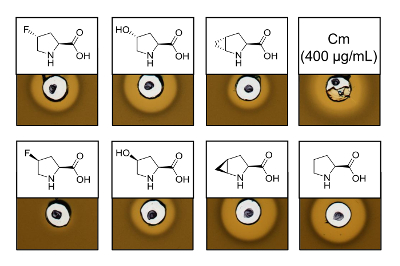
Figura 3 . Ensayo de actividad antimicrobiana de lysates de la célula que contiene variantes de nisina producida vía SPI con análogos de prolina. Comparación de las variantes de nisina con muestras de tipo recombinantes. Todas las muestras fueron OD600-normalizados después de la lisis celular en relación con la densidad de la cultura de cosecha celular. Halos indican actividad biológica en forma de inhibición de crecimiento la cepa indicadora. Primera fila de izquierda a derecha: (4R)-fluoroproline, (4R) - hidroxiprolina, (4R) - methanoproline y el cloramfenicol (400 μg/mL; antimicrobiana control positivo). Segunda fila: (4S)-fluoroproline, (4S) - hidroxiprolina, (4S) - methanoproline y prolina (control de tipo salvaje). Tenga en cuenta la nomenclatura química; por ejemplo, (4R) - fluoroproline es también conocida como trans-4 - fluoroproline. Haga clic aquí para ver una versión más grande de esta figura.
Espectrometría de masas LC-ESI-TOF
Con posterioridad a la purificación del IMAC, la incorporación del ncAAs nisina fue analizada por espectrometría de masas LC-ESI-TOF. La figura 4 muestra los espectros de masas deconvoluted de una variante de la nisina que contiene (4R)-fluoroproline. Esta variante era IMAC purificado como se describe anteriormente y luego analizados por espectrometría de masas LC-ESI-TOF, por lo que todavía llevaba el líder. El principal pico en la figura 4A se corresponde con la nisina modificada que contiene (4R)-fluoroproline con una masa deconvoluted de Da 6883.18 (masa calculada 6882.05 Da, calcula masa del péptido correspondiente de tipo salvaje con prolina en posición 9 es 6864.06 Da no). Los dos picos con abundancia baja y mayor masa corresponden a aductos de sodio según lo indicado. Figura 4 B muestra especies diferente cargadas de los principales compuestos que se encuentran por el algoritmo de deconvolución. Por ejemplo, el pico a 1148.11 m/z corresponde a la especie cargada seis veces ([M + 6H]6 +).

Figura 4 . Espectrometría de masas LC-ESI-TOF de variantes de nisina recombinante purificada de IMAC que contiene (4R)-fluoroproline. (A) Deconvoluted cromatograma de espectrometría de masas (zoom en el recuadro) para la variante de la nisina (todavía que lleva el líder) con (4R)-fluoroproline (espera masas (Da): [M + H]+ = 6882.05, [M + Na]+ = 6904.03, [M + 2Na]2 + = 6926.02). (B) compuesto de los espectros de especies [M + H]+. Espera que las masas (Da): [M + 5H]5 + = 1377.41, [M + 6 H]6 + = 1148.01, [M + 7 H]7 + = 984.15, [M + 8 H]8 + = 861.26, [M + 9 H]9 + = 765.67, [M + 10 H]10 + = 689.21, [M + 11 H]11 + = 626.64, [M + 12 H] 12 + = 574.50. Haga clic aquí para ver una versión más grande de esta figura.
Microscopía de fluorescencia
Actividad antimicrobiana de nisina recombinante y sus variantes que contiene la ncAA también puede ser demostrada por la observación directa de la L. lactis indicador tensión mediante microscopía de fluorescencia. Nilo rojo, colorante fluorescente altamente hidrofóbico, se utilizó para teñir la membrana celular bacteriana. La figura 5 muestra el cambio cualitativo del estado de agregación de la morfología de célula y cultivo celular. Células teñidas con rojo Nilo y depositadas en un portaobjetos de microscopía cubierta. La fila superior muestra las células directamente al principio cuando del almacenador intermediario, nisina recombinante de tipo salvaje, o nisina que contiene (4R)-fluoroproline, o (4R)-hidroxiprolina fueron agregados. El panel inferior muestra las imágenes correspondientes después de 20 minutos de incubación.
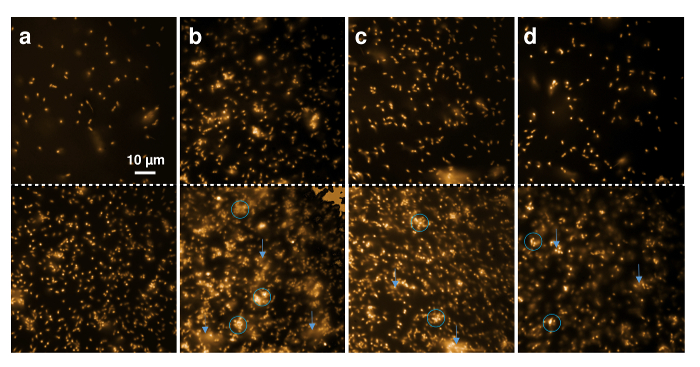
Figura 5 . Microscopía de fluorescencia de nisina recombinante efectos sobre las células grampositivas. Imágenes microscópicas de 30 μL L. lactis indicador la tensión (OD600 = 1) marcado con Nilo rojo fueron tomadas antes (panel superior) y después (panel inferior) 20 min de incubación con 1 μl de tampón (A), 0,3 μl recombinante tipo salvaje nisina (B) y 0,6 μl nisina las variantes que contienen (4R)-fluoroproline (C) y (4R)-hidroxiprolina (D). Círculos azules marcan regiones con punto flechas de células agregadas o deformadas, azul a las regiones donde se observa la difusión de fragmentos de membrana fluorescente. Haga clic aquí para ver una versión más grande de esta figura.
Figura 5 A muestra que el aspecto general de las células no cambió a 20 minutos de observación. Sólo el número de células que durante tiempo se levantó y, por tanto, una mayor cantidad de células es visibles en el μm del 80 μm x 80 de la región observada. Figura 5 B demuestra que las células Gram positivas aparecieron agregadas y borrosa (marcadas con círculos azules) después de 20 minutos de exposición a la nisina de tipo salvaje, incluso cuando bajas cantidades (aquí, elución de IMAC de 0,3 μL) fueron agregados. Además, material luz difusa de las células en el búfer, lo que indica que los fragmentos de membrana marcadas con Nilo rojo fueron movilizados durante el período de tiempo (señalada con flechas azules). Estos resultados indican la lisis celular como fue demostrado para ocurrir sobre el tratamiento con nisina6,49. Efectos similares fueron observados después de la incubación con la nisina variant que contiene (4R) - fluoroproline (figura 5C) y nisina que contiene (4R) - hidroxiprolina(figura 5)ambos mostrando grandes cantidades de células distorsionadas y agregadas después de 20 minutos, en marcado contraste con la muestra de control (figura 5A).
| Componente | Concentración |
| (NH4) 2 Así que4 | 7.5 mM |
| NaCl | 8,5 mM |
| KH2PO4 | 22 mM |
| K2HPO4 | 50 mM |
| MgSO4 | 1 mM |
| D-glucosa | 20 mM |
| Todos los aminoácidos canónicos (excepto el reemplazar) | 50 mg/L |
| CA2 + | 1 μg/mL |
| Fe2 + | 1 μg/mL |
| Elementos traza (Cu2 +, Zn2 +, Mn2 +, MoOH2 +) | 0,01 μg/mL |
| Tiamina | 10 μg/mL |
| Biotina | 10 μg/mL |
Tabla 1. Composición del medio de crecimiento bacteriano químicamente definidos de NMM19 después de la preparación según el paso 2.
Discusión
Mediante el uso de SPI para la introducción de análogos de prolina, las estructuras específicas de nisina pueden ser sustancialmente modificadas, crear variantes de nuevos péptidos con propiedades químicas y combinaciones de secuencia única. De esta manera, puede eludirse el límite básico de tecnología genética clásica, que está limitado para el análisis bioquímico de la cadena lateral de los 20 cAAs. En vivo química diversificación de nisina como se ejemplifica arriba demuestra un acercamiento general para complementar los naturales PTMs y dramáticamente mejorar el espacio químico de RiPPs. Creemos que ampliar el repertorio de los aminoácidos naturales es muy prometedor especialmente para amplificadores. En proteínas, una enorme gama de funciones puede realizarse a través de un arreglo definido de los 20 cAAs en estructuras tridimensionales. Con sólo 7-100 aa de longitud3, formas para lograr esas características estructurales sólo a través de cAAs se limitaría a amperios. Por lo tanto no es sorprendente que amperios naturales en forma de RiPPs comúnmente son ampliamente postraduccional modificado4. De la misma manera, ncAAs como bloques de construcción alternativa mantener gran promesa para mejorar sus parámetros farmacodinámicos y farmacocinéticos (véase Baumann et al. 201735 y referencias en esto).
La metodología SPI utilizada en este trabajo se beneficia de una relativamente fácil instalación experimental, ejecución sencilla y alta reproducibilidad. Debido a la sustitución global, multisitio incorporación de ncAA en péptidos de destino también es factible. Por otro lado, el método no puede ser adecuado para la sustitución de aminoácidos que ocurren con frecuencia en el producto del gene blanco. En principio, posiciones indeseables pueden ser cambiados por mutagénesis sitio-dirigida, pero estos cambios adicionales también podrían afectar a varias propiedades de AMP como estructura y actividad biológica. Una vez que existe una tensión auxotrófica para producción, varios ncAAs puede probarse sin necesidad de grandes cambios en el nivel genético. Por otra parte, el método no se limita a auxotrófica e. coli tensiones, pero también se puede realizar mediante el host de producción natural. Por ejemplo, Zhou et al mostró que SPI para la producción de novela RiPPs también funciona el naturalmente Trp auxotroph L. lactis: usando define los medios de comunicación, se incorporaron tres análogos de triptófano en las cuatro posiciones en la nisina50.
Puesto que el método SPI conduce a la sustitución global de los elegidos cAA por la ncAA, es generalmente aplicable a una amplia gama de objetivos de péptidos y proteínas. Una gama de auxotrófica Escherichia coli cepas está disponible (ver paso 1), permitiendo que varios cAAs cada una para probar para el reemplazo por el ncAAs. Se reunieron análogos incorporados mediante metA-cepas deficientes (por ejemplo, B834(DE3)) más comúnmente se emplean. Ejemplos de análogos de Met isostructural son azidohomoalanine (Aha) y homopropargylglycine (Hpg), ncAAs disponibles comercialmente que puede ser eficientemente. Ambos presentan mangos de bioorthogonal que permiten la fijación de las moléculas que transportan un alquino compatible o funcionalidad azida, respectivamente. Por ejemplo, tintes fluorescentes o moléculas de polietilenglicol (PEG) pueden fijarse por el cobre (I)-catalizado azida alquino cicloadición (CuAAC)51.
Aunque ambos métodos recombinantes de incorporación de ncAA (SPI y SCS) generalmente alcanzar cantidades suficientes de destino, los rendimientos se reducen a menudo en relación con la producción de tipo salvaje de la correspondientes péptidos y proteínas. Como las purezas a menudo se correlacionan con la eficacia de la producción, medidas de purificación adicional pueden ser requeridos, especialmente para especies poco abundantes. En este caso particular de la producción recombinante de la nisina, la secuencia con su etiqueta de líder simplifica enormemente RiPP purificación por enriquecimiento selectivo de los lysates de la célula. La purificación que se muestra en este protocolo mejora la pureza y la concentración de la nisina, pero a menudo no produce suficiente para determinar el rendimiento y la actividad específica de purezas de AMP. Además de IMAC, comúnmente utilizados métodos de purificación de AMP incluyen HPLC, cromatografía de intercambio iónico (IEC) y precipitación (por ejemplo. uso de acetona o ácido tricloroacético (TCA)) o combinaciones de los mismos - lo que resulta en un esquema de purificación multietapa52 . Cabe señalar que su comúnmente polycationic naturaleza puede facilitar la purificación de la IEC. La liofilización se utiliza con frecuencia para almacenar purificadas amperios.
Idealmente, ncAAs para incorporación en amperios debe estar comercialmente disponible a precios accesibles o fácilmente producido por protocolos de síntesis química sencilla y reproducible. Un requisito previo importante para el método SPI es que la ncAA es reconocido, activada y cargada en el tRNA cognado de la aaRS endógena o co expresado. Esto puede ser probado en vitro por aminoácido activación o tRNA aminoacilación ensayo53. Como una alternativa fácil, SPI prueba expresiones de proteínas modelo como la proteína verde fluorescente (GFP) llevó a cabo en presencia y en ausencia de suplementación de ncAA pueden realizar. Además, la solubilidad en la permeabilidad del medio y la célula crecimiento como estabilidad química constituyen factores importantes.
En este ejemplo, la actividad antimicrobiana se proyectó utilizando una cepa indicadora Gram-positivas. Como expresa la peptidasa del líder NisP, el paso final de la maduración de la nisina es catalizado. Eliminación de la secuencia líder (su-etiqueta para fines de purificación) también pueden ser realizados en vitro por tratamiento con NisP purificado50 o tripsina54. Más allá del alcance de este trabajo, organismos patógenos y las cepas multirresistentes pueden entonces probar para bacteriostática o bactericida inhibición por amperios utilizando una metodología similar. Especies objetivo clínicamente relevantes son SARM, MDR Mycobacterium tuberculosis, VRE, Acinetobacter baumannii, Streptococcus pneumoniae, Pseudomonas aeruginosa y Klebsiella pneumoniae. Además de la difusión de la placa de agar ensayo aquí presentado crecimiento inhibición puede realizarse también utilizando medios apropiados líquidos inoculado con la especie bacteriana y complementados con AMP. Utilizando métodos de dilución de caldo, puede determinarse la concentración inhibitoria mínima (CIM) con péptidos puros55. El ensayo de actividad presentado aquí puede utilizarse también para estimar la bioactividad y la potencia de las soluciones que contiene la AMP en relación con compuestos de referencia, disponibles en el mercado por ejemplo nisina.
Producción recombinante del RiPPs es a menudo factible39, que comúnmente incluye la expresión de los genes de la PTM. Tan pronto como la tensión de producción se transfiere en un medio mínimo químicamente definido o sintético que contengan un adecuado ncAA, reemplazo de residuos específicos de la cAA correspondiente lleva a cabo. Así, otros RiPPs puede ser producido por la misma metodología, siempre que su producción recombinante es factible y se pueden encontrar condiciones donde la incorporación de ncAA y PTM producen cantidades suficientes del producto objetivo. Tenga en cuenta que además el proteoma de células huésped, la maquinaria PTM péptido puede ser modificado de ncAA en SPI. En consecuencia, el momento de la inducción de expresión de destino y la duración de la incubación siguiente pueden requerir optimización. Puesto que la incorporación de la ncAA en las enzimas de la PTM puede afectar su estabilidad y su actividad, la producción de lo procesado RiPP puede en principio ser afectada. Suficiente eficacia de enzima PTM es indicado por la formación de prepeptide procesado, según lo detectado por los análisis de MS y bioactividad. Como por encima de diferentes promotores inducibles podrían ser empleados para producir la PTM genes primero (en ausencia de la ncAA) seguido por la inducción del gen de péptido precursor en presencia de la ncAA. En general, la producción de péptido de destino que contiene el cAA debe ser suprimida antes además de la ncAA, que apretado represión del gen precursor es necesaria. Dentro de este protocolo, esto se logra mediante represión catabólica por la adición de glucosa al medio de crecimiento. Especialmente puesto que las enzimas de la PTM necesarias para el procesamiento de prepeptide originan normalmente en un anfitrión genéticamente distante, uso de temperatura y a un codón de expresión de los genes correspondientes puede requerir optimización si producción recombinante aún no ha sido establecido. En principio, la presencia de ncAAs en la prepeptide puede interferir con el reconocimiento y procesamiento de las enzimas de la PTM, en el caso de la nisina NisBC y NisP. Para incorporación de ncAA en amperios, así se recomienda realizar experimentos de expresión en pequeña escala para identificar las condiciones de expresión adecuada y la fiabilidad del ensayo de actividad de la AMP.
Divulgaciones
Los autores declaran que no tienen intereses financieros que compiten.
Agradecimientos
J.H.N., T.B. y M.B. reconocen financiamiento por el programa de la UE FW7 (SYNPEPTIDE). F. J.S. y T.F. reconocen la financiación por el Ministerio Federal de educación y ciencia (BMBF programa "HSP 2020", TU-WIMIplus proyecto SynTUBio) y la Fundación alemana de investigación (grupo de excelencia "Unificando conceptos de catálisis").
Materiales
| Name | Company | Catalog Number | Comments |
| sodium chloride | Carl Roth, Germany | P029 | |
| guanidine hydrochloride | Carl Roth, Germany | 0035.2 | |
| dipotassium hydrogen phosphate | Carl Roth, Germany | P749.3 | |
| potassium dihydrogen phosphate | Carl Roth, Germany | 3904.3 | |
| sodium dihydrogen phosphate monohydrate | Carl Roth, Germany | K300.2 | |
| disodium hydrogen phosphate | Carl Roth, Germany | P030.2 | |
| L-alanine | Carl Roth, Germany | 3076.2 | |
| L-arginine | Carl Roth, Germany | 3144.3 | |
| L-asparagine monohydrate | Carl Roth, Germany | HN23.1 | |
| L-aspartic acid | Carl Roth, Germany | T202.1 | |
| L-cysteine | Carl Roth, Germany | 3467.3 | |
| L-glutamine | Carl Roth, Germany | 3772.1 | |
| L-glutamic acid | Carl Roth, Germany | 3774.1 | |
| L-glycine | Carl Roth, Germany | 3187.3 | |
| L-histidine | Carl Roth, Germany | 3852.3 | |
| L-isoleucine | Carl Roth, Germany | 3922.3 | |
| L-leucine | Carl Roth, Germany | 3984.3 | |
| L-lysine monohydrate | Carl Roth, Germany | 4207.2 | |
| L-methionine | Carl Roth, Germany | 9359.4 | |
| L-phenylalanine | Carl Roth, Germany | 4491.2 | |
| L-proline | Carl Roth, Germany | T205.3 | |
| L-serine | Carl Roth, Germany | 4682.4 | |
| L-threonine | Carl Roth, Germany | T206.2 | |
| L-tryptophan | Carl Roth, Germany | 4858.2 | |
| L-tyrosine | Carl Roth, Germany | T207.2 | |
| L-valine | Carl Roth, Germany | 4879.4 | |
| ammonium sulfate | Carl Roth, Germany | 3746.3 | |
| magnesium sulfate | Carl Roth, Germany | 0261.2 | |
| D-glucose | Carl Roth, Germany | 6780 | prepare a 20% (w/v) solution for addition into molten agar |
| calcium chloride | Carl Roth, Germany | PN93.2 | |
| iron(II) chloride | Sigma-Aldrich, Germany | 372870 | |
| thiamine hydrochloride | Sigma-Aldrich, Germany | T1270 | |
| biotin | Carl Roth, Germany | 3822.2 | |
| copper(II) sulfate | Merck, Germany | 102792 | |
| manganese(II) chloride | Carl Roth, Germany | KK36.2 | |
| zinc chloride | Merck, Germany | 108816 | |
| immonium orthomolybdate | Sigma-Aldrich, Germany | 277908 | |
| glycerol | Carl Roth, Germany | 7533.3 | |
| isopropyl β-D-1-thiogalactopyranoside | Sigma-Aldrich, Germany | I6758 | |
| ampicillin sodium salt | Carl Roth, Germany | K029.5 | working concentration 100 µg/mL for E. coli, prepare 100 mg/mL stock in ddH2O |
| kanamycin sulfate | Carl Roth, Germany | T832.2 | working concentration 50 µg/mL for E. coli, prepare 50 mg/mL stock in ddH2O |
| chloramphenicol | Carl Roth, Germany | 3886.1 | working concentration 5 µg/mL for L. lactis, prepare 37 mg/mL stock in ethanol |
| (4S)-fluoroproline | Bachem, Switzerland | F-3970 | |
| (4R)-fluoroproline | Bachem, Switzerland | F-3975 | |
| (4S)-hydroxyproline | Bachem, Switzerland | F-1395 | |
| (4R)-hydroxyproline | Bachem, Switzerland | F-2980 | |
| (4S)-methanoproline | chemically synthesized | ||
| (4R)-methanoproline | chemically synthesized | ||
| hydrochloric acid (HCl) | Carl Roth, Germany | P074.4 | |
| ethanol | VWR, Germany | 20825.324 | |
| M17-broth | Sigmal-Aldrich, Germany | 56156 | commercial product, see Terzaghi BE & Sandine WE, Appl Microbiol., 1975, 29(6):807-13 for contents and preparation |
| agar-agar | Carl Roth, Germany | 5210.5 | |
| Nisin from Lactococcus lactis | Sigma-Aldrich, Germany | N5764 | commercial product, can be used as reference for bioactivity |
| dimethyl sulfoxide (DMSO) | Carl Roth, Germany | A994.1 | |
| imidazole | Carl Roth, Germany | 3899.3 | |
| 1.5 mL autosampler vial for LC-MS | Sigma-Aldrich, Germany | Supelco 854165 | |
| acetonitrile | VWR, Germany | HiPerSolv CHROMANORM ULTRA for LC-MS, 83642 | LC-MS grade required |
| formic acid | VWR, Germany | HiPerSolv CHROMANORM for LC-MS, 84865 | LC-MS grade required |
| 1 mL Ni-NTA IMAC column, e.g. HisTrap FF Crude | GE Healthcare, UK | 29-0486-31 | different manufacturers and resins available for IMAC |
| 0.45 µm bottle top filter unit | VWR, Germany | 10040-470 | sterile filtration of solutions using a vacuum pump |
| 0.45 µm syringe filter PVDF membrane | Carl Roth, Germany | CCY1.1 | sterile filtration of solutions using a syringe and to remove particles from cell lysates |
| luer-lock syringe, PP, 50 ml | Carl Roth, Germany | T552.2 | sterile filtration of solutions |
| 1.5 mL Eppendorf tubes | Eppendorf, Germany | 30120086 | |
| petri dishes (polystyrene, sterile) | Carl Roth, Germany | TA19 | |
| Nile red | Sigma-Aldrich, Germany | 72485 | |
| E. coli ΔproA strain | CGSC, Keio collection | JW0233-2 | proline-auxotrophic E. coli K-12 strain |
| E. coli B834(DE3) | Novagen (Merck), Germany | 69041 | methionine-auxotrophic E. coli B strain |
| λDE3 Lysogenization Kit | Novagen (Merck), Germany | 69734-3 | |
| Lactococcus lactis NZ9000 pNG nisPT | bacterial indicator strain, see Khusainov R & Kuipers OP, PLoS One, 8 (9), e74890 | ||
| benchtop centrifuge for 1.5 mL Eppendorf tubes | Eppendorf, Germany | 5427 R | |
| peristaltic pump | GE Healthcare, UK | P1 | |
| FPLC system | GE Healthcare, UK | Äkta Purifier 10 or the like | |
| inverted microscope | Nikon | TI Eclipse wide-field fluorescence microscope with 100x (N.A. 1.4) objective and Mercury Lamp | example setup for fluorescence microscopy |
| electron multiplying CCD (EMCCD) camera | Andor Technologies, UK | Andor Luca | example setup for fluorescence microscopy |
| fluorescence excitation filter | Thorlabs, USA | Dichroic cube (TLV-U-MF2-TRITC) | example setup for fluorescence microscopy |
| fluorescence emission filter | AHF Analysentechnik, Germany | T 560 LPXR | example setup for fluorescence microscopy |
| cover slip 24 x 60 mm | Carl Roth, Germany | LH26.1 | example setup for fluorescence microscopy |
| Immersion Oil | Carl Zeiss, Germany | Immersol 518 F | example setup for fluorescence microscopy |
| probe sonicator | Bandelin, Germany | Sonopuls HD3200 with sonotrode MS-72 | 200 W maximum HF output |
| C5 HPLC column (2.1x100 mm, 3 µm particle size) | Sigma-Aldrich, Germany | 567227-U | example setup for mass spectrometry |
| ESI-TOF coupled to HPLC system | Agilent, USA | Agilent 6530 Accurate Mass QTOF with 1260 HPLC | example setup for mass spectrometry |
Referencias
- Ferri, M., Ranucci, E., Romagnoli, P., Giaccone, V. Antimicrobial resistance: A global emerging threat to public health systems. Crit Rev Food Sci Nutr. 57 (13), 2857-2876 (2017).
- Bahar, A. A., Ren, D. Antimicrobial peptides. Pharmaceuticals. 6 (12), 1543-1575 (2013).
- Ageitos, J. M., Sánchez-Pérez, A., Calo-Mata, P., Villa, T. G. Antimicrobial peptides (AMPs): Ancient compounds that represent novel weapons in the fight against bacteria. Biochem Pharmacol. 133, 117-138 (2017).
- Arnison, P. G., et al. Ribosomally synthesized and post-translationally modified peptide natural products: overview and recommendations for a universal nomenclature. Nat Prod Rep. 30 (1), 108-160 (2013).
- Lubelski, J., Rink, R., Khusainov, R., Moll, G. N., Kuipers, O. P. Biosynthesis, immunity, regulation, mode of action and engineering of the model lantibiotic nisin. Cell Mol Life Sci. 65 (3), 455-476 (2008).
- Shin, J. M., Gwak, J. W., Kamarajan, P., Fenno, J. C., Rickard, A. H., Kapila, Y. L. Biomedical applications of nisin. J Appl Microbiol. 120 (6), 1449-1465 (2016).
- Scherer, K. M., Spille, J. -. H., Sahl, H. -. G., Grein, F., Kubitscheck, U. The lantibiotic nisin induces lipid II aggregation, causing membrane instability and vesicle budding. Biophys J. 108 (5), 1114-1124 (2015).
- Jung, G. Lantibiotica - ribosomal synthetisierte Polypeptidwirkstoffe mit Sulfidbrücken und α,β-Didehydroaminosäuren. Angew Chemie. 103 (9), 1067-1084 (1991).
- Rink, R., et al. Lantibiotic structures as guidelines for the design of peptides that can be modified by lantibiotic enzymes. Biochemistry. 44 (24), 8873-8882 (2005).
- Lagedroste, M., Smits, S. H. J., Schmitt, L. Substrate Specificity of the Secreted Nisin Leader Peptidase NisP. Biochemistry. 56 (30), 4005-4014 (2017).
- Ross, A. C., Liu, H., Pattabiraman, V. R., Vederas, J. C. Synthesis of the lantibiotic lactocin S using peptide cyclizations on solid phase. J Am Chem Soc. 132 (2), 462-463 (2010).
- Fukase, K., et al. Synthetic Study on Peptide Antibiotic Nisin. V. Total Synthesis of Nisin. Bull Chem Soc Jpn. 65 (8), 2227-2240 (1992).
- Dumas, A., Lercher, L., Spicer, C. D., Davis, B. G. Designing logical codon reassignment - Expanding the chemistry in biology. Chem Sci. 6 (1), 50-69 (2015).
- Kuthning, A., Durkin, P., Oehm, S., Hoesl, M. G., Budisa, N., Süssmuth, R. D. Towards Biocontained Cell Factories: An Evolutionarily Adapted Escherichia coli Strain Produces a New-to-nature Bioactive Lantibiotic Containing Thienopyrrole-Alanine. Sci Rep. 6, 33447 (2016).
- Piscotta, F. J., Tharp, J. M., Liu, W. R., Link, A. J. Expanding the chemical diversity of lasso peptide MccJ25 with genetically encoded noncanonical amino acids. Chem Commun (Camb). 51 (2), 409-412 (2015).
- Hartman, M. C. T., Josephson, K., Lin, C. -. W., Szostak, J. W. An expanded set of amino acid analogs for the ribosomal translation of unnatural peptides. PLoS One. 2 (10), 972 (2007).
- Johnson, J. A., Lu, Y. Y., Van Deventer, J. A., Tirrell, D. A. Residue-specific incorporation of non-canonical amino acids into proteins: recent developments and applications. Curr Opin Chem Biol. 14 (6), 774-780 (2010).
- Ibba, M., Söll, D. Aminoacyl-tRNAs: setting the limits of the genetic code. Genes Dev. 18 (7), 731-738 (2004).
- Studier, F. W., Moffatt, B. A. Use of bacteriophage T7 RNA polymerase to direct selective high-level expression of cloned genes. J Mol Biol. 189 (1), 113-130 (1986).
- Budisa, N., Steipe, B., Demange, P., Eckerskorn, C., Kellermann, J., Huber, R. High-level biosynthetic substitution of methionine in proteins by its analogs 2-aminohexanoic acid, selenomethionine, telluromethionine and ethionine in Escherichia coli. Eur J Biochem. 230 (2), 788-796 (1995).
- Rink, R., et al. Dissection and modulation of the four distinct activities of nisin by mutagenesis of rings A and B and by C-terminal truncation. Appl Environ Microbiol. 73 (18), 5809-5816 (2007).
- Kubyshkin, V., Durkin, P., Budisa, N. Energetic contribution to both acidity and conformational stability in peptide models. New J Chem. 40 (6), 5209-5220 (2016).
- Molloy, E. M., Field, D., O'Connor, P. M., Cotter, P. D., Hill, C., Ross, R. P. Saturation mutagenesis of lysine 12 leads to the identification of derivatives of nisin A with enhanced antimicrobial activity. PLoS One. 8 (3), 58530 (2013).
- Wang, L., Brock, A., Herberich, B., Schultz, P. G. Expanding the genetic code of Escherichia coli. Science. 292 (5516), 498-500 (2001).
- Liu, C. C., Schultz, P. G. Adding new chemistries to the genetic code. Annu Rev Biochem. 79, 413-444 (2010).
- Anderson, J. C., Wu, N., Santoro, S. W., Lakshman, V., King, D. S., Schultz, P. G. An expanded genetic code with a functional quadruplet codon. Proc Natl Acad Sci U S A. 101 (20), 7566-7571 (2004).
- Zambaldo, C., Luo, X., Mehta, A. P., Schultz, P. G. Recombinant macrocyclic lanthipeptides incorporating non-canonical amino acids. J Am Chem Soc. 139 (34), 11646-11649 (2017).
- Al Toma, R. S., et al. Site-directed and global incorporation of orthogonal and isostructural noncanonical amino acids into the ribosomal lasso peptide capistruin. Chembiochem. 16 (3), 503-509 (2015).
- Chatterjee, A., Xiao, H., Schultz, P. G. Evolution of multiple, mutually orthogonal prolyl-tRNA synthetase/tRNA pairs for unnatural amino acid mutagenesis in Escherichia coli. Proc Natl Acad Sci U S A. 109 (37), 14841-14846 (2012).
- Budisa, N., Pal, P. P. Designing novel spectral classes of proteins with a tryptophan-expanded genetic code. Biol Chem. 385 (10), 893-904 (2004).
- Voller, J. -. s., Thi To, T. M., Biava, H., Koksch, B., Budisa, N. Global substitution of hemeproteins with noncanonical amino acids in Escherichia coli with intact cofactor maturation machinery. Enzyme Microb Technol. 106, 55-59 (2017).
- Moghal, A., Hwang, L., Faull, K., Ibba, M. Multiple Quality Control Pathways Limit Non-protein Amino Acid Use by Yeast Cytoplasmic Phenylalanyl-tRNA Synthetase. J Biol Chem. 291 (30), 15796-15805 (2016).
- Datsenko, K. A., Wanner, B. L. One-step inactivation of chromosomal genes in Escherichia coli K-12 using PCR products. Proc Natl Acad Sci U S A. 97 (12), 6640-6645 (2000).
- Engelke, G., Gutowski-Eckel, Z., Hammelmann, M., Entian, K. D. Biosynthesis of the lantibiotic nisin: genomic organization and membrane localization of the NisB protein. Appl Environ Microbiol. 58 (11), 3730-3743 (1992).
- Baumann, T., Nickling, J. H., Bartholomae, M., Buivydas, A., Kuipers, O. P., Budisa, N. Prospects of In vivo Incorporation of Non-canonical Amino Acids for the Chemical Diversification of Antimicrobial Peptides. Front Microbiol. 8, 124 (2017).
- Plat, A., Kluskens, L. D., Kuipers, A., Rink, R., Moll, G. N. Requirements of the engineered leader peptide of nisin for inducing modification, export, and cleavage. Appl Environ Microbiol. 77 (2), 604-611 (2011).
- JoVE Science Education Database. Basic Methods in Cellular and Molecular Biology. Bacterial Transformation: The Heat Shock Method. J Vis Exp. , (2017).
- JoVE Science Education Database. Basic Methods in Cellular and Molecular Biology. Bacterial Transformation: Electroporation. J Vis Exp. , (2017).
- Shi, Y., Yang, X., Garg, N., van der Donk, W. A. Production of lantipeptides in Escherichia coli. J Am Chem Soc. 133 (8), 2338-2341 (2011).
- Hochuli, E., Bannwarth, W., Döbeli, H., Gentz, R., Stüber, D. Genetic Approach to Facilitate Purification of Recombinant Proteins with a Novel Metal Chelate Adsorbent. Nat Biotechnol. 6 (11), 1321-1325 (1988).
- Zhang, Z., Marshall, A. G. A universal algorithm for fast and automated charge state deconvolution of electrospray mass-to-charge ratio spectra. J Am Soc Mass Spectrom. 9 (3), 225-233 (1998).
- JoVE Science Education Database. High-Performance Liquid Chromatography (HPLC). J Vis Exp. , (2017).
- JoVE Science Education Database. Dialysis: Diffusion Based Separation. J Vis Exp. , (2017).
- Khusainov, R., Kuipers, O. P. The presence of modifiable residues in the core peptide part of precursor nisin is not crucial for precursor nisin interactions with NisB- and NisC. PLoS One. 8 (9), 74890 (2013).
- Terzaghi, B. E., Sandine, W. E. Improved medium for lactic streptococci and their bacteriophages. Appl Microbiol. 29 (6), 807-813 (1975).
- Schindelin, J., Rueden, C. T., Hiner, M. C., Eliceiri, K. W. The ImageJ ecosystem: An open platform for biomedical image analysis. Mol Reprod Dev. 82 (7-8), 518-529 (2015).
- . Phosphate-buffered saline (PBS). Cold Spring Harb Protoc. 2006 (1), (2006).
- van Hest, J. C. M., Tirrell, D. A. Efficient introduction of alkene functionality into proteins in vivo. Febs Lett. 428 (1-2), 68-70 (1998).
- Prince, A., et al. Lipid-II Independent Antimicrobial Mechanism of Nisin Depends On Its Crowding And Degree Of Oligomerization. Sci Rep. 6 (1), 37908 (2016).
- Zhou, L., et al. Incorporation of tryptophan analogues into the lantibiotic nisin. Amino Acids. 48 (5), 1309-1318 (2016).
- Presolski, S. I., Hong, V. P., Finn, M. G. Copper-Catalyzed Azide-Alkyne Click Chemistry for Bioconjugation. Curr Protoc Chem Biol. 3 (4), 153-162 (2011).
- Abts, A., et al. Easy and rapid purification of highly active nisin. Int J Pept. 2011, 175145 (2011).
- Francklyn, C. S., First, E. A., Perona, J. J., Hou, Y. -. M. Methods for kinetic and thermodynamic analysis of aminoacyl-tRNA synthetases. Methods. 44 (2), 100-118 (2008).
- van Heel, A. J., et al. Production and Modification of Five Novel Lantibiotics Using the Promiscuous Nisin Modification Machinery. ACS Synth Biol. 5 (10), 1146-1154 (2016).
- Wiegand, I., Hilpert, K., Hancock, R. E. W. Agar and broth dilution methods to determine the minimal inhibitory concentration (MIC) of antimicrobial substances. Nat Protoc. 3 (2), 163-175 (2008).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados