Method Article
Peptidi antimicrobici prodotte dalla pressione selettiva incorporazione di aminoacidi Non canonico
* Questi autori hanno contribuito in egual misura
In questo articolo
Riepilogo
Il protocollo presenta l' Escherichia coli-base pressione selettiva incorporazione degli aminoacidi non canonico (ncAAs) il lactococcal peptide antimicrobico nisina. Le proprietà possono essere modificate durante l'espressione ricombinante tramite sostituzione con ncAAs desiderata in media di sviluppo definito. Conseguenti variazioni bioattività sono mappati da saggi di inibizione di crescita e microscopia a fluorescenza.
Abstract
La natura ha una varietà di possibilità per creare nuove proteine funzioni modificando la sequenza dei blocchi di costruzione di singoli aminoacidi. Tuttavia, tutte le variazioni sono basate su 20 aminoacidi canonici (cAAs). Come un modo per introdurre ulteriori proprietà fisico-chimiche in polipeptidi, l'incorporazione di aminoacidi non canonico (ncAAs) viene sempre più utilizzato in ingegneria proteica. A causa della loro lunghezza relativamente breve, la modifica di peptidi ribosomally sintetizzati e traduzionalmente modificate da ncAAs è particolarmente attraente. Nuove funzionalità e maniglie chimiche possono essere generate da modifiche specifiche di singoli residui. Il metodo di incorporazione (SPI) di pressione selettiva utilizza ceppi auxotrofi host che sono privi di un aminoacido essenziale nei media di crescita chimicamente definite. Strutturalmente e chimicamente simile dell'amminoacido parecchi analoghi quindi attivabili tramite il corrispondente amminoacil-tRNA sintetasi e forniscono specifici residui cAA(s) → ncAA(s) sostituzioni nella sequenza del peptide o della proteina dell'obiettivo. Anche se, nel contesto del metodo SPI, ncAAs sono anche incorporati nel proteoma host durante la fase di espressione del gene ricombinante, la maggior parte delle risorse della cella vengono assegnata per l'espressione del gene dell'obiettivo. In questo modo efficiente incorporazione di residui specifici di ncAAs spesso accompagnato con le quantità elevate di destinazione modificato. Il lavoro presentato descrive l'incorporazione in vivo di sei analoghi di prolina nella nisina peptide antimicrobico, un lantibiotic prodotta naturalmente dal Lactococcus lactis. Proprietà antimicrobiche di nisina può essere cambiato e ulteriormente ampliato durante la sua fermentazione ed espressione in auxotrofi Escherichia coli ceppi in media di sviluppo definito. Quindi, gli effetti della sostituzione di specifici residui di cAAs con ncAAs possono offrire cambiamenti nella specificità e attività antimicrobica. Saggi di attività antimicrobica e microscopia a fluorescenza sono utilizzati per testare le nuove varianti di nisina per inibizione della crescita di un ceppo di batteri Gram-positivi Lactococcus lactis indicatore. Spettroscopia di massa viene utilizzata per confermare l'incorporazione di ncAA in varianti di nisina bioattivi.
Introduzione
La scoperta di antibiotici nel ventesimo secolo e lo sviluppo parallelo di nuovi composti antimicrobici contro microrganismi patogeni abilitati mirati trattamenti delle infezioni batteriche. Tuttavia, a causa della comparsa di patogeni multiresistenti come meticillina-resistente Staphylococcusaureus (MRSA), enterococchi resistenti alla vancomicina (VRE), MDR (multidrug-resistente) Salmonella typhimurium phage digitare 10 (DT10 ), e Klebsiella pneumoniae, è urgentemente necessario generare nuovi agenti antimicrobici1. Peptidi antimicrobici (amp) sono composti versatili, spesso altamente specifici che sono promettenti candidati per lo sviluppo di nuovi farmaci grazie alle loro proprietà fisico-chimiche, flessibilità, dimensione, idrofobicità e modalità dell'azione2. Amplificatori sono piccoli peptidi solitamente costituito da 7-100 amminoacidi. Spesso, hanno una struttura cationica ricca di caricati positiva residui di lisina e arginina, che interagiscono con la membrana delle cellule microbica mirata, che è carica opposta3. Un particolare sottogruppo di ampere sono peptidi ribosomally sintetizzato e posttranslationally modificato (RiPPs)4. Queste sono prodotte da molti organismi dal Regno dei funghi e il dominio dei batteri. Uno del più noto e ampiamente utilizzato RiPPs è nisina, naturalmente prodotta dal batterio dell'acido lattico Lactococcus lactis (L. lactis). Attivo contro un pannello di batteri Gram-positivi, nisina è stata usata come un biopreservative nell'industria alimentare per più di 50 anni a causa di sue proprietà antimicrobiche e l'assenza di resistenza evoluta in ceppi microbici mirati5. Studi hanno dimostrato che la nisina destabilizza e genera i pori nelle membrane cellulari batteriche, che conduce ad attività antimicrobica contro sia di patogeni Gram-positivi e Gram-negativi6. Legandosi al lipido II, sintesi della parete cellulare batterica sono inibito7. La nisina è codificata da nisA come peptide precursore lineare, che si compone di un leader e una regione del peptide di nucleo (Figura 1). Dopo la sintesi ribosomiale, prenisin in primo luogo viene modificata da deidratasi NisB. Qui, residui di serina e treonina nella regione prepeptide core sono disidratati dehydroalanine (Dha) e dehydrobutyrine (Dhb)8. Successivamente, i residui disidratati sono accoppiati con la cisteina per formare lanthionine anelli (da qui il nome "lantibiotic" per lanthionine anello contenenti antibiotici) tramite un'aggiunta di Michael enzima-catalizzate. Questa modificazione post traduzionale (PTM) è catalizzata dalla ciclasi NisC. In L. lactis, il prenisin modificato viene quindi trasportato fuori dalla cella dal trasportatore NisT e il peptide leader viene scisso della proteinasi NisP per rilasciare la nisina maturi attivi e modulo9. La peptidasi di leader responsabile NisP ha una specificità di substrato alta, poiché esso solo processi modificati nisina efficientemente10.
In generale, attivo RiPPs risultato dall'azione degli enzimi PTM (per esempio NisBC), che aumentano drasticamente lo spazio chimico di brevi peptidi, per esempio, via acetilazione, glicosilazione, metilazione o fosforilazione. Questo livello di complessità può essere ulteriormente espansa dall'incorporazione diretta di ncAAs. Mentre spesso fattibile, sintesi chimica di ampere sono una sfida per la produzione su larga scala a causa della loro complessità strutturale. Ad esempio, la sintesi chimica totale della lactosin lantibiotic S a 71 punti di reazione è stata realizzata con una resa finale del 10% e quella di nisina con una resa di prodotto grezzo di 0,003%11,12. Pertanto, la produzione biologica offre una valida alternativa, a causa della generazione di stereocentri corretta e prodotto ad alta concentrazione.
Fino ad oggi, più di 150 ncAAs, per esempio, avendo gruppi funzionali contenenti fluoro o azidi, sono state integrate di proteine ricombinanti, e diversi esempi di ncAA-modified AMPs sono stati segnalati13,14, 15,16. Con l'introduzione di ncAAs, romanzo proprietà fisico-chimiche possono essere generati rispetto al convenzionale mutagenesi. La diversità dei peptidi esistenti può essere aumentata, possibilmente conducendo a nuovi antibiotici.
Un metodo per l'incorporazione di ncAAs in peptidi ricombinanti è incorporazione di pressione selettiva (SPI) basato sull'impiego di ceppi batterici auxotrofi17. Questi ceppi non sono in grado di sintetizzare l'analogico di cAA corrispondente della ncAA. La metodologia utilizza la specificità di substrato rilassato frequentemente osservato, una caratteristica di molti naturale amminoacil-tRNA sintetasi (aaRSs)18. Oltre a loro substrati naturali di cAA, questi enzimi sono spesso in grado di riconoscere e attivare la ncAA desiderata e caricarla sul loro tRNA(s) cognate. Questo porta a ribosomal incorporazione della ncAA nel prodotto del gene bersaglio in un modo specifico del residuo (cioè, sostituzione di cAA → ncAA). Questo è naturalmente possibile solo quando la ncAA desiderata è strutturalmente e chimicamente simile per l'amminoacido canonica e tollerato dalla fisiologia delle cellule, il macchinario di traduzione e sequenza del peptide o della proteina dell'obiettivo. In una particolare configurazione sperimentale, le cellule ospite auxotrofi sono coltivate in medium definito fornito con una concentrazione di limitazione dell'amminoacido nativo deve essere sostituito. La crescita cellulare o cambio di mezzo privo di cAA conduce a svuotamento intracellulare della cAA. Nel passaggio successivo, viene aggiunto il ncAA e viene indotta l'espressione del gene bersaglio. Inevitabilmente, ncAAs anche ora sono incorporate in molte altre proteine nella cellula ospite durante questa fase dell'espressione genica. Tuttavia, la tossicità del setup SPI è mantenuta a un livello basso in quanto il ceppo di Escherichia coli (e. coli) si trasforma con un plasmide che trasporta il gene bersaglio sotto il controllo di un promotore forte (comunemente il promotore T7 altamente competitivo / Sistema di polimerasi del RNA)19. Immediatamente dopo l'induzione (di solito quando è esaurito il cAA), l'host le cellule smettono di crescere e loro macchinari enzimatiche citoplasmici sono utilizzati principalmente per l'espressione del gene di plasmide-basata su target. Mutagenesi sito-diretta può essere utilizzata per definire i siti di installazione ncAA residuo specifiche nel gene bersaglio20.
Un peptide di modello per l'incorporazione di ncAAs, è stata scelta la nisina AMP pentaciclici A. 34 gli aminoacidi lunghi è solo un residuo della prolina singolo nella sequenza del peptide core (Figura 1). Come in subtilisina, ericin A e S ed epidermina pure come nisina Z e nisina Q, la prolina conservata sembra essere essenziale per attività9,21. La prolina cAA svolge un ruolo particolarmente importante nella rotazione di ammide peptidil-prolil e stabilizzazione di struttura secondaria. Relativa catena laterale anello conformazioni (exo / endo si increspa) sono responsabili di una stabilizzazione termodinamica del legame dell'ammide. Modificazioni chimiche mirate (ad esempio idrossilazioni, fluorazioni, iperomocisteinemici) di prolyl pieghe spesso criticamente influenzano la stabilità, rigidità di impalcatura e le funzioni di molte strutture biologiche22pieghevole. Pertanto, è plausibile aspettarsi che le sostituzioni analogiche di prolina Pro→ saranno dotare anello B, il secondo anello della nisina, romanzo e proprietà insolite.
Qui, una prolina-auxotrofi ceppo di e. coli è stato utilizzato per la produzione di nisina ricombinante. Questo richiede l'espressione del gene prepeptide nisA , nonché la modificazione enzimatica geni nisBC. Il prodotto codificato geneticamente peptide porta un leader N-terminalmente His-tag per cromatografia di affinità tramite purificazione. Per la determinazione dell'attività, L. lactis esprimendo e secernendo NisPT viene utilizzata per attivare le varianti di nisina ricombinante da lisati di Escherichia coli o peptide purificato campioni (Figura 1). L'AMP maturo viene rilasciato dopo la scissione del leader di NisP. In questo metodo di diffusione di agar, il campione di AMP diffonde nel mezzo di una crescita solida e può inibire la crescita del microorganismo gram-positivo. Dopo l'incubazione, questo può essere osservato visivamente da aloni di inibizione di crescita. Oltre L. lactis come indicatore, modificati in varianti di nisina ha mostrati attività antimicrobica contro Enterococcus faecalis, Bacillus cereus, Staphylococcus aureus e Lactobacillus johnsonii 21,23.
Un metodo alternativo e sperimentalmente diverso per incorporare ncAAs in RiPPs è fermata codone soppressione (SCS)24. Per questo, un tRNA ortogonale / coppia di aminoacyl-tRNA sintetasi (aaRS) è necessaria per la ncAA corrispondente. Idealmente, tutti questi tre componenti sono bioorthogonal, cioè, non interagiscono con l'endogeno tRNAs e aaRSs. Un aaRS ncAA-specifici possono essere generati da modificazione del sito attivo dell'enzima e screening di librerie genetiche di mutanti sintetasi25. Inoltre, l'introduzione di un ncAA richiede un codone che viene riassegnato e che non codifica per la cAA. Comunemente, il codone di stop ambra è usata24,26.
Recentemente, SPI è stato stabilito per l'incorporazione di ncAAs contenenti α-chloroacetamide e clic-chimica-compatibile in NisA27. Ad esempio, Nε- alloc-lisina fu incorporata il lazo peptide captistruin con site-specific (SCS) e metodi di incorporazione di residui specifici (SPI) e successivamente modificate in vitro di rutenio-catalizzata metatesi28 . In confronto a SPI, il metodo SCS è più complicato da un tRNA ortogonale / aaRS coppia deve essere co-espressi. Ad oggi, o coppie per l'incorporazione di prolina sono stati sviluppati29, ma al meglio della nostra conoscenza, nessun esempio di incorporazione analogico prolina è stato segnalato.
Si noti che non tutti i ncAAs possono essere incorporati utilizzando la metodologia SPI. In primo luogo, l'assorbimento di ncAAs nel citoplasma è regolata da una moltitudine di proteine di trasporto che sono incorporati nella membrana citoplasmatica, che è la membrana interna per batteri gram-negativi come e. coli. Normalmente, e. coli è in grado di trasportare una vasta gamma di analoghi dell'amminoacido nella cellula con catene laterali strutturalmente e chimicamente simile alla canoniche aminoacidi. Secondo, molti ncAAs chimicamente reattive o instabile potrebbe agire come un inibitore della crescita cellulare, come essi sono tossici per il metabolismo e la fisiologia dell'ospite cellulare30. Così, l'assorbimento e la tossicità della ncAA per l'host di produzione dovrebbe essere testati in anticipo. Per evitare l'inattivazione del macchinario PTM come effetto collaterale, un setup di espressione strettamente controllata di geni responsabili può essere utilizzato per incorporare l'aminoacido naturale enzimi di modificazione (ad esempio, nisBC) e la ncAA nel gene bersaglio ( ad esempio, nisA). Questo può essere realizzato utilizzando due differenti promotori e induzione dell'espressione genica, come dimostrato in appositi protocolli SPI31. Come indicato sopra, il metodo SPI si basa sulla specificità di substrato rilassato Aars, che consente l'attivazione di ncAA e cognate tRNA ricarica. Successivamente, il tRNA viene recapitato al ribosoma seguita dalla formazione di legami ammidici e pieghevole del peptide bersaglio (poli). In questi processi, revisione ed editing di meccanismi possono diventare rilevanti32. Per questi motivi, è di grande importanza per avere un target ncAA che è strutturalmente e chimicamente simile alla cAA. Altri punti cruciali sono sufficiente stabilità (sia in media crescita ed esposto al metabolismo cellulare) e la solubilità della ncAA. Inoltre, dovrebbe essere disponibile in commercio o facile da essere sintetizzato chimicamente.
Qui, descriviamo un protocollo per SPI, permettendo di incorporazione di residui specifici di ncAAs in RiPPs ricombinante. In particolare, gli analoghi diversi prolina sono incorporati nella nisina peptide antimicrobico A utilizzando Escherichia coli come organismo ospite. Spettrometria di massa viene utilizzata per verificare la sostituzione dell'amminoacido e prodotti peptidici sono analizzati per bioattività mediante saggi di inibizione di crescita e microscopia di fluorescenza usando ceppi microbici indicatore.
Il requisito di base per l'espressione di successo nisina ricombinante con ncAAs definito richiede una prolina adatta auxotrofico ceppo di e. coli . Per questo Auxotrofia, proA dev'essere disfunzionale, genomica KO per esempio raggiunto. Le cellule completamente private della biosintesi di Pro intracellulare (cioè, l'eliminazione di proABC) senza possibilità di ripristino sono auxotrophs stabile. Trasduzione dei fagi o singolo gene knockout secondo Datsenko & Wanner33sono ampiamente usate gene knockout metodi. Inoltre, ceppi di knockout proA sono ottenibili da archivi pubblici come Addgene, CGSC o la raccolta di Keio. Poiché l'espressione ricombinante nisABC illustrato di seguito si basa sull'uso di promotori di T7, il ceppo di host espressione deve trasportare un gene inducibile per T7 RNA polimerasi. Questo è possibile tramite introduzione del profago λDE3 nel genoma ospite, ad esempio utilizzando il kit commerciale. In alternativa, ceppi ad esempio BL21 (DE3) possono essere fatta auxotrofi come descritto sopra.
Protocollo
1. clonazione di vettori di espressione e di trasformazione di un ceppo di produzione auxotrofi
Qui, i geni per la biosintesi di nisina, vale a dire nisABC, sono stati presi da L. lactis e trasferiti nei vettori di espressione del plasmide T7-basato. Sequenze di DNA complete di nisABC sono disponibili in GenBank voce X6830734. Il gene per il peptide precursore (nisA) è stato posto su un vettore animale-3a che conferisce resistenza all'ampicillina. Geni per la deidratasi (nisB) e la ciclasi (nisC) sono stati immessi sul vettore pRSFDuet-1, come segnalati precedenti35, che conferisce resistenza alla kanamicina.
Nota: Per nisA, i codoni degli ultimi quattro amminoacidi (ASPR) della sequenza leader erano mutati per codificare VSLR36 rendono unico il residuo della prolina nel peptide core e garantire adeguata prepeptide elaborazione di NisP. Al N-terminale, è stato aggiunto un tag di hexa-istidina affiancato da residui del linker per scopi di purificazione (Vedi Figura 1).

Figura 1 . Rappresentazione schematica della biosintesi e PTM di NisA e. coli così come scissione leader dal ceppo indicatore L. lactis in un'analisi successiva attività. Nel primo passaggio, il prenisin lineare inattivo (composto di un leader e una regione di nucleo del peptide contenente un unico proline (rosa) alla posizione 9) codificati da nisA ribosomally è sintetizzato. Successivamente, prenisin è posttranslationally modificato da disidratazione dei residui di serina e treonina dehydroalanine (Dha) e dehydrobutyrine (Dhb) come catalizzata da NisB. La ciclasi NisC forma il thioether ponti tramite addizione di Michael di gruppi solfidrilici della cisteina con Dha o Dhb. Il prenisin modificate inattivo è purificato da e. coli e testato per attività antimicrobica. Qui, è trasportato nella cella del ceppo indicatore Gram-positivi L. lactis . Il leader viene scisso dalla proteasi NisP (come indicato da una freccia) per rilasciare la nisina pienamente attiva. Può anche essere rimosso in vitro dal trattamento con tripsina (*). Clicca qui per visualizzare una versione più grande di questa figura.
- Utilizzare standard di scossa di calore protocollo37 o elettroporazione38 per trasformare la prolina auxotrofico Escherichia coli ceppo (Vedi sopra) con i plasmidi pET-3a nisA(VSLR) e pRSFDuet-1 nisBC.
- Pipettare 25-100 µ l di sospensione cellulare trasformato su piastre di agar contenente ampicillina, kanamicina e 1% (p/v) di glucosio. Utilizzare un diffusore di piastra o perle di vetro per diffondere la soluzione in modo uniforme sulle piastre.
- Incubare le piastre durante la notte a 37 ° C.
- Il pomeriggio seguente, utilizzare una singola Colonia per inoculare 10 mL LB liquido contenente ampicillina, kanamicina e 1% (p/v) di glucosio in un pallone da 50 mL.
- Agitare la cultura durante la notte (12-16 h) a 37 ° C e 200 giri/min.
- Prendere 250 µ l sterile 80% glicerolo e cultura 550 µ l, mescolare bene in una provetta da 2 mL e conservare come cellula congelati stock a 80 ° C.
2. nuova preparazione terreno minimo (NMM)
Nota: Questo protocollo utilizza NMM20 come mezzo di crescita batterica liquido chimicamente definite. Inoltre, si consiglia di seguire rigorosamente l'ordine di preparazione. In caso contrario, possono verificarsi precipitazioni. Per aminoacido forme diverse da quelle elencate nella tabella di materiali (ad es., cloridrati), verificare la solubilità. NMM19 contiene 19 aminoacidi fatta eccezione per la cAA per essere sostituito (qui, prolina) dall'analog di ncAA. Vedere la tabella 1 per le concentrazioni di ingrediente finale. A seconda del ceppo batterico utilizzato per la produzione, della tiamina e biotina può essere opzionale.
- Preparazione della miscela dell'aminoacido
- Sciogliere 0,5 g di Phe, Trp e Tyr in 100 mL ddH2O con l'aggiunta di poche gocce di HCl concentrato fino alla dissoluzione.
- Pesare 0,5 g di ciascuno dei rimanenti 16 aminoacidi. Mescolare con 22 mL di 1 M di KH2PO4 e 48 mL di 1 M K2HPO4. Aggiungere ddH2O a ~ 800 mL. Mescolare fino a quando la soluzione diventa chiara.
- Aggiungere il disciolto Phe, Trp e Tyr e regolare il volume della soluzione a 1 L con ddH2O.
- Sterilizzare la miscela dell'aminoacido di filtrazione sotto vuoto con un'unità di filtro superiore della bottiglia.
- Soluzioni di riserva per NMM19
- In primo luogo, preparare 1 M soluzioni di riserva dei seguenti componenti: (NH4)2modo4, KH2PO4, K2HPO4, MgSO4 e un 5 M stock soluzione di NaCl. Sterilizzare in autoclave.
- Preparare scorte di 50 mL di D-glucosio (1 M),2 (1 g/L) CaCl,2 (1 g/L) FeCl, tiamina (10 g/L), biotina (10 g/L) e oligoelementi (CuSO4, ZnCl2, MnCl2, (NH4)2MoO4; 1 mg/L ). Sterilizzare a ciascuno per filtrazione con un filtro per siringa.
- Preparazione NMM19
- Mescolare tutte le soluzioni di riserva per ottenere una concentrazione finale di 7,5 mM (NH4)2SO4, 1.7 mM NaCl, 22mm KH2PO4, 50mm K2HPO4, 1mm MgSO4 e 20 mM D-glucosio, aminoacidi di 50 mg/L mescolare, 1 µ g/L CaCl2, 1 µ g/L FeCl2, 10 µ g/L tiamina, biotina 10 mg/L e 0,01 µ g/mL oligoelementi.
3. espressione di nisina ricombinante con l'incorporazione di prolina analoghi di SPI
In questa sezione, espressione ricombinante della prepeptide (qui: nisA) e geni PTM (qui: nisBC) viene eseguita. In primo luogo, le cellule sono coltivate in presenza di tutti i cAAs, poiché LB complesso medio viene utilizzato. Il glucosio è aggiunto per reprimere l'espressione genica a livello di sfondo, che altrimenti potrebbe portare alla produzione di selvaggio-tipo peptide (qui: nisina) a causa della permeabilità dei promotori. Solo dopo la destinazione cAA (qui: prolina) è esaurita, la ncAA è aggiunto ed espressione genica è indotto in terreno chimicamente definito. L'incubazione delle colture liquide deve essere eseguita in boccette adatti con aerazione (ad es., 500 mL in un matraccio di Erlenmeyer 2L a 200 giri/min).
- Utilizzando una pipetta sterile, avviare una coltura fresca durante la notte da Stock in cella surgelati o fresco Colonia (Vedi punto 1). Utilizzo medio di 25 mL LB contenente ampicillina, kanamicina e 1% (p/v) di glucosio e incubare a 37 ° C durante la notte (12-16 h) e 200 giri/min.
- Inoculare 1 L di terreno sterile nuovo con 10 mL di coltura durante la notte (1% v/v) e incubare a 37 ° C e 200 giri/min fino a OD600 = 0,5.
- Centrifuga a 4 ° C per 15 min a 4.500 x g.
- Versare il supernatante e risospendere il sedimento con 20 mL NMM19 (preparata al punto 2.3) contenenti antibiotici e 1% (p/v) di glucosio. Centrifuga a 4 ° C per 10 min a 4.500 x g.
- Risospendere il pellet cellulare in 500 mL dello stesso mezzo e incubare a 30 ° C e 200 giri/min per 1 h.
Nota: In questa fase, lo svuotamento di cAA (qui, prolina) avviene. - Dividere la cultura in parti uguali (uno per ogni ncAA). Indurre ogni cultura con 1 mM isopropilico β-D-1-thiogalactopyranoside (IPTG) e fornire gli analoghi di prolina di 1 mM (4S/R- fluoroproline, 4S/R- idrossiprolina o 4S/R- methanoproline).
Nota: Come controllo, una cultura può essere fornita con prolina di 1 mM, con conseguente produzione del peptide di selvaggio-tipo. - Incubi durante la notte (12-16 h) a 28 ° C e 200 giri/min.
- Centrifugare la cella culture in provette da 50 mL a 4 ° C per 20 min a g. 5.000 x versare il sovranatante e conservano il pellet a-80 ° C fino alla purificazione.
4. isolamento e purificazione di His-Tag nisina analoghi
Peptidi sono purificati sotto condizioni con guanidina cloridrato (GuHCl)39, un forte denaturante di denaturazione.
Attenzione: GuHCl è nocivo se ingerito o inalato e provoca pelle e grave irritazione oculare. Indossare guanti e occhiali di protezione.
- Preparare 250 mL di binding buffer (5 M GuHCl, 300 mM NaCl, 25 mM Tris, pH 7.4), tampone di lavaggio (300 mM NaCl, 25 mM Tris, imidazolo 25 mM, pH 7.4) e tampone di eluizione (300 mM NaCl, 25 mM Tris, imidazolo 250 mM, pH 7.4). Per questi, trasferire i solidi in un flacone da 250 mL e riempire fino a 200 mL con ddH2O. Mix bene e regolare il pH a 7.4 con 1 M NaOH o HCl. Quindi, riempire fino a 250 mL con ddH2filtro O. tutte le soluzioni tampone utilizzando un'unità di filtro superiore della bottiglia.
- Lisi delle cellule
Qui, viene utilizzato un sonicatore (con 200 W massimo ad alta frequenza (HF) uscita); Si noti che le impostazioni di alimentazione necessarie per distruzione cellulare possono differire per altri strumenti. Tutti i passaggi vengono eseguiti sul ghiaccio. In alternativa, può essere utilizzata lisi chimica delle cellule, un omogeneizzatore liquido o una stampa francese.- Aggiungere 12 mL di tampone di associazione per ogni provetta da centrifuga (dal punto 3.8) e risospendere nel Vortex.
- Immergere la punta della sonda sonicatore in sospensione delle cellule. Impostare sonicatore ad ampiezza di 40% con l'impulso di 1 s su / 5 s fuori per 15 min.
Nota: Pulire il sonicatore tra campioni per evitare il riporto. Pulire la sonda sonicatore con etanolo al 70%. - Centrifugare la sospensione di lisato cellulare a 4 ° C per 40 min a 15.000 x g a pellet detriti cellulari. Trasferire i surnatanti ad un nuovo tubo di reazione.
- Cromatografia di affinità
Per ioni metallici immobilizzato affinità cromatografia (IMAC)40, una pompa peristaltica o un sistema FPLC può essere utilizzato con una cartuccia di 1 mL (qui piena di resina Ni-NTA). Per la preparazione di buffer, vedi punto 4.1.
Nota: Purificazione di IMAC è fattibile poiché il peptide ricombinante prodotto trasporta un N-terminalmente His-tag leader, che è rimosso nel passaggio 6 di peptidasi leader NisP, rilasciando matura nisina. Eseguire la purificazione a temperatura ambiente o a 4 ° C. Utilizzare una portata di 1 mL al minuto, se applicabile, per la cartuccia IMAC.- In primo luogo, lavare la cartuccia con 5 volumi di colonna (cv) di ddH2O rimuovere buffer di archiviazione.
- Equilibrare con 10 cv del buffer obbligatorio.
- Processo delle cellule lisato (passo 4.2) utilizzando una siringa filtro per rimuovere le particelle, quindi applicare alla cartuccia.
- Lavare con 15 cv del tampone di lavaggio per rimuovere materiali non specifici e non associato.
- Eluire con 10 cv di tampone di eluizione e frazioni di raccogliere 1 mL in provette da 1,5 mL. Memorizzare le frazioni a 4 ° C per breve termine (fino a 3 giorni) o a-20 ° C per periodi più lunghi.
- Per deposito, lavare la cartuccia con 10 cv di ddH2O seguita da 5 cv di etanolo al 20%.
5. LC-ESI-TOF analisi spettrometria di nisina analoghi
Nota: Tabella materiali Vedi ad esempio strumentazione per cromatografia liquida accoppiata con spettrometria di massa electrospray ionizzazione time-of-flight (LC-ESI-TOF-MS).
- Eseguire separazione HPLC di 15-20 µ l di soluzione del peptide (preparata al punto 4.3) su una colonna di C5 con una fase mobile di acqua (A) e (B) entrambi completati con acido formico 0.1% e un gradiente da 5-80% B oltre 20 min di acetonitrile. Per spettrometria di massa (MS), utilizzare eluizione dopo 5 min.
Nota: A seconda del peptide contenuto e affinità alla colonna HPLC, separazione e volumi di campione può bisogno di ottimizzazione. - Utilizzare software appropriato per deconvolute gli spettri di massa misurati e calcolare che la carica di peptidi diversi stati41. Confrontare la massa di specie osservate peptide per la massa calcolata di selvaggio-tipo alterata dalla sostituzione cAA → ncAA. Tener conto che il prepeptide lineare posttranslationally è modificato da otto disidratazioni (-8 H2O) e cinque cyclizations (Vedi Figura 1).
Nota: Utilizzando tamponi contenenti sodio, analisi di MS in modalità positiva possono mostrare sodio addotti. Questi diventano visibili come ulteriori picchi con massa superiore riconducibili (per ogni sodio del complesso, la massa osservata deconvoluted è 22.99 Da superiore). Per rimuovere questi addotti, HPLC purificazione42 o dialisi vasto43 può essere eseguita.
6. Test di attività antimicrobica
- Preparazione delle piastre di agar GM17 in condizioni sterili
- Preparare una coltura durante la notte di 5 µ g/mL cloramfenicolo e il glucosio del ceppo L. lactis NZ9000 portando il plasmide pNG nisPT44 a 30 ° C in M17 brodo45 con 1% (p/v) di indicatore (= GM17).
- Misurare OD600, inoculare mezzo fresco a OD600 = 0.1 e incubare fino a OD600 = 0.4-0.6. Quindi mettere il pallone sul ghiaccio.
Nota: Ogni misura di600 OD consumerà il volume di cultura. Tieni presente che per ogni piastra di agar di analisi, sarà necessario 1 mL coltura batterica. Se necessario, scalabilità di conseguenza il volume di coltura liquida. - Per 1,5% agar, pesare 4,5 g di agar in una bottiglia di vetro media. Aggiungere 300 mL ddH2O, mix e autoclave.
- Preparare 2 brodo di x M17 (due volte concentrato) in 300 mL ddH2O e autoclave.
- Mescolare 25 mL 2 brodo di x M17 contenente 10 µ g/mL cloramfenicolo e 2% di glucosio con 1 mL di coltura di L. lactis (4% v/v).
- Aggiungere 25 mL fuso 1,5% di agar (appena sterilizzato nell'autoclave o riscaldata in un forno a microonde).
Nota: Prima di questo, lasciare raffreddare la bottiglia al tatto (circa 50 ° C). Ciò è necessario poiché L. lactis è un organismo mesofila sensibile alle alte temperature. - Versare la soluzione in un grande piatto di petri. Piastre a secco per 10-15 min.
- Sterilizzare le estremità di una pipetta Pasteur di vetro dalla fiamma. Attendere che si raffreddi, quindi utilizzare il grandangolo per creare fori nel GM17-agar solidificato.
- Preparazione del campione
- Prendere 1 mL di e. coli espressione culture (creato nel passaggio 3,7) in una provetta etichettata da 1,5 mL e centrifugare per 3 min a 7.000 x g. aspirato il mezzo rimanente e risospendere il pellet cellulare in 500 µ l Na-P (tampone sodio fosfato 50 mM pH 7,4 fatta da 0,5 M sodio fosfato monobasico e sodio fosfato dibasico 0,5 M).
- Sonicare i campioni su ghiaccio (confronta punto 4.2.2). Immergere la punta della sonda sonicatore in sospensione delle cellule. Impostare sonicatore ad ampiezza di 30% con impulso di 1 s s on e 5 fuori per 3 min.
- Centrifugare la cella lysata per 10 min a 13.000 x g a pellet detriti cellulari. Trasferire il surnatante ad un nuovo tubo di reazione sul ghiaccio.
- Diluire e normalizzare i surnatanti di estratto cellulare a 1 mL OD600 = 0,6, rispetto la densità delle cellule raccolte, con Na-P.
- Test di attività
- Aggiungere 40 µ l di ciascun campione normalizzato in un foro della piastra di agar di indicatore (Figura 3). Utilizzare cloramfenicolo a 400 µ g/mL come antibatterico controllo composto. Tampone di eluizione di uso come controllo negativo. Attendere fino a quando tutti i campioni sono diffusi nell'agar. Incubare la piastra durante la notte a 30 ° C.
- Fotografare le piastre di agar utilizzando uno scanner piano o fotocamera digitale. Dimensioni halo inibizione di crescita possono essere misurata a mano o usando ImageJ46.
7. microscopia a fluorescenza
Per osservare l'effetto degli amp su cellule batteriche, microscopia di fluorescenza e luce può essere utilizzata. Si noti che la modalità di nisina d'azione si basa sulla destabilizzazione e la formazione di pori nella membrane batteriche6. Qui, Nilo rosso viene utilizzato per macchiare la membrana delle cellule batterica, che diventa la lisi delle cellule sparse e aggregati al momento.
Nota: Tabella materiali Vedi ad esempio strumentazione. Quantità di soluzione di AMP aggiunta può essere regolata a seconda della concentrazione del peptide e bioattività.
- Preparazione delle cellule
- Preparare 10 mM soluzione di riserva di Nilo rosso in dimetilsolfossido (DMSO).
- Crescere il ceppo di L. lactis indicatore a OD600 = 1.0 come nel passo 6.1.1-6.1.2.
- Centrifugare 1 mL di coltura per 3 min a 4 ° C e 5.000 x g.
- Eliminare il surnatante, risospendere in 1 mL di tampone fosfato salino (PBS)47.
- Centrifuga e risospendere nuovamente.
- Aggiungere 1 µ l Nilo rosso di soluzione, mescolare delicatamente.
- Acquisizione immagine microscopica
- Aggiungere 30 µ l di preparazione delle cellule su un vetrino di copertura mentre emozionante a 520 nm.
- Impostare acquisizione tempo 0.2 s, serie cinetica 0,1 Hz, immagini di lunghezza 200 serie.
- Aggiungere 0,3 - 1,5 µ l di campione IMAC o lysate delle cellule (da passo 6.2.4 o 4.3.5, rispettivamente). Per i campioni IMAC, tampone di eluizione può essere utilizzato come controllo negativo.
- Monitorare e registrare l'emissione di fluorescenza a λ ≥ 560 nm.
- Analisi dei dati
- Sequenze di immagini di microscopia sono memorizzati come file di filmato (. avi). Singole immagini vengono analizzate con ImageJ46.
Risultati
Questo protocollo è progettato per consentire la produzione di varianti di nisina ncAA-modificato con l'incorporazione di residui specifici di analoghi di prolina tramite il metodo SPI. In precedenza, la fattibilità e rendimenti di 24 mg/L sono stati segnalati per produzione ricombinante di completamente modificate selvaggio-tipo nisina39. Utilizzando il metodo SPI, rendimenti di peptidi/proteine bersaglio sono spesso buoni e possono raggiungere quantità vicino alla produzione di selvaggio-tipo48. Come primi esperimenti, produzione di RiPP di selvaggio-tipo ricombinante dovrebbe essere testati nell'ospite auxotrofico prescelto. Qui, la prolina-auxotrofi Escherichia coli MG1655 ΔproBA:: frt ΔproC:: frt (DE3) è stato usato come ceppo di host. Per l'incorporazione di ncAAs, di coltivazione e di induzione temperatura e tempi così come medie composizione può essere ottimizzate verso la resa massima del peptide.
Analisi di attività antimicrobica
Purificazione e selvaggio-tipo ricombinante nisina produzione sono stati effettuati seguendo il protocollo di cui sopra. In questo caso, la prolina è stata utilizzata invece di suoi derivati ncAA al punto 3.6. Un'analisi di attività antimicrobica era usata per verificare la produzione di RiPP e confrontare l'attività antimicrobica prima e dopo la purificazione. Per il dosaggio di attività, frazioni di eluizione e flusso continuo IMAC erano utilizzati direttamente e testati contro il ceppo di batteri Gram-positivi L. lactis indicatore (Figura 2). Come questo ceppo esprime NisP, le varianti di nisina contenute nei lisati di Escherichia coli o campioni del peptide purificato, rispettivamente, sono attivati tramite fenditura proteolitica del peptide leader. Evidentemente, il flusso continuo ha mostrato attività crescita-inibitoria. Questo può essere spiegato da materiale bioattivo non vincolanti per la colonna IMAC. Le frazioni di eluizione testati tutti hanno mostrato attività aumentata rispetto al campione non purificato, che indica una concentrazione del peptide His-tag di IMAC. Si noti che il buffer di eluizione (come controllo negativo) non ha influenzato la crescita di L. lactis in questo test.
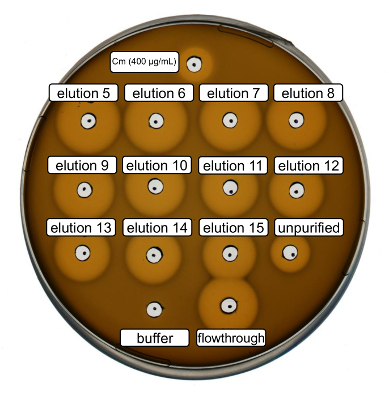
Figura 2 . Attività antimicrobica test dopo purificazione IMAC di recombinantly prodotto selvaggio-tipo nisina. Frazioni di eluizione 5 a 15 e il flusso attraverso di purificazione di IMAC sono stati testati in confronto con il lisato cellulare impura (diluito per la normalizzazione dei600 OD) contro il ceppo di indicatore L. lactis . La dimensione degli aloni di inibizione di crescita indica attività antimicrobica. Cloramfenicolo ad una concentrazione di 400 µ g/mL è stato usato come controllo positivo e il buffer di eluizione di IMAC come controllo negativo. Clicca qui per visualizzare una versione più grande di questa figura.
Per dimostrare l'attività antimicrobica di recombinantly prodotto nisina varianti che contengono sei analoghi diversi prolina, un'analisi di attività è stata effettuata per verificare l'inibizione del ceppo indicatore L. lactis . La figura 3 Mostra l'inibizione della crescita per cinque dei sei campioni prodotti utilizzando analoghi di prolina. I migliori risultati (come giudicato da dimensioni di halo) sono stati osservati per gli esperimenti di incorporazione di analogico (4R) - fluoroproline, (4R) - idrossiprolina e 4S-methanoproline. Confrontando le dimensioni di alone di inibizione crescita per la nisina selvaggio-tipo prodotto e testato in parallelo, tutte le tre varianti di nisina ha mostrato simile forza di inibizione. Tuttavia, la dimensione di halo da solo non può essere utilizzato per valutare un'attività specifica, poiché non è stata determinata la concentrazione di AMP. Di conseguenza, le analisi servono solo a testare qualitativamente se l'attività antimicrobica delle varianti nisina risultante è conservato o perso. Per determinare l'attività specifica, la concentrazione delle varianti nisina dovrà essere quantificati (vedi discussione).
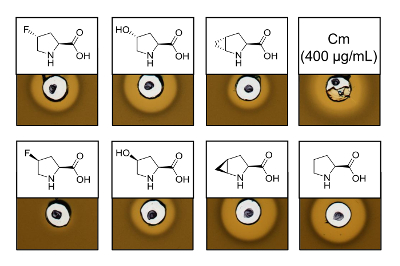
Figura 3 . Analisi di attività antimicrobica dei lisati cellulari contenenti varianti di nisina prodotta tramite SPI con gli analoghi prolina. Confronto delle varianti di nisina con campioni di selvaggio-tipo ricombinanti. Tutti i campioni sono stati OD600-normalizzati dopo lisi cellulare rispetto la densità di coltura delle cellule raccolte. Aloni indicano bioattività in forma indicatore ceppo di inibizione della crescita. Prima fila da sinistra a destra: (4R)-fluoroproline, (4R) - idrossiprolina, (4R) - methanoproline e cloramfenicolo (400 µ g/mL; Controllo positivo antimicrobica). Seconda fila: (4S)-fluoroproline, (4S) - idrossiprolina, (4S) - methanoproline e prolina (selvaggio-tipo di controllo). Nota la nomenclatura chimica; ad esempio, (4R) - fluoroproline è indicato anche come trans-4 - fluoroproline. Clicca qui per visualizzare una versione più grande di questa figura.
Spettrometria di massa LC-ESI-TOF
A seguito di purificazione di IMAC, l'incorporazione del ncAAs nisina è stato analizzato tramite spettrometria di massa LC-ESI-TOF. La figura 4 Mostra i deconvoluted spettri di massa di una variante di nisina contenente (4R)-fluoroproline. Questa variante era IMAC purificata come descritto in precedenza e successivamente analizzati mediante spettrometria di massa LC-ESI-TOF, così ha trasportato ancora il leader. La vetta principale in Figura 4A corrisponde alla nisina modificata che contiene (4R)-fluoroproline con una massa deconvoluted di 6883.18 Da (massa calcolata 6882.05 Da, calcolato massa del selvaggio-tipo peptide corrispondente con prolina a posizione 9 è Da 6864.06). Le due cime con abbondanza più bassa e più alta massa corrispondono al sodio addotti come indicato. Figura 4 B evidenzia specie diversamente cariche dei principali composti come rilevato dall'algoritmo di deconvoluzione. Ad esempio, il picco a 1148.11 m/z corrisponde alla specie cariche sestuplo ([M + 6H]6 +).

Figura 4 . Spettrometria di massa LC-ESI-TOF di nisina ricombinante purificato per IMAC varianti contenenti (4R)-fluoroproline. (A) riconducibili cromatogramma di spettrometria di massa (lo zoom nell'inserto) per la variante di nisina (che porta ancora il leader) con (4R)-fluoroproline (previsto masse (Da): [M + H]+ = 6882.05, [M + Na]+ = 6904.03, [M + 2Na]2 + = 6926.02). (B) Compound spettri per specie [M + H]+. Previsto masse (Da): [M + 5H]+ 5 = 1377.41, [M + 6 H]6 + = 1148.01, [M + 7 H]7 + = 984.15, [M + 8 H]8 + = 861.26, [M + H 9]9 + = 765.67, [M + H 10]10 + = 689.21, [M + 11h]11 + = 626,64, [M + 12h] 12 + = 574.50. Clicca qui per visualizzare una versione più grande di questa figura.
Microscopia a fluorescenza
Attività antimicrobica di nisina ricombinante e le sue varianti contenenti ncAA possono essere mostrate anche mediante osservazione diretta del L. lactis indicatore ceppo tramite microscopia a fluorescenza. Nilo rosso, una tintura fluorescente altamente idrofobo, è stato utilizzato a macchiare la membrana cellulare batterica. La figura 5 Mostra il cambiamento qualitativo dello stato di aggregazione della coltura delle cellule e morfologia delle cellule singole. Le cellule erano macchiate con colore rosso del Nilo e depositate su un vetrino di copertura di microscopia. La riga superiore indica le celle direttamente all'inizio quando buffer, ricombinante selvaggio-tipo nisina, o contenente nisina (4R)-fluoroproline, o (4R)-idrossiprolina sono stati aggiunti. Il pannello inferiore mostra le immagini corrispondenti dopo 20 minuti di incubazione.
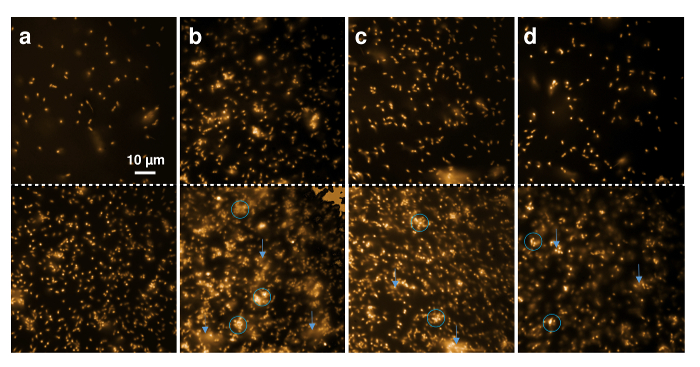
Figura 5 . Microscopia di fluorescenza di nisina ricombinante effetti sulle cellule Gram-. Immagini microscopiche di ceppo indicatore di 30 µ l L. lactis (OD600 = 1) contrassegnato con Nilo rosso sono stati prelevati prima (pannello superiore) e dopo (pannello inferiore) 20 min di incubazione con 1 µ l di tampone (A), 0,3 µ l ricombinante selvaggio-tipo nisina (B) e Varianti di nisina µ l 0,6 contenente (4R)-fluoroproline (C) e (4R)-idrossiprolina (D). Cerchi blu contrassegno regioni con punto di frecce di cellule aggregate o deforme, blu nelle regioni dove la diffusione dei frammenti della membrana fluorescente può essere osservato. Clicca qui per visualizzare una versione più grande di questa figura.
Figura 5 A Mostra che l'aspetto generale delle cellule non ha cambiato in 20 minuti di osservazione. Solo il numero di cellule che si deposita durante la rosa di tempo e, di conseguenza, una maggiore quantità di cellule è visibile all'interno del µm 80 µm x 80 della regione osservata. Figura 5 B Mostra che le cellule Gram-positivi sono sembrato aggregate e sfocate (contrassegnato con cerchi blu) dopo 20 minuti di esposizione al selvaggio-tipo nisina, anche quando bassa quantità (qui, eluizione di IMAC 0,3 µ l) sono stati aggiunti. Inoltre, il materiale leggero diffusa dalle cellule nel buffer, che indica che i frammenti di membrana contrassegnati con Nilo rossi sono stati mobilitati durante l'intervallo di tempo (contrassegnato dalle frecce blu). Questi risultati indicano la lisi cellulare come è stato indicato per accadere sul trattamento con nisina6,49. Effetti simili sono stati osservati dopo incubazione con la nisina variant contenente (4R) - fluoroproline (Figura 5C) e nisina contenente (4R) - idrossiprolina(Figura 5)entrambi grandi risultati quantità di cellule distorte e aggregate dopo 20 minuti, in netto contrasto con il campione di controllo (Figura 5A).
| Componente | Concentrazione |
| (NH4) 2 COSÌ4 | 7.5 mM |
| NaCl | 8.5 mM |
| KH2PO4 | 22 mM |
| K2HPO4 | 50 mM |
| MgSO4 | 1 mM |
| D-glucosio | 20 mM |
| Tutti gli aminoacidi canonici (ad eccezione di quella da sostituire) | 50 mg/L |
| CA2 + | 1 µ g/mL |
| Fe2 + | 1 µ g/mL |
| Gli oligoelementi (Cu2 +, Zn2 +, Mn2 +, Milla2 +) | 0,01 µ g/mL |
| Tiamina | 10 µ g/mL |
| Biotina | 10 µ g/mL |
Tabella 1. Composizione del mezzo di crescita batterica chimicamente definite NMM19 dopo la preparazione del secondo passaggio 2.
Discussione
Utilizzando SPI per l'inserimento degli analoghi di prolina, le strutture di nisina mirato possono essere sostanzialmente modificate, creando varianti peptide novello con combinazioni di sequenza univoca e proprietà chimiche. In questo modo, può essere aggirato il limite di base della tecnologia genetica classica, che è vincolato a composizioni chimiche di catena il lato del 20 cAAs. In vivo chimica diversificazione della nisina come esemplificato sopra dimostra un approccio generale per integrare PTMs naturale e migliorare drammaticamente dallo spazio chimico di RiPPs. Noi crediamo che ampliando il repertorio degli aminoacidi naturali rappresenta una grande promessa soprattutto per amplificatori. In proteine, una straordinaria gamma di funzionalità può essere realizzata attraverso una disposizione definita della 20 cAAs in strutture tridimensionali. Con solo 7-100 aa in lunghezza3, modi per ottenere tali caratteristiche strutturali solo attraverso cAAs sarebbe limitati per amplificatori. Non sorprende quindi che ampli naturale in forma di RiPPs comunemente sono ampiamente traduzionalmente modificate4. Allo stesso modo, ncAAs come blocchetti di costruzione alternativi promettono grandi per migliorare i loro parametri farmacodinamici e farmacocinetici (vedere Baumann et al 201735 e riferimenti ivi).
La metodologia SPI utilizzata in questo lavoro beneficia di un relativamente facile messa a punto sperimentale, esecuzione semplice e alta riproducibilità. A causa di sostituzione globale, multisito incorporazione di ncAA in peptidi di destinazione è anche fattibile. D'altra parte, il metodo potrebbe non essere adeguato per la sostituzione di aminoacidi che accade frequentemente nel prodotto del gene bersaglio. In linea di principio, posizioni indesiderati possono essere modificati mediante mutagenesi sito-diretta, ma queste modifiche aggiuntive potrebbero anche interessare parecchie proprietà di AMP compreso struttura e bioattività. Una volta disponibile un ceppo auxotrofico per produzione, ncAAs diversi possono essere testati senza richiedere modifiche estese a livello genetico. Inoltre, il metodo non è limitato a auxotrofi Escherichia coli ceppi, ma può essere eseguita anche utilizzando l'host di produzione naturale. Ad esempio, Zhou et al hanno dimostrato che SPI per la produzione di Novello RiPPs funziona anche naturalmente Trp-auxotroph L. lactis: utilizzo definita media, tre analoghi di triptofano sono stati incorporati a quattro posizioni in nisina50.
Poiché il metodo SPI conduce alla sostituzione globale del scelto cAA dalla ncAA, è generalmente applicabile ad una vasta gamma di destinazione peptidi e proteine. Una gamma di auxotrofi Escherichia coli ceppi è disponibile (Vedi punto 1), permettendo diverse cAAs ciascuno per essere testato per la sostituzione di ncAAs. Incontrato analoghi incorporati utilizzando metA-ceppi carenti (ad es., B834(DE3)) più comunemente sono impiegati. Esempi di isostrutturale Met analoghi sono azidohomoalanine (Aha) e homopropargylglycine (Hpg), ncAAs disponibili in commercio che possono essere incorporati in modo efficiente. Entrambi introdurre bioorthogonal maniglie che consentono l'aggancio di molecole che trasportano un alchino compatibile o funzionalità di azide, rispettivamente. Ad esempio, le tinture fluorescenti o moiety polietilenglicole (PEG) può essere fissato da rame (I)-catalizzata azide alchino cicloaddizione (CuAAC)51.
Anche se entrambi metodi di incorporazione di ncAA ricombinante (SPI e SCS) solitamente ottenere quantità sufficienti di destinazione, i rendimenti sono spesso ridotti rispetto alla produzione di selvaggio-tipo del corrispondente peptidi e proteine. Come le purezze spesso correlano con l'efficienza di produzione, fasi di purificazione supplementare possono essere richiesti, soprattutto per specie basso-abbondante. In questo caso particolare di produzione ricombinante nisina, la sequenza leader His-tag semplifica notevolmente RiPP purificazione di arricchimento selettivo dai lisati cellulari. La purificazione mostrata in questo protocollo migliora la purezza e la concentrazione della nisina, ma spesso non produce purezze AMP sufficiente per determinare il rendimento e l'attività specifica. Oltre a IMAC, metodi di purificazione AMP comunemente usati includono HPLC, cromatografia a scambio ionico (IEC) e precipitazioni (per esempio. utilizzando acetone o acido tricloroacetico (TCA)) o combinazioni degli stessi - risultante in un schema di purificazione multistep52 . Dovrebbe essere notato che loro comunemente natura polycationic può facilitare la purificazione di IEC. Liofilizzazione è frequentemente utilizzato per memorizzare AMPs purificata.
Idealmente, ncAAs per incorporazione in ampere dovrebbe essere disponibile in commercio a prezzi accessibili o facilmente prodotte dai protocolli di sintesi chimica semplice e riproducibile. Un altrettanto importante prerequisito per il metodo SPI è che la ncAA è riconosciuto, attivato e addebitato sul tRNA cognate delle RAA endogene o co-espresse. Questo può essere testata in vitro dall'aminoacido attivazione o tRNA aminoacylation dosaggio53. Come un'alternativa facile, espressioni di test SPI di proteine modello come proteina fluorescente verde (GFP) condotto sia in presenza e in assenza del completamento di ncAA possono essere eseguite. Inoltre, solubilità nella permeabilità di medium e delle cellule di crescita così come stabilità chimica costituiscono fattori importanti.
In questo esempio, l'attività antimicrobica è stato proiettato utilizzando un ceppo di batteri Gram-positivi indicatore. Come esprime la peptidasi leader NisP, la fase finale di maturazione di nisina è catalizzata. Rimozione della sequenza leader (His-tag per scopi di purificazione) possono anche essere eseguiti in vitro dal trattamento con purificato NisP50 o tripsina54. Oltre lo scopo di questo lavoro, organismi patogeni e ceppi multiresistenti possono poi essere testati per inibizione battericida o batteriostatica di AMPs utilizzando una metodologia simile. Specie bersaglio clinicamente rilevanti includono MRSA, MDR tubercolosi del micobatterio, VRE, Acinetobacter baumannii, Streptococcus pneumoniae, Pseudomonas aeruginosa e Klebsiella pneumoniae. Oltre alla diffusione di piastra di agar analisi presentati qui, crescita inibizione può essere eseguita anche utilizzando appropriati mezzi liquidi inoculati con le specie batteriche e completati con AMP. Utilizzando metodi di diluizione in brodo, la concentrazione inibitoria minima (MIC) può essere determinata utilizzando peptidi puro55. L'analisi di attività qui presentata è utilizzabile anche per stimare la bioattività e la potenza di soluzioni contenenti AMP relativi composti di riferimento, ad esempio commercialmente disponibile nisina.
Produzione ricombinante di RiPPs è spesso fattibile39, che comprende comunemente co-espressione di geni PTM. Non appena il ceppo di produzione viene trasferito in un medium minimo chimicamente definito o sintetico contenente un adatto ncAA, sostituzione di residui specifici della cAA corrispondente si svolge. Così, altri RiPPs può essere prodotto dalla stessa metodologia, purché la loro produzione ricombinante è fattibile e condizioni possono essere trovate dove incorporazione di ncAA e PTM producono una quantità sufficiente di prodotto di destinazione. Si noti che oltre il proteoma cellulare di host, il macchinario PTM peptide può anche diventare ncAA-modificato durante SPI. Di conseguenza, i tempi di induzione di espressione di destinazione e il seguente periodo di incubazione può richiedere ottimizzazione. Poiché incorporazione ncAA gli enzimi PTM può influenzare la stabilità e l'attività, la produzione della RiPP trasformati può in linea di principio essere influenzata. L'efficacia di enzima PTM sufficiente è indicato dalla formazione di prepeptide trasformati, come rilevato dalle analisi MS e bioattività. Come introdotto sopra, differenti promotori inducibili potrebbero essere impiegati per produrre il PTM geni prima (in assenza di ncAA) seguirono da induzione del gene precursore del peptide in presenza della ncAA. In generale, la produzione del peptide cAA-contenente di destinazione dovrà essere eliminata prima dell'aggiunta della ncAA, ragion per cui stretta repressione del gene precursore è richiesta. All'interno di questo protocollo, questo si ottiene dalla repressione catabolica attraverso l'aggiunta di glucosio per mezzo di crescita. Soprattutto perché gli enzimi PTM richiesti per l'elaborazione prepeptide provengono solitamente da un host geneticamente distante, utilizzo di temperatura e codone dell'espressione dei geni corrispondenti possa richiedere ottimizzazione se produzione ricombinante non è ancora stato stabilito. In linea di principio, la presenza di ncAAs nel prepeptide possa interferire con il riconoscimento e l'elaborazione degli enzimi PTM, nel caso di nisina NisBC e NisP. Per incorporazione di ncAA in AMPs, pertanto è consigliabile eseguire esperimenti su scala ridotta espressione in primo luogo per identificare condizioni di espressione adatto e l'affidabilità del dosaggio attività AMP.
Divulgazioni
Gli autori dichiarano di non avere nessun concorrenti interessi finanziari.
Riconoscimenti
J.H.N., T.B. e M.B. riconosce finanziamenti dal programma UE FW7 (SYNPEPTIDE). F.-J.S. e T.F. riconosce finanziamenti dal Ministero federale dell'educazione e scienza (BMBF programma "HSP 2020", TU-WIMIplus progetto SynTUBio) e la Fondazione di ricerca tedesca (Cluster of Excellence "Unifying concepts in catalisi").
Materiali
| Name | Company | Catalog Number | Comments |
| sodium chloride | Carl Roth, Germany | P029 | |
| guanidine hydrochloride | Carl Roth, Germany | 0035.2 | |
| dipotassium hydrogen phosphate | Carl Roth, Germany | P749.3 | |
| potassium dihydrogen phosphate | Carl Roth, Germany | 3904.3 | |
| sodium dihydrogen phosphate monohydrate | Carl Roth, Germany | K300.2 | |
| disodium hydrogen phosphate | Carl Roth, Germany | P030.2 | |
| L-alanine | Carl Roth, Germany | 3076.2 | |
| L-arginine | Carl Roth, Germany | 3144.3 | |
| L-asparagine monohydrate | Carl Roth, Germany | HN23.1 | |
| L-aspartic acid | Carl Roth, Germany | T202.1 | |
| L-cysteine | Carl Roth, Germany | 3467.3 | |
| L-glutamine | Carl Roth, Germany | 3772.1 | |
| L-glutamic acid | Carl Roth, Germany | 3774.1 | |
| L-glycine | Carl Roth, Germany | 3187.3 | |
| L-histidine | Carl Roth, Germany | 3852.3 | |
| L-isoleucine | Carl Roth, Germany | 3922.3 | |
| L-leucine | Carl Roth, Germany | 3984.3 | |
| L-lysine monohydrate | Carl Roth, Germany | 4207.2 | |
| L-methionine | Carl Roth, Germany | 9359.4 | |
| L-phenylalanine | Carl Roth, Germany | 4491.2 | |
| L-proline | Carl Roth, Germany | T205.3 | |
| L-serine | Carl Roth, Germany | 4682.4 | |
| L-threonine | Carl Roth, Germany | T206.2 | |
| L-tryptophan | Carl Roth, Germany | 4858.2 | |
| L-tyrosine | Carl Roth, Germany | T207.2 | |
| L-valine | Carl Roth, Germany | 4879.4 | |
| ammonium sulfate | Carl Roth, Germany | 3746.3 | |
| magnesium sulfate | Carl Roth, Germany | 0261.2 | |
| D-glucose | Carl Roth, Germany | 6780 | prepare a 20% (w/v) solution for addition into molten agar |
| calcium chloride | Carl Roth, Germany | PN93.2 | |
| iron(II) chloride | Sigma-Aldrich, Germany | 372870 | |
| thiamine hydrochloride | Sigma-Aldrich, Germany | T1270 | |
| biotin | Carl Roth, Germany | 3822.2 | |
| copper(II) sulfate | Merck, Germany | 102792 | |
| manganese(II) chloride | Carl Roth, Germany | KK36.2 | |
| zinc chloride | Merck, Germany | 108816 | |
| immonium orthomolybdate | Sigma-Aldrich, Germany | 277908 | |
| glycerol | Carl Roth, Germany | 7533.3 | |
| isopropyl β-D-1-thiogalactopyranoside | Sigma-Aldrich, Germany | I6758 | |
| ampicillin sodium salt | Carl Roth, Germany | K029.5 | working concentration 100 µg/mL for E. coli, prepare 100 mg/mL stock in ddH2O |
| kanamycin sulfate | Carl Roth, Germany | T832.2 | working concentration 50 µg/mL for E. coli, prepare 50 mg/mL stock in ddH2O |
| chloramphenicol | Carl Roth, Germany | 3886.1 | working concentration 5 µg/mL for L. lactis, prepare 37 mg/mL stock in ethanol |
| (4S)-fluoroproline | Bachem, Switzerland | F-3970 | |
| (4R)-fluoroproline | Bachem, Switzerland | F-3975 | |
| (4S)-hydroxyproline | Bachem, Switzerland | F-1395 | |
| (4R)-hydroxyproline | Bachem, Switzerland | F-2980 | |
| (4S)-methanoproline | chemically synthesized | ||
| (4R)-methanoproline | chemically synthesized | ||
| hydrochloric acid (HCl) | Carl Roth, Germany | P074.4 | |
| ethanol | VWR, Germany | 20825.324 | |
| M17-broth | Sigmal-Aldrich, Germany | 56156 | commercial product, see Terzaghi BE & Sandine WE, Appl Microbiol., 1975, 29(6):807-13 for contents and preparation |
| agar-agar | Carl Roth, Germany | 5210.5 | |
| Nisin from Lactococcus lactis | Sigma-Aldrich, Germany | N5764 | commercial product, can be used as reference for bioactivity |
| dimethyl sulfoxide (DMSO) | Carl Roth, Germany | A994.1 | |
| imidazole | Carl Roth, Germany | 3899.3 | |
| 1.5 mL autosampler vial for LC-MS | Sigma-Aldrich, Germany | Supelco 854165 | |
| acetonitrile | VWR, Germany | HiPerSolv CHROMANORM ULTRA for LC-MS, 83642 | LC-MS grade required |
| formic acid | VWR, Germany | HiPerSolv CHROMANORM for LC-MS, 84865 | LC-MS grade required |
| 1 mL Ni-NTA IMAC column, e.g. HisTrap FF Crude | GE Healthcare, UK | 29-0486-31 | different manufacturers and resins available for IMAC |
| 0.45 µm bottle top filter unit | VWR, Germany | 10040-470 | sterile filtration of solutions using a vacuum pump |
| 0.45 µm syringe filter PVDF membrane | Carl Roth, Germany | CCY1.1 | sterile filtration of solutions using a syringe and to remove particles from cell lysates |
| luer-lock syringe, PP, 50 ml | Carl Roth, Germany | T552.2 | sterile filtration of solutions |
| 1.5 mL Eppendorf tubes | Eppendorf, Germany | 30120086 | |
| petri dishes (polystyrene, sterile) | Carl Roth, Germany | TA19 | |
| Nile red | Sigma-Aldrich, Germany | 72485 | |
| E. coli ΔproA strain | CGSC, Keio collection | JW0233-2 | proline-auxotrophic E. coli K-12 strain |
| E. coli B834(DE3) | Novagen (Merck), Germany | 69041 | methionine-auxotrophic E. coli B strain |
| λDE3 Lysogenization Kit | Novagen (Merck), Germany | 69734-3 | |
| Lactococcus lactis NZ9000 pNG nisPT | bacterial indicator strain, see Khusainov R & Kuipers OP, PLoS One, 8 (9), e74890 | ||
| benchtop centrifuge for 1.5 mL Eppendorf tubes | Eppendorf, Germany | 5427 R | |
| peristaltic pump | GE Healthcare, UK | P1 | |
| FPLC system | GE Healthcare, UK | Äkta Purifier 10 or the like | |
| inverted microscope | Nikon | TI Eclipse wide-field fluorescence microscope with 100x (N.A. 1.4) objective and Mercury Lamp | example setup for fluorescence microscopy |
| electron multiplying CCD (EMCCD) camera | Andor Technologies, UK | Andor Luca | example setup for fluorescence microscopy |
| fluorescence excitation filter | Thorlabs, USA | Dichroic cube (TLV-U-MF2-TRITC) | example setup for fluorescence microscopy |
| fluorescence emission filter | AHF Analysentechnik, Germany | T 560 LPXR | example setup for fluorescence microscopy |
| cover slip 24 x 60 mm | Carl Roth, Germany | LH26.1 | example setup for fluorescence microscopy |
| Immersion Oil | Carl Zeiss, Germany | Immersol 518 F | example setup for fluorescence microscopy |
| probe sonicator | Bandelin, Germany | Sonopuls HD3200 with sonotrode MS-72 | 200 W maximum HF output |
| C5 HPLC column (2.1x100 mm, 3 µm particle size) | Sigma-Aldrich, Germany | 567227-U | example setup for mass spectrometry |
| ESI-TOF coupled to HPLC system | Agilent, USA | Agilent 6530 Accurate Mass QTOF with 1260 HPLC | example setup for mass spectrometry |
Riferimenti
- Ferri, M., Ranucci, E., Romagnoli, P., Giaccone, V. Antimicrobial resistance: A global emerging threat to public health systems. Crit Rev Food Sci Nutr. 57 (13), 2857-2876 (2017).
- Bahar, A. A., Ren, D. Antimicrobial peptides. Pharmaceuticals. 6 (12), 1543-1575 (2013).
- Ageitos, J. M., Sánchez-Pérez, A., Calo-Mata, P., Villa, T. G. Antimicrobial peptides (AMPs): Ancient compounds that represent novel weapons in the fight against bacteria. Biochem Pharmacol. 133, 117-138 (2017).
- Arnison, P. G., et al. Ribosomally synthesized and post-translationally modified peptide natural products: overview and recommendations for a universal nomenclature. Nat Prod Rep. 30 (1), 108-160 (2013).
- Lubelski, J., Rink, R., Khusainov, R., Moll, G. N., Kuipers, O. P. Biosynthesis, immunity, regulation, mode of action and engineering of the model lantibiotic nisin. Cell Mol Life Sci. 65 (3), 455-476 (2008).
- Shin, J. M., Gwak, J. W., Kamarajan, P., Fenno, J. C., Rickard, A. H., Kapila, Y. L. Biomedical applications of nisin. J Appl Microbiol. 120 (6), 1449-1465 (2016).
- Scherer, K. M., Spille, J. -. H., Sahl, H. -. G., Grein, F., Kubitscheck, U. The lantibiotic nisin induces lipid II aggregation, causing membrane instability and vesicle budding. Biophys J. 108 (5), 1114-1124 (2015).
- Jung, G. Lantibiotica - ribosomal synthetisierte Polypeptidwirkstoffe mit Sulfidbrücken und α,β-Didehydroaminosäuren. Angew Chemie. 103 (9), 1067-1084 (1991).
- Rink, R., et al. Lantibiotic structures as guidelines for the design of peptides that can be modified by lantibiotic enzymes. Biochemistry. 44 (24), 8873-8882 (2005).
- Lagedroste, M., Smits, S. H. J., Schmitt, L. Substrate Specificity of the Secreted Nisin Leader Peptidase NisP. Biochemistry. 56 (30), 4005-4014 (2017).
- Ross, A. C., Liu, H., Pattabiraman, V. R., Vederas, J. C. Synthesis of the lantibiotic lactocin S using peptide cyclizations on solid phase. J Am Chem Soc. 132 (2), 462-463 (2010).
- Fukase, K., et al. Synthetic Study on Peptide Antibiotic Nisin. V. Total Synthesis of Nisin. Bull Chem Soc Jpn. 65 (8), 2227-2240 (1992).
- Dumas, A., Lercher, L., Spicer, C. D., Davis, B. G. Designing logical codon reassignment - Expanding the chemistry in biology. Chem Sci. 6 (1), 50-69 (2015).
- Kuthning, A., Durkin, P., Oehm, S., Hoesl, M. G., Budisa, N., Süssmuth, R. D. Towards Biocontained Cell Factories: An Evolutionarily Adapted Escherichia coli Strain Produces a New-to-nature Bioactive Lantibiotic Containing Thienopyrrole-Alanine. Sci Rep. 6, 33447 (2016).
- Piscotta, F. J., Tharp, J. M., Liu, W. R., Link, A. J. Expanding the chemical diversity of lasso peptide MccJ25 with genetically encoded noncanonical amino acids. Chem Commun (Camb). 51 (2), 409-412 (2015).
- Hartman, M. C. T., Josephson, K., Lin, C. -. W., Szostak, J. W. An expanded set of amino acid analogs for the ribosomal translation of unnatural peptides. PLoS One. 2 (10), 972 (2007).
- Johnson, J. A., Lu, Y. Y., Van Deventer, J. A., Tirrell, D. A. Residue-specific incorporation of non-canonical amino acids into proteins: recent developments and applications. Curr Opin Chem Biol. 14 (6), 774-780 (2010).
- Ibba, M., Söll, D. Aminoacyl-tRNAs: setting the limits of the genetic code. Genes Dev. 18 (7), 731-738 (2004).
- Studier, F. W., Moffatt, B. A. Use of bacteriophage T7 RNA polymerase to direct selective high-level expression of cloned genes. J Mol Biol. 189 (1), 113-130 (1986).
- Budisa, N., Steipe, B., Demange, P., Eckerskorn, C., Kellermann, J., Huber, R. High-level biosynthetic substitution of methionine in proteins by its analogs 2-aminohexanoic acid, selenomethionine, telluromethionine and ethionine in Escherichia coli. Eur J Biochem. 230 (2), 788-796 (1995).
- Rink, R., et al. Dissection and modulation of the four distinct activities of nisin by mutagenesis of rings A and B and by C-terminal truncation. Appl Environ Microbiol. 73 (18), 5809-5816 (2007).
- Kubyshkin, V., Durkin, P., Budisa, N. Energetic contribution to both acidity and conformational stability in peptide models. New J Chem. 40 (6), 5209-5220 (2016).
- Molloy, E. M., Field, D., O'Connor, P. M., Cotter, P. D., Hill, C., Ross, R. P. Saturation mutagenesis of lysine 12 leads to the identification of derivatives of nisin A with enhanced antimicrobial activity. PLoS One. 8 (3), 58530 (2013).
- Wang, L., Brock, A., Herberich, B., Schultz, P. G. Expanding the genetic code of Escherichia coli. Science. 292 (5516), 498-500 (2001).
- Liu, C. C., Schultz, P. G. Adding new chemistries to the genetic code. Annu Rev Biochem. 79, 413-444 (2010).
- Anderson, J. C., Wu, N., Santoro, S. W., Lakshman, V., King, D. S., Schultz, P. G. An expanded genetic code with a functional quadruplet codon. Proc Natl Acad Sci U S A. 101 (20), 7566-7571 (2004).
- Zambaldo, C., Luo, X., Mehta, A. P., Schultz, P. G. Recombinant macrocyclic lanthipeptides incorporating non-canonical amino acids. J Am Chem Soc. 139 (34), 11646-11649 (2017).
- Al Toma, R. S., et al. Site-directed and global incorporation of orthogonal and isostructural noncanonical amino acids into the ribosomal lasso peptide capistruin. Chembiochem. 16 (3), 503-509 (2015).
- Chatterjee, A., Xiao, H., Schultz, P. G. Evolution of multiple, mutually orthogonal prolyl-tRNA synthetase/tRNA pairs for unnatural amino acid mutagenesis in Escherichia coli. Proc Natl Acad Sci U S A. 109 (37), 14841-14846 (2012).
- Budisa, N., Pal, P. P. Designing novel spectral classes of proteins with a tryptophan-expanded genetic code. Biol Chem. 385 (10), 893-904 (2004).
- Voller, J. -. s., Thi To, T. M., Biava, H., Koksch, B., Budisa, N. Global substitution of hemeproteins with noncanonical amino acids in Escherichia coli with intact cofactor maturation machinery. Enzyme Microb Technol. 106, 55-59 (2017).
- Moghal, A., Hwang, L., Faull, K., Ibba, M. Multiple Quality Control Pathways Limit Non-protein Amino Acid Use by Yeast Cytoplasmic Phenylalanyl-tRNA Synthetase. J Biol Chem. 291 (30), 15796-15805 (2016).
- Datsenko, K. A., Wanner, B. L. One-step inactivation of chromosomal genes in Escherichia coli K-12 using PCR products. Proc Natl Acad Sci U S A. 97 (12), 6640-6645 (2000).
- Engelke, G., Gutowski-Eckel, Z., Hammelmann, M., Entian, K. D. Biosynthesis of the lantibiotic nisin: genomic organization and membrane localization of the NisB protein. Appl Environ Microbiol. 58 (11), 3730-3743 (1992).
- Baumann, T., Nickling, J. H., Bartholomae, M., Buivydas, A., Kuipers, O. P., Budisa, N. Prospects of In vivo Incorporation of Non-canonical Amino Acids for the Chemical Diversification of Antimicrobial Peptides. Front Microbiol. 8, 124 (2017).
- Plat, A., Kluskens, L. D., Kuipers, A., Rink, R., Moll, G. N. Requirements of the engineered leader peptide of nisin for inducing modification, export, and cleavage. Appl Environ Microbiol. 77 (2), 604-611 (2011).
- JoVE Science Education Database. Basic Methods in Cellular and Molecular Biology. Bacterial Transformation: The Heat Shock Method. J Vis Exp. , (2017).
- JoVE Science Education Database. Basic Methods in Cellular and Molecular Biology. Bacterial Transformation: Electroporation. J Vis Exp. , (2017).
- Shi, Y., Yang, X., Garg, N., van der Donk, W. A. Production of lantipeptides in Escherichia coli. J Am Chem Soc. 133 (8), 2338-2341 (2011).
- Hochuli, E., Bannwarth, W., Döbeli, H., Gentz, R., Stüber, D. Genetic Approach to Facilitate Purification of Recombinant Proteins with a Novel Metal Chelate Adsorbent. Nat Biotechnol. 6 (11), 1321-1325 (1988).
- Zhang, Z., Marshall, A. G. A universal algorithm for fast and automated charge state deconvolution of electrospray mass-to-charge ratio spectra. J Am Soc Mass Spectrom. 9 (3), 225-233 (1998).
- JoVE Science Education Database. High-Performance Liquid Chromatography (HPLC). J Vis Exp. , (2017).
- JoVE Science Education Database. Dialysis: Diffusion Based Separation. J Vis Exp. , (2017).
- Khusainov, R., Kuipers, O. P. The presence of modifiable residues in the core peptide part of precursor nisin is not crucial for precursor nisin interactions with NisB- and NisC. PLoS One. 8 (9), 74890 (2013).
- Terzaghi, B. E., Sandine, W. E. Improved medium for lactic streptococci and their bacteriophages. Appl Microbiol. 29 (6), 807-813 (1975).
- Schindelin, J., Rueden, C. T., Hiner, M. C., Eliceiri, K. W. The ImageJ ecosystem: An open platform for biomedical image analysis. Mol Reprod Dev. 82 (7-8), 518-529 (2015).
- . Phosphate-buffered saline (PBS). Cold Spring Harb Protoc. 2006 (1), (2006).
- van Hest, J. C. M., Tirrell, D. A. Efficient introduction of alkene functionality into proteins in vivo. Febs Lett. 428 (1-2), 68-70 (1998).
- Prince, A., et al. Lipid-II Independent Antimicrobial Mechanism of Nisin Depends On Its Crowding And Degree Of Oligomerization. Sci Rep. 6 (1), 37908 (2016).
- Zhou, L., et al. Incorporation of tryptophan analogues into the lantibiotic nisin. Amino Acids. 48 (5), 1309-1318 (2016).
- Presolski, S. I., Hong, V. P., Finn, M. G. Copper-Catalyzed Azide-Alkyne Click Chemistry for Bioconjugation. Curr Protoc Chem Biol. 3 (4), 153-162 (2011).
- Abts, A., et al. Easy and rapid purification of highly active nisin. Int J Pept. 2011, 175145 (2011).
- Francklyn, C. S., First, E. A., Perona, J. J., Hou, Y. -. M. Methods for kinetic and thermodynamic analysis of aminoacyl-tRNA synthetases. Methods. 44 (2), 100-118 (2008).
- van Heel, A. J., et al. Production and Modification of Five Novel Lantibiotics Using the Promiscuous Nisin Modification Machinery. ACS Synth Biol. 5 (10), 1146-1154 (2016).
- Wiegand, I., Hilpert, K., Hancock, R. E. W. Agar and broth dilution methods to determine the minimal inhibitory concentration (MIC) of antimicrobial substances. Nat Protoc. 3 (2), 163-175 (2008).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon