Method Article
非规范氨基酸选择性压力合成抗菌肽的研究
* 这些作者具有相同的贡献
摘要
该协议将非规范氨基酸 (ncAAs) 的选择性压力纳入 lactococcal 抗菌肽乳酸杆菌中。它的属性可以在重组表达式通过替换过程中通过所定义的增长媒体中所需的 ncAAs 进行更改。生物活性的变化由生长抑制试验和荧光显微学来绘制。
摘要
自然界有各种各样的可能性通过修改个体氨基酸积木的序列来创造新的蛋白质功能。然而, 所有的变异都是基于20标准氨基酸 (cAAs)。作为一种将附加物理化学性质引入多肽的方法, 非规范氨基酸 (ncAAs) 在蛋白质工程中的应用越来越广泛。由于其长度相对较短, ncAAs 对 ribosomally 合成和后 translationally 改性肽的改性特别有吸引力。新的功能和化学手柄可以通过个别的残留物的具体修改产生。选择性压力法 (SPI) 方法利用 auxotrophic 寄主菌株, 在化学定义的生长介质中被剥夺了必需的氨基酸。几个结构上和化学上相似的氨基酸类似物可以由相应的氨酰-tRNA 合成酶激活, 并提供残留特定的民航局 (s) →在目标肽或蛋白质序列的替代。虽然, 在 SPI 方法的情况下, ncAAs 也被纳入到宿主蛋白质组在重组基因表达阶段, 细胞的大部分资源被分配到目标基因的表达。这使得 ncAAs 的高效残留物的合并往往伴随着大量的修改目标。所提出的工作描述了体内纳入六脯氨酸类似物的抗菌肽乳酸链球菌素, 一个 lantibiotic 自然产生的球菌球菌。在 auxotrophic 大肠杆菌菌株的发酵和表达过程中, 乳酸链球菌素的抗菌性能可以改变并进一步扩大. 因此, cAAs 与 ncAAs 的残留物替代剂的影响可以提供抗菌活性和特异性的变化。抗菌活性的测定和荧光显微学被用来测试新的乳酸菌素变种的生长抑制革兰阳性的球菌球菌指标菌株。质谱被用来确认 ncAA 在生物活性乳酸菌素变种中的加入。
引言
在第二十世纪发现抗生素, 并平行开发新的抗菌化合物对抗致病微生物, 使细菌感染有针对性的治疗。然而, 由于耐多药病原体的出现, 如耐甲氧西林Staphylococcusaureus (MRSA), 万古霉素耐药肠球菌 (VRE), MDR (耐多药)伤寒沙门氏菌噬菌体类型 10 (DT10) 和肺炎克雷伯菌, 迫切需要生成新的抗菌剂1。抗菌肽 (安培) 是多种用途的, 往往是高度特异的化合物, 因为它们的物理化学特性、柔韧性、大小、疏水性和行动方式2, 因此有望成为新药开发的候选者。安培是小肽通常由 7-100 氨基酸组成。通常, 他们有一个阳离子结构丰富的积极充电精氨酸和赖氨酸残留物, 这与靶向微生物细胞膜, 这是相反的电荷3。一个特殊的安培子群是 ribosomally 合成和 posttranslationally 修饰肽 (RiPPs)4。这些都是由来自真菌王国和细菌领域的许多有机体产生的。其中最知名和广泛使用的 RiPPs 是乳酸链球菌素, 自然地产生的细菌, 由乳酸菌球菌球菌(L. 球菌)。由于其抗菌性能和在靶向微生物菌株中缺乏进化阻力, 在50年的时间里, 乳酸链球菌素已被用作食品工业中的生物防腐剂, 这是对革兰氏阳性菌群的积极作用 5.研究表明, 乳酸链球菌素破坏和产生毛孔的细菌细胞膜, 导致抗菌活性的革兰阳性和革兰阴性病原体6。通过结合脂质 II, 细菌细胞壁合成被抑制7。乳酸链球菌素由nisA编码为线性前体肽, 由引线和核心肽区域 (图 1) 组成。核糖体合成后, prenisin 首先由脱水酶基因 NisB 修饰。在这里, prepeptide 核心区的丝氨酸和苏氨酸残留物脱水至 dehydroalanine (Dha) 和 dehydrobutyrine (Dhb)8。随后, 脱水残渣与半胱氨酸结合形成 lanthionine 环 (因此命名为 lanthionine 环含抗生素的 "lantibiotic") 由酶催化迈克尔加法。此翻译后修改 (PTM) 由酶 NisC 催化。在L. 球菌中, 修改后的 prenisin 由运输者 NisT 运出该单元格, 并由蛋白酶 NisP 对引线肽进行劈裂, 以释放成熟和活性的乳酸链球菌素形式9。负责任的领导酶 NisP 有一个高基体特异性, 因为它只处理被改进的链球菌有效地10。
一般而言, 活性 RiPPs 是由 PTM 酶 (例如 NisBC) 的作用引起的, 它极大地增加了短肽的化学空间,例如, 通过乙酰化、糖基化、甲基化或成磷酸。ncAAs 的直接合并可以进一步扩大这种复杂程度。尽管通常可行, 但由于其结构复杂, 安培的化学合成对大规模生产来说是一个挑战。例如, 在71反应步骤中, lantibiotic lactosin 的总化学合成达到了最终产量 10%, 而乳酸链球菌素的产率只有 0.003%11,12。因此, 生物生产提供了一个可行的选择, 由于产生正确的 stereocenters 和高产品浓度。
截至今天, 超过 150 ncAAs,例如,具有含氟或叠氮化合物功能组, 已被纳入重组蛋白, 并报告了一些 ncAA 修改安培的例子13, 14, 15,16。随着 ncAAs 的引入, 与常规诱变相比, 可以产生新的物理化学性质。现有肽的多样性可以增加, 可能导致新的抗生素。
在重组肽中加入 ncAAs 的一种方法是选择性压力合并 (SPI), 其基础是使用 auxotrophic 菌株17。这些菌株没有能力合成相应的 ncAA 模拟。该方法使用经常观察到的松弛基底特异性, 许多自然氨酰-tRNA 合成酶系 (aaRSs) 18 的特征。除了天然的民航基质, 这些酶往往能够识别和激活所期望的 ncAA, 并收取其同源 tRNA (s)。这导致将 ncAA 的核糖体纳入目标基因产品中以残留特定的方式 (即,民航局→ ncAA 替代)。这当然只有当所期望的 ncAA 在结构上和化学上类似于标准氨基酸并且被细胞生理学、翻译机器和目标肽或蛋白质序列所容忍时才可能发生。在特定的实验设置中, auxotrophic 宿主细胞在所提供的限定培养基中进行培养, 以取代本族氨基酸的限制浓度。细胞的生长或通过无自由介质的交流, 导致了细胞内衰竭的民航局。下一步, 加入 ncAA, 并诱导目标基因表达。不可避免的是, ncAAs 现在也被纳入在宿主细胞中的许多其他蛋白质在这个阶段的目标基因表达。尽管如此, SPI 设置的毒性保持在较低的水平, 因为大肠杆菌 ( 大肠杆菌) 菌株是由携带目标基因的质粒在强启动子控制下 (通常是高度竞争的 T7 启动子/RNA 聚合酶系统)19。诱导后立即 (通常当民航局耗尽), 宿主细胞停止生长, 其细胞质酶机械主要用于表达的质粒为基础的目标基因。站点定向突变可用于定义在目标基因20中特定于残滓的 ncAA 安装的站点。
作为 ncAAs 的模型肽, 选择了 pentacyclic 腺苷 a。它是34氨基酸长, 只有单一的脯氨酸残留在核心肽序列 (图 1)。与枯草杆菌、ericin A 和 S、epidermin 以及在乳链菌 Z 和乳酸链球菌 Q 中一样, 保守的脯氨酸似乎对于活动9、21至关重要。在 peptidyl-脯酰胺旋转和二次结构稳定中, 其脯氨酸起着特别重要的作用。它的侧链环构象 (外 puckers) 负责酰胺键的热力学稳定。脯 puckers 的靶向化学修饰 (如 hydroxylations、fluorinations、methylations) 经常严重影响到许多生物结构的折叠稳定性、脚手架刚度和功能22。因此, 预计 Pro→脯氨酸模拟替代将赋予环 B, 第二环乳酸菌素, 具有新颖和不寻常的性质。
在这里, 用脯氨酸 auxotrophic 的大肠杆菌菌株用于重组乳酸链球菌素的生产。这要求 prepeptide 基因nisA的表达以及修饰酶基因nisBC。基因编码肽产品运载一个 N 末期他标记的领导为纯化通过亲和层析。对于活动确定, L. 球菌表达和分泌 NisPT 用于激活由大肠杆菌细胞裂解物或纯化肽样品 (图1) 中重组的乳酸链球菌素变种。成熟的安培被释放后, 由 NisP 的领导者的分裂。在琼脂扩散法中, AMP 样品扩散到固体生长培养基中, 可抑制革兰阳性微生物的生长。孵化后, 可以通过生长抑制晕视觉观察。除球菌作为指示器外, 修饰的乳酸链球菌变种还显示了对粪肠球菌、芽胞杆菌、金黄色葡萄球菌、和乳酸杆菌 johnsonii的抗菌活性.21,23。
在 RiPPs 中合并 ncAAs 的一种替代性和实验性不同的方法是停止密码子抑制 (SCS)24。为此, 相应的 ncAA 需要一个正交 tRNA/氨酰-tRNA 合成酶 (aaRS) 对。理想情况下, 所有这三组件都是 bioorthogonal 的,即它们不与内生 tRNAs 和 aaRSs 交互。通过修改酶活性部位和筛选突变体合成酶系25 的遗传文库, 可以产生一个 ncAA 特定的 aaRS。此外, 一个 ncAA 的引进需要一个密码子, 被重新分配, 并没有编码的民航局。通常, 琥珀色停止密码子使用24,26。
最近, SPI 的成立是为了将α氯乙酰胺包含和单击化学兼容的 ncAAs 纳入NisA27。例如, Nε-分配赖氨酸被合并到套索肽 captistruin 中, 与特定于站点的 (SCS) 和残滓 (SPI) 合并方法和随后修改的体外由钌催化置换28.与 SPI 相比, SCS 方法更为复杂, 因为正交 tRNA/aaRS 对必须共同表达。迄今为止, 对脯氨酸公司的 o 型配对已经开发了29, 但据我们所知, 未报告脯氨酸模拟合并的例子。
应该指出的是, 并非所有 ncAAs 都可以使用 SPI 方法来合并。首先, 吸收 ncAAs 进入细胞质是由大量的运输蛋白, 嵌入在细胞质膜, 这是内膜的革兰氏阴性细菌, 如大肠杆菌。通常情况下,大肠杆菌能够将多种氨基酸类似物输送到细胞中, 结构上和化学上类似于标准氨基酸的侧链。第二, 许多化学活性或不稳定的 ncAAs 可能作为细胞生长的抑制剂, 因为它们对宿主细胞的新陈代谢和生理学有毒性30。因此, 对生产主机的吸收和毒性应事先进行测试。为了避免 PTM 机械的失活作为副作用, 一个严格控制的表达式设置的负责任的基因可以用来将天然氨基酸纳入改性酶 (例如, nisBC) 和 ncAA 到目标基因 (例如, nisA)。这可以通过两种不同的启动器和诱导的目标基因表达来完成, 如特别设计的 SPI 协议31所示。如上所述, SPI 方法依赖于 aaRS 的松弛基底特异性, 它允许 ncAA 激活和同源 tRNA 充电。随后, tRNA 被送到核糖体之后, 酰胺键形成和折叠的目标 (聚) 肽。在这一过程中, 校对和编辑机制可能会成为相关的32。基于这些原因, 有一个与民航局的结构和化学相似的目标 ncAA 是非常重要的。其他关键点是充足的稳定 (在成长媒介和暴露于细胞新陈代谢) 和可溶性的 ncAA。此外, 它应该是商业可用或容易被化学合成。
在这里, 我们描述了一个 SPI 的协议, 允许残留特定的 ncAAs 纳入重组 RiPPs。特别是, 不同的脯氨酸类似物被纳入抗菌肽乳酸链球菌素 A 使用大肠杆菌作为宿主有机体。采用质谱法对氨基酸替代品进行验证, 并利用微生物指标菌株对生物活性进行了生长抑制和荧光显微分析。
成功重组的 ncAAs 蛋白表达的基本要求必须有适当的脯氨酸 auxotrophic大肠杆菌菌株。对于此 auxotrophy, proA必须功能失调, 例如通过基因组挖空实现。完全剥夺细胞内亲生物合成 (即,删除proABC) 而没有逆转的可能性是稳定的 auxotrophs。广泛应用的基因敲除方法是噬菌体转导或单基因剔除根据 Datsenko & 华纳33。此外, proA挖空菌株可以从公共资料库 (如 Addgene、CGSC 或京王集合) 获得。由于此处显示的重组nisABC表达式依赖于 T7 启动子的使用, 因此表达式宿主应变必须携带一个可诱导基因用于 T7 RNA 聚合酶。这可以通过引入λDE3 带有前噬菌体到宿主基因组来完成, 例如使用商业套件。或者, 如上文所述, BL21 (DE3) 等菌株可以 auxotrophic。
研究方案
1. 表达载体的克隆和 auxotrophic 生产菌株的转化
本文从L. 球菌中取出了链球菌合成的基因, 即nisABC, 并将其转化为 T7-based 质粒表达载体。nisABC的完整 DNA 序列可以在基因库条目 X6830734中找到。前体肽 (nisA) 的基因被放置在 pET-3a 的载体上, 它能赋予氨苄西林抗药性。脱水酶基因(nisB) 和酶(nisC) 的基因已被放置在矢量 pRSFDuet-1 上, 如前所述35 所报告的, 它提供了卡那霉素电阻。
注意: 对于nisA, 前导序列的最后四个氨基酸 (ASPR) 的密码子被变异为编码 VSLR36 , 以使核心肽中的脯氨酸残留物具有独特性, 并确保 NisP 进行适当的 prepeptide 处理。在 N 端, 为纯化目的添加了由链接器残端两侧的六组氨酸标记 (请参见图 1)。

图 1.NisA 在大肠杆菌中的生物合成和 PTM 的示意图, 以及由L. 球菌指示株在随后的活动化验中的引线裂解.在第一步, ribosomally 合成了由nisA编码的非活动线性 prenisin (由一个引线和一个含有唯一的脯氨酸 (粉红色) 的核心肽区组成), 该区域在位置 9) 上被编译。其次, prenisin 是 posttranslationally 的 dehydroalanine (Dha) 和 dehydrobutyrine (Dhb) 由 NisB 催化脱水的丝氨酸和苏化残留物所改变的。酶 NisC 形成硫醚类桥梁通过迈克尔加法半胱氨酸巯基小组与 Dha 或 Dhb。非活动的修改后的 prenisin 从大肠杆菌中纯化并进行抗菌活性测试。在这里, 它被传送到革兰阳性的L. 球菌指示器应变的细胞中。领导是由蛋白酶 NisP (如箭头所示), 以释放完全活跃的乳酸菌素。也可以通过用胰蛋白酶 (*) 治疗来去除体外。请单击此处查看此图的较大版本.
- 使用标准热休克协议37或电穿孔38用质粒 pET-3a nisA(VSLR) 和 pRSFDuet-1 nisBC转换脯氨酸 auxotrophic大肠杆菌菌株 (见上文)。
- 吸管25-100 µL 转化细胞悬浮在含有氨苄西林, 卡那霉素和 1% (瓦特/v) 葡萄糖的琼脂板上。使用板上的摊铺机或玻璃珠均匀地将溶液涂在盘子上。
- 孵化盘隔夜在37°c。
- 第二天下午, 使用一个单一的群体接种10毫升 LB 培养基含有氨苄西林, 卡那霉素和 1% (瓦特/v) 葡萄糖在50毫升烧瓶。
- 摇晃文化隔夜 (12-16 小时) 在37°c 和200转每分钟。
- 服用250µL 不育80% 甘油和550µL 培养, 混合在2毫升管和储存为冷冻细胞库存在80摄氏度。
2. 新的最小介质 (NMM) 制备
注意: 此协议使用 NMM20作为化学定义的液体细菌生长培养基。此外, 建议严格遵守准备顺序。否则, 可能会发生降水。对于与材料表 (例如,氯化物) 中列出的氨基酸形式不同, 请检查溶解度。NMM19 含有19种氨基酸, 除了要替换的民航局 (这里, 脯氨酸) 由 ncAA 模拟。见表1的最后成分浓度。根据用于生产的细菌菌株, 生物素和硫胺可能是可选的。
- 氨基酸混合物的制备
- 在100毫升 ddH2O 中溶解0.5 克、多党和 Tyr, 加入几滴浓缩盐酸直到溶解。
- 将余下的16种氨基酸中的每一个重0.5 克。混合22毫升1米的2PO4和48毫升 1 M K2HPO4。添加 ddH2O 到 ~ 800 毫升。搅拌, 直到解决方案变得清晰。
- 添加溶解的 Tyr, 跨国激进党和 ddH, 并调整解决方案的体积为1升与2O。
- 用瓶顶过滤装置对氨基酸混合物进行真空过滤消毒。
- NMM19 库存解决方案
- 首先, 准备以下组件的 1 M 库存解决方案: (NH4)2, 所以4, KH2PO4, K2HPO 4, MgSO4和一个 5 M 股票溶液氯化钠。热处理消毒。
- 准备50毫升的 d-葡萄糖 (1 米), CaCl2 (1 克/升), FeCl2 (1 克/升) 的库存, 硫胺 (10 克/升), 生物素 (10 克/升) 和微量元素 (丘索4, ZnCl2, MnCl2, (NH4)2MoO4; 1 毫克/升).用注射器过滤器进行过滤消毒。
- NMM19 准备
- 混合所有库存解决方案以获得最终浓度为7.5 毫米 (NH4)2, 所以4, 1.7 毫米氯化钠, 22 毫米2PO4, 50 毫米 K2HPO4, 1 毫米 MgSO4和20毫米 d-葡萄糖, 50 毫克/升氨基酸混合, 1 µg CaCl2, 1 µg/升 FeCl2, 10 µg/升硫胺, 10 毫克/升生物素和0.01 µg/毫升微量元素。
3. 重组乳酸链球菌素与脯氨酸类似物的 SPI 表达
在本节中, prepeptide 的重组表达式 (这里: nisA) 和 PTM 基因 (这里: nisBC) 执行。首先, 细胞是生长在所有 cAAs 的存在, 因为 LB 复杂的媒介被使用。葡萄糖被添加到抑制目标基因表达的背景水平, 否则可能导致野生型肽 (这里: 乳酸菌素) 的生产, 由于泄漏的发起人。只有在目标的民航局 (在这里: 脯氨酸) 被耗尽后, ncAA 被添加, 目标基因表达在化学定义的培养基中诱导。液体培养的孵化应在适当的烧瓶中进行曝气 (例如, 500 毫升在2升锥形烧瓶 200 rpm)。
- 使用不育的吸管尖, 开始一个新鲜的隔夜文化从冰冻的细胞存量或新鲜的殖民地 (见步骤 1)。使用25毫升 LB 中含有氨苄西林, 卡那霉素和 1% (瓦特/v) 葡萄糖和孵化过夜 (12-16 小时) 在37摄氏度和 200 rpm。
- 接种1升的无菌新鲜培养基与10毫升隔夜养殖 (1% 伏/五) 和孵化在37°c 和 200 rpm, 直到 OD600 = 0.5。
- 离心机在4°c 为15分钟在 4500 x g。
- 用20毫升 NMM19 (在步骤2.3 中制备) 含有抗生素和 1% (并用重悬) 葡萄糖的颗粒倒入上清和。离心机在4°c 为10分钟在 4500 x g。
- 并用重悬细胞颗粒在同一培养基的500毫升和孵育在30°c 和 200 rpm 为 1 h。
注意: 在这一步, 民航局耗尽 (这里, 脯氨酸) 发生。 - 将文化分成平等的部分 (每一个 ncAA)。用1毫米异丙基β-1-thiogalactopyranoside (IPTG) 诱导每种培养, 并提供1毫米脯氨酸类似物 (4s/r-fluoroproline, 4s/r-羟脯氨醇或 4s/r-methanoproline)。
注: 作为控制, 一个文化可以提供1毫米脯氨酸, 导致野生型肽生产。 - 孵化过夜 (12-16 小时) 在28°c 和 200 rpm。
- 离心细胞培养在50毫升管在4°c 20 分钟在 5000 x g. 倒入上清和储存丸在-80 °c, 直到纯化。
4. 他标记的乳酸链球菌素类似物的分离和纯化
肽在变性条件下纯化, 盐酸胍 (图法分别) 39 是一种强变性.
注意: 图法分别是有害的, 如果吞咽或吸入, 导致皮肤和严重的眼睛发炎。戴上眼睛保护手套。
- 准备250毫升的捆绑缓冲器 (5 米图法分别, 300 毫米氯化钠, 25 毫米三, pH 7.4), 洗涤缓冲器 (300 毫米氯化钠, 25 毫米三, 25 毫米咪唑, pH 7.4) 和洗脱缓冲器 (300 毫米氯化钠, 25 毫米三, 250 毫米咪唑, pH 7.4)。对于这些, 把固体转化成一个250毫升瓶, 并填充高达200毫升与 ddH2o 混合良好, 并调整 pH 为7.4 与1米氢氧化钠或 HCl。然后, 用 ddH2填充多达250毫升, 使用瓶顶过滤单元过滤所有缓冲液。
- 细胞裂解
在这里, 使用一个 sonicator (200 W 最大高频 (HF) 输出);请注意, 对于其他仪器, 单元中断所需的电源设置可能会有所不同。所有步骤都在冰上执行。或者, 化学细胞裂解, 液体均质机或法国印刷机可以使用。- 在每个离心管 (从步骤 3.8) 和并用重悬的涡流中添加12毫升绑定缓冲器。
- 将 sonicator 探针的尖端浸入细胞悬浮液中。设置 sonicator 在40% 振幅与 1 s 的脉搏 5 s 关闭15分钟。
注: 清洗样品之间的 sonicator 尖端, 以避免结转。用70% 乙醇擦拭 sonicator 探针。 - 离心机裂解细胞悬浮在4°c 40 分钟在 1.5万 x g 到颗粒细胞碎片。将上清液转移到新的反应管上。
- 亲和层析
对于固定化金属离子亲和层析 (IMAC)40, 蠕动泵或 FPLC 系统可与1毫升墨盒 (此处填充镍 NTA 树脂) 一起使用。有关缓冲区的准备, 请参见步骤4.1。
注意: IMAC 纯化是可行的, 因为所生产的重组肽携带一个 N 末期他标记的领导者, 这是删除在步骤6由领导酶 NisP, 释放成熟的乳酸链球菌素。室温或摄氏4摄氏度进行净化。如果适用于 IMAC 墨盒, 请使用每分钟1毫升的流量。- 首先, 用 ddH2O 的5列卷 (cv) 来清洗墨盒, 以删除存储缓冲区。
- 平衡具有10个绑定缓冲区的 cv。
- 处理细胞裂解物 (步骤 4.2) 使用注射器过滤器去除微粒, 然后应用到弹药筒。
- 清洗与 15 cv 的洗涤缓冲, 以去除非特异性和未绑定的材料。
- 洗脱 10 cv 的洗脱缓冲和收集1毫升分数1.5 毫升管。将分数存储在4摄氏度, 短期 (最多3天) 或在-20 摄氏度的更长的期限。
- 对于存储, 用 10 ddH2O 的 cv 来清洗墨盒, 后跟 5 cv 20% 乙醇。
5. LC-ESI-飞行中乳酸链球菌素类似物的质谱分析
注: 参见材料表例如仪器为液相色谱与电喷雾电离飞行时间质谱 (LC-ESI-MS) 结合。
- 在具有流动相的水 (a) 和乙腈 (B) 的 C5 柱上进行 HPLC 分离15-20 µL 肽溶液 (在步骤4.3 中制备), 两者均辅以0.1% 甲酸和从 5-80% B 到20分钟的梯度。对于质谱 (MS), 使用5分钟后洗脱。
注: 根据多肽含量和亲和性的 HPLC 柱, 试样体积和分离可能需要优化。 - 使用适当的软件 deconvolute 测量的质量谱并计算不同的肽电荷状态41。将所观察到的肽类质量与民航局的计算的野生型质量进行比较→ ncAA 替代。考虑到线性 prepeptide 是 posttranslationally 修改八脱水 (-8 H2O) 和五 cyclizations (请参见图 1)。
注: 采用含钠缓冲液, 阳性模式的 MS 分析可以显示加合物钠。这些变得可看见作为另外的高峰以更高的 deconvoluted 质量 (为每个钠加合物, 被观察的 deconvoluted 质量是 22.99 Da 更高)。要去除这些加合物, 可以执行 HPLC纯化42 或广泛透析43。
6. 抗菌活性试验
- 无菌条件下 GM17-agar 板的制备
- 准备一夜文化的指示器应变L. 球菌NZ9000 运载质粒 pNG nisPT44在30°c 在 M17 汤45与 1% (瓦特/v) 葡萄糖 (= GM17) 和5µg/毫升氯霉素。
- 测量 od600, 接种新鲜的媒介到 od600 = 0.1 并且孵化直到 od600 = 0.4-0.6。然后把瓶子放在冰上。
注意: 每个 OD600度量都将消耗区域性卷。请记住, 每一个化验琼脂板, 1 毫升细菌培养将需要。如果需要, 请相应地放大液体培养卷。 - 1.5% 琼脂, 在玻璃培养基瓶中称4.5 克琼脂。添加300毫升 ddH2O、混合和高压釜。
- 准备 2x M17 汤 (两次浓缩) 在300毫升 ddH2O 和高压釜。
- 混合25毫升 2x M17 汤含有10µg/毫升氯霉素和2% 葡萄糖与1毫升L. 球菌preculture (4% v/v)。
- 添加25毫升熔融1.5% 琼脂 (新鲜蒸压或加热在微波炉)。
注: 在此之前, 让瓶子冷却到触摸 (约50°c)。这是必要的, 因为球菌是一种对高温敏感的温有机体。 - 把溶液倒入一个大的培养皿中。干板10-15 分钟。
- 用火焰消毒玻璃巴斯德吸管的末端。等待它冷却下来, 然后使用宽的末端在凝固的 GM17-agar 创造孔。
- 样品准备
- 取1毫升的大肠杆菌表达式区域性 (在步骤3.7 中创建) 在标签1.5 毫升管和离心机为3分钟在 7000 x g. 吸入剩余的培养基和并用重悬细胞颗粒在500µL 钠磷 (50 毫米磷酸钠缓冲, pH 为7.4 的磷酸二氢钠和0.5 米磷酸氢磷酸钠的0.5 米。
- 油脂实验在冰上的样品 (比较步骤 4.2.2)。将 sonicator 探针的尖端浸入细胞悬浮液中。设置 sonicator 在30% 振幅与脉冲 1 s 和 5 s 关闭3分钟。
- 离心细胞裂解物10分钟, 在 1.3万 x g 到颗粒细胞碎片。将上清液转移到冰上新的反应管上。
- 稀释和正常化细胞提取物上清液到1毫升OD 600 = 0.6, 相对于收获细胞密度, 与 Na P。
- 活动测试
- 将每个规范化的样本的40µL 添加到指示琼脂板的一个孔中 (图 3)。使用氯霉素在400µg/毫升作为抗菌控制化合物。使用洗脱缓冲器作为负控制。等到所有样品都扩散到琼脂中。在30摄氏度一夜之间孵化盘子。
- 使用平板扫描仪或数码相机拍摄琼脂板的图片。生长抑制晕大小可以用手或使用 ImageJ46来测量。
7. 荧光显微术
为了观察安培对细菌细胞的影响, 可以使用光和荧光显微镜。请注意, 乳酸链球菌素的作用方式依赖于细菌膜中的不稳定和孔隙的形成6。在这里, 尼罗河红被用来染色的细菌细胞膜, 它变得分散和聚集后, 细胞裂解。
注: 参见材料表例如仪器仪表。添加的 AMP 溶液的数量可以根据肽浓度和生物活性进行调整。
- 细胞制剂
- 在二甲基亚砜 (亚砜) 上制备10毫米尼罗河红液。
- 将L. 球菌指示器应变扩展到 OD600 = 1.0, 如步骤 6.1. 1-6. 1.2。
- 离心机1毫升培养3分钟在4°c 和 5000 x g。
- 放弃上清, 并用重悬1毫升磷酸盐缓冲盐水 (PBS)47。
- 离心机和并用重悬。
- 添加1µL 尼罗河红股票溶液, 轻轻搅拌。
- 显微图像采集
- 添加30µL 的细胞准备在一个封面幻灯片, 而令人兴奋的 520 nm。
- 集采集时间0.2 秒, 动能系列0.1 赫兹, 系列长度200幅图像。
- 添加 0.3-1.5 µL 细胞裂解或 IMAC 样品 (分别从步骤6.2.4 或 4.3.5)。对于 IMAC 样本, 洗脱缓冲器可以用作负控制。
- 监测和记录荧光发射在λ≥ 560 nm。
- 数据分析
- 显微图像序列存储为电影文件 (. avi)。使用 ImageJ46分析单个图像。
结果
本协议的目的是使生产的 ncAA-改良的乳酸菌素变种与残留特定的脯氨酸类似物的 SPI 方法。以前, 24 毫克/升的可行性和产量报告了重组生产完全改良野生型乳酸链球菌素39。使用 SPI 方法, 目标肽/蛋白质产量往往是好的, 可以达到接近野生型生产的数量48。作为第一次试验, 重组野生型 RiPP 生产应在选定的 auxotrophic 主机上进行测试。这里, 脯氨酸 auxotrophic大肠杆菌MG1655 ΔproBA:: 首次登记税δ进程:: 首次登记税 (DE3) 被用作寄主菌株。为 ncAAs 的加入, 培养和诱导时间以及培养基组成和温度可以优化, 以最大肽产量。
抗菌活性测定
根据上述协议, 对野生型重组乳酸链球菌素进行了生产和纯化。在这种情况下, 用脯氨酸代替其在步骤3.6 中的 ncAA 衍生物。采用抗菌活性测定法对 RiPP 的生产进行了验证, 并对纯化前后的抗菌活性进行了比较。对于活性测定, 洗脱分数和 IMAC 流动通过直接使用和测试的革兰阳性L. 球菌指示器应变 (图 2)。由于这一菌株表达 NisP, 在大肠杆菌细胞裂解物或纯化肽样品中所含的乳酸链球菌素变种, 分别由肽的蛋白水解裂解激活。显然, 通过流动显示了抑制生长的活动。这可以解释为生物活性材料不绑定到 IMAC 专栏。经测试的洗脱分数均显示, 与粗样品相比, 活性增加, 表明他的标签肽的浓度由 IMAC。请注意, 洗脱缓冲区 (作为负控制) 不会影响此检测中的球菌的增长。
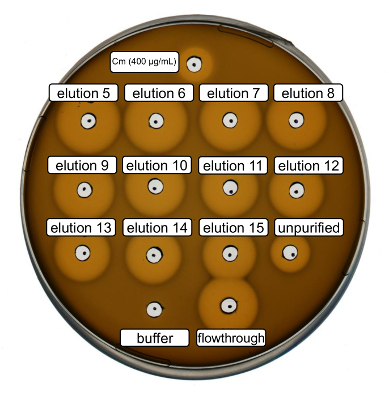
图 2.recombinantly 生产野生型乳酸链球菌素后的抗菌活性试验。洗脱分数5至 15, 通过与粗细胞裂解剂 (稀释的 OD600规范化) 相比, 测试了 IMAC 纯化的流量, 对L. 球菌指示器应变。生长抑制晕的大小表明了抗菌活性。以400µg/毫升浓度氯霉素为阳性对照, IMAC 洗脱缓冲器为阴性对照。请单击此处查看此图的较大版本.
为了证明 recombinantly 生产的含有六种不同脯氨酸类似物的乳酸链球菌素变种的抗菌活性, 进行了活性测定, 以测试对球菌指标菌株的抑制作用。图 3显示了使用脯氨酸类似物生产的六个样品中五的生长抑制。在模拟 (4R)-fluoroproline (4r)-羟脯氨酸和 (4S)-methanoproline 的合并实验中观察到的最佳结果 (从光晕大小判断)。将生长抑制晕的大小与野生型乳酸链球菌素的测定相比较, 所有三株乳酸菌素变种均有类似的抑制强度。然而, 由于不确定安培的浓度, 单独的光环大小不能用来对特定的活动进行驴子。因此, 化验结果只能定性地检验所产生的乳酸菌素变种的抗菌活性是否保留或丢失。为了确定特定的活动, 必须量化乳酸链球菌变种的浓度 (见讨论)。
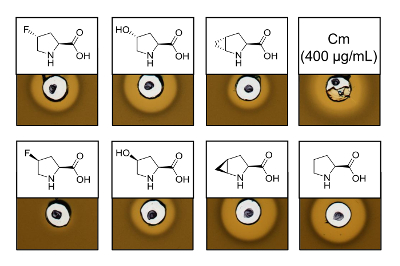
图 3.用脯氨酸类似物产生的通过SPI 的细胞裂解物的抗菌活性测定。乳酸链球菌素变种与重组野生型样品的比较。在细胞裂解后, 与收获细胞培养密度有关的所有样品均为600-规范化。晕指的是生物活性以指示菌株生长抑制的形式。第一行从左向右: (4R)-fluoroproline, (4r)-羟脯氨酸, (4R)-methanoproline 和氯霉素 (400 µg/毫升; 抗菌阳性对照)。第二行: (4S)-fluoroproline, (4s)-羟脯氨酸, (4S)-methanoproline 和脯氨酸 (野生型控制)。注意化学名称;例如,(4R)-fluoroproline 也称为反式-4 fluoroproline。请单击此处查看此图的较大版本.
质谱
在 IMAC 纯化后, 采用 LC-ESI-ncAAs 质谱法对乳酸链球菌素的加入进行了分析。图 4显示了包含 (4R)-fluoroproline 的乳酸菌素变体的 deconvoluted 质谱。这一变种是 IMAC 纯化如上所述, 事后分析的 LC-ESI-通过质谱, 所以它仍然携带的领导者。图 4A中的主峰值对应于已修改的含乳酸菌素 (4R)-fluoroproline, deconvoluted 质量为 6883.18 da (计算质量 6882.05 Da, 计算出相应的野生型肽与脯氨酸的质量位置9是 6864.06 Da)。两个峰的丰度和较高的质量对应加合物钠的指示。图 4B显示由反褶积算法发现的主化合物的不同电荷种类。例如, 峰值在1148.11 米/z 对应于六倍的带电物种 ([M+6H]6 +)。

图 4.具有 (4R)-fluoroproline 的 IMAC 纯化重组乳酸链球菌素的质谱。(A) Deconvoluted 质谱图谱 (在插入图中放大) 为乳酸链球菌变种 (仍然携带的领导者) 与 (4R)-fluoroproline (预期质量 (Da): [m + H]+ = 6882.05, [m + Na]+ = 6904.03, [M+2Na]2 += 6926.02)。(B)物种的复合光谱 [M + H]+。预期质量 (Da): [M+5H]5 + = 1377.41, [M+6H]6 + = 1148.01, [M+7H]7 + = 984.15, [M+8H]8 + = 861.26, [M+9H]9 + = 765.67, [M+10H]10 + = 689.21, [M+11H]11 + = 626.64, [M+12H]12 + = 574.50。请单击此处查看此图的较大版本.
荧光显微镜
通过对L. 球菌指示器应变通过荧光显微镜的直接观察, 可以看出重组乳酸链球菌素及其所含变种的抗菌活性。尼罗河红, 一种高度疏水性的荧光染料, 被用来染色细菌细胞膜。图 5显示了单元格区域性和单细胞形态学的聚合状态的质量变化。细胞被尼罗河红色染色, 并沉积在显微镜覆盖的幻灯片上。上一行在开始时直接显示单元格, 当缓冲区、重组野型乳酸链球菌素或含乳酸链球菌 (4r)-fluoroproline, 或 (4r)-羟脯氨酸添加。下部面板显示20分钟的孵化后的相应图像。
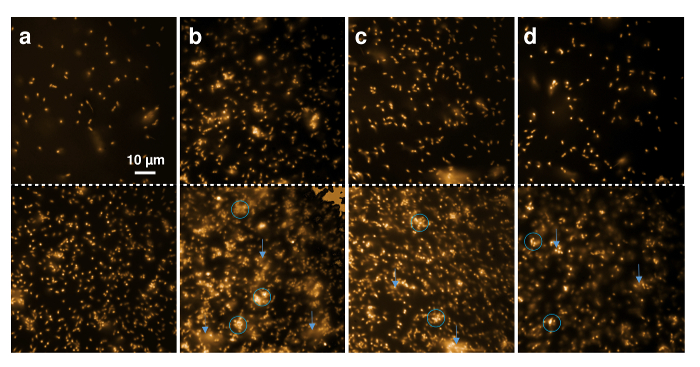
图 5.重组乳酸链球菌素对革兰阳性细胞的荧光显微术.显微图像30µL L. 球菌指示器应变 (OD600 = 1) 用尼罗河红色标记之前 (上部板) 和后 (下板) 20 分钟孵化与1µL 缓冲 (A), 0.3 µL 重组野生型乳酸链球菌素 (B) 和0.6 µL 乳酸菌素变种, 包含 (4R)-fluoroproline (C) 和 (4R)-羟脯氨酸 (D)。蓝色圆圈标记有聚集或变形细胞的区域, 蓝色箭头指向可以观察到荧光膜碎片扩散的区域。请单击此处查看此图的较大版本.
图 5A显示在观察20分钟内, 单元格的一般外观没有变化。只有在时间内沉积的细胞数量上升, 因此, 在观察到的区域的80µm x 80 µm 中可见大量的细胞。图 5B表明, 即使在低量 (这里, 0.3 µL IMAC 洗脱) 的情况下, 革兰阳性细胞在接触野生型乳酸链球菌素20分钟后出现聚集和模糊 (标记为蓝色圆圈)。此外, 轻质物质从细胞扩散到缓冲物中, 表明在时间范围内 (用蓝色箭头标记), 以尼罗河红色标记的膜碎片被动员起来。这些发现表明细胞裂解, 因为它被证明是在治疗与乳酸链球菌素6,49。在孵化后观察到类似的效果, 包括 (4R)-fluoroproline (图 5C) 和含乳酸菌素 (4R)-羟脯氨酸 (图 5D) 都显示大20分钟后扭曲和聚集的单元格的数量, 与控件示例 (图 5A) 显着对比。
| 组件 | 浓度 |
| (NH4)2因此4 | 7.5 毫米 |
| Nacl | 8.5 毫米 |
| 2PO4 | 22毫米 |
| K2HPO4 | 50毫米 |
| MgSO4 | 1毫米 |
| d-葡萄糖 | 20毫米 |
| 所有标准氨基酸 (除了要替换的那个) | 50毫克/升 |
| Ca2 + | 1µg/毫升 |
| Fe2 + | 1µg/毫升 |
| 微量元素 (Cu2 +, 锌2 +, 锰2 +, 卢武铉2 +) | 0.01 µg/毫升 |
| 硫胺素 | 10µg/毫升 |
| 素 | 10µg/毫升 |
表1。NMM19 化学定义细菌生长培养基的组成根据步骤2。
讨论
通过使用 SPI 来插入脯氨酸类似物, 可以大幅度地改变靶向的乳酸菌素结构, 创建具有独特序列组合和化学性质的新型肽变种。这样, 就可以规避经典基因技术的基本极限, 从而限制了 20 cAAs 的侧链化学。体内乳酸菌素的化学多样性如上文所示, 表明了一种一般的方法来补充天然 PTMs, 并显著提高 RiPPs 的化学空间。我们相信, 扩大天然氨基酸的汇辑, 特别是对安培有很大的希望。在蛋白质中, 可以通过定义的 20 cAAs 在三维结构中的排列来实现一个巨大的功能范围。只有 7-100 aa 长度为3, 只有通过 cAAs 才能实现此类结构特征的方法才会受到放大器的限制。因此, 不奇怪的是, RiPPs 形式的自然安培通常广泛地 translationally 修改后的4。以同样的方式, ncAAs 作为替代积木持有巨大的承诺, 以改善其药效学和药代动力学参数 (见鲍曼et 等) 201735和引用其中)。
在这项工作中使用的 SPI 方法得益于比较容易的实验设置, 直接执行和高重现性。由于全球的替代, 多站点的 ncAA 纳入目标肽也是可行的。另一方面, 该方法可能不足以取代经常发生在靶基因产品中的氨基酸。原则上, 不期望的位置可以通过站点定向诱变改变, 但这些额外的变化也可能影响几个 AMP 的性质, 包括结构和生物活性。一旦有了生产 auxotrophic 菌株, 就可以测试一些 ncAAs, 而不需要对遗传水平进行广泛的改变。此外, 该方法不仅限于 auxotrophic大肠杆菌菌株, 而且还可以使用天然生产宿主进行。例如, 周et表明, 用于生产新型 RiPPs 的 SPI 也在自然跨国激进党-营养缺陷型 L. 球菌: 使用定义的媒体, 三色氨酸类似物被纳入四个位置的乳酸链球菌50。
由于 SPI 方法导致了由 ncAA 全球替代选择的民航局, 它一般适用于广泛的目标肽和蛋白质。提供了一系列 auxotrophic大肠杆菌菌株 (请参见步骤 1), 允许对多个 cAAs 进行测试以 ncAAs 替换。使用metA缺陷菌株 (例如, B834 (DE3)) 合并的类似物通常被使用。isostructural 遇见类似物的例子是 azidohomoalanine (哈) 和 homopropargylglycine (Hpg), 商业上可利用的 ncAAs 可以有效地被结合。两者都引入 bioorthogonal 手柄, 允许附着携带兼容炔烃或叠氮化物功能的分子。例如, 荧光染料或聚乙二醇 (PEG) 基团可以被铜 (I) 催化叠氮化物炔烃 cycloaddition (CuAAC)51所附。
虽然重组的 ncAA 方法 (SPI 和 SCS) 通常达到足够的目标数量, 但产量往往减少相对于野生型生产的相应的肽和蛋白质。由于纯度经常与生产效率相关, 可能需要额外的净化步骤, 特别是对于低丰种。在这一特定的重组链球菌生产的情况下, 他标记的领导序列大大简化了 RiPP 纯化的选择性浓缩从细胞裂解物。本协议所示的纯化改善了乳酸链球菌素的纯度和浓度, 但往往不产生纯度, 足以确定产量和特定的活动。除 IMAC 外, 常用的安培纯化方法包括高效液相色谱法、离子交换层析法 (IEC) 和降水 (例如使用丙酮或乙酸酸 (TCA)) 或其组合-导致多步法纯化方案52.应该指出, 它们通常多聚阳离子的性质可以促进 IEC 纯化。冷冻干燥常用于贮存纯化的安培。
理想情况下, ncAAs 应以可负担的价格在商业上提供, 或者通过简单和可再生的化学合成协议轻易地产生。SPI 方法的一个同样重要的先决条件是, ncAA 被认可, 激活和充电到同源 tRNA 由内生或共同表达的 aaRS。这可以通过氨基酸活化或 tRNA aminoacylation 化验53来测试体外。作为一种简单的替代方法, 在存在和不存在 ncAA 补充的情况下进行的模型蛋白如绿色荧光蛋白 (GFP) 的 SPI 测试表达可以进行。此外, 可溶性在生长介质和细胞通透性以及化学稳定性等方面都是重要的因素。
在这个例子中, 用革兰阳性指示器菌株筛选抗菌活性。当它表达的领导者酶 NisP, 最后一步的乳酸菌素成熟是催化。清除的领导序列 (他标记为净化目的) 也可以执行在体外通过治疗与纯化 NisP50或胰蛋白酶54。在这项工作范围之外, 病原体和多药耐药性菌株可以通过类似的方法测试安培的抑菌或杀菌抑制作用。临床相关目标种类包括 MRSA、MDR结核分枝杆菌、VRE、鲍曼不动杆菌、肺炎链球菌、铜绿假单胞菌和肺炎克雷伯菌。除琼脂板块扩散试验外, 还可以利用适当的液体培养基接种细菌, 并辅以 AMP, 生长抑制。使用肉汤稀释法, 可以用纯肽55确定最小抑制浓度 (MIC)。这里介绍的活性测定也可用于估算与参考化合物相关的含安培溶液的生物活性和效力, 例如商业上可用的乳酸链球菌素。
RiPPs 的重组生产通常是可行的39, 通常包括 PTM 基因的共同表达。一旦生产菌株转移到含有合适的 ncAA 的化学定义或合成的最小介质中, 相应的民航局的残渣特定替换就会发生。因此, 其他 RiPPs 可以用同样的方法产生, 前提是它们的重组生产是可行的, 并且在 ncAA 的合并和 PTM 产生足够数量的目标产品时可以找到条件。注意, 除了宿主细胞蛋白质组, 肽 PTM 机械也可以成为 ncAA-修改在 SPI。因此, 目标表达诱导的时间和以下潜伏期的长度都需要优化。因为 ncAA 入 PTM 酵素可能影响他们的稳定和活动, 被处理的 RiPP 的生产原则上可能被影响。经 MS 和生物活性测定发现, 经加工 prepeptide 的形成, 充分 PTM 酶的有效性。如前所述, 可以使用不同的诱导性促进剂, 以产生 PTM 基因首先 (在没有 ncaa) 之后, 诱导的前体肽基因在存在的 ncaa。一般而言, 在加入 ncAA 之前, 必须先抑制含有包含的目标肽的生产, 这就是为什么需要对前体基因进行严密压制。在本议定书中, 这是通过将葡萄糖添加到生长培养基中的分解抑制而实现的。特别是由于 prepeptide 处理所需的 PTM 酶通常来源于遗传的远端宿主, 因此如果重组生产尚未被应用, 则相应基因的表达温度和密码子的使用都需要优化。建立。原则上, ncAAs 在 prepeptide 中的存在会干扰 PTM 酶的识别和处理, 如乳酸链球菌素 NisBC 和 NisP。为使 ncAA 纳入安培, 因此建议进行小规模表达实验, 首先确定合适的表达条件和可靠性的安培活性测定。
披露声明
作者声明他们没有竞争的财政利益。
致谢
约、肺结核和手机承认欧盟 FW7 计划 (SYNPEPTIDE) 提供的资金。F.-T.F. 承认联邦教育和科学部 (BMBF 项目 "热休克 2020"、WIMIplus 项目 SynTUBio) 和德国研究基金会 ("统一的催化概念") 的资助。
材料
| Name | Company | Catalog Number | Comments |
| sodium chloride | Carl Roth, Germany | P029 | |
| guanidine hydrochloride | Carl Roth, Germany | 0035.2 | |
| dipotassium hydrogen phosphate | Carl Roth, Germany | P749.3 | |
| potassium dihydrogen phosphate | Carl Roth, Germany | 3904.3 | |
| sodium dihydrogen phosphate monohydrate | Carl Roth, Germany | K300.2 | |
| disodium hydrogen phosphate | Carl Roth, Germany | P030.2 | |
| L-alanine | Carl Roth, Germany | 3076.2 | |
| L-arginine | Carl Roth, Germany | 3144.3 | |
| L-asparagine monohydrate | Carl Roth, Germany | HN23.1 | |
| L-aspartic acid | Carl Roth, Germany | T202.1 | |
| L-cysteine | Carl Roth, Germany | 3467.3 | |
| L-glutamine | Carl Roth, Germany | 3772.1 | |
| L-glutamic acid | Carl Roth, Germany | 3774.1 | |
| L-glycine | Carl Roth, Germany | 3187.3 | |
| L-histidine | Carl Roth, Germany | 3852.3 | |
| L-isoleucine | Carl Roth, Germany | 3922.3 | |
| L-leucine | Carl Roth, Germany | 3984.3 | |
| L-lysine monohydrate | Carl Roth, Germany | 4207.2 | |
| L-methionine | Carl Roth, Germany | 9359.4 | |
| L-phenylalanine | Carl Roth, Germany | 4491.2 | |
| L-proline | Carl Roth, Germany | T205.3 | |
| L-serine | Carl Roth, Germany | 4682.4 | |
| L-threonine | Carl Roth, Germany | T206.2 | |
| L-tryptophan | Carl Roth, Germany | 4858.2 | |
| L-tyrosine | Carl Roth, Germany | T207.2 | |
| L-valine | Carl Roth, Germany | 4879.4 | |
| ammonium sulfate | Carl Roth, Germany | 3746.3 | |
| magnesium sulfate | Carl Roth, Germany | 0261.2 | |
| D-glucose | Carl Roth, Germany | 6780 | prepare a 20% (w/v) solution for addition into molten agar |
| calcium chloride | Carl Roth, Germany | PN93.2 | |
| iron(II) chloride | Sigma-Aldrich, Germany | 372870 | |
| thiamine hydrochloride | Sigma-Aldrich, Germany | T1270 | |
| biotin | Carl Roth, Germany | 3822.2 | |
| copper(II) sulfate | Merck, Germany | 102792 | |
| manganese(II) chloride | Carl Roth, Germany | KK36.2 | |
| zinc chloride | Merck, Germany | 108816 | |
| immonium orthomolybdate | Sigma-Aldrich, Germany | 277908 | |
| glycerol | Carl Roth, Germany | 7533.3 | |
| isopropyl β-D-1-thiogalactopyranoside | Sigma-Aldrich, Germany | I6758 | |
| ampicillin sodium salt | Carl Roth, Germany | K029.5 | working concentration 100 µg/mL for E. coli, prepare 100 mg/mL stock in ddH2O |
| kanamycin sulfate | Carl Roth, Germany | T832.2 | working concentration 50 µg/mL for E. coli, prepare 50 mg/mL stock in ddH2O |
| chloramphenicol | Carl Roth, Germany | 3886.1 | working concentration 5 µg/mL for L. lactis, prepare 37 mg/mL stock in ethanol |
| (4S)-fluoroproline | Bachem, Switzerland | F-3970 | |
| (4R)-fluoroproline | Bachem, Switzerland | F-3975 | |
| (4S)-hydroxyproline | Bachem, Switzerland | F-1395 | |
| (4R)-hydroxyproline | Bachem, Switzerland | F-2980 | |
| (4S)-methanoproline | chemically synthesized | ||
| (4R)-methanoproline | chemically synthesized | ||
| hydrochloric acid (HCl) | Carl Roth, Germany | P074.4 | |
| ethanol | VWR, Germany | 20825.324 | |
| M17-broth | Sigmal-Aldrich, Germany | 56156 | commercial product, see Terzaghi BE & Sandine WE, Appl Microbiol., 1975, 29(6):807-13 for contents and preparation |
| agar-agar | Carl Roth, Germany | 5210.5 | |
| Nisin from Lactococcus lactis | Sigma-Aldrich, Germany | N5764 | commercial product, can be used as reference for bioactivity |
| dimethyl sulfoxide (DMSO) | Carl Roth, Germany | A994.1 | |
| imidazole | Carl Roth, Germany | 3899.3 | |
| 1.5 mL autosampler vial for LC-MS | Sigma-Aldrich, Germany | Supelco 854165 | |
| acetonitrile | VWR, Germany | HiPerSolv CHROMANORM ULTRA for LC-MS, 83642 | LC-MS grade required |
| formic acid | VWR, Germany | HiPerSolv CHROMANORM for LC-MS, 84865 | LC-MS grade required |
| 1 mL Ni-NTA IMAC column, e.g. HisTrap FF Crude | GE Healthcare, UK | 29-0486-31 | different manufacturers and resins available for IMAC |
| 0.45 µm bottle top filter unit | VWR, Germany | 10040-470 | sterile filtration of solutions using a vacuum pump |
| 0.45 µm syringe filter PVDF membrane | Carl Roth, Germany | CCY1.1 | sterile filtration of solutions using a syringe and to remove particles from cell lysates |
| luer-lock syringe, PP, 50 ml | Carl Roth, Germany | T552.2 | sterile filtration of solutions |
| 1.5 mL Eppendorf tubes | Eppendorf, Germany | 30120086 | |
| petri dishes (polystyrene, sterile) | Carl Roth, Germany | TA19 | |
| Nile red | Sigma-Aldrich, Germany | 72485 | |
| E. coli ΔproA strain | CGSC, Keio collection | JW0233-2 | proline-auxotrophic E. coli K-12 strain |
| E. coli B834(DE3) | Novagen (Merck), Germany | 69041 | methionine-auxotrophic E. coli B strain |
| λDE3 Lysogenization Kit | Novagen (Merck), Germany | 69734-3 | |
| Lactococcus lactis NZ9000 pNG nisPT | bacterial indicator strain, see Khusainov R & Kuipers OP, PLoS One, 8 (9), e74890 | ||
| benchtop centrifuge for 1.5 mL Eppendorf tubes | Eppendorf, Germany | 5427 R | |
| peristaltic pump | GE Healthcare, UK | P1 | |
| FPLC system | GE Healthcare, UK | Äkta Purifier 10 or the like | |
| inverted microscope | Nikon | TI Eclipse wide-field fluorescence microscope with 100x (N.A. 1.4) objective and Mercury Lamp | example setup for fluorescence microscopy |
| electron multiplying CCD (EMCCD) camera | Andor Technologies, UK | Andor Luca | example setup for fluorescence microscopy |
| fluorescence excitation filter | Thorlabs, USA | Dichroic cube (TLV-U-MF2-TRITC) | example setup for fluorescence microscopy |
| fluorescence emission filter | AHF Analysentechnik, Germany | T 560 LPXR | example setup for fluorescence microscopy |
| cover slip 24 x 60 mm | Carl Roth, Germany | LH26.1 | example setup for fluorescence microscopy |
| Immersion Oil | Carl Zeiss, Germany | Immersol 518 F | example setup for fluorescence microscopy |
| probe sonicator | Bandelin, Germany | Sonopuls HD3200 with sonotrode MS-72 | 200 W maximum HF output |
| C5 HPLC column (2.1x100 mm, 3 µm particle size) | Sigma-Aldrich, Germany | 567227-U | example setup for mass spectrometry |
| ESI-TOF coupled to HPLC system | Agilent, USA | Agilent 6530 Accurate Mass QTOF with 1260 HPLC | example setup for mass spectrometry |
参考文献
- Ferri, M., Ranucci, E., Romagnoli, P., Giaccone, V. Antimicrobial resistance: A global emerging threat to public health systems. Crit Rev Food Sci Nutr. 57 (13), 2857-2876 (2017).
- Bahar, A. A., Ren, D. Antimicrobial peptides. Pharmaceuticals. 6 (12), 1543-1575 (2013).
- Ageitos, J. M., Sánchez-Pérez, A., Calo-Mata, P., Villa, T. G. Antimicrobial peptides (AMPs): Ancient compounds that represent novel weapons in the fight against bacteria. Biochem Pharmacol. 133, 117-138 (2017).
- Arnison, P. G., et al. Ribosomally synthesized and post-translationally modified peptide natural products: overview and recommendations for a universal nomenclature. Nat Prod Rep. 30 (1), 108-160 (2013).
- Lubelski, J., Rink, R., Khusainov, R., Moll, G. N., Kuipers, O. P. Biosynthesis, immunity, regulation, mode of action and engineering of the model lantibiotic nisin. Cell Mol Life Sci. 65 (3), 455-476 (2008).
- Shin, J. M., Gwak, J. W., Kamarajan, P., Fenno, J. C., Rickard, A. H., Kapila, Y. L. Biomedical applications of nisin. J Appl Microbiol. 120 (6), 1449-1465 (2016).
- Scherer, K. M., Spille, J. -. H., Sahl, H. -. G., Grein, F., Kubitscheck, U. The lantibiotic nisin induces lipid II aggregation, causing membrane instability and vesicle budding. Biophys J. 108 (5), 1114-1124 (2015).
- Jung, G. Lantibiotica - ribosomal synthetisierte Polypeptidwirkstoffe mit Sulfidbrücken und α,β-Didehydroaminosäuren. Angew Chemie. 103 (9), 1067-1084 (1991).
- Rink, R., et al. Lantibiotic structures as guidelines for the design of peptides that can be modified by lantibiotic enzymes. Biochemistry. 44 (24), 8873-8882 (2005).
- Lagedroste, M., Smits, S. H. J., Schmitt, L. Substrate Specificity of the Secreted Nisin Leader Peptidase NisP. Biochemistry. 56 (30), 4005-4014 (2017).
- Ross, A. C., Liu, H., Pattabiraman, V. R., Vederas, J. C. Synthesis of the lantibiotic lactocin S using peptide cyclizations on solid phase. J Am Chem Soc. 132 (2), 462-463 (2010).
- Fukase, K., et al. Synthetic Study on Peptide Antibiotic Nisin. V. Total Synthesis of Nisin. Bull Chem Soc Jpn. 65 (8), 2227-2240 (1992).
- Dumas, A., Lercher, L., Spicer, C. D., Davis, B. G. Designing logical codon reassignment - Expanding the chemistry in biology. Chem Sci. 6 (1), 50-69 (2015).
- Kuthning, A., Durkin, P., Oehm, S., Hoesl, M. G., Budisa, N., Süssmuth, R. D. Towards Biocontained Cell Factories: An Evolutionarily Adapted Escherichia coli Strain Produces a New-to-nature Bioactive Lantibiotic Containing Thienopyrrole-Alanine. Sci Rep. 6, 33447 (2016).
- Piscotta, F. J., Tharp, J. M., Liu, W. R., Link, A. J. Expanding the chemical diversity of lasso peptide MccJ25 with genetically encoded noncanonical amino acids. Chem Commun (Camb). 51 (2), 409-412 (2015).
- Hartman, M. C. T., Josephson, K., Lin, C. -. W., Szostak, J. W. An expanded set of amino acid analogs for the ribosomal translation of unnatural peptides. PLoS One. 2 (10), 972 (2007).
- Johnson, J. A., Lu, Y. Y., Van Deventer, J. A., Tirrell, D. A. Residue-specific incorporation of non-canonical amino acids into proteins: recent developments and applications. Curr Opin Chem Biol. 14 (6), 774-780 (2010).
- Ibba, M., Söll, D. Aminoacyl-tRNAs: setting the limits of the genetic code. Genes Dev. 18 (7), 731-738 (2004).
- Studier, F. W., Moffatt, B. A. Use of bacteriophage T7 RNA polymerase to direct selective high-level expression of cloned genes. J Mol Biol. 189 (1), 113-130 (1986).
- Budisa, N., Steipe, B., Demange, P., Eckerskorn, C., Kellermann, J., Huber, R. High-level biosynthetic substitution of methionine in proteins by its analogs 2-aminohexanoic acid, selenomethionine, telluromethionine and ethionine in Escherichia coli. Eur J Biochem. 230 (2), 788-796 (1995).
- Rink, R., et al. Dissection and modulation of the four distinct activities of nisin by mutagenesis of rings A and B and by C-terminal truncation. Appl Environ Microbiol. 73 (18), 5809-5816 (2007).
- Kubyshkin, V., Durkin, P., Budisa, N. Energetic contribution to both acidity and conformational stability in peptide models. New J Chem. 40 (6), 5209-5220 (2016).
- Molloy, E. M., Field, D., O'Connor, P. M., Cotter, P. D., Hill, C., Ross, R. P. Saturation mutagenesis of lysine 12 leads to the identification of derivatives of nisin A with enhanced antimicrobial activity. PLoS One. 8 (3), 58530 (2013).
- Wang, L., Brock, A., Herberich, B., Schultz, P. G. Expanding the genetic code of Escherichia coli. Science. 292 (5516), 498-500 (2001).
- Liu, C. C., Schultz, P. G. Adding new chemistries to the genetic code. Annu Rev Biochem. 79, 413-444 (2010).
- Anderson, J. C., Wu, N., Santoro, S. W., Lakshman, V., King, D. S., Schultz, P. G. An expanded genetic code with a functional quadruplet codon. Proc Natl Acad Sci U S A. 101 (20), 7566-7571 (2004).
- Zambaldo, C., Luo, X., Mehta, A. P., Schultz, P. G. Recombinant macrocyclic lanthipeptides incorporating non-canonical amino acids. J Am Chem Soc. 139 (34), 11646-11649 (2017).
- Al Toma, R. S., et al. Site-directed and global incorporation of orthogonal and isostructural noncanonical amino acids into the ribosomal lasso peptide capistruin. Chembiochem. 16 (3), 503-509 (2015).
- Chatterjee, A., Xiao, H., Schultz, P. G. Evolution of multiple, mutually orthogonal prolyl-tRNA synthetase/tRNA pairs for unnatural amino acid mutagenesis in Escherichia coli. Proc Natl Acad Sci U S A. 109 (37), 14841-14846 (2012).
- Budisa, N., Pal, P. P. Designing novel spectral classes of proteins with a tryptophan-expanded genetic code. Biol Chem. 385 (10), 893-904 (2004).
- Voller, J. -. s., Thi To, T. M., Biava, H., Koksch, B., Budisa, N. Global substitution of hemeproteins with noncanonical amino acids in Escherichia coli with intact cofactor maturation machinery. Enzyme Microb Technol. 106, 55-59 (2017).
- Moghal, A., Hwang, L., Faull, K., Ibba, M. Multiple Quality Control Pathways Limit Non-protein Amino Acid Use by Yeast Cytoplasmic Phenylalanyl-tRNA Synthetase. J Biol Chem. 291 (30), 15796-15805 (2016).
- Datsenko, K. A., Wanner, B. L. One-step inactivation of chromosomal genes in Escherichia coli K-12 using PCR products. Proc Natl Acad Sci U S A. 97 (12), 6640-6645 (2000).
- Engelke, G., Gutowski-Eckel, Z., Hammelmann, M., Entian, K. D. Biosynthesis of the lantibiotic nisin: genomic organization and membrane localization of the NisB protein. Appl Environ Microbiol. 58 (11), 3730-3743 (1992).
- Baumann, T., Nickling, J. H., Bartholomae, M., Buivydas, A., Kuipers, O. P., Budisa, N. Prospects of In vivo Incorporation of Non-canonical Amino Acids for the Chemical Diversification of Antimicrobial Peptides. Front Microbiol. 8, 124 (2017).
- Plat, A., Kluskens, L. D., Kuipers, A., Rink, R., Moll, G. N. Requirements of the engineered leader peptide of nisin for inducing modification, export, and cleavage. Appl Environ Microbiol. 77 (2), 604-611 (2011).
- JoVE Science Education Database. Basic Methods in Cellular and Molecular Biology. Bacterial Transformation: The Heat Shock Method. J Vis Exp. , (2017).
- JoVE Science Education Database. Basic Methods in Cellular and Molecular Biology. Bacterial Transformation: Electroporation. J Vis Exp. , (2017).
- Shi, Y., Yang, X., Garg, N., van der Donk, W. A. Production of lantipeptides in Escherichia coli. J Am Chem Soc. 133 (8), 2338-2341 (2011).
- Hochuli, E., Bannwarth, W., Döbeli, H., Gentz, R., Stüber, D. Genetic Approach to Facilitate Purification of Recombinant Proteins with a Novel Metal Chelate Adsorbent. Nat Biotechnol. 6 (11), 1321-1325 (1988).
- Zhang, Z., Marshall, A. G. A universal algorithm for fast and automated charge state deconvolution of electrospray mass-to-charge ratio spectra. J Am Soc Mass Spectrom. 9 (3), 225-233 (1998).
- JoVE Science Education Database. High-Performance Liquid Chromatography (HPLC). J Vis Exp. , (2017).
- JoVE Science Education Database. Dialysis: Diffusion Based Separation. J Vis Exp. , (2017).
- Khusainov, R., Kuipers, O. P. The presence of modifiable residues in the core peptide part of precursor nisin is not crucial for precursor nisin interactions with NisB- and NisC. PLoS One. 8 (9), 74890 (2013).
- Terzaghi, B. E., Sandine, W. E. Improved medium for lactic streptococci and their bacteriophages. Appl Microbiol. 29 (6), 807-813 (1975).
- Schindelin, J., Rueden, C. T., Hiner, M. C., Eliceiri, K. W. The ImageJ ecosystem: An open platform for biomedical image analysis. Mol Reprod Dev. 82 (7-8), 518-529 (2015).
- . Phosphate-buffered saline (PBS). Cold Spring Harb Protoc. 2006 (1), (2006).
- van Hest, J. C. M., Tirrell, D. A. Efficient introduction of alkene functionality into proteins in vivo. Febs Lett. 428 (1-2), 68-70 (1998).
- Prince, A., et al. Lipid-II Independent Antimicrobial Mechanism of Nisin Depends On Its Crowding And Degree Of Oligomerization. Sci Rep. 6 (1), 37908 (2016).
- Zhou, L., et al. Incorporation of tryptophan analogues into the lantibiotic nisin. Amino Acids. 48 (5), 1309-1318 (2016).
- Presolski, S. I., Hong, V. P., Finn, M. G. Copper-Catalyzed Azide-Alkyne Click Chemistry for Bioconjugation. Curr Protoc Chem Biol. 3 (4), 153-162 (2011).
- Abts, A., et al. Easy and rapid purification of highly active nisin. Int J Pept. 2011, 175145 (2011).
- Francklyn, C. S., First, E. A., Perona, J. J., Hou, Y. -. M. Methods for kinetic and thermodynamic analysis of aminoacyl-tRNA synthetases. Methods. 44 (2), 100-118 (2008).
- van Heel, A. J., et al. Production and Modification of Five Novel Lantibiotics Using the Promiscuous Nisin Modification Machinery. ACS Synth Biol. 5 (10), 1146-1154 (2016).
- Wiegand, I., Hilpert, K., Hancock, R. E. W. Agar and broth dilution methods to determine the minimal inhibitory concentration (MIC) of antimicrobial substances. Nat Protoc. 3 (2), 163-175 (2008).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。