Method Article
Peptídeos antimicrobianos produzidos pela incorporação de pressão seletiva de aminoácidos não-canônicos
* Estes autores contribuíram igualmente
Neste Artigo
Resumo
O protocolo apresenta o Escherichia coli-baseado pressão seletiva incorporação de aminoácidos não-canônicos (ncAAs) a lactococcal peptídeo antimicrobiano nisina. Suas propriedades podem ser alteradas durante a expressão recombinantes através de substituição com ncAAs desejado em meios de crescimento definido. As alterações resultantes na Bioatividade são mapeadas por ensaios de inibição de crescimento e de microscopia de fluorescência.
Resumo
A natureza tem uma variedade de possibilidades para criar novas funções de proteínas modificando a sequência dos blocos de construção de cada aminoácido. No entanto, todas as variações baseiam-se os 20 aminoácidos canônicos (cAAs). Como uma maneira de introduzir os polipeptídeos adicionais propriedades físico-químicas, a incorporação de aminoácidos não-canônicos (ncAAs) é cada vez mais usada na engenharia de proteínas. Devido à sua extensão relativamente curta, a modificação de peptídeos ribosomally sintetizados e post-translationally modificados por ncAAs é particularmente atraente. Novas funcionalidades e alças de químicas podem ser geradas por alterações específicas de resíduos individuais. O método de incorporação (SPI) de pressão seletiva utiliza cepas auxotróficos anfitrião que são privadas de um aminoácido essencial em meios quimicamente definidas de crescimento. Vários análogos de aminoácido estruturalmente e quimicamente semelhante podem então ser ativados pelo correspondente aminoacil-tRNA sintetase e fornecem resíduos específicos cAA(s) substituições de ncAA(s) → na sequência do peptide ou proteína alvo. Embora, no contexto do método SPI, ncAAs são também incorporadas o proteome anfitrião durante a fase de expressão de gene recombinante, a maioria dos recursos da célula é atribuída à expressão do gene do alvo. Isto permite eficiente incorporação de resíduos específicos de ncAAs muitas vezes acompanhada com quantidades elevadas de destino modificado. O trabalho apresentado descreve na vivo incorporação de seis análogos de prolina a nisina peptídeo antimicrobiano, uma lantibiotic naturalmente produzida por Lactococcus lactis. Propriedades antimicrobianas da nisina podem ser alteradas e ampliadas durante sua fermentação e expressão em Escherichia coli de auxotróficos estirpes em meios de crescimento definido. Desse modo, os efeitos da substituição de resíduos específicos da cAAs com ncAAs podem proporcionar mudanças na especificidade e atividade antimicrobiana. Ensaios de atividade antimicrobiana e microscopia de fluorescência são usados para testar as novas variantes de nisina para inibição do crescimento de uma estirpe de indicador de Gram-positivas Lactococcus lactis . Espectroscopia de massa é usada para confirmar a incorporação da ncAA em variantes de nisina bioativos.
Introdução
A descoberta de antibióticos no século XX e o desenvolvimento paralelo de novos compostos antimicrobianos contra microorganismos patogênicos habilitados direcionados tratamentos de infecções bacterianas. No entanto, devido ao surgimento de patógenos multirresistentes como resistente à meticilina Staphylococcusaureus (MRSA), enterococos resistentes à vancomicina (VRE), MDR (multirresistentes) Salmonella typhimurium fago tipo 10 (DT10 ), e Klebsiella pneumoniae, é urgentemente necessário gerar novos agentes antimicrobianos1. Peptídeos antimicrobianos (AMPs) são compostos versáteis, muitas vezes altamente específicos que são candidatos promissores para o desenvolvimento de novas drogas, graças a suas propriedades físico-químicas, flexibilidade, tamanho, hidrofobicidade e modo de acção2. Amplificadores são pequenos peptídeos geralmente consiste de 7-100 aminoácidos. Muitas vezes, eles têm uma estrutura catiônica rica em resíduos carregados positivamente de arginina e lisina, que interagem com a membrana celular microbiana direcionada, que oposta é cobrada3. Um subgrupo especial de amplificadores são peptídeos ribosomally sintetizado e modificado posttranslationally (RiPPs)4. Estes são produzidos por muitos organismos do Reino dos fungos e o domínio das bactérias. Um do mais conhecido e amplamente utilizado RiPPs é nisina, naturalmente produzida pela bactéria ácido láctico Lactococcus lactis (L. lactis). Ativo contra um painel de bactérias gram-positivas, nisina tem sido usada como um biopreservative na indústria de alimentos para mais de 50 anos, devido às suas propriedades antimicrobianas e ausência de resistência evoluída no cepas microbianas alvo5. Estudos têm mostrado que a nisina desestabiliza e gera poros em membranas de pilha bacterianas, levando a atividade antimicrobiana contra ambos os patógenos Gram-positivas e Gram-negativas6. Por ligação de lipídios II, síntese da parede celular bacteriana é inibida7. A nisina é codificada por nisA como um peptídeo precursor linear, que é composto de um líder e uma região de peptídeo de núcleo (Figura 1). Após a síntese ribossomal, prenisin primeiro é modificado pelo dehidratase NisB. Aqui, resíduos de serina e treonina na região prepeptide do núcleo são desidratados para dehydroalanine (Dha) e dehydrobutyrine (Dhb)8. Posteriormente, os resíduos desidratados são acoplados com cisteína para anéis de forma lanthionine (daí o nome "lantibiotic" para lanthionine anel contendo antibióticos) por uma adição de Michael catalisada por enzima. Esta modificação pós-traducional (PTM) é catalisada pela ciclase NisC. Em L. lactis, o prenisin modificado é então transportado fora da célula por transporte NisT, e o peptídeo líder é clivado pela protease NisP para liberar o formulário nisina maduro e ativo9. O peptidase líder responsável NisP tem uma alta especificidade, uma vez que somente processos modificados nisina eficientemente10.
Em geral, ativos RiPPs resultar da ação de enzimas PTM (por exemplo NisBC), que aumentam drasticamente o espaço químico de peptides curtos, por exemplo, através de acetilação, glicosilação, metilação ou fosforilação. Este nível de complexidade pode ser expandida ainda mais pela incorporação direta de ncAAs. Enquanto muitas vezes viável, síntese química de AMPs é um desafio para a produção em larga escala devido à sua complexidade estrutural. Por exemplo, a síntese química total do lactosin lantibiotic S em 71 passos de reação foi conseguida com um rendimento final de 10% e o de nisina com um rendimento bruto de 0,003%11,12. Portanto, a produção biológica oferece uma alternativa viável, devido a geração de estereocentros corretos e produto de alta concentração.
Até hoje, mais de 150 ncAAs, por exemplo, tendo grupos funcionais contendo flúor ou azidas, foram incorporadas proteínas recombinantes e vários exemplos de amplificadores ncAA-modificado foram relatados13,14, 15,16. Com a introdução do ncAAs, romance propriedades físico-químicas podem ser geradas em comparação com o mutagenesis convencional. A diversidade dos peptídeos existentes pode ser aumentada, possivelmente levando a novos antibióticos.
Um método para a incorporação de ncAAs peptídeos recombinantes é incorporação de pressão seletiva (SPI) baseada na utilização de cepas bacterianas auxotróficos17. Estas variedades não são capazes de sintetizar o correspondente analógico de cAA do ncAA. A metodologia usa a especificidade de substrato relaxante frequentemente observado, uma característica de muitos naturais aminoacil-tRNA sintetases (aaRSs)18. Além de seus substratos naturais de cAA, estas enzimas são frequentemente capazes de reconhecer e ativar o ncAA desejado e carregá-lo em sua cognata tRNA(s). Isto leva a incorporação ribosomal da ncAA para o produto do gene alvo em forma de resíduo-específica (ou seja, cAA → ncAA substituição). Isto naturalmente só é possível quando o ncAA desejado é estrutural e quimicamente semelhante ao ácido aminado canônico e tolerado pela fisiologia da célula, a maquinaria de tradução e a sequência do alvo do peptide ou proteína. Em uma instalação experimental particular, as células hospedeiras auxotróficos são cultivadas em meio definido fornecido com uma concentração limitante do aminoácido nativo para ser substituído. O crescimento celular ou troca por cAA-livre médio leva à depleção intracelular de cAA. Na próxima etapa, a ncAA é adicionado e a expressão do gene alvo é induzida. Inevitavelmente, ncAAs são agora também incorporados em muitas outras proteínas na célula hospedeira durante esta fase da expressão do gene alvo. Não obstante, a toxicidade da instalação do SPI é mantida em um nível baixo desde que a cepa de Escherichia coli (e. coli) é transformada com um plasmídeo que carreg o gene alvo sob controle de um promotor forte (comumente o promotor T7 altamente competitivo / Sistema de RNA polimerase)19. Imediatamente após a indução (geralmente quando o cAA está esgotado), o host células deixam de crescer e suas machineries citoplasmáticos enzimáticos são utilizados principalmente para a expressão do gene alvo baseados no plasmídeo. Mutagenesis local-dirigido pode ser usado para definir o site da instalação de ncAA de resíduo-específicas no gene alvo20.
Como um peptídeo de modelo para a incorporação de ncAAs, a efeitos AMP nisina A foi escolhida. É 34 aminoácidos longos e tem apenas um resíduo prolina único na sequência de peptídeo de núcleo (Figura 1). Como em subtilisina, ericin A e S e epidermin, bem como em nisina Z e nisina Q, a prolina conservada parece ser essencial para a atividade9,21. A prolina cAA desempenha um papel particularmente importante na rotação de Amida peptidyl-prolil e estabilização da estrutura secundária. Sua cadeia lateral anel conformações (exo / endo puckers) são responsáveis por uma estabilização termodinâmica da ligação Amida. Modificações químicas específicas (tais como hydroxylations, fluorinations, methylations) de prolil puckers frequentemente criticamente influenciam o dobramento estabilidade, rigidez do andaime e funções de muitas estruturas biológicas22. Assim, é plausível esperar que as substituições de analógico de prolina Pro→ vão dotar o anel B, o segundo anel da nisina, com romance e propriedades incomuns.
Aqui, uma prolina-auxotróficos estirpe de Escherichia coli foi usado para a produção de nisina recombinante. Isso requer a expressão do gene prepeptide nisA , bem como a modificação da enzima genes nisBC. O produto de peptídeo geneticamente codificado carrega um N-terminal com sua tag líder para cromatografia de purificação através de afinidade. Para determinação da atividade, L. lactis expressando e secretando NisPT é usado para ativar as variantes de nisina recombinante de lisados celulares de e. coli ou peptídeo purificada amostras (Figura 1). O AMP maduro é liberado após a clivagem do líder por NisP. Neste método de difusão de ágar, a amostra de AMP difunde-se no meio de um crescimento sólido e pode inibir o crescimento dos microorganismos Gram-positivos. Após a incubação, isto pode ser observado visualmente por halos de inibição do crescimento. Além de L. lactis como um indicador, modificado nisina variantes mostrou atividade antimicrobiana contra Enterococcus faecalis, Bacillus cereus, Staphylococcus aureus e Lactobacillus johnsonii 21,23.
Um método alternativo e experimentalmente diferente para incorporar ncAAs em RiPPs é stop códon supressão (SCS)24. Por isso, um tRNA ortogonais / par de aminoacil-tRNA sintetase (aaRS) é necessária para o ncAA correspondente. Idealmente, todos estes três componentes são opaco, ou seja, eles não interagem com os tRNAs endógenos e aaRSs. Um aaRS ncAA específicos podem ser gerados pela modificação do sítio ativo da enzima e triagem de bibliotecas genéticas de mutante sintetases25. Além disso, a introdução de um ncAA exige um codão que é transferido, e que não codifica para o cAA. Comumente, o codão stop âmbar é usado24,26.
Recentemente, o SPI foi estabelecido para a incorporação de α-cloroacetamida-contendo e clique-química-compatible ncAAs NisA27. Por exemplo, Nε- alocação-lisina foi incorporada a captistruin de peptídeo de laço com site-specific (SCS) e métodos de incorporação de resíduos específicos (SPI) e posteriormente modificada em vitro por metátese de rutênio-catalisada28 . Em comparação com o SPI, o método do SCS é mais complicado desde um tRNA ortogonais / RAA par tem que ser co expressa. Até à data, ó pares para incorporação de prolina foram desenvolvidos29, mas o melhor de nosso conhecimento, nenhum exemplo de incorporação analógico de prolina tem sido relatado.
Note-se que nem todos os ncAAs pode ser incorporadas utilizando a metodologia SPI. Em primeiro lugar, a absorção de ncAAs para o citoplasma é regulada por uma infinidade de proteínas de transporte que são incorporados na membrana citoplasmática, que é a membrana interna para bactérias Gram-negativas como e. coli. Normalmente, e. coli é capaz de transportar uma vasta gama de análogos de aminoácidos na célula com cadeias laterais estruturalmente e quimicamente semelhante ao canônico de aminoácidos. Segundo, muitos ncAAs quimicamente reativos, ou instáveis pode agir como um inibidor para o crescimento celular, como eles são tóxicos para o metabolismo e a fisiologia do hospedeiro celular30. Assim, a absorção e toxicidade do ncAA para o host de produção devem ser testados previamente. Para evitar a inativação da maquinaria PTM como um efeito colateral, uma instalação de expressão estritamente controlada dos genes responsáveis pode ser usada para incorporar o aminoácido natural as enzimas de modificação (por exemplo, nisBC) e o ncAA no gene do alvo ( por exemplo, nisA). Isso pode ser feito usando dois diferentes promotores e indução da expressão do gene alvo, conforme demonstrado no especialmente projetada de protocolos SPI31. Conforme descrito acima, o método SPI depende da especificidade de substrato descontraído da aaRS, que permite a ativação de ncAA e tRNA cognatos de carregamento. Posteriormente, o tRNA é entregue ao ribosome seguido de formação de ligação amida e dobramento do peptide alvo (poli). Este processos, revisão e edição de mecanismos podem tornar-se relevante32. Por estas razões, é de grande importância para ter um alvo ncAA estruturalmente e quimicamente semelhante a cAA. Outros pontos cruciais são estabilidade suficiente (ambos na mídia crescimento e expostos para o metabolismo celular) e solubilidade do ncAA. Além disso, deve ser comercialmente disponíveis ou fáceis de ser sintetizados quimicamente.
Aqui, descrevemos um protocolo para SPI, permitindo a incorporação de resíduos específicos de ncAAs em RiPPs recombinante. Particularmente, os análogos de prolina diferentes são incorporados a nisina peptídeo antimicrobiano A usando e. coli como organismo hospedeiro. Espectrometria de massa é usada para verificar a substituição do amino-ácido e produtos do peptide são analisados por Bioatividade usando microscopia de fluorescência usando cepas microbianas indicador e ensaios de inibição de crescimento.
O requisito básico para a expressão de sucesso nisina recombinante com ncAAs definidos requer uma adequado prolina auxotróficos estirpe de Escherichia coli . Para isto auxotrophy, a proA tem que ser disfuncional, por exemplo, alcançado por nocaute genômica. Células totalmente privaram da biossíntese de Pro intracelular (ou seja, a exclusão de proABC) sem possibilidade de reversão são auxotrophs estáveis. Amplamente utilizado gene nocaute métodos são transdução fago ou single-gene nocaute de acordo com Datsenko & Wanner33. Além disso, cepas de nocaute de proA podem ser obtidas de repositórios públicos como Addgene, NODIA ou a coleção de Keio. Desde que a expressão recombinante nisABC mostrada aqui baseia-se na utilização de promotores de T7, a estirpe de anfitrião de expressão tem que carregam um gene inducible para T7 RNA polimerase. Isso pode ser feito pela introdução da prophage λDE3 o genoma do hospedeiro, por exemplo, utilizando o kit comercial. Alternativamente, cepas como BL21(DE3) podem ser feitas auxotróficos conforme descrito acima.
Protocolo
1. clonagem de vetores de expressão e transformação de uma estirpe de produção auxotróficos
Neste documento, os genes para a biossíntese de nisina, nisABC, ou seja, foram tomados de L. lactis e transferidos em vetores de expressão de T7-baseado do plasmídeo. Sequências de DNA completa do nisABC podem ser encontradas no GenBank entrada X6830734. O gene para o peptide precursor (nisA) foi colocado em um vetor de animal de estimação-3a que confere resistência à ampicilina. Genes para o dehidratase (nisB) e ciclase (nisC) foram colocados no vetor pRSFDuet-1, como relatado anteriormente35, que confere resistência canamicina.
Nota: Para nisA, os codões dos últimos quatro aminoácidos (ASPR) da sequência líder foram uma mutação para codificar VSLR36 para processar o resíduo prolina no peptídeo de núcleo único e para assegurar a adequada prepeptide processamento por NisP. No N-terminal, uma marca de hexa-histidina ladeada por resíduos de vinculador foi adicionada para fins de purificação (ver Figura 1).

Figura 1 . Representação esquemática da biossíntese e PTM de NisA em e. coli bem como clivagem líder pela tensão indicador L. lactis em um ensaio da atividade subsequente. Na primeira etapa, o inativo prenisin linear (composto de um líder e uma região de peptídeo de núcleo contendo uma única prolina (rosa) na posição 9) codificado por nisA ribosomally é sintetizado. Em seguida, prenisin é modificado posttranslationally por desidratação de resíduos de serina e treonina para dehydroalanine (Dha) e dehydrobutyrine (Dhb) como catalisada por NisB. A ciclase NisC forma o Tioéter pontes através de adição de Michael de grupos tióis de cisteína com Dha ou Dhb. O prenisin modificado inativo é purificado de e. coli e testado para atividade antimicrobiana. Aqui, é transportado para a célula da estirpe indicador Gram-positivas, L. lactis . O líder é clivado por proteases NisP (conforme indicado por uma seta) para liberar a nisina totalmente ativa. Também pode ser removido em vitro por tratamento com tripsina (*). Clique aqui para ver uma versão maior desta figura.
- Usar calor-choque padrão protocolo37 ou eletroporação38 para transformar a prolina auxotróficos estirpe de Escherichia coli (veja acima) com o plasmídeo do animal de estimação-3a nisA(VSLR) e pRSFDuet-1 nisBC.
- Pipete 25-100 µ l de suspensão de células transformadas em placas de ágar contendo ampicilina, canamicina e glicose 1% (p/v). Use um espalhador de placa ou grânulos de vidro para espalhar a solução uniformemente sobre as placas.
- Incubar as placas durante a noite a 37 ° C.
- Na tarde seguinte, use uma única colônia para inocular 10 mL LB meio contendo ampicilina, canamicina e glicose 1% (p/v) em um balão de 50 mL.
- Agite a cultura durante a noite (12-16 h) a 37 ° C e 200 rpm.
- Tomar 250 µ l estéril 80% glicerol e cultura 550 µ l, misturar bem em um tubo de 2 mL e armazenar como estoque de células congeladas a 80 ° C.
2. nova preparação meio mínimo (NMM)
Nota: Este protocolo usa NMM20 como um meio de crescimento bacteriano líquidos quimicamente definidas. Além disso, é aconselhável seguir a ordem de preparação estritamente. Caso contrário, a precipitação pode ocorrer. Para formulários de aminoácidos diferentes daqueles listados na tabela de materiais (por exemplo, cloridratos), verificar a solubilidade. NMM19 contém 19 aminoácidos, exceto o cAA para ser substituído (aqui, prolina) pelo analógico de ncAA. Consulte a tabela 1 para as concentrações do último ingrediente. Dependendo a cepa bacteriana utilizada para a produção, biotina e tiamina podem ser opcionais.
- Preparação da mistura de aminoácidos
- Dissolva 0,5 g de Phe, Trp e Tyr, em 100 mL ddH2O com a adição de algumas gotas de HCl concentrado até dissolução.
- Pese 0,5 g de cada um dos restantes 16 aminoácidos. Misturar com 22 mL de 1 M KH2PO4 e 48 mL de 1 M K2HPO4. Adicione O ddH2~ 800 ml. Mexa até que a solução torna-se claro.
- Adicione o dissolvido Phe, Trp e Tyr e ajustar o volume da solução de 1 L com DDQ2O.
- Esterilize a mistura de aminoácidos por filtração em vácuo com uma unidade de filtro superior da garrafa.
- As soluções para NMM19
- Primeiro, prepare-se 1 M as soluções dos seguintes componentes: (NH4)2então4, KH2PO4, K2HPO4, MgSO4 e 5 M de uma solução de NaCl de reserva. Esterilize em autoclave.
- Prepare estoques de 50 mL de D-glicose (1m), CaCl2 (1 g/L), FeCl2 (1 g/L), tiamina (10 g/L), biotina (10 g/L) e oligoelementos (CuSO4, ZnCl2, MnCl2, (NH4)2MoO4; 1 mg/L ). Esterilize por filtração cada uma com um filtro de seringa.
- Preparação de NMM19
- Misture todas as soluções para obter uma concentração final de 7,5 mM (NH4)2SO4, 1.7 mM NaCl, 22mm KH2PO4, 50mm K2HPO4, 1mm MgSO4 e 20 mM D-glicose, aminoácido 50mg/L Misture, 1 µ g/L de CaCl2, 1 µ g/L de FeCl2, 10 tiamina µ g/L, a biotina 10 mg/L e 0,01 µ g/mL oligoelementos.
3. a expressão da nisina recombinante com incorporação de análogos de prolina pela SPI
Nesta seção, expressão recombinante da prepeptide (aqui: nisA) e genes PTM (aqui: nisBC) é executada. Primeiro, as células são cultivadas na presença de todos os cAAs, desde LB complexo médio é usado. Glicose é adicionado para reprimir a expressão do gene alvo ao nível do fundo, que caso contrário poderia levar à produção de peptídeo de tipo selvagem (aqui: nisina) devido a leakiness dos promotores. Somente após o destino cAA (aqui: prolina) é esgotado, a ncAA é adicionado e expressão do gene alvo é induzida quimicamente definidas médio. Incubação de culturas de líquido deve ser realizada em frascos apropriados com aeração (por exemplo, 500 mL em um frasco de Erlenmeyer de 2 L a 200 rpm).
- Usando uma ponta de pipeta estéril, começar uma cultura fresca durante a noite do estoque de célula congelado ou fresca colônia (Veja passo 1). Usar meio de 25 mL LB contendo ampicilina, canamicina e glicose 1% (p/v) e incubar durante a noite (12-16 h) a 37 ° C e 200 rpm.
- Inocular 1 L de meio fresco estéril com cultura durante a noite de 10 mL (1% v/v) e incubar a 37 ° C e 200 rpm até OD600 = 0,5.
- Centrifugar a 4 ° C por 15 min a 4.500 x g.
- Decantar o sobrenadante e ressuspender o precipitado com 20 mL NMM19 (preparado no passo 2.3) contendo antibióticos e glicose 1% (p/v). Centrifugar a 4 ° C por 10 min a 4.500 x g.
- Resuspenda o pellet celular em 500 mL do mesmo meio e incubar a 30 ° C e 200 rpm por 1h.
Nota: Neste passo, o esgotamento de cAA (aqui, prolina) ocorre. - Divida a cultura em partes iguais (um para cada ncAA). Induzir a cada cultura com 1mm isopropílico β-D-1-thiogalactopyranoside (IPTG) e fornecer os análogos de prolina 1mm (4S/R- fluoroproline, 4S/R- hidroxiprolina ou 4S/R- methanoproline).
Nota: Como controle, uma cultura pode ser fornecida com prolina 1 mM, resultando na produção de peptídeo de tipo selvagem. - Incube durante a noite (12-16 h) a 28 ° C e 200 rpm.
- Centrifugue a célula culturas em tubos de 50 mL a 4 ° C por 20 min em 5.000 x g. decantar o sobrenadante e armazenam Pelotas a-80 ° C até a purificação.
4. isolamento e purificação de análogos de nisina com sua Tag
Peptídeos são purificados sob condições com guanidina cloridrato (GuHCl)39, um forte desnaturante de desnaturação.
Atenção: GuHCl é prejudicial se ingerido ou inalado e faz com que a pele e irritação ocular grave. Use luvas e óculos de proteção.
- Prepare 250ml de binding buffer (5 M GuHCl, 300 mM de NaCl, 25 mM Tris, pH 7,4), o tampão de lavagem (300 mM de NaCl, 25 mM Tris, imidazol 25 mM, pH 7,4) e o tampão de eluição (300 mM de NaCl, 25 mM Tris, imidazol 250 mM, pH 7,4). Para estes, transferir os sólidos dentro de uma garrafa de 250 mL e encha até 200 mL com DDQ2Mix O. bem e ajustar o pH para 7,4 com 1 M de NaOH ou HCl. Em seguida, encha até 250 mL com ddH2filtro de O. todas as soluções-tampão usando uma unidade de filtro superior da garrafa.
- Lise celular
Aqui, um sonicador (com 200 W máximo de alta frequência (HF) saída) é usado; Observe que as configurações de energia necessárias para o rompimento da pilha podem ser diferente para outros instrumentos. Todas as etapas são executadas no gelo. Alternativamente, pode ser usada lysis da pilha química, um homogeneizador de líquido ou uma imprensa francesa.- Adicionar 12 mL de tampão de ligação para cada tubo de centrifugação (da etapa 3.8) e ressuspender vortexing.
- Mergulhe a ponta da sonda sonicador a suspensão de eritrócitos. Definir sonicador em 40% de amplitude com pulso de 1 s na / 5 s fora por 15 min.
Nota: Limpe a ponta do sonicador entre amostras para evitar reporte. Limpe a sonda sonicador com etanol a 70%. - Centrifugar a suspensão de eritrócitos lisados a 4 ° C por 40 min a 15.000 x g de restos de células de Pelotas. Transferi os sobrenadantes para um novo tubo de reação.
- Cromatografia de afinidade
Para cromatografia (IMAC) de afinidade do íon do metal imobilizado40, uma bomba peristáltica ou um sistema FPLC pode ser usado com um cartucho de 1 mL (aqui cheio de resina Ni-NTA). Para preparação de buffers, consulte Etapa 4.1.
Nota: Purificação de IMAC é viável, desde que o peptídeo recombinante produzido transporta um N-terminal com sua tag líder, que é removido na etapa 6 pela peptidase líder NisP, liberando a nisina madura. Realizar a purificação em temperatura ambiente ou a 4 ° C. Use uma taxa de fluxo de 1 mL por minuto se aplicável para o cartucho de IMAC.- Primeiro, lave o cartucho com 5 volumes de coluna (cv) do ddH2O para remover o buffer de armazenamento.
- Equilibrar com 10 cv de tampão de ligação.
- Processo celular lisada (etapa 4.2) usando uma seringa de filtro para remover partículas e, em seguida, aplicar-se para o cartucho.
- Lave com 15 cv de tampão de lavagem para remover material inespecífico e desacoplado.
- Eluir com 10 cv de tampão de eluição e frações coletar 1 mL em tubos de 1,5 mL. Armazene as frações a 4 ° C para curto prazo (até 3 dias) ou a-20 ° C para termos mais tempo.
- Para armazenamento, lavar o cartucho com 10 cv de DDQ2O seguido por 5 cv de 20% de etanol.
5. LC-ESI-TOF análise de espectrometria de massa de análogos de nisina
Nota: Tabela de materiais Veja por exemplo, instrumentação para cromatografia líquida acoplada com electrospray ionização tempo-de-voo espectrometria de massas (LC-ESI-TOF-MS).
- Realize a separação de HPLC de 15-20 µ l do peptide solução (preparada no passo 4.3) em uma coluna de C5 com uma fase móvel de água (A) e (B) ambos suplementados com 0,1% de ácido fórmico e um gradiente de 5-80% B mais de 20 min de acetonitrilo. Por espectrometria de massa (MS), use eluição após 5 min.
Nota: Dependendo do conteúdo do peptide e afinidade para a coluna HPLC, separação e volumes de amostra podem ser necessário otimização. - Use o software adequado para deconvolute os espectros de massa medidos e calcular que a carga de peptídeo diferentes Estados41. Compare a peptídeo observados espécies massa massa do calculado selvagem-tipo alterada pela substituição cAA → ncAA. Levar em conta que a prepeptide linear é modificado posttranslationally por oito dehydrations (-8 H2O) e cinco cyclizations (ver Figura 1).
Nota: Uso de buffers contendo sódio, análise de MS no modo positivo pode mostrar adutos de sódio. Estes tornam-se visíveis como picos adicionais com maior massa deconvoluted (para cada sódio aduto, a massa observada deconvoluted é 22.99 Da maior). Para remover estes adutos, HPLC purificação42 ou diálise extensa43 pode ser realizada.
6. antimicrobial atividade teste
- Preparação das placas de ágar-GM17 sob condições estéreis
- Prepare uma cultura durante a noite da glicose de cepa L. lactis NZ9000 carregando plasmídeo pNG nisPT44 a 30 ° C em caldo de M1745 com 1% (p/v) o indicador (= GM17) e 5 cloranfenicol µ g/mL.
- Medir o OD600, inocular meio fresco para OD600 = 0.1 e incubar até OD600 = 0.4-0.6. Em seguida, coloca o balão no gelo.
Nota: Cada medição de600 OD consumirá volume de cultura. Tenha em mente que para cada placa de ágar de ensaio, cultura bacteriana 1 mL será necessária. Se necessário, aumenta o volume de líquido de cultura nesse sentido. - Para 1,5% de ágar, pese 4,5 g ágar-ágar em um frasco de vidro mídia. Adicione 300ml ddH2O, mix e autoclave.
- Prepare 2 x M17 caldo (duas vezes mais concentrada) em 300 mL ddH2O e autoclave.
- Misture 25 mL 2 caldo de x M17, contendo 10 µ g/mL cloranfenicol e 2% de glicose com 1 mL L. lactis preculture (4% v/v).
- Adicione 25 mL fundido 1,5% ágar-ágar (recentemente autoclavado ou aquecida no microondas).
Nota: Antes disso, deixe arrefecer o frasco ao toque (em torno de 50 ° C). Isto é necessário uma vez que L. lactis é um organismo mesofílicas sensível a altas temperaturas. - Despeje a solução em um grande prato de petri. Chapas secas por 10-15 min.
- Esterilize as extremidades de uma pipeta Pasteur de vidro pela chama. Esperar que arrefeça e, em seguida, use a extremidade larga para criar furos no GM17-ágar solidificado.
- Preparação da amostra
- Tomar 1 mL de e. coli expressão culturas (criado na etapa 3.7) em um tubo rotulado 1,5 mL e centrifugar por 3 min em 7.000 x g. Aspire o meio restante e ressuspender as células em 500 µ l at-P (50 mM de tampão fosfato de sódio pH 7,4, feito de fosfato de-hidrogenofosfato de sódio 0,5 M e hidrogenofosfato dissódico de 0,5 M).
- Proceda à sonicação as amostras no gelo (comparar passo 4.2.2). Mergulhe a ponta da sonda sonicador a suspensão de eritrócitos. Definir sonicador em 30% de amplitude com pulso de 1 s s no e 5 fora por 3 min.
- Centrifugue o lisado por 10 min a 13.000 x g a pelota detritos de célula a célula. Transferi o sobrenadante para um novo tubo de reação no gelo.
- Diluir e normalizar os sobrenadantes de extrato celular para 1ml OD600 = 0,6, em relação a densidade de células colhidos, com at-P.
- Teste de atividade
- Adicione 40 µ l de cada amostra normalizada em um buraco da placa de ágar de indicador (Figura 3). Use cloranfenicol a 400 µ g/mL como antibacteriano controle composto. Use o tampão de eluição como controlo negativo. Espere até que todas as amostras são difundidas sobre o agar. Incubar a placa durante a noite a 30 ° C.
- Tire fotos das placas de ágar usando um scanner de mesa ou câmera digital. Tamanhos de halo de inibição de crescimento podem ser medido manualmente ou usando o ImageJ46.
7. microscopia de fluorescência
A fim de observar o efeito do AMPs em células bacterianas, microscopia de luz e a fluorescência pode ser usada. Observe que o modo de nisina de acção depende a desestabilização e a formação de poros em membranas bacterianas6. Aqui, Nilo vermelho é usado para manchar a membrana celular bacteriana, que se torna a lise celular dispersas e agregados em cima.
Nota: Tabela de materiais Veja instrumentação por exemplo. Quantidades de solução de AMP adicionada podem ser ajustadas dependendo da Bioatividade e concentração de peptídeo.
- Preparação da pilha
- Prepare-se 10 mM solução Nilo vermelho em dimetilsulfóxido (DMSO).
- Crescer a cepa de L. lactis indicador para OD600 = 1.0 como no passo 6.1.1-6.1.2.
- Centrifugar a cultura de 1 mL por 3 min a 4 ° C e 5.000 x g.
- Descartar o sobrenadante, resuspenda em 1 mL de tampão fosfato salino (PBS)47.
- Centrifugue e ressuspender novamente.
- Adicionar 1 µ l Nilo vermelho de solução, misture suavemente.
- Aquisição de imagens microscópicas
- Adicionar 30 µ l de preparação da pilha em um slide de cobertura ao mesmo tempo excitante em 520 nm.
- Definir aquisição tempo 0.2 s, série cinética 0,1 Hz, imagens de comprimento 200 series.
- Adicionar 0,3 - 1,5 µ l de lisado celular ou amostra IMAC (da etapa 6.2.4 ou 4.3.5, respectivamente). Para amostras IMAC, tampão de eluição pode ser usado como um controle negativo.
- Emissão de fluorescência de monitorar e gravar no λ ≥ 560 nm.
- Análise de dados
- Sequências de imagem de microscopia são armazenadas como arquivos de filme (. avi). Imagens isoladas são analisadas com ImageJ46.
Resultados
Este protocolo é projetado para permitir a produção de variantes de nisina ncAA-modificado com a incorporação de resíduos específicos de análogos de prolina pelo método SPI. Anteriormente, a viabilidade e o rendimento de 24 mg/L foram relatado para produção recombinante de nisina totalmente modificada do selvagem-tipo39. Usando o método SPI, rendimentos de proteína/peptídeo alvo são frequentemente bons e podem atingir quantidades perto do selvagem-tipo produção48. Como primeiras experiências, produção de RiPP recombinante selvagem-tipo deve ser analisada no acolhimento auxotróficos escolhido. Aqui, a prolina-auxotróficos Escherichia coli MG1655 Δprobabilidade:: frt ΔproC:: frt (DE3) foi usado como tensão de anfitrião. Para a incorporação de ncAAs, cultivo e indução temperatura e composição de sincronismo, bem como média podem ser otimizadas para o rendimento máximo do peptide.
Ensaio de atividade antimicrobiana
Purificação e produção de nisina recombinante tipo selvagem foram realizados seguindo o protocolo acima. Neste caso, prolina foi usada em vez de seus derivados de ncAA no passo 3.6. Um ensaio de atividade antimicrobiana foi utilizado para verificar a produção de RiPP e comparar a atividade antimicrobiana, antes e após a purificação. Para o ensaio da atividade, frações de eluição e IMAC de passagem foram utilizados diretamente e testados contra a estirpe de indicador de Gram-positivas, L. lactis (Figura 2). Como esta estirpe expressa NisP, as variantes de nisina contidas no lisados celulares de e. coli ou amostras de peptídeo purificado, respectivamente, tornam-se ativadas por clivagem proteolítica do peptide líder. Evidentemente, o escoamento mostrou atividade inibitória de crescimento. Isto pode ser explicado pelo material bioactivo não vinculativo para a coluna do IMAC. As frações de eluição testado todos mostraram atividade aumentada em comparação com a amostra impuro, indicando uma concentração do peptide His-marcados pelo IMAC. Observe que o tampão de eluição (como controlo negativo) não influenciou o crescimento de L. lactis neste ensaio.
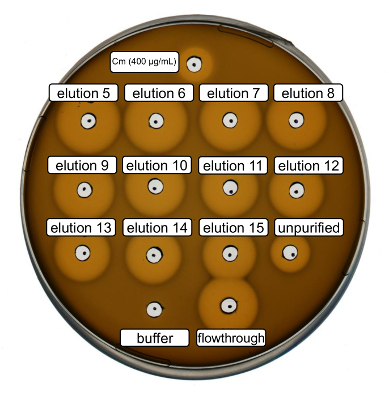
Figura 2 . Atividade antimicrobiana de teste após purificação IMAC de recombinantes produzidos selvagem-tipo nisina. Frações de eluição 5 a 15 e o fluxo através da purificação do IMAC foram testados em comparação com o lisado celular impuro (diluído para normalização de600 OD) contra a estirpe de indicador de L. lactis . O tamanho dos halos de inibição de crescimento indica atividade antimicrobiana. Cloranfenicol em uma concentração de 400 µ g/mL foi usado como um controle positivo e o tampão de eluição do IMAC como controlo negativo. Clique aqui para ver uma versão maior desta figura.
Para provar a atividade antimicrobiana de recombinantes produzidos nisina variantes contendo seis análogos de prolina diferentes, um ensaio de atividade foi realizado para testar a inibição da cepa L. lactis indicador. A Figura 3 mostra a inibição do crescimento por cinco das seis amostras produzidas usando análogos de prolina. Os melhores resultados (como julgados de tamanhos de halo) foram observados para os experimentos de incorporação de analógico (R. 4) - fluoroproline, (4R) - hidroxiprolina e 4S-methanoproline. Comparar o tamanho de halo de inibição de crescimento para o selvagem-tipo nisina produzido e testado em paralelo, todas as três variantes de nisina mostraram força de inibição similar. No entanto, o tamanho da auréola sozinho não pode ser usado para avaliar uma atividade específica, desde que a concentração de AMP não foi determinada. Portanto, os ensaios servem apenas para testar qualitativamente a atividade antimicrobiana das variantes nisina resultante é preservada ou perdida. Para determinar a atividade específica, a concentração das variantes nisina deve ser quantificado (ver discussão).
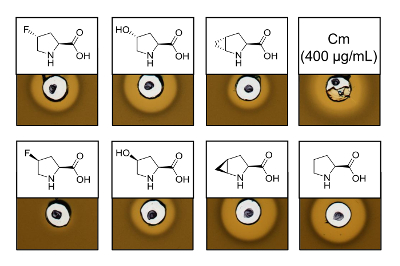
Figura 3 . Ensaio de atividade antimicrobiana de lisados celulares contendo variantes nisina produzido através de SPI com análogos de prolina. Comparação de variantes de nisina com amostras recombinantes do selvagem-tipo. Todas as amostras foram OD600-normalizado depois da lise celular em relação a densidade de cultura de células colhidos. Auréolas indicam Bioatividade sob forma de inibição de crescimento de tensão de indicador. Primeiro da fileira da esquerda para a direita: (R. 4)-fluoroproline, (4R) - hidroxiprolina, (4R) - methanoproline e cloranfenicol (400 µ g/mL; controle antimicrobiano positivo). Segunda fileira: (S. 4)-fluoroproline, (4S) - hidroxiprolina, (4S) - methanoproline e prolina (controle do selvagem-tipo). Nota a nomenclatura química; por exemplo, (R. 4) - fluoroproline é também conhecido como trans-4 - fluoroproline. Clique aqui para ver uma versão maior desta figura.
LC-ESI-TOF espectrometria de massa
Na sequência da purificação do IMAC, a incorporação do ncAAs nisina foi analisada por espectrometria de massa LC-ESI-TOF. A Figura 4 mostra os espectros de massa deconvoluted de uma variante de nisina contendo (R. 4)-fluoroproline. Esta variante foi IMAC purificado conforme descrito acima e depois analisados por espectrometria de massa LC-ESI-TOF, então ele ainda carregava o líder. O pico principal na Figura 4A corresponde a nisina modificada contendo (R. 4)-fluoroproline com uma massa deconvoluted de 6883.18 Da (massa calculada 6882.05 pai, calcula massa do selvagem-tipo peptide correspondente com prolina no posição 9 é Da 6864.06). Os dois picos com menor abundância e maior massa correspondem ao sódio adutos como indicado. Figura 4 B mostra a espécie diferente carregada dos principais compostos como encontrado pelo algoritmo de deconvolução. Por exemplo, o pico do 1148.11 m/z corresponde à espécie carregada seis vezes ([M + H 6]6 +).

Figura 4 . LC-ESI-TOF espectrometria de massa das variantes do IMAC-purificado nisina recombinante contendo (R. 4)-fluoroproline. (A) Deconvoluted cromatograma de espectrometria de massa (zoom para fora o baixo-relevo) para a variante de nisina (ainda carregando o líder) com (R. 4)-fluoroproline (espera-se massas (Da): [M + H]+ = 6882.05, [Na + M]+ = 6904.03, [M + 2Na]2 + = 6926.02). (B) o composto espectros para espécies [M + H]+. Esperado de massas (Da): [M + 5h]5 + = 1377.41, [M + H 6]6 + = 1148.01, [M + H 7]7 + = 984.15, [8 M + H]+ 8 = 861.26, [M + 9 H]9 + = 765.67, [M + 10 H]10 + = 689.21, [M + H 11]11 + = 626.64, [M + 12 H] 12 + = 574.50. Clique aqui para ver uma versão maior desta figura.
Microscopia de fluorescência
Atividade antimicrobiana de nisina recombinante e suas variantes de ncAA, contendo também pode ser mostrada pela observação direta da L. lactis Indicador tensão através de microscopia de fluorescência. Nilo vermelho, um corante fluorescente altamente hidrofóbico, foi usado para manchar a membrana da célula bacteriana. A Figura 5 mostra a mudança qualitativa do estado da cultura de pilha e morfologia única célula de agregação. Células foram manchadas de vermelho do Nilo e depositadas em um slide de capa de microscopia. A linha superior mostra as células diretamente no início quando o buffer, nisina recombinante do selvagem-tipo, ou nisina contendo (R. 4)-fluoroproline, ou 4R-hidroxiprolina foram adicionados. O painel inferior mostra as imagens correspondentes após 20 minutos de incubação.
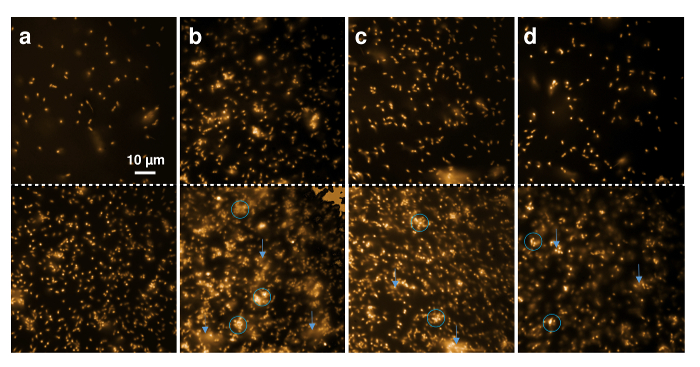
Figura 5 . Microscopia de fluorescência dos efeitos de nisina recombinante em células gram-positivas. Imagens microscópicas de 30 estirpe de indicador de L. lactis µ l (OD600 = 1) marcado com Nilo vermelho foram tiradas antes (painel superior) e depois (painel inferior) 20 min incubação com tampão de 1 µ l (A), 0,3 µ l recombinante selvagem-tipo nisina (B) e Variantes de nisina 0,6 µ l contendo (R. 4)-fluoroproline (C) e (R. 4)-hidroxiprolina (D). Círculos azuis marcam regiões com ponto de setas de células agregadas ou deformado, azul para regiões onde a difusão de fragmentos de membrana fluorescentes pode ser observado. Clique aqui para ver uma versão maior desta figura.
Figura 5 A mostra que o aspecto geral das células não mudar dentro de 20 minutos de observação. Apenas o número de células que depositados durante a rosa do tempo e, portanto, uma maior quantidade de células são visíveis dentro a 80 µm x 80 µm da região observada. Figura 5 B mostra que as células gram-positivas apareceram agregadas e embaçada (marcado com círculos azuis) após 20 minutos de exposição ao tipo selvagem nisina, mesmo quando baixas quantidades (aqui, eluição de IMAC 0,3 µ l) foram adicionadas. Além disso, material luz difusa das células para o buffer, indicando que os fragmentos de membrana marcados com Nilo vermelhos foram mobilizados durante o período de tempo (marcado por setas azuis). Esses achados indicam lysis da pilha, como foi mostrado para ocorrer após tratamento com nisina6,49. Efeitos semelhantes foram observados após incubação com a nisina variante que contém (R. 4) - fluoroproline (Figura 5-C) e nisina contendo (R. 4) - hidroxiprolina (Figura 5D) ambos mostrando grande quantidades de células distorcidas e agregadas após 20 minutos, em nítido contraste com a amostra de controle (Figura 5A).
| Componente de | Concentração |
| (NH4) 2 Então4 | 7,5 mM |
| NaCl | 8.5 mM |
| KH2PO4 | 22 mM |
| K2HPO4 | 50 mM |
| MgSO4 | 1 mM |
| D-glicose | 20 mM |
| Todos os aminoácidos canônicos (exceto a substituir) | 50 mg/L |
| CA2 + | 1 µ g/mL |
| Fe2 + | 1 µ g/mL |
| Elementos de traço (Cu2 +, Zn+ 2, Mn+ 2, MoOH2 +) | 0,01 µ g/mL |
| Tiamina | 10 µ g/mL |
| Biotina | 10 µ g/mL |
Tabela 1. Composição do meio de crescimento bacteriano quimicamente definidas NMM19 após a preparação de acordo com a etapa 2.
Discussão
Usando SPI para inserção de análogos de prolina, as estruturas de nisina alvo podem ser substancialmente modificadas, criação de variantes de peptídeo romance com combinações de sequência única e propriedades químicas. Desta forma, o limite básico de tecnologia genética clássica pode ser contornado, que é restrito para os químicos de cadeia lateral da cAAs a 20. Na vivo química diversificação da nisina como exemplificado acima demonstra uma abordagem geral para complementar PTMs naturais e para melhorar drasticamente o espaço químico de RiPPs. Acreditamos que ampliar o repertório dos aminoácidos naturais detém grande promessa especial para amplificadores. Em proteínas, uma gama enorme de funcionalidades pode ser realizada através de um arranjo definido dos 20 cAAs em estruturas tridimensionais. Com apenas 7-100 aa no comprimento3, maneiras de alcançar tais características estruturais somente através de cAAs seria limitadas para amplificadores. Assim, não é surpreendente que AMPs naturais em forma de RiPPs comumente são modificados extensivamente post-translationally4. Da mesma forma, ncAAs como blocos de construção alternativos segura a grande promessa para melhorar seus parâmetros farmacocinéticos e farmacodinâmicos (ver referências e Baumann et al . 201735 nele).
A SPI metodologia este trabalho beneficia de uma instalação experimental relativamente fácil, simples execução e alta reprodutibilidade. Devido à substituição global, incorporação de ncAA em vários locais em peptídeos de destino também é viável. Por outro lado, o método pode não ser adequado para substituição de aminoácidos, ocorrendo frequentemente no produto do gene alvo. Em princípio, posições indesejadas podem ser alteradas pelo mutagenesis local-dirigido, mas essas alterações adicionais também podem afetar várias propriedades de AMP, incluindo estrutura e Bioatividade. Quando uma tensão auxotróficos de produção estiver disponível, vários ncAAs pode ser testados sem a necessidade de grandes mudanças a nível genético. Além disso, o método não está limitado a auxotróficos Escherichia coli as tensões, mas também pode ser realizada usando o host de produção natural. Por exemplo, Zhou et al mostrou que a SPI para produção de novela RiPPs também funciona naturalmente Trp-auxotroph L. lactis: usando definido mídia, três análogos de triptofano foram incorporados em quatro posições em nisina50.
Desde que o método SPI conduz à substituição global dos escolhidos cAA pela ncAA, é geralmente aplicável a uma ampla gama de alvo de peptídeos e proteínas. Uma gama de auxotróficos de Escherichia coli , cepas está disponível (Veja passo 1), permitindo que vários cAAs cada a ser testado para substituição por ncAAs. Conheci os análogos incorporados usando metA-cepas deficientes (por exemplo, B834(DE3)) do são mais comumente empregados. Exemplos de isostructural Met análogos são azidohomoalanine (Aha) e homopropargylglycine (Hpg), ncAAs comercialmente disponíveis que podem ser incorporados de forma eficiente. Ambos apresentar opaco alças que permitem a fixação de moléculas carregando um alquino compatível ou funcionalidade de azida sódica, respectivamente. Por exemplo, corantes fluorescentes ou metades de polietileno glicol (PEG) podem ser anexados por cobre (I)-catalisada azida alquino cicloadição (CuAAC)51.
Embora os dois métodos de incorporação da ncAA recombinante (SPI e SCS) geralmente obter quantidades suficientes de alvo, rendimentos são frequentemente reduzidos em relação à produção do selvagem-tipo do correspondente de peptídeos e proteínas. Como as purezas frequentemente correlacionam com a eficiência da produção, etapas de purificação adicional podem ser necessárias, especialmente para espécies abundantes-baixo. Neste caso específico de produção de nisina recombinantes, a sequência de líder com sua tag simplifica RiPP purificação por enriquecimento seletivo dos lisados celulares. A purificação mostrada neste protocolo melhora a pureza e concentração da nisina, mas muitas vezes não rende purezas AMP suficientes para determinar o rendimento e a atividade específica. Além de IMAC, métodos de purificação de AMP comumente usados incluem HPLC, cromatografia de troca iônica (IEC) e precipitação (por exemplo. usando acetona ou ácido tricloroacético (TCA)) ou combinações - resultando em um esquema de várias etapas de purificação52 . Note-se que sua comumente polycationic natureza pode facilitar a purificação do IEC. Liofilização é frequentemente usado para armazenar AMPs purificadas.
Idealmente, ncAAs para incorporação em ampères deve ser comercialmente disponível a preços acessíveis ou facilmente produzido por protocolos de síntese química simples e reprodutível. Uma condição igualmente importante para o método SPI é que a ncAA é reconhecido, ativado e cobrado para o tRNA cognatos pela aaRS endógena ou co expressa. Isso pode ser testado em vitro por aminoácidos ativação ou tRNA aminoacylation ensaio53. Como uma alternativa fácil, expressões de teste SPI de proteínas de modelo como a proteína verde fluorescente (GFP) realizada tanto na presença e na ausência de suplementação de ncAA podem ser executadas. Além disso, solubilidade na permeabilidade média e célula de crescimento, bem como estabilidade química constituem fatores importantes.
Neste exemplo, a atividade antimicrobiana foi exibida usando uma estirpe de indicador Gram-positivas. Como expressa o peptidase líder NisP, a etapa final da maturação da nisina é catalisada. Remoção da sequência líder (His-marcados para fins de purificação) também pode ser realizada em vitro por tratamento com purificada NisP50 ou tripsina54. Além do escopo deste trabalho, os organismos patogénicos e multi-droga resistentes podem então ser testados para inibição bacteriostática ou bactericida por amplificadores utilizando uma metodologia semelhante. Espécies-alvo clinicamente relevantes incluem MRSA, MDR Mycobacterium tuberculosis, VRE, Acinetobacter baumannii, Streptococcus pneumoniae, Pseudomonas aeruginosa e Klebsiella pneumoniae. Além da difusão de placa de ágar, ensaio, apresentou crescimento inibição também pode ser executada usando a mídia adequada de líquido inoculado com a espécie bacteriana e suplementado com AMP. Usando métodos de diluição do caldo, a concentração inibitória mínima (CIM) pode ser determinada usando peptídeos pura55. O ensaio da atividade aqui apresentado também pode ser usado para estimar a bioatividade e potência do AMP-contendo soluções em relação à referência compostos, nisina por exemplo comercialmente disponível.
Produção recombinante de RiPPs é muitas vezes possível39, que geralmente inclui co a expressão de genes PTM. Assim que o esforço de produção é transferido para um meio mínimo quimicamente definido ou sintético contendo um apropriado ncAA, substituição de resíduos específicos de cAA correspondente tem lugar. Assim, outros RiPPs pode ser produzido pela mesma metodologia, desde que sua produção recombinante é viável e condições encontram-se a incorporação da ncAA e PTM rendem suficientes quantidades de produto-alvo. Observe que, além do anfitrião célula proteome, a maquinaria PTM peptídeo também pode se tornar ncAA-modificado durante a SPI. Consequentemente, o timing da indução de expressão de destino e a duração do período de incubação de seguir podem exigir otimização. Desde que a incorporação de ncAA em enzimas PTM pode afetar a sua estabilidade e atividade, a produção do RiPP transformado pode em princípio ser afetada. Eficácia de enzima suficiente PTM é indicada pela formação de prepeptide transformado, detectadas por ensaios MS e Bioatividade. Como apresentado acima, diferentes promotores inducible poderiam ser empregados para produzir o PTM genes primeiro (na ausência do ncAA) seguiram por indução do gene do peptide precursor na presença do ncAA. Em geral, a produção de cAA-contendo o peptídeo de destino deve ser suprimida antes da adição do ncAA, é por isso que a forte repressão do gene precursor é necessária. Neste protocolo, isto é conseguido pela repressão catabólica por meio da adição de glicose para o meio de crescimento. Especialmente, uma vez que as enzimas PTM necessárias para processamento prepeptide originam-se geralmente um host geneticamente distante, uso de temperatura e códon de expressão dos genes correspondentes pode exigir otimização se produção recombinante ainda não foi estabelecido. Em princípio, a presença de ncAAs no prepeptide pode interferir com reconhecimento e processamento das enzimas PTM, no caso de nisina, NisBC e NisP. Para a incorporação de ncAA nos amplificadores, assim é aconselhável realizar experiências em escala reduzida expressão primeiro para identificar condições de expressão adequado e a confiabilidade do ensaio de atividade do AMP.
Divulgações
Os autores declaram que eles têm não tem interesses financeiro concorrente.
Agradecimentos
J.H.N., T.B. e M.B. reconheceram financiamento pelo programa UE FW7 (SYNPEPTIDE). F.-J.S. e T.F. reconheceram financiamento pelo Ministério Federal da educação e ciência (BMBF programa "HSP 2020", TU-WIMIplus projeto SynTUBio) e Fundação de pesquisa alemã (Cluster de excelência "Unifying conceitos em catálise").
Materiais
| Name | Company | Catalog Number | Comments |
| sodium chloride | Carl Roth, Germany | P029 | |
| guanidine hydrochloride | Carl Roth, Germany | 0035.2 | |
| dipotassium hydrogen phosphate | Carl Roth, Germany | P749.3 | |
| potassium dihydrogen phosphate | Carl Roth, Germany | 3904.3 | |
| sodium dihydrogen phosphate monohydrate | Carl Roth, Germany | K300.2 | |
| disodium hydrogen phosphate | Carl Roth, Germany | P030.2 | |
| L-alanine | Carl Roth, Germany | 3076.2 | |
| L-arginine | Carl Roth, Germany | 3144.3 | |
| L-asparagine monohydrate | Carl Roth, Germany | HN23.1 | |
| L-aspartic acid | Carl Roth, Germany | T202.1 | |
| L-cysteine | Carl Roth, Germany | 3467.3 | |
| L-glutamine | Carl Roth, Germany | 3772.1 | |
| L-glutamic acid | Carl Roth, Germany | 3774.1 | |
| L-glycine | Carl Roth, Germany | 3187.3 | |
| L-histidine | Carl Roth, Germany | 3852.3 | |
| L-isoleucine | Carl Roth, Germany | 3922.3 | |
| L-leucine | Carl Roth, Germany | 3984.3 | |
| L-lysine monohydrate | Carl Roth, Germany | 4207.2 | |
| L-methionine | Carl Roth, Germany | 9359.4 | |
| L-phenylalanine | Carl Roth, Germany | 4491.2 | |
| L-proline | Carl Roth, Germany | T205.3 | |
| L-serine | Carl Roth, Germany | 4682.4 | |
| L-threonine | Carl Roth, Germany | T206.2 | |
| L-tryptophan | Carl Roth, Germany | 4858.2 | |
| L-tyrosine | Carl Roth, Germany | T207.2 | |
| L-valine | Carl Roth, Germany | 4879.4 | |
| ammonium sulfate | Carl Roth, Germany | 3746.3 | |
| magnesium sulfate | Carl Roth, Germany | 0261.2 | |
| D-glucose | Carl Roth, Germany | 6780 | prepare a 20% (w/v) solution for addition into molten agar |
| calcium chloride | Carl Roth, Germany | PN93.2 | |
| iron(II) chloride | Sigma-Aldrich, Germany | 372870 | |
| thiamine hydrochloride | Sigma-Aldrich, Germany | T1270 | |
| biotin | Carl Roth, Germany | 3822.2 | |
| copper(II) sulfate | Merck, Germany | 102792 | |
| manganese(II) chloride | Carl Roth, Germany | KK36.2 | |
| zinc chloride | Merck, Germany | 108816 | |
| immonium orthomolybdate | Sigma-Aldrich, Germany | 277908 | |
| glycerol | Carl Roth, Germany | 7533.3 | |
| isopropyl β-D-1-thiogalactopyranoside | Sigma-Aldrich, Germany | I6758 | |
| ampicillin sodium salt | Carl Roth, Germany | K029.5 | working concentration 100 µg/mL for E. coli, prepare 100 mg/mL stock in ddH2O |
| kanamycin sulfate | Carl Roth, Germany | T832.2 | working concentration 50 µg/mL for E. coli, prepare 50 mg/mL stock in ddH2O |
| chloramphenicol | Carl Roth, Germany | 3886.1 | working concentration 5 µg/mL for L. lactis, prepare 37 mg/mL stock in ethanol |
| (4S)-fluoroproline | Bachem, Switzerland | F-3970 | |
| (4R)-fluoroproline | Bachem, Switzerland | F-3975 | |
| (4S)-hydroxyproline | Bachem, Switzerland | F-1395 | |
| (4R)-hydroxyproline | Bachem, Switzerland | F-2980 | |
| (4S)-methanoproline | chemically synthesized | ||
| (4R)-methanoproline | chemically synthesized | ||
| hydrochloric acid (HCl) | Carl Roth, Germany | P074.4 | |
| ethanol | VWR, Germany | 20825.324 | |
| M17-broth | Sigmal-Aldrich, Germany | 56156 | commercial product, see Terzaghi BE & Sandine WE, Appl Microbiol., 1975, 29(6):807-13 for contents and preparation |
| agar-agar | Carl Roth, Germany | 5210.5 | |
| Nisin from Lactococcus lactis | Sigma-Aldrich, Germany | N5764 | commercial product, can be used as reference for bioactivity |
| dimethyl sulfoxide (DMSO) | Carl Roth, Germany | A994.1 | |
| imidazole | Carl Roth, Germany | 3899.3 | |
| 1.5 mL autosampler vial for LC-MS | Sigma-Aldrich, Germany | Supelco 854165 | |
| acetonitrile | VWR, Germany | HiPerSolv CHROMANORM ULTRA for LC-MS, 83642 | LC-MS grade required |
| formic acid | VWR, Germany | HiPerSolv CHROMANORM for LC-MS, 84865 | LC-MS grade required |
| 1 mL Ni-NTA IMAC column, e.g. HisTrap FF Crude | GE Healthcare, UK | 29-0486-31 | different manufacturers and resins available for IMAC |
| 0.45 µm bottle top filter unit | VWR, Germany | 10040-470 | sterile filtration of solutions using a vacuum pump |
| 0.45 µm syringe filter PVDF membrane | Carl Roth, Germany | CCY1.1 | sterile filtration of solutions using a syringe and to remove particles from cell lysates |
| luer-lock syringe, PP, 50 ml | Carl Roth, Germany | T552.2 | sterile filtration of solutions |
| 1.5 mL Eppendorf tubes | Eppendorf, Germany | 30120086 | |
| petri dishes (polystyrene, sterile) | Carl Roth, Germany | TA19 | |
| Nile red | Sigma-Aldrich, Germany | 72485 | |
| E. coli ΔproA strain | CGSC, Keio collection | JW0233-2 | proline-auxotrophic E. coli K-12 strain |
| E. coli B834(DE3) | Novagen (Merck), Germany | 69041 | methionine-auxotrophic E. coli B strain |
| λDE3 Lysogenization Kit | Novagen (Merck), Germany | 69734-3 | |
| Lactococcus lactis NZ9000 pNG nisPT | bacterial indicator strain, see Khusainov R & Kuipers OP, PLoS One, 8 (9), e74890 | ||
| benchtop centrifuge for 1.5 mL Eppendorf tubes | Eppendorf, Germany | 5427 R | |
| peristaltic pump | GE Healthcare, UK | P1 | |
| FPLC system | GE Healthcare, UK | Äkta Purifier 10 or the like | |
| inverted microscope | Nikon | TI Eclipse wide-field fluorescence microscope with 100x (N.A. 1.4) objective and Mercury Lamp | example setup for fluorescence microscopy |
| electron multiplying CCD (EMCCD) camera | Andor Technologies, UK | Andor Luca | example setup for fluorescence microscopy |
| fluorescence excitation filter | Thorlabs, USA | Dichroic cube (TLV-U-MF2-TRITC) | example setup for fluorescence microscopy |
| fluorescence emission filter | AHF Analysentechnik, Germany | T 560 LPXR | example setup for fluorescence microscopy |
| cover slip 24 x 60 mm | Carl Roth, Germany | LH26.1 | example setup for fluorescence microscopy |
| Immersion Oil | Carl Zeiss, Germany | Immersol 518 F | example setup for fluorescence microscopy |
| probe sonicator | Bandelin, Germany | Sonopuls HD3200 with sonotrode MS-72 | 200 W maximum HF output |
| C5 HPLC column (2.1x100 mm, 3 µm particle size) | Sigma-Aldrich, Germany | 567227-U | example setup for mass spectrometry |
| ESI-TOF coupled to HPLC system | Agilent, USA | Agilent 6530 Accurate Mass QTOF with 1260 HPLC | example setup for mass spectrometry |
Referências
- Ferri, M., Ranucci, E., Romagnoli, P., Giaccone, V. Antimicrobial resistance: A global emerging threat to public health systems. Crit Rev Food Sci Nutr. 57 (13), 2857-2876 (2017).
- Bahar, A. A., Ren, D. Antimicrobial peptides. Pharmaceuticals. 6 (12), 1543-1575 (2013).
- Ageitos, J. M., Sánchez-Pérez, A., Calo-Mata, P., Villa, T. G. Antimicrobial peptides (AMPs): Ancient compounds that represent novel weapons in the fight against bacteria. Biochem Pharmacol. 133, 117-138 (2017).
- Arnison, P. G., et al. Ribosomally synthesized and post-translationally modified peptide natural products: overview and recommendations for a universal nomenclature. Nat Prod Rep. 30 (1), 108-160 (2013).
- Lubelski, J., Rink, R., Khusainov, R., Moll, G. N., Kuipers, O. P. Biosynthesis, immunity, regulation, mode of action and engineering of the model lantibiotic nisin. Cell Mol Life Sci. 65 (3), 455-476 (2008).
- Shin, J. M., Gwak, J. W., Kamarajan, P., Fenno, J. C., Rickard, A. H., Kapila, Y. L. Biomedical applications of nisin. J Appl Microbiol. 120 (6), 1449-1465 (2016).
- Scherer, K. M., Spille, J. -. H., Sahl, H. -. G., Grein, F., Kubitscheck, U. The lantibiotic nisin induces lipid II aggregation, causing membrane instability and vesicle budding. Biophys J. 108 (5), 1114-1124 (2015).
- Jung, G. Lantibiotica - ribosomal synthetisierte Polypeptidwirkstoffe mit Sulfidbrücken und α,β-Didehydroaminosäuren. Angew Chemie. 103 (9), 1067-1084 (1991).
- Rink, R., et al. Lantibiotic structures as guidelines for the design of peptides that can be modified by lantibiotic enzymes. Biochemistry. 44 (24), 8873-8882 (2005).
- Lagedroste, M., Smits, S. H. J., Schmitt, L. Substrate Specificity of the Secreted Nisin Leader Peptidase NisP. Biochemistry. 56 (30), 4005-4014 (2017).
- Ross, A. C., Liu, H., Pattabiraman, V. R., Vederas, J. C. Synthesis of the lantibiotic lactocin S using peptide cyclizations on solid phase. J Am Chem Soc. 132 (2), 462-463 (2010).
- Fukase, K., et al. Synthetic Study on Peptide Antibiotic Nisin. V. Total Synthesis of Nisin. Bull Chem Soc Jpn. 65 (8), 2227-2240 (1992).
- Dumas, A., Lercher, L., Spicer, C. D., Davis, B. G. Designing logical codon reassignment - Expanding the chemistry in biology. Chem Sci. 6 (1), 50-69 (2015).
- Kuthning, A., Durkin, P., Oehm, S., Hoesl, M. G., Budisa, N., Süssmuth, R. D. Towards Biocontained Cell Factories: An Evolutionarily Adapted Escherichia coli Strain Produces a New-to-nature Bioactive Lantibiotic Containing Thienopyrrole-Alanine. Sci Rep. 6, 33447 (2016).
- Piscotta, F. J., Tharp, J. M., Liu, W. R., Link, A. J. Expanding the chemical diversity of lasso peptide MccJ25 with genetically encoded noncanonical amino acids. Chem Commun (Camb). 51 (2), 409-412 (2015).
- Hartman, M. C. T., Josephson, K., Lin, C. -. W., Szostak, J. W. An expanded set of amino acid analogs for the ribosomal translation of unnatural peptides. PLoS One. 2 (10), 972 (2007).
- Johnson, J. A., Lu, Y. Y., Van Deventer, J. A., Tirrell, D. A. Residue-specific incorporation of non-canonical amino acids into proteins: recent developments and applications. Curr Opin Chem Biol. 14 (6), 774-780 (2010).
- Ibba, M., Söll, D. Aminoacyl-tRNAs: setting the limits of the genetic code. Genes Dev. 18 (7), 731-738 (2004).
- Studier, F. W., Moffatt, B. A. Use of bacteriophage T7 RNA polymerase to direct selective high-level expression of cloned genes. J Mol Biol. 189 (1), 113-130 (1986).
- Budisa, N., Steipe, B., Demange, P., Eckerskorn, C., Kellermann, J., Huber, R. High-level biosynthetic substitution of methionine in proteins by its analogs 2-aminohexanoic acid, selenomethionine, telluromethionine and ethionine in Escherichia coli. Eur J Biochem. 230 (2), 788-796 (1995).
- Rink, R., et al. Dissection and modulation of the four distinct activities of nisin by mutagenesis of rings A and B and by C-terminal truncation. Appl Environ Microbiol. 73 (18), 5809-5816 (2007).
- Kubyshkin, V., Durkin, P., Budisa, N. Energetic contribution to both acidity and conformational stability in peptide models. New J Chem. 40 (6), 5209-5220 (2016).
- Molloy, E. M., Field, D., O'Connor, P. M., Cotter, P. D., Hill, C., Ross, R. P. Saturation mutagenesis of lysine 12 leads to the identification of derivatives of nisin A with enhanced antimicrobial activity. PLoS One. 8 (3), 58530 (2013).
- Wang, L., Brock, A., Herberich, B., Schultz, P. G. Expanding the genetic code of Escherichia coli. Science. 292 (5516), 498-500 (2001).
- Liu, C. C., Schultz, P. G. Adding new chemistries to the genetic code. Annu Rev Biochem. 79, 413-444 (2010).
- Anderson, J. C., Wu, N., Santoro, S. W., Lakshman, V., King, D. S., Schultz, P. G. An expanded genetic code with a functional quadruplet codon. Proc Natl Acad Sci U S A. 101 (20), 7566-7571 (2004).
- Zambaldo, C., Luo, X., Mehta, A. P., Schultz, P. G. Recombinant macrocyclic lanthipeptides incorporating non-canonical amino acids. J Am Chem Soc. 139 (34), 11646-11649 (2017).
- Al Toma, R. S., et al. Site-directed and global incorporation of orthogonal and isostructural noncanonical amino acids into the ribosomal lasso peptide capistruin. Chembiochem. 16 (3), 503-509 (2015).
- Chatterjee, A., Xiao, H., Schultz, P. G. Evolution of multiple, mutually orthogonal prolyl-tRNA synthetase/tRNA pairs for unnatural amino acid mutagenesis in Escherichia coli. Proc Natl Acad Sci U S A. 109 (37), 14841-14846 (2012).
- Budisa, N., Pal, P. P. Designing novel spectral classes of proteins with a tryptophan-expanded genetic code. Biol Chem. 385 (10), 893-904 (2004).
- Voller, J. -. s., Thi To, T. M., Biava, H., Koksch, B., Budisa, N. Global substitution of hemeproteins with noncanonical amino acids in Escherichia coli with intact cofactor maturation machinery. Enzyme Microb Technol. 106, 55-59 (2017).
- Moghal, A., Hwang, L., Faull, K., Ibba, M. Multiple Quality Control Pathways Limit Non-protein Amino Acid Use by Yeast Cytoplasmic Phenylalanyl-tRNA Synthetase. J Biol Chem. 291 (30), 15796-15805 (2016).
- Datsenko, K. A., Wanner, B. L. One-step inactivation of chromosomal genes in Escherichia coli K-12 using PCR products. Proc Natl Acad Sci U S A. 97 (12), 6640-6645 (2000).
- Engelke, G., Gutowski-Eckel, Z., Hammelmann, M., Entian, K. D. Biosynthesis of the lantibiotic nisin: genomic organization and membrane localization of the NisB protein. Appl Environ Microbiol. 58 (11), 3730-3743 (1992).
- Baumann, T., Nickling, J. H., Bartholomae, M., Buivydas, A., Kuipers, O. P., Budisa, N. Prospects of In vivo Incorporation of Non-canonical Amino Acids for the Chemical Diversification of Antimicrobial Peptides. Front Microbiol. 8, 124 (2017).
- Plat, A., Kluskens, L. D., Kuipers, A., Rink, R., Moll, G. N. Requirements of the engineered leader peptide of nisin for inducing modification, export, and cleavage. Appl Environ Microbiol. 77 (2), 604-611 (2011).
- JoVE Science Education Database. Basic Methods in Cellular and Molecular Biology. Bacterial Transformation: The Heat Shock Method. J Vis Exp. , (2017).
- JoVE Science Education Database. Basic Methods in Cellular and Molecular Biology. Bacterial Transformation: Electroporation. J Vis Exp. , (2017).
- Shi, Y., Yang, X., Garg, N., van der Donk, W. A. Production of lantipeptides in Escherichia coli. J Am Chem Soc. 133 (8), 2338-2341 (2011).
- Hochuli, E., Bannwarth, W., Döbeli, H., Gentz, R., Stüber, D. Genetic Approach to Facilitate Purification of Recombinant Proteins with a Novel Metal Chelate Adsorbent. Nat Biotechnol. 6 (11), 1321-1325 (1988).
- Zhang, Z., Marshall, A. G. A universal algorithm for fast and automated charge state deconvolution of electrospray mass-to-charge ratio spectra. J Am Soc Mass Spectrom. 9 (3), 225-233 (1998).
- JoVE Science Education Database. High-Performance Liquid Chromatography (HPLC). J Vis Exp. , (2017).
- JoVE Science Education Database. Dialysis: Diffusion Based Separation. J Vis Exp. , (2017).
- Khusainov, R., Kuipers, O. P. The presence of modifiable residues in the core peptide part of precursor nisin is not crucial for precursor nisin interactions with NisB- and NisC. PLoS One. 8 (9), 74890 (2013).
- Terzaghi, B. E., Sandine, W. E. Improved medium for lactic streptococci and their bacteriophages. Appl Microbiol. 29 (6), 807-813 (1975).
- Schindelin, J., Rueden, C. T., Hiner, M. C., Eliceiri, K. W. The ImageJ ecosystem: An open platform for biomedical image analysis. Mol Reprod Dev. 82 (7-8), 518-529 (2015).
- . Phosphate-buffered saline (PBS). Cold Spring Harb Protoc. 2006 (1), (2006).
- van Hest, J. C. M., Tirrell, D. A. Efficient introduction of alkene functionality into proteins in vivo. Febs Lett. 428 (1-2), 68-70 (1998).
- Prince, A., et al. Lipid-II Independent Antimicrobial Mechanism of Nisin Depends On Its Crowding And Degree Of Oligomerization. Sci Rep. 6 (1), 37908 (2016).
- Zhou, L., et al. Incorporation of tryptophan analogues into the lantibiotic nisin. Amino Acids. 48 (5), 1309-1318 (2016).
- Presolski, S. I., Hong, V. P., Finn, M. G. Copper-Catalyzed Azide-Alkyne Click Chemistry for Bioconjugation. Curr Protoc Chem Biol. 3 (4), 153-162 (2011).
- Abts, A., et al. Easy and rapid purification of highly active nisin. Int J Pept. 2011, 175145 (2011).
- Francklyn, C. S., First, E. A., Perona, J. J., Hou, Y. -. M. Methods for kinetic and thermodynamic analysis of aminoacyl-tRNA synthetases. Methods. 44 (2), 100-118 (2008).
- van Heel, A. J., et al. Production and Modification of Five Novel Lantibiotics Using the Promiscuous Nisin Modification Machinery. ACS Synth Biol. 5 (10), 1146-1154 (2016).
- Wiegand, I., Hilpert, K., Hancock, R. E. W. Agar and broth dilution methods to determine the minimal inhibitory concentration (MIC) of antimicrobial substances. Nat Protoc. 3 (2), 163-175 (2008).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados