Method Article
정식이 아닌 아미노산의 선택적 압력 관에 의해 생산 하는 항균 성 펩 티 드
* 이 저자들은 동등하게 기여했습니다
요약
프로토콜 선물 대장균-lactococcal 항균 성 펩 티 드 nisin에 비정규 아미노산 (ncAAs)의 선택적 압력 관을 기반으로. 재조합 식을 통해 대체 정의 된 성장 매체에서 원하는 ncAAs로 동안 그것의 속성을 변경할 수 있습니다. Bioactivity 결과 변화 성장 금지 분석 실험 및 형광 현미경 검사 법에 의해 매핑됩니다.
초록
자연 개별 아미노산 빌딩 블록의 순서를 수정 하 여 새로운 단백질 기능을 만들 수 있는 가능성의 다양 한 있다. 그러나, 모든 변화는 정식 20 아미노산 (cAAs) 기반으로 합니다. Polypeptides에 추가 물리 화학적 특성을 소개 하는 방법으로 비 정식 아미노산 (ncAAs)의 점점 단백질 공학에 사용 됩니다. 그들의 상대적으로 짧은 길이 때문에 ribosomally 합성 및 post-translationally 수정 ncAAs에 의해 펩 티 드의 수정 특히 매력적 이다. 새로운 기능 및 화학 처리 개별 잔류물의 특정 수정 생성 될 수 있습니다. 선택적 압력 관 (SPI) 메서드 auxotrophic 호스트 긴장 화학적으로 정의 된 성장 매체에는 필수 아미노산의 박탈을 활용 합니다. 여러 가지 구조적 및 화학적으로 유사한 아미노산 아날로그 다음 해당 aminoacyl-tRNA 합성에 의해 활성화 될 수 있다 고 제공 잔류물 전용 cAA(s) → ncAA(s) 대체 대상 펩 티 드 또는 단백질 순서에서. 비록, SPI 메서드의 컨텍스트에서 ncAAs 또한 재조합 유전자 발현 단계에서 호스트 프로테옴에 통합 됩니다, 셀의 자원의 대부분 대상 유전자의 표현에 할당 됩니다. 그러면 ncAAs 종종 수정된 대상의 다량과 함께의 효율적인 잔류물 관련 법인. 제시 작품 vivo에서 의 설립을 여섯 프롤린 유사 체 항균 펩타이드 nisin, 자연스럽 게 Lactococcus lactis제작한 lantibiotic에 설명 합니다. Nisin의 항균 속성 변경 되 고 추가 발효와 auxotrophic 대장균 에 식 동안 확대 될 수 있다 정의 성장 매체에 긴장. 따라서, ncAAs로 cAAs의 잔류물 관련 교체의 효과 항균 성 활동 그리고 특이성에 변화를 제공할 수 있습니다. 항균 성 활동 분석 실험 및 형광 현미경 검사 법 그람 양성 Lactococcus lactis 표시기 긴장의 성장 억제에 대 한 새로운 nisin 변형 테스트 하는 데 사용 됩니다. 질량 분광학 생리 nisin 변종에 번의 전미 대학 설립을 확인 하는 데 사용 됩니다.
서문
20 세기에 항생제의 발견과 사용 하는 병원 성 미생물에 대 한 새로운 항균 성 화합물의 병렬 개발 세균 감염의 치료 대상. 그러나, 메 티 실린 내성 Staphylococcusaureus (MRSA), vancomycin 내성 enterococci (VRE) 등 multidrug 저항 병원 균의 출현으로 인해 MDR (multidrug 저항 하는) 살 모 넬 라 typhimurium 살 균 소 10 (DT10 입력 ), Klebsiella 균, 그것은 긴급 하 게 필요한 새로운 항균 성 에이전트1을 생성 하 고. 항균 성 펩 티 드 (암페어)는 그들의 물리 화학적 특성, 유연성, 크기, hydrophobicity, 및 작업2모드 덕분에 새로운 약물의 개발을 위한 유망한 후보자는 다재 다능 한, 종종 매우 구체적인 화합물. 앰프는 작은 펩 티 드 일반적으로 7-100 아미노산의 구성. 종종, 그들은 양이온 구조는 반대로3청구 대상된 미생물 세포 막 상호 작용 충전 된 아르기닌과 리 진 잔류물에서 풍부한 있다. 앰프의 특정 하위 그룹은 ribosomally 합성 및 posttranslationally 수정 펩 티 드 (RiPPs)4. 이 버섯의 왕국 및 박테리아의 도메인에서 많은 유기 체에 의해 생산 됩니다. 가장 유명 하 고 널리 사용 되는 RiPPs 중 하나입니다 nisin, 자연스럽 게 Lactococcus lactis (L. lactis) 젖 산 박테리아에 의해 생산. 그람 양성 세균의 패널에 대 한 활성, nisin 사용 되었습니다 식품 산업에서 biopreservative로 50 년 이상 그것의 항균 속성 및 대상된 미생물 긴장5에 저항을 진화의 부재. 연구는 보여주 그 nisin destabilizes 모두 그람 양성 및 그람 음성 병원 균6에 대 한 항균 성 활동으로 이어지는 박테리아 세포 막에 숨 구멍을 생성. 지질 II에 바인딩하여 세균 세포 벽 합성 저해7입니다. Nisin 니사 선형 전조 펩 티 드, 지도자와 코어 펩 티 드 지역 (그림 1)의 구성 되는으로 인코딩됩니다. Ribosomal 합성 후 prenisin dehydratase NisB에 의해 먼저 수정 됩니다. 여기, prepeptide 코어 지역에서 떠들고, 트레오닌 잔류물 dehydroalanine (Dha) 및 dehydrobutyrine (Dhb)8을 탈수 있다. 그 후, 탈수 잔류물 양식 lanthionine 반지에 시스테인과 결합 된다 (따라서 lanthionine 반지-포함 된 항생제에 대 한 이름 "lantibiotic")는 효소 촉매 마이클 추가 의해. 이 posttranslational 수정 (PTM) 있고 탈에 의해 촉매 이다. L. lactis, 수정 된 prenisin 다음 전송 NisT에 의해 셀에서 수송 그리고 지도자 펩 티 드 가수분해 NisP 성숙 하 고 활성 nisin 양식9을 출시 하 여 죽 습. 책임 지도자 peptidase NisP 높은 기질 특이성, 이후 과정만 효율적으로 nisin 수정10.
일반적으로 활성 RiPPs PTM 효소 (예를 들어 NisBC), 과감 하 게 짧은 펩 티 드, 예를 들어, 통해 acetylation, glycosylation, 메 틸 화 또는 인 산화 화학 공간 증가의 행동에서 유래한 다. 이 정도의 복잡성 ncAAs의 직접 결합 하 여 더 확장할 수 있습니다. 종종 가능 하 고, 앰프의 화학 합성 그들의 구조적 복잡성 때문에 대규모 생산에 대 한 도전입니다. 예를 들어 71 반응 단계에서 lantibiotic lactosin S의 총 화학 합성 10%의 최종 수익률 및 nisin만 0.00311,12의 원유 수익률의 달성 되었다. 따라서, 생물 생산 올바른 stereocenters 그리고 높은 제품 농도의 생성으로 인해 실행 가능한 대안을 제공합니다.
오늘, 최대 재조합 단백질에 150 이상 ncAAs, 예를 들어, 불 소 또는 azides, 포함 하는 기능적인 그룹 데 통합 되었습니다 그리고 ncAA 수정 앰프의 몇 가지 예 보고13,14, 15,16. NcAAs의 도입과 함께 새로운 물리 화학적 속성 기존의 mutagenesis에 비해 생성 수 있습니다. 기존 펩 티 드의 다양성, 새로운 항생제에 증가 수 있습니다.
재조합 펩 티 드로 ncAAs의 설립에 대 한 한 가지 방법은 선택적 압력 관 (SPI) auxotrophic 세균성 긴장17의 사용에 따라 이다. 이 종자는 ncAA의 해당 cAA 아날로그 합성의 수 없습니다. 방법론은 자주 관찰된 편안한 기질 특이성, 많은 자연 aminoacyl-tRNA synthetases (aaRSs)18의 기능을 사용합니다. 그들의 자연적인 cAA 기판 외이 효소 종종 인식 하 고 원하는 미식 축구를 활성화 하 고 그들의 동족 tRNA(s)에 그것을 위탁 할 수 있다. 이 잔류물 특정 방식으로 (즉, cAA → ncAA 대체) 대상 유전자 제품으로 ncAA의 ribosomal 설립 리드. 물론만 가능 때 원하는 ncAA 비슷합니다 구조적 및 화학적 정식 아미노산 이며 세포 생리학, 번역 기계 및 대상 펩 티 드 또는 단백질 순서에 의해 용납. 특정 실험 설정에서 auxotrophic 호스트 세포 대체 하는 기본 아미노산의 제한 농도 함께 제공 된 정의 된 매체에 교양. 세포 성장 또는 cAA 무료 매체에 의해 exchange는 cAA의 세포내 고갈 이끌어 낸다. 다음 단계에서 ncAA 추가 하 고 대상 유전자 발현을 유도 합니다. 필연적으로, ncAAs는 지금 또한 통합 하지 호스트 셀에 다른 많은 단백질에 표적 유전자 발현의이 단계 동안. 그럼에도 불구 하 고, SPI 설치의 독성 유지 낮은 수준 때문에 대장균 (대장균) 스트레인 들고 강한 발기인의 통제 대상 유전자를 플라스 미드로 변환 됩니다 (일반적으로 매우 경쟁력 있는 T7 발기인 / RNA 중 합 효소 시스템)19. (보통 때 cAA는 소진) 유도, 세포 성장을 중단 호스트와 그들의 세포질 효소 기계 직후 플라스 미드 기반의 목표 유전자의 표현에 주로 사용 됩니다. 사이트 지시 된 mutagenesis 대상 유전자20잔류물 특정 ncAA 설치의 사이트 정의를 사용할 수 있습니다.
NcAAs의 설립에 대 한 모델 펩타이드로 pentacyclic 앰프 nisin A 선정 되었다. 오랫동안 34 아미노산 이며 코어 펩 티 드 순서 (그림 1)에서 단일 프롤린 잔류물만 있다. Subtilisin, ericin A, S, 및 nisin Z 및 nisin Q 뿐만 아니라 epidermin, 보존된 프롤린 활동9,21에 필수적인 것으로 보인다. CAA 프롤린 peptidyl prolyl 아 미드 회전 및 이차 구조 안정화에 특히 중요 한 역할을 한다. 그것의 측면 체인 반지 conformations (엑 소 / 엔도 puckers) 아 미드 유대의 열역학적 안정화에 대 한 책임이 있습니다. Prolyl puckers의 대상된 화학 수정 (예: hydroxylations, fluorinations, methylations) 자주 비판적으로 영향을 미칠 접는 안정성, 비 강성 및 많은 생물학 구조22의 기능. 따라서, Pro→ 프롤린 아날로그 대체 반지 B, nisin의 두 번째 반지 소설 및 특이 한 속성 부여 됩니다 기대 하는 듯 하다.
여기, 프롤린 auxotrophic 대장균 스트레인 재조합 nisin 생산을 위해 사용 되었다. 이 수정 효소 유전자 nisBC및 prepeptide 유전자 nisA 의 식이 필요합니다. 유전자 인코딩된 펩 티 드 제품 N 말기 그의 태그에 대 한 리더로 친화성 크로마토그래피를 통해 정화를 수행합니다. 활동 결정에 대 한 L. lactis 표현 및 NisPT를 은닉 재조합 nisin 변종 대장균 세포 lysates 또는 순화 된 펩 티 드 샘플 (그림 1)에서 활성화 하는 데 사용 됩니다. 성숙한 앰프 NisP 지도자의 분열 후 출시 됩니다. 이 한 천 유포 방법에서는 앰프 샘플 단단한 성장 매체에 확산 하 고 그람 양성 미생물의 성장을 억제 수 있습니다. 부 화, 후이 성장 저해 후광에 의해 시각적으로 관찰할 수 있습니다. L. lactis 지표로 서, 뿐만 아니라 수정 nisin 변종 Enterococcus faecalis 균 cereus, 포도 상 구 균 , 유산 균 johnsonii 에 대 한 항균 성 활동을 보여준 21,23.
RiPPs에 있는 ncAAs를 통합 하는 대체 하 고 실험적으로 다른 방법은 정지 codon 억제 (SCS)24입니다. 이 위해, 직교 tRNA / aminoacyl-tRNA 합성 (aaRS) 쌍 해당 미식 축구에 대 한 필요. 이상적으로, 이러한 모든 세 가지 구성 요소는 bioorthogonal, 즉, 그들은 내 생 tRNAs 그리고 aaRSs 상호 작용 하지 않습니다. 미식 축구-관련 aaRS 효소 활성 사이트의 수정 및 돌연변이 synthetases25의 유전자 라이브러리의 심사에 의해 생성할 수 있습니다. 또한,는 ncAA의 소개는 codon를 다시 배정 되 고는 cAA에 인코딩하지 않습니다 필요 합니다. 일반적으로, 황색 정지 codon 사용된24,26입니다.
최근, SPI 니사27에 α-chloroacetamide을 포함 하 고 클릭-화학-호환 ncAAs의 설립 설립 되었다. 예를 들어 Nε-alloc-리 루 테 늄 촉매 metathesis28 여 올가미 펩 티 드 captistruin 사이트 (SCS) 및 잔류물 관련 (SPI) 설립 방법 및 이후 수정된 체 외 에 통합 되었다 . SPI, 비해 SCS 방법은 더 복잡 한 직교 tRNA 이후/aaRS 쌍 공동 표현 될 수 있다. 날짜 하려면, o-쌍 프롤린 통합 개발된29, 하지만 우리의 지식 최선을 프롤린 아날로그 관 더 예 보고 되었습니다.
그것은 모든 ncAAs SPI 방법론을 사용 하 여 통합 될 수 있다 지적 한다. 첫째, ncAAs에 세포질 통풍 관은 대장균같은 그람 음성 세균에 대 한 내부 막 세포질 막에 포함 된 수송 단백질의 무리에 의해 통제 된다. 일반적으로, 대장균 은 구조적 측면 체인 셀에 다양 한 아미노산 아날로그 수송 능력과 정식 아미노산을 화학적으로 유사한. 두 번째, 그들은 독성 물질 대사 및 호스트의 생리학 셀30대 한 많은 화학적 반응 또는 불안정 ncAAs 세포 성장 향해 억제제 역할 수 있습니다. 따라서, 통풍 관 및 프로덕션 호스트에 대 한 미식 축구의 독성 테스트 해야 미리. 부작용으로 PTM 기계의 비활성화를 방지 하려면 책임 있는 유전자의 엄격 하 게 제어 식 설치 사용할 수 있습니다 수정 효소 (예를 들어, nisBC)에 천연 아미노산을 통합 하 고 대상 유전자 ( 에 미식 축구 예를 들어, 니사). 이 특별히 설계 된 SPI 프로토콜31에서 같이 두 개의 다른 발기인 및 대상 유전자 발현의 유도 사용 하 여 수행할 수 있습니다. 위에서 설명한 대로 SPI 메서드 미식 축구 활성화 및 충전 동족 tRNA aaRS의 편안한 기질 특이성에 의존 합니다. 그 후, tRNA는 리보솜 아 미드 유대 형성 및 대상 (폴 리) 펩 티 드의 폴딩에 전달 됩니다. 이 과정에서 교정과 편집 메커니즘 관련32될 수 있습니다. 이러한 이유로, 그것은 목표를가지고 매우 중요 구조적 및 화학적 cAA 유사한 ncAA. 다른 중요 한 포인트는 충분 한 안정성 (성장 매체에서 둘 다 세포질 물질 대사에 노출) 및 ncAA의 가용성. 또한, 그것은 상업적으로 사용할 수 또는 화학적으로 합성을 쉽게 해야 합니다.
여기, 우리는 SPI, 재조합 RiPPs로 ncAAs의 잔류물 관련 설립 허용에 대 한 프로토콜을 설명 합니다. 특히, 다른 프롤린 유사 체 항균 펩타이드 nisin A에 통합 하는 대장균 을 사용 하 여 호스트 유기 체로. 펩 티 드 제품 성장 저해 분석 및 미생물 표시기 종자를 사용 하 여 형광 현미경을 사용 하 여 bioactivity에 대 한 분석 및 질량 분석 아미노산 보충을 확인 하기 위해 사용 됩니다.
성공적인 재조합 nisin 식 정의 ncAAs에 대 한 기본 요구 사항은 필요 적합 프롤린 auxotrophic E. 콜라이 긴장. 이 대 한 auxotrophy, 쾌속 범선 수 있다 역 기능, 예를 들어 게놈 녹아웃에 의해 달성. 셀을 완벽 하 게 세포내 프로 생 합성의 박탈 (즉, 삭제 proABC) 복귀에 대 한 가능성은 안정적인 auxotrophs 없이. 널리 사용 되는 유전자 녹아웃 메서드는 페이지 변환 또는 Datsenko & Wanner33에 따라 단일 유전자 녹아웃. 또한, Addgene, CGSC 등 게이오 컬렉션 공개 저장소에서 쾌속 범선 녹아웃 종자를 얻을 수 있습니다. 여기에 표시 된 재조합 nisABC 식 T7 발기인의 사용에 의존, 식 호스트 스트레인은 T7 RNA 중 합 효소에 유도할 수 있는 유전자를 수행 해야 합니다. 이 예를 들면 상업 키트를 사용 하 여 호스트 게놈에 λDE3 prophage의 도입에 의해 수행할 수 있습니다. 또는, BL21(DE3) 같은 변종 auxotrophic 위에서 설명한 대로 만들 수 있습니다.
프로토콜
1. 복제 식 벡터와 auxotrophic 생산 스트레인의 변화
여기, nisin 생 합성, 즉 nisABC에 대 한 유전자 L. lactis 에서 가져온 고 T7 기반 플라스 미드 식 벡터에 전송 되었습니다. NisABC 의 전체 DNA 시퀀스 은행 항목 X6830734에서 찾을 수 있습니다. 선구자 펩 티 드 (nisA)에 대 한 유전자 암 피 실린 저항 수 여 하는 애완 동물-3a 벡터에 배치 하고있다. Dehydratase (nisB)와 있고 (탈)에 대 한 유전자 벡터 pRSFDuet-1에 보고 된 이전35, 대 저항 수 여 하는 배치 되었습니다.
참고: 니사에 대 한 지도자 시퀀스의 마지막 4 개의 아미노산 (ASPR)의 codons 인코딩할 VSLR36 코어 펩 티 드에 프롤린 잔류물 고유 렌더링 하 고 적절 한 prepeptide NisP에 의해 처리 되도록 변경 했다. N-말단에서 링커 잔류물에 의해 형벌 hexa-히스티딘 태그 정화 목적 ( 그림 1참조)에 대 한 추가 되었습니다.

그림 1 . 생 합성 및 대장균 에 니사 PTM의 도식 표현 뿐만 아니라, 이후의 활동 분석 결과에 L. lactis 표시기 긴장에 의해 지도자 분열. 첫 번째 단계에서 (지도자와 독특한 프롤린 (분홍색)를 포함 하는 핵심 펩 티 드 지역 위치 9에 구성) 하는 비활성 선형 prenisin 인코딩 니사 ribosomally 합성. 다음으로, prenisin는 posttranslationally 수정 dehydroalanine (Dha) 및 dehydrobutyrine (Dhb) 떠들고, 트레오닌 잔류물의 탈수에 의해 NisB에 의해 촉매. 있고 탈 형성은 thioether 교량을 통해 Dha 또는 Dhb 시스테인 sulfhydryl 그룹의 마이클 추가. 비활성 수정된 prenisin 대장균 에서 정화 하 고 항균 성 활동에 대 한 테스트. 여기, 그것은 그람 양성 L. lactis 표시기 긴장의 세포로 수송 된다. 지도자는 완전히 활성화 nisin 출시 protease NisP (로 화살촉으로 표시)에 의해 죽 습. 그것은 제거 된 시험관에 트립 신 (*)로 처리 하 여 수 있습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
- 표준 열-충격 프로토콜37 또는 electroporation38 프롤린 auxotrophic 변환을 사용 하 여 플라스 미드 애완 동물-3a 니사(VSLR)와 pRSFDuet-1 nisBC E. 콜라이 긴장 (위 참조).
- 암 피 실린, 대과 1% (w/v) 포도 당을 포함 하는 한 천 배지 위에 변형된 세포 현 탁 액의 25-100 µ L 플라스틱 플레이트 분산기 또는 유리 구슬에 사용 하 여 판에 균등 하 게 솔루션을 확산.
- 37 ° c.에 하룻밤 번호판을 품 어
- 다음 오후 단일 식민지를 사용 하 여 포함 하는 암 피 실린, 대과 1% (w/v) 포도 당 50 mL 플라스 크에 10 mL 파운드 매체를 예방.
- 문화 하룻밤 (12-16 h) 37 ° C와 200 rpm에 흔들.
- 250 µ L 살 균 80% 글리세롤과 550 µ L 문화, 믹스 2 mL 튜브에 잘 걸리고 80 ° c.에 언된 셀 주식으로 저장
2. 새로운 최소 매체 (NMM) 준비
참고:이 프로토콜 화학적으로 정의 된 액체 세균성 성장 매체로 NMM20 을 사용합니다. 또한, 준비의 순서를 엄격 하 게 따라 하는 것이 좋습니다. 그렇지 않으면, 강 수 발생할 수 있습니다. 자료 테이블 (예: 염 산 염)에 나열 된에서 서로 다른 아미노산 형태에 대 한 가용성을 확인 합니다. NMM19 교체 cAA 제외 19 아미노산을 포함 (여기, 프롤린) ncAA 아날로그에 의해. 마지막 성분 농도 표 1을 참조 하십시오. 생산을 위해 사용 하는 세균성 스트레인에 따라 biotin과 티 아민 옵션 수 있습니다.
- 아미노산 혼합물의 준비
- 0.5 g 페, 100 mL ddH2O 해체까지 집중된 HCl 몇 방울의 추가 함께 Tyr와 Trp를 분해.
- 나머지 16 아미노산의 각 0.5 g으로 무게. 22 mL의 1 M KH2포4 및 48 mL 1 M K2HPO4의 믹스. DdH2O ~ 800 mL를 추가 합니다. 솔루션 취소 될 때까지 저 어.
- 녹은 Phe, Trp 및 Tyr 더하고 ddH2오 1 l 솔루션의 볼륨을 조정
- 병 상단 필터 장치 진공 여과 의해 아미노산 혼합물을 소독.
- NMM19에 대 한 재고 솔루션
- 먼저, 준비 1 M 재고 솔루션의 다음 구성 요소: (NH4)24, KH2포4, K2HPO4, MgSO4 및 5 M NaCl의 솔루션 재고 그래서. 압력가 마로 소독 하 여 소독.
- 50 mL 주식 (1 M) D-포도 당, CaCl2 (1 g/L), FeCl2 (1 g/L), 티 아민 (10 g/L), biotin (10 g/L) 성분 (CuSO4, ZnCl2, MnCl2, (NH4)2무4; 1 mg/L를 준비 ). 주사기 필터 여과 하 여 각을 소독.
- NMM19 준비
- 7.5 m m (NH4)2의 최종 농도 얻기 위해 모든 재고 솔루션을 혼합 등4, 1.7 m m NaCl, 22 mM KH2포4, 50 m K m2HPO4, 1 mM MgSO4 및 20 밀리미터 D-포도 당, 아미노산 50mg/L 혼합, 1 µ g/L CaCl2, 1 µ g/L FeCl2, 10 µ g/L 티 아민, 비오 틴 10 mg/L, 0.01 µ g/mL 추적 요소.
3. 재조합 Nisin SPI에 의해 프롤린 아날로그의 결합으로 표현
이 섹션에는 prepeptide의 재조합 식에서 (여기: 니사) 및 PTM 유전자 (여기: nisBC) 수행 됩니다. 첫째, 세포는 파운드 복잡 한 매체 사용 모든 cAAs의 성장. 그렇지 않으면 야생-타입 펩 티 드의 생산으로 이어질 수 있는 배경 수준 대상 유전자 발현을 억 누르기 위해 포도 당 추가 (여기: nisin) 발기인의 시키는 때문. 대상 후 cAA (여기: 프롤린)는 고갈, ncAA 추가 되 고 대상 유전자 발현 화학적으로 정의 된 매체에서 유도 된다. 액체 문화 부 화 통 기 통풍 (예를 들어, 200 rpm에서 2 L 삼각 플라스 크에 500 mL)와 적당 한 플라스 크에서 수행 되어야 합니다.
- 냉동된 세포 주식 또는 신선한 식민지에서 신선한 숙박 문화를 시작 살 균 피 펫 팁을 사용 하 여 (단계 1 참조). 암 피 실린, 대과 1% (w/v) 포도 당을 포함 하는 25 mL 파운드 매체를 사용 하 고 37 ° C에서 하룻밤 (12-16 h)와 200 rpm을 품 어.
- 10 mL 1 박 문화 (1 %v / v)와 살 균 신선한 매체의 1 L를 접종 하 고 37 ° C와 200 rpm에서 OD600 까지 품 어 = 0.5.
- 4500 x g에서 15 분 동안 4 ° C에서 원심 분리기.
- 상쾌한 오프와 20 mL (2.3 단계에서 준비) NMM19 포함 된 항생제와 포도 당 1% (w/v) 펠 릿 resuspend. 4500 x g에서 10 분 동안 4 ° C에서 원심 분리기.
- 같은 매체의 500 mL에 셀 펠 릿 resuspend와 30 ° C와 1 시간에 200 rpm에서 품 어.
참고:이 단계에서 cAA 소모 (여기, 프롤린) 일어난다. - 문화 (각 ncAA 한) 등분으로 나눕니다. 1mm 이소프로필 β-D-1-thiogalactopyranoside (IPTG)와 각 문화를 유도 하 고 1mm 프롤린 아날로그를 공급 (4S/R-fluoroproline, 4S/R-하이드 또는 4S/R-methanoproline).
참고: 제어, 한 문화는 1mm 프롤린, 야생-타입 펩 티 드 생산의 결과 함께 공급 될 수 있다. - 28 ° C에서 하룻밤 (12-16 h)와 200 rpm를 품 어.
- 5000 x g.에서 20 분 동안 4 ° C에서 50 mL 튜브에 부는 상쾌한 어 문화와 정화까지-80 ° C에서 펠 릿을 저장할 셀 원심
4. 절연 및 그의 태그 Nisin 아날로그의 정화
펩 티 드 denaturant guanidine 염 산 염 (GuHCl)39, 강한 조건을 변성 시키기에서 정화 됩니다.
주의: GuHCl은 유해 삼 킨 하거나 흡입 및 피부와 눈 자극. 눈 보호와 장갑을 착용 하십시오.
- 바인딩 버퍼 (5 M GuHCl, 300 m m NaCl, 25mm Tris, pH 7.4), 워시 버퍼 (300 m m NaCl, 25mm Tris, 25mm 이미, pH 7.4) 및 차입 버퍼 (300 m m NaCl, 25mm Tris, 이미 250 m m, pH 7.4)의 250 mL를 준비 합니다. 이들을 위해, 250 mL 병으로 고체를 전송 하 고 채워 최대 200 mL ddH2오 믹스 잘 7.4 1 M NaOH와 HCl로 pH를 조정. 그런 다음, 채워 최대 250 mL ddH2O. 필터 병 최고 필터 단위를 사용 하 여 모든 버퍼 솔루션.
- 세포 세포의 용 해
여기에, (와 함께 200 W 최대 고주파 (HF) 출력) sonicator 사용 됩니다; 참고 세포 파쇄에 필요한 전원 설정을 다른 악기에 대 한 달라질 수 있습니다. 모든 단계는 얼음에 수행 됩니다. 또는, 화학 세포 세포의 용 해, 액체 균질 화기 또는 프랑스 언론을 사용할 수 있습니다.- (단계 3.8)에서 각 원심 분리기 튜브를 12 mL 바인딩 버퍼를 추가 하 고 vortexing에 의해 resuspend.
- 세포 현 탁 액으로 sonicator 프로브의 팁을 잠수함. 40 %1의 펄스 진폭 sonicator 설정에 s / 5 15 분 떨어져 s.
참고: 샘플을 피하기 위해 carryover 사이 sonicator 팁 청소. 70% 에탄올 sonicator 프로브를 닦아냅니다. - 작은 세포 파편을 15000 x g에서 40 분 4 ° C에서 lysed 세포 현 탁 액 원심 새로운 반응 관에는 supernatants 전송.
- 친화성 크로마토그래피
고정된 금속 이온 친화성 크로마토그래피 (IMAC)40, 연동 펌프 또는 FPLC 시스템 1 mL 카트리지 (여기 Ni NTA 수 지 가득 함)와 함께 사용할 수 있습니다. 버퍼의 준비 단계 4.1을 참조 하십시오.
참고: IMAC 정화는 이후 생산된 재조합 펩타이드는 N 말기 태그 그의 지도자, 지도자 peptidase NisP, 성숙한 nisin 방출 하 여 6 단계에서 제거 되는 운반 가능. 실내 온도에 또는 4 ° c.에 정화를 수행 아이맥 카트리지를 위한 한 분당 1 mL의 유량을 해당 하는 경우 사용 합니다.- 첫째, 씻어 5 열 양의 (cv) ddH2O 저장소 버퍼를 제거 하는 카트리지.
- 10 equilibrate 바인딩 버퍼의 이력서.
- 프로세스 세포 lysate (4.2 단계) 사용 하 여 주사기 입자 제거 필터 다음 카트리지를 적용.
- 15 세척 일반적인 및 언바운드 물자를 제거 하기 위하여 세척 버퍼의 이력서.
- 10 elute 차입 버퍼와 1.5 mL 튜브에 수집 1 mL 분수의 이력서. 단기 (최대 3 일) 4 ° C에 또는 더 긴 기간 동안-20 ° C에서 분수를 저장 합니다.
- 저장, 세척 10 카트리지 ddH2O의 이력서 5 다음 20% 에탄올의 이력서.
5. LC ESI TOF 질량 Spectrometric 분석 Nisin 아날로그의
참고: 참조 자료 테이블 분무 이온화 시간의 비행 질량 분석 (LC-ESI-TOF-석사)와 결합 하는 액체 크로마토그래피에 대 한 예를 들어 계측.
- C5 열 물 (A)와 (B) 모두 0.1% 포 름 산 및 5-80% B 20 분 이상에서 그라데이션 보충 이기의 모바일 단계에 15-20 µ L 펩 티 드 솔루션 (단계 4.3에서에서 준비)의 HPLC 분리를 수행 합니다. 질량 분석 (MS), 5 분 후 차입 사용 하 여.
참고: 펩 티 드 콘텐츠 및 HPLC 열 선호도 따라 샘플 볼륨 및 분리 할 수 최적화. - 적절 한 소프트웨어를 사용 하 여 측정 된 질량 스펙트럼을 deconvolute와 다른 펩 티 드 충전 상태41계산. CAA → ncAA 대체 하 여 변경 계산된 야생-타입 질량에 관찰 된 펩 티 드 종 질량을 비교 합니다. 선형 prepeptide posttranslationally 8 dehydrations (-8 H2O) 및 5 cyclizations에 의해 수정 된 계정 ( 그림 1참조).
참고: 나트륨을 포함 하는 버퍼를 사용 하 여, 긍정적인 모드에서 MS 분석 나트륨 adducts 표시할 수 있습니다. 이들은 더 높은 deconvoluted 질량 추가 봉우리로 표시 된다 (각 나트륨 adduct, 관찰 된 deconvoluted 질량은 22.99 다 더 높은). 이러한 제거 하려면 adducts, HPLC 정화42 또는 광범위 한 투 석43 수행할 수 있습니다.
6. 항균 활성 시험
- GM17-한 천 배지 메 마른 조건 하에서 준비
- (= GM17) 표시기 스트레인 L. lactis NZ9000 1% (w/v) M17 국물45 에서 30 ° C에서 플라스 미드 pNG nisPT44 를 들고 포도 당 및 5 µ g/mL 페니의 숙박 문화를 준비 합니다.
- OD600측정, OD600 신선한 매체 접종 = 0.1과 OD600 까지 품 어 0.4-0.6 =. 그런 다음 얼음에 플라스 크를 놓습니다.
참고: 각 OD600 측정 문화 볼륨을 사용 합니다. 유의 하십시오 각각에 대 한 천 배지를 분석 결과, 1 mL 세균성 문화 필요한 것입니다. 필요한 경우, 그에 따라 액체 문화 볼륨을 확장할. - 한 천 1.5%, 대 한 미디어 유리병에 4.5 g 천 밖으로 무게. 300 mL ddH2O, 믹스, 그리고 압력솥 추가 합니다.
- 2 x M17 (두 집중)에 국물 300ml ddH2O와 오토 클레이 브를 준비 합니다.
- 25 mL 2 x M17 국물 10 µ g/mL 페니 및 2% 포도 당 1 mL L. lactis preculture (4 %v / v)와 함께 믹스.
- 25 mL 녹은 1.5 %agar (갓 압력가 마로 소독 하거나 전자 레인지에가 열)를 추가 합니다.
참고: 이전에, 식힙니다 병 터치 (약 50 ° C). 이 L. lactis 이기 때문에 높은 온도에 민감한 mesophilic 유기 체. - 큰 페 트리 접시에 솔루션을 붓는 다. 10-15 분에 대 한 번호판을 건조.
- 불꽃에 의해 유리 파스퇴르 피 펫의 끝을 소독. 진정, 그것을 위해 기다릴 다음 넓은 끝을 사용 하 여 응고 GM17 agar에 구멍을 만들.
- 샘플 준비
- 이라는 1.5 mL 튜브에 3 분 동안 원심 분리기 (단계 3.7에서에서 만든) 대장균 식 문화 1 mL 7000 x g. Aspirate 나머지 매체에서 고 500 µ L에서 셀 펠 릿 resuspend Na-P (50 m m 나트륨 인산 염 버퍼 pH 7.4 산화물이 인산 나트륨 0.5 M와 0.5 M disodium 인산 수소에서 만든).
- 얼음 (비교 단계 4.2.2)에 샘플 sonicate 세포 현 탁 액으로 sonicator 프로브의 팁을 잠수함. 30 %1의 펄스 진폭 sonicator 설정 s 3 분에서 5 및 s.
- 세포 lysate 작은 세포 파편을 13000 x g에서 10 분 원심 얼음에는 상쾌한 새로운 반응 관에 전송.
- 희석 및 1 mL OD600 셀 추출 supernatants 정상화 나 피와 함께 수확된 셀 밀도 기준으로 0.6 =
- 작업 테스트
- 표시기 한 천 배지 (그림 3)의 구멍에 각 정규화 된 샘플의 40 µ L를 추가 합니다. 복합 항균 컨트롤로 400 µ g/mL에서 페니를 사용 합니다. 차입 버퍼를 사용 하 여 부정적인 컨트롤. 모든 샘플은 한 천으로 확산 됩니다 때까지 기다립니다. 30 ° c.에 하룻밤 접시를 품 어
- 평판 스캐너 또는 디지털 카메라를 사용 하 여 한 천 격판덮개의 사진을 찍을. 성장 저해 헤일로 크기는 손으로 측정 또는 사용 ImageJ46일 수 있다.
7. 형광 현미경 검사 법
세균성 세포의 효과 관찰 하기 위해 빛과 형광 현미경 검사 법을 사용할 수 있습니다. 참고 작업의 nisin 모드 불안정 및 세균성 막6숨 구멍의 대형에 의존 합니다. 여기, 나 일 붉은 얼룩 흩어져 고 시 집계 셀 세포의 용 해 되는 세균 세포 막 데 사용 됩니다.
참고: 참조 자료 테이블 예 계측입니다. 펩 티 드 농도 및 bioactivity에 따라 추가 앰프 솔루션의 금액을 조정할 수 있습니다.
- 세포 준비
- 10mm에서 디 메 틸 sulfoxide (DMSO) 나 일 빨강 재고 솔루션을 준비 합니다.
- OD600 L. lactis 표시기 스트레인 성장 = 1.0 단계 6.1.1-6.1.2에서.
- 4 ° C와 5000 x g 3 분 1 mL 문화 원심
- 상쾌한, 1 mL의 인산 염 버퍼 식 염 수 (PBS)47에 resuspend.
- 원심 분리기와 다시 resuspend입니다.
- 부드럽게 혼합, 1 µ L 나 일 빨강 재고 솔루션을 추가 합니다.
- 미세한 이미지 수집
- 520에 흥분 하는 동안 커버 슬라이드에 세포 준비의 30 µ L를 추가 nm.
- 수집 시간 0.2 s, 운동 시리즈 설정 0.1 Hz, 시리즈 길이 200 이미지.
- 추가 하는 0.3-세포 lysate의 아이맥 샘플 1.5 µ L (에서 단계 6.2.4 또는 4.3.5, 각각). 아이맥 샘플에 대 한 차입 버퍼 부정적인 컨트롤로 사용할 수 있습니다.
- 모니터 및 기록 형광 방출에서 λ ≥ 560 nm.
- 데이터 분석
- 현미경 이미지 시퀀스는 영화 파일 (.avi)로 저장 됩니다. 단일 이미지 ImageJ46으로 분석 된다.
결과
이 프로토콜은 SPI 메서드에서 프롤린 아날로그의 잔류물 관련 법인 ncAA 수정 nisin 이체의 생산을 활성화 하도록 설계 되었습니다. 이전에 타당성과 24 mg/L의 수확량 완전히 수정된 야생-타입 nisin39의 재조합 생산을 위해 보고 되었다. SPI 메서드를 사용 하 여 대상 펩타이드/단백질 수율 자주 고 좋은 야생-타입 생산48가까운 수량을 도달할 수 있다. 첫 번째 실험으로 재조합 야생-타입 RiPP 생산 선택한 auxotrophic 호스트에서 테스트 되어야 합니다. 여기, 프롤린 auxotrophic 대장균 MG1655 ΔproBA:: frt Δ프로세서:: 호스트 스트레인 frt (DE3) 사용 되었다. NcAAs, 재배와 유도의 설립에 대 한 타이밍 뿐만 아니라 중간 구성 및 온도 최대 펩 티 드 항복으로 최적화할 수 있습니다.
항균 성 활동 분석 결과
야생-타입 재조합 nisin 생산 및 정화 위의 프로토콜에 따라 수행 했다. 이 경우에, 프롤린 단계 3.6에서 ncAA 파생 대신 사용 되었다. 항균 성 활동 분석 결과 RiPP 생산을 확인 하 고 항균 성 활동 정화 전후 비교을 사용 되었다. 활동 분석 결과 대 한 차입 분수와 아이맥 흐름 통해 직접 사용 되었고 그람 양성 L. lactis 표시기 스트레인 (그림 2)에 대 한 테스트. NisP, nisin 변종 대장균 세포 lysates에 포함 된 또는 펩 티 드 샘플을 각각, 정화를 표현 하는이 긴장으로 지도자 펩 티 드의 분해 분열에 의해 활성화 된다. 결국, 흐름 통해 성장 억제 활동을 보여주었다. 이 없는 아이맥 열에 바인딩 생리 활성 물질에 의해 설명 될 수 있다. 모든 테스트 차입 분수 아이맥에 의해 그의 태그 펩 티 드의 농도 나타내는 unpurified 샘플에 비해 증가 한 활동을 보였다. 참고 (부정적인 제어)으로 차입 버퍼가 분석이 결과에 L. lactis 의 성장을 좌우 하지 않았다.
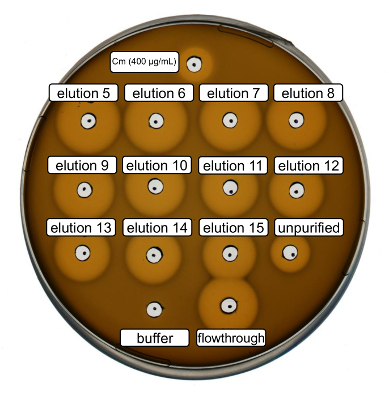
그림 2 . 항균 성 활동의 아이맥 정화 recombinantly 야생-타입 nisin 생성 후 테스트 합니다. 차입 분수 5 ~ 15와 아이맥 정화의 통해 흐름 L. lactis 표시기 스트레인에 대 한 (OD600 정규화에 대 한 희석) unpurified 세포 lysate 비교 테스트 했다. 성장 저해 후광의 크기는 항균 성 활동을 나타냅니다. 400 µ g/mL의 농도에서 페니 부정적인 컨트롤로 긍정적인 제어 및 아이맥 차입 버퍼로 사용 되었다. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
Recombinantly의 항균 활동을 증명 하기 위해 여섯 프롤린 다른 아날로그를 포함 하는 변종, 활동 분석 결과 L. lactis 표시기 긴장의 억제 테스트를 수행한 nisin 생산. 그림 3 5 프롤린 아날로그를 사용 하 여 생산 하는 6 개의 샘플에 대 한 성장 억제를 보여준다. -Fluoroproline, (4R)-아날로그 (4R)의 합동 실험에 대 한 최상의 결과 (헤일로 크기에서 판단)으로 관찰 했다 하이드 (4S)-methanoproline. 야생-타입 nisin에 성장 저해 헤일로 크기 비교 생산과 동시에 모든 3 개의 nisin 이체 보여 비슷한 억제 강도 테스트. 그러나, 혼자 헤일로 크기 수 없습니다 데 엉덩이 특정 활동 때문에 앰프의 농도 결정 하지 했다. 따라서,는 분석 실험 결과 nisin 이체의 항균 활동 보존 또는 분실 여부 품질로 테스트에 제공 합니다. 특정 활동을 확인 하려면 nisin 이체의 농도 정량된 (토론 참조) 해야 합니다.
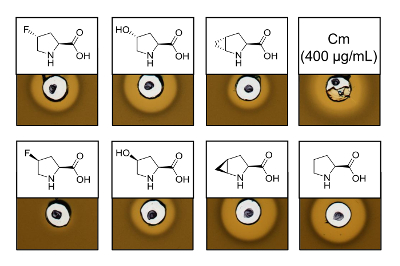
그림 3 . Nisin 이체를 포함 하는 세포 lysates의 항균 활동 분석 결과 통해 SPI 프롤린 아날로그와 생산. 재조합 야생-타입 샘플 nisin 이체의 비교. 모든 샘플은 OD600-수확된 셀 문화 밀도 기준으로 세포 세포의 용 해 후 정규화. 후광은 표시기 스트레인 성장 저해의 형태로 bioactivity을 나타냅니다. 첫째 행을 왼쪽에서 오른쪽: (4R)-fluoroproline, (4R)-하이드, (4R)-methanoproline와 페니 (400 µ g/mL; 항균 긍정적인 통제). 둘째 행: (4S)-fluoroproline, 4 (S)-하이드, 4 (S)-methanoproline, 프롤린 (야생-타입 컨트롤). 참고 화학 명명법; 예를 들어, (4R)-fluoroproline는 라고도 트랜스-4-fluoroproline. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
LC ESI TOF 질량 분석
아이맥 정화 후 nisin에 있는 ncAAs의 설립 LC ESI TOF 질량 분석에 의해 분석 되었다. 그림 4 는 (4R)를 포함 하는 nisin variant의 deconvoluted 질량 스펙트럼-fluoroproline. 이 변종 아이맥 위에서 설명한 대로 정화 하 고 그래서 그것은 여전히 지도자 수행 이후에 LC ESI TOF 질량 분석, 분석 했다. 그림 4A 에 주요 피크 (4R) 포함 된 수정된 nisin에 해당-6883.18 다의 deconvoluted 질량을 가진 fluoroproline (계산 된 질량 6882.05 다, 계산에 프롤린과 해당 야생-타입 펩 티 드의 질량 위치 9는 6864.06 다)입니다. 더 낮은 풍부 및 높은 질량 두 봉우리에 해당 하는 나트륨 adducts 표시. 그림 4 B 다르게 충전된 종의 주요 복합 deconvolution 알고리즘에 의해 발견으로 보여줍니다. 1148.11 m/z에서 피크 six-fold 충전된 종에 해당 하는 예를 들어 ([M + 6 H]6 +).

그림 4 . (4R)를 포함 하는 재조합 nisin 아이맥 정화 변종의 LC ESI TOF 질량 분석-fluoroproline. (A) Deconvoluted (4R) nisin 변종 (아직도 운반 지도자)에 대 한 질량 분석 크로마 (축소는 삽입에)-fluoroproline (예상 질량 (다): [M + H]+ 6882.05, [M + 나]+ = = 6904.03, [M + 2Na]2 + = 6926.02). (B) 복합 종 [M + H]+스펙트럼. 예상 질량 (다): [M + 5 H]5 + 1377.41, = [M + 6 H]6 + 1148.01, = [M + 7 H]7 + = 984.15, [M + 8 H]8 + 861.26, = [M + 9 H]9 + = 765.67, [M + 10 H]10 + = 689.21, [M + 11 H]11 + = 626.64, [M + 12 H] 12 + 574.50 =. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
형광 현미경 검사 법
재조합 nisin 및 그것의 ncAA 포함 된 이체의 항균 활동 또한 형광 현미경을 통해 L. lactis 표시기 스트레인의 직접 관찰에 의해 게재 수 있습니다. 나 일 빨강, 매우 소수 형광 염료, 얼룩 박테리아 세포 막에 사용 되었다. 그림 5 셀 문화와 단일 셀 형태학의 집계 상태의 질적 변화를 보여준다. 셀 나 일 레드 스테인드 되었고 현미경 커버 슬라이드에 입금. 위쪽 행에 표시 시작에서 직접 셀 때 버퍼, 재조합 야생-타입 nisin, 또는 nisin 포함 (4R)-fluoroproline, 또는 (4R)-하이드 추가 되었습니다. 하단 패널 외피의 20 분 후 해당 이미지를 보여줍니다.
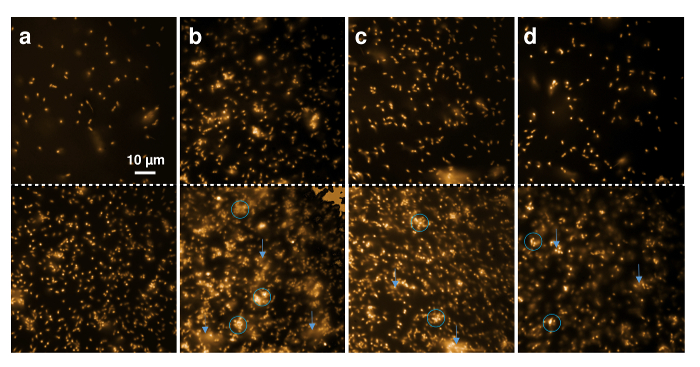
그림 5 . 그람 양성 세포에서 재조합 nisin 효과의 형광 현미경 검사 법. 30 µ L L. lactis 표시기 스트레인의 미세한 이미지 (OD600 = 1) 나 일 빨강 (상단 패널) 전에 찍은 표시 (하단 패널) 후 1 µ L 버퍼 (A), 0.3 µ L 재조합 야생-타입 nisin (B) 20 분 보육 및 0.6 µ L nisin 변종 포함 (4R)-fluoroproline (C)와 (4R)-하이드 (D). 블루 서클 지역 지역 형광 막 파편의 확산을 관찰 될 수 있다 집계 또는 변형 세포, 파란색 화살표 지점으로 표시 합니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
그림 5 A 표시 셀의 일반적인 모양을 관찰의 20 분 이내에 변화 하지 않았다. 시간 로즈 동안 예금 하는 셀의 수만 하 고, 따라서 세포의 큰 금액 80 µ m x 80 µ m의 관찰된 영역 내에서 표시 됩니다. 그림 5 B 에서는 그람 양성 세포 등장 집계 모호한 ()로 표시 파란 동그라미의 야생-타입 nisin에 노출 20 분 후, 심지어 낮은 금액 (여기, 0.3 µ L 아이맥 차입) 추가 되었다. 또한, 가벼운 소재 막 조각 나 일 빨간 표시 (파란색 화살표에 의해 표시 된) 기간 동안 동원 했다 나타내는 버퍼에 세포에서 확산 된다. 이러한 결과 nisin6,49치료 시 발생 하는 것 같이 했다 세포 세포의 용 해를 나타냅니다. 비슷한 효과-fluoroproline (그림 5C) 및 nisin (4R) 포함-는 nisin 변형 포함 (4R)와 부 화 후 관찰 되었다 하이드 (그림 5D) 모두 보여주는 큰 20 분 후, 컨트롤 샘플 (그림 5A)에 표시 된 대조에서 왜곡 하 고 집계 된 셀의 금액.
| 구성 요소 | 농도 |
| (NH4) 2 그래서4 | 7.5 m m |
| NaCl | 8.5 m m |
| KH2포4 | 22 m m |
| K2HPO4 | 50 mM |
| MgSO4 | 1mm |
| D-포도 당 | 20 mM |
| 모든 정식 아미노산 (대체 한) 제외 | 50 mg/L |
| 캘리포니아2 + | 1 µ g/mL |
| Fe2 + | 1 µ g/mL |
| 추적 요소 (Cu2 +, Zn2 +, 미네소타2 +, MoOH2 +) | 0.01 µ g/mL |
| 티 아민 | 10 µ g/mL |
| 비타민 b 복합체 | 10 µ g/mL |
표 1입니다. NMM19의 구성 2 단계에 따라 준비 후 화학적으로 세균 성장 매체를 정의합니다.
토론
프롤린 아날로그의 삽입에 대 한 SPI를 사용 하 여 대상된 nisin 구조 수정할 수 있습니다 실질적으로, 독특한 시퀀스 조합 및 화학적 특성 새로운 펩 티 드 이체를 만들기. 이 방법에서는, 고아 한 유전자 기술의 기본 제한 피할 수, 20 cAAs의 사이드 체인 화학 제한 되는. Nisin 위의 exemplified의 vivo에서 화학 다변화 자연 PTMs 보완 하 고 극적으로 RiPPs의 화학 공간을 향상 시키기 위해 일반적인 접근 방식을 보여 줍니다. 우리는 특히 앰프에 대 한 위대한 약속을 보유 천연 아미노산의 레 퍼 토리를 확대 생각 합니다. 단백질, 엄청난 범위의 기능 3 차원 구조에 20 cAAs의 정의 된 배열을 통해 실현 될 수 있다. 길이3만 7-100 aa와 cAAs 통해서만 같은 구조 기능을 달성 하는 방법 앰프에 대 한 제한 됩니다. 아니다 따라서 놀라운 RiPPs의 형태로 자연 앰프는 일반적으로 광범위 하 게 post-translationally 수정된4. 같은 방식 ncAAs 대체 빌딩 블록으로 (바 우만 외. 201735 참조 및 참조 거기에) 그들의 pharmacodynamic 및 pharmacokinetic 매개 변수를 개선 하기 위해 큰 약속 잡으십시오.
비교적 쉬운 실험 설치, 간단 실행 및 높은 재현성이 작품 혜택에 사용 되는 SPI 방법론. 때문에 글로벌 대체 multisite ncAA 법인 대상 펩 티 드에 가능한 이기도합니다. 다른 한편으로, 방법은 대상 유전자 제품에서 자주 발생 하는 아미노산의 교체에 대 한 적절 한 않을 수 있습니다. 원칙적으로, 바람직하지 않은 위치 사이트 지시 된 mutagenesis에 의해 변경 될 수 있습니다 하지만 이러한 추가 변경 또한 구조와 bioactivity를 포함 하 여 여러 앰프 속성에 영향을 미칠 수 있습니다. 일단 생산을 위한 auxotrophic 긴장을 사용할 수 있는 여러 ncAAs 유전 수준에 광범위 한 변경 하지 않고도 테스트할 수 있습니다. 또한, 메서드 auxotrophic 대장균 에 국한 되지 않습니다 변종, 그러나 또한 자연적인 생산 호스트를 사용 하 여 수행할 수 있습니다. 예를 들어 주 외. 소설 RiPPs의 생산을 위한 SPI 또한 작동 했다는 자연스럽 게 Trp 주별 L. lactis: 미디어 정의 사용 하 여, 3 개의 트립토판 아날로그 nisin50에 4 개의 위치에 통합 되었다.
SPI 메서드 리드 선택의 글로벌 교체 이후 cAA는 ncAA에 의해, 그것은 일반적으로 광범위 한 대상 펩 티 드 및 단백질에 적용. 범위 auxotrophic 대장균 의 긴장은 사용할 수 (1 단계 참조), 여러 cAAs 각 ncAAs에 의해 교체에 대 한 검사 수 있도록. 아날로그 메타를 사용 하 여 통합을 만났다-결핍 긴장 (예를 들어, B834(DE3))는 가장 일반적으로 고용. Isostructural 메트로 아날로그의 예로 azidohomoalanine (아 하) 및 homopropargylglycine (Hpg), 상용 ncAAs 효율적으로 통합 될 수 있다. 둘 다 호환 alkyne 또는 아 지 드 기능을 각각 수행 하는 분자의 부착을 허용 하는 bioorthogonal 핸들을 소개 합니다. 예를 들어 형광 염료 또는 폴 리 에틸렌 글리콜 (PEG) moieties 구리 (I)에 의해 붙어 있을 수 있다-아 지 드 alkyne cycloaddition (CuAAC)51촉매.
비록 두 재조합 ncAA 설립 방법 (SPI와 SCS) 일반적으로 충분 한 목표 수량 달성, 수익률 종종 해당 펩 티 드와 단백질의 야생-타입 생산에 상대적으로 감소 된다. 고 순도 생산 효율을 자주 연관, 추가 정화 단계 필요, 특히 낮은 풍부한 종 수 있습니다. 재조합 nisin 생산의이 특정 한 경우, 그의 태그 리더 시퀀스 크게 간소화 RiPP 정화 세포 lysates에서 선택적 풍부 합니다. 이 프로토콜에 표시 된 정화 순도 및 nisin, 집중력 향상 하지만 종종 앰프 순도 수율 및 특정 활동을 확인 하기에 충분을 생성 하지 않습니다. 아이맥, 게다가 일반적으로 사용 되는 앰프 정화 방법 등 HPLC, 이온 교환 착 색 인쇄기 (IEC) 강수량 (예:. 아세톤 또는 trichloroacetic 산 (TCA)를 사용 하 여) 또는 조합 그것으로-다단계 정화 체계52 결과 . 주목 해야 한다 하는 그들의 일반적으로 polycationic 자연 IEC 정화를 촉진할 수 있다. 동결 자주 사용 됩니다 순화 앰프 저장 하.
이상적으로, 앰프 위한 ncAAs 저렴 한 가격에 상용 또는 쉽게 간단 하 고 재현할 수 화학 합성 프로토콜에 의해 생산. SPI 메서드에 대 한 동등 하 게 중요 한 필수가 이다 ncAA 인식 및 활성화 생 또는 공동 표현 aaRS 동족 tRNA에 청구. 이 시험 체 외에 아미노산 활성화 또는 tRNA aminoacylation 분석 결과53에 의해 될 수 있습니다. 쉬운 대신 SPI 테스트 식 녹색 형광 단백질 (GFP) 등 모델 단백질의 존재에 모두 실시 하 고 미식 축구 보충의 부재에서 수행할 수 있습니다. 또한, 화학 안정성 뿐만 아니라 성장 매체와 세포 침투성 용 해도 중요 한 요소를 구성 합니다.
이 예제에서 항균 성 활동은 그람 양성 표시기 긴장을 사용 하 여 상영 했다. 로 그것은 지도자 peptidase NisP 표현, nisin 성숙의 마지막 단계 촉매 이다. 지도자 시퀀스의 제거 (그의 태그 정화 목적을 위해) 수행 체 외에서 정화 NisP50 또는 트립 신54치료 하 여 수도 있습니다. 이 작업의 범위를 넘어 병원 성 유기 체 및 multidrug 저항 긴장 다음 테스트할 수 있습니다 bacteriostatic 또는 살 균 억제에 대 한 앰프와 유사한 방법론을 사용 하 여. 임상 관련 대상 종에는 MRSA, MDR 결핵균, VRE, Acinetobacter baumannii, 구 균, 녹 농 균 , Klebsiella 균포함 됩니다. 한 천 격판덮개 보급 외 분석 결과 여기에 제시, 성장 억제 또한 수행할 수 있습니다 적절 한 액체 미디어 세균성 종으로 주사 하 고 앰프와 보충을 사용 하 여. 국물 희석 방법을 사용 하 여, 최소 억제 농도 (MIC) 순수 펩 티 드55를 사용 하 여 확인할 수 있습니다. 여기에 제시 된 활동 분석 결과 또한 bioactivity와 참조 화합물, 예를 들어 상용 nisin 상대적인 앰프 포함 된 솔루션의 힘을 견적 하기 위하여 사용할 수 있습니다.
RiPPs의 재조합 생산 종종 가능39, 일반적으로 공동 표현의 PTM 유전자를 포함 하는. 최대한 빨리 생산 포함 하는 적당 한 ncAA 화학적으로 정의 또는 합성 최소한의 매체로 전달 됩니다, 해당 cAA의 잔류물 관련 대체가 일어난다. 따라서, 다른 RiPPs 그들의 재조합 생산은 가능 하 고 조건 ncAA 설립 및 PTM 대상 제품의 충분 한 양의 얻을 찾을 수 있습니다 동일한 방법론으로 생산 수 있습니다. 호스트 세포 프로테옴 외 유의 펩 티 드 PTM 기계 또한 될 수 있다 ncAA 수정 SPI 동안. 따라서, 대상 식 유도의 타이밍 및 다음 잠복기의 길이 최적화를 요구할 수 있습니다. 때문에 ncAA 법인 PTM 효소에 그들의 안정성과 활동에 영향을 미칠 수, 처리 RiPP의 생산 원리에서 달라질 수 있습니다. 충분 한 PTM 효소 효능 MS와 bioactivity 분석 실험에 의해 검출로 처리 된 prepeptide의 형성에 의해 표시 됩니다. 다른 유도할 수 있는 발기인은 PTM을 생산 하기 위해 고용 수 위의 소개로 먼저 (ncAA의 부재)에 유전자 다음 전조 펩 티 드 유전자의 유도 ncAA의 존재에. 일반적으로, 포함 하는 cAA 대상 펩 티 드의 생산 전조 유전자의 꽉 억압이 필요한 이유는 ncAA의 추가 하기 전에 억압 해야 합니다. 이 프로토콜 내에서이 성장 매체에 포도의 추가 통해 catabolic 억압에 의해 이루어집니다. 재조합 생산 아직 되지 않은 경우 해당 유전자의 식 온도 코 돈 사용 최적화를 요구할 수 있습니다 특히 이후 prepeptide 처리에 필요한 PTM 효소 유전자 먼 호스트에서 일반적으로 발생, 설립. 원칙적으로 prepeptide에 있는 ncAAs의 존재 방해할 수 있습니다 인식 및 nisin 경우 PTM 효소의 처리 NisBC와 NisP. NcAA 통합 앰프에, 따라서 먼저 적당 한 식 조건 및 앰프 활동 분석 결과의 신뢰성을 확인 하는 소규모 식 실험을 수행 하 추천은.
공개
저자 들은 아무 경쟁 금융 관심사 선언 합니다.
감사의 말
J.H.N., 결핵 및 M.B. 인정 EU FW7 프로그램 (SYNPEPTIDE)에 의해 자금. F. 제 및 T.F. 연방 교육부 (BMBF 프로그램 "HSP 2020", TU WIMIplus 프로젝트 SynTUBio) 과학 및 독일 연구 재단 (클러스터의 우수성 "촉매에 Unifying 개념")에 의해 자금을 인정 합니다.
자료
| Name | Company | Catalog Number | Comments |
| sodium chloride | Carl Roth, Germany | P029 | |
| guanidine hydrochloride | Carl Roth, Germany | 0035.2 | |
| dipotassium hydrogen phosphate | Carl Roth, Germany | P749.3 | |
| potassium dihydrogen phosphate | Carl Roth, Germany | 3904.3 | |
| sodium dihydrogen phosphate monohydrate | Carl Roth, Germany | K300.2 | |
| disodium hydrogen phosphate | Carl Roth, Germany | P030.2 | |
| L-alanine | Carl Roth, Germany | 3076.2 | |
| L-arginine | Carl Roth, Germany | 3144.3 | |
| L-asparagine monohydrate | Carl Roth, Germany | HN23.1 | |
| L-aspartic acid | Carl Roth, Germany | T202.1 | |
| L-cysteine | Carl Roth, Germany | 3467.3 | |
| L-glutamine | Carl Roth, Germany | 3772.1 | |
| L-glutamic acid | Carl Roth, Germany | 3774.1 | |
| L-glycine | Carl Roth, Germany | 3187.3 | |
| L-histidine | Carl Roth, Germany | 3852.3 | |
| L-isoleucine | Carl Roth, Germany | 3922.3 | |
| L-leucine | Carl Roth, Germany | 3984.3 | |
| L-lysine monohydrate | Carl Roth, Germany | 4207.2 | |
| L-methionine | Carl Roth, Germany | 9359.4 | |
| L-phenylalanine | Carl Roth, Germany | 4491.2 | |
| L-proline | Carl Roth, Germany | T205.3 | |
| L-serine | Carl Roth, Germany | 4682.4 | |
| L-threonine | Carl Roth, Germany | T206.2 | |
| L-tryptophan | Carl Roth, Germany | 4858.2 | |
| L-tyrosine | Carl Roth, Germany | T207.2 | |
| L-valine | Carl Roth, Germany | 4879.4 | |
| ammonium sulfate | Carl Roth, Germany | 3746.3 | |
| magnesium sulfate | Carl Roth, Germany | 0261.2 | |
| D-glucose | Carl Roth, Germany | 6780 | prepare a 20% (w/v) solution for addition into molten agar |
| calcium chloride | Carl Roth, Germany | PN93.2 | |
| iron(II) chloride | Sigma-Aldrich, Germany | 372870 | |
| thiamine hydrochloride | Sigma-Aldrich, Germany | T1270 | |
| biotin | Carl Roth, Germany | 3822.2 | |
| copper(II) sulfate | Merck, Germany | 102792 | |
| manganese(II) chloride | Carl Roth, Germany | KK36.2 | |
| zinc chloride | Merck, Germany | 108816 | |
| immonium orthomolybdate | Sigma-Aldrich, Germany | 277908 | |
| glycerol | Carl Roth, Germany | 7533.3 | |
| isopropyl β-D-1-thiogalactopyranoside | Sigma-Aldrich, Germany | I6758 | |
| ampicillin sodium salt | Carl Roth, Germany | K029.5 | working concentration 100 µg/mL for E. coli, prepare 100 mg/mL stock in ddH2O |
| kanamycin sulfate | Carl Roth, Germany | T832.2 | working concentration 50 µg/mL for E. coli, prepare 50 mg/mL stock in ddH2O |
| chloramphenicol | Carl Roth, Germany | 3886.1 | working concentration 5 µg/mL for L. lactis, prepare 37 mg/mL stock in ethanol |
| (4S)-fluoroproline | Bachem, Switzerland | F-3970 | |
| (4R)-fluoroproline | Bachem, Switzerland | F-3975 | |
| (4S)-hydroxyproline | Bachem, Switzerland | F-1395 | |
| (4R)-hydroxyproline | Bachem, Switzerland | F-2980 | |
| (4S)-methanoproline | chemically synthesized | ||
| (4R)-methanoproline | chemically synthesized | ||
| hydrochloric acid (HCl) | Carl Roth, Germany | P074.4 | |
| ethanol | VWR, Germany | 20825.324 | |
| M17-broth | Sigmal-Aldrich, Germany | 56156 | commercial product, see Terzaghi BE & Sandine WE, Appl Microbiol., 1975, 29(6):807-13 for contents and preparation |
| agar-agar | Carl Roth, Germany | 5210.5 | |
| Nisin from Lactococcus lactis | Sigma-Aldrich, Germany | N5764 | commercial product, can be used as reference for bioactivity |
| dimethyl sulfoxide (DMSO) | Carl Roth, Germany | A994.1 | |
| imidazole | Carl Roth, Germany | 3899.3 | |
| 1.5 mL autosampler vial for LC-MS | Sigma-Aldrich, Germany | Supelco 854165 | |
| acetonitrile | VWR, Germany | HiPerSolv CHROMANORM ULTRA for LC-MS, 83642 | LC-MS grade required |
| formic acid | VWR, Germany | HiPerSolv CHROMANORM for LC-MS, 84865 | LC-MS grade required |
| 1 mL Ni-NTA IMAC column, e.g. HisTrap FF Crude | GE Healthcare, UK | 29-0486-31 | different manufacturers and resins available for IMAC |
| 0.45 µm bottle top filter unit | VWR, Germany | 10040-470 | sterile filtration of solutions using a vacuum pump |
| 0.45 µm syringe filter PVDF membrane | Carl Roth, Germany | CCY1.1 | sterile filtration of solutions using a syringe and to remove particles from cell lysates |
| luer-lock syringe, PP, 50 ml | Carl Roth, Germany | T552.2 | sterile filtration of solutions |
| 1.5 mL Eppendorf tubes | Eppendorf, Germany | 30120086 | |
| petri dishes (polystyrene, sterile) | Carl Roth, Germany | TA19 | |
| Nile red | Sigma-Aldrich, Germany | 72485 | |
| E. coli ΔproA strain | CGSC, Keio collection | JW0233-2 | proline-auxotrophic E. coli K-12 strain |
| E. coli B834(DE3) | Novagen (Merck), Germany | 69041 | methionine-auxotrophic E. coli B strain |
| λDE3 Lysogenization Kit | Novagen (Merck), Germany | 69734-3 | |
| Lactococcus lactis NZ9000 pNG nisPT | bacterial indicator strain, see Khusainov R & Kuipers OP, PLoS One, 8 (9), e74890 | ||
| benchtop centrifuge for 1.5 mL Eppendorf tubes | Eppendorf, Germany | 5427 R | |
| peristaltic pump | GE Healthcare, UK | P1 | |
| FPLC system | GE Healthcare, UK | Äkta Purifier 10 or the like | |
| inverted microscope | Nikon | TI Eclipse wide-field fluorescence microscope with 100x (N.A. 1.4) objective and Mercury Lamp | example setup for fluorescence microscopy |
| electron multiplying CCD (EMCCD) camera | Andor Technologies, UK | Andor Luca | example setup for fluorescence microscopy |
| fluorescence excitation filter | Thorlabs, USA | Dichroic cube (TLV-U-MF2-TRITC) | example setup for fluorescence microscopy |
| fluorescence emission filter | AHF Analysentechnik, Germany | T 560 LPXR | example setup for fluorescence microscopy |
| cover slip 24 x 60 mm | Carl Roth, Germany | LH26.1 | example setup for fluorescence microscopy |
| Immersion Oil | Carl Zeiss, Germany | Immersol 518 F | example setup for fluorescence microscopy |
| probe sonicator | Bandelin, Germany | Sonopuls HD3200 with sonotrode MS-72 | 200 W maximum HF output |
| C5 HPLC column (2.1x100 mm, 3 µm particle size) | Sigma-Aldrich, Germany | 567227-U | example setup for mass spectrometry |
| ESI-TOF coupled to HPLC system | Agilent, USA | Agilent 6530 Accurate Mass QTOF with 1260 HPLC | example setup for mass spectrometry |
참고문헌
- Ferri, M., Ranucci, E., Romagnoli, P., Giaccone, V. Antimicrobial resistance: A global emerging threat to public health systems. Crit Rev Food Sci Nutr. 57 (13), 2857-2876 (2017).
- Bahar, A. A., Ren, D. Antimicrobial peptides. Pharmaceuticals. 6 (12), 1543-1575 (2013).
- Ageitos, J. M., Sánchez-Pérez, A., Calo-Mata, P., Villa, T. G. Antimicrobial peptides (AMPs): Ancient compounds that represent novel weapons in the fight against bacteria. Biochem Pharmacol. 133, 117-138 (2017).
- Arnison, P. G., et al. Ribosomally synthesized and post-translationally modified peptide natural products: overview and recommendations for a universal nomenclature. Nat Prod Rep. 30 (1), 108-160 (2013).
- Lubelski, J., Rink, R., Khusainov, R., Moll, G. N., Kuipers, O. P. Biosynthesis, immunity, regulation, mode of action and engineering of the model lantibiotic nisin. Cell Mol Life Sci. 65 (3), 455-476 (2008).
- Shin, J. M., Gwak, J. W., Kamarajan, P., Fenno, J. C., Rickard, A. H., Kapila, Y. L. Biomedical applications of nisin. J Appl Microbiol. 120 (6), 1449-1465 (2016).
- Scherer, K. M., Spille, J. -. H., Sahl, H. -. G., Grein, F., Kubitscheck, U. The lantibiotic nisin induces lipid II aggregation, causing membrane instability and vesicle budding. Biophys J. 108 (5), 1114-1124 (2015).
- Jung, G. Lantibiotica - ribosomal synthetisierte Polypeptidwirkstoffe mit Sulfidbrücken und α,β-Didehydroaminosäuren. Angew Chemie. 103 (9), 1067-1084 (1991).
- Rink, R., et al. Lantibiotic structures as guidelines for the design of peptides that can be modified by lantibiotic enzymes. Biochemistry. 44 (24), 8873-8882 (2005).
- Lagedroste, M., Smits, S. H. J., Schmitt, L. Substrate Specificity of the Secreted Nisin Leader Peptidase NisP. Biochemistry. 56 (30), 4005-4014 (2017).
- Ross, A. C., Liu, H., Pattabiraman, V. R., Vederas, J. C. Synthesis of the lantibiotic lactocin S using peptide cyclizations on solid phase. J Am Chem Soc. 132 (2), 462-463 (2010).
- Fukase, K., et al. Synthetic Study on Peptide Antibiotic Nisin. V. Total Synthesis of Nisin. Bull Chem Soc Jpn. 65 (8), 2227-2240 (1992).
- Dumas, A., Lercher, L., Spicer, C. D., Davis, B. G. Designing logical codon reassignment - Expanding the chemistry in biology. Chem Sci. 6 (1), 50-69 (2015).
- Kuthning, A., Durkin, P., Oehm, S., Hoesl, M. G., Budisa, N., Süssmuth, R. D. Towards Biocontained Cell Factories: An Evolutionarily Adapted Escherichia coli Strain Produces a New-to-nature Bioactive Lantibiotic Containing Thienopyrrole-Alanine. Sci Rep. 6, 33447 (2016).
- Piscotta, F. J., Tharp, J. M., Liu, W. R., Link, A. J. Expanding the chemical diversity of lasso peptide MccJ25 with genetically encoded noncanonical amino acids. Chem Commun (Camb). 51 (2), 409-412 (2015).
- Hartman, M. C. T., Josephson, K., Lin, C. -. W., Szostak, J. W. An expanded set of amino acid analogs for the ribosomal translation of unnatural peptides. PLoS One. 2 (10), 972 (2007).
- Johnson, J. A., Lu, Y. Y., Van Deventer, J. A., Tirrell, D. A. Residue-specific incorporation of non-canonical amino acids into proteins: recent developments and applications. Curr Opin Chem Biol. 14 (6), 774-780 (2010).
- Ibba, M., Söll, D. Aminoacyl-tRNAs: setting the limits of the genetic code. Genes Dev. 18 (7), 731-738 (2004).
- Studier, F. W., Moffatt, B. A. Use of bacteriophage T7 RNA polymerase to direct selective high-level expression of cloned genes. J Mol Biol. 189 (1), 113-130 (1986).
- Budisa, N., Steipe, B., Demange, P., Eckerskorn, C., Kellermann, J., Huber, R. High-level biosynthetic substitution of methionine in proteins by its analogs 2-aminohexanoic acid, selenomethionine, telluromethionine and ethionine in Escherichia coli. Eur J Biochem. 230 (2), 788-796 (1995).
- Rink, R., et al. Dissection and modulation of the four distinct activities of nisin by mutagenesis of rings A and B and by C-terminal truncation. Appl Environ Microbiol. 73 (18), 5809-5816 (2007).
- Kubyshkin, V., Durkin, P., Budisa, N. Energetic contribution to both acidity and conformational stability in peptide models. New J Chem. 40 (6), 5209-5220 (2016).
- Molloy, E. M., Field, D., O'Connor, P. M., Cotter, P. D., Hill, C., Ross, R. P. Saturation mutagenesis of lysine 12 leads to the identification of derivatives of nisin A with enhanced antimicrobial activity. PLoS One. 8 (3), 58530 (2013).
- Wang, L., Brock, A., Herberich, B., Schultz, P. G. Expanding the genetic code of Escherichia coli. Science. 292 (5516), 498-500 (2001).
- Liu, C. C., Schultz, P. G. Adding new chemistries to the genetic code. Annu Rev Biochem. 79, 413-444 (2010).
- Anderson, J. C., Wu, N., Santoro, S. W., Lakshman, V., King, D. S., Schultz, P. G. An expanded genetic code with a functional quadruplet codon. Proc Natl Acad Sci U S A. 101 (20), 7566-7571 (2004).
- Zambaldo, C., Luo, X., Mehta, A. P., Schultz, P. G. Recombinant macrocyclic lanthipeptides incorporating non-canonical amino acids. J Am Chem Soc. 139 (34), 11646-11649 (2017).
- Al Toma, R. S., et al. Site-directed and global incorporation of orthogonal and isostructural noncanonical amino acids into the ribosomal lasso peptide capistruin. Chembiochem. 16 (3), 503-509 (2015).
- Chatterjee, A., Xiao, H., Schultz, P. G. Evolution of multiple, mutually orthogonal prolyl-tRNA synthetase/tRNA pairs for unnatural amino acid mutagenesis in Escherichia coli. Proc Natl Acad Sci U S A. 109 (37), 14841-14846 (2012).
- Budisa, N., Pal, P. P. Designing novel spectral classes of proteins with a tryptophan-expanded genetic code. Biol Chem. 385 (10), 893-904 (2004).
- Voller, J. -. s., Thi To, T. M., Biava, H., Koksch, B., Budisa, N. Global substitution of hemeproteins with noncanonical amino acids in Escherichia coli with intact cofactor maturation machinery. Enzyme Microb Technol. 106, 55-59 (2017).
- Moghal, A., Hwang, L., Faull, K., Ibba, M. Multiple Quality Control Pathways Limit Non-protein Amino Acid Use by Yeast Cytoplasmic Phenylalanyl-tRNA Synthetase. J Biol Chem. 291 (30), 15796-15805 (2016).
- Datsenko, K. A., Wanner, B. L. One-step inactivation of chromosomal genes in Escherichia coli K-12 using PCR products. Proc Natl Acad Sci U S A. 97 (12), 6640-6645 (2000).
- Engelke, G., Gutowski-Eckel, Z., Hammelmann, M., Entian, K. D. Biosynthesis of the lantibiotic nisin: genomic organization and membrane localization of the NisB protein. Appl Environ Microbiol. 58 (11), 3730-3743 (1992).
- Baumann, T., Nickling, J. H., Bartholomae, M., Buivydas, A., Kuipers, O. P., Budisa, N. Prospects of In vivo Incorporation of Non-canonical Amino Acids for the Chemical Diversification of Antimicrobial Peptides. Front Microbiol. 8, 124 (2017).
- Plat, A., Kluskens, L. D., Kuipers, A., Rink, R., Moll, G. N. Requirements of the engineered leader peptide of nisin for inducing modification, export, and cleavage. Appl Environ Microbiol. 77 (2), 604-611 (2011).
- JoVE Science Education Database. Basic Methods in Cellular and Molecular Biology. Bacterial Transformation: The Heat Shock Method. J Vis Exp. , (2017).
- JoVE Science Education Database. Basic Methods in Cellular and Molecular Biology. Bacterial Transformation: Electroporation. J Vis Exp. , (2017).
- Shi, Y., Yang, X., Garg, N., van der Donk, W. A. Production of lantipeptides in Escherichia coli. J Am Chem Soc. 133 (8), 2338-2341 (2011).
- Hochuli, E., Bannwarth, W., Döbeli, H., Gentz, R., Stüber, D. Genetic Approach to Facilitate Purification of Recombinant Proteins with a Novel Metal Chelate Adsorbent. Nat Biotechnol. 6 (11), 1321-1325 (1988).
- Zhang, Z., Marshall, A. G. A universal algorithm for fast and automated charge state deconvolution of electrospray mass-to-charge ratio spectra. J Am Soc Mass Spectrom. 9 (3), 225-233 (1998).
- JoVE Science Education Database. High-Performance Liquid Chromatography (HPLC). J Vis Exp. , (2017).
- JoVE Science Education Database. Dialysis: Diffusion Based Separation. J Vis Exp. , (2017).
- Khusainov, R., Kuipers, O. P. The presence of modifiable residues in the core peptide part of precursor nisin is not crucial for precursor nisin interactions with NisB- and NisC. PLoS One. 8 (9), 74890 (2013).
- Terzaghi, B. E., Sandine, W. E. Improved medium for lactic streptococci and their bacteriophages. Appl Microbiol. 29 (6), 807-813 (1975).
- Schindelin, J., Rueden, C. T., Hiner, M. C., Eliceiri, K. W. The ImageJ ecosystem: An open platform for biomedical image analysis. Mol Reprod Dev. 82 (7-8), 518-529 (2015).
- . Phosphate-buffered saline (PBS). Cold Spring Harb Protoc. 2006 (1), (2006).
- van Hest, J. C. M., Tirrell, D. A. Efficient introduction of alkene functionality into proteins in vivo. Febs Lett. 428 (1-2), 68-70 (1998).
- Prince, A., et al. Lipid-II Independent Antimicrobial Mechanism of Nisin Depends On Its Crowding And Degree Of Oligomerization. Sci Rep. 6 (1), 37908 (2016).
- Zhou, L., et al. Incorporation of tryptophan analogues into the lantibiotic nisin. Amino Acids. 48 (5), 1309-1318 (2016).
- Presolski, S. I., Hong, V. P., Finn, M. G. Copper-Catalyzed Azide-Alkyne Click Chemistry for Bioconjugation. Curr Protoc Chem Biol. 3 (4), 153-162 (2011).
- Abts, A., et al. Easy and rapid purification of highly active nisin. Int J Pept. 2011, 175145 (2011).
- Francklyn, C. S., First, E. A., Perona, J. J., Hou, Y. -. M. Methods for kinetic and thermodynamic analysis of aminoacyl-tRNA synthetases. Methods. 44 (2), 100-118 (2008).
- van Heel, A. J., et al. Production and Modification of Five Novel Lantibiotics Using the Promiscuous Nisin Modification Machinery. ACS Synth Biol. 5 (10), 1146-1154 (2016).
- Wiegand, I., Hilpert, K., Hancock, R. E. W. Agar and broth dilution methods to determine the minimal inhibitory concentration (MIC) of antimicrobial substances. Nat Protoc. 3 (2), 163-175 (2008).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유