Method Article
Codificación genética de un aminoácido no-canónico para la generación de anticuerpos medicamentos conjugados a través de una reacción rápida Bioorthogonal
En este artículo
Resumen
Incorporar un cyclopropene derivado de la lisina de anticuerpos permite la vinculación específica, rápida y eficiente de moléculas tetrazina-cojinete para generar fármacos de anticuerpos conjugados.
Resumen
Conjugados de anticuerpos-drogas (ADCs) utilizadas en la actualidad en la práctica clínica son mezclas de moléculas de anticuerpo ligadas a un número variable de toxinas en diferentes posiciones. Estudios preclínicos han demostrado que se puede mejorar el índice terapéutico de estos ADCs tradicionales por la vinculación específica de toxinas. Sin embargo, enfoques actuales para producir ADCs homogéneas tienen varias limitaciones, como expresión de la proteína bajo y cinética de reacción lenta. En este protocolo se describe cómo configurar un sistema de expresión incorporar un cyclopropene derivado de la lisina (CypK) de anticuerpos mediante la expansión del código genético. Esta manija de bioorthogonal mínima permite rápida Conjugación de tetrazina derivados a través de una cicloadición de Diels-Alder de demanda inversa. El sistema de expresión aquí registrado permite la fácil producción y purificación de trastuzumab con CypK en cada una de las cadenas pesadas. Explicamos cómo vincular el anticuerpo para la toxina monometil auristatin E y caracterizar el immunoconjugate por cromatografía de interacción hidrofóbica y espectrometría de masas. Finalmente, se describen los ensayos para evaluar la estabilidad en suero humano de la vinculación de dihydropyridazine resultante de la conjugación y la citotoxicidad selectiva de la ADC para las células de cáncer de mama con altos niveles de HER2 receptor de prueba.
Introducción
Conjugados de anticuerpos-drogas (ADCs) combinan la selectividad de biotherapeutics y la potencia de pequeñas moléculas citotóxicas. ADCs mayoría pretenden disminuir los efectos secundarios de la quimioterapia tradicional dirigiéndose a drogas que afectan la polimerización de ADN o los microtúbulos de las células de cáncer1. ADC primera generación aprobado por la Food and Drug Administration (FDA) se basan en la modificación de lisinas y cisteínas, que genera mezclas de moléculas modificadas en diferentes posiciones con propiedades farmacocinéticas disminución2. Por el contrario, la conjugación específica de fármacos para los anticuerpos puede generar compuestos con mejores índices terapéuticos3,4. Tratando de enfrentar el desafío de producir ADCs homogéneas, varias modificaciones químicas y enzimáticas selectivas han sido reportados1,5. Sin embargo, los métodos actuales pueden apuntar sólo cierta posición en el anticuerpo, sufren de expresión de la proteína baja, proporcionan a enlazadores con baja estabilidad o dependen de reacciones lentas y bajo rendimiento.
Incorporación de los aminoácidos no-canónico (ncAA) a través de la expansión del código genético permite la instalación site-specific de una plétora de grupos reactivos bioorthogonal en proteínas, potencialmente superar las limitaciones de otros métodos utilizados para generar ADCs. Codificación ncAAs en respuesta a un codón de destino (parada) se basa en pares de sintetasa/tRNA de aminoacyl-tRNA que son ortogonales a los pares endógenos que incorporan aminoácidos canónicos6. NcAAs varios se han incorporado en anticuerpos para generar ADCs. Sin embargo, más sufren diversos pasivos para aplicaciones en la conjugación de drogas terapéuticas. p-acetylphenylalanine (pAcF)7,8 no es totalmente bioorthogonal, requiere un pH bajo (4.5) y tiempos de reacción largos (> 60 h), mientras azides como p-azidophenylalanine (pAzF)7,9,10, p-azidomethylphenylalanine (revocación)11y un derivado de la azida de lisina (AzK)12,13 pueden ser reducida en la celda14, y el cobre utilizado para catalizar la actividad de Huisgen puede inducir daño oxidativo 15.
Aunque ncAAs alternativo basado en transporte-cyclooctene (TCO), cyclooctyne (SCO) y bicyclo [6.1.0] nonene (BCN) recientemente han sido codificados en un anticuerpo para los propósitos de la bio-proyección de imagen, el sistema de expresión sufre de rendimientos muy bajos (0,5 mg/L)16. Por otra parte, cyclooctenes y cyclooctynes son grandes y manijas hidrofóbicas que pueden aumentar la susceptibilidad de la ADC para cargas útiles -ADC de agregación son tradicionalmente hidrofóbicos y las propiedades fisicoquímicas de la máquina para hacer chorizos han demostrado mucho farmacocinética e índice terapéutico impacto17. Por el contrario, cyclopropenes 1,3-disubstitued son pequeños grupos reactivos que deben causar la mínima alteración en la proteína estructura y physichochemical propiedades18. Cyclopropenes selectivamente y rápidamente reaccionan con tetrazines a través de una de cicloadición de Diels-Alder de demanda electrónica inversa19. En el presente Protocolo hacemos uso de un derivado del cojinete de la lisina (CypK, Figura 1b) un cyclopropene de metilo que es menos afectada por impedimento estérico que ciclos insaturados filtrados más grandes y tiene una constante de velocidad de reacción en el orden 1-30 M-1s -1 en medio acuoso18,20.
Recientemente nos informó cómo incorporar CypK en anticuerpos para generar ADCs reaccionando este mango mínimo bioorthogonal con moléculas de tetrazina-cojinete21. Aquí describimos el procedimiento de preparación de ADC más detalladamente con énfasis en los pasos más difíciles. La incorporación de CypK se dirige con una pyrrolysyl-tRNA sintetasa (PylRS) / tRNACUA(PylT) par en respuesta a un codón ámbar introducido en la cadena pesada del anticuerpo (HC)22. Aquí utilizamos dos plásmidos para transfección transitoria (Figura 1a), codificación de la cadena pesada del anticuerpo y el otro codificación de la cadena ligera (LC), ambos que contienen el cassette de PylRS/PylT. Alternativamente, una línea celular estable que permite rendimientos más altos del anticuerpo puede ser generada a través de una más laborioso procedimiento21.
Los sistemas de la expresión anterior pueden producir la inmunoglobulina anti-HER2 terapéutico 1 (IgG1) trastuzumab con CypK en niveles similares a los anticuerpos de tipo salvaje. Seleccionamos la primera posición el dominio CH1 de la cadena pesada para codificar la ncAA (HC-118TAG). Este es el sitio más comúnmente modificado en ADCs23 y es conocida como HC-118 (enumeración de EU) pero también ha sido conocido como HC-121 (posición de la secuencia) y HC-114 (enumeración de Kabat)24. Desde esta posición se conserva a lo largo de los IgG1s, estos sistemas de expresión deben ser susceptibles a los anticuerpos más terapéuticos.
Mostramos trastuzumab(CypK)2 puede ser fácilmente purificado de proteína A seguido por cromatografía líquida rápida de proteínas con una columna de interacción hidrofóbica (HIC-FPLC). Posteriormente, el anticuerpo es covalente dentro de 3 h a la polimerización de microtúbulos inhibidor monometil auristatin E (MMAE), que se utiliza en el ADC Adcetris aprobados por la FDA. Aquí utilizamos un derivado bencílico tetrazina MMAE (tetrazina-vcMMAE) con un enlazador que comprende un espaciador glutarato y un componente lábil de proteasa valina-citrulina seguido de una unidad self-immolative p- aminobenzylalcohol; Este enlazador es dividido por la catepsina B en el lisosoma en la internalización de la ADC resultando en la liberación sin dejar huellas de la toxina25. Para demostrar la amplitud de la reacción, que el anticuerpo también está vinculado a la tetramethylrhodamine del fluoróforo (TAMRA). Explicamos cómo verificar la identidad del conjugado por cromatografía líquida acoplada a espectrometría de masas (LC-MS) y calcular la relación droga-anticuerpo (DAR) mediante cromatografía líquida de alto rendimiento con una columna de interacción hidrofóbica (HIC-HPLC) .
Como parte de la caracterización de la actuación de anticuerpos, se describe cómo comprobar la estabilidad de la articulación dihydropyridazine en suero humano. Este parámetro se evalúa más fácilmente en trastuzumab-TAMRA porque puede cuantificarse mediante un ELISA simple y no se complica la interpretación de los resultados por el componente lábil de la proteasa de trastuzumab(MMAE)2. Por último, la selectividad y la potencia de trastuzumab(MMAE)2 se evalúa comparando la citoxicidad de la ADC a través de las líneas celulares que expresan diferentes niveles de HER2. Este análisis también proporciona una prueba funcional de la estabilidad de la ADC cuando se realiza después de la incubación el immunoconjugate en suero humano.
Protocolo
1. producir y caracterizar el anticuerpo
- Expresan el anticuerpo
- Descongelar un vial de células HEK suspensión en un matraz de 250 mL que contenga 50 mL de medio de expresión con 100 unidades/mL de penicilina estreptomicina μg/mL 100 y 250 ng/mL anfotericina B. Mantenga las células a 37 ° C con 8% CO2 en humedecían incubadoras equipados con un agitador a 125 rpm. Dividir celdas a 0.3-0.5 x 106 células/mL (cada 2-3 días) por lo menos 2 veces antes de transferencia.
- Cuando una densidad de 2.5 x 106 células/mL se alcanzó (2-3 días después de partir), preparar una solución fresca de 100 mM CypK. Para ello, pesa 64 mg de CypK, añadir 2,5 mL de hidróxido de sodio 0,1, vortex, vuelta hacia abajo para recuperar partículas sin disolver todo y someter a ultrasonidos.
- Añadir 2,5 mL de CypK (100 mM de 0,1 M NaOH) 42,5 mL de medio de expresión suplementado con antibióticos. Mezclar bien, Añadir 250 μl de 0,1 M de HCl y esterilice usando un filtro de 0,22 μm.
- Diluir 50 μg de HC y cl pKym1 plásmidos21 2,5 ml con medio de suero reducido. En un tubo aparte, diluir 135 μl de reactivo de transfección a 2,5 mL con medio de suero reducido.
- Cinco minutos después de preparar las soluciones, mezclar la plásmidos y la solución de reactivo de transfección e incubar durante 20 min permitir la formación de complejos entre el ADN y el reactivo de transfección.
- Mientras tanto, centrifugar las células 125 millones en la densidad objetivo durante 5 minutos a 500 x g, suspender con el medio de expresión que contiene CypK y añadir la mezcla de reactivo de transfección – ADN. CypK puede ser comprado o sintetizado como divulgado previamente18.
- Después de incubar las células durante 20 h, Añadir 250 μl de potenciadores de reactivo de transfección incluido en el kit.
- Los anticuerpos de los flotantes 6-7 días después de la adición de CypK (cambio de medio no se requiere durante la expresión) de la cosecha.
* Por otra parte, para obtener rendimientos más altos y más coherentes, una línea celular estable puede generarse como se describe en Oller-Salvia et al. 201821. En este caso, trastuzumab(CypK)2 se expresa simplemente por la adición de CypK 5 mM en el medio de expresión.
- Purificar el anticuerpo
- Centrifugar las células durante 15 min a 3000 x g.
- Filtrar el sobrenadante con un 0.45 o un filtro de 0,22 μm. Si el filtro queda ocluido, reemplazarlo por uno nuevo y continuar filtrando. Si esto sucede después de sólo unos pocos mililitros, centrifugar el sobrenadante por un adicional 15 min a 7000 x g.
- Añadir resina de proteína A 2 mL/100 mL de sobrenadante en una columna de cromatografía vacía de polipropileno y equilibre la resina con al menos 5 volúmenes de tampón de lavado del grano (fosfato de sodio de 0,1 M, NaCl 150 mM).
- Dividir el sobrenadante en tubos cónicos de 50 mL dos y agregue 5 x de tampón de lavado del grano (fosfato de sodio de 0,5 M, 150 mM NaCl) seguido de la resina de A proteína previamente equilibrado. Coloque el tubo cónico en un rodillo de 3 h a temperatura ambiente para bajar los anticuerpos en el sobrenadante.
Como alternativa: Añadir el sobrenadante a la columna con al menos el doble del volumen recomendado de la resina y permite que fluya a través. Asegúrese de que no hay una cantidad importante de anticuerpos en el sobrenadante por SDS-PAGE. Si hay, eluir el sobrenadante a través de la resina una vez más. - Transferencia de resina de proteína con el sobrenadante en una columna y permitir que el líquido fluya a través.
- Añadir 25 mL de buffer (o volúmenes de resina por lo menos 10) y permitir que fluya a través.
- Procederá a la elución del anticuerpo con 4 mL de citrato de sodio de 0.1 M, pH 3, en 1 mL de tampón de fosfato de 1 M, 150 mM NaCl.
- Diluir el anticuerpo con 10 mL de PBS, concentrar a 0.5-1 mL de filtrado centrífugo y búfer de intercambio tres veces con PBS.
- Purificar las muestras por FPLC, usando una columna HIC de butilo con un flujo de 0,5 mL/min y 0-100% gradiente en 30 min de tampón baja en sal (50 mM fosfato de sodio de pH 7.0, 20% isopropanol) en buffer de alta sal (1,5 M (NH4)2SO4, 50 mM de fosfato sódico pH 7,0 isopropanol al 5%). Recoger todas aquellas fracciones y monitorear la elución a 280 nm. Pequeñas cantidades (< 1 mg) pueden ser purificadas con HIC HPLC bajo las condiciones descritas en el 2.4 para maximizar el rendimiento y pureza.
- Piscina las fracciones que contienen anticuerpos, diluir hasta por lo menos 4 mL con PBS, concentran de tampón centrífugo de filtración e intercambio tres veces con PBS.
- Cuantificar el anticuerpo
- Obtener una concentración aproximada mediante la medición de absorbancia a 280 nm usando un espectrofotómetro micro-volumen.
- Si una medición precisa es necesaria, utilice un kit de ELISA para medir IgGs humanas. Para un cálculo aproximado, utilice SDS-PAGE con una tinción de Coomassie como sigue:
- Preparar estándares diluyendo doble seis veces un estándar trastuzumab cuantificado por ELISA 1 mg/ml.
- Hervir los estándares y las muestras de aproximadamente 0.25 mg/ml en la reducción de buffer de carga.
- Ejecutar un Bis-Tris SDS-PAGE de 4-12% con buffer MES-SDS y tinción con un colorante de Coomassie-basado. Finalmente medir la densidad del color de la banda correspondiente a la luz o la cadena pesada con ImageJ e interpolar la señal de las muestras en la curva estándar.
- Tienda el anticuerpo a 4 ° C.
2. conjugado anticuerpo y caracterizar el ADC
- Conjugado de anticuerpo con la molécula de tetrazina-cojinete
- Diluir 10 equivalentes molares de tetrazina-vcMMAE (4 μL, 3,4 mM en dimetil sulfóxido (DMSO)) con 20 μl de acetonitrilo y 76 μl de PBS en un pequeño tubo cónico (por ejemplo,tubo de PCR).
- Agregar 1 equivalente molar de trastuzumab(CypK)2 (100 μl, 2 mg/mL en PBS), mezclar bien y dejar para reaccionar por 3 h a temperatura ambiente (25 ° C) para formar trastuzumab(MMAE)2.
Nota: Otras moléculas como la tetrazina-5-TAMRA pueden vincularse con el anticuerpo en vez de tetrazina-vcMMAE usando este protocolo.
- Purificar el ADC
- Pre-equilibrar una columna de tamaño exclusión centrifugado con PBS siguiendo las instrucciones del fabricante.
- Añadir todo el volumen de la reacción en la columna de spin y centrifugar a 1500 x g durante 1 minuto.
- El ADC de cuantificar y analizar el conjugado por SDS-PAGE
- Cuantificar al ADC como se describe en la 1.3.2. mediante la medición de la densidad del color de la cadena ligera en un SDS-PAGE utilizando el anticuerpo no modificados para la curva estándar.
- La cadena pesada debe han cambiado un poco mostrando un aumento en peso molecular sobre la conjugación.
Nota: Si el anticuerpo se modifica con un fluoróforo como en trastuzumab(TAMRA)2, sólo la banda correspondiente a la cadena pesada debe mostrar fluorescencia en gel antes de la tinción.
- Analizar el conjugado por HPLC-HIC
- Equilibrar la columna de HPLC-HIC con tampón de 100% A (1,5 M (NH4)2SO4, 50 mM de fosfato sódico pH 7,0, isopropanol al 5%) durante 5 minutos.
- Mix 15 μl (67 pmol) de una solución de 1 mg/mL de trastuzumab (CypK) 2 con 15 μl de 2 x del almacenador intermediario A en un frasco. Programa después de una inyección de 10 μL en el HPLC.
- Eluir en un flujo de 1 mL/min isocrática con 100% de tampón A durante 1 min seguido de un gradiente de 15 min desde 100 hasta 0% de tampón de A en B (50 mM fosfato de sodio pH 7.0, isopropanol 20%). Supervisar la elución a 280 nm.
- Calcular el DAR integrando el pico correspondiente a cada especie y utilizando las zonas resultantes de la siguiente ecuación:
DAR = (trastuzumab(MMAE) x 1 + 2 x trastuzumab(MMAE)2)
/(trastuzumab(MMAE)0 trastuzumab(MMAE)1 + trastuzumab(MMAE)2)
Tiempo de retención previsto para trastuzumab(CypK)2 es min 7.5-8.0, trastuzumab (CypK, MMAE) es 9.1 9.6 min, y para trastuzumab(MMAE)2 min 10.5-11.0.
- Analizar el conjugado por LC-MS
- Deglycosylate 30 μl de 1 mg/mL ADC y el anticuerpo sin modificar sin reducir las condiciones de uso de unidades de PNGase F 250 por menos de 6 h a 37 ° C.
- Procederá a la elución del anticuerpo en el espectrómetro de masas en un C4 1-5 μm 1.0 x 100 mm columna con un gradiente de 20 min de 2% a 80% de acetonitrilo en agua. Adquirir datos sobre una gama de m/z de 350-4000 en el modo de ion positivo con una tensión de cono de 150v.
- Deconvolucionar los datos crudos utilizando software apropiado. Calcular la diferencia de masa entre el modificado y los anticuerpos sin modificar.
3. Análisis de estabilidad de la vinculación de Dihydropyridazine en Trastuzumab(TAMRA)2 en suero
- Filtrar el suero utilizando un filtro de 0,22 μm en condiciones estériles. Puede añadir 100 unidades/mL de penicilina y estreptomicina 100 de μg/mL.
- Llenar los pozos externos de una placa de 96 pocillos con agua. En los pozos central, mezcla en triplicado 90 μl de suero filtrado con 10 μl de 1 mg/mL trastuzumab(TAMRA)2 en PBS a una concentración final de 0,1 mg/mL. Colocar la placa en una incubadora saturada de humedad a 37 ° C y 4-5% CO2.
- Cada 24 h durante 5 días, cada pipeta bien bien a la mezcla, tomar 5 μl alícuota, flash-congela con nitrógeno líquido y almacenar a-80 ° C.
- Una vez que todas las muestras han sido recogidas, descongelar las alícuotas y analizar utilizando un ELISA indirecto previamente divulgados12 con algunas modificaciones:
- Cubrir una placa de 96 pozos durante la noche con HER2 de 0.25 μg/mL a 4 ° C. Todos los demás pasos se realizan a temperatura ambiente.
- Al día siguiente, lavar 5 veces con PBS tween de 0,05% (PBS-T) y bloque con seroalbúmina bovina al 1% durante 1 hora.
- Lavar e incubar las muestras a 1:10000 dilución en PBS durante 2 h.
- De lavado e incubar un anticuerpo anti-TAMRA en ratón en dilución 1: 2000 en PBS-T con 0,5% BSA durante 1 hora.
- Lavado e incubar un anti-ratón HRP conjugadas 1: 1000 en PBS-T con 0,5% BSA durante 1 hora.
- Añadir TMB y dejar reaccionar 5-10 minutos.
- Detener la reacción con 50 μl de H2hasta4 M 1 y medir absorbancia a 450 nm. Restar el fondo midió a 570 nm.
- Ajustar una curva de regresión logística 4 parámetros a diluciones estándar e interpolar las mediciones de las muestras.
Nota: La estabilidad del trastuzumab(MMAE)2 podría evaluarse utilizando el mismo protocolo cambiando el ensayo descrito en 3.3 para un kit comercial de ELISA para medir la concentración de la ADC.
4. evaluar la citotoxicidad de la ADC
Nota: Este protocolo se basa en ensayos previamente divulgados23,26 con algunas modificaciones.
- Descongelar las células MCF-7 y SK-BR-3 y que puedan establecerse en p25 frascos que contienen el medio completo, es decir, DMEM suplementado con 10% de calor inactiva el suero bovino fetal, 100 unidades/mL de penicilina y 100 de μg/mL estreptomicina.
- Dividir celdas en 80-90% de confluencia (cada 3-4 días) al menos 2 veces antes del ensayo.
- Dos días antes de la prueba, llene el exteriores pocillos de una placa de 96 pocillos con agua. Luego levantar las células con 0.05% tripsina en 0,5 mM EDTA, centrifugar 3 minutos a 250 g de x, resuspender en medio de nuevas y semilla 3000 células en 100 μl por pocillo (vacío) en placas de 96 pocillos.
- Dos días después de la siembra de las células, preparar 10 diluciones seriadas de las muestras por triplicado con 0.1% de DMSO en medio completo. Considere los siguientes controles y muestras: trastuzumab(MMAE)2, trastuzumab(CypK)2, tipo salvaje de trastuzumab, tetrazina-vcMMAE y MMAE.
- Añada 100 μl de cada muestra en cada pocillo e incubar durante 5 días a 37 ° C y 4-5% CO2.
- El día 5, medir la viabilidad de las células. Para ello, utilice un kit comercial para lyse las células y medir el ATP liberado. Representar el porcentaje de señal con respecto a control las células tratadas con 0,1% de DMSO.
Nota: ADCs pueden incubar durante 5 días en el suero y repetir el ensayo de citotoxicidad probar estabilidad funcional.
PRECAUCIÓN: MMAE es altamente tóxico. Por lo tanto, utilizar guantes y gafas protectoras al manipular derivados MMAE. Si utilizas MMAE sin modificar como control en el experimento, al preparar la solución madre en DMSO, maneje el producto sólido dentro de una campana de humos.
Resultados
El sistema de expresión transitoria divulgado (Figura 1a) produce 22 ± 2 mg de trastuzumab(CypK)2 por litro de medio de cultivo, que representa 2/3 del tipo salvaje anticuerpo producido en las mismas condiciones (figura 1C). La línea celular estable puede incrementar este rendimiento hasta de 2 mg/L ± 3121.
Trastuzumab(CypK)2 puede ser conjugado con tetrazina-vcMMAE, que rinde casi homogénea trastuzumab(MMAE)2 a 3 h a 25 ° C (figura 2). La alta hidrofobicidad de esta citotoxina requiere adición de acetonitrilo 10% cuando 5 o más equivalentes molares de la toxina por CypK se utilizan. Por otra parte, la cicloadición se completa también dentro de las 20 h con 2 equivalentes de tetrazina-vcMMAE sin acetonitrilo (figura 2C). Trastuzumab(CypK)2 reacciona con tetrazina-TAMRA dentro de 2 h a 25 ° C y 3-6 h son necesarios cuando se disminuye la temperatura a 4 ° C (Figura 3C).
El DAR previsto para trastuzumab(MMAE)2 medido por HPLC-HIC es 1.9 (figura 2b). El pico observado inicialmente en el cromatograma a 8,0 min representa el anticuerpo no conjugado (DAR 0) y debe han desaparecido totalmente cuando la reacción se ha completado. Las especies con DAR 1 elutes 9.1 9.6 min y deben tener un área < 10% después de 3 horas; y el producto de destino con DAR 2 tiene un tiempo de retención de 10.5-11.0 con un área de espera > 90%. El turno de movilidad y fluorescencia en geles de SDS-PAGE confirma la incorporación de TAMRA (figura 3b) y la identidad de la immunoconjugates se verifica por LC-MS (Figura 2d-e y Figura 3d).
Incubación de trastuzumab(TAMRA)2 por 5 días en suero humano y posterior análisis por ELISA confirma que la carga permanece unida al anticuerpo (Figura 4b). Sobre el ensayo de citotoxicidad, trastuzumab(MMAE)2 muestra alta potencia en pecho SK-BR-3 (alta de HER2) las células de cáncer, con una media concentración eficaz máxima (EC50) de 55 ± 22:00 (figura 4 d). Trastuzumab(MMAE)2 mantiene la citotoxicidad tras 5 días de incubación en suero humano (figura 4 c). Por el contrario, cuando el ADC se analiza en MCF-7 (baja de HER2) EC50 es 200-fold inferior (figura 4 d). El anticuerpo de tipo salvaje, trastuzumab(CypK)2 y tetrazina-vcMMAE muestran toxicidad extremadamente baja (4e y 4 figuras d), mientras que MMAE muestra alta citotoxicidad no selectivo en ambas líneas celulares (Figura 4e).
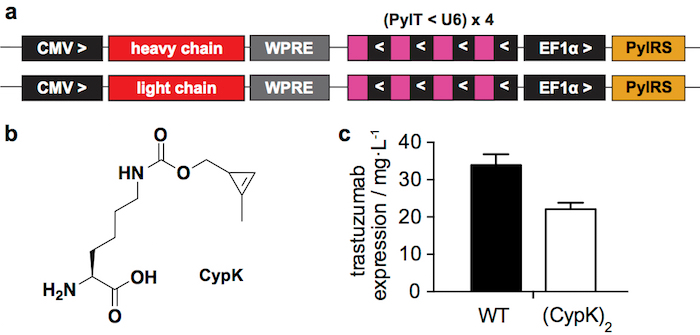
Figura 1: sistema de expresión transitoria. A. las regiones de la plásmidos utilizada para transitorios de la transfección en células HEK293. CMV: promotor citomegalovirus, WPRE: elemento regulador postranscripcional del Virus de la Hepatitis de la marmota, PylT: pyrrolysyl tRNA, U6: promotor específico, PylRS: pyrrolysil tRNA sintetasa, > y <: dirección de la transcripción. B. Nε-[((2-methylcycloprop-2-en-1-yl)methoxy)carbonyl]-L-lysine (CypK). C. expresión rendimientos de trastuzumab de tipo salvaje (WT) y trastuzumab(CypK)2 medida en un western blot después de proteína una purificación. Barras de error representan la desviación estándar de triplicados biológicas. Esta figura ha sido modificada con permiso de Oller-Salvia et al. 201821. Haga clic aquí para ver una versión más grande de esta figura.
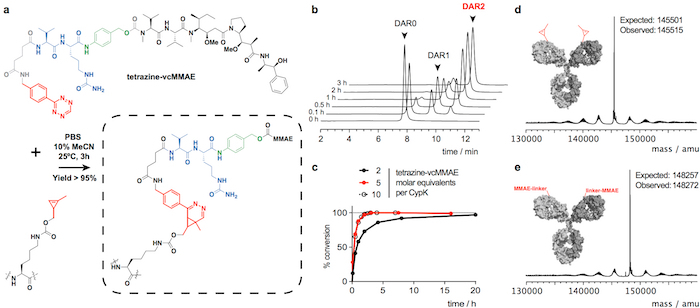
Figura 2: Conjugación de trastuzumab(CypK)2 con tetrazina-vcMMAE. A. inversa electrónica demanda cicloadición de Diels-Alder entre el residuo CypK en el anticuerpo y el derivado de tetrazina de MMAE. Los grupos de reacción están destacados en color rojo, p- aminobenzylalcohol se representa en verde y el dipéptido de valina-citrulina en azul. B. los cromatogramas HPLC-HIC que muestra el progreso de la conjugación del anticuerpo. C. grado de conversión con respecto a DAR máxima de 1.9 con concentraciones de reactivos diferentes. D-E. Espectros de masas deconvoluted de los anticuerpos de larga duración antes y después de la conjugación. Trastuzumab(CypK)2 se obtuvo utilizando la línea celular estable. Esta figura ha sido modificada con permiso de Oller-Salvia et al. 201821. Haga clic aquí para ver una versión más grande de esta figura.
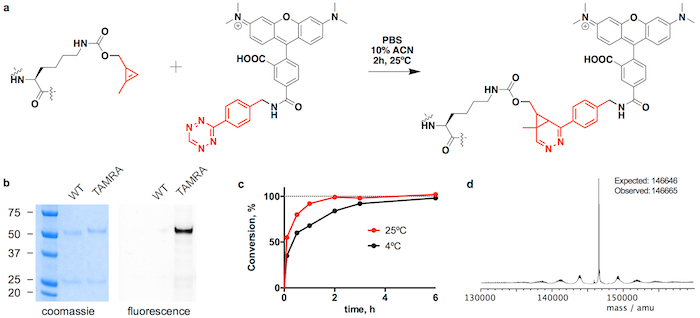
Figura 3: Conjugación de trastuzumab(CypK)2 con tetrazina-TAMRA. A. inversa electrónica demanda cicloadición de Diels-Alder entre el residuo CypK en el anticuerpo y el derivado de tetrazina de TAMRA. B. geles de SDS-PAGE que muestra el cambio de movilidad y la fluorescencia en gel que se originó por la conjugación de TAMRA. C. cinética verbal a dos temperaturas diferentes. D. espectro de masas de Deconvoluted de trastuzumab(TAMRA)2. Trastuzumab(CypK)2 se obtuvo utilizando la línea celular estable. Esta figura ha sido modificada con permiso de Oller-Salvia et al. 201821. Haga clic aquí para ver una versión más grande de esta figura.
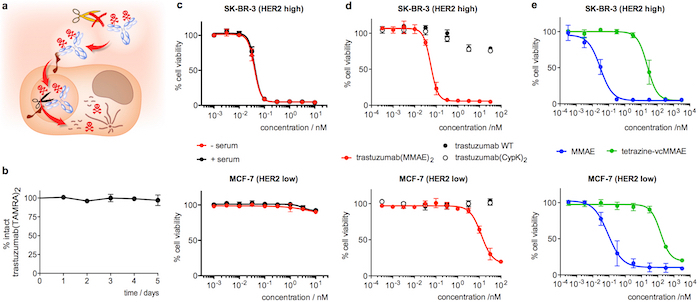
Figura 4: estabilidad en suero y la citotoxicidad de conjugados de trastuzumab. A. dibujos resaltando las características deseadas en un ADC de internalización. B. estabilidad de trastuzumab(TAMRA)2 en suero humano medida en ELISA. C. ensayo de viabilidad celular con trastuzumab(MMAE)2 después de 5 días en suero humano (+ suero, negro). Una muestra de control se incubaron en PBS en lugar del suero (-suero, rojo) se incluyó en el análisis del mismo. D. ensayo de viabilidad celular con muestras de anticuerpo recién diluido. E. ensayo de viabilidad celular con derivados MMAE recién diluidos. Barras de error representan el error estándar de la media de 3 experimentos independientes. Esta figura ha sido modificada con permiso de Oller-Salvia et al. 201821. Haga clic aquí para ver una versión más grande de esta figura.
Discusión
El procedimiento de expresión transitoria para producir trastuzumab(CypK)2 descrito en el presente Protocolo es simple y permite alta modularidad. Los rendimientos obtenidos están dentro de los esperado en un entorno académico27 y líneas celulares estables pueden generarse para potenciar aún más el rendimiento de producción21. Durante la expresión, las concentraciones de CypK inferiores a 5 mM puede resultar en menor incorporación de ncAA, y cantidades mayores pueden afectar crecimiento celular y disminuir la producción de anticuerpos. CypK como un aminoácido libre tiene solubilidad de agua baja, así deben ser primero disuelto en 100 mM de 0,1 M NaOH y luego se añadió al medio de cultivo. Después de diluir el CypK en el medio y antes de agregar a las células, es esencial para neutralizar el medio con ácido clorhídrico y el filtro para esterilizar. Posteriormente, utilizando los reactivos de transfección especificado en el presente Protocolo y siguiendo los tiempos de incubación recomendados por el fabricante es importante para una expresión de alto rendimiento. Para obtener más información sobre expresión transitoria de anticuerpos humanos, el lector es referido a otros protocolos publicados31,32.
Cuando el anticuerpo se purifica, un alto exceso de resina de proteína es necesario como se indica para anticuerpo completo desplegable desde el sobrenadante. Para prevenir la precipitación de trastuzumab durante la elución, es recomendable utilizar una solución con tampón de alta capacidad, diluir inmediatamente con PBS y el búfer de evitar una concentración excesiva de intercambio. Mantenga siempre el anticuerpo < 5 mg/mL.
La conjugación de trastuzumab(CypK)2 con tetrazina-vcMMAE es más rápida que la mayoría de las reacciones registrada con otras asas bioorthogonal para ADCs. Por otra parte, esta cycladdition se produce en condiciones muy suaves: temperatura ambiente o inferior y fisiológico pH. Es importante diluir las soluciones stock de DMSO de los reactantes con acetonitrilo antes de la adición de PBS y el anticuerpo; de lo contrario precipitará los tetrazina derivados. Acetonitrilo se requiere solamente debido a la alta hidrofobicidad de MMAE y TAMRA, pero menos moléculas hidrofóbicas no necesita la adición de un co-solvente. Alternativamente, puede ser conjugado tetrazina-vcMMAE sin acetonitrilo y solamente 2 equivalentes molares de tetrazina-vcMMAE dentro de las 20 h. Esta pequeña cantidad de la toxina podría implicar una disminución substancial en el costo de fabricación de ADC en comparación con las tecnologías actuales basadas en la ncAA. Trastuzumab(CypK)2 es totalmente reactivo durante al menos 4 meses cuando se conserva a 4 ° C.
HPLC-HIC permite una determinación exacta de DAR ya MMAE es altamente hidrofóbico y proporciona una excelente resolución de los picos correspondientes a los anticuerpos conjugados con toxinas de 0, 1 y 2. Tetrazina-vcMMAE elutes alrededor de 13,7 minutos y se detecta a 280 nm. Esta técnica requiere un material de partida de alta pureza. Por otra parte, no es recomendable para calmar la reacción con otras moléculas reactivas con tetrazina como BCN-OH ya que ellos pueden alterar los tiempos de retención y la forma de los picos. Es esencial que la concentración de sal de las muestras coincide con uno en la fase móvil en el comienzo del degradado para obtener una buena separación, especialmente si se inyecta más de 10-20 μl.
En relación con el análisis de LC-MS, deglycosylation de las muestras de anticuerpos es necesaria para obtener un solo pico en deconvolución del espectro crudo. La exactitud del anticuerpo total y masas de ADC puede variar dependiendo de la calibración del instrumento. Por lo tanto, para calcular la masa de la modificación, restar la masa obtenida de los anticuerpos no modificados del obtenido por el ADC. Modernos espectrómetros de masas de alta resolución deben proporcionar un error relativo debajo de 1:10000. Aunque LC-MS también puede utilizarse para calcular la relación entre las diferentes especies, este valor suele ser una sobrestimación porque la modificación puede afectar la capacidad de ionización de las especies generadas y no se pueden detectar pequeñas cantidades de impurezas.
La estabilidad de la máquina para hacer chorizos en ADCs es crítica debido a la liberación prematura del fármaco mayor toxicidad y menor eficacia; la citotoxina libre daña los tejidos sanos y el anticuerpo desnudo compite con el armado de los sitios de unión de destino de las células enfermas. Un lanzamiento por debajo del 5%, que está dentro de la variabilidad de la prueba de estabilidad, es de esperarse.
Por último, la selectividad de un ADC dirigida a HER2 como trastuzumab(MMAE)2 puede evaluarse mediante la comparación de la citotoxicidad en células de SK-BR-3 (alta de HER2) y células de MCF-7 (HER2 baja) desde el último expresan 15 dobleces menos receptores HER2 que el anterior28 . El immunoconjugate es que resulte en una viabilidad celular al menos 2 órdenes de magnitud menores en SK-BR-3 comparado con MCF-7. CE50 en SK-BR-3 debe estar en el rango nanomolar de dos dígitos que refleja la alta potencia de este ADC29,30. El anticuerpo sin modificar, trastuzumab(MMAE)2 o trastuzumab, no debe mostrar ninguna toxicidad en este ensayo. Tetrazina-vcMMAE debe tener un efecto de 3 órdenes de magnitud menor que la ADC desde el vinculador quita la actividad de la toxina de peptidomiméticos. Por el contrario, porque MMAE es capaz de penetrar la membrana de la célula30, debe tiene una toxicidad similar a la ADC pero no mostrar ninguna discriminación entre HER2 altas y líneas de celulares baja de HER2. Por otra parte, si este ensayo se realiza después de una incubación de 5 días de la ADC en suero, puede ser utilizado para proporcionar una prueba funcional de la estabilidad de la máquina para hacer chorizos: daría lugar una liberación de la toxina en cualquiera una disminución en la eficiencia de la ADC en SK-BR-3 si MMAE fue liberado p arte de la máquina para hacer chorizos o una disminución en la selectividad si el vinculador fue hendido de manera sin dejar huellas.
La tecnología ADC descrita permite la incorporación eficiente y específica de un derivado del cyclopropene de lisina en IgG1s. Después de una purificación fácil, anticuerpos pueden ser rápidamente conjugados con moléculas que contienen la tetrazina, obtención de productos homogéneos. Debido al pequeño tamaño y alta reactividad del cyclopropene mango mínimo, este método debería permitir la conjugación de cargas sterically obstaculizados. El immunoconjugates resultantes es estables en suero y son muy potentes y selectivos. En general, CypK permite un acoplamiento de bioorthogonal rápida, específica y estable de anticuerpos y otras proteínas conjugados para usarse en terapia o en diagnóstico.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Este trabajo fue financiado por el Medical Research Council, UK. S. B.O. es una beca de la EMBO (P.E.N. 158-2016) y a H. Pelham y J.W. barbilla para apoyo y G. Kym, C. W. Morgan y O. Perisic por ayuda y Consejo.
Materiales
| Name | Company | Catalog Number | Comments |
| Expi293F | ThermoFisher Scientific | A14527 | HEK suspension cells |
| Expi293 Expression Medium | ThermoFisher Scientific | A1435101 | Expression medium |
| Antibiotic-antimycotic | ThermoFisher Scientific | 15240062 | Penicillin-streptomycin-amphotericin B |
| 125mL Polycarbonate Erlenmeyer Flask with Vent Cap | Corning | 431143 | Shake flasks |
| Brunswick S41i incubator | Eppendorf | S41I230011 | CO2 incubator with a shaker |
| Sodium hydroxide 4 mol/l (4 N) in aqueous solution | VWR | 191373M | |
| Cyclopropene lysine | Sichem | SC-8017 | In this study it was synthesized as described by Elliot et al. 2014 |
| Steriflip-GP, 0.22 µm, polyethersulfone, gamma irradiated | Merck Millipore | SCGP00525 | |
| Opti-MEM, Reduced Serum Medium | ThermoFisher Scientific | 31985070 | Reduced serum medium |
| ExpiFectamine 293 Transfection Kit | ThermoFisher Scientific | A14525 | Transfection reagent |
| 5810 R centrifuge | Eppendorf | 5811000460 | |
| Millex-GP Syringe Filter Unit, 0.22 µm, polyethersulfone, 33 mm, gamma sterilized | Merck Millipore | SLGP033RS | |
| Protein A resin | Sino Biological | 10600-P07E-RN-25 | |
| Poly-Prep Chromatography Columns, Pkg of 50 | Bio-Rad | 7311550 | Polypropylene chromatography column |
| Econo-Column Funnel | Bio-Rad | 7310003 | |
| Sodium citrate | Fluka | 71635 | |
| ÄKTA explorer FPLC | GE Healthcare | ||
| HiTrap HIC Selection Kit | GE Healthcare | 28-4110-07 | Includes HiTrap 1 mL Butyl HP |
| Ammonium sulfate | VWR | 2133.296 | |
| Isopropanol | Honywell | 34863-2.5L | |
| Dymethyl sulfoxide | Sigma-Aldrich | D8418-50ML | |
| Tetrazine-vcMMAE | ChemPartner | - | Costum synthesized |
| Tetrazine-5-TAMRA | Jena Bioscience | CLK-017-05 | |
| NuPAGE 4-12% Bis-Tris Gel 1.0mm x 10 well | ThermoFisherScientific | NP0321BOX | |
| Xcell SureLock Mini-Cell | ThermoFisherScientific | EI0001 | |
| UltiMate 3000 HPLC | ThermoFisherScientific | ||
| Thermo Scientific MAbPac, HIC-20, 4.6 x 100 mm, 5 µm | ThermoFisherScientific | 088553 | |
| PNGase F | New England BioLabs | P0704S | |
| NanoAcquity | Waters | ||
| C4 BEH 1-5 µm 1.0 x 100 mm UPLC column | Waters | ||
| 96-well microplates for cell culture | ThermoFisherScientific | 156545 | |
| Human serum | Sigma-Aldrich | H4522-20mL | |
| CO2 incubator | Panasonic | ||
| HER2 ECD | Sino Biological | 10004-HCCH | |
| Anti-TAMRA | Abcam | an171120 | |
| Anti-mouse HRP | Santa Cruz | sc-2005 | |
| TMB | BioLengend | 421101 | |
| Sulfuric acid | Sigma-Aldrich | 84727-500ML | |
| PHERAstar FS | BMG Labtech | Plate reader | |
| DMEM | Sigma-Aldrich | D5671-500ML | |
| SK-BR-3 | ATCC | HTB-30 | |
| MCF-7 | ATCC | HTB-22 | |
| CellTiterGlo 2.0 Assay | Promega | G9242 | Cell viability assay based on the measurement of ATP released after cell lysis. The output signal is luminscence. |
| Monomethyl Auristatin E | Cayman Chemical | 16267 | |
| NanoDrop 2000 | ThermoFisherScientific | Microvolume spectrophotometer | |
| Human IgG ELISA Quantificaiton Set | Bethyl | E80-104 | |
| MaxEnt1 in MassLynx | Waters | Software application for mass spectrum deconvolution | |
| IntantBlue | Expedeon | ISB1L | Coomassie-based stain |
| Intact MMAE-ADC ELISA Kit (Sandwich Assay) | Epitope Diagnostics, Inc. | KTR 782 | |
| Tube 50 mL, 114x28mm, PP | Sarstedt | 62.547.254 | Conical tube |
| Amicon Ultra-15 Centrifugal Filter Units 50,000 NMWL | Merck | UFC905024 | Centrifugal filtration concentrator (after protein A pull down) |
| Amicon Ultra-4 Centrifugal Filter Units 50,000 NMWL | Merck | UFC805024 | Centrifugal filtration concentrators (after FPLC or HPLC purification) |
| Zeba Spin Desalting Columns, 7K MWCO, 0.5 mL | ThermoFisherScientific | 89882 | Size exclusion spin columns |
| Tube PCR 0.2ml Flat Cap | Thistle Scientific Ltd | AX-PCR-02-C-CS | PCR tubes |
| Nunc MaxiSorpª flat-bottom | ThermoFisherScientific | 44-2404-21 | Plates for ELISA |
Referencias
- Beck, A., Goetsch, L., Dumontet, C., Corvaia, N. Strategies and challenges for the next generation of antibody-drug conjugates. Nature Reviews Drug Discovery. 16 (5), 315-337 (2017).
- Wakankar, A. A., et al. Physicochemical Stability of the Antibody−Drug Conjugate Trastuzumab-DM1: Changes due to Modification and Conjugation Processes. Bioconjugate Chemistry. 21 (9), 1588-1595 (2010).
- Stan, A. C., Radu, D. L., Casares, S., Bona, C. A., Brumeanu, T. -. D. Antineoplastic Efficacy of Doxorubicin Enzymatically Assembled on Galactose Residues of a Monoclonal Antibody Specific for the Carcinoembryonic Antigen. Cancer Research. 59 (1), 115-121 (1999).
- Hamblett, K. J., et al. Effects of Drug Loading on the Antitumor Activity of a Monoclonal Antibody Drug Conjugate. Clinical Cancer Research. 10 (20), 7063-7070 (2004).
- Chari, R. V. J., Miller, M. L., Widdison, W. C. Antibody-Drug Conjugates: An Emerging Concept in Cancer Therapy. Angewandte Chemie International Edition. 53 (15), 3796-3827 (2014).
- Chin, J. W. Expanding and Reprogramming the Genetic Code. Nature. 550 (7674), 53-60 (2017).
- Axup, J. Y., et al. Synthesis of Site-Specific Antibody-Drug Conjugates Using Unnatural Amino Acids. Proceedings of the National Academy of Sciences of the United States of America. 109 (40), 16101-16106 (2012).
- Hallam, T. J., Wold, E., Wahl, A., Smider, V. V. Antibody Conjugates with Unnatural Amino Acids. Molecular Pharmaceutics. 12 (6), 1848-1862 (2015).
- Tian, F., et al. A General Approach to Site-Specific Antibody Drug Conjugates. Proceedings of the National Academy of Sciences of the United States of America. 111 (5), 1766-1771 (2014).
- Kern, J. C., et al. Discovery of Pyrophosphate Diesters as Tunable, Soluble, and Bioorthogonal Linkers for Site-Specific Antibody-Drug Conjugates. Journal of the American Chemical Society. 138 (4), 1430-1445 (2016).
- Zimmerman, E. S., et al. Production of Site-Specific Antibody-Drug Conjugates Using Optimized Non-Natural Amino Acids in a Cell-Free Expression System. Bioconjugate Chemistry. 25 (2), 351-361 (2014).
- VanBrunt, M. P., et al. Genetically Encoded Azide Containing Amino Acid in Mammalian Cells Enables Site-Specific Antibody-Drug Conjugates Using Click Cycloaddition Chemistry. Bioconjugate Chemistry. 26 (11), 2249-2260 (2015).
- Xiao, H., et al. Genetic Incorporation of Multiple Unnatural Amino Acids into Proteins in Mammalian Cells. Angewandte Chemie International Edition. 52 (52), 14080-14083 (2013).
- Milles, S., et al. Click Strategies for Single-Molecule Protein Fluorescence. Journal of the American Chemical Society. 134 (11), 5187-5195 (2012).
- Lallana, E., Riguera, R., Fernandez-Megia, E. Reliable and Efficient Procedures for the Conjugation of Biomolecules through Huisgen Azide-Alkyne Cycloadditions. Angewandte Chemie International Edition. 50 (38), 8794-8804 (2011).
- Koehler, C., et al. Genetic Code Expansion for Multiprotein Complex Engineering. Nature Methods. 13 (12), 997-1000 (2016).
- Lyon, R. P., et al. Reducing Hydrophobicity of Homogeneous Antibody-Drug Conjugates Improves Pharmacokinetics and Therapeutic Index. Nature Biotechnology. 33 (7), 733-735 (2015).
- Elliott, T. S., et al. Proteome Labeling and Protein Identification in Specific Tissues and at Specific Developmental Stages in an Animal. Nature Biotechnology. 32, 465-472 (2014).
- Ravasco, J. M. J. M., Monteiro, C. M., Trindade, A. F. Cyclopropenes: A New Tool for the Study of Biological Systems. Organic Chemistry Frontiers. 4 (6), 1167-1198 (2017).
- Yang, J., Šečkutė, J., Cole, C. M., Devaraj, N. K. Live-Cell Imaging of Cyclopropene Tags with Fluorogenic Tetrazine Cycloadditions. Angewandte Chemie International Edition. 124 (30), 7594-7597 (2012).
- Oller-Salvia, B., Kym, G., Chin, J. W. Rapid and Efficient Generation of Stable Antibody-Drug Conjugates via an Encoded Cyclopropene and an Inverse-Electron-Demand Diels-Alder Reaction. Angewandte Chemie International Edition. 57, 2831-2834 (2018).
- Schmied, W. H., Elsässer, S. J., Uttamapinant, C., Chin, J. W. Efficient Multisite Unnatural Amino Acid Incorporation in Mammalian Cells via Optimized Pyrrolysyl tRNA Synthetase/tRNA Expression and Engineered eRF1. Journal of the American Chemical Society. 136 (44), 15577-15583 (2014).
- Junutula, J. R., et al. Site-Specific Conjugation of a Cytotoxic Drug to an Antibody Improves the Therapeutic Index. Nature Biotechnology. 26 (8), 925-932 (2008).
- Junutula, J. R., et al. Rapid Identification of Reactive Cysteine Residues for Site-Specific Labeling of Antibody-Fabs. Journal of Immunological Methods. 332 (1), 41-52 (2008).
- Doronina, S. O., et al. Development of potent monoclonal antibody auristatin conjugates for cancer therapy. Nature Biotechnology. 21 (7), 778-784 (2003).
- Shiraishi, Y., et al. Identification of Highly Reactive Cysteine Residues at Less Exposed Positions in the Fab Constant Region for Site-Specific Conjugation. Bioconjugate Chemistry. 26 (6), 1032-1040 (2015).
- Sabourin, M., et al. Increasing Antibody Yield and Modulating Final Product Quality using the Freedom(TM). CHO-S(TM) Production Platform. BMC Proceedings. 5 (8), 102 (2011).
- Xiao, Y., Gao, X., Maragh, S., Telford, W. G., Tona, A. Cell Lines as Candidate Reference Materials for Quality Control of ERBB2 Amplification and Expression Assays in Breast Cancer. Clinical Chemistry. 55 (7), 1307-1315 (2009).
- Shinmi, D., et al. One-Step Conjugation Method for Site-Specific Antibody-Drug Conjugates through Reactive Cysteine-Engineered Antibodies. Bioconjugate Chemistry. 27 (5), 1324-1331 (2016).
- Badescu, G., et al. Bridging Disulfides for Stable and Defined Antibody Drug Conjugates. Bioconjugate Chemistry. 25 (6), 1124-1136 (2014).
- Vazquez-Lombardi, R., et al. Transient expression of human antibodies in mammalian cells. Nature Protocols. 13 (1), 99-117 (2018).
- Baldi, L., Hacker, D. L., Meerschman, C., Wurm, F. M., Hartley, J. L. . Protein Expression in Mammalian Cells: Methods and Protocols. , 13-26 (2012).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados