Method Article
Codificação genética de um aminoácido não-canônicos para a geração de anticorpos-droga conjuga através de uma reação rápida opaco
Neste Artigo
Resumo
Incorporando um derivado do ciclopropeno de lisina em anticorpos permite a ligação de site-specific, rápida e eficiente de moléculas de tetrazine-rolamento para gerar o cojugado anticorpo-droga.
Resumo
Conjugados de anticorpo-drogas (ADCs) usados hoje em dia na prática clínica são misturas de moléculas de anticorpo, ligadas a um número variável de toxinas em posições diferentes. Estudos pré-clínicos têm demonstrado que o índice terapêutico destes ADCs tradicionais pode ser melhorado pela União site-specific de toxinas. No entanto, as abordagens atuais para produzir ADCs homogêneas tem várias limitações, tais como expressão de baixa proteína e cinética de reação lenta. Neste protocolo, descrevemos como configurar um sistema de expressão para incorporar um derivado do ciclopropeno de lisina (CypK) anticorpos usando expansão de código genético. Esse identificador opaco mínima permite rápida conjugação de derivados de tetrazine através de uma cicloadição de Diels-Alder de demanda inversa. O sistema de expressão aqui relatado permite a fácil produção e purificação de Trastuzumabe tendo CypK em cada uma das cadeias pesadas. Vamos explicar como Hiperligação a toxina monometílico auristatin E o anticorpo e caracterizar o immunoconjugate por cromatografia de interação hidrofóbica e espectrometria de massa. Finalmente, descrevemos os ensaios para avaliar a estabilidade no soro humano da ligação dihydropyridazine resultantes da conjugação e testar a citotoxicidade seletiva da ADC para células de câncer de mama com altos níveis do receptor HER2.
Introdução
Anticorpo-droga o cojugado (ADCs) combina a seletividade de biotherapeutics e a potência de pequenas moléculas citotóxicas. A maioria dos ADCs visam diminuir os efeitos colaterais da quimioterapia tradicional pela segmentação de drogas que afetam a polimerização do DNA ou do microtubule para câncer células1. Primeira geração ADCs aprovados pela Food and Drug Administration (FDA) contam com a modificação de lisinas e cisteínas, que gera as misturas de moléculas modificadas em posições diferentes, com propriedades farmacocinéticas diminuiu2. Por outro lado, site-specific conjugação de drogas para os anticorpos pode gerar compostos com melhoria terapêutica indeces3,4. Buscando enfrentar o desafio de produzir ADCs homogêneas, várias modificações químicas e enzimáticas selectivas têm sido relatados1,5. No entanto, métodos atuais podem apenas determinada posição no anticorpo do alvo, sofrem de expressão da proteína baixa, fornecer linkers com baixa estabilidade ou dependem de reações lentas e baixo rendimento.
Incorporação de aminoácidos não-canônicos (ncAA) através do código genético de expansão permite a instalação site-specific de uma infinidade de grupos reativos opaco nas proteínas, potencialmente, superando as limitações dos outros métodos utilizados para gerar ADCs. Codificação ncAAs em resposta a um codão de alvo (paragem) baseia-se em pares de aminoacil-tRNA sintetase/tRNA que são ortogonais para os pares endógenos que incorporam aminoácidos canônico6. Foram incorporadas ncAAs vários anticorpos para gerar ADCs. No entanto, mais sofrem de vários passivos para aplicações em conjugação de drogas terapêuticas. p-acetylphenylalanine (pAcF)7,8 não é totalmente opaco, requer baixo pH (4.5) e longos tempos de reação (> 60 h), enquanto azidas tais como p-azidophenylalanine (pAzF)7,9,10, p-azidomethylphenylalanine (pAMF)11e um derivado azida de lisina (AzK)12,13 podem ser reduzido na célula14, e o cobre usado para catalisar Huisgen cicloadições pode induzir danos oxidativos 15.
Embora ncAAs alternativo baseado na trans-cyclooctene (TCO), cyclooctyne (SCO) e biciclo [6.1.0] Noneno (BCN) recentemente têm sido codificados em um anticorpo para fins de bio-imagem, o sistema de expressão sofre de muito baixo rendimento (0,5 mg/L)16. Além disso, cyclooctenes e cyclooctynes são grandes e alças hidrofóbicas que podem aumentar a susceptibilidade do ADC para cargas de agregação -ADC são tradicionalmente hidrofóbicas e as propriedades físico-químicas do vinculador têm se mostrado extremamente impacto da farmacocinética e índice terapêutico17. Por outro lado, 1,3-disubstitued Ciclopropenos são pequenos grupos reativos que devem causar mínima alteração na proteína estrutura e physichochemical propriedades18. Ciclopropenos seletivamente e rapidamente reagem com tetrazines através de um elétron-demanda inversa Diels-Alder cicloadição19. Neste protocolo, fazemos uso de um derivado do rolamento de lisina (CypK, Figura 1b), um metil-ciclopropeno é menor que afetou estérico de maiores ciclos insaturados tensas e tem uma constante de velocidade de reação na ordem de 1 a 30 M-1s -1 em meios aquosos18,20.
Nós recentemente relatou como incorporar CypK em anticorpos para gerar ADCs por reagir a esse identificador opaco mínima com moléculas de tetrazine-rolamento21. Aqui descrevemos o procedimento de preparação de ADC mais detalhadamente, com destaque para as etapas mais desafiadoras. Destina-se a incorporação de CypK usando um pyrrolysyl-tRNA sintetase (PylRS) / par de tRNACUA(PylT) em resposta a um códon âmbar introduzido na cadeia pesada de anticorpo (HC)22. Aqui nós usamos dois plasmídeos para transfecção transiente (Figura 1a), uma cadeia pesada do anticorpo de codificação e a outra codificação a cadeia leve (LC), ambos contendo a gaveta de PylRS/PylT. Alternativamente, uma linha de celular estável que permite rendimentos mais elevados de anticorpos pode ser gerada através de um de procedimento mais trabalhoso21.
Os sistemas de expressão acima mencionado podem produzir imunoglobulina a terapêutica anti-HER2 1 (IgG1) trastuzumab com CypK a níveis semelhantes ao anticorpo tipo selvagem. Nós selecionamos a primeira posição do domínio CH1 da cadeia pesada para codificar a ncAA (HC-118TAG). Este é o local mais comumente modificado na ADCs23 e é conhecido como HC-118 (numeração EU) mas também tem sido referido como HC-121 (posição de sequência) e HC-114 (Kabat numeração)24. Desde que esta posição é conservada ao longo de todos os IgG1s, estes sistemas de expressão devem ser passíveis de anticorpos terapêuticos mais.
Mostramos que trastuzumab(CypK)2 pode ser facilmente purificada pela proteína um seguido por cromatografia líquida de proteína rápida com uma coluna de interação hidrofóbica (FPLC-HIC). Posteriormente o anticorpo é covalentemente ligado dentro de 3 h para o microtubule polimerização inibidor monometílico auristatin E (MMAE), que é usado na ADC Adcetris aprovado pela FDA. Aqui usamos um derivado de benzil-tetrazine do MMAE (tetrazine-vcMMAE) com um vinculador compreendendo um espaçador de glutarato e um componente de protease-labile valina-citrulina, seguido por uma unidade de self-immolative p- aminobenzylalcohol; o vinculador é clivado pela catepsina B na lisossoma mediante a internalização da ADC resultando na liberação de toxina25traceless. A fim de mostrar o amplo escopo da reação, que o anticorpo está também relacionado com o fluoróforo diversos (TAMRA). Vamos explicar como verificar a identidade do conjugado por cromatografia líquida acoplada a espectrometria de massas (LC-MS) e para calcular a proporção de droga-para-anticorpo (DAR) usando cromatografia líquida de alta performance com uma coluna de interação hidrofóbica (HPLC-HIC) .
Como parte da caracterização de desempenho do anticorpo, descrevemos como testar a estabilidade da ligação dihydropyridazine no soro humano. Este parâmetro é mais facilmente avaliado em trastuzumab-TAMRA porque isso pode ser quantificado por um simples ELISA e a interpretação dos resultados não é complicada pelo componente lábil de protease trastuzumab(MMAE)2. Finalmente, a seletividade e potência de trastuzumab(MMAE)2 é avaliada comparando a citotoxicidade da ADC em linhagens celulares expressando diferentes níveis de HER2. Este ensaio também fornece uma prova funcional da estabilidade da ADC quando realizada após incubação a immunoconjugate no soro humano.
Protocolo
1. produzir e caracterizar o anticorpo
- Expressar o anticorpo
- Descongelar um frasco de células de suspensão HEK em um balão de 250 mL contendo 50 mL de meio de expressão suplementado com 100 penicilina unidades/mL, 100 µ g/mL Estreptomicina e 250 ng/mL anfotericina B. Keep as células a 37 ° C, com 8% de CO2 em humedecidas incubadoras equipadas com um misturador a 125 rpm. Dividir células a 0,3-0,5 x 106 células/mL (a cada 2-3 dias) pelo menos 2 vezes antes de transfecting.
- Quando uma densidade de 2,5 x 106 células/mL é atingidos (2-3 dias após a divisão), preparar uma solução fresca de 100 mM CypK. Para este efeito, pesar 64 mg de CypK, adicione 2,5 mL de hidróxido de sódio 0,1, vórtice, rotação para baixo para recuperar partículas tudo não dissolvidas e proceda à sonicação.
- Adicione 2,5 mL de CypK (100 mM em 0.1 M NaOH) para 42,5 mL de meio de expressão suplementado com antibióticos. Misturar bem, adicionar 250 µ l de 0.1 M HCl e esterilizar usando um filtro de 0,22 µm.
- Dilua 50 µ g de HC e LC pKym1 plasmídeos21 para 2,5 mL com médio reduzido de soro. Em um tubo separado, dilua 135 µ l de reagente de Transfeccao para 2,5 mL com médio reduzido de soro.
- Cinco minutos depois de preparar as soluções, misture o plasmídeo e a solução de reagente de transfeccao e incube por 20 min permitir a formação de complexos entre o ADN e o reagente de transfeccao.
- Entretanto, centrifugue 125 milhões de células para a densidade do alvo durante 5 min à 500g x, resuspenda com o meio de expressão contendo CypK e adicione a mistura de reagente de transfeccao – DNA. CypK pode ser comprado ou sintetizado, conforme relatado anteriormente,18.
- Após incubação de células para 20 h, adicione 250 µ l de potenciadores de reagente de transfeccao incluído no kit.
- Colheita de anticorpos a partir do sobrenadante 6-7 dias após a adição de CypK (sem alteração do meio é necessária durante a expressão).
* Como alternativa, para obter rendimentos mais elevados e mais consistentes, uma linhagem de células estável pode ser gerada como descrito em Oller-Salvia et al 2018.21. Neste caso, trastuzumab(CypK)2 é expresso simplesmente pela adição de CypK 5 mM no meio de expressão.
- Purificar o anticorpo
- Centrifugar as células durante 15 minutos a 3000 x g.
- Filtre o sobrenadante com um 0.45 ou um filtro de 0,22 µm. Se o filtro se torna obstruído, substituí-lo por um novo e continuar filtrando. Se isso acontecer depois de apenas alguns mililitros, centrifugar o sobrenadante para um adicional 15 min a 7000 x g.
- Adicione resina A de proteína (2 mL/100 mL do sobrenadante) em uma coluna de cromatografia de polipropileno vazio e equilibrar a resina com pelo menos 5 volumes de tampão de lavagem do grânulo (fosfato de sódio 0,1 M, 150 mM NaCl).
- Dividir o sobrenadante em dois tubos cônicos de 50 mL e adicionar 5 x tampão de lavagem do grânulo (fosfato de sódio 0,5 M, 150 mM NaCl) seguido pela resina A proteína pre-equilibrado. Coloque o tubo cônico em um rolo de 3 h à temperatura ambiente a puxar para baixo o anticorpo no sobrenadante.
Como alternativa: Adicione o sobrenadante na coluna pelo menos o dobro do volume recomendado de resina e permitir que flua. Certifique-se que não há uma quantidade significativa de anticorpo esquerda no sobrenadante por SDS-PAGE. Se houver, Eluir o sobrenadante com a resina mais uma vez. - Transferir proteína A resina com o sobrenadante uma coluna e permitir que o líquido flua.
- Adicionar 25 mL de tampão de lavagem (ou resina pelo menos 10 volumes) e permitir que flua.
- Eluir o anticorpo com 4 mL de citrato de sódio 0,1 M, pH 3, em 1 mL de tampão fosfato de 1 M, 150 mM de NaCl.
- Diluir o anticorpo com 10 mL de PBS, concentre-se para 0,5-1 mL por filtragem centrífuga e buffer de troca três vezes com PBS.
- Purificar as amostras por FPLC usando uma coluna HIC butil com um fluxo de 0,5 mL/min e um 0-100% gradiente em 30 min de buffer de baixo teor de sal (50 mM de fosfato de sódio pH 7,0, 20% isopropanol) no buffer de elevado-sal (1,5 M (NH4)2SO4, 50mm fosfato de sódio pH 7,0 5% isopropanol). Recolher todas as frações e monitorar a eluição em 280 nm. Pequenas quantidades (< 1 mg) podem ser purificadas com HPLC-HIC, nas condições descritas no ponto 2.4 para maximizar o rendimento e pureza.
- Piscina as frações que contêm anticorpos, diluí-los a pelo menos 4 mL com PBS, concentração-las pelo buffer centrífuga de filtração e troca três vezes com PBS.
- Quantificar o anticorpo
- Obter uma concentração aproximada, medindo a absorbância em 280 nm, utilizando um Espectrofotômetro de micro-volume.
- Se uma medida exata for necessária, use um kit de ELISA para medir IgGs humana. Para uma estimativa aproximada, use SDS-PAGE com uma mancha de Coomassie-baseado como segue:
- Prepare padrões diluindo duplo seis vezes, um padrão de Trastuzumabe quantificado por ELISA a 1 mg/mL.
- Ferva as normas e as amostras em aproximadamente 0,25 mg/mL na redução do amortecedor do carregamento.
- Executá-los em um usando o Bis-Tris SDS-PAGE 4-12% MES-SDS buffer e mancha com um corante Coomassie-baseado. Finalmente, medir a densidade de cor da banda correspondente a luz ou a cadeia pesada usando o ImageJ e interpolar o sinal das amostras na curva padrão.
- Armazenar o anticorpo a 4 ° C.
2. conjugado anticorpo e caracterizar o ADC
- Conjugar o anticorpo com a molécula de tetrazine-rolamento
- Dilua 10 molares equivalentes de tetrazine-vcMMAE (4 µ l, dimetilsulfóxido (DMSO) 3,4 mM) com 20 µ l de acetonitrilo e 76 µ l de PBS em um pequeno tubo cónico (por exemplo,tubo PCR).
- Adicionar 1 molar equivalente de trastuzumab(CypK)2 (100 µ l, 2 mg/mL em PBS), homogeneizar e deixar reagir durante 3 h à temperatura ambiente (25 ° C) para formar o trastuzumab(MMAE)2.
Nota: Outras moléculas tais como tetrazine-5-TAMRA podem ser vinculadas ao anticorpo em vez de tetrazine-vcMMAE usando este protocolo.
- Purificar o ADC
- Pre-equilibrar uma coluna de rotação de exclusão de tamanho com PBS, seguindo as instruções do fabricante.
- Adicione todo o volume da reação na coluna de rotação e centrifugar a 1500 x g por 1 min.
- Quantificar o ADC e analisar o conjugado por SDS-PAGE
- Quantificar o ADC, conforme descrito em 1.3.2. medindo a densidade de cor da cadeia de luz em um SDS-PAGE usando o anticorpo não modificado para a curva padrão.
- A cadeia pesada deve ter levemente deslocada mostrando um aumento no peso molecular sobre a conjugação.
Nota: Se o anticorpo é modificado com um fluoróforo como na trastuzumab(TAMRA)2, apenas a banda correspondente à cadeia pesada deve mostrar fluorescência em-gel antes de coloração.
- Analisar o conjugado por HPLC-HIC
- Equilibrar a coluna de HPLC-HIC com tampão 100% A (1,5 M (NH4)2SO4, 50mm fosfato de sódio pH 7,0, 5% isopropanol) por 5 min.
- Mix 15 µ l (67 pmol) de uma solução de 1 mg/mL de trastuzumab (CypK) 2 com 15 µ l de 2x buffer A em um frasco. Em seguida, uma injeção de 10 µ l na HPLC programa.
- Eluir em um fluxo de 1 mL/min isocrática com tampão de 100% A por 1 min, seguido por um gradiente de 15 min de 100 a 0% de tampão A em B (50 mM de fosfato de sódio pH 7,0, 20% isopropanol). Monitorar a eluição em 280 nm.
- Calcule o DAR ao integrar o pico correspondente a cada espécie e usando as áreas resultantes na seguinte equação:
DAR = (1 x trastuzumab(MMAE) + 2 x trastuzumab(MMAE)2)
/(trastuzumab(MMAE)0 + trastuzumab(MMAE)1 + trastuzumab(MMAE)2)
Tempo de retenção esperada para trastuzumab(CypK)2 é 7.5-8.0 min, para Trastuzumabe (CypK, MMAE) é 9.1-9.6 min, e para trastuzumab(MMAE)2 é 10,5-11,0 min.
- Analisar o conjugado por LC-MS
- Deglycosylate 30 µ l de 1 mg/mL ADC e o anticorpo não modificado em não reduzir condições usando 250 unidades PNGase F pelo menos 6 h a 37 ° C.
- Eluir o anticorpo para o espectrômetro de massa em um C4 1-5 µm coluna de 1.0 x 100mm usando um gradiente de 20 min de acetonitrilo de 2% a 80% em água. Aquisição de dados em um intervalo de m/z de 350-4000 no modo de íon positivo com uma tensão de cone de 150v.
- Deconvolute os dados brutos, usando o software apropriado. Calcule a diferença de massa entre os modificados e os anticorpos não modificados.
3. ensaio de estabilidade da ligação Dihydropyridazine em Trastuzumab(TAMRA)2 no soro
- Filtre o soro usando um filtro de 0,22 μm sob condições estéreis. Você pode adicionar 100 unidades/mL penicilina e estreptomicina 100 de μg/mL.
- Enche os externos poços de uma placa de 96 poços de água. Em poços de central, misture em triplicado µ l 90 de soro filtrado com 10 µ l de 1 mg/mL trastuzumab(TAMRA)2 em PBS em uma concentração final de 0,1 mg/mL. Coloque a placa em uma incubadora saturada de umidade a 37 ° C e 4-5% de CO2.
- Cada 24 horas durante 5 dias, pipetar cada completamente bem para misturar, leve um 5 µ l alíquota, flash-congelamento com nitrogênio líquido e armazenar a-80 ° C.
- Uma vez que todas as amostras foram coletadas, descongelar as alíquotas e analisar usando um ELISA indireto como anteriormente relatados12 com algumas modificações:
- Revestir uma placa de 96 poços durante a noite com 0,25 µ g/mL HER2 a 4 ° C. Todas as outras etapas são executadas à temperatura ambiente.
- No dia seguinte, lavar 5 vezes com PBS 0,05% tween (PBS-T) e bloquear com 1% albumina de soro bovino por 1h.
- Lave e incubar as amostras na diluição de 1: 10000 em PBS por 2 h.
- Lave e incubar um anticorpo anti-TAMRA levantado no mouse em diluição de 1: 2000 em PBS-T com 0,5% de BSA por 1h.
- Lave e incubar um anti-rato HRP conjugado 1: 1000 em PBS-T com 0,5% de BSA por 1h.
- Adicionar TMB e deixar reagir 5-10 min.
- Parar a reação com 50 µ l H2então4 1 M e medida de absorvância a 450 nm. Subtrair o fundo medido em 570 nm.
- Ajustar uma curva de regressão logística 4-parâmetro de diluições padrão e interpolar as medições de amostras.
Nota: A estabilidade do trastuzumab(MMAE)2 podia ser avaliada usando o mesmo protocolo, alterando o ensaio descrito no ponto 3.3 para um kit comercial de ELISA para medir a concentração da ADC.
4. avaliar a citotoxicidade da ADC
Nota: Este protocolo é baseado em ensaios anteriormente relatados23,26 , com algumas modificações.
- Descongelar o SK-BR-3 e células MCF-7 e permitir-lhes a se estabelecer em p25 frascos contendo meio completo, ou seja, DMEM suplementado com 10% de calor inativada soro fetal bovino, 100 unidades/mL penicilina e estreptomicina 100 de µ g/mL.
- Dividir células na confluência de 80-90% (a cada 3-4 dias) pelo menos 2 vezes antes do ensaio.
- Dois dias antes do ensaio, enche os exteriores poços de uma placa de 96 poços de água. Então células de elevador com tripsina 0,05% em 0,5 mM EDTA, centrifugar 3 min a 250 x g, resuspenda em novo meio e semente 3000 células em 100 µ l por alvéolo (vazio) nas placas de 96 poços.
- Dois dias após a semeadura as células, prepare 10 diluições de série de todas as amostras em triplicata com 0,1% DMSO em meio completo. Considere as seguintes amostras e controles: trastuzumab(MMAE)2, trastuzumab(CypK)2, tipo selvagem de Trastuzumabe, tetrazine-vcMMAE e MMAE.
- Adicionar 100 µ l de cada amostra em cada poço e incubar 5 dias a 37 ° C e 4-5% de CO2.
- No dia 5, medir a viabilidade celular. Para o efeito, use um kit comercial para lisar as células e medir o ATP liberado. Traça a percentagem do sinal em relação ao controle de células tratadas com 0,1% DMSO.
Nota: ADCs podem ser incubadas durante 5 dias no soro e ensaio de citotoxicidade provar a estabilidade funcional.
Atenção: MMAE é altamente tóxico. Portanto use luvas e óculos de proteção quando manusear derivados MMAE. Se você usar MMAE não modificado como um controle em seu experimento, ao preparar a solução estoque em DMSO, manipule o produto sólido dentro de uma coifa.
Resultados
O sistema de expressão transiente relatados (Figura 1a) rende 22 ± 2 mg de trastuzumab(CypK)2 por litro de meio de cultura, o que representa 2/3 do tipo selvagem anticorpo produzido nas mesmas condições (Figura 1C). A linha celular estável pode aumentar esse rendimento até 31 ± 2 mg/L21.
Trastuzumab(CypK)2 pode ser conjugado com tetrazine-vcMMAE, que produz quase homogênea trastuzumab(MMAE)2 até 3 horas a 25 ° C (Figura 2). A alta hidrofobicidade deste cytotoxin requer a adição de 10% acetonitrila quando 5 ou mais equivalentes molares de toxina por CypK são usados. Alternativamente, a cicloadição também é concluída no prazo de 20 h, usando 2 equivalentes de tetrazine-vcMMAE sem acetonitrilo (Figura 2C). Trastuzumab(CypK)2 reage com tetrazine-TAMRA até 2 horas a 25 ° C e 3-6 h são necessários quando a temperatura é reduzida a 4 ° C (Figura 3C).
O esperado DAR para trastuzumab(MMAE)2 medido por HPLC-HIC é 1.9 (Figura 2b). O pico observado inicialmente no cromatograma em min 8,0 representa o anticorpo unconjugated (DAR 0) e deve ter desaparecido completamente quando a reação é concluída. As espécies com DAR 1 elutes 9.1-9.6 min e devem ter uma área < 10% após 3 h; e o produto do alvo com DAR 2 tem um tempo de retenção de 10,5-11,0 com uma área prevista > 90%. O turno de mobilidade e fluorescência em geles de SDS-PAGE confirma a incorporação da TAMRA (Figura 3b) e a identidade do immunoconjugates são verificadas por LC-MS (Figura 2d-e e Figura 3d).
Incubação de trastuzumab(TAMRA)2 por 5 dias no soro humano e posterior análise por ELISA confirma que a carga permanece ligada ao anticorpo (figura 4b). Sobre o ensaio de citotoxicidade, trastuzumab(MMAE)2 mostra alta potência em SK-BR-3 (HER2 alta) mama células cancerosas, com uma concentração máxima meio eficaz (CE50) de 55 ± 22:00 (Figura 4D). Trastuzumab(MMAE)2 mantém a citotoxicidade após 5 dias de incubação no soro humano (Figura 4C). Inversamente, quando o ADC é analisada na MCF-7 (HER2 baixa) o CE50 é 200-fold inferior (Figura 4D). O anticorpo do tipo selvagem, trastuzumab(CypK)2 e tetrazine-vcMMAE mostram extremamente baixa toxicidade (4e e figuras 4 d), Considerando que MMAE exibe alta citotoxicidade não-seletivo em ambas as linhas de célula (Figura 4e).
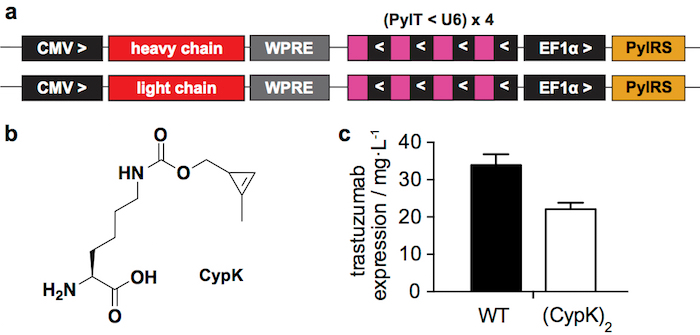
Figura 1: sistema de expressão transiente. R. regiões relevantes dos plasmídeos utilizados para transfecção transiente em células HEK293. CMV: promotor de citomegalovírus, WPRE: marmota vírus hepatite Posttranscriptional elemento regulamentar, PylT: pyrrolysyl tRNA, U6: promotor específico, PylRS: pyrrolysil tRNA sintetase, > e <: direção da transcrição. B. Nε-[((2-methylcycloprop-2-en-1-yl)methoxy)carbonyl]-L-lysine (CypK). C. expressão rende de tipo selvagem (WT) trastuzumab e trastuzumab(CypK)2 como medido em um western blot após proteína uma purificação. Barras de erro representam o desvio padrão de biológica triplica. Esta figura foi modificada com a permissão do Oller-Salvia et al 2018.21. Clique aqui para ver uma versão maior desta figura.
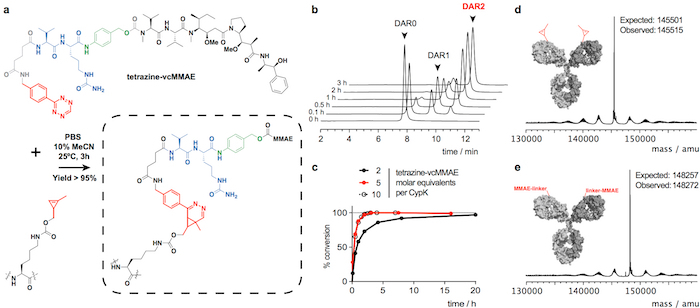
Figura 2: Conjugação de trastuzumab(CypK)2 com tetrazine-vcMMAE. R. cicloadição de Diels-Alder de elétron-demanda inversa entre o resíduo de CypK com o anticorpo e o derivado tetrazine da MMAE. Os grupos reagindo são destacados em vermelho, p- aminobenzylalcohol está representado em verde e o dipeptídeo valina-citrulina em azul. B. cromatogramas de HPLC-HIC mostrando o progresso de conjugação de anticorpo. C. grau de conversão com relação a DAR o máximo de 1,9 usando concentrações de reagente diferente. D-E. Deconvoluted espectros de massa do anticorpo completo antes e depois a conjugação. Trastuzumab(CypK)2 foi obtido usando a linha celular estável. Esta figura foi modificada com a permissão do Oller-Salvia et al 2018.21. Clique aqui para ver uma versão maior desta figura.
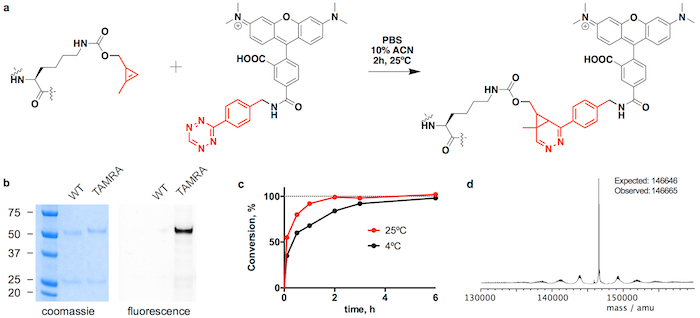
Figura 3: Conjugação de trastuzumab(CypK)2 com tetrazine-TAMRA. R. cicloadição de Diels-Alder de elétron-demanda inversa entre o resíduo de CypK com o anticorpo e o derivado tetrazine da TAMRA. B. gel de SDS-PAGE mostrando a mudança de mobilidade e a fluorescência em-gel originado pela conjugação da TAMRA. C. cinética de conjugação em duas temperaturas diferentes. Espectro de massa m. Deconvoluted de trastuzumab(TAMRA)2. Trastuzumab(CypK)2 foi obtido usando a linha celular estável. Esta figura foi modificada com a permissão do Oller-Salvia et al 2018.21. Clique aqui para ver uma versão maior desta figura.
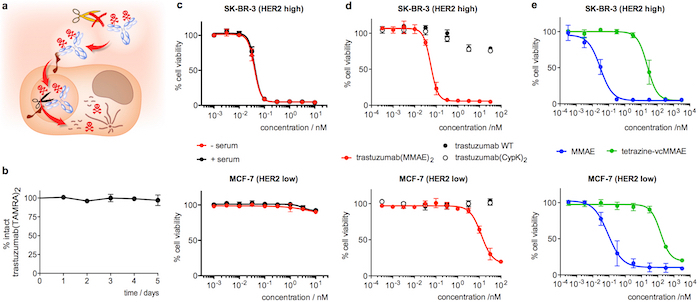
Figura 4: estabilidade no soro e citotoxicidade de Trastuzumabe conjugados. R. dos desenhos animados, destacando as características desejadas em uma ADC internalizar. B. estabilidade de trastuzumab(TAMRA)2 no soro humano, medido em ELISA. C. ensaio da viabilidade celular com trastuzumab(MMAE)2 após 5 dias no soro humano (+ soro, preto). Uma amostra de controle incubadas em PBS, em vez de soro (-soro, vermelho) foi incluído no mesmo ensaio. M. ensaio da viabilidade celular com amostras de anticorpo recentemente diluída. E. ensaio da viabilidade celular com derivados MMAE recentemente diluídos. Barras de erro representam o erro padrão da média de 3 experimentos independentes. Esta figura foi modificada com a permissão do Oller-Salvia et al 2018.21. Clique aqui para ver uma versão maior desta figura.
Discussão
O procedimento de expressão transiente para produzir trastuzumab(CypK)2 descrito neste protocolo é simples e permite alta modularidade. Os rendimentos obtidos são os esperados em um ambiente acadêmico27 e linhas celulares estável podem ser geradas para impulsionar ainda mais o rendimento de produção21. Durante a expressão, as concentrações de CypK menor que 5 mM pode resultar em menor incorporação de ncAA e quantidades mais elevadas podem afetar o crescimento celular e diminuir a produção de anticorpos. CypK como ácidos aminados livres tem baixa hidrossolubilidade, assim deve ser primeiramente dissolvido em 100 milímetros em 0.1 M NaOH e então adicionado ao meio de cultura. Após diluição CypK no meio e antes de adicioná-lo às células, é fundamental para neutralizar o meio com HCl e filtro para esterilizar. Posteriormente, utilizar os reagentes de transfecção especificados no presente protocolo e seguir os tempos de incubação recomendados pelo fabricante é importante para uma expressão de alto rendimento. Para obter mais detalhes sobre a expressão transiente de anticorpos humanos, o leitor é referido por outros protocolos publicados31,32.
Quando o anticorpo é purificado, um elevado excesso de resina de proteína A é necessário conforme indicado para garantir o completo anticorpo puxe para baixo a partir do sobrenadante. Para evitar a precipitação do Trastuzumabe durante a eluição, é recomendável usar uma solução com buffer de alta capacidade, diluído imediatamente com PBS e trocar o tampão evitando a concentração excessiva. Mantenha sempre o anticorpo < 5 mg/mL.
A conjugação do trastuzumab(CypK)2 com tetrazine-vcMMAE é mais rápida que a maioria das reações relatadas com outras alças opaco para ADCs. Além disso, este cycladdition ocorre em condições muito suaves: temperatura ou pH inferior e fisiológico. É importante diluir as soluções estoque de DMSO dos reagentes com acetonitrilo antes da adição de PBS e o anticorpo; caso contrário, os derivados de tetrazine irão precipitar. Acetonitrilo é necessário apenas devido a alta hidrofobicidade da MMAE e TAMRA, mas menos moléculas hidrofóbicas não podem ser necessário a adição de um solvente co. Como alternativa, tetrazine-vcMMAE pode ser conjugado sem acetonitrilo e apenas 2 molares equivalentes de tetrazine-vcMMAE no prazo de 20 h. Esta pequena quantidade de toxina poderia implicar uma diminuição substancial do custo de fabricação do ADC quando comparado com as tecnologias atuais baseados na ncAA. Trastuzumab(CypK)2 é totalmente reativa pelo menos 4 meses quando conservado a 4 ° C.
HPLC-HIC permite uma determinação precisa de DAR desde MMAE é altamente hidrofóbico e fornece uma excelente resolução dos picos correspondentes para o anticorpo cojugado com toxinas de 0, 1 e 2. Não tenha reagido tetrazine-vcMMAE elutes em torno de 13,7 min e é detectado em 280 nm. Esta técnica requer uma matéria-prima com elevado grau de pureza. Além disso, não é recomendável para saciar a reação com outras moléculas tetrazine-reativa como BCN-OH, uma vez que eles podem alterar os tempos de retenção e a forma dos picos. É essencial que a concentração de sal das amostras corresponde a uma na fase móvel no início do gradiente para obter uma boa separação, especialmente se mais de 10-20 µ l são injetados.
Sobre a análise de LC-MS, deglycosylation das amostras de anticorpo é necessária para obter um único pico sobre deconvolução do espectro cru. A precisão do anticorpo total e massas ADC pode variar consoante a calibrar o instrumento. Portanto, para calcular a massa para a modificação, subtrai a massa obtida para os anticorpos não modificados da que obteve para a ADC. Espectrómetros de massa de alta resolução modernos devem fornecer um erro relativo abaixo de 1: 10000. Apesar de LC-MS também pode ser usado para calcular a relação entre as diferentes espécies, esse valor é normalmente uma sobreavaliação porque a modificação pode afetar a capacidade de ionização das espécies geradas e pequenas quantidades de impurezas podem não ser detectadas.
A estabilidade do vinculador em ADCs é crítica, porque o lançamento prematuro da droga resulta em maior toxicidade e baixa eficácia; a enciclopédia cytotoxin danifica os tecidos saudáveis e o anticorpo nu concorre com o único armado para sites de ligação de destino em células doentes. Uma versão inferior a 5%, que está dentro da variabilidade do ensaio de estabilidade, deve ser esperada.
Finalmente, a seletividade de um ADC direcionamento HER2, tais como trastuzumab(MMAE)2 pode ser avaliada comparando a citotoxidade em células SK-BR-3 (HER2 alta) e células MCF-7 (HER2 baixa) desde o último expressam 15-fold menos receptores HER2 do que o antigo28 . O immunoconjugate é esperado para resultar em uma viabilidade celular pelo menos 2 ordens de grandeza inferiores no SK-BR-3 quando comparado ao MCF-7. O CE50 na SK-BR-3 deve ser na faixa nanomolar de dois dígitos, refletindo a alta potência desta ADC29,30. O anticorpo não modificado, trastuzumab(MMAE)2 ou Trastuzumabe, não deve mostrar nenhuma toxicidade neste ensaio. Tetrazine-vcMMAE deve ter um efeito 3 ordens de magnitude menor do que a ADC, desde que o vinculador remove a atividade da toxina peptidomimetic. Inversamente, porque MMAE é capaz de permear a membrana celular30, ele deveria ter uma toxicidade semelhante para a ADC mas não exibir nenhuma discriminação entre HER2 alta e linhas de baixo célula HER2. Além disso, se este ensaio é realizado após uma incubação de 5 dias de ADC no soro, pode ser usada para fornecer uma prova funcional da estabilidade do vinculador: uma liberação da toxina resultaria em qualquer uma diminuição da eficiência do ADC em SK-BR-3 se MMAE foi lançado com p arte de vinculador ou uma diminuição da seletividade se o vinculador foi clivado em uma moda traceless.
A tecnologia de ADC aqui descrita permite a incorporação eficiente e site-specific de um derivado do ciclopropeno de lisina em IgG1s. Após uma purificação facile, anticorpos podem rapidamente ser conjugados com moléculas contendo tetrazine, produzindo produtos homogéneos. Devido ao pequeno tamanho e alta reatividade do ciclopropeno identificador mínimo, esse método deve permitir a conjugação de cargas estericamente impedidas. As immunoconjugates resultantes é estáveis no soro e são altamente potente e seletivo. Em geral, CypK permite uma ligação rápida, estável e site-specific opaco para anticorpos e outros proteínas conjugados para ser usado em terapia ou diagnóstico.
Divulgações
Os autores não têm nada para divulgar.
Agradecimentos
Este trabalho foi apoiado pelo Conselho de pesquisa médica, UK. B.O. N-S. detém um fellowship EMBO (ATLF 158-2016) e é grato ao H. Pelham e J.W. queixo para apoio e G. Kym, C. W. Morgan e O. Perisic para ajuda e conselhos.
Materiais
| Name | Company | Catalog Number | Comments |
| Expi293F | ThermoFisher Scientific | A14527 | HEK suspension cells |
| Expi293 Expression Medium | ThermoFisher Scientific | A1435101 | Expression medium |
| Antibiotic-antimycotic | ThermoFisher Scientific | 15240062 | Penicillin-streptomycin-amphotericin B |
| 125mL Polycarbonate Erlenmeyer Flask with Vent Cap | Corning | 431143 | Shake flasks |
| Brunswick S41i incubator | Eppendorf | S41I230011 | CO2 incubator with a shaker |
| Sodium hydroxide 4 mol/l (4 N) in aqueous solution | VWR | 191373M | |
| Cyclopropene lysine | Sichem | SC-8017 | In this study it was synthesized as described by Elliot et al. 2014 |
| Steriflip-GP, 0.22 µm, polyethersulfone, gamma irradiated | Merck Millipore | SCGP00525 | |
| Opti-MEM, Reduced Serum Medium | ThermoFisher Scientific | 31985070 | Reduced serum medium |
| ExpiFectamine 293 Transfection Kit | ThermoFisher Scientific | A14525 | Transfection reagent |
| 5810 R centrifuge | Eppendorf | 5811000460 | |
| Millex-GP Syringe Filter Unit, 0.22 µm, polyethersulfone, 33 mm, gamma sterilized | Merck Millipore | SLGP033RS | |
| Protein A resin | Sino Biological | 10600-P07E-RN-25 | |
| Poly-Prep Chromatography Columns, Pkg of 50 | Bio-Rad | 7311550 | Polypropylene chromatography column |
| Econo-Column Funnel | Bio-Rad | 7310003 | |
| Sodium citrate | Fluka | 71635 | |
| ÄKTA explorer FPLC | GE Healthcare | ||
| HiTrap HIC Selection Kit | GE Healthcare | 28-4110-07 | Includes HiTrap 1 mL Butyl HP |
| Ammonium sulfate | VWR | 2133.296 | |
| Isopropanol | Honywell | 34863-2.5L | |
| Dymethyl sulfoxide | Sigma-Aldrich | D8418-50ML | |
| Tetrazine-vcMMAE | ChemPartner | - | Costum synthesized |
| Tetrazine-5-TAMRA | Jena Bioscience | CLK-017-05 | |
| NuPAGE 4-12% Bis-Tris Gel 1.0mm x 10 well | ThermoFisherScientific | NP0321BOX | |
| Xcell SureLock Mini-Cell | ThermoFisherScientific | EI0001 | |
| UltiMate 3000 HPLC | ThermoFisherScientific | ||
| Thermo Scientific MAbPac, HIC-20, 4.6 x 100 mm, 5 µm | ThermoFisherScientific | 088553 | |
| PNGase F | New England BioLabs | P0704S | |
| NanoAcquity | Waters | ||
| C4 BEH 1-5 µm 1.0 x 100 mm UPLC column | Waters | ||
| 96-well microplates for cell culture | ThermoFisherScientific | 156545 | |
| Human serum | Sigma-Aldrich | H4522-20mL | |
| CO2 incubator | Panasonic | ||
| HER2 ECD | Sino Biological | 10004-HCCH | |
| Anti-TAMRA | Abcam | an171120 | |
| Anti-mouse HRP | Santa Cruz | sc-2005 | |
| TMB | BioLengend | 421101 | |
| Sulfuric acid | Sigma-Aldrich | 84727-500ML | |
| PHERAstar FS | BMG Labtech | Plate reader | |
| DMEM | Sigma-Aldrich | D5671-500ML | |
| SK-BR-3 | ATCC | HTB-30 | |
| MCF-7 | ATCC | HTB-22 | |
| CellTiterGlo 2.0 Assay | Promega | G9242 | Cell viability assay based on the measurement of ATP released after cell lysis. The output signal is luminscence. |
| Monomethyl Auristatin E | Cayman Chemical | 16267 | |
| NanoDrop 2000 | ThermoFisherScientific | Microvolume spectrophotometer | |
| Human IgG ELISA Quantificaiton Set | Bethyl | E80-104 | |
| MaxEnt1 in MassLynx | Waters | Software application for mass spectrum deconvolution | |
| IntantBlue | Expedeon | ISB1L | Coomassie-based stain |
| Intact MMAE-ADC ELISA Kit (Sandwich Assay) | Epitope Diagnostics, Inc. | KTR 782 | |
| Tube 50 mL, 114x28mm, PP | Sarstedt | 62.547.254 | Conical tube |
| Amicon Ultra-15 Centrifugal Filter Units 50,000 NMWL | Merck | UFC905024 | Centrifugal filtration concentrator (after protein A pull down) |
| Amicon Ultra-4 Centrifugal Filter Units 50,000 NMWL | Merck | UFC805024 | Centrifugal filtration concentrators (after FPLC or HPLC purification) |
| Zeba Spin Desalting Columns, 7K MWCO, 0.5 mL | ThermoFisherScientific | 89882 | Size exclusion spin columns |
| Tube PCR 0.2ml Flat Cap | Thistle Scientific Ltd | AX-PCR-02-C-CS | PCR tubes |
| Nunc MaxiSorpª flat-bottom | ThermoFisherScientific | 44-2404-21 | Plates for ELISA |
Referências
- Beck, A., Goetsch, L., Dumontet, C., Corvaia, N. Strategies and challenges for the next generation of antibody-drug conjugates. Nature Reviews Drug Discovery. 16 (5), 315-337 (2017).
- Wakankar, A. A., et al. Physicochemical Stability of the Antibody−Drug Conjugate Trastuzumab-DM1: Changes due to Modification and Conjugation Processes. Bioconjugate Chemistry. 21 (9), 1588-1595 (2010).
- Stan, A. C., Radu, D. L., Casares, S., Bona, C. A., Brumeanu, T. -. D. Antineoplastic Efficacy of Doxorubicin Enzymatically Assembled on Galactose Residues of a Monoclonal Antibody Specific for the Carcinoembryonic Antigen. Cancer Research. 59 (1), 115-121 (1999).
- Hamblett, K. J., et al. Effects of Drug Loading on the Antitumor Activity of a Monoclonal Antibody Drug Conjugate. Clinical Cancer Research. 10 (20), 7063-7070 (2004).
- Chari, R. V. J., Miller, M. L., Widdison, W. C. Antibody-Drug Conjugates: An Emerging Concept in Cancer Therapy. Angewandte Chemie International Edition. 53 (15), 3796-3827 (2014).
- Chin, J. W. Expanding and Reprogramming the Genetic Code. Nature. 550 (7674), 53-60 (2017).
- Axup, J. Y., et al. Synthesis of Site-Specific Antibody-Drug Conjugates Using Unnatural Amino Acids. Proceedings of the National Academy of Sciences of the United States of America. 109 (40), 16101-16106 (2012).
- Hallam, T. J., Wold, E., Wahl, A., Smider, V. V. Antibody Conjugates with Unnatural Amino Acids. Molecular Pharmaceutics. 12 (6), 1848-1862 (2015).
- Tian, F., et al. A General Approach to Site-Specific Antibody Drug Conjugates. Proceedings of the National Academy of Sciences of the United States of America. 111 (5), 1766-1771 (2014).
- Kern, J. C., et al. Discovery of Pyrophosphate Diesters as Tunable, Soluble, and Bioorthogonal Linkers for Site-Specific Antibody-Drug Conjugates. Journal of the American Chemical Society. 138 (4), 1430-1445 (2016).
- Zimmerman, E. S., et al. Production of Site-Specific Antibody-Drug Conjugates Using Optimized Non-Natural Amino Acids in a Cell-Free Expression System. Bioconjugate Chemistry. 25 (2), 351-361 (2014).
- VanBrunt, M. P., et al. Genetically Encoded Azide Containing Amino Acid in Mammalian Cells Enables Site-Specific Antibody-Drug Conjugates Using Click Cycloaddition Chemistry. Bioconjugate Chemistry. 26 (11), 2249-2260 (2015).
- Xiao, H., et al. Genetic Incorporation of Multiple Unnatural Amino Acids into Proteins in Mammalian Cells. Angewandte Chemie International Edition. 52 (52), 14080-14083 (2013).
- Milles, S., et al. Click Strategies for Single-Molecule Protein Fluorescence. Journal of the American Chemical Society. 134 (11), 5187-5195 (2012).
- Lallana, E., Riguera, R., Fernandez-Megia, E. Reliable and Efficient Procedures for the Conjugation of Biomolecules through Huisgen Azide-Alkyne Cycloadditions. Angewandte Chemie International Edition. 50 (38), 8794-8804 (2011).
- Koehler, C., et al. Genetic Code Expansion for Multiprotein Complex Engineering. Nature Methods. 13 (12), 997-1000 (2016).
- Lyon, R. P., et al. Reducing Hydrophobicity of Homogeneous Antibody-Drug Conjugates Improves Pharmacokinetics and Therapeutic Index. Nature Biotechnology. 33 (7), 733-735 (2015).
- Elliott, T. S., et al. Proteome Labeling and Protein Identification in Specific Tissues and at Specific Developmental Stages in an Animal. Nature Biotechnology. 32, 465-472 (2014).
- Ravasco, J. M. J. M., Monteiro, C. M., Trindade, A. F. Cyclopropenes: A New Tool for the Study of Biological Systems. Organic Chemistry Frontiers. 4 (6), 1167-1198 (2017).
- Yang, J., Šečkutė, J., Cole, C. M., Devaraj, N. K. Live-Cell Imaging of Cyclopropene Tags with Fluorogenic Tetrazine Cycloadditions. Angewandte Chemie International Edition. 124 (30), 7594-7597 (2012).
- Oller-Salvia, B., Kym, G., Chin, J. W. Rapid and Efficient Generation of Stable Antibody-Drug Conjugates via an Encoded Cyclopropene and an Inverse-Electron-Demand Diels-Alder Reaction. Angewandte Chemie International Edition. 57, 2831-2834 (2018).
- Schmied, W. H., Elsässer, S. J., Uttamapinant, C., Chin, J. W. Efficient Multisite Unnatural Amino Acid Incorporation in Mammalian Cells via Optimized Pyrrolysyl tRNA Synthetase/tRNA Expression and Engineered eRF1. Journal of the American Chemical Society. 136 (44), 15577-15583 (2014).
- Junutula, J. R., et al. Site-Specific Conjugation of a Cytotoxic Drug to an Antibody Improves the Therapeutic Index. Nature Biotechnology. 26 (8), 925-932 (2008).
- Junutula, J. R., et al. Rapid Identification of Reactive Cysteine Residues for Site-Specific Labeling of Antibody-Fabs. Journal of Immunological Methods. 332 (1), 41-52 (2008).
- Doronina, S. O., et al. Development of potent monoclonal antibody auristatin conjugates for cancer therapy. Nature Biotechnology. 21 (7), 778-784 (2003).
- Shiraishi, Y., et al. Identification of Highly Reactive Cysteine Residues at Less Exposed Positions in the Fab Constant Region for Site-Specific Conjugation. Bioconjugate Chemistry. 26 (6), 1032-1040 (2015).
- Sabourin, M., et al. Increasing Antibody Yield and Modulating Final Product Quality using the Freedom(TM). CHO-S(TM) Production Platform. BMC Proceedings. 5 (8), 102 (2011).
- Xiao, Y., Gao, X., Maragh, S., Telford, W. G., Tona, A. Cell Lines as Candidate Reference Materials for Quality Control of ERBB2 Amplification and Expression Assays in Breast Cancer. Clinical Chemistry. 55 (7), 1307-1315 (2009).
- Shinmi, D., et al. One-Step Conjugation Method for Site-Specific Antibody-Drug Conjugates through Reactive Cysteine-Engineered Antibodies. Bioconjugate Chemistry. 27 (5), 1324-1331 (2016).
- Badescu, G., et al. Bridging Disulfides for Stable and Defined Antibody Drug Conjugates. Bioconjugate Chemistry. 25 (6), 1124-1136 (2014).
- Vazquez-Lombardi, R., et al. Transient expression of human antibodies in mammalian cells. Nature Protocols. 13 (1), 99-117 (2018).
- Baldi, L., Hacker, D. L., Meerschman, C., Wurm, F. M., Hartley, J. L. . Protein Expression in Mammalian Cells: Methods and Protocols. , 13-26 (2012).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados