Method Article
Codage génétique d’un acide aminé Non canonique pour la génération d’anticorps-médicament conjugués par une réaction rapide Bioorthogonal
Dans cet article
Résumé
Intégrer un dérivé cyclopropène de lysine anticorps permet le lien au site, rapid et efficace des molécules portant tetrazine pour générer des conjugués anticorps-médicament.
Résumé
Conjugués anticorps-médicament (ADCs) utilisés aujourd'hui dans la pratique clinique sont des mélanges de molécules d’anticorps liés à un nombre variable de toxines à des positions différentes. Les études précliniques ont montré que l’indice thérapeutique de ces convertisseurs a/n traditionnelle peut être améliorée par l’assemblage in situ des toxines. Toutefois, les approches actuelles de production homogènes ADCs présentent plusieurs limites, comme expression de la protéine faible et cinétique de la réaction lente. Dans ce protocole, nous décrivons comment mettre en place un système d’expression à intégrer un dérivé cyclopropène de lysine (CypK) anticorps utilisant la dilatation du code génétique. Cette poignée de bioorthogonal minime permet de conjugaison rapide des dérivés tetrazine par une cycloaddition de Diels-Alder inverse la demande. Le système d’expression ici signalé permet la production facile et la purification du trastuzumab ayant CypK à chacune des chaînes lourdes. Nous expliquons comment lier les anticorps à la toxine monométhyl auristatin E et caractériser l’immunoconjugué par chromatographie hydrophobe et spectrométrie de masse. Enfin, nous décrivons des tests pour évaluer la stabilité dans le sérum humain de la tringlerie de pyridazine résultant de la conjugaison et de tester la cytotoxicité sélective de l’ADC pour les cellules cancéreuses du sein avec des récepteurs HER2 élevés.
Introduction
Conjugués anticorps-médicament (ADCs) combinent la sélectivité des biothérapeutiques et la puissance de petites molécules cytotoxiques. Convertisseurs a/n la plupart vise à diminuer les effets secondaires de la chimiothérapie traditionnelle en ciblant les médicaments qui affectent la polymérisation ADN ou microtubules de cellules de cancer1. ADCs première génération approuvés par la Food and Drug Administration (FDA) s’appuient sur la modification des lysines et cystéines, qui génère des mélanges de molécules modifiées à différentes positions avec une diminution des propriétés pharmacocinétiques2. En revanche, conjugaison in site des médicaments aux anticorps peut générer des composés avec amélioration thérapeutique indeces3,4. Cherchant à relever le défi de produire des convertisseurs a/n homogène, plusieurs modifications chimiques et enzymatiques sélectifs ont été signalés1,5. Cependant, les méthodes actuelles peuvent cibler seulement certaine position sur l’anticorps, souffrent d’expression des protéines de faible, fournissent des linkers avec faible stabilité ou s’appuient sur la réaction lente et faible rendement.
Incorporation des acides aminés non canoniques (ncAA) grâce à l’expansion du code génétique permet l’installation in situ d’une pléthore de groupes réactifs bioorthogonal dans les protéines, potentiellement de surmonter les limites des autres méthodes utilisées pour générer Convertisseurs a/n. Encodage ANAC en réponse à un codon de cible (arrêt) s’appuie sur les paires aminoacyl-ARNt synthétase/ARNt qui sont orthogonaux aux couples endogènes qui incorporent des aminoacides canonique6. Plusieurs ANAC ont été intégrées d’anticorps pour générer des convertisseurs a/n. Cependant, plus souffrent de divers engagements pour des applications dans la conjugaison de médicaments thérapeutiques. p-acetylphenylalanine (FACP)7,8 n’est pas entièrement bioorthogonal, requiert un pH faible (4,5) et un longs temps de réaction (> 60 h), il azotures tels que p-azidophenylalanine (pAzF)7,9,10, p-azidomethylphenylalanine (FMPA)11et un dérivé de l’azoture de lysine (AzK)12,13 peuvent être réduite à la cellule14, et le cuivre utilisé pour catalyser des réactions de Huisgen cycloaddition peut provoquer des dommages oxydatifs 15.
Bien qu’ANAC alternative basée sur trans-cyclooctène (TCO), cyclooctyne (SCO) et bicyclo [6.1.0] nonène (BCN) ont récemment été encodés dans un anticorps à des fins de bio-imagerie, le système d’expression souffre de très faibles rendements (0,5 mg/L),16. En outre, cyclooctènes et cyclooctynes sont grandes et poignées hydrophobes qui peuvent augmenter la susceptibilité de l’ADC pour charges utiles -ADC d’agrégation sont traditionnellement hydrophobes et les propriétés physico-chimiques de l’éditeur de liens ont été démontrées que beaucoup impact pharmacocinétique et index thérapeutique17. En revanche, 1, 3-disubstitués cyclopropènes sont des petits groupes réactifs qui devraient provoquer une modification minime dans la protéine structure et physichochemical propriétés18. Cyclopropènes rapidement et de manière sélective réagissent avec les tétrazines via une demande électronique inverse Diels-Alder cycloaddition19. Dans ce protocole, nous faire utiliser d’un dérivé du roulement de la lysine (CypK, Figure 1 b) un méthyl-cyclopropène qui est moins affectée par empêchement stérique à grands cycles insaturés tendues et a une constante de vitesse de réaction dans l’ordre 1-30 M-1s -1 en milieu aqueux18,20.
Nous avons récemment rapporté comment intégrer CypK à anticorps pour générer des convertisseurs a/n en faisant réagir cette poignée de bioorthogonal minime avec des molécules portant tetrazine21. Nous décrivons ici la procédure de préparation d’ADC plus en détail en mettant l’accent sur les étapes plus difficiles. L’incorporation de CypK est réalisée à l’aide d’un pyrrolysyl-ARNt synthétase (PylRS) / paire de tRNACUA(PylT) en réponse à un codon ambré introduit dans la chaîne lourde d’anticorps (HC)22. Ici, nous utilisons deux plasmides pour la transfection transitoire (Figure 1 a), un codage de la chaîne lourde de l’anticorps et l’autre codage de la chaîne légère (LC), contenant la cassette PylRS/PylT. Alternativement, une lignée cellulaire stable qui permet des rendements plus élevés d’anticorps peut être générée par un plus laborieuse procédure21.
Les systèmes d’expression susmentionnée peuvent produire l’immunoglobuline thérapeutique anti-HER2 1 (IgG1) trastuzumab avec CypK à des niveaux semblables à l’anticorps de type sauvage. Nous avons choisi la première position du domaine CH1 sur la chaîne lourde d’encoder la ncAA (HC-118TAG). C’est le plus souvent mis à jour le site dans les convertisseurs a/n23 et est connu comme HC-118 (numérotation des EU) mais a également été dénommé HC-121 (position de la séquence) et HC-114 (numérotation de Kabat)24. Étant donné que cette position est conservée tout au long de toutes les IgG1s, ces systèmes d’expression devraient être susceptibles d’anticorps thérapeutiques plus.
Nous montrons trastuzumab(CypK)2 peut être facilement purifié par protéine A suivie par chromatographie liquide de protéine rapide avec une colonne d’interaction hydrophobe (FPLC-HIC). Par la suite l’anticorps est lié de façon covalente au sein de 3 h au microtubule polymérisation inhibiteur monométhyl auristatin E (MMAE), qui est utilisé dans le ADC Adcetris approuvé par la FDA. Ici, nous utilisons un dérivé de benzyl-tetrazine de MMAE (tetrazine-vcMMAE) avec un linker comprenant une entretoise glutarate et un composant de protéase labile de valine-citrulline suivie d’une unité self-immolative de p- aminobenzylalcohol ; ce linker est clivé par la cathepsine B dans le lysosome sur l’internalisation de l’ADC, aboutissant à la libération de chimiothèques de la toxine25. Afin de montrer l’étendue de la réaction de que l’anticorps est également lié à la tétraméthylrhodamine fluorophore (TAMRA). Nous expliquons comment vérifier l’identité du conjugué par chromatographie liquide couplée à la spectrométrie de masse (LC-MS) et de calculer le ratio de drogue-à-anticorps (DAR), chromatographie liquide à haute performance avec une colonne d’interaction hydrophobe (HPLC-HIC) .
Dans le cadre de la caractérisation de la performance d’anticorps, nous décrivons comment tester la stabilité de l’articulation de la pyridazine dans le sérum humain. Ce paramètre est plus facile d’évaluer au trastuzumab-TAMRA parce qu’elle peut être quantifiée par un simple ELISA et l’interprétation des résultats n’est pas compliquée par le composant thermolabile de protéase de trastuzumab(MMAE)2. Enfin, la sélectivité et la puissance de la trastuzumab(MMAE)2 est évaluée en comparant la recherche de l’ADC dans l’ensemble des lignées de cellules exprimant des niveaux différents de HER2. Ce test fournit aussi une démonstration fonctionnelle de la stabilité de l’ADC lorsqu’effectuée après incubation du immunoconjugué dans le sérum humain.
Protocole
1. produire et caractériser l’anticorps
- Exprimer l’anticorps
- Décongeler un flacon de cellules en suspension dans un ballon jaugé de 250 mL contenant 50 mL de milieu d’expression additionné de 100 unités/mL de pénicilline, 100 µg/mL de streptomycine et 250 ng/mL amphotéricine B. Gardez les cellules à 37 ° C avec 8 % de CO2 dans humidifié incubateurs équipées HEK avec un agitateur à 125 tr/min. Fractionner les cellules à 0,3-0,5 x 106 cellules/mL (tous les 2-3 jours) au moins 2 fois avant transfectants.
- Quand une densité de 2. 5 x 106 cellules/mL est atteint (2-3 jours après le fractionnement), préparer une nouvelle solution de 100 mM CypK. À cette fin, pèse 64 mg de CypK, ajouter 2,5 mL de 0,1 d’hydroxyde de sodium, vortex, rotation vers le bas pour récupérer des particules tout non dissoutes et laisser agir.
- Ajouter 2,5 mL de CypK (100 mM de NaOH 0,1 M) à 42,5 mL de milieu d’expression additionné d’antibiotiques. Bien mélanger, ajouter 250 µL de 0,1 M HCl et stériliser à l’aide d’un filtre de 0,22 µm.
- Diluer 50 µg de HC et LC pKym1 plasmides21 à 2,5 mL avec milieu de sérum réduit. Dans une éprouvette, diluer 135 µL de réactif de transfection de 2,5 mL avec milieu de sérum réduit.
- Cinq minutes après avoir préparé les solutions, mélanger les plasmides et la solution de réactif de transfection et incuber pendant 20 min permettre la formation de complexes entre l’ADN et le réactif de transfection.
- Dans l’intervalle, centrifuger 125 millions de cellules à la densité de la cible pendant 5 min à 500 x g, remettre en suspension avec le médium d’expression contenant CypK et ajouter le mélange réactif d’ADN – transfection. CypK peut être acheté ou synthétisé comme indiqué précédemment18.
- Après incubation des cellules pour 20 h, ajouter 250 µL d’exhausteurs de réactif de transfection inclus dans le kit.
- Récolter des anticorps à partir du surnageants 6-7 jours après l’addition de CypK (sans changement de support est nécessaire au cours de l’expression).
* Sinon, pour obtenir des rendements plus élevés et plus cohérentes, une lignée cellulaire stable peut être générée comme décrit dans Oller-Salvia et al. 21de 2018. Dans ce cas, trastuzumab(CypK)2 s’exprime simplement par l’addition de CypK 5 mM dans le milieu de l’expression.
- Purifier les anticorps
- Centrifuger les cellules à 3000 x g pendant 15 minutes.
- Filtrer le liquide surnageant avec un 0,45 ou un filtre de 0,22 µm. Si le filtre est obstrué, remplacez-la par une nouvelle et continuer à filtrer. Si cela arrive après seulement quelques millilitres, centrifuger le surnageant pour un 15 min supplémentaire à 7000 x g.
- Ajouter résine de protéine A (2 mL/100 mL de liquide surnageant) dans une colonne de chromatographie en polypropylène vide et équilibrer la résine avec au moins 5 volumes de tampon de lavage perle (0,1 M phosphate de sodium, NaCl 150 mM).
- Le surnageant scindée en deux tubes conique de 50 mL et ajouter 5 x tampon de lavage de perle (0,5 M phosphate de sodium, NaCl 150 mM) suivie de la résine de A préalablement équilibré de protéines. Placer le tube conique sur un rouleau de 3 h à température ambiante pour tirer vers le bas de l’anticorps dans le surnageant.
Alternative : Ajouter le surnageant sur la colonne au moins double de la quantité recommandée de résine et laisser se pour écouler à travers. Assurez-vous qu’il n’y a pas une quantité importante d’anticorps restant dans le surnageant par SDS-PAGE. S’il y a, éluer le surnageant à travers la résine une fois de plus. - Transférer la protéine A résine avec le liquide surnageant dans une colonne et laisser le liquide s’écouler à travers.
- Ajouter 25 mL de tampon de lavage (ou volumes de résine au moins 10) et laisser se pour écouler à travers.
- Éluer les anticorps avec 4 mL de citrate de sodium 0,1 M, pH 3, sur 1 mL de tampon phosphate 1 M NaCl 150 mM.
- Diluer l’anticorps avec 10 mL de PBS, concentré de 0,5 à 1 mL par filtration centrifuge et d’échange tampon trois fois avec du PBS.
- Purifier les échantillons par FPLC utilisant une colonne HIC butyle avec un débit de 0,5 mL/min et un 0-100 % dégradé en 30 min de tampon de faible teneur en sel (50 mM phosphate de sodium pH 7.0, isopropanol 20 %) dans le tampon de la forte teneur en sel (de 1,5 M (NH4)2SO4, 50 mM de phosphate de sodium pH 7.0 5 % alcool isopropylique). Collecter toutes les fractions et surveiller l’élution à 280 nm. Petites quantités (< 1 mg) peuvent être purifiées par HPLC-HIC dans les conditions décrites au point 2.4 de maximiser le rendement et la pureté.
- Mettre en commun les fractions qui contiennent des anticorps, Diluez-les dans au moins 4 mL avec du PBS, les concentrent par centrifuge tampon filtration et change trois fois avec du PBS.
- Quantifier l’anticorps
- Obtenir une concentration approximative en mesurant l’absorbance à 280 nm à l’aide d’un spectrophotomètre micro-volume.
- Si une mesure précise est nécessaire, utilisez un kit ELISA pour mesurer les IgG humaine. Pour une estimation grossière, utilisez SDS-PAGE avec une tache axée sur le bleu de Coomassie comme suit :
- Élaborer des normes en diluant les double six fois un standard de trastuzumab quantifié par ELISA à 1 mg/mL.
- Faire bouillir les normes et les échantillons à environ 0,25 mg/mL dans la réduction de tampon de charge.
- Exécutez-les dans un Bis-Tris SDS-PAGE 4-12 % à l’aide mémoire tampon MES-SDS et teinté avec un colorant à base de bleu de Coomassie. Enfin, mesurer la densité de la couleur de la bande correspondant à la lumière ou la chaîne lourde utilisant ImageJ et interpoler le signal des échantillons dans la courbe d’étalonnage.
- Magasin de l’anticorps à 4 ° C.
2. conjugué de l’anticorps et de caractériser l’ADC
- Conjugué à l’anticorps avec la molécule tetrazine-roulement
- Diluer 10 équivalents molaires de tetrazine-vcMMAE (4 µL, 3,4 mM dans le diméthylsulfoxyde (DMSO)) avec 20 µL d’acétonitrile et 76 µL de PBS dans un petit tube conique (par exemple,le tube PCR).
- Ajouter 1 équivalent molaire de trastuzumab(CypK)2 (100 µL, 2 mg/mL dans du PBS), bien mélanger et laisser pour réagir pendant 3 h à température ambiante (25 ° C) pour former des trastuzumab(MMAE)2.
Remarque : Les autres molécules telles que tetrazine-5-TAMRA peuvent être liées à l’anticorps au lieu de tetrazine-vcMMAE utilisant ce protocole.
- Purifier l’ADC
- Equilibrer avant une colonne taille exclusion avec PBS en suivant les instructions du fabricant.
- Ajouter le volume entier de la réaction sur la colonne et centrifuger à 1500 x g pendant 1 min.
- Quantifier l’ADC et d’analyser le conjugué par SDS-PAGE
- Quantifier l’ADC comme décrit dans la section 1.3.2. en mesurant la densité de la couleur de la chaîne légère sur une SDS-PAGE à l’aide de l’anticorps non modifiés pour la courbe d’étalonnage.
- La chaîne lourde devrait avoir légèrement décalé faisant apparaître une augmentation du poids moléculaire sur la conjugaison.
Remarque : Si l’anticorps est modifié avec un fluorophore comme dans trastuzumab(TAMRA)2, seule la bande correspondant à la chaîne lourde devrait montrer de fluorescence en gel avant la coloration.
- Analyser le conjugué par HPLC-HIC
- Équilibrer la colonne HPLC-HIC avec 100 % tampons A (1,5 M (NH4)2SO4, 50 mM de phosphate de sodium pH 7.0, 5 % isopropanol) pendant 5 min.
- Mix 15 µL (67 pmol) d’une solution de 1 mg/mL de trastuzumab (CypK) 2 avec 15 µL de 2 x tampon A dans un flacon. Programmer ensuite une injection de 10 µL de la CLHP.
- Éluer dans un débit de 1 mL/min isocratique avec 100 % tampons A pendant 1 min, suivie d’une pente de 15 min de 100 à 0 % de tampons A à B (50 mM de phosphate de sodium de pH 7.0, isopropanol 20 %). Surveiller l’élution à 280 nm.
- Calculer le DAR en intégrant le pic correspondant à chaque espèce et en utilisant les zones qui en résulte dans l’équation suivante :
DAR = (1 x trastuzumab(MMAE) + 2 x trastuzumab(MMAE)2)
/(trastuzumab(mmae)0 , trastuzumab(MMAE)1 + trastuzumab(MMAE)2)
Temps de rétention prévu pour trastuzumab(CypK)2 est 7,5-8,0 min, pour trastuzumab (CypK, MMAE) est 9.1-9,6 min, et pour trastuzumab(MMAE)2 min de 10,5 à 11,0.
- Analyser le conjugué par LC-MS
- Déglycosyler 30 µL de 1 mg/mL ADC et l’anticorps non modifiés dans non réductrice des conditions à l’aide de 250 unités de PNGase F pendant au moins 6 h à 37 ° C.
- Éluer les anticorps dans le spectromètre de masse dans une C4 1-5 µm 1.0 x 100 mm colonne en utilisant une pente de 20 min de 2 % à 80 % d’acétonitrile dans l’eau. Acquisition de données sur une gamme de m/z de 350-4000 en mode ions positifs avec une tension de cône de 150v.
- Deconvolute les données brutes à l’aide de logiciels appropriés. Calculer la différence de masse entre les modifiés et les anticorps non modifiés.
3. test de stabilité de la tringlerie de pyridazine dans Trastuzumab(TAMRA)2 dans le sérum
- Filtrer le sérum à l’aide d’un filtre de 0,22 µm dans des conditions stériles. Vous pouvez ajouter 100 unités/mL de pénicilline et 100 μg/mL de streptomycine.
- Remplir les puits externes d’une plaque à 96 puits d’eau. Dans les puits centrales, mélanger en trois exemplaires à 90 µL de sérum filtrée avec 10 µL de 1 mg/mL trastuzumab(TAMRA)2 dans du PBS à une concentration finale de 0,1 mg/mL. Placer la plaque dans un incubateur saturé d’humidité à 37 ° C et 4-5 % CO2.
- Toutes les 24 h pendant 5 jours, pipette chaque bien bien mélanger, prendre un 5 µL aliquote, flash-congélation à l’azote liquide et conserver à-80 ° C.
- Une fois que tous les échantillons ont été prélevés, décongeler les aliquotes et analysent à l’aide d’une test ELISA indirect comme précédemment signalé12 avec quelques modifications :
- Recouvrir une plaque à 96 puits du jour au lendemain avec 0,25 µg/mL HER2 à 4 ° C. Toutes les autres étapes sont effectuées à température ambiante.
- Le lendemain, laver 5 fois avec du PBS 0,05 % tween (PBS-T) et bloquer avec 1 % d’albumine sérique bovine pendant 1 h.
- Laver et incuber les échantillons à la dilution de 1 : 10000 en PBS pendant 2 h.
- Laver et laisser incuber un anticorps anti-TAMRA chez la souris à la dilution de 1 : 2000 en PBS-T avec 0,5 % de BSA pendant 1 h.
- Laver et laisser incuber un anti-souris HRP 1/de 1000 conjugué dans PBS-T avec 0,5 % de BSA pendant 1 h.
- Ajouter TMB et laisser pour réagir 5-10 min.
- Arrêter la réaction avec 50 µL H2SO4 1 M et mesure absorbance à 450 nm. Soustraire de fond mesurées à 570 nm.
- Ajuster une courbe 4 paramètres de régression logistique à des dilutions en série et interpoler les mesures provenant d’échantillons.
Remarque : La stabilité des trastuzumab(MMAE)2 pouvait être évaluée en utilisant le même protocole en changeant le test décrit à 3.3 pour une trousse ELISA commerciale pour mesurer la concentration de l’ADC.
4. évaluer la cytotoxicité de l’ADC
Remarque : Ce protocole est basé sur tests rapportés antérieurement23,26 , avec quelques modifications.
- Décongeler les SK-BR-3 et des cellules MCF-7 et leur permettre de s’installer dans des flacons de p25 contenant le milieu complet, c'est-à-dire DMEM additionné de 10 % de chaleur inactivé de sérum de veau fœtal, 100 unités/mL de pénicilline et 100 µg/mL de streptomycine.
- Fractionner les cellules à confluence de 80 à 90 % (tous les 3-4 jours) au moins 2 fois avant le dosage.
- Deux jours avant l’essai, remplir l’extérieurs puits d’une plaque de 96 puits avec de l’eau. Puis ascenseur cellules avec de la trypsine de 0.05 % en 0,5 mM EDTA, centrifugeuse 3 min à 250 x g, remettre en suspension dans un milieu nouveau et semences 3000 cellules dans 100 µL / puits (vide) dans les plaques de 96 puits.
- Deux jours après l’ensemencement les cellules, préparer des 10 dilutions de tous les échantillons en trois exemplaires, avec 0,1 % DMSO en milieu complet. Examiner les échantillons et les contrôles suivants : trastuzumab(MMAE)2, trastuzumab(CypK)2, type sauvage trastuzumab, tetrazine-vcMMAE et MMAE.
- Ajouter 100 µL de chaque échantillon dans chaque puits et incuber pendant 5 jours à 37 ° C et 4-5 % CO2.
- Le jour 5, mesurer la viabilité des cellules. Pour ce faire, utilisez une trousse commerciale pour lyser les cellules et mesurer l’ATP libérée. Tracer le pourcentage de signal en ce qui concerne le contrôle des cellules traitées avec 0,1 % DMSO.
Remarque : Convertisseurs a/n peut être incubées pendant 5 jours dans le sérum et testés pour la cytotoxicité de prouver la stabilité fonctionnelle.
ATTENTION : MMAE est hautement toxique. Par conséquent utiliser gants et lunettes de protection lors de la manipulation des dérivés MMAE. Si vous utilisez MMAE non modifié comme un contrôle dans votre expérience, lorsque vous préparez la solution mère dans le DMSO, manipuler le produit solid à l’intérieur d’une hotte aspirante.
Résultats
Le système d’expression transitoire rapportés (Figure 1 a) conduit à 22 ± 2 mg de trastuzumab(CypK)2 par litre de milieu de culture, ce qui représente 2/3 de l’anticorps de type sauvage, produit dans les mêmes conditions (Figure 1C). La lignée cellulaire stable peut augmenter ce rendement jusqu'à 31 ± 2 mg/L21.
Trastuzumab(CypK)2 peut se conjuguer avec le tetrazine-vcMMAE, c'est-à-dire quasi homogène trastuzumab(MMAE)2 moins de 3 h à 25 ° C (Figure 2). L’hydrophobie élevée de cette cytotoxine nécessite plus de 10 % d’acétonitrile lorsque 5 ou plus équivalents molaires de toxine par CypK sont utilisés. Alternativement, la cycloaddition est également terminée dans les 20 h, à l’aide de 2 équivalents de tetrazine-vcMMAE sans l’acétonitrile (Figure 2c). Trastuzumab(CypK)2 réagit avec tetrazine-TAMRA moins de 2 h à 25 ° C et 3 à 6 h sont nécessaires lorsque la température est retombée à 4 ° C (Figure 3C).
Le DAR attendu pour trastuzumab(MMAE)2 mesuré par HPLC-HIC est 1,9 (Figure 2 b). Le pic observé au départ dans le chromatogramme à 8,0 min représente l’anticorps non conjuguée (DAR 0) et devrait avoir complètement disparu lorsque la réaction est terminée. Les espèces à DAR 1 élue à 9.1-9,6 min et devraient avoir une zone < 10 % après 3 h ; et le produit cible avec DAR 2 a un temps de rétention de 10,5 à 11,0 avec une zone attendue > 90 %. Le déplacement de la mobilité et la fluorescence dans les gels SDS-PAGE confirme l’incorporation de TAMRA (Figure 3 b) et l’identité de l’immunoconjugués sont vérifiées par LC-MS (Figure 2d-e et Figure 3d).
L’incubation des trastuzumab(TAMRA)2 pendant 5 jours dans le sérum humain et l’analyse ultérieure par ELISA confirme que la charge utile reste attachée à l’anticorps (Figure 4 b). En ce qui concerne le test de cytotoxicité, trastuzumab(MMAE)2 montre très alcoolisée désossée SK-BR-3 (HER2 élevée) des cellules cancéreuses, avec une moitié de la concentration efficace maximale (EC50) de 55 ± 22:00 (Figure 4D). Trastuzumab(mmae)2 maintient la cytotoxicité après 5 jours d’incubation dans le sérum humain (Figure 4C). À l’inverse, lorsque le connecteur ADC est dosé sur MCF-7 (HER2 faible) l’EC50 est 200-fold inférieur (Figure 4D). Les anticorps de type sauvage, les trastuzumab(CypK)2 et les tetrazine-vcMMAE montrent très faible toxicité (4e et Figures 4 d), tandis que MMAE affiche haute cytotoxicité non sélectifs dans les deux lignées cellulaires (Figure 4e).
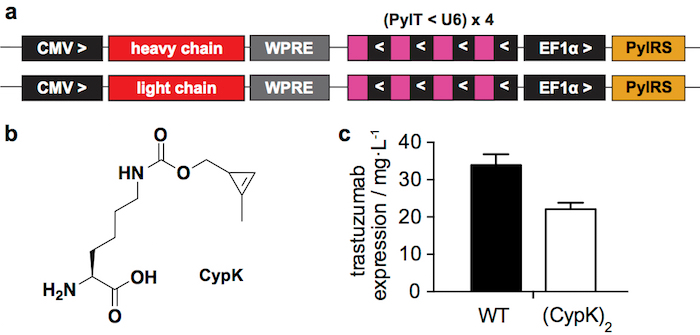
Figure 1 : système d’expression transitoire. A. des régions concernées des plasmides utilisés pour la transfection transitoire dans les cellules HEK293. CMV : promoteur cytomégalovirus, WPRE : Woodchuck Hepatitis Virus post-transcriptionnel Regulatory Element, PylT : pyrrolysyl ARNt, U6 : promoteur spécifique, PylRS : pyrrolysil tRNA synthétase, > et < : direction de la transcription. B. Nε-[((2-methylcycloprop-2-en-1-yl)methoxy)carbonyl]-L-lysine (CypK). C. Expression produit de trastuzumab de type sauvage (WT) et trastuzumab(CypK)2 tel que mesuré dans un western blot après protéine une purification. Barres d’erreur représentent l’écart-type de géométrie biologique. Ce chiffre a été modifié avec la permission de Oller-Salvia et al. 21de 2018. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
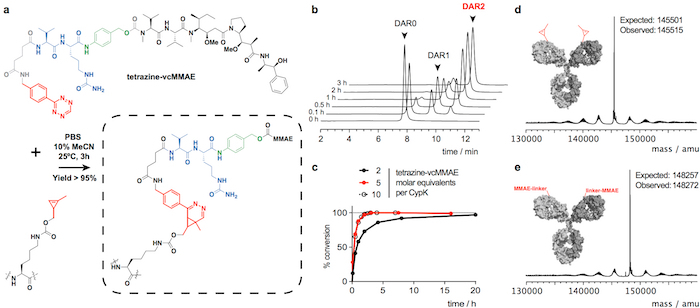
Figure 2 : Conjugaison trastuzumab(CypK)2 avec tetrazine-vcMMAE. A. Inverse électron demande Diels-Alder cycloaddition entre le résidu de CypK dans l’anticorps et la dérivée de tetrazine de MMAE. Les réaction entre groupes sont surlignées en rouge, p- aminobenzylalcohol est représenté en vert et le dipeptide valine-citrulline en bleu. B. les chromatogrammes HPLC-HIC affichant la progression de la conjugaison des anticorps. C. degré de conversion en ce qui concerne le DAR maximale de 1,9 en utilisant des concentrations de réactifs différents. D.-e. Déconvolutée des spectres de masse de l’anticorps complet avant et après la conjugaison. Trastuzumab(CypK)2 a été obtenu à l’aide de la lignée cellulaire stable. Ce chiffre a été modifié avec la permission de Oller-Salvia et al. 21de 2018. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
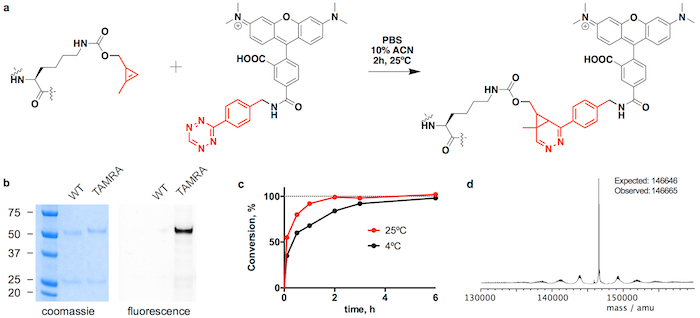
Figure 3 : Conjugaison trastuzumab(CypK)2 avec tetrazine-TAMRA. A. Inverse électron demande Diels-Alder cycloaddition entre le résidu de CypK dans l’anticorps et le dérivé tetrazine de TAMRA. B. les gels SDS-PAGE montrant l’évolution de la mobilité et la fluorescence en gel par la conjugaison de TAMRA. C. les cinétiques de conjugaison à deux températures différentes. D. Deconvoluted spectre de masse de trastuzumab(TAMRA)2. Trastuzumab(CypK)2 a été obtenu à l’aide de la lignée cellulaire stable. Ce chiffre a été modifié avec la permission de Oller-Salvia et al. 21de 2018. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
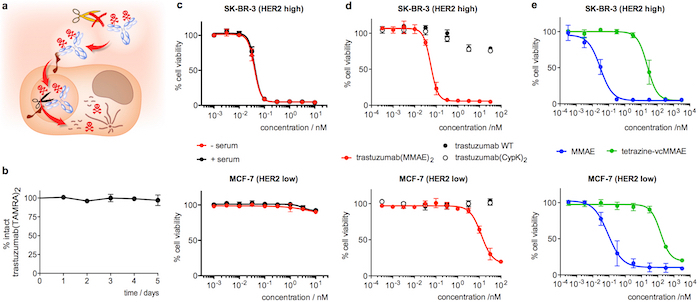
Figure 4 : stabilité dans le sérum et la cytotoxicité des conjugués de trastuzumab. A. dessin animé mettant en évidence les fonctionnalités souhaitées dans un ADC intériorisation. B. stabilité de trastuzumab(TAMRA)2 dans le sérum humain mesuré en ELISA. C. analyse de viabilité de cellules avec trastuzumab(MMAE)2 après 5 jours dans le sérum humain (+ sérum, noir). Un échantillon de contrôle incubés dans du PBS au lieu du sérum (-sérum, rouge) a été inclus dans la même épreuve. D. analyse de viabilité de cellules avec des échantillons d’anticorps fraîchement diluée. E. analyse de viabilité de cellules avec des dérivés MMAE fraîchement diluées. Barres d’erreur représentent l’écart-type de la moyenne des 3 expériences indépendantes. Ce chiffre a été modifié avec la permission de Oller-Salvia et al. 21de 2018. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
Discussion
La procédure d’expression transitoire pour produire trastuzumab(CypK)2 décrit dans le présent protocole est simple et permet de grande modularité. Les rendements obtenus sont à ceux attendus dans un cadre universitaire27 et lignées cellulaires stables peuvent être générées afin d’améliorer encore le rendement de production21. Au cours de l’expression, les concentrations de CypK inférieures à 5 mM pourra entraîner des bas incorporation de ncAA, et des montants plus élevés peuvent influer sur la croissance cellulaire et diminuer les rendements de l’anticorps. CypK comme un acide aminé libre a faible hydrosolubilité, donc il doit être tout d’abord dissous à 100 mM en NaOH 0,1 M et ensuite ajouté au milieu de culture. Après dilution CypK à moyen terme et avant de l’ajouter aux cellules, il est essentiel de neutraliser le milieu avec HCl et filtre pour stériliser. Par la suite, en utilisant des réactifs de transfection précisés dans le présent protocole et après les temps d’incubation recommandées par le fabricant est important pour une expression à haut rendement. Pour plus d’informations sur expression transitoire d’anticorps humains, on se reportera aux autres protocoles publiés31,32.
Lorsque l’anticorps est purifié, un haut excès de résine de la protéine A est requis comme il est indiqué pour assurer la pleine anticorps se déroulant du surnageant. Afin d’éviter la précipitation du trastuzumab pendant l’élution, il est recommandé d’utiliser une solution avec un tampon haute capacité, diluer immédiatement avec du PBS et d’échanger le tampon en évitant une concentration excessive. Gardez toujours l’anticorps < 5 mg/mL.
La conjugaison du trastuzumab(CypK)2 avec tetrazine-vcMMAE est plus rapide que la plupart des réactions signalées avec autres poignées bioorthogonal pour convertisseurs a/n. Par ailleurs, cette cycladdition se produit dans des conditions très douces : température ambiante ou inférieur et physiologique du pH. Il est important de diluer les solutions mères de DMSO des réactifs avec de l’acétonitrile avant l’addition de PBS et l’anticorps ; dans le cas contraire, les dérivés tetrazine précipitera. L’acétonitrile est nécessaire uniquement en raison de l’hydrophobie élevée de MMAE et TAMRA, mais moins molécules hydrophobes ne peut-être pas besoin l’ajout d’un co-solvant. Alternativement, tetrazine-vcMMAE peut se conjuguer sans l’acétonitrile et seulement 2 équivalents molaires de tetrazine-vcMMAE moins de 20 h. Cette petite quantité de toxine pourrait impliquer une diminution substantielle du coût de fabrication du connecteur Active Directory par rapport aux technologies actuelles axées sur la ncAA. Trastuzumab(CypK)2 est entièrement réactif pendant au moins 4 mois lorsque conservé à 4 ° C.
HPLC-HIC permet une détermination précise de DAR puisque MMAE est hautement hydrophobe et offre une excellente résolution des pics correspondant aux anticorps conjugués avec des toxines 0, 1 et 2. Tetrazine-vcMMAE n’a pas réagi élué environ 13,7 min et est détectée à 280 nm. Cette technique nécessite un matériel de départ avec la grande pureté. En outre, il n’est pas recommandé d’étancher la réaction avec d’autres molécules tetrazine-réactifs tels que les BCN-OH car ils peuvent modifier les temps de rétention et la forme des pics. Il est essentiel que la concentration en sel des échantillons correspond à celle dans la phase mobile au début de la pente afin d’obtenir une bonne séparation, surtout si plus de 10-20 µL sont injectées.
Concernant l’analyse de LC-MS, déglycosylation des échantillons anticorps est tenue d’obtenir un seul pic à déconvolution du spectre brut. La précision de l’anticorps total et les masses de l’ADC peut varier selon le calibrage de l’instrument. Par conséquent, afin de calculer la masse de la modification, soustrayez la masse obtenue pour les anticorps non modifiés de celui obtenu pour l’ADC. Spectromètres de masse haute résolution modernes devraient fournir une erreur relative inférieure à 1 : 10000. Bien que LC-MS peut également être utilisé pour calculer le ratio entre les différentes espèces, cette valeur est généralement une surestimation car la modification peut affecter la capacité d’ionisation des espèces produites et de faibles quantités d’impuretés ne peuvent pas être détectées.
La stabilité de l’éditeur de liens dans les convertisseurs a/n est essentielle car la sortie prématurée du médicament se traduit par la toxicité plus élevée et plus faible efficacité ; la cytotoxine gratuite endommage les tissus sains et l’anticorps nu est en concurrence avec celui armé pour les sites de fixation de cibles sur les cellules malades. Une version inférieure à 5 %, ce qui relève de la variabilité de l’essai de stabilité, devrait avoir.
Enfin, la sélectivité d’un ADC ciblant HER2 comme trastuzumab(MMAE)2 peut être évaluée en comparant la cytotoxicité dans les cellules SK-BR-3 (HER2 élevée) et les cellules MCF-7 (HER2 faible) depuis ce dernier exprimant 15 fois moins récepteurs HER2 que le premier28 . L’immunoconjugué doit se traduire en une viabilité cellulaire au moins 2 ordres de grandeur inférieurs à SK-BR-3 comparativement à MCF-7. L’EC50 SK-BR-3 devrait être dans le deux chiffres nanomolaire reflétant la forte activité de cette ADC29,30. Les anticorps non modifiés, trastuzumab(MMAE)2 ou trastuzumab, ne devrait montrer aucune toxicité dans cet essai. Tetrazine-vcMMAE devrait avoir un effet 3 ordres de grandeur plus faible que l’ADC depuis l’éditeur de liens supprime l’activité de la toxine peptidomimétiques. À l’inverse, MMAE étant en mesure d’imprégner la membrane cellulaire30, il doit avoir une toxicité semblable à l’ADC mais n’afficher aucune discrimination entre HER2 haute et basse de lignées HER2. En outre, si cet essai est effectué après 5 jours d’incubation de l’ADC dans le sérum, il peut être utilisé pour fournir une démonstration fonctionnelle de la stabilité de l’éditeur de liens : un communiqué de la toxine se traduirait en soit une diminution de l’efficacité ADC SK-BR-3 si MMAE a été libéré avec p art de l’éditeur de liens ou une diminution de la sélectivité si l’éditeur de liens a été coupée de manière chimiothèques.
La technologie ADC décrite ci-après permet l’incorporation efficace et spécifique au site d’un dérivé de cyclopropène de lysine dans IgG1s. Suite à une purification facile, les anticorps peuvent être rapidement conjugués avec des molécules contenant du tetrazine, donnant des produits homogènes. En raison de la petite taille et de la forte réactivité de la poignée de minimes cyclopropène, cette méthode devrait permettre à la conjugaison de charge utile stériquement. Les immunoconjugués qui en résultent sont stables dans le sérum et sont très puissants et très sélectifs. Dans l’ensemble, CypK permet une liaison rapide, stable et propre au site bioorthogonal pour les anticorps et autres conjugués de protéines pour être utilisé dans le traitement ou le diagnostic.
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
Ce travail a été soutenu par le Medical Research Council, UK. B.O.-S. est titulaire d’une bourse de l’EMBO (ATLF 158-2016) et remercie H. Pelham et J.W. Chin pour la prise en charge et G. Kym, C. W. Morgan et O. Perisic pour aide et conseils.
matériels
| Name | Company | Catalog Number | Comments |
| Expi293F | ThermoFisher Scientific | A14527 | HEK suspension cells |
| Expi293 Expression Medium | ThermoFisher Scientific | A1435101 | Expression medium |
| Antibiotic-antimycotic | ThermoFisher Scientific | 15240062 | Penicillin-streptomycin-amphotericin B |
| 125mL Polycarbonate Erlenmeyer Flask with Vent Cap | Corning | 431143 | Shake flasks |
| Brunswick S41i incubator | Eppendorf | S41I230011 | CO2 incubator with a shaker |
| Sodium hydroxide 4 mol/l (4 N) in aqueous solution | VWR | 191373M | |
| Cyclopropene lysine | Sichem | SC-8017 | In this study it was synthesized as described by Elliot et al. 2014 |
| Steriflip-GP, 0.22 µm, polyethersulfone, gamma irradiated | Merck Millipore | SCGP00525 | |
| Opti-MEM, Reduced Serum Medium | ThermoFisher Scientific | 31985070 | Reduced serum medium |
| ExpiFectamine 293 Transfection Kit | ThermoFisher Scientific | A14525 | Transfection reagent |
| 5810 R centrifuge | Eppendorf | 5811000460 | |
| Millex-GP Syringe Filter Unit, 0.22 µm, polyethersulfone, 33 mm, gamma sterilized | Merck Millipore | SLGP033RS | |
| Protein A resin | Sino Biological | 10600-P07E-RN-25 | |
| Poly-Prep Chromatography Columns, Pkg of 50 | Bio-Rad | 7311550 | Polypropylene chromatography column |
| Econo-Column Funnel | Bio-Rad | 7310003 | |
| Sodium citrate | Fluka | 71635 | |
| ÄKTA explorer FPLC | GE Healthcare | ||
| HiTrap HIC Selection Kit | GE Healthcare | 28-4110-07 | Includes HiTrap 1 mL Butyl HP |
| Ammonium sulfate | VWR | 2133.296 | |
| Isopropanol | Honywell | 34863-2.5L | |
| Dymethyl sulfoxide | Sigma-Aldrich | D8418-50ML | |
| Tetrazine-vcMMAE | ChemPartner | - | Costum synthesized |
| Tetrazine-5-TAMRA | Jena Bioscience | CLK-017-05 | |
| NuPAGE 4-12% Bis-Tris Gel 1.0mm x 10 well | ThermoFisherScientific | NP0321BOX | |
| Xcell SureLock Mini-Cell | ThermoFisherScientific | EI0001 | |
| UltiMate 3000 HPLC | ThermoFisherScientific | ||
| Thermo Scientific MAbPac, HIC-20, 4.6 x 100 mm, 5 µm | ThermoFisherScientific | 088553 | |
| PNGase F | New England BioLabs | P0704S | |
| NanoAcquity | Waters | ||
| C4 BEH 1-5 µm 1.0 x 100 mm UPLC column | Waters | ||
| 96-well microplates for cell culture | ThermoFisherScientific | 156545 | |
| Human serum | Sigma-Aldrich | H4522-20mL | |
| CO2 incubator | Panasonic | ||
| HER2 ECD | Sino Biological | 10004-HCCH | |
| Anti-TAMRA | Abcam | an171120 | |
| Anti-mouse HRP | Santa Cruz | sc-2005 | |
| TMB | BioLengend | 421101 | |
| Sulfuric acid | Sigma-Aldrich | 84727-500ML | |
| PHERAstar FS | BMG Labtech | Plate reader | |
| DMEM | Sigma-Aldrich | D5671-500ML | |
| SK-BR-3 | ATCC | HTB-30 | |
| MCF-7 | ATCC | HTB-22 | |
| CellTiterGlo 2.0 Assay | Promega | G9242 | Cell viability assay based on the measurement of ATP released after cell lysis. The output signal is luminscence. |
| Monomethyl Auristatin E | Cayman Chemical | 16267 | |
| NanoDrop 2000 | ThermoFisherScientific | Microvolume spectrophotometer | |
| Human IgG ELISA Quantificaiton Set | Bethyl | E80-104 | |
| MaxEnt1 in MassLynx | Waters | Software application for mass spectrum deconvolution | |
| IntantBlue | Expedeon | ISB1L | Coomassie-based stain |
| Intact MMAE-ADC ELISA Kit (Sandwich Assay) | Epitope Diagnostics, Inc. | KTR 782 | |
| Tube 50 mL, 114x28mm, PP | Sarstedt | 62.547.254 | Conical tube |
| Amicon Ultra-15 Centrifugal Filter Units 50,000 NMWL | Merck | UFC905024 | Centrifugal filtration concentrator (after protein A pull down) |
| Amicon Ultra-4 Centrifugal Filter Units 50,000 NMWL | Merck | UFC805024 | Centrifugal filtration concentrators (after FPLC or HPLC purification) |
| Zeba Spin Desalting Columns, 7K MWCO, 0.5 mL | ThermoFisherScientific | 89882 | Size exclusion spin columns |
| Tube PCR 0.2ml Flat Cap | Thistle Scientific Ltd | AX-PCR-02-C-CS | PCR tubes |
| Nunc MaxiSorpª flat-bottom | ThermoFisherScientific | 44-2404-21 | Plates for ELISA |
Références
- Beck, A., Goetsch, L., Dumontet, C., Corvaia, N. Strategies and challenges for the next generation of antibody-drug conjugates. Nature Reviews Drug Discovery. 16 (5), 315-337 (2017).
- Wakankar, A. A., et al. Physicochemical Stability of the Antibody−Drug Conjugate Trastuzumab-DM1: Changes due to Modification and Conjugation Processes. Bioconjugate Chemistry. 21 (9), 1588-1595 (2010).
- Stan, A. C., Radu, D. L., Casares, S., Bona, C. A., Brumeanu, T. -. D. Antineoplastic Efficacy of Doxorubicin Enzymatically Assembled on Galactose Residues of a Monoclonal Antibody Specific for the Carcinoembryonic Antigen. Cancer Research. 59 (1), 115-121 (1999).
- Hamblett, K. J., et al. Effects of Drug Loading on the Antitumor Activity of a Monoclonal Antibody Drug Conjugate. Clinical Cancer Research. 10 (20), 7063-7070 (2004).
- Chari, R. V. J., Miller, M. L., Widdison, W. C. Antibody-Drug Conjugates: An Emerging Concept in Cancer Therapy. Angewandte Chemie International Edition. 53 (15), 3796-3827 (2014).
- Chin, J. W. Expanding and Reprogramming the Genetic Code. Nature. 550 (7674), 53-60 (2017).
- Axup, J. Y., et al. Synthesis of Site-Specific Antibody-Drug Conjugates Using Unnatural Amino Acids. Proceedings of the National Academy of Sciences of the United States of America. 109 (40), 16101-16106 (2012).
- Hallam, T. J., Wold, E., Wahl, A., Smider, V. V. Antibody Conjugates with Unnatural Amino Acids. Molecular Pharmaceutics. 12 (6), 1848-1862 (2015).
- Tian, F., et al. A General Approach to Site-Specific Antibody Drug Conjugates. Proceedings of the National Academy of Sciences of the United States of America. 111 (5), 1766-1771 (2014).
- Kern, J. C., et al. Discovery of Pyrophosphate Diesters as Tunable, Soluble, and Bioorthogonal Linkers for Site-Specific Antibody-Drug Conjugates. Journal of the American Chemical Society. 138 (4), 1430-1445 (2016).
- Zimmerman, E. S., et al. Production of Site-Specific Antibody-Drug Conjugates Using Optimized Non-Natural Amino Acids in a Cell-Free Expression System. Bioconjugate Chemistry. 25 (2), 351-361 (2014).
- VanBrunt, M. P., et al. Genetically Encoded Azide Containing Amino Acid in Mammalian Cells Enables Site-Specific Antibody-Drug Conjugates Using Click Cycloaddition Chemistry. Bioconjugate Chemistry. 26 (11), 2249-2260 (2015).
- Xiao, H., et al. Genetic Incorporation of Multiple Unnatural Amino Acids into Proteins in Mammalian Cells. Angewandte Chemie International Edition. 52 (52), 14080-14083 (2013).
- Milles, S., et al. Click Strategies for Single-Molecule Protein Fluorescence. Journal of the American Chemical Society. 134 (11), 5187-5195 (2012).
- Lallana, E., Riguera, R., Fernandez-Megia, E. Reliable and Efficient Procedures for the Conjugation of Biomolecules through Huisgen Azide-Alkyne Cycloadditions. Angewandte Chemie International Edition. 50 (38), 8794-8804 (2011).
- Koehler, C., et al. Genetic Code Expansion for Multiprotein Complex Engineering. Nature Methods. 13 (12), 997-1000 (2016).
- Lyon, R. P., et al. Reducing Hydrophobicity of Homogeneous Antibody-Drug Conjugates Improves Pharmacokinetics and Therapeutic Index. Nature Biotechnology. 33 (7), 733-735 (2015).
- Elliott, T. S., et al. Proteome Labeling and Protein Identification in Specific Tissues and at Specific Developmental Stages in an Animal. Nature Biotechnology. 32, 465-472 (2014).
- Ravasco, J. M. J. M., Monteiro, C. M., Trindade, A. F. Cyclopropenes: A New Tool for the Study of Biological Systems. Organic Chemistry Frontiers. 4 (6), 1167-1198 (2017).
- Yang, J., Šečkutė, J., Cole, C. M., Devaraj, N. K. Live-Cell Imaging of Cyclopropene Tags with Fluorogenic Tetrazine Cycloadditions. Angewandte Chemie International Edition. 124 (30), 7594-7597 (2012).
- Oller-Salvia, B., Kym, G., Chin, J. W. Rapid and Efficient Generation of Stable Antibody-Drug Conjugates via an Encoded Cyclopropene and an Inverse-Electron-Demand Diels-Alder Reaction. Angewandte Chemie International Edition. 57, 2831-2834 (2018).
- Schmied, W. H., Elsässer, S. J., Uttamapinant, C., Chin, J. W. Efficient Multisite Unnatural Amino Acid Incorporation in Mammalian Cells via Optimized Pyrrolysyl tRNA Synthetase/tRNA Expression and Engineered eRF1. Journal of the American Chemical Society. 136 (44), 15577-15583 (2014).
- Junutula, J. R., et al. Site-Specific Conjugation of a Cytotoxic Drug to an Antibody Improves the Therapeutic Index. Nature Biotechnology. 26 (8), 925-932 (2008).
- Junutula, J. R., et al. Rapid Identification of Reactive Cysteine Residues for Site-Specific Labeling of Antibody-Fabs. Journal of Immunological Methods. 332 (1), 41-52 (2008).
- Doronina, S. O., et al. Development of potent monoclonal antibody auristatin conjugates for cancer therapy. Nature Biotechnology. 21 (7), 778-784 (2003).
- Shiraishi, Y., et al. Identification of Highly Reactive Cysteine Residues at Less Exposed Positions in the Fab Constant Region for Site-Specific Conjugation. Bioconjugate Chemistry. 26 (6), 1032-1040 (2015).
- Sabourin, M., et al. Increasing Antibody Yield and Modulating Final Product Quality using the Freedom(TM). CHO-S(TM) Production Platform. BMC Proceedings. 5 (8), 102 (2011).
- Xiao, Y., Gao, X., Maragh, S., Telford, W. G., Tona, A. Cell Lines as Candidate Reference Materials for Quality Control of ERBB2 Amplification and Expression Assays in Breast Cancer. Clinical Chemistry. 55 (7), 1307-1315 (2009).
- Shinmi, D., et al. One-Step Conjugation Method for Site-Specific Antibody-Drug Conjugates through Reactive Cysteine-Engineered Antibodies. Bioconjugate Chemistry. 27 (5), 1324-1331 (2016).
- Badescu, G., et al. Bridging Disulfides for Stable and Defined Antibody Drug Conjugates. Bioconjugate Chemistry. 25 (6), 1124-1136 (2014).
- Vazquez-Lombardi, R., et al. Transient expression of human antibodies in mammalian cells. Nature Protocols. 13 (1), 99-117 (2018).
- Baldi, L., Hacker, D. L., Meerschman, C., Wurm, F. M., Hartley, J. L. . Protein Expression in Mammalian Cells: Methods and Protocols. , 13-26 (2012).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon