Method Article
Генетического кодирования неканонических аминокислоты для поколения антител наркотиков конъюгатов через реакцию быстро Bioorthogonal
В этой статье
Резюме
Включение cyclopropene производное лизина в антител позволяет участкам, быстрой и эффективной связи молекул тетразина подшипник для создания антител наркотиков конъюгатов.
Аннотация
Антитела наркотиков конъюгатов (ADCs) используется в настоящее время в клинической практике являются смесями молекул антитела связаны с различной количество токсинов в разных позициях. Доклинические исследования показали, что терапевтический индекс этих традиционных АЦП может быть улучшена путем конкретных связей токсинов. Однако нынешние подходы для получения однородной АЦП имеют ряд ограничений, например низкопротеиновое выражение и медленной реакции кинетики. В этом протоколе мы описывают, как настроить систему выражение для включения cyclopropene производное лизина (CypK) в антител с использованием генетического кода расширения. Этот минимальный bioorthogonal ручка позволяет быстрое спряжение производных тетразина через обратное спрос Дильса-Альдера циклоприсоединения. Система выражение здесь сообщили позволяет легким производства и очистки трастузумаб подшипник CypK в каждом из тяжелых цепей. Мы объясним, как связать антитела к auristatin токсин монометиловый E и характеризуют immunoconjugate гидрофобные взаимодействия хроматографии и масс-спектрометрии. Наконец мы описываем анализов для оценки стабильности в человеческой сыворотке dihydropyridazine связь, результате спряжения и тестирования селективного цитотоксичность АЦП для клеток рака молочной железы с высоким уровнем рецептора HER2.
Введение
Антитела наркотиков конъюгатов (ADCs) сочетают избирательность применения инновационных технологий биотерапевтических и потенции малых цитотоксических молекул. Большинство АЦП цель уменьшить побочные эффекты традиционной химиотерапии по ориентации препаратов, которые влияют на ДНК или микротрубочек полимеризации для раковых клеток1. Первого поколения АЦП, утвержденных Продовольственной и лекарствами (FDA) полагаться на модификации lysines и которым, который генерирует смеси молекул, изменения в различных позициях с снижение фармакокинетические свойства2. Напротив участкам глагольных форм препаратов для антител может генерировать соединений с более терапевтические показатели3,4. Стремясь решить проблему производства однородного АЦП, несколько селективного химических и ферментативной изменения были сообщил1,5. Однако текущие методы могут целевой только определенные позиции на антитела, страдают от низкой белков, предоставляют линкеры с низкой стабильностью или полагаться на медленных и низкодоходных реакций.
Включение неканонических аминокислот (ncAA) путем расширения генетического кода позволяет участкам установки множества bioorthogonal реактивной групп в белки, потенциально преодолеть ограничения других методов, используемых для создания АЦП. Кодирование ncAAs в ответ целевого (остановка) кодон опирается на аминоацил тРНК синтетазы/tRNA пар, которые перпендикулярны эндогенного пар, которые включают6канонических аминокислоты. Несколько ncAAs были включены в антитела для создания АЦП. Однако наиболее страдают от различных обязательств для приложений в спряжение лечебного препарата. p-acetylphenylalanine (ЧАКФ)7,8 не является полностью bioorthogonal, требует низкого pH (4.5) и долгое время реакции (> 60 h), а азиды например, p-azidophenylalanine (pAzF)7,9,10, p-azidomethylphenylalanine (pAMF)11и азид производная лизина (АЗК)12,13 может быть уменьшена в ячейке14, и медь, используемый для ускорения Huisgen cycloadditions может вызвать окислительного повреждения 15.
Хотя альтернативные ncAAs основана на транс cyclooctene (TCO), cyclooctyne (SCO) и nonene бицикло [6.1.0] (BCN) недавно зашифрованных в антитела для целей био изображений, выражение система страдает от очень низкая урожайность (0,5 мг/Л)16. Кроме того cyclooctenes и cyclooctynes являются большими и гидрофобных маркеры, которые могут повысить восприимчивость АЦП для агрегации -ADC нагрузок традиционно гидрофобных и физико-химических свойств компоновщика было показано, значительно влияние фармакокинетики и терапевтический индекс17. В отличие от 1,3-disubstitued cyclopropenes являются небольшие реактивные группы, которые должны вызвать минимальные изменения в протеин структуры и physichochemical свойства18. Cyclopropenes выборочно и быстро реагируют с tetrazines через обратные электрон спрос Дильса-Альдера циклоприсоединения19. В этом протоколе мы делаем использование производных лизина (CypK, рис. 1b) подшипник метил cyclopropene, что является менее пострадавших от их пространственной помехой, чем больших напряженный ненасыщенных циклов и имеет константа скорости реакции порядка 1-30 М-1с -1 в водной среде18,20.
Недавно мы сообщали, как включить CypK в антитела для создания АЦП, реагируя ручка этот минимальный bioorthogonal с тетразина подшипник молекул21. Здесь мы описываем процедуры подготовки ADC более подробно с упором на самых сложных шагов. Включение CypK направляется с помощью pyrrolysyl ТРНК синтетазы (PylRS) / tRNACUA(PylT) пара в ответ на янтарь кодон, введена в тяжелых цепей антитела (HC)22. Здесь мы используем два плазмиды для переходных трансфекции (Рисунок 1a), кодирование тяжелых цепей антитела и другие кодировки лёгкие цепи (LC), оба содержащих кассеты PylRS/PylT. Кроме того стабильные клеточная линия, которая позволяет более высокие урожаи антитела могут быть созданы через более трудоемкая процедура21.
Вышеупомянутые выражения системы может производить терапевтического анти HER2 иммуноглобулина 1 (IgG1) трастузумаб с CypK на аналогичных уровнях к антителу дикого типа. Мы выбрали первое положение CH1 домена на тяжелые цепи для кодирования ncAA (HC-118TAG). Это чаще всего измененного сайта в АЦП23 и известен как HC-118 (нумерация ЕС) но также упоминаемые как HC-121 (последовательность позиции) и HC-114 (Kabat нумерация)24. Поскольку эта позиция сохраняется на протяжении всех IgG1s, эти системы выражения должны подпадать наиболее терапевтических антител.
Мы покажем, что trastuzumab(CypK)2 может быть легко неразделимая белка следуют быстро белок жидкостной хроматографии со столбцом гидрофобные взаимодействия (ПСОК-HIC). Впоследствии антитела ковалентно связан в течение 3 ч для микротрубочек полимеризации ингибитор монометиловый auristatin E (MMAE), который используется в FDA утвержденных АЦП Adcetris. Здесь мы используем производная бензил тетразина MMAE (тетразина vcMMAE) с компоновщик составе glutarate прокладку и валин цитруллин протеаз лабильного компонента группой p- aminobenzylalcohol self-immolative; Этот компоновщик расщепляется, катепсин B в Лизосома по интернализации АЦП, что приводит к бесследного выпуска токсин25. Для того чтобы показать широкий спектр реакции, антитела связано также с Флюорофор тетраметилродамина (ТАМРА). Мы объясним, как проверить личность сопряженное с жидкостной хроматографии в сочетании с масс-спектрометрия (LC-MS) и рассчитать коэффициент наркотиков антитела (дар) с помощью высокопроизводительной жидкостной хроматографии со столбцом гидрофобные взаимодействия (ВЭЖХ-HIC) .
В рамках характеристики производительности антитела мы опишем, как для тестирования стабильности связи dihydropyridazine в сыворотке крови человека. Этот параметр более легко оценивается в трастузумаб ТАМРА, потому что она может быть определена количественно простой ELISA и интерпретации результатов не осложняется протеазы лабильных компонентов trastuzumab(MMAE)2. Наконец избирательности и потенции trastuzumab(MMAE)2 оценивается путем сравнения cytoxicity АЦП через клеточные линии, выражая различные уровни HER2. Этот assay также предоставляет функциональный доказательство ADC стабильности при выполнении после инкубации immunoconjugate в сыворотке крови человека.
протокол
1. Подготовка и характеризуют антитела
- Экспресс антитела
- Оттепель флакон ГЭС подвеска клеток в 250 мл флакон, содержащий 50 мл выражение среды дополняется 100 единиц/мл пенициллин, 100 мкг/мл стрептомицина и 250 нг/мл амфотерицин B. Держите клетки при 37 ° C с 8% CO2 в увлажненный инкубаторы оборудованы с шейкер на 125 об/мин. Разбиение ячеек на 0,3-0,5 x 106 клеток/мл (каждые 2-3 дня) по крайней мере 2 раза до transfecting.
- Когда плотность 2,5 х 106 клеток/мл достиг (2-3 дня после разделения), готовят свежий раствор 100 мм CypK. Для этой цели весят 64 мг CypK, добавить 2,5 мл 0,1 гидроксида натрия, вихревые, спин вниз восстановить все нерастворенных частиц и sonicate.
- Добавьте 2,5 мл CypK (100 мм в 0,1 М NaOH) 42.5 мл выражение среды с антибиотиками. Хорошо перемешать, добавить 250 мкл 0,1 М HCl и стерилизации с помощью фильтра 0.22 мкм.
- Развести 50 мкг HC и LC pKym1 плазмид21 по 2,5 мл с сокращение сыворотке среднего. В отдельном трубку разбавляют 135 мкл Реагента трансфекции до 2,5 мл с сокращение сыворотке среднего.
- Через пять минут после подготовки решения, смешать плазмиды и раствора реагента transfection и инкубировать на 20 минут позволить образование комплексов между ДНК и трансфекции реагента.
- В то же время центрифуга 125 миллионов клеток в целевой плотности 5 мин на 500 x g, Ресуспензируйте с средство выражения, содержащие CypK и добавить ДНК – трансфекции смеси реагентов. CypK могут быть приобретены или синтезированных как сообщалось ранее,18.
- После инкубации клеток для 20 h, 250 мкл трансфекции реагент усилители включены в комплект.
- Урожай антитела от супернатанта 6-7 дней после добавления CypK (не требуется вносить изменения среды во время выражения).
* Кроме того чтобы получить урожайность выше и более последовательной, стабильной линии клетки могут создаваться как описано в Оллер-Сальвиа et al. 201821. В этом случае просто путем добавления CypK 5 мм в среде выражение выражается trastuzumab(CypK)2 .
- Очищение антитела
- Центрифуга для ячейки 15 мин на 3000 x g.
- Фильтр супернатант с 0,45 или фильтра 0.22 мкм. Если фильтр становится закрыта, замените его на новый и продолжить фильтрацию. Если это произойдет после лишь несколько миллилитров, центрифуга супернатант дополнительные 15 мин на 7000 x g.
- Добавить белка A смолы (2 мл/100 мл супернатант) в столбец пустой полипропиленовые хроматографии и сбалансировать смолы с по крайней мере 5 томов шарик мыть буфера (фосфат натрия 0,1 М, 150 мм NaCl).
- Супернатант разделить два 50 мл конические трубы и добавьте 5 x шарик мыть буфера (фосфат натрия 0,5 М, 150 мм NaCl) следуют предварительно уравновешенной белка А смолы. Место конические пробки на ролике за 3 ч при комнатной температуре, чтобы тянуть вниз антител в надосадке.
В качестве альтернативы: Добавить супернатант в столбце с по крайней мере двойной рекомендуемый объем смолы и позволить течь через. Убедитесь, что не существует значительное количество антител слева в надосадке на SDS-PAGE. Если есть, элюировать супернатант через смолы еще раз. - Передача белок А смолы с супернатант в столбец и позволяют жидкости через.
- Добавить 25 мл буфера мытья (или по крайней мере 10 смолы томов) и позволить течь через.
- Элюировать антитела с 4 мл 0,1 М натрия цитрата, рН 3, по 1 мл раствора фосфатного буфера 1 М, 150 мм NaCl.
- Разбавьте антитела с 10 мл PBS, концентрата на 0,5-1 мл центробежной фильтрации, и буфер обмена в три раза с PBS.
- Очистить образцы по ПСОК, используя столбец МКХ бутила с потоком 0,5 мл/мин и 0-100% градиент в 30 мин низким соли буфера (50 мм натрия фосфат pH 7.0, 20% изопропиловый спирт) в буфере высоким соли (1,5 М (NH4)2т4, 50 мм натрия фосфат pH 7.0 5% изопропиловый спирт). Собрать все фракции и контролировать элюции в 280 Нм. Небольшие суммы (< 1 мг) могут быть очищены с ВЭЖХ-HIC на условиях, описанных в 2.4 увеличить урожайность и чистоты.
- Бильярд фракции, которые содержат антитела, развести их по крайней мере 4 мл с PBS, сконцентрировать их буфером центробежной фильтрации и обмен три раза с PBS.
- Количественное определение антител
- Получить Приблизительные концентрации путем измерения оптической плотности на 280 Нм, используя спектрофотометр микро Тома.
- Если требуется точное измерение, используйте набор ELISA для измерения человеческого IgGs. По приблизительным оценкам используйте SDS-PAGE с пятно на основе Кумасси следующим образом:
- Подготовка стандартов путем разбавления шесть раз два раза трастузумаб стандартных количественно ELISA в 1 мг/мл.
- Отварите стандарты и образцы на приблизительно 0,25 мг/мл в сокращении загрузки буфера.
- Запускать их в бис-трис SDS-PAGE 4-12% с помощью MES-SDS буфер и пятно с краской на основе Кумасси. И наконец измерить Плотность цвета группы, соответствующий свет или тяжелые цепи, используя ImageJ и интерполировать сигнал от образцов в калибровочной кривой.
- Магазин антител при 4 ° C.
2. Конъюгат антител и характеризуют АЦП
- Конъюгат антител с молекулой тетразина подшипник
- Разбавляют 20 мкл ацетонитриле и 76 мкл PBS в небольшой Конические трубки (например,ПЦР-пробирку) 10 Молярная эквиваленты тетразина vcMMAE (4 мкл, 3,4 мм в диметилсульфоксида (ДМСО)).
- Добавить 1 Молярная эквивалент trastuzumab(CypK)2 (100 мкл, 2 мг/мл в PBS), тщательно перемешать и позволяют реагировать на 3 ч при комнатной температуре (25 ° C) в форме trastuzumab(MMAE)2.
Примечание: Другие молекулы, такие как тетразина-5-ТАМРА могут быть связаны с антителом вместо тетразина vcMMAE, используя этот протокол.
- Очистить АЦП
- Предварительно сбалансировать размер столбца исключение спин с PBS следуя инструкциям производителя.
- Добавьте весь объем реакции на спин столбец и центрифуги на 1500 x г за 1 мин.
- Количественно ADC и анализировать конъюгата, SDS-PAGE
- Количественно ADC, как описано в 1.3.2. измеряя Плотность цвета лёгкие цепи на SDS-PAGE с использованием антител-модифицированные для стандартной кривой.
- Тяжелые цепи должны перешли слегка показаны увеличение в молекулярном весе после сопряжения.
Примечание: Если антитела изменяется с Флюорофор такие как в trastuzumab(TAMRA)2, только группа соответствует тяжелой цепи должны показать флуоресценции в гель до окрашивания.
- Анализировать конъюгата, ВЭЖХ-HIC
- Сбалансировать ВЭЖХ-HIC столбец с 100% буфера A (1,5 М (NH4)2т4, 50 мм натрия фосфат pH 7.0, 5% изопропиловый спирт) за 5 мин.
- Смесь 15 мкл (67 пмоль) 1 мг/мл раствора трастузумаб (CypK) 2 с 2 x 15 мкл буфера В ампулу. Затем программа 10 мкл инъекций в HPLC.
- Элюировать в потоке Изократические 1 мл/мин с буфером A 100% за 1 мин, следуют 15 мин градиент от 100 до 0% буфера A в B (50 мм натрия фосфат pH 7.0, 20% изопропиловый спирт). Контролировать элюции при 280 Нм.
- Вычислите дар путем интеграции пик соответствующий для каждого вида и с помощью результирующей области в следующем уравнении:
Дар = (1 x trastuzumab(MMAE) + trastuzumab(MMAE) 2 x2)
/(Trastuzumab(MMAE)0 + trastuzumab(MMAE)1 trastuzumab(MMAE)2)
Ожидается сохранение время для trastuzumab(CypK)2 -7,5-8,0 мин, трастузумаб (CypK, MMAE) — 9.1-9,6 мин, и для trastuzumab(MMAE)2 -10,5-11,0 мин.
- Анализировать конъюгата, LC-MS
- Deglycosylate 30 мкл 1 мг/мл ADC и неизмененной антитела в-уменьшение условия с использованием 250 единиц PNGase F для по крайней мере в 6 ч при 37 ° C.
- Элюировать антитела в масс-спектрометр в C4 1-5 мкм 1.0 x 100 мм столбца с использованием градиента 20 мин от 2% до 80% Ацетонитрил в воде. Получение данных диапазоне m/z 350-4000 в режиме положительный ион с конуса напряжение 150В.
- Deconvolute исходных данных с использованием соответствующего программного обеспечения. Вычислите разницу в массы между измененный и неизмененной антител.
3. assay стабильность связи Dihydropyridazine в2 Trastuzumab(TAMRA) в сыворотке
- Фильтрация сыворотки, с помощью фильтра 0.22 мкм в стерильных условиях. Можно добавить 100 единиц/мл пенициллина и стрептомицина 100 мкг/мл.
- Заполните внешней скважин 96-луночных плиты с водой. В центре скважин Смешайте в трех экземплярах 90 мкл отфильтрованных сыворотки с 10 мкл 1 мг/мл trastuzumab(TAMRA)2 в PBS в конечной концентрации 0,1 мг/мл. Место пластину в инкубаторе, насыщенных с влажность при 37 ° C и 4-5% CO2.
- Каждые 24 часа на протяжении 5 дней, накапайте каждый хорошо тщательно смешать, принять 5 мкл аликвота, флэш замораживание жидким азотом и хранить при температуре-80 ° C.
- После того, как все образцы были собраны, оттепель аликвоты и анализировать с помощью косвенных ELISA как ранее сообщила12 с некоторыми изменениями:
- Слой 96-луночных пластины на ночь с 0,25 мкг/мл HER2 на 4 ° C. Все другие шаги выполняются при комнатной температуре.
- На следующий день 5 раз промойте PBS 0,05% анимации (PBS-T) и блок с бычьим сывороточным альбумином 1% за 1 час.
- Вымойте и Проинкубируйте образцы при разбавлении 1: 10000 в PBS на 2 ч.
- Вымойте и инкубации антитела анти ТАМРА вырос в мышь при разбавлении 1: 2000 в PBS-T с BSA 0,5% за 1 час.
- Вымойте и инкубировать анти мыши HRP конъюгата 1: 1000 в PBS-T с BSA 0,5% за 1 час.
- Добавить ТМБ и позволяют реагировать 5-10 мин.
- Так что остановить реакции с 50 мкл H24 1 М и измерения поглощения на 450 Нм. Вычитание фона, измеренных в 570 Нм.
- Установите 4-параметр логистической регрессии кривая для стандартных растворов и интерполяция измерений из образцов.
Примечание: Стабильность trastuzumab(MMAE)2 можно было бы оценить используя тот же протокол, изменив assay, описанные в 3.3 для коммерческих комплект ELISA для измерения концентрации ADC.
4. оценить цитотоксичность АЦП
Примечание: Этот протокол основан на23,сообщалось ранее анализов26 с некоторыми изменениями.
- Оттепель SK-BR-3 и клетками MCF-7 и позволять им селиться в p25 флаконы, содержащие полного среднего, т.е. что DMEM дополнена 10% тепла инактивированная плода бычьим сывороточным, 100 единиц/мл пенициллина и стрептомицина 100 мкг/мл.
- Разбиение ячеек на 80-90% слияния (каждые 3-4 дня) по крайней мере 2 раза до assay.
- За два дня до assay, заполните внешней скважин 96-луночных плиты с водой. Затем подъем клетки с 0,05% трипсина в 0,5 мм ЭДТА, центрифуги 3 мин на 250 x g, Ресуспензируйте в новой среде и семян 3000 клетки в 100 мкл в (пусто) колодец в 96-луночных пластины.
- Через два дня после заполнения ячеек, подготовьте 10 серийных разведений всех образцов с 0.1% ДМСО в полной среды в трех экземплярах. Рассмотрим следующие примеры и элементы управления: trastuzumab(MMAE)2, trastuzumab(CypK)2, трастузумаб дикого типа, тетразина vcMMAE и MMAE.
- 100 мкл каждого образца в каждой скважине и инкубировать в течение 5 дней при 37 ° C и 4-5% CO2.
- На 5 день Измерьте жизнеспособность клеток. С этой целью используйте коммерческие kit Лизируйте клетки и измерить выпустила СПС. Участок процент сигнала в отношении управления клетках, обработанных с 0,1% ДМСО.
Примечание: АЦП может быть инкубировали в течение 5 дней в сыворотке и assayed для цитотоксичность доказать функциональных стабильности.
Предупреждение: MMAE высоко токсичен. Поэтому используйте перчатки и защитные очки при работе с MMAE производных. Если вы используете неизмененном MMAE как элемент управления в эксперименте, когда вы подготовить раствор в ДМСО, обработайте твердый продукт внутри зонта.
Результаты
Сообщения о переходных выражение системы (рис. 1a) дает 22 ± 2 мг2 trastuzumab(CypK) за литр питательной среды, которая составляет 2/3 дикого типа антитела производится на тех же условиях (рис. 1С). Стабильные клеточная линия может увеличить этот выход до 31 ± 2 мг/Л21.
Trastuzumab(CypK)2 может быть проспряганное с тетразина vcMMAE, который дает квази однородной trastuzumab(MMAE)2 в течение 3 ч при 25 ° C (рис. 2). Высокая гидрофобность этот cytotoxin требует добавления 10% Ацетонитрил когда 5 или более Молярная эквиваленты токсина в CypK используются. Кроме того циклоприсоединения также завершается в течение 20 мин с использованием 2 эквиваленты тетразина vcMMAE без Ацетонитрил (рис. 2 c). Trastuzumab(CypK)2 реагирует с тетразина ТАМРА в течение 2 ч при 25 ° C и 3-6 ч необходимы, когда температура уменьшается до 4 ° C (рис. 3 c).
Ожидаемые дар для trastuzumab(MMAE)2 измеряется ВЭЖХ-HIC это 1.9 (рис. 2b). Пик, первоначально наблюдается в хроматограмму в 8.0 мин представляет неконъюгированной антитела (Дар 0) и должен полностью исчезли после завершения реакции. Виды с 1 дар elutes в 9,1-9,6 мин и должны иметь области < 10% через 3 ч; и целевой продукт с дар 2 имеет срок хранения 10,5-11,0 с ожидаемым область > 90%. Перенос удобоподвижности и флуоресценции в гелях SDS-PAGE подтверждает, что включение ТАМРА (рис. 3b) и личность immunoconjugates проверяется LC-MS (Рисунок 2d-e и 3d рисунок).
Инкубационный trastuzumab(TAMRA)2 для 5 дней в сыворотке крови человека и последующего анализа ELISA подтверждает, что полезная нагрузка остается прикрепленным к антитела (Рисунок 4b). Что касается анализа цитотоксичности, trastuzumab(MMAE)2 показывает высокие потенции в SK-BR-3 (HER2 высокий) груди раковые клетки, с половины максимальной эффективной концентрации (50EC) 55 ± 10 вечера (рис. 4 d). Trastuzumab(MMAE)2 поддерживает цитотоксичность после 5 дней инкубации в сыворотке крови человека (рис. 4 c). И наоборот, когда ADC assayed MCF-7 (низкий уровень HER2) ЕС50 200-fold ниже (Рисунок 4 d). Дикого типа антитела, trastuzumab(CypK)2 и тетразина vcMMAE показывают чрезвычайно низкую токсичность (рисунки 4 d и 4e), тогда как MMAE отображает высокий неизбирательной цитотоксичность в обеих линий клетки (Рисунок 4e).
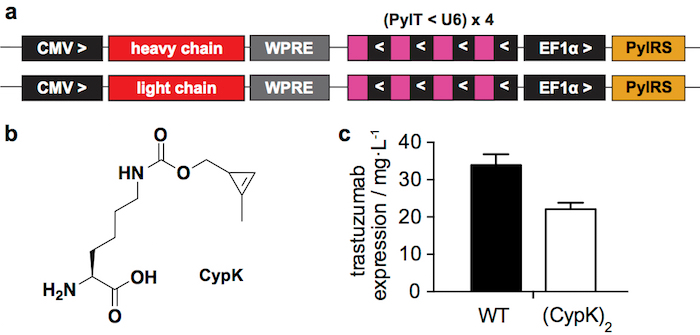
Рисунок 1: система переходных выражение. A. соответствующих регионов плазмид, используется для переходных трансфекции в HEK293 клетках. ЦМВ: цитомегаловирус промоутер, WPRE: сурок гепатитом вирус посттранскрипционного регулирования элемент, PylT: pyrrolysyl тРНК, U6: конкретной промоутера, PylRS: pyrrolysil ТРНК синтетазы, > и <: направление транскрипции. B. Nε-[((2-methylcycloprop-2-en-1-yl)methoxy)carbonyl]-L-lysine (CypK). C. выражение дает из дикого типа (WT) трастузумаб и trastuzumab(CypK)2 измеряемая в западной помарки после белка очистки. Планки погрешностей представляют собой стандартное отклонение биологических triplicates. Эта цифра была изменена с разрешения Оллер-шалфей и др. 201821. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
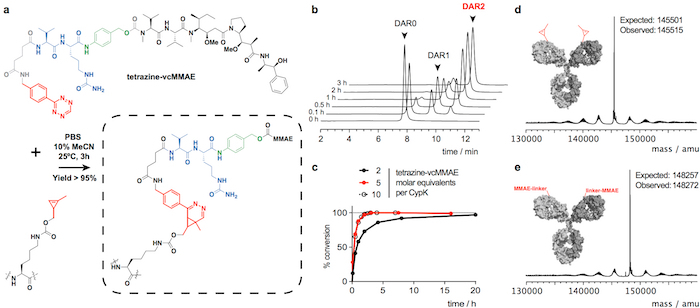
Рисунок 2: Спряжение2 trastuzumab(CypK) с тетразина vcMMAE. A. обратное электрон спрос Дильса-Альдера циклоприсоединения между CypK остатков в антитела и тетразина производное MMAE. Реагирующих групп выделяются красным цветом, p- aminobenzylalcohol изображен в зеленый и валин цитруллин дипептид синим цветом. B. ВЭЖХ-HIC хроматограммы показаны хода спряжение антител. C. степень конверсии в отношении максимальной дар 1.9, с использованием различных реагентов концентрации. D-E. Deconvoluted массовых спектры полнометражного антитела до и после сопряжения. Trastuzumab(CypK)2 был получен с помощью стабильных ячейки строки. Эта цифра была изменена с разрешения Оллер-шалфей и др. 201821. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
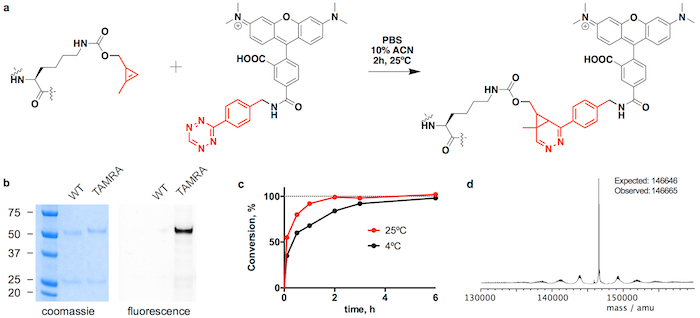
Рисунок 3: Спряжение2 trastuzumab(CypK) с тетразина ТАМРА. A. обратное электрон спрос Дильса-Альдера циклоприсоединения между CypK остатков в антитела и тетразина производная ТАМРА. B. SDS-PAGE гели, показаны перенос удобоподвижности и флуоресценции в гель, возникла путем конъюгации ТАМРЕ. C. спряжение кинетика в двух разных температурах. D. Deconvoluted массовых спектр trastuzumab(TAMRA)2. Trastuzumab(CypK)2 был получен с помощью стабильных ячейки строки. Эта цифра была изменена с разрешения Оллер-шалфей и др. 201821. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
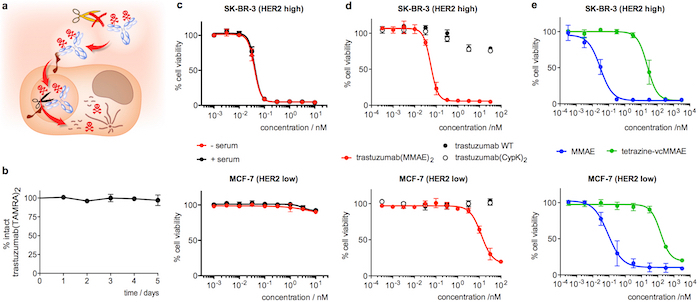
Рисунок 4: стабильность в сыворотке и цитотоксичность трастузумаб конъюгатов. A. мультфильм, подчеркнув опции в интернализации ADC. B. устойчивость2 trastuzumab(TAMRA) в сыворотке крови человека как измеряется в ELISA. C. assay жизнеспособности клетки с2 trastuzumab(MMAE) после 5 дней в сыворотке крови человека (+ сыворотка, черный). Образец элемента управления инкубировали в PBS вместо сыворотки (-сыворотки, красный) был включен в же assay. D. assay жизнеспособности клетки с образцами свежезаваренным разбавленные антитела. Е. жизнеспособность assay клетки с свежезаваренным разбавленных MMAE производных. Планки погрешностей представляют Среднеквадратичная ошибка среднего 3 независимых экспериментов. Эта цифра была изменена с разрешения Оллер-шалфей и др. 201821. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
Обсуждение
Процедура переходных выражение производить trastuzumab(CypK)2 указанных в настоящем Протоколе прост и позволяет высокая модульность. Полученные урожаи находятся в пределах тех ожидается в академической обстановке27 и стабильных клеточных линий могут быть сгенерированы для дальнейшего повышения доходности производства21. Во время выражения концентрации CypK ниже чем 5 мм может привести к нижней ncAA включение, и более высокие суммы могут повлиять на рост клеток и снижение урожайности антитела. CypK как свободных аминокислот обладает низкой растворимостью, поэтому он должен быть сначала растворяют в 100 мм в 0,1 М NaOH и затем добавлены в среде культуры. После разбавления CypK в средне- и перед его добавлением в клетки, критически важно для нейтрализации в среду с HCl и фильтр для стерилизации. Впоследствии с использованием реагентов трансфекции указанных в настоящем Протоколе и после инкубации раз, рекомендованный производителем важное значение для выражения, высокопродуктивный. Для получения более подробной информации о переходных выражение человеческих антител читатель отсылался к других опубликованных протоколов31,32.
Когда очищенные антитела, высокий избыток белка А смолы является обязательным, как указано для обеспечения полного антитела тянуть вниз от супернатант. Во избежание осадков трастузумаб течение элюции, рекомендуется использовать решение с высокой буферизации ёмкости, сразу же разбавляют PBS и обмениваться буфера, избегая чрезмерной концентрации. Всегда держите антитела < 5 мг/мл.
Спряжение2 trastuzumab(CypK) с тетразина vcMMAE быстрее, чем большинство реакций, сообщили с другими bioorthogonal ручками для АЦП. Кроме того, этот cycladdition происходит в очень мягких условиях: при комнатной температуре или ниже и физиологических рН. Важно разбавить ДМСО фондовых растворов реагентов с Ацетонитрил перед добавлением PBS и антител; в противном случае будет выпадать в осадок тетразина производные. Ацетонитрил требуется только из-за высокой гидрофобность ТАМРА и MMAE, но менее гидрофобные молекулы не может понадобиться добавление совместного растворителя. Кроме того тетразина vcMMAE может быть конъюгированных без ацетонитриле и только 2 Молярная эквиваленты тетразина vcMMAE в течение 20 ч. Этот маленький количество токсина может включать существенное снижение стоимости производства АЦП по сравнению с текущей технологии, основанные на ncAA. Trastuzumab(CypK)2 полностью реактивной для по крайней мере 4 месяца, когда сохраняется при 4 ° C.
ВЭЖХ-HIC позволяет точного определения дар, так как MMAE отличается высокой гидрофобностью и обеспечивает отличное разрешение пики, соответствующие антитела конъюгаты с токсинами, 0, 1 и 2. Непрореагировавшего тетразина vcMMAE elutes около 13,7 мин и обнаруживается при 280 Нм. Этот метод требует исходного материала с высокой чистоты. Кроме того это не рекомендуется для утоления реакции с другими тетразина реактивных молекул, таких как BCN-OH, так как они могут изменить время удержания и формы пиков. Важно, что концентрация соли образцов соответствует один мобильный этапе в начале градиента для того чтобы получить хорошее разделение, особенно если вводят более чем 10-20 мкл.
Относительно анализа LC-MS deglycosylation антитела образцов не требуется для получения одного пика после деконволюции спектра сырья. Точность всего антитела и ADC масс может варьироваться в зависимости от Калибровка инструмента. Следовательно для того чтобы вычислить массу для модификации, вычтите массы, полученной для неизмененных антитела от того, получены для ADC. Современные с высоким разрешением масс-спектрометров должен обеспечить относительная ошибка ниже 1: 10000. Хотя LC-MS может также использоваться для вычисления соотношения между различных видов, это значение обычно происходит переоценка модификации могут повлиять на потенциал ионизации видов генерируется и низкое количество примесей не могут быть обнаружены.
Стабильность компоновщик в АЦП имеет решающее значение, потому что досрочного освобождения препарата приводит к более высокой токсичностью и Нижняя эффективность; Бесплатный cytotoxin повреждает здоровые ткани и голый антитела конкурирует с вооруженным один для целевого объекта привязки сайтов на больные клетки. Релиз ниже 5%, которая находится в пределах изменчивости assay стабильности, следует ожидать.
Наконец избирательность ADC ориентации HER2, такие, как trastuzumab(MMAE)2 могут быть оценены путем сопоставления цитотоксичность в SK-BR-3 клетки (HER2 высокий) и клетками MCF-7 (HER2 низкий) с момента последнего Экспресс 15 раз меньше рецепторы HER2 чем бывший28 . Immunoconjugate, как ожидается, привести к жизнеспособности клеток по крайней мере 2 порядков в SK-BR-3 по сравнению с MCF-7 ниже. EC50 в SK-BR-3 должна быть в диапазоне 2 значный наномолярных, отражающие высокие потенции этой ADC29,30. Неизмененное антител, trastuzumab(MMAE)2 или трастузумаб, должен показать отсутствие токсичности в этот assay. Тетразина vcMMAE должен иметь эффект 3 порядков ниже, чем ADC, поскольку компоновщик удаляет действие пептидомиметидные токсин. И наоборот потому что MMAE способен проникать в клеточной мембраны30, она должна иметь аналогичные токсичность для ADC но отображать никакой дискриминации между HER2 высокой и низкой клеточных линий HER2. Кроме того, если этот assay выполняется после 5 дней инкубации АЦП в сыворотке, он может использоваться для обеспечения функциональной доказательством стабильности компоновщик: выпуск токсина приведет в либо снижением эффективности АЦП в SK-BR-3, если MMAE был выпущен с p Искусство компоновщик или снижению селективности, если компоновщик был расщепляется в бесследного моды.
Технология ADC, описываемые позволяет эффективным и конкретным участкам включение cyclopropene производное лизина в IgG1s. После снисходительный Очищение антитела могут быстро проспряганное с тетразина содержащих молекул, уступая однородной продукции. Из-за малого размера и высокой реактивности минимальный ручки cyclopropene этот метод должен позволить спряжение труднодоступных препятствуют полезных данных. Результате immunoconjugates являются стабильными в сыворотке и очень мощным и селективным. В целом CypK позволяет быстро, участкам и стабильные bioorthogonal связь для антитела и другие конъюгатов белков использоваться в терапии или диагностики.
Раскрытие информации
Авторы не имеют ничего сообщать.
Благодарности
Эта работа была поддержана медицинский исследовательский совет, Великобритания. B.O.-S. держит EMBO стипендий (ATLF 158-2016) и признателен H. Pelham и J.W. Чин для поддержки и G. Ким, C. W. Морган и O. Perisic за помощь и советы.
Материалы
| Name | Company | Catalog Number | Comments |
| Expi293F | ThermoFisher Scientific | A14527 | HEK suspension cells |
| Expi293 Expression Medium | ThermoFisher Scientific | A1435101 | Expression medium |
| Antibiotic-antimycotic | ThermoFisher Scientific | 15240062 | Penicillin-streptomycin-amphotericin B |
| 125mL Polycarbonate Erlenmeyer Flask with Vent Cap | Corning | 431143 | Shake flasks |
| Brunswick S41i incubator | Eppendorf | S41I230011 | CO2 incubator with a shaker |
| Sodium hydroxide 4 mol/l (4 N) in aqueous solution | VWR | 191373M | |
| Cyclopropene lysine | Sichem | SC-8017 | In this study it was synthesized as described by Elliot et al. 2014 |
| Steriflip-GP, 0.22 µm, polyethersulfone, gamma irradiated | Merck Millipore | SCGP00525 | |
| Opti-MEM, Reduced Serum Medium | ThermoFisher Scientific | 31985070 | Reduced serum medium |
| ExpiFectamine 293 Transfection Kit | ThermoFisher Scientific | A14525 | Transfection reagent |
| 5810 R centrifuge | Eppendorf | 5811000460 | |
| Millex-GP Syringe Filter Unit, 0.22 µm, polyethersulfone, 33 mm, gamma sterilized | Merck Millipore | SLGP033RS | |
| Protein A resin | Sino Biological | 10600-P07E-RN-25 | |
| Poly-Prep Chromatography Columns, Pkg of 50 | Bio-Rad | 7311550 | Polypropylene chromatography column |
| Econo-Column Funnel | Bio-Rad | 7310003 | |
| Sodium citrate | Fluka | 71635 | |
| ÄKTA explorer FPLC | GE Healthcare | ||
| HiTrap HIC Selection Kit | GE Healthcare | 28-4110-07 | Includes HiTrap 1 mL Butyl HP |
| Ammonium sulfate | VWR | 2133.296 | |
| Isopropanol | Honywell | 34863-2.5L | |
| Dymethyl sulfoxide | Sigma-Aldrich | D8418-50ML | |
| Tetrazine-vcMMAE | ChemPartner | - | Costum synthesized |
| Tetrazine-5-TAMRA | Jena Bioscience | CLK-017-05 | |
| NuPAGE 4-12% Bis-Tris Gel 1.0mm x 10 well | ThermoFisherScientific | NP0321BOX | |
| Xcell SureLock Mini-Cell | ThermoFisherScientific | EI0001 | |
| UltiMate 3000 HPLC | ThermoFisherScientific | ||
| Thermo Scientific MAbPac, HIC-20, 4.6 x 100 mm, 5 µm | ThermoFisherScientific | 088553 | |
| PNGase F | New England BioLabs | P0704S | |
| NanoAcquity | Waters | ||
| C4 BEH 1-5 µm 1.0 x 100 mm UPLC column | Waters | ||
| 96-well microplates for cell culture | ThermoFisherScientific | 156545 | |
| Human serum | Sigma-Aldrich | H4522-20mL | |
| CO2 incubator | Panasonic | ||
| HER2 ECD | Sino Biological | 10004-HCCH | |
| Anti-TAMRA | Abcam | an171120 | |
| Anti-mouse HRP | Santa Cruz | sc-2005 | |
| TMB | BioLengend | 421101 | |
| Sulfuric acid | Sigma-Aldrich | 84727-500ML | |
| PHERAstar FS | BMG Labtech | Plate reader | |
| DMEM | Sigma-Aldrich | D5671-500ML | |
| SK-BR-3 | ATCC | HTB-30 | |
| MCF-7 | ATCC | HTB-22 | |
| CellTiterGlo 2.0 Assay | Promega | G9242 | Cell viability assay based on the measurement of ATP released after cell lysis. The output signal is luminscence. |
| Monomethyl Auristatin E | Cayman Chemical | 16267 | |
| NanoDrop 2000 | ThermoFisherScientific | Microvolume spectrophotometer | |
| Human IgG ELISA Quantificaiton Set | Bethyl | E80-104 | |
| MaxEnt1 in MassLynx | Waters | Software application for mass spectrum deconvolution | |
| IntantBlue | Expedeon | ISB1L | Coomassie-based stain |
| Intact MMAE-ADC ELISA Kit (Sandwich Assay) | Epitope Diagnostics, Inc. | KTR 782 | |
| Tube 50 mL, 114x28mm, PP | Sarstedt | 62.547.254 | Conical tube |
| Amicon Ultra-15 Centrifugal Filter Units 50,000 NMWL | Merck | UFC905024 | Centrifugal filtration concentrator (after protein A pull down) |
| Amicon Ultra-4 Centrifugal Filter Units 50,000 NMWL | Merck | UFC805024 | Centrifugal filtration concentrators (after FPLC or HPLC purification) |
| Zeba Spin Desalting Columns, 7K MWCO, 0.5 mL | ThermoFisherScientific | 89882 | Size exclusion spin columns |
| Tube PCR 0.2ml Flat Cap | Thistle Scientific Ltd | AX-PCR-02-C-CS | PCR tubes |
| Nunc MaxiSorpª flat-bottom | ThermoFisherScientific | 44-2404-21 | Plates for ELISA |
Ссылки
- Beck, A., Goetsch, L., Dumontet, C., Corvaia, N. Strategies and challenges for the next generation of antibody-drug conjugates. Nature Reviews Drug Discovery. 16 (5), 315-337 (2017).
- Wakankar, A. A., et al. Physicochemical Stability of the Antibody−Drug Conjugate Trastuzumab-DM1: Changes due to Modification and Conjugation Processes. Bioconjugate Chemistry. 21 (9), 1588-1595 (2010).
- Stan, A. C., Radu, D. L., Casares, S., Bona, C. A., Brumeanu, T. -. D. Antineoplastic Efficacy of Doxorubicin Enzymatically Assembled on Galactose Residues of a Monoclonal Antibody Specific for the Carcinoembryonic Antigen. Cancer Research. 59 (1), 115-121 (1999).
- Hamblett, K. J., et al. Effects of Drug Loading on the Antitumor Activity of a Monoclonal Antibody Drug Conjugate. Clinical Cancer Research. 10 (20), 7063-7070 (2004).
- Chari, R. V. J., Miller, M. L., Widdison, W. C. Antibody-Drug Conjugates: An Emerging Concept in Cancer Therapy. Angewandte Chemie International Edition. 53 (15), 3796-3827 (2014).
- Chin, J. W. Expanding and Reprogramming the Genetic Code. Nature. 550 (7674), 53-60 (2017).
- Axup, J. Y., et al. Synthesis of Site-Specific Antibody-Drug Conjugates Using Unnatural Amino Acids. Proceedings of the National Academy of Sciences of the United States of America. 109 (40), 16101-16106 (2012).
- Hallam, T. J., Wold, E., Wahl, A., Smider, V. V. Antibody Conjugates with Unnatural Amino Acids. Molecular Pharmaceutics. 12 (6), 1848-1862 (2015).
- Tian, F., et al. A General Approach to Site-Specific Antibody Drug Conjugates. Proceedings of the National Academy of Sciences of the United States of America. 111 (5), 1766-1771 (2014).
- Kern, J. C., et al. Discovery of Pyrophosphate Diesters as Tunable, Soluble, and Bioorthogonal Linkers for Site-Specific Antibody-Drug Conjugates. Journal of the American Chemical Society. 138 (4), 1430-1445 (2016).
- Zimmerman, E. S., et al. Production of Site-Specific Antibody-Drug Conjugates Using Optimized Non-Natural Amino Acids in a Cell-Free Expression System. Bioconjugate Chemistry. 25 (2), 351-361 (2014).
- VanBrunt, M. P., et al. Genetically Encoded Azide Containing Amino Acid in Mammalian Cells Enables Site-Specific Antibody-Drug Conjugates Using Click Cycloaddition Chemistry. Bioconjugate Chemistry. 26 (11), 2249-2260 (2015).
- Xiao, H., et al. Genetic Incorporation of Multiple Unnatural Amino Acids into Proteins in Mammalian Cells. Angewandte Chemie International Edition. 52 (52), 14080-14083 (2013).
- Milles, S., et al. Click Strategies for Single-Molecule Protein Fluorescence. Journal of the American Chemical Society. 134 (11), 5187-5195 (2012).
- Lallana, E., Riguera, R., Fernandez-Megia, E. Reliable and Efficient Procedures for the Conjugation of Biomolecules through Huisgen Azide-Alkyne Cycloadditions. Angewandte Chemie International Edition. 50 (38), 8794-8804 (2011).
- Koehler, C., et al. Genetic Code Expansion for Multiprotein Complex Engineering. Nature Methods. 13 (12), 997-1000 (2016).
- Lyon, R. P., et al. Reducing Hydrophobicity of Homogeneous Antibody-Drug Conjugates Improves Pharmacokinetics and Therapeutic Index. Nature Biotechnology. 33 (7), 733-735 (2015).
- Elliott, T. S., et al. Proteome Labeling and Protein Identification in Specific Tissues and at Specific Developmental Stages in an Animal. Nature Biotechnology. 32, 465-472 (2014).
- Ravasco, J. M. J. M., Monteiro, C. M., Trindade, A. F. Cyclopropenes: A New Tool for the Study of Biological Systems. Organic Chemistry Frontiers. 4 (6), 1167-1198 (2017).
- Yang, J., Šečkutė, J., Cole, C. M., Devaraj, N. K. Live-Cell Imaging of Cyclopropene Tags with Fluorogenic Tetrazine Cycloadditions. Angewandte Chemie International Edition. 124 (30), 7594-7597 (2012).
- Oller-Salvia, B., Kym, G., Chin, J. W. Rapid and Efficient Generation of Stable Antibody-Drug Conjugates via an Encoded Cyclopropene and an Inverse-Electron-Demand Diels-Alder Reaction. Angewandte Chemie International Edition. 57, 2831-2834 (2018).
- Schmied, W. H., Elsässer, S. J., Uttamapinant, C., Chin, J. W. Efficient Multisite Unnatural Amino Acid Incorporation in Mammalian Cells via Optimized Pyrrolysyl tRNA Synthetase/tRNA Expression and Engineered eRF1. Journal of the American Chemical Society. 136 (44), 15577-15583 (2014).
- Junutula, J. R., et al. Site-Specific Conjugation of a Cytotoxic Drug to an Antibody Improves the Therapeutic Index. Nature Biotechnology. 26 (8), 925-932 (2008).
- Junutula, J. R., et al. Rapid Identification of Reactive Cysteine Residues for Site-Specific Labeling of Antibody-Fabs. Journal of Immunological Methods. 332 (1), 41-52 (2008).
- Doronina, S. O., et al. Development of potent monoclonal antibody auristatin conjugates for cancer therapy. Nature Biotechnology. 21 (7), 778-784 (2003).
- Shiraishi, Y., et al. Identification of Highly Reactive Cysteine Residues at Less Exposed Positions in the Fab Constant Region for Site-Specific Conjugation. Bioconjugate Chemistry. 26 (6), 1032-1040 (2015).
- Sabourin, M., et al. Increasing Antibody Yield and Modulating Final Product Quality using the Freedom(TM). CHO-S(TM) Production Platform. BMC Proceedings. 5 (8), 102 (2011).
- Xiao, Y., Gao, X., Maragh, S., Telford, W. G., Tona, A. Cell Lines as Candidate Reference Materials for Quality Control of ERBB2 Amplification and Expression Assays in Breast Cancer. Clinical Chemistry. 55 (7), 1307-1315 (2009).
- Shinmi, D., et al. One-Step Conjugation Method for Site-Specific Antibody-Drug Conjugates through Reactive Cysteine-Engineered Antibodies. Bioconjugate Chemistry. 27 (5), 1324-1331 (2016).
- Badescu, G., et al. Bridging Disulfides for Stable and Defined Antibody Drug Conjugates. Bioconjugate Chemistry. 25 (6), 1124-1136 (2014).
- Vazquez-Lombardi, R., et al. Transient expression of human antibodies in mammalian cells. Nature Protocols. 13 (1), 99-117 (2018).
- Baldi, L., Hacker, D. L., Meerschman, C., Wurm, F. M., Hartley, J. L. . Protein Expression in Mammalian Cells: Methods and Protocols. , 13-26 (2012).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены