Method Article
קידוד גנטי חומצת אמינו קאנונית לדור של נוגדן תרופתיים Conjugates דרך תגובה מהירה Bioorthogonal
In This Article
Summary
שילוב נגזרת cyclopropene של ליזין נוגדנים מאפשר הצמדה בייעודי לאתר, מהיר ויעיל של מולקולות tetrazine מניבי לייצר נוגדן-סמים conjugates.
Abstract
נוגדן תרופתיים conjugates (ADCs) בשימוש כיום בפרקטיקה הקלינית הם תערובות של מולקולות הנוגדן מקושרת למספר משתנה של רעלים לעבר עמדות שונות. פרה מחקרים הראו כי ניתן לשפר את חלון תרפויטי של אלה ADCs מסורתיים מאת ניגודים בייעודי לאתר רעלים. אולם, לגישות כדי לייצר ADCs הומוגנית יש מספר מגבלות, כגון חלבון נמוכה ביטוי וקינטיקה מגיבים לאט. ב פרוטוקול זה נתאר כיצד להגדיר מערכת ביטוי לשלב נגזרת cyclopropene של ליזין (CypK) נוגדנים באמצעות הרחבת הקוד הגנטי. ידית bioorthogonal מינימלי זה מאפשר נטיה מהירה של נגזרות tetrazine דרך cycloaddition תגובת דילס-אלדר הפיכה-דרישה. המערכת הביטוי כאן דיווח מאפשרת ייצור נתיישב ולטיהור הרצפטין הנושאת CypK בכל אחד השלשלאות הכבדות. אנחנו מסבירים כיצד ליצור קישור הנוגדן auristatin monomethyl הרעלן E ולאפיין את immunoconjugate על ידי האינטראקציה הידרופובי וספקטרומטר מסה. לבסוף, אנו מתארים את מבחני כדי להעריך את היציבות בנסיוב האנושי של ניגודים dihydropyridazine הנובע הבניין וכדי לבחון את cytotoxicity סלקטיבית של נ עבור תאים סרטניים בשד עם רמות גבוהות של הקולטן HER2.
Introduction
נוגדן תרופתיים conjugates (ADCs) לשלב את מידת הבררנות של חברת את העוצמה של מולקולות קטנות ציטוטוקסיות. רוב ADCs במטרה להקטין את תופעות הלוואי של כימותרפיה מסורתי על ידי מיקוד תרופות המשפיעות על דנ א או microtubule הפילמור סרטן תאים1. דור ראשון ADCs אושרה על ידי מינהל המזון והתרופות האמריקני (FDA) מסתמכים על השינוי של lysines ו cysteines, אשר יוצר תערובות של מולקולות ששינה לעבר עמדות שונות עם ירידה המאפיינים פרמוקוקינטיים2. לעומת זאת, ההטיה לרישום תרופות הנוגדנים ניתן להפיק תרכובות עם3,indeces טיפולית משופר4. המבקשים לפנות את האתגר של הפקת ADCs הומוגנית, מספר סלקטיבי שינויים כימיים, אנזימטי כבר דווח על1,5. עם זאת, שיטות הנוכחי יכול המטרה רק עמדה מסוימת על הנוגדן, סובלים ביטוי חלבון נמוכה, linkers לספק יציבות נמוכה או להסתמך על תגובות איטי תנובה נמוך.
שילוב של חומצות אמינו קאנונית (ncAA) דרך הרחבת הקוד הגנטי מאפשר התקנה בייעודי לאתר של שפע של קבוצות תגובתי bioorthogonal לחלבונים, פוטנציאל להתגבר על המגבלות של שיטות אחרות ששימשו ליצירת ADCs. קידוד ncAAs בתגובה codon היעד (stop) מסתמך על זוגות המעביר/tRNA aminoacyl-tRNA שנמצאים אורתוגונלית כדי זוגות אנדוגני המשלבים חומצות אמינו הקנוני6. NcAAs מספר שולב נוגדנים כדי ליצור ADCs. עם זאת, ביותר סובלים התחייבויות שונות עבור יישומים בסמים טיפולית ההטיה. p-acetylphenylalanine (pAcF)7,8 הוא לא מלא bioorthogonal, דורש חומציות נמוכה (4.5), זמני תגובה ארוכים (> 60 h), בעוד azides כגון p-azidophenylalanine (pAzF)7,9,10, p-azidomethylphenylalanine (pAMF)11, ושאול אזיד של ליזין (AzK)12,13 עשוי להיות מופחת ב תא14, ואת הנחושת נהגה לעודד Huisgen cycloadditions יכול לגרום נזק חמצוני 15.
למרות ncAAs חלופית המבוססת על טרנס-cyclooctene (TCO), cyclooctyne (SCO) ו- bicyclo [6.1.0] nonene (BCN) לאחרונה קודדו נוגדן למטרות הדמיה, מערכת ביטוי סובל תשואות נמוכות מאוד (0.5 מ ג/ליטר)16. יתר על כן, cyclooctenes ואת cyclooctynes הם גדולים, ידיות הידרופובי אשר עשוי להגדיל את הרגישות של נ עבור מטענים -ADC צבירת באופן מסורתי הידרופובי הינם המאפיינים physicochemical של מקשר הוכחו במידה רבה השפעת פרמקוקינטיקה ותרפויטי17. לעומת זאת, cyclopropenes 1, 3-disubstitued הן קבוצות קטנות תגובתי זה אמור לגרום שינוי מינימלית חלבון מבנה ו- physichochemical מאפיינים18. Cyclopropenes באופן סלקטיבי ובלתי במהירות להגיב עם tetrazines דרך האלקטרון הפוך-דרישה תגובת דילס-אלדר cycloaddition19. ב פרוטוקול זה נעשה שימוש נגזרת של מיסב ליזין (CypK, איור 1b) מתיל-cyclopropene זה פחות מושפע הסטריים אני אפריע גדול יותר מחזורי רוויים מאומצות ויש קבוע קצב התגובה לפי סדר 1-30 מ'-1ש -1 מדיה מימית18,20.
לאחרונה דיווחנו כיצד לשלב CypK נוגדנים כדי ליצור ADCs תוך שהיא מגיבה זו אחיזה מינימלית bioorthogonal עם מולקולות tetrazine מניבי21. כאן נתאר את ההליך הכנה ADC בפירוט רב יותר עם דגש על השלבים המאתגרים ביותר. שילוב של CypK מכוון משתמש של pyrrolysyl-סינתזת המעביר (PylRS) / זוג tRNAצ'ואה(PylT) בתגובה codon ענבר הציג בשרשרת כבדה נוגדן (HC)22. כאן אנו משתמשים פלסמידים 2 תרביות תאים ארעי (איור 1 א'), אחד קידוד שרשרת כבדה של הנוגדן, והשני קידוד שרשרת אור (LC), שני המכיל את הקלטת PylRS/PylT. לחלופין, ניתן להפיק קו תא יציב המאפשר תשואות גבוהות של נוגדנים דרך פרוצדורה יותר מפרך21.
המערכות הביטוי הנ ל יכול לייצר את נוגדן anti טיפולית-HER2 1 (IgG1) הרצפטין עם CypK ברמות דומות כדי פראי סוג נוגדן. בחרנו העמדה הראשונה של התחום CH1 בשרשרת כבדה כדי לקודד ncAA (HC-118TAG). זה הוא אתר ששונה הנפוץ ביותר ADCs23 נקראת HC-118 (האיחוד האירופי מספור) אבל יש גם מכונה HC-121 (רצף מיקום) ו HC-114 (מספור Kabat)24. מאז עמדה זו כולו לאורך כל IgG1s, מערכות אלו ביטוי צריך להיות מקובל נוגדנים הכי טיפולית.
אנו מראים trastuzumab(CypK)2 יכול בקלות להיטהר על ידי חלבון שהופעלו על ידי חלבון מהיר כרומטוגרפיה נוזלית עם עמודה אינטראקציה הידרופובי (FPLC-HIC). לאחר מכן הנוגדן מקושר covalently בתוך 3 h microtubule הפילמור מעכב monomethyl auristatin E (MMAE), אשר משמש את ADC Adcetris שאושרו על-ידי ה-FDA. כאן אנו משתמשים נגזרת בנזיל-tetrazine של MMAE (tetrazine-vcMMAE) עם מקשר (linker) כגון כרווח glutarate, ולין-citrulline רכיב פרוטאז-יציב ולאחריו יחידת - aminobenzylalcohol pself-immolative; מקשר זה הוא ביקע מאת Cathepsin B ב- ליזוזום על הפנמה של נ וכתוצאה מכך השחרור traceless של הרעלן25. כדי להראות היקפה הנרחב של התגובה, הנוגדן מקושר גם tetramethylrhodamine fluorophore (טמרה). נסביר איך לאמת את זהות לחשב את המשלים שלו באמצעות כרומטוגרפיה נוזלית מצמידים ספקטרומטר מסה (LC-MS) כדי לחשב את יחס סמים-כדי-נוגדנים (DAR) באמצעות כרומטוגרפיה נוזלית ביצועים גבוהים עם עמודה אינטראקציה הידרופובי (HPLC-HIC) .
במסגרת האפיון של הופעת נוגדנים, אנו נתאר כיצד לבחון את היציבות של ניגודים dihydropyridazine בנסיוב אדם. פרמטר זה בקלות רבה יותר שקובעת בטמרה-הרצפטין כי זה ניתן לכמת מאת אליסה פשוטה הפרשנות של התוצאות לא מסובך ידי ברכיב פרוטאז יציב של trastuzumab(MMAE)2. לבסוף, סלקטיביות של עוצמת האנרגיה של trastuzumab(MMAE)2 מוערך על-ידי השוואת את cytoxicity של ADC מעבר לגבולות התא לבטא רמות שונות של HER2. זה וזמינותו מספק גם הוכחה פונקציונלי של יציבות ADC כאשר מבוצעת לאחר המקננת על immunoconjugate בנסיוב אדם.
Protocol
1. לייצר, לאפיין את הנוגדן
- אקספרס הנוגדן
- הפשרת בקבוקון של תאים ההשעיה HEK בבקבוקון 250 מ ל המכיל 50 מ של הביטוי מדיום בתוספת 100 יחידות/mL פניצילין סטרפטומיצין µg/mL 100, 250 ננוגרם למ"ל שהוא גוסס B. לשמור התאים ב 37 ° C עם 8% CO2 ב humidified חממות מצויד עם מטרף-125 סל ד. פצל תאים 0.3-0.5 x 106 תאים/מ ל (כל 2-3 ימים) לפחות 2 פעמים לפני transfecting.
- כאשר צפיפות של 2.5 x 106 תאים למ"ל הגיעו (2-3 ימים לאחר פיצול), להכין פתרון טריים של 100 מ מ CypK. למטרה זו, שוקלת 64 מ"ג של CypK, להוסיף 2.5 מ של 0.1 נתרן הידרוקסידי, מערבולת, ספין למטה כדי לשחזר את כל undissolved חלקיקים sonicate.
- להוסיף 2.5 מ של CypK (100 מ מ ב- 0.1 M NaOH) 42.5 מ של הביטוי בינוני עם אנטיביוטיקה. לערבב היטב, להוסיף 250 µL של 0.1 M HCl, לעקר באמצעות מסנן 0.22 מיקרומטר.
- לדלל 50 µg HC ו- LC pKym1 פלסמידים21 עד 2.5 מ"ל מופחת סרום בינונית. בשפופרת נפרדים, לדלל 135 µL של תרביות תאים ריאגנט 2.5 מ ל מופחת סרום בינונית.
- חמש דקות לאחר הכנת את הפתרונות, לערבב את פלסמידים והפתרון ריאגנט תרביות תאים, תקופת דגירה של 20 דקות לאפשר הקמת מתחמי בין ה-DNA הכימית תרביות תאים.
- בינתיים, צנטריפוגה 125 מיליון תאים על הצפיפות יעד של 5 דקות ב 500 x g, resuspend עם המדיום ביטוי המכיל CypK ולהוסיף את תערובת ריאגנט DNA – תקנים. ניתן לרכוש CypK או מסונתז כפי שדווח בעבר18.
- לאחר המקננת תאים עבור 20 h, להוסיף 250 µL של תרביות תאים ריאגנט משפרי כלול בערכה.
- הקציר נוגדנים מן supernatant 6-7 הימים לאחר תוספת של CypK (ללא שינוי של מדיום זה נדרש במהלך הביטוי).
*. לחלופין, כדי להשיג תשואות גבוהות יותר ועקבית יותר, קו תא יציב יכול להיווצר כפי שמתואר Oller-מרווה. et al. 201821. במקרה זה, trastuzumab(CypK)2 מתבטאת פשוט על ידי תוספת של CypK 5 מ מ ב המדיום הביטוי.
- לטהר את הנוגדן
- Centrifuge התאים למשך 15 דקות ב 3000 x g.
- לסנן את תגובת שיקוע של 0.45 או מסנן 0.22 מיקרומטר. אם המסנן הופך occluded, להחליף אותו באחד חדש והמשך סינון. אם זה קורה לאחר רק כמה מיליליטר, centrifuge את תגובת שיקוע למשך 15 דקות נוספות ב 7000 x g.
- להוסיף חלבון A שרף (2 מ ל/100 מ של תגובת שיקוע) בעמודה הריקה כרומטוגרפיה פוליפרופילן, equilibrate השרף לפחות 5 כרכים של מאגר שטיפת חרוז (0.1 M סודיום פוספט, 150 מ מ NaCl).
- לפצל את תגובת שיקוע שני צינורות חרוט 50 מ"ל ולהוסיף 5 x חרוז שטיפת מאגר (0.5 M סודיום פוספט, 150 מ מ NaCl) ואחריו השרף A חלבון equilibrated מראש. במקום הצינור חרוט על גלגלת עבור 3 שעות בטמפרטורת החדר, כדי להוריד את הנוגדן ב תגובת שיקוע.
לחלופין: להוסיף את תגובת שיקוע על העמודה לפחות פעמיים את אמצעי האחסון המומלץ של שרף ולאפשר לזרום דרך. ודא שאין כמות משמעותית של נוגדן שמאלן תגובת שיקוע על ידי עמודים מרחביות. אם יש, elute שוב את תגובת שיקוע דרך השרף. - להעביר חלבון א' שרף עם תגובת שיקוע לתוך עמודה ולא תאפשר לנוזל לזרום דרך.
- להוסיף 25 מ של שטיפת מאגר (או שרף לפחות 10 כרכים) ולאפשר לזרום דרך.
- Elute הנוגדן עם 4 מ של 0.1 M סודיום ציטרט, pH 3, ב- 1 מ ל 1 מ' פוספט מאגר, 150 מ מ NaCl.
- לדלל הנוגדן עם 10 מ"ל ל- PBS, להתרכז 0.5-1 מ על ידי סינון צנטריפוגלי, מאגר exchange שלוש פעמים עם PBS.
- לטהר את הדגימות מאת FPLC באמצעות עמודה היק בוטיל עם זרם של 0.5 mL/min ו- 0-100% מעבר 30 דקות של מאגר מלח נמוכה (50 מ מ סודיום פוספט pH 7.0, 20% אלכוהול איזופרופיל) במאגר מלח גבוהה (1.5 M (NH4)2אז4, 50 מ מ סודיום פוספט pH 7.0 5% אלכוהול איזופרופיל). לאסוף את השברים כל ולנטר את • תנאי ב 280 ננומטר. כמויות קטנות (< 1 מ ג) יכול להיטהר עם HPLC-HIC בתנאים המתוארים 2.4 כדי למקסם את התשואה וטוהר.
- בריכת שברים להכיל נוגדנים, לדלל אותם לפחות 4 מ עם PBS, לרכז אותם על-ידי מאגר סינון והחלפת צנטריפוגלי שלוש פעמים עם PBS.
- לכמת את הנוגדן
- להשיג ריכוז המשוער על ידי מדידת ספיגת ב 280 ננומטר באמצעות ספקטרופוטומטרים מיקרו נפח.
- אם נדרש מדידה מדויקת, להשתמש ערכת דיאגנוסטיקה כדי למדוד IgGs האנושית. הערכה גסה, השתמש מרחביות-דף עם כתם מבוססי Coomassie כדלקמן:
- הכן סטנדרטים על ידי דילול שש פעמים כפולה של הרצפטין סטנדרטי לכמת מאת אליסה-1 מ"ג/מ"ל.
- מרתיחים את הסטנדרטים והדוגמאות כ 0.25 מ"ג/מ"ל בהפחתת טעינת מאגר.
- להפעיל אותן בהקשר האבטחה משתמש Bis-טריס מרחביות-דף 4-12% מאגר MES-מרחביות, הכתם עם צבע מבוסס Coomassie. לבסוף למדוד צפיפות צבע של הלהקה התואם את האור או את שרשרת כבדה באמצעות ImageJ, לבצע אינטרפולציה האות מדגימות בעקומת סטנדרטי.
- חנות הנוגדן ב 4 º C.
2. נזווג הנוגדן ולאפיין את ADC
- נזווג הנוגדן עם מולקולת tetrazine מניבי
- לדלל 10 טוחנת במקבילות של tetrazine-vcMMAE (4 µL, 3.4 מ מ דימתיל סולפוקסיד (דימתיל סולפוקסיד)) עם 20 µL של acetonitrile ו µL 76 ל- PBS בשפופרת חרוטיים קטנים (למשל,ה-PCR הצינור).
- להוסיף 1 שן טוחנת המקבילה trastuzumab(CypK)2 (100 µL, 2 מ"ג/מ"ל ב- PBS), לערבב היטב, אפשר להגיב במשך 3 שעות בטמפרטורת החדר (25 ° C) כדי ליצור trastuzumab(MMAE)2.
הערה: מולקולות אחרות כגון tetrazine-5-טמרה שניתן לקשרו הנוגדן במקום tetrazine-vcMMAE באמצעות פרוטוקול זה.
- לטהר את ADC
- מראש equilibrate גודל אי-הכללה של ספין עמודה עם PBS בעקבות הוראות היצרן.
- להוסיף את כל עוצמת התגובה על עמודה ספין, צנטריפוגה ב 1500 x g עבור 1 דקות.
- לכמת את ADC ולנתח את המספר המשלים מאת מרחביות-דף
- לכמת את ADC כפי שמתואר 1.3.2. על ידי מדידת צפיפות צבע של שרשרת אור בעמוד-מרחביות באמצעות הנוגדן-לאחרונה עבור העקומה סטנדרטי.
- שרשרת כבדה צריך מעט זזו מראה עלייה משקל מולקולרי על הבניין.
הערה: אם הנוגדן משתנה עם fluorophore כגון trastuzumab(TAMRA)2, רק הלהקה המתאים לשרשרת כבדה צריך להראות זריחה בג'ל לפני צביעת.
- לנתח את המספר המשלים על-ידי HPLC-היק
- Equilibrate את העמודה HPLC-HIC עם 100% מאגר A (1.5 M (NH4)2אז4, 50 מ מ סודיום פוספט pH 7.0, 5% אלכוהול איזופרופיל) במשך 5 דקות.
- לערבב 15 µL (67 pmol) של פתרון 1 מ"ג/מ"ל של הרצפטין (CypK) 2 עם µL 15 של 2 x מאגר A בבקבוקון. ואז תוכנית זריקה 10 µL ב- HPLC.
- Elute ב תזרים 1 mL/min איזוקראטית עם 100% למאגר A 1 דקות ולאחריו הדרגתי 15 דקות מ- 100 ל- 0% של מאגר A B (50 מ מ סודיום פוספט pH 7.0, 20% אלכוהול איזופרופיל). לפקח על • תנאי ב 280 ננומטר.
- לחשב את דאר בהכניסו שיא המתאימים לכל מין ושימוש האזורים וכתוצאה מכך המשוואה הבאה:
דאר = (1 x trastuzumab(MMAE) + 2 x trastuzumab(MMAE)2)
/(trastuzumab(MMAE)0 + trastuzumab(MMAE)1 trastuzumab(MMAE)2)
שמירה צפוי זמן trastuzumab(CypK)2 הוא מין 7.5-8.0, הרצפטין (CypK, MMAE) הוא מין 9.1-9.6, עבור trastuzumab(MMAE)2 הוא 10.5-11.0 min.
- לנתח את המספר המשלים על-ידי LC-MS
- Deglycosylate 30 µL של 1 מ"ג/מ"ל ADC ו הנוגדן יאומתו בהפחתת ללא תנאי שימוש 250 יחידות PNGase F לפחות 6-אייץ '-37 מעלות צלזיוס.
- Elute הנוגדן לתוך ספקטרומטר מסה ב- C4 1-5 מיקרומטר 1.0 x 100 מ"מ עמודה באמצעות שיפוע 20 דקות של 2% עד 80% acetonitrile במים. לרכוש נתונים מעל טווח מ/z 350-4000 במצב יון חיובי עם מתח קונוס של 150v.
- Deconvolute את הנתונים הגולמיים באמצעות תוכנה מתאימה. לחשב את ההבדל במסה בין שונה נוגדנים שלא שונתה.
3. assay היציבות של ניגודים Dihydropyridazine Trastuzumab(TAMRA)2 בנסיוב
- לסנן בנסיוב באמצעות מסנן 0.22 μm בתנאים סטריליים. ניתן להוסיף 100 יחידות/mL פניצילין, סטרפטומיצין μg/mL 100.
- למלא הבארות חיצוני של צלחת 96-ובכן עם מים. בבארות במרכז, מערבבים את µL 90 triplicate של נסיוב המסוננת עם 10 µL של 1 מ"ג/מ"ל trastuzumab(TAMRA)2 ב- PBS ב ריכוז סופי של 0.1 mg/mL. מקם את הצלחת באינקובטור רווי לחות-CO 37 ° C ו- 4-5%2.
- כל 24 שעות ביממה במשך 5 ימים, pipet כל טוב ביסודיות מערבבים, לקחת µL 5 aliquot, הקפאה בחנקן נוזלי, ולאחסן ב-80 מעלות צלזיוס.
- לאחר שנאסף כל הדגימות, להפשיר את aliquots ולנתח תוך שימוש של אליסה עקיף כמו שדווחה בעבר12 עם מספר שינויים:
- מעיל צלחת 96-ובכן לילה עם 0.25 µg/mL HER2 ב 4 º C. כל צעדים אחרים מבוצעות בטמפרטורת החדר.
- למחרת, לשטוף 5 פעמים עם PBS 0.05% tween (PBS-T) ולחסום עם אלבומין פרה 1% לשעה.
- רוחצים את דגירה הדגימות ב 1:10000 דילול ב- PBS כבר שעתיים.
- רוחצים את דגירה נוגדן anti-טמרה העולות העכבר 1:2000 דילול ב- PBS-T עם 0.5% BSA לשעה.
- רוחצים את דגירה אנטי-העכבר HRP תרכיב 1:1000 ב- PBS-T עם 0.5% BSA לשעה.
- להוסיף שוייץ ולאפשר להגיב 5-10 דקות.
- לעצור את התגובה עם µL H 502אז ספיגת 1 מ' ולמדוד4 -450 ננומטר. להחסיר רקע נמדד ב 570 ננומטר.
- להתאים עקומה רגרסיה לוגיסטית 4-פרמטר כדי דילולים סטנדרטי, אינטרפולציה מדידות מדגימות.
הערה: היציבות של trastuzumab(MMAE)2 יכול להיות מוערך באמצעות פרוטוקול אותו על-ידי שינוי וזמינותו שמתואר 3.3 עבור ערכת דיאגנוסטיקה מסחרית כדי למדוד את הריכוז של נ.
4. להעריך את Cytotoxicity של נ
הערה: פרוטוקול זה מבוסס על מבחני שדווחה בעבר23,,26 , עם מספר שינויים.
- הפשרת SK-BR-3 ו- MCF-7 תאים ולאפשר להם להתיישב p25 מבחנות המכילות בינוני מלא, קרי DMEM בתוספת 10% חום להשבית סרום שור עוברית, 100 יחידות/mL פניצילין, סטרפטומיצין µg/mL 100.
- פצל תאים על 80-90% הנהרות (כל 3-4 ימים) לפחות 2 פעמים לפני וזמינותו.
- יומיים לפני וזמינותו, למלא הבארות החיצוני של צלחת 96-ובכן עם מים. לאחר מכן להרים תאים עם 0.05% טריפסין ב- 0.5 מ מ EDTA, צנטריפוגה 3 דקות ב 250 x g, resuspend במדיום חדש, זרע 3000 בתאים µL 100 לכל טוב (ריק) לוחית 96-ובכן.
- יומיים לאחר זריעת תאי, להכין 10 דילולים טורי של כל הדגימות שהפקידים עם דימתיל סולפוקסיד 0.1% בינוני מלא. שקול את דגימות והפקדים הבאים: trastuzumab(MMAE)2, trastuzumab(CypK)2, הרצפטין פראי סוג, tetrazine-vcMMAE ו- MMAE.
- מוסיפים 100 µL של כל דגימה מכל קידוח, תקופת דגירה של 5 ימים-CO 37 ° C ו- 4-5%2.
- יום 5, למדוד תא הכדאיות. לשם כך, השתמש ערכת מסחרי lyse התאים ולמדוד את ATP שוחרר. להתוות את אחוז אות ביחס תאים שליטה שטופלו דימתיל סולפוקסיד 0.1%.
הערה: ADCs יכול להיות מודגרות במשך 5 ימים בנסיוב, לבדיקה עבור cytotoxicity להוכיח יציבות פונקציונלי.
התראה: MMAE הוא רעיל מאוד. לפיכך משתמשים כפפות ומשקפי מגן בעת טיפול MMAE נגזרים. אם אתה משתמש MMAE שלא שונתה כפקד בניסוי שלך, כאשר מכינים את הפתרון מניות ב דימתיל סולפוקסיד, להתמודד עם המוצר מוצק בפנים ברדס fume.
תוצאות
מערכת דווח על הביטוי ארעי (איור 1 א') מניב 22 ± 2 מ ג של trastuzumab(CypK)2 לליטר של תרבות בינוני, אשר מייצג את 2/3 של הנוגדן פראי סוג מיוצר תחת באותם התנאים (איור 1 c). הקו הסלולרי יציב יכול להגדיל את התשואה עד 2 mg/L ±2131.
יכול להיות מצומדת Trastuzumab(CypK)2 עם tetrazine-vcMMAE, אשר מניב trastuzumab(MMAE) הומוגנית בדאנטה2 בתוך 3 שעות 25 ° c (איור 2). Hydrophobicity גבוהה של cytotoxin זה דורש תוספת של 10% acetonitrile כאשר 5 או יותר מהמקבילות טוחנת של רעל לכל CypK משמשים. לחלופין, cycloaddition השלמת גם בתוך 20 h שימוש במקבילות 2 של tetrazine-vcMMAE ללא acetonitrile (איור 2 c). Trastuzumab(CypK)2 מגיב עם tetrazine-טמרה בתוך 2 h ב- 25 ° C, h 3-6 נדרשים כאשר הטמפרטורה יורדת עד 4 ° C (איור 3 c).
דאר הצפוי עבור trastuzumab(MMAE)2 נמדדת HPLC-HIC הוא 1.9 (איור 2b). הפסגה שנצפתה בתחילה chromatogram ב דקה 8.0 מייצג הנוגדן unconjugated (DAR 0), כדאי נעלמו לחלוטין כאשר התגובה הושלם. המין עם 1 דאר elutes ב 9.1-9.6 דקה ויש לו של האזור < 10% לאחר 3 שעות; ויש המוצר היעד עם 2 דאר לו זמן השמירה של 10.5-11.0% > 90 אזור הצפוי. הניידות shift וזריחה במרחביות-דף ג'לים מאשר שילוב של טמרה (איור 3b) והזהות של immunoconjugates מאומת על ידי LC-MS (איור דו-ממדי-e ו- 3d איור).
דגירה של trastuzumab(TAMRA)2 במשך 5 ימים בנסיוב אדם, לאחר מכן ניתוח מאת אליסה מאשרת כי המטען נשאר קשור הנוגדן (איור 4b). לגבי וזמינותו cytotoxicity, trastuzumab(MMAE)2 מציג האון גבוהה ב- SK-BR-3 (HER2 גבוהה) השד תאים סרטניים, עם ריכוז אפקטיבי מקסימלי חצי (EC50) של 55 ± 10 בלילה (איור 4 d). Trastuzumab(MMAE)2 שומר את cytotoxicity לאחר 5 ימי דגירה בנסיוב אדם (איור 4 c). לעומת זאת, כאשר ADC זה לבדיקה-MCF-7 (HER2 נמוך) ה EC50 הוא 200-fold נמוך (איור 4 d). פראי סוג נוגדן, trastuzumab(CypK)2 , tetrazine-vcMMAE מראים רעילות נמוכה ביותר (איורים 4 d ו- 4e), ואילו MMAE מציג גבוה cytotoxicity לא בררניים בשתי השורות תא (איור 4e).
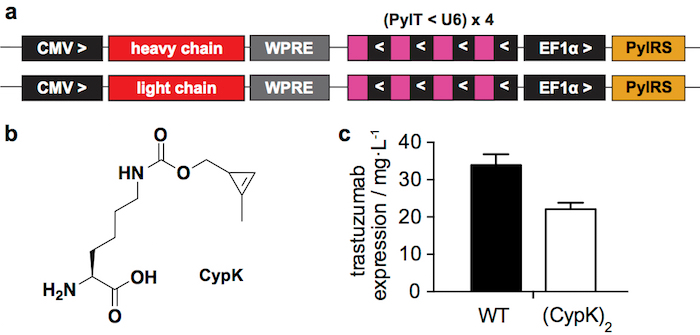
איור 1: מערכת ביטוי ארעית. א רלוונטי מחוזות פלסמידים משמש תקנים ארעי בתאים HEK293. CMV: cytomegalovirus מקדם, WPRE: וודצ'אק הפטיטיס וירוס תקינה רכיב Posttranscriptional, PylT: pyrrolysyl tRNA, U6: מקדם ספציפי, PylRS: pyrrolysil סינתזת המעביר, > ו- <: כיוון של שעתוק. N B. חדוה-[((2-methylcycloprop-2-en-1-yl)methoxy)carbonyl]-L-lysine (CypK). ג. הביטוי התשואות של הרצפטין פראי סוג (WT), trastuzumab(CypK)2 כפי שנמדד מערבון כתם לאחר החלבון הוא לטיהור. קווי שגיאה לייצג סטיית התקן של triplicates ביולוגית. דמות זו שונתה באישור Oller-מרווה. et al. 201821. אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.
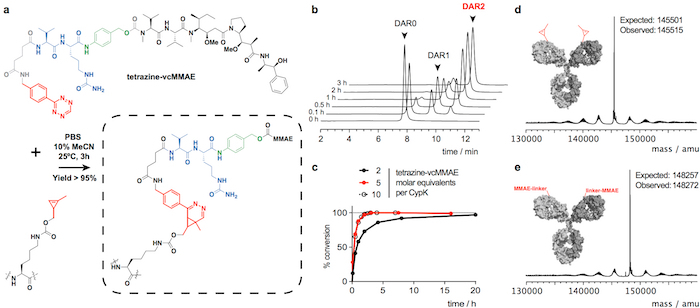
איור 2: ההטיה של trastuzumab(CypK)2 עם tetrazine-vcMMAE. א cycloaddition תגובת דילס-אלדר אלקטרון-דרישה הופכי בין השאריות CypK ב הנוגדן הנגזרת tetrazine של MMAE. הקבוצות מגיבים מובלטים באדום, p- aminobenzylalcohol מתואר את dipeptide ולין-citrulline בכחול וירוק. B. HPLC-היק chromatograms מציג את ההתקדמות של הבניין של נוגדן. ג. מידת המרה ביחס דאר המרבי של 1.9 באמצעות ריכוזים ריאגנט שונים. D-אי Deconvoluted ספקטרום המונית של הנוגדן באורך מלא לפני ואחרי הבניין. Trastuzumab(CypK)2 הושג באמצעות שורת תאים יציב. דמות זו שונתה באישור Oller-מרווה. et al. 201821. אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.
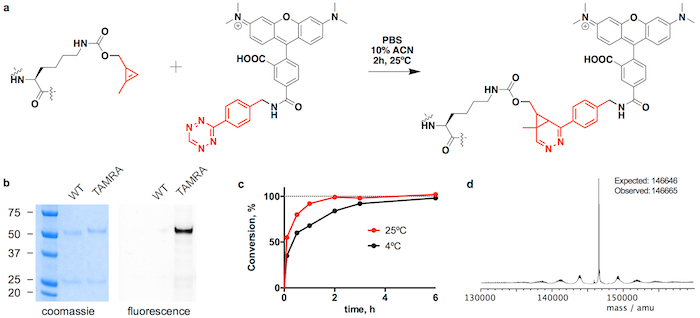
איור 3: ההטיה של trastuzumab(CypK)2 עם tetrazine-טמרה. א cycloaddition תגובת דילס-אלדר אלקטרון-דרישה הופכי בין השאריות CypK ב הנוגדן tetrazine הנגזרת של טמרה. B. מרחביות-דף ג ' לים מציגים את המשמרת ניידות וגם את זריחה בג'ל מקורו הבניין של טמרה. ג. ההטיה קינטיקה בטמפרטורות שונות שני. ד Deconvoluted הספקטרום המונית של trastuzumab(TAMRA)2- Trastuzumab(CypK)2 הושג באמצעות שורת תאים יציב. דמות זו שונתה באישור Oller-מרווה. et al. 201821. אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.
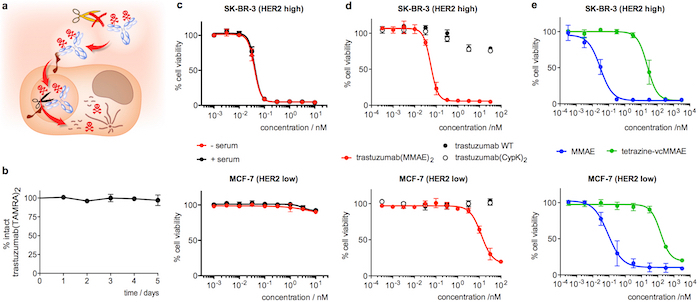
איור 4: יציבות סרום, cytotoxicity של הרצפטין conjugates. א קריקטורה הדגשת התכונות הרצוי ב- ADC בהטמעת. B. יציבות של trastuzumab(TAMRA)2 בנסיוב אדם כפי שנמדד ב- ELISA. ג תא הכדאיות assay עם trastuzumab(MMAE)2 לאחר 5 ימים בנסיוב אדם (+ סרום, שחור). דגימת הבקרה מודגרות ב- PBS במקום סרום (-סרום, אדום) נכלל באותו וזמינותו. ד תא הכדאיות assay עם דגימות נוגדן טרי מדולל. ה תא הכדאיות assay עם נגזרות MMAE טרי מדולל. קווי שגיאה מייצגים השגיאה הסטנדרטית של הממוצע של 3 ניסויים עצמאית. דמות זו שונתה באישור Oller-מרווה. et al. 201821. אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.
Discussion
ההליך ביטוי ארעית כדי לייצר trastuzumab(CypK)2 שמתואר פרוטוקול זה היא פשוטה ומאפשרת מודולריות גבוהות. התשואות שהושגו נמצאים במרחק אלה צפוי של הגדרה אקדמית27 , שורות תאים יציב יכול להיווצר להמשיך להגביר את תפוקת הייצור21. במהלך ביטוי, ריכוזי CypK נמוכים מ- 5 מ מ עשוי לגרום לתוך התחתון התאגדות המכללות, סכומים גבוהים עשויים להשפיע על צמיחת תאים ולהקטין נוגדן התשואות. CypK כמו חומצה אמינית חופשית יש מסיסות נמוכה במים, וכך זה צריך להיות קודם נעלם על 100 מ מ ב- 0.1 M NaOH ולאחר מכן נוסף המדיום תרבות. לאחר דילול CypK בטווח הבינוני, לפני הוספתו לתאים, הוא קריטי כדי לנטרל. את המדיום עם HCl מסנן כדי לעקר. לאחר מכן, בעזרת ריאגנטים של תרביות תאים שצוין בפרוטוקול זה, בעקבות הזמנים הדגירה המומלץ על ידי היצרן חשוב עבור ביטוי גבוהות תנובה. לפרטים נוספים על ביטוי ארעית של נוגדנים אנושיים, הקורא מכונה אחרים שפורסמו פרוטוקולים31,32.
כאשר הנוגדן מטוהר, עודף גבוה של חלבון A שרף נדרש כמצוין כדי להבטיח נוגדן מלא לנתץ מ תגובת שיקוע. על מנת למנוע תחילת המדידות של הרצפטין • תנאי, זה recommendable להשתמש פתרון עם אגירת גבוהה קיבולת, שתדללו מיד עם PBS ולהחליף את המאגר הימנעות ריכוז מופרז. תמיד מחזיקים הנוגדן < 5 מ"ג/מ"ל.
הבניין של trastuzumab(CypK)2 עם tetrazine-vcMMAE הוא מהיר יותר מאשר רוב התגובות התייצבתי עם ידיות bioorthogonal אחרים ADCs. יתר על כן, cycladdition הזה מתרחש בתנאים קלה מאוד: בטמפרטורת החדר או pH נמוך יותר, פיזיולוגיים. זה חשוב לדלל את הפתרונות דימתיל סולפוקסיד מניות של שני המגיבים עם acetonitrile לפני תוספת של PBS הנוגדן; אחרת לזרז נגזרות tetrazine. Acetonitrile נדרשת רק בשל hydrophobicity גבוהה של MMAE, טמרה, אך פחות מולקולות הידרופוביות ייתכן שלא תזדקק התוספת של הממס שותף. לחלופין, tetrazine-vcMMAE יכול להיות מצומדת ללא acetonitrile ושווי טוחנת רק 2 של tetrazine-vcMMAE בתוך 20 h. זו כמות קטנה של הרעלן יכול לכלול ירידה משמעותית עלות הייצור של ADC בהשוואה לטכנולוגיות הנוכחי מבוסס ncAA. Trastuzumab(CypK)2 הוא מלא תגובתי לפחות 4 חודשים כאשר נשמר ב 4 º C.
HPLC-HIC מאפשר של קביעה מדויקת של דאר מאז MMAE הידרופוביות מאוד ומספק פתרון מעולה של הפסגות המתאים נוגדן conjugates עם רעלים 0, 1 ו-2. Tetrazine unreacted-vcMMAE elutes בסביבות 13.7 min, ומתגלה ב 280 ננומטר. טכניקה זו דורשת חומר המוצא עם טוהר גבוהה. יתר על כן, זה לא recommendable כדי להרוות את התגובה עם מולקולות tetrazine-תגובתי אחרות כגון BCN-הו, מאחר שהם יכולים לשנות את הזמנים שבהם השמירה ואת הצורה של הפסגות. זה חיוני כי ריכוז מלח של הדגימות תואם האחד בשלב ניידים ההתחלה של מעבר הצבע על מנת לקבל הפרדה טובה, במיוחד אם יותר מ 10-20 µL מוזרקים.
לגבי הניתוח של LC-MS, deglycosylation של הדגימות נוגדן נדרש כדי להשיג לשיא יחיד על deconvolution של הספקטרום raw. הדיוק של נוגדן הכולל וגושים ADC עשוי להשתנות בהתאם callibration של המכשיר. לפיכך, על מנת לחשב את המסה על השינוי, להחסיר את המסה השיג עבור נוגדנים שלא שונתה מזו השיג עבור נ. מודרני ספקטרומטרים המוני ברזולוציה גבוהה לספק הודעת שגיאה יחסית מתחת 1:10000. למרות LC-MS יכול לשמש גם כדי לחשב את היחס בין המינים השונים, ערך זה הוא בדרך כלל הערכה מופרזת כי השינוי עשוי להשפיע על יכולת יינון של המין האנושי שנוצר ולא ייתכן כמויות נמוכות של זיהומים לא יזוהו.
היציבות של מקשר ב ADCs היא קריטית, כי שחרור מוקדם של התרופה גורמת רעילות גבוהה יותר, יעילותם נמוכה יותר; cytotoxin חינם נזקים לרקמות בריאות ומתחרה הנוגדן עירום עם אחד החמושים של האתרים מחייב היעד על תאים נגועים. שחרור להלן 5%, אשר נמצאים ההשתנות של יציבות וזמינותו, אמור להיות צפוי.
בסופו של דבר, את מידת הבררנות של ADC פילוח HER2 כגון trastuzumab(MMAE)2 יכול להיות מוערך על ידי השוואת את cytotoxicity בתאי SK-BR-3 (HER2 גבוהה) ו- MCF-7 תאים (HER2 נמוך) מאז שהאחרון express 15-fold קולטני HER2 פחות מאשר לשעבר28 . Immunoconjugate צפויה לגרום לתוך הכדאיות תא לפחות 2 סדרי גודל נמוך יותר ב- SK-BR-3 בהשוואה ל- MCF-7. ה EC50 ב- SK-BR-3 צריך להיות בטווח של nanomolar-ספרתיים המשקף את האון גבוהה של29,הזה ADC30. הנוגדן שלא שונתה, trastuzumab(MMAE)2 או הרצפטין, צריך להראות אין רעילות ב זה וזמינותו. Tetrazine-vcMMAE צריך להיות עם אפקט 3 סדרי גודל נמוך יותר ADC מאז מקשר מסיר את הפעילות של הרעלן peptidomimetic. לעומת זאת, כי MMAE הוא מסוגל לחדור את קרום התא30, רצוי יש של רעילות דומה ל נ אלא להציג שום אפליה בין HER2 גבוהה וקווים תא נמוך HER2. יתר על כן, אם וזמינותו הזה מבוצע לאחר דגירה 5 ימים של נ בנסיוב, זה יכול לשמש כדי לספק הוכחה פונקציונלי היציבות של מקשר: שחרור של הרעלן יגרום לתוך גם ירידה ברמת היעילות ADC SK-BR-3 MMAE שוחרר עם p אמנות את מקשר או לירידה סלקטיביות אם מקשר היה ביקע בצורה traceless.
הטכנולוגיה ADC המתוארים בזאת מאפשר שילוב יעיל של בייעודי לאתר של נגזרת cyclopropene של ליזין לתוך IgG1s. בעקבות הוא לטיהור נתיישב, נוגדנים יכולים להיות במהירות מצומדת עם מולקולות המכילות tetrazine, מניבים מוצרים הומוגנית. בשל גודלו הקטן תגובתיות גבוהה של הידית מינימלית cyclopropene, שיטה זו צריך לאפשר את ההטיה של מטענים sterically הפריע. Immunoconjugates שנוצר יציבים בנסיוב והם מאוד חזק, סלקטיבי. בסך הכל, CypK מאפשר חיבור אמיתי bioorthogonal מהיר, בייעודי לאתר ויציב נוגדן, אחרים conjugates חלבון כדי לשמש טיפול או אבחון.
Disclosures
המחברים אין לחשוף.
Acknowledgements
עבודה זו נתמכה על ידי המועצה למחקר רפואי, בריטניה. ריח רע-S. מחזיק של אחוות EMBO (ATLF 158-2016) והיא אסירת תודה ה' פלהאם, צ'ין וו לתמיכה, קים ג'י, מורגן וו ג ו- O. Perisic עבור עזרה וייעוץ.
Materials
| Name | Company | Catalog Number | Comments |
| Expi293F | ThermoFisher Scientific | A14527 | HEK suspension cells |
| Expi293 Expression Medium | ThermoFisher Scientific | A1435101 | Expression medium |
| Antibiotic-antimycotic | ThermoFisher Scientific | 15240062 | Penicillin-streptomycin-amphotericin B |
| 125mL Polycarbonate Erlenmeyer Flask with Vent Cap | Corning | 431143 | Shake flasks |
| Brunswick S41i incubator | Eppendorf | S41I230011 | CO2 incubator with a shaker |
| Sodium hydroxide 4 mol/l (4 N) in aqueous solution | VWR | 191373M | |
| Cyclopropene lysine | Sichem | SC-8017 | In this study it was synthesized as described by Elliot et al. 2014 |
| Steriflip-GP, 0.22 µm, polyethersulfone, gamma irradiated | Merck Millipore | SCGP00525 | |
| Opti-MEM, Reduced Serum Medium | ThermoFisher Scientific | 31985070 | Reduced serum medium |
| ExpiFectamine 293 Transfection Kit | ThermoFisher Scientific | A14525 | Transfection reagent |
| 5810 R centrifuge | Eppendorf | 5811000460 | |
| Millex-GP Syringe Filter Unit, 0.22 µm, polyethersulfone, 33 mm, gamma sterilized | Merck Millipore | SLGP033RS | |
| Protein A resin | Sino Biological | 10600-P07E-RN-25 | |
| Poly-Prep Chromatography Columns, Pkg of 50 | Bio-Rad | 7311550 | Polypropylene chromatography column |
| Econo-Column Funnel | Bio-Rad | 7310003 | |
| Sodium citrate | Fluka | 71635 | |
| ÄKTA explorer FPLC | GE Healthcare | ||
| HiTrap HIC Selection Kit | GE Healthcare | 28-4110-07 | Includes HiTrap 1 mL Butyl HP |
| Ammonium sulfate | VWR | 2133.296 | |
| Isopropanol | Honywell | 34863-2.5L | |
| Dymethyl sulfoxide | Sigma-Aldrich | D8418-50ML | |
| Tetrazine-vcMMAE | ChemPartner | - | Costum synthesized |
| Tetrazine-5-TAMRA | Jena Bioscience | CLK-017-05 | |
| NuPAGE 4-12% Bis-Tris Gel 1.0mm x 10 well | ThermoFisherScientific | NP0321BOX | |
| Xcell SureLock Mini-Cell | ThermoFisherScientific | EI0001 | |
| UltiMate 3000 HPLC | ThermoFisherScientific | ||
| Thermo Scientific MAbPac, HIC-20, 4.6 x 100 mm, 5 µm | ThermoFisherScientific | 088553 | |
| PNGase F | New England BioLabs | P0704S | |
| NanoAcquity | Waters | ||
| C4 BEH 1-5 µm 1.0 x 100 mm UPLC column | Waters | ||
| 96-well microplates for cell culture | ThermoFisherScientific | 156545 | |
| Human serum | Sigma-Aldrich | H4522-20mL | |
| CO2 incubator | Panasonic | ||
| HER2 ECD | Sino Biological | 10004-HCCH | |
| Anti-TAMRA | Abcam | an171120 | |
| Anti-mouse HRP | Santa Cruz | sc-2005 | |
| TMB | BioLengend | 421101 | |
| Sulfuric acid | Sigma-Aldrich | 84727-500ML | |
| PHERAstar FS | BMG Labtech | Plate reader | |
| DMEM | Sigma-Aldrich | D5671-500ML | |
| SK-BR-3 | ATCC | HTB-30 | |
| MCF-7 | ATCC | HTB-22 | |
| CellTiterGlo 2.0 Assay | Promega | G9242 | Cell viability assay based on the measurement of ATP released after cell lysis. The output signal is luminscence. |
| Monomethyl Auristatin E | Cayman Chemical | 16267 | |
| NanoDrop 2000 | ThermoFisherScientific | Microvolume spectrophotometer | |
| Human IgG ELISA Quantificaiton Set | Bethyl | E80-104 | |
| MaxEnt1 in MassLynx | Waters | Software application for mass spectrum deconvolution | |
| IntantBlue | Expedeon | ISB1L | Coomassie-based stain |
| Intact MMAE-ADC ELISA Kit (Sandwich Assay) | Epitope Diagnostics, Inc. | KTR 782 | |
| Tube 50 mL, 114x28mm, PP | Sarstedt | 62.547.254 | Conical tube |
| Amicon Ultra-15 Centrifugal Filter Units 50,000 NMWL | Merck | UFC905024 | Centrifugal filtration concentrator (after protein A pull down) |
| Amicon Ultra-4 Centrifugal Filter Units 50,000 NMWL | Merck | UFC805024 | Centrifugal filtration concentrators (after FPLC or HPLC purification) |
| Zeba Spin Desalting Columns, 7K MWCO, 0.5 mL | ThermoFisherScientific | 89882 | Size exclusion spin columns |
| Tube PCR 0.2ml Flat Cap | Thistle Scientific Ltd | AX-PCR-02-C-CS | PCR tubes |
| Nunc MaxiSorpª flat-bottom | ThermoFisherScientific | 44-2404-21 | Plates for ELISA |
References
- Beck, A., Goetsch, L., Dumontet, C., Corvaia, N. Strategies and challenges for the next generation of antibody-drug conjugates. Nature Reviews Drug Discovery. 16 (5), 315-337 (2017).
- Wakankar, A. A., et al. Physicochemical Stability of the Antibody−Drug Conjugate Trastuzumab-DM1: Changes due to Modification and Conjugation Processes. Bioconjugate Chemistry. 21 (9), 1588-1595 (2010).
- Stan, A. C., Radu, D. L., Casares, S., Bona, C. A., Brumeanu, T. -. D. Antineoplastic Efficacy of Doxorubicin Enzymatically Assembled on Galactose Residues of a Monoclonal Antibody Specific for the Carcinoembryonic Antigen. Cancer Research. 59 (1), 115-121 (1999).
- Hamblett, K. J., et al. Effects of Drug Loading on the Antitumor Activity of a Monoclonal Antibody Drug Conjugate. Clinical Cancer Research. 10 (20), 7063-7070 (2004).
- Chari, R. V. J., Miller, M. L., Widdison, W. C. Antibody-Drug Conjugates: An Emerging Concept in Cancer Therapy. Angewandte Chemie International Edition. 53 (15), 3796-3827 (2014).
- Chin, J. W. Expanding and Reprogramming the Genetic Code. Nature. 550 (7674), 53-60 (2017).
- Axup, J. Y., et al. Synthesis of Site-Specific Antibody-Drug Conjugates Using Unnatural Amino Acids. Proceedings of the National Academy of Sciences of the United States of America. 109 (40), 16101-16106 (2012).
- Hallam, T. J., Wold, E., Wahl, A., Smider, V. V. Antibody Conjugates with Unnatural Amino Acids. Molecular Pharmaceutics. 12 (6), 1848-1862 (2015).
- Tian, F., et al. A General Approach to Site-Specific Antibody Drug Conjugates. Proceedings of the National Academy of Sciences of the United States of America. 111 (5), 1766-1771 (2014).
- Kern, J. C., et al. Discovery of Pyrophosphate Diesters as Tunable, Soluble, and Bioorthogonal Linkers for Site-Specific Antibody-Drug Conjugates. Journal of the American Chemical Society. 138 (4), 1430-1445 (2016).
- Zimmerman, E. S., et al. Production of Site-Specific Antibody-Drug Conjugates Using Optimized Non-Natural Amino Acids in a Cell-Free Expression System. Bioconjugate Chemistry. 25 (2), 351-361 (2014).
- VanBrunt, M. P., et al. Genetically Encoded Azide Containing Amino Acid in Mammalian Cells Enables Site-Specific Antibody-Drug Conjugates Using Click Cycloaddition Chemistry. Bioconjugate Chemistry. 26 (11), 2249-2260 (2015).
- Xiao, H., et al. Genetic Incorporation of Multiple Unnatural Amino Acids into Proteins in Mammalian Cells. Angewandte Chemie International Edition. 52 (52), 14080-14083 (2013).
- Milles, S., et al. Click Strategies for Single-Molecule Protein Fluorescence. Journal of the American Chemical Society. 134 (11), 5187-5195 (2012).
- Lallana, E., Riguera, R., Fernandez-Megia, E. Reliable and Efficient Procedures for the Conjugation of Biomolecules through Huisgen Azide-Alkyne Cycloadditions. Angewandte Chemie International Edition. 50 (38), 8794-8804 (2011).
- Koehler, C., et al. Genetic Code Expansion for Multiprotein Complex Engineering. Nature Methods. 13 (12), 997-1000 (2016).
- Lyon, R. P., et al. Reducing Hydrophobicity of Homogeneous Antibody-Drug Conjugates Improves Pharmacokinetics and Therapeutic Index. Nature Biotechnology. 33 (7), 733-735 (2015).
- Elliott, T. S., et al. Proteome Labeling and Protein Identification in Specific Tissues and at Specific Developmental Stages in an Animal. Nature Biotechnology. 32, 465-472 (2014).
- Ravasco, J. M. J. M., Monteiro, C. M., Trindade, A. F. Cyclopropenes: A New Tool for the Study of Biological Systems. Organic Chemistry Frontiers. 4 (6), 1167-1198 (2017).
- Yang, J., Šečkutė, J., Cole, C. M., Devaraj, N. K. Live-Cell Imaging of Cyclopropene Tags with Fluorogenic Tetrazine Cycloadditions. Angewandte Chemie International Edition. 124 (30), 7594-7597 (2012).
- Oller-Salvia, B., Kym, G., Chin, J. W. Rapid and Efficient Generation of Stable Antibody-Drug Conjugates via an Encoded Cyclopropene and an Inverse-Electron-Demand Diels-Alder Reaction. Angewandte Chemie International Edition. 57, 2831-2834 (2018).
- Schmied, W. H., Elsässer, S. J., Uttamapinant, C., Chin, J. W. Efficient Multisite Unnatural Amino Acid Incorporation in Mammalian Cells via Optimized Pyrrolysyl tRNA Synthetase/tRNA Expression and Engineered eRF1. Journal of the American Chemical Society. 136 (44), 15577-15583 (2014).
- Junutula, J. R., et al. Site-Specific Conjugation of a Cytotoxic Drug to an Antibody Improves the Therapeutic Index. Nature Biotechnology. 26 (8), 925-932 (2008).
- Junutula, J. R., et al. Rapid Identification of Reactive Cysteine Residues for Site-Specific Labeling of Antibody-Fabs. Journal of Immunological Methods. 332 (1), 41-52 (2008).
- Doronina, S. O., et al. Development of potent monoclonal antibody auristatin conjugates for cancer therapy. Nature Biotechnology. 21 (7), 778-784 (2003).
- Shiraishi, Y., et al. Identification of Highly Reactive Cysteine Residues at Less Exposed Positions in the Fab Constant Region for Site-Specific Conjugation. Bioconjugate Chemistry. 26 (6), 1032-1040 (2015).
- Sabourin, M., et al. Increasing Antibody Yield and Modulating Final Product Quality using the Freedom(TM). CHO-S(TM) Production Platform. BMC Proceedings. 5 (8), 102 (2011).
- Xiao, Y., Gao, X., Maragh, S., Telford, W. G., Tona, A. Cell Lines as Candidate Reference Materials for Quality Control of ERBB2 Amplification and Expression Assays in Breast Cancer. Clinical Chemistry. 55 (7), 1307-1315 (2009).
- Shinmi, D., et al. One-Step Conjugation Method for Site-Specific Antibody-Drug Conjugates through Reactive Cysteine-Engineered Antibodies. Bioconjugate Chemistry. 27 (5), 1324-1331 (2016).
- Badescu, G., et al. Bridging Disulfides for Stable and Defined Antibody Drug Conjugates. Bioconjugate Chemistry. 25 (6), 1124-1136 (2014).
- Vazquez-Lombardi, R., et al. Transient expression of human antibodies in mammalian cells. Nature Protocols. 13 (1), 99-117 (2018).
- Baldi, L., Hacker, D. L., Meerschman, C., Wurm, F. M., Hartley, J. L. . Protein Expression in Mammalian Cells: Methods and Protocols. , 13-26 (2012).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved