Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
La multiplexación enfocada ultrasonido estimulación con microscopía de fluorescencia
En este artículo
Resumen
Estimulación de ultrasonido pulsado (LIPUS) de baja intensidad es una modalidad de estimulación mecánica no invasiva de células endógenas o ingeniería con alta resolución espacial y temporal. Este artículo describe cómo implementar LIPUS a un microscopio de epifluorescencia y cómo minimizar el desajuste de impedancia acústica en el camino de ultrasonido para evitar artefactos mecánicos no deseados.
Resumen
Al enfocar pulsos de ultrasonido de baja intensidad que penetran en los tejidos blandos, LIPUS representa una prometedora Tecnología biomédica remotamente y con seguridad manipular leña neuronal, secreción hormonal y las células reprogramadas genéticamente. Sin embargo, la traducción de esta tecnología para aplicaciones médicas actualmente es obstaculizada por la falta de mecanismos biofísicos que objetivo sentido tejidos y responder a LIPUS. Un enfoque adecuado para identificar estos mecanismos sería utilizar biosensores ópticos en combinación con LIPUS para determinar base de vías de señalización. Sin embargo, aplicación del LIPUS a un microscopio de fluorescencia puede introducir artefactos mecánicos indeseados debido a la presencia de interfaces físicas que reflejan, absorben y refractan las ondas acústicas. Este artículo presenta un procedimiento paso a paso para incorporar LIPUS a microscopios de epifluorescencia vertical comercialmente disponibles y reducir al mínimo la influencia de interfaces físicas a lo largo de la trayectoria acústica. Se describe un procedimiento sencillo para operar un solo elemento transductor y para poner la zona focal del transductor en el punto focal objetivo. El uso de LIPUS se ilustra con un ejemplo de transitorios del calcio LIPUS-inducida en células de glioblastoma humano cultivadas medidas usando proyección de imagen del calcio.
Introducción
Muchas enfermedades requieren de algún tipo de intervención médica invasiva. Estos procedimientos son a menudo costosas, riesgosas, requieren periodos de recuperación y así añadir una carga a los sistemas de salud. Modalidades terapéuticas no invasivas tienen el potencial para ofrecer alternativas más seguras y más baratas a los procedimientos quirúrgicos convencionales. Sin embargo, actuales no invasivos como la farmacoterapia o transcraneal de la estimulación magnética a menudo están limitados por las compensaciones entre la penetración del tejido, resolución espaciotemporal y efectos no deseados fuera del objetivo. En este contexto, un ultrasonido focalizado constituye una tecnología no invasiva prometedora con el potencial para manipular funciones biológicas en tejidos con alta precisión espacio-temporal y limitados efectos off-target.
Ultrasonido focalizado estimulación consiste en entregar energía acústica en lugares precisos dentro de los organismos vivos. Dependiendo de los parámetros de pulso acústico, esta energía puede tener una variedad de aplicaciones médicas. Por ejemplo, la Food and Drug Administration ha aprobado el uso de ultrasonidos focalizados de alta intensidad (HiFU) para la ablación térmica de tumores de próstata, regiones del cerebro que causa temblor, fibromas uterinos y las terminaciones nerviosas causando dolor en metástasis óseas1 . Cavitación HiFu-mediada microburbujas también se utiliza para abrir transitoriamente la barrera blood - brain para la entrega específica de terapéutica administrada sistémicamente2. La intensidad de pulso promedio pico espacial (Isppa) y pico espacial temporal media intensidad (spta) utilizado para HiFU aplicaciones suelen ser por encima de varios kW cm-2 y producen la presión de pulso de varias decenas de MPa. Estos valores de intensidad son muy por encima del aprobado por la FDA-sppa yspta límites de ultrasonido diagnóstico, 190 W cm-2 y 720 mW cm-2, respectivamente3. Por el contrario, estudios recientes han demostrado que el estímulo no destructivo ultrasonido pulsado que están dentro o cerca de la gama de los límites de intensidad de ultrasonido diagnóstico (LIPUS) puede ser eficaz de forma remota y segura manipulación neural disparar4, 5,6,7,8, secreción hormonal9,10 y Bioingeniería células11. Sin embargo, los mecanismos celulares y moleculares por el cual las células sensación y responden al ultrasonido no quedan claros, imposibilitando la traducción clínica de LIPUS. Por lo tanto, en los últimos años, estudios de membranas artificiales, cultivos de células y animales estimulados con ultrasonido han ganado impulso para revelar biofísicos y los procesos fisiológicos modulan por LIPUS12,13, 14,15.
Sonido consiste en una vibración propagación por un medio físico. Un ultrasonido es un sonido con una frecuencia por encima del rango audible humano (es decir, por encima de 20 kHz). En un entorno de laboratorio, ondas de ultrasonido se producen generalmente por transductores piezoeléctricos que contienen un material que vibra en respuesta a un campo eléctrico Oscilante en un determinado ancho de banda de alta frecuencia. Existen dos tipos de transductores: único elemento transductores y arreglos de discos de transductor. Transductores piezoeléctricos individuales poseen una superficie curva que actúa como una lente de enfoque y por lo tanto, se concentra la energía acústica en una región definida llamada la zona focal. Único elemento transductores están mucho más barato y más fácil de utilizar que los arreglos de discos de transductor. Este artículo se centrará en transductores de elemento único.
El tamaño de la zona focal de un transductor de elemento enfocado depende de las propiedades geométricas de la lente acústica y su frecuencia acústica. Para lograr una zona focal de tamaño milimétrico con un transductor de elemento, frecuencias de ultrasonido en el rango de MHz se requiere generalmente. Desafortunadamente, las ondas acústicas en tal frecuencia se atenúan muy rápidamente cuando se propaga en un medio frágil como el aire. Así, las ondas del ultrasonido MHz tiene que ser generado y propagado a la muestra en un material más denso como el agua. Esto constituye el primer desafío de integración de la modalidad LIPUS a un microscopio.
Un segundo desafío es minimizar interfaces físicas entre materiales con diferentes impedancias acústicas (que es un producto de la densidad material y la velocidad acústica) a lo largo de la trayectoria acústica. Estas interfaces se pueden reflejar, refractar, dispersión y absorber las ondas acústicas, lo que hace difícil cuantificar la cantidad de energía acústica efectivamente entregado a una muestra. También pueden crear artefactos mecánicos no deseados. Por ejemplo, reflejos produce desajuste perpendicular al acústico impedancia interfaces crean backpropagating ondas que interfieren con los de propagación hacia adelante. A lo largo de la ruta de interferencia, las olas cancelan mutuamente en regiones fijadas de espacios llamados nodos y resumir en alternando regiones llamadas los nodos, creación de supuesto ondas estacionarias (figura 1). Es importante que el experimentador poder controlar o eliminar estas interfaces experimentales in vitro , que pueden no existir en vivo.
Medida de fluorescencia óptica reporteros es un método bien conocido para interrogar las muestras biológicas transparentes en tiempo real y con ninguna alteración física. Este enfoque por lo tanto es ideal para estudios LIPUS como cualquier sondas físicas presentes en el área de sonicación introducir artefactos mecánicos. Este protocolo describe la implementación y operación de LIPUS a un microscopio de epi-fluorescencia comercial.
Protocolo
1. cultivo de células de película de poliester transparente acústicamente
- Un tamaño de orificio de 12 mm en la parte inferior de una placa de cultivo de 35 mm estándar utilizando un taladro de prensa vertical del taladro. El taladro se mueven lentamente y Protéjase los ojos. Retire las piezas de plástico en la parte inferior del plato con una hoja para crear una superficie lisa en el lado externo (figura 2).
- Aplique una capa delgada de resina epóxica grado marino o pegamento en la superficie inferior externa del plato.
- Coloque una capa de poliester (2,5 μm espesor) contra la superficie inferior externa del plato y presione firmemente para asegurarse de que el pegamento de epoxi se separa uniformemente entre la película y la superficie de plástico gruesa. Tire suavemente de la película de manera centrífuga con los dedos para crear una superficie plana (figura 2).
- Cuando se haya secado el pegamento epoxy, brevemente enjuague secado el fondo poliéster plato con etanol al 95% y esterilizar colocando el plato y el interior de su tapa en una fuente de excitación fuerte de 254 nm UV superficial. Ajustar la duración y la intensidad para entregar una dosis UV de aproximadamente 330 mJ cm-2 para la destrucción completa de la mayoría de los microorganismos. Esta energía corresponde aproximadamente con una duración de 5 minutos utilizando un 1.000 μW cm-2 UV la iluminación.
- Alícuota comercialmente disponible matriz extracelular proteína mezclas (EMPM) en tubos pequeños (50-100 μL) y almacenar a-20 ° C o menos en condiciones estériles.
- En un ambiente estéril (por ejemplo, dentro de un gabinete de bioseguridad), diluir un caldo congelado de la EMPM con un medio de cultivo deseado a 1: 100. Trabajar en hielo para evitar EMPM polimerización a temperatura ambiente. Aplicar rápidamente 100 μl de la mezcla de media en la película de poliester. Coloque la tapa en el plato para mantener la esterilidad.
- Incubar los platos de la parte inferior de poliéster revestido EMPM en una célula cultura CO2 la incubadora a 37 ° C durante 6-12 h.
- Después de la incubación, aspirar el exceso medio y semilla directamente la superficie con las células de la densidad deseada. Trabajar bajo condiciones de esterilidad para mantener la esterilidad.
2. LIPUS implementación
- Colocar un tanque de agua por debajo del objetivo de un microscopio vertical con gran volumen de trabajo y sin hardware de iluminación en la ruta de transmisión.
- Usando componentes optomecánicos comercialmente disponibles, coloque un poseedor de muestra abajo el objetivo y un transductor por debajo del sostenedor de la muestra. Muestra posterior búsqueda y ultrasonido alineación, la Monte estos dos titulares sobre etapas de la traducción.
- Coloque las piezas móviles y actuadores de etapas de la traducción fuera del tanque o por encima de la línea de agua para evitar daños por agua. Utilice sólo materiales no corrosivos como el aluminio anodizado o acero inoxidable para componentes optomecánicos sumergidos.
- Llene el tanque con agua desionizado y desgasificado antes de utilizar el transductor de inmersión. La línea del agua debe coincidir con el plano horizontal del portamuestras (figura 3).
Nota: Agua desionizada evita el acoplamiento eléctrico en presencia de campos eléctricos de alta. Desgasificación también evitará dispersión y alteraciones de las ondas acústicas. Drene el agua después de cada experimento con una bomba o una válvula para que la línea de agua cae por debajo de la posición del transductor. También, reemplazar o filtrar el agua con frecuencia y limpiar el tanque de agua según sea necesario para evitar el crecimiento de microorganismos.
3. oblicua excitación acústica
- Utilizando componentes optomecánicos comercialmente disponible, Oriente el transductor en una posición oblicua con respecto a la vía óptica. Esto se asegurará de que ninguna refleja ondas serán dirigidas de la muestra (figura 3 y figura 4).
4. conducir el transductor
Nota: Transductores de ultrasonido para convierten energía eléctrica oscilante mecánica expansión/contracción de un material piezoeléctrico. Esta conversión produce pérdida de energía en forma de energía térmica. Por lo tanto, mientras que los transductores poseen un límite de voltaje de entrada máximo, también poseen un límite de corriente eléctrica para evitar el daño térmico al elemento piezoeléctrico: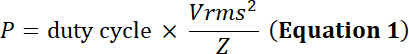
la tarea ciclo de la fracción relativa del tiempo de simulación eléctrica, P la potencia eléctrica (en vatios), Vrms voltaje raíz cuadrada media (en voltios) de la fuente de voltaje alternativo y Z eléctrico impedancia (en Ohms).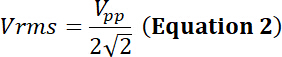
con Vpp el voltaje de pico a pico de entrada aplicado al transductor.
- Crear una forma de onda sinusoidal con la frecuencia deseada, número de ciclos por pulso, y la frecuencia de repetición utilizando un generador de función comercial del pulso. Sin embargo, el relativamente alto Vpp necesario para conducir eficazmente transductores de ultrasonido estándar a menudo requiere la adición de un amplificador para amplificar la salida (es decir, aumento de la amplitud de Vpp) del generador de funciones.
Nota: por ejemplo, fabricante de un transductor indica el límite de potencia para un transductor dado es de 35 w el. ¿Será un pico a pico sinusoidal voltaje (Ven) de 500 mV en un deber ciclo del 50% y amplificada a través de 50 dB/100 amplificador de W ser dentro del límite de potencia de este transductor?- Para responder a esta pregunta, calcular la tensión después de la amplificación. Para un amplificador de potencia de radiofrecuencia (RF), el factor de amplificación (dB) se define por:
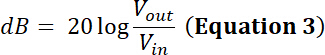
Así, la tensión amplificada tiene una amplitud de salida Vpp (Vpp =hacia fuera) de: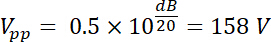
Usando las ecuaciones 1 y 2, utilizando 50 Ω como impedancia eléctrica, la energía correspondiente generada por esta tensión es: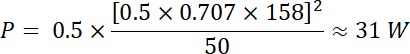
Esta estimulación es, por tanto, dentro del límite de corriente del transductor. - El ejemplo anterior, calcular los parámetros de forma de onda (Vpp, frecuencia, duración del pulso y la frecuencia de repetición de pulso) que corresponden a los límites de corriente y el voltaje suministrados por el fabricante del transductor. Asegúrese de respetar estos límites para evitar dañar el transductor y otros instrumentos conectados.
- Para responder a esta pregunta, calcular la tensión después de la amplificación. Para un amplificador de potencia de radiofrecuencia (RF), el factor de amplificación (dB) se define por:
- Elegir un generador de funciones que opera dentro de un rango de frecuencias compatible con el transductor de ultrasonido. Ajusta la frecuencia del generador de función a la frecuencia máxima nominal del transductor.
- Crear un pulso de voltaje sinusoidal de la duración deseada y la frecuencia de repetición usando el modo ráfaga del generador de funciones. Ajuste el voltaje de pico a pico a un valor deseado. Asegúrese de que la duración del pulso es más corto que el tiempo transcurrido entre dos pulsos consecutivos.
- Comprobar que la forma de onda corresponde a la señal deseada mediante la conexión de la salida del generador de funciones a la entrada de un osciloscopio.
- Conecte la salida del generador de funciones a la entrada de un amplificador de RF (figura 4). Asegúrese de que los parámetros de estimulación son dentro de los límites del fabricante del transductor.
5. viga de alineación
- Elegir un hidrófono que opera con una frecuencia acústica y rango de intensidad compatible con la frecuencia y la intensidad del transductor de ultrasonido.
- Llevar cuidadosamente la punta de una sonda de hidrófono en foco dentro del campo de visión objetivado en la posición correspondiente a la posición de la muestra (figura 4).
- Asegúrese de que la sonda y transductor se sumergen en agua desionizado y desgasificado. Golpee la punta del hidrófono con cualquier objeto físico que no sea agua, ya que esto altera su capa y afectar la medición.
- Realizar una alineación previa bruta del transductor colocando visualmente su eje acústico hacia la sonda de hidrófono. Se asegura que la distancia entre la superficie del transductor y la punta de hidrófono corresponde aproximadamente a la distancia focal del transductor.
- Conecte el hidrófono de la salida a una entrada de señal del osciloscopio. Conectar el disparador de sincronización de la función a otra entrada del osciloscopio. Visualizar dos señales simultáneamente en el osciloscopio.
- Conducir el transductor con pocos ciclos de ultrasonido en un ciclo de trabajo baja y baja amplitud para evitar dañar la sonda. Compruebe las condiciones de operación segura de fabricante de hidrófono para evitar dañar la punta del hidrófono.
- Ajuste la perilla s/división según el tiempo del recorrido de ultrasonido de la superficie del transductor para el hidrófono. Cuidar para un hidrófono de señal en el osciloscopio el disparador de sincronización.
- Accione lentamente el transductor con una etapa XYZ motorizada o manual. Dejar el transductor en la posición que se correlaciona con la señal de máxima hidrófono (figura 4).
Nota: Si no se detecta ninguna señal, es posible que la intensidad de los pulsos acústicos es demasiado baja o que la viga está mal alineada o dispersa por un objeto. Compruebe con regularidad que el hidrófono y el transductor son visualmente Pre-alineada y que no hay burbujas u objeto físico presente en el camino excepto la película de poliester. Si todavía no se detecta ninguna señal, aumentar la tensión de entrada por una pequeña cantidad para aumentar la amplitud de la señal del hidrófono.
6. determinación de la presión de pulso de ultrasonido y la intensidad
- Con el rayo alineado, medir la amplitud de pico a pico del hidrófono en el osciloscopio para varios voltajes conduce el transductor de salida. Asegúrese de no exceder el límite de presión recomendado por el fabricante del hidrófono.
- A convertir estas mediciones de presión y/o valores de intensidad acústica mediante el método de calibración suministrado por el fabricante del hidrófono.
Nota: La intensidad acústica se puede determinar de la presión y viceversa, utilizando la fórmula:
con la presión acústica (en W m-2), P la presión acústica (en Pa), ρ la densidad de la propagación de material (1.000 kg m-3 para el agua) y c la velocidad del sonido en el medio de propagación (agua, c = 1.500 m s-1). - Crear curvas de calibración usando estas medidas.
Nota: Las presión vs tensión e intensidad vs voltaje curvas tienen forma lineal y parabólica, respectivamente. - Determinar el valor de presión o intensidad de un voltaje de conducción deseado mediante la correspondiente curva de calibración.
7. imágenes por fluorescencia de células vivas calcio-sensible/LIPUS
- Reemplazar el medio de cultivo de la célula con un búfer de imagen deseado con 5 μm de un colorante sensible a calcio celular florescente (p. ej., Fluo-4 AM). Incubar la placa de cultivo en un incubador de2 CO a 37 ° C durante 1 hora.
- Lave cuidadosamente las células con el mismo buffer libre de tinte.
- Coloque el plato en el portamuestras. Excitar las células utilizando iluminación luz azul (490 nm) y ajustar la excitación exposición intensidad y cámara para evitar la excesiva saturación de blanqueo o pixel.
- Realizar proyección de imagen de Time-lapse parámetros de adquisición de imagen deseada. Utilice un objetivo de inmersión para una mejor calidad de imagen y con distancia de funcionamiento larga para reducir reflexiones no deseadas (ver figura 4).
Resultados
Figura 5 es un ejemplo de experimento LIPUS multiplexado con proyección de imagen de calcio. Células de glioblastoma (A-172) se cultiva en EMPM recubierto de película de poliéster en medio de cultivo estándar (suplementado con 10% suero y 1% antibióticos) y se incubaron con el reportero fluorescente sensible al calcio Fluo-4 AM. Células fueron fotografiadas usando un lente de inmersión X 10 e iluminado con una fuente de luz blanca de LED y luz de la f...
Discusión
Una ventaja principal de ultrasonido focalizado es su capacidad para proporcionar de forma no invasiva energía mecánica o térmica a muestras biológicas con la alta precisión espacio-temporal. Otras técnicas pretende estimular mecánicamente las células generalmente emplean sondas física invasiva (por ejemplo, meter celular) o requiere la interacción de rayos láser de alta energía con objetos extraños (por ejemplo, pinzas ópticas). Calefacción magnético puede calentar ubicaciones espaciale...
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Agradecemos a los Drs. Mikhail Shapiro y Nikita Reznik discusiones fructíferas. Este trabajo fue apoyado por fondos de puesta en marcha de la Western University of Health Sciences y NIH grant R21NS101384.
Materiales
| Name | Company | Catalog Number | Comments |
| upright microscope with large working volume | Thorlabs | CERNA | |
| upright microscope with large working volume | Scientifica | SliceScope | |
| optomechanical components | Thorlabs | n/a | |
| needle hydrophone | ONDA Corporation | HNP/C/R/A/T series + AH/G pre-amplifier | |
| needle hydrophone | Precision Acoustics | n/a | |
| fiber optic hydrophone | ONDA Corporation | HFO series | |
| fiber optic hydrophone | Precision Acoustics | n/a | |
| oscilloscope | Keysight Technology | DSOX2004A (4-channels 70MHz) | |
| function generator | Keysight Technology | 33500B (20MHz single-channel) | |
| RF power amplifier | Electronic Navigation Industries (ENI) | 325LA, 525LA, 240L, 350L, A075, 2100L, 3100LA | |
| RF power amplifier | Electronics & Innovation (E&I) | ||
| immersion ultrasound transducer | Olympus | focused immersion transdcuers | |
| immersion ultrasound transducer | Benthowave Instrument | HiFu transducer BII-76 series | |
| immersion ultrasound transducer | Precision Acoustics | Piezo-ceramic or HiFu transducers | |
| immersion ultrasound transducer | Ultrasonic-S-lab | HiFu transducers made to order | |
| high-density Matrigel | Corning | VWR 80094-330 | |
| Mylar film 2.5 microns | Chemplex | CAT.NO:107 |
Referencias
- Elhelf, I. A. S., et al. High intensity focused ultrasound: The fundamentals, clinical applications and research trends. Diagnostic and Interventional Imaging. 99 (6), 349-359 (2018).
- Toccaceli, G., Delfini, R., Colonnese, C., Raco, A., Peschillo, S. . Emerging strategies and future perspective in neuro-oncology using Transcranial Focused Ultrasound Technology. , (2018).
- Duck, F. A. Medical and non-medical protection standards for ultrasound and infrasound. Progress in Biophysics and Molecular Biology. 93 (1-3), 176-191 (2007).
- Legon, W., et al. Transcranial focused ultrasound modulates the activity of primary somatosensory cortex in humans. Nature Neuroscience. 17 (2), 322-329 (2014).
- Tyler, W. J. The mechanobiology of brain function. Nature Reviews: Neuroscience. 13 (12), 867-878 (2012).
- Tyler, W. J. Noninvasive neuromodulation with ultrasound? A continuum mechanics hypothesis. Neuroscientist. 17 (1), 25-36 (2011).
- Tufail, Y., et al. Transcranial pulsed ultrasound stimulates intact brain circuits. Neuron. 66 (5), 681-694 (2010).
- Tyler, W. J., et al. Remote excitation of neuronal circuits using low-intensity, low-frequency ultrasound. PloS One. 3 (10), e3511 (2008).
- Suarez Castellanos, I., et al. Calcium-dependent ultrasound stimulation of secretory events from pancreatic beta cells. Journal of Therapeutic Ultrasound. 5, 30 (2017).
- Suarez Castellanos, I., Jeremic, A., Cohen, J., Zderic, V. Ultrasound Stimulation of Insulin Release from Pancreatic Beta Cells as a Potential Novel Treatment for Type 2 Diabetes. Ultrasound in Medicine and Biology. 43 (6), 1210-1222 (2017).
- Ibsen, S., Tong, A., Schutt, C., Esener, S., Chalasani, S. H. Sonogenetics is a non-invasive approach to activating neurons in Caenorhabditis elegans. Nature Communications. 6, 8264 (2015).
- Prieto, M. L., Firouzi, K., Khuri-Yakub, B. T., Maduke, M. Activation of Piezo1 but Not NaV1.2 Channels by Ultrasound at 43 MHz. Ultrasound in Medicine and Biology. 44 (6), 1217-1232 (2018).
- Kubanek, J., et al. Ultrasound modulates ion channel currents. Scientific Reports. 6, 24170 (2016).
- Prieto, M. L., Omer, O., Khuri-Yakub, B. T., Maduke, M. C. Dynamic response of model lipid membranes to ultrasonic radiation force. PloS One. 8 (10), e77115 (2013).
- Sato, T., Shapiro, M. G., Tsao, D. Y. Ultrasonic Neuromodulation Causes Widespread Cortical Activation via an Indirect Auditory Mechanism. Neuron. 98 (5), 1031-1041 (2018).
- O'Brien, W. D. Ultrasound-biophysics mechanisms. Progress in Biophysics and Molecular Biology. 93 (1-3), 212-255 (2007).
- Shapiro, M. G., Homma, K., Villarreal, S., Richter, C. P., Bezanilla, F. Corrigendum: Infrared light excites cells by changing their electrical capacitance. Nature Communications. 8, 16148 (2017).
- Shapiro, M. G., Homma, K., Villarreal, S., Richter, C. P., Bezanilla, F. Infrared light excites cells by changing their electrical capacitance. Nature Communications. 3, 736 (2012).
- Shapiro, M. G., Priest, M. F., Siegel, P. H., Bezanilla, F. Thermal mechanisms of millimeter wave stimulation of excitable cells. Biophysical Journal. 104 (12), 2622-2628 (2013).
- Hwang, J. Y., et al. Investigating contactless high frequency ultrasound microbeam stimulation for determination of invasion potential of breast cancer cells. Biotechnology and Bioengineering. 110 (10), 2697-2705 (2013).
- Nakano, M., et al. Genetically encoded ratiometric fluorescent thermometer with wide range and rapid response. PloS One. 12 (2), e0172344 (2017).
- Donner, J. S., Thompson, S. A., Kreuzer, M. P., Baffou, G., Quidant, R. Mapping intracellular temperature using green fluorescent protein. Nano Letters. 12 (4), 2107-2111 (2012).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados