É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Multiplexação focada a estimulação de ultra-som com microscopia de fluorescência
Neste Artigo
Resumo
Estimulação de ultra-som pulsado da baixo-intensidade (U.S.P) é uma modalidade para a estimulação mecânica não-invasiva de células endógenas ou projetadas com alta resolução espacial e temporal. Este artigo descreve como implementar U.S.P para um microscópio de fluorescência-epi e como minimizar a incompatibilidade de impedância acústica ao longo do caminho de ultra-som para evitar artefatos mecânicos indesejáveis.
Resumo
Centrando-se pulsos de ultra-som de baixa intensidade que penetram os tecidos moles, U.S.P representa uma tecnologia promissora biomédica remotamente e com segurança manipular disparo neural, secreção hormonal e células reprogramadas geneticamente. No entanto, a tradução desta tecnologia para aplicações médicas atualmente é dificultada pela falta de mecanismos biofísicos pelo qual sentido de tecidos como alvo e responder a U.S.P. Uma abordagem adequada para identificar esses mecanismos seria usar biossensores ópticos em combinação com U.S.P para determinar subjacentes vias de sinalização. No entanto, implementar U.S.P a um microscópio de fluorescência pode introduzir artefatos mecânicos indesejáveis devido à presença de interfaces físicas que reflectem, absorvem e refratam ondas acústicas. Este artigo apresenta um procedimento passo a passo para incorporar U.S.P para microscópios comercialmente disponíveis na vertical epi-fluorescência, minimizando a influência das interfaces físicas ao longo do trajeto acústico. Um procedimento simples é descrito para operar um transdutor de ultrassom de elemento único e trazer a zona focal do transdutor para o ponto focal objectivo. O uso de U.S.P é ilustrado com um exemplo de transientes de cálcio U.S.P-induzida em células de glioblastoma humano culta medidas utilizando imagens de cálcio.
Introdução
Muitas doenças requerem alguma forma de intervenção médica invasiva. Estes procedimentos são muitas vezes caro, arriscado, requerem períodos de recuperação e, portanto, adicionar um fardo para sistemas de saúde. Modalidades terapêuticas não-invasivos têm potencial para fornecer alternativas mais seguras e mais baratas para procedimentos cirúrgicos convencionais. No entanto, as abordagens atuais não-invasiva como farmacoterapia ou transcraniana estimulação magnética frequentemente são limitadas pelo trade-offs entre a penetração do tecido, spatiotemporal resolução e efeitos indesejados fora do alvo. Neste contexto, um ultrasound focalizado constitui uma tecnologia promissora e não-invasiva com o potencial de manipular funções biológicas dentro de tecidos com alta precisão spatiotemporal e efeitos limitados fora do alvo.
Estimulação do ultrasound focalizado consiste de fornecimento de energia acústica em locais precisos dentro de organismos vivos. Dependendo dos parâmetros de pulso acústico, esta energia pode ter uma variedade de usos médicos. Por exemplo, a Food and Drug Administration aprovou o uso do ultra-som de focado de alta intensidade (HiFU) para ablação térmica de tumores de próstata, regiões do cérebro causando o tremor, miomas uterinos e causando dor de terminações nervosas em metástases ósseas1 . Mediada por HiFu microbolhas cavitação também é usada para abrir transitoriamente a barreira sangue - cérebro, para a entrega de alvo da terapêutica administrada sistemicamente2. A intensidade do pulso-média de pico espacial (eusppa) e pico espacial temporal-média intensidade (euspta) usado para HiFU aplicações são tipicamente acima vários kW cm-2 e produzem a pressão de pulso de várias dezenas de MPa. Esses valores de intensidade são muito acima da FDA-aprovadosppa e euspta limites para ultra-som diagnóstico, 190 W cm-2 e 720 mW cm-2, respectivamente3. Em contraste, estudos recentes demonstraram que a estimulação não-destrutivos ultra-som pulsado que estão dentro ou perto da gama de limites de intensidade do ultra-som diagnóstico (U.S.P.) pode ser eficaz para remotamente e com segurança manipular neural disparar4, 5,6,7,8, secreção hormonal9,10 e bioengenharia células11. Ainda, os mecanismos celulares e moleculares pelos quais células detetam e respondem ao ultra-som permanecem pouco claras, impedindo a tradução clínica da U.S.P. Por isso, nos últimos anos, estudos de membranas artificiais, células cultivadas e animais estimulados com ultra-som ganharam ímpeto para revelar biofísicas e processos fisiológicos modulada por U.S.P12,13, 14,15.
Som consiste de uma vibração de propagação através de um meio físico. Um ultra-som é um som com uma frequência acima da faixa audível humana (isto é, acima de 20 kHz). Em um ambiente de laboratório, ondas de ultra-som são geralmente produzidas por transdutores piezoelétricos que contêm um material que vibra em resposta a um campo elétrico oscilando em uma largura de banda alta frequência específica. Existem dois tipos de transdutores: único elemento transdutores e matrizes do transdutor. Transdutores piezoelétricos único elemento possuem uma superfície curva que atua como uma lente de focalização e, portanto, concentra a energia acústica em uma região definida, chamada de zona focal. Transdutores de elemento único são muito mais barato e mais fácil de operar do que matrizes de transdutor. Este artigo irá se concentrar em transdutores de elemento único.
O tamanho da zona focal de um transdutor de elemento único focalizado depende as Propriedades geométricas da lente acústica e sua frequência acústica. Para atingir uma zona focal milímetros-tamanho com um transdutor de elemento único, frequências de ultra-som na faixa de MHz são geralmente necessárias. Infelizmente, ondas acústicas numa frequência tão rapidamente são atenuadas quando propagadas em meio tênue como o ar. Assim, as ondas de ultra-som MHz precisam ser gerado e propagado para a amostra em um material mais denso como água. Este constitui o primeiro desafio em integrar a modalidade U.S.P a um microscópio.
Um segundo desafio é minimizar as interfaces físicas entre materiais com diferentes impedâncias acústicas (que é um produto da densidade do material e a velocidade acústica) ao longo do trajeto acústico. Estas interfaces podem refletir, refratar, dispersão e absorver ondas acústicas, tornando-se difícil de quantificar a quantidade de energia acústica efetivamente entregue a uma amostra. Também podem criar artefatos mecânicos indesejáveis. Por exemplo, interfaces de impedância de incompatibilidade perpendicular ao acústico produzido reflexões criam ondas backpropagating que interferem com os materiais de propagação para a frente. Ao longo do caminho de interferência, as ondas se cancelam mutuamente em regiões fixas de espaços chamados nós e resumir em alternando regiões chamadas antilinfonodos, criando so-called ondas estacionárias (Figura 1). É importante para o experimentalista ser capaz de controlar ou eliminar estas interfaces experimentais em vitro como eles não podem existir em vivo.
Medição de fluorescência de repórteres ópticas é um método conhecido para interrogar amostras biológicas transparentes em tempo real e com nenhum distúrbio físico. Esta abordagem é, portanto, ideal para estudos de U.S.P como qualquer sondas físicas presentes na área lisada irão introduzir artefatos mecânicos. Este protocolo descreve a implementação e operação de U.S.P a um microscópio de fluorescência-epi comercial.
Protocolo
1. cultivo de células em película de poliéster acusticamente transparente
- Perfure um tamanho do furo de 12 mm no fundo de um prato de cultura padrão 35mm usando uma broca imprensa vertical. Mova a broca lentamente e use óculos de protecção. Retire os pedaços de plástico ligada ao fundo do prato usando uma lâmina para criar uma superfície lisa do lado externo (Figura 2).
- Aplique uma camada fina de fuzileiro naval-grau epóxi ou cola na superfície externa do fundo do prato.
- Coloque uma película de poliéster (2,5 µm de espessura) contra a superfície externa do fundo do prato e pressione firmemente para certificar-se de que a cola epóxi/espalha-se uniformemente entre o filme e a superfície de plástico grossa. Puxe delicadamente o filme de forma centrífuga com os dedos para criar uma superfície plana (Figura 2).
- Quando seca a cola epoxy/cola, brevemente enxaguar-seco poliéster-fundo do prato com etanol a 95% e esterilizar, colocando o prato e o interior superfície da tampa sob uma forte fonte de excitação 254 nanômetro UV. Ajuste a duração e intensidade para entregar uma dose de UV de aproximadamente 330 mJ cm-2 para a completa destruição da maioria dos tipos de microrganismos. Esta energia corresponde aproximadamente a uma duração de 5 min usando uma iluminação UV-2 de cm µW 1.000.
- Alíquota da matriz extracelular comercialmente disponíveis misturas da proteína (EMPM) em pequenos tubos (50-100 µ l) e loja-los a-20 ° C ou menos em condições estéreis.
- Em um ambiente estéril (por exemplo, dentro de uma armário de biossegurança), dilua um estoque congelado do EMPM, com um meio de cultura desejado a 1: 100. Trabalhar no gelo para evitar a polimerização do EMPM à temperatura ambiente. Aplica rapidamente 100 µ l da mistura média para a película de poliéster. Coloque a tampa novamente no prato para manter a esterilidade.
- Incube pratos fundo poliéster revestido EMPM incubadora uma célula cultura CO2 a 37 ° C por 6-12 h.
- Após a incubação, Aspire o excesso de meio e sementes diretamente a superfície com células a densidade desejada. Trabalho sob condição estéril para manter a esterilidade.
2. U.S.P implementação
- Coloca um tanque de água sob o objetivo de um microscópio na posição vertical, com grande volume de trabalho e sem hardware de iluminação no caminho de transmissão.
- Usando componentes de microscópios comercialmente disponíveis, coloque um suporte de amostra abaixo o objetivo e um suporte de transdutor debaixo do porta-amostras. Para alinhamento de busca e ultra-som amostra subsequente, monte esses dois suportes em estágios de translação.
- Coloque as peças em movimento e atuadores de estágios de translação ou fora do tanque, ou acima da linha de água para evitar danos causados pela água. Utilize apenas materiais não corrosivos tais como alumínio anodizado ou aço inoxidável para componentes de microscópios imerso.
- Encha o tanque com água desionizada e desgaseificada antes utilizando o transdutor de imersão. A linha de água deve coincidir com o plano horizontal do porta-amostras (Figura 3).
Nota: Água deionizada evita acoplamento elétrico na presença de altos campos elétricos. Desgaseificação também irá impedir alterações de ondas acústicas e dispersão. Drene a água após cada experimento usando uma bomba ou válvula de modo que a linha de água cai abaixo da posição do transdutor. Também, substituir ou filtrar a água com frequência e limpar o tanque de água conforme necessário para evitar o crescimento de microorganismos.
3. oblíqua excitação acústica
- Usando componentes de microscópios disponíveis comercialmente, Oriente o transdutor em posição oblíqua em relação ao percurso óptico. Isto irá assegurar que qualquer refletida ondas serão dirigidas longe da amostra (Figura 3 e Figura 4).
4. conduzir o transdutor
Nota: Transdutores convertem a energia elétrica oscilante em expansão/contração mecânica de um material piezoelétrico. Esta conversão produz perda de energia sob a forma de calor e energia. Portanto, enquanto transdutores possuem um limite de tensão de entrada de pico, eles também possuem um limite de corrente eléctrica para evitar danos térmicos ao elemento piezoelétrico: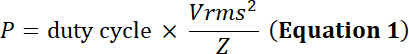
com o dever ciclo da fração relativa do tempo de simulação eléctrica, P a potência elétrica (em Watts), Vrms da tensão de entrada root-mean-square (em Volts) da fonte de tensão alternativa e Z a elétrica impedância (em Ohms).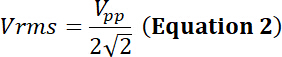
com Vpp o pico-a-pico de tensão de entrada aplicado para o transdutor.
- Criar uma forma de onda senoidal contendo a frequência desejada, o número de ciclos por impulso, e usando um gerador de função comercial de frequência de repetição do pulso. No entanto, o Vpp relativamente elevado necessário para efetivamente conduzir transdutores padrão muitas vezes requer a adição de um amplificador de potência para amplificar a saída (ou seja, aumentar a amplitude de Vpp) do gerador de função.
Nota: por exemplo, fabricante de um transdutor indica o limite de potência para um dado transdutor é 35 W. Será uma pico a pico sinusoidal tensão de entrada (Vem) de 500 mV a um dever ciclo de 50% e amplificado através de um dB 50/amplificador de 100 W estar dentro do limite de potência deste transdutor?- Para responder a esta pergunta, calcule a tensão após amplificação. Para um amplificador de potência de rádio frequência (RF), o fator de amplificação (dB) é definido por:
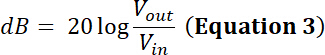
Assim, a tensão amplificada tem uma amplitude de saída Vpp (Vpp = Vfora) de: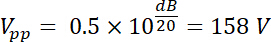
Usando as equações 1 e 2 e 50 Ω como impedância elétrica, a potência correspondente gerada por essa tensão é: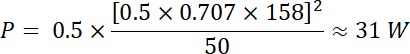
Esta estimulação é, portanto, dentro do limite de potência do transdutor. - Usando o exemplo acima, calcule os parâmetros de forma de onda (Vpp, frequência, duração do pulso e a frequência de repetição de pulso) que correspondem os limites de potência e tensão fornecidos pelo fabricante do transdutor. Certifique-se de respeitar esses limites para evitar danificar o transdutor e outros instrumentos conectados.
- Para responder a esta pergunta, calcule a tensão após amplificação. Para um amplificador de potência de rádio frequência (RF), o fator de amplificação (dB) é definido por:
- Escolha um gerador de função que opera dentro de um intervalo de frequência compatível com o transdutor de ultrassom. Ajuste a frequência do gerador de função para a frequência de pico nominal do transdutor.
- Crie um pulso de tensão senoidal do tempo de duração desejado e frequência de repetição usando o modo burst do gerador de função. Ajuste a tensão de pico a pico para um valor desejado. Certifique-se que a duração do pulso é menor do que o tempo decorrido entre dois pulsos consecutivos.
- Verifique a forma de onda corresponde ao sinal desejado ao ligar a saída do gerador de função para a entrada de um osciloscópio.
- Conecte a saída do gerador de função para a entrada de um amplificador de RF de potência (Figura 4). Certifique-se de que os parâmetros de estimulação são dentro dos limites do fabricante do transdutor.
5. feixe de alinhamento
- Escolha um hidrofone que opera com uma frequência gama e acústica intensidade compatível com a frequência e intensidade do transdutor de ultrassom.
- Cuidadosamente, colocar a ponta de uma sonda de hidrofone em foco dentro do campo de visão objetivo na posição correspondente à posição da amostra (Figura 4).
- Certifique-se que tanto a sonda e transdutor são imersos em água deionizada e desgaseificada. Não bata a ponta do hidrofone com qualquer objeto físico com exclusão da água pois isso irá alterar o seu revestimento e afetar a medição.
- Realizar um pré-alinhamento bruto do transdutor posicionando visualmente seu eixo acústico em direção a sonda do hidrofone. Certifica-se de que a distância entre a superfície do transdutor e a ponta do hidrofone corresponde aproximadamente a distância focal do transdutor.
- Conecte o hidrofone de saída a uma entrada de sinal do osciloscópio. Conecte o gatilho de sincronização do gerador de função a outra entrada do osciloscópio. Visualize os dois sinais simultaneamente no osciloscópio.
- Dirigir o transdutor com alguns ciclos de ultra-som em um ciclo de trabalho de baixa e baixa amplitude para não danificar a sonda. Verifique com as condições de operação segura de fabricante do hidrofone para não danificar a ponta do hidrofone.
- Ajuste o botão s/divisão de acordo com o tempo de viagem de ultra-som da superfície do transdutor para o hidrofone. Procure por um hidrofone sinal no osciloscópio após o gatilho de sincronização.
- Lentamente, accione o transdutor usando uma fase XYZ motorizada ou manual. Deixe o transdutor para a posição que se correlaciona com o sinal de máxima hidrofone (Figura 4).
Nota: Se nenhum sinal for detectado, é possível que a intensidade dos pulsos acústicos é muito baixa ou que o feixe é mis alinhado ou espalhado por um objeto. Verificar regularmente que o hidrofone e transdutor são visualmente pre-alinhados e que sem bolhas ou objeto físico estão presentes no caminho exceto o filme de poliéster. Se nenhum sinal for detectado ainda, aumente a tensão de entrada por uma pequena quantia para aumentar a amplitude do sinal do hidrofone.
6. determinação da pressão de pulso de ultra-som e intensidade
- Com o feixe alinhado, medi a amplitude pico-a-pico do hidrofone de saída no osciloscópio para várias tensões dirigindo o transdutor. Certifique-se para não exceder o limite de pressão recomendado pelo fabricante do hidrofone.
- Converta essas medidas em pressão e/ou valores de intensidade acústica usando o método de calibração fornecido pelo fabricante do hidrofone.
Nota: A intensidade acústica pode ser determinada a partir da pressão e vice-versa, usando a fórmula:
com a pressão acústica (em W m-2), P a pressão acústica (em Pa), ρ a densidade do material (1.000 kg m-3 para a água) e c a velocidade do som no meio de propagação de propagação (para água, c = 1.500 m s-1). - Crie as curvas de calibração usando estas medições.
Nota: As pressão vs tensão e intensidade vs curvas de tensão tem uma forma linear e parabólica, respectivamente. - Determine o valor de pressão e/ou intensidade de uma tensão de condução desejada usando a curva de calibração correspondente.
7. cálcio-sensíveis/U.S.P viver-pilha fluorescência Imaging
- Substituir o meio de cultura da célula com um buffer de imagem desejado contendo 5 µM de um corante de cálcio sensíveis a célula-permeant (por exemplo, sou de Fluo-4). Incube a placa de cultura em uma incubadora de CO2 a 37 ° C por 1h.
- Lave cuidadosamente as células com a mesma reserva livre da tintura.
- Coloque o prato no suporte de amostra. Excitar as células usando a iluminação azul (490 nm) e ajustar a exposição de intensidade e câmera de excitação para evitar saturação excessiva de branqueamento ou pixel.
- Execute o lapso de tempo de imagem usando as configurações de aquisição de imagem desejada. Use um objectivo de imersão para melhor qualidade de imagem e com longa distância de trabalho para reduzir reflexos indesejados (ver Figura 4).
Resultados
A Figura 5 é um exemplo de experimento U.S.P multiplexado com imagem de cálcio. Células de glioblastoma (A-172) foram cultivadas em película de poliéster EMPM revestido em meio de cultura padrão (suplementado com 10% de soro e 1% de antibióticos) e incubadas com o repórter fluorescente sensíveis ao cálcio Fluo-4 AM. As células foram fotografadas usando uma lente de imersão 10 X e iluminado com uma fonte de luz branca LED e luz de fluorescência fo...
Discussão
A principal vantagem do ultrasound focalizado é sua capacidade de forma não-invasiva entregar a energia mecânica e/ou térmica para amostras biológicas com alta precisão espácio-temporais. Outras técnicas destinadas a estimular mecanicamente as células geralmente empregam invasiva sondas físico (por exemplo, célula-cutucando) ou requer a interação dos feixes de laser de alta energia com objectos estranhos (por exemplo, Pinça óptica). Aquecimento magnético pode aquecer locais geográficos ...
Divulgações
Os autores não têm nada para divulgar.
Agradecimentos
Agradecemos os Drs Mikhail Shapiro e Nikita Reznik discussões frutíferas. Este trabalho foi financiado por fundos de start-up da Western University of Health Sciences e NIH grant R21NS101384.
Materiais
| Name | Company | Catalog Number | Comments |
| upright microscope with large working volume | Thorlabs | CERNA | |
| upright microscope with large working volume | Scientifica | SliceScope | |
| optomechanical components | Thorlabs | n/a | |
| needle hydrophone | ONDA Corporation | HNP/C/R/A/T series + AH/G pre-amplifier | |
| needle hydrophone | Precision Acoustics | n/a | |
| fiber optic hydrophone | ONDA Corporation | HFO series | |
| fiber optic hydrophone | Precision Acoustics | n/a | |
| oscilloscope | Keysight Technology | DSOX2004A (4-channels 70MHz) | |
| function generator | Keysight Technology | 33500B (20MHz single-channel) | |
| RF power amplifier | Electronic Navigation Industries (ENI) | 325LA, 525LA, 240L, 350L, A075, 2100L, 3100LA | |
| RF power amplifier | Electronics & Innovation (E&I) | ||
| immersion ultrasound transducer | Olympus | focused immersion transdcuers | |
| immersion ultrasound transducer | Benthowave Instrument | HiFu transducer BII-76 series | |
| immersion ultrasound transducer | Precision Acoustics | Piezo-ceramic or HiFu transducers | |
| immersion ultrasound transducer | Ultrasonic-S-lab | HiFu transducers made to order | |
| high-density Matrigel | Corning | VWR 80094-330 | |
| Mylar film 2.5 microns | Chemplex | CAT.NO:107 |
Referências
- Elhelf, I. A. S., et al. High intensity focused ultrasound: The fundamentals, clinical applications and research trends. Diagnostic and Interventional Imaging. 99 (6), 349-359 (2018).
- Toccaceli, G., Delfini, R., Colonnese, C., Raco, A., Peschillo, S. . Emerging strategies and future perspective in neuro-oncology using Transcranial Focused Ultrasound Technology. , (2018).
- Duck, F. A. Medical and non-medical protection standards for ultrasound and infrasound. Progress in Biophysics and Molecular Biology. 93 (1-3), 176-191 (2007).
- Legon, W., et al. Transcranial focused ultrasound modulates the activity of primary somatosensory cortex in humans. Nature Neuroscience. 17 (2), 322-329 (2014).
- Tyler, W. J. The mechanobiology of brain function. Nature Reviews: Neuroscience. 13 (12), 867-878 (2012).
- Tyler, W. J. Noninvasive neuromodulation with ultrasound? A continuum mechanics hypothesis. Neuroscientist. 17 (1), 25-36 (2011).
- Tufail, Y., et al. Transcranial pulsed ultrasound stimulates intact brain circuits. Neuron. 66 (5), 681-694 (2010).
- Tyler, W. J., et al. Remote excitation of neuronal circuits using low-intensity, low-frequency ultrasound. PloS One. 3 (10), e3511 (2008).
- Suarez Castellanos, I., et al. Calcium-dependent ultrasound stimulation of secretory events from pancreatic beta cells. Journal of Therapeutic Ultrasound. 5, 30 (2017).
- Suarez Castellanos, I., Jeremic, A., Cohen, J., Zderic, V. Ultrasound Stimulation of Insulin Release from Pancreatic Beta Cells as a Potential Novel Treatment for Type 2 Diabetes. Ultrasound in Medicine and Biology. 43 (6), 1210-1222 (2017).
- Ibsen, S., Tong, A., Schutt, C., Esener, S., Chalasani, S. H. Sonogenetics is a non-invasive approach to activating neurons in Caenorhabditis elegans. Nature Communications. 6, 8264 (2015).
- Prieto, M. L., Firouzi, K., Khuri-Yakub, B. T., Maduke, M. Activation of Piezo1 but Not NaV1.2 Channels by Ultrasound at 43 MHz. Ultrasound in Medicine and Biology. 44 (6), 1217-1232 (2018).
- Kubanek, J., et al. Ultrasound modulates ion channel currents. Scientific Reports. 6, 24170 (2016).
- Prieto, M. L., Omer, O., Khuri-Yakub, B. T., Maduke, M. C. Dynamic response of model lipid membranes to ultrasonic radiation force. PloS One. 8 (10), e77115 (2013).
- Sato, T., Shapiro, M. G., Tsao, D. Y. Ultrasonic Neuromodulation Causes Widespread Cortical Activation via an Indirect Auditory Mechanism. Neuron. 98 (5), 1031-1041 (2018).
- O'Brien, W. D. Ultrasound-biophysics mechanisms. Progress in Biophysics and Molecular Biology. 93 (1-3), 212-255 (2007).
- Shapiro, M. G., Homma, K., Villarreal, S., Richter, C. P., Bezanilla, F. Corrigendum: Infrared light excites cells by changing their electrical capacitance. Nature Communications. 8, 16148 (2017).
- Shapiro, M. G., Homma, K., Villarreal, S., Richter, C. P., Bezanilla, F. Infrared light excites cells by changing their electrical capacitance. Nature Communications. 3, 736 (2012).
- Shapiro, M. G., Priest, M. F., Siegel, P. H., Bezanilla, F. Thermal mechanisms of millimeter wave stimulation of excitable cells. Biophysical Journal. 104 (12), 2622-2628 (2013).
- Hwang, J. Y., et al. Investigating contactless high frequency ultrasound microbeam stimulation for determination of invasion potential of breast cancer cells. Biotechnology and Bioengineering. 110 (10), 2697-2705 (2013).
- Nakano, M., et al. Genetically encoded ratiometric fluorescent thermometer with wide range and rapid response. PloS One. 12 (2), e0172344 (2017).
- Donner, J. S., Thompson, S. A., Kreuzer, M. P., Baffou, G., Quidant, R. Mapping intracellular temperature using green fluorescent protein. Nano Letters. 12 (4), 2107-2111 (2012).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados