Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Multiplexen fokussiert Ultraschall-Stimulation mit Fluoreszenz-Mikroskopie
In diesem Artikel
Zusammenfassung
Niedrige Intensität pulsierte Ultraschall Stimulation (LIPUŠ) ist eine Modalität für nicht-invasive mechanische Stimulation der endogenen oder veränderter Zellen mit hoher räumlicher und zeitlicher Auflösung. Dieser Artikel beschreibt wie LIPUŠ zu einem Epi-Fluoreszenz-Mikroskop zu implementieren und akustische Impedanzfehlanpassung auf dem Ultraschall Weg zu verhindern, dass unerwünschte mechanische Artefakte zu minimieren.
Zusammenfassung
Durch die Konzentration geringer Intensität Ultraschall-Impulse, die weiche Gewebe eindringen, stellt LIPUŠ eine viel versprechende Biomedizinische Technologie, aus der Ferne und sicher neuronale feuern, hormonellen Sekretion und genetisch umprogrammiert Zellen zu manipulieren. Allerdings ist die Übersetzung dieser Technologie für medizinische Anwendungen derzeit durch behindert, mangelnder biophysikalischen Mechanismen mit denen gezielt Gewebe Sinn und reagieren auf LIPUŠ. Ein geeigneter Ansatz, diese Mechanismen zu identifizieren wäre, optische Biosensoren in Kombination mit LIPUŠ verwenden, um die zugrunde liegenden Signalwege zu bestimmen. Umsetzung LIPUŠ zu einem Fluoreszenzmikroskop kann jedoch unerwünschte mechanische Artefakte aufgrund des Vorhandenseins von physikalischen Schnittstellen einführen, die reflektieren, absorbieren und akustische Wellen brechen. Dieser Artikel stellt eine Schrittanleitung um LIPUŠ zu handelsüblichen aufrecht Epi-Fluoreszenz Mikroskope zu integrieren, bei gleichzeitiger Minimierung des Einfluss der physikalischen Schnittstellen den akustischen Weg. Ein einfaches Verfahren bezeichnet man einen Single-Element-Ultraschall-Wandler zu betreiben und der Fokuszone des Wandlers in den objektiven Brennpunkt bringen. Die Verwendung von LIPUŠ wird anhand eines Beispiels der LIPUŠ-induzierte Kalzium Transienten in kultivierten menschlichen Glioblastom-Zellen mit Kalzium Bildgebung gemessen dargestellt.
Einleitung
Viele Krankheiten erfordern eine Form der invasiven medizinischen Eingriff. Diese Verfahren sind oft teuer, riskant, Erholungsphasen erfordern und so eine Belastung zu Gesundheitssystemen hinzufügen. Nicht-invasive therapeutische Modalitäten haben das Potenzial, sicherere und billigere Alternativen zu herkömmlichen chirurgischen Eingriffen bieten. Aktuelle nicht-invasive Ansätze wie Pharmakotherapie oder transkranielle Magnetstimulation sind jedoch oft durch Trade-Offs zwischen Gewebe eindringen, räumlich-zeitliche Auflösung und Ziel Nebenwirkungen begrenzt. In diesem Zusammenhang eine Ultraschall stellt eine viel versprechende nicht-invasive Technologie das Potenzial zur biologische Funktionen manipulieren tief in Gewebe mit hoher räumlich-zeitliche Genauigkeit und begrenzte off-Target-Wirkung.
Ultraschall-Stimulation besteht aus Schallenergie an genauen Standorte liefern tief in lebenden Organismen. Je nach akustischen Pulsparameter kann diese Energie eine Vielzahl von medizinischen Anwendungen haben. Zum Beispiel, der Food and Drug Administration genehmigt die Verwendung von hochintensivem fokussierten Ultraschall (HiFU) für thermische Ablation von Prostatatumoren, Tremor verursachen Hirnregionen, Myome und Schmerz verursachende Nervenenden in Knochenmetastasen1 . HiFu-vermittelten Mikroblasen Kavitation dient auch vorübergehend die Blut - Hirn-Schranke für die gezielte Bereitstellung von systemisch verabreicht Therapeutika2öffnen. Die räumliche Peak-Puls-Durchschnitt-Intensität (ichSppa) und räumliche Peak zeitlichen Durchschnitt-Intensität (ichBÜPF) verwendet für HiFU-Anwendungen sind in der Regel über mehrere kW cm-2 und Pulsdruck von mehreren zehntausend MPa zu produzieren. Diese Intensitätswerte sind weit über die FDA-Zulassung ichSppa und ichSpta Grenzwerte für diagnostischen Ultraschall, 190 W cm-2 und 720 mW cm-2, bzw.3. Im Gegensatz dazu, haben neuere Studien gezeigt, dass zerstörungsfreie gepulster Ultraschall-Stimulation, die innerhalb oder in der Nähe das Spektrum der diagnostischen Ultraschall Intensität Grenzen (LIPUŠ) effektiv, sicher und aus der Ferne neuronale manipulieren4ausgelöst werden kann, 5,6,7,8, hormonellen Sekretion9,10 und biotechnologisch Zellen11. Und doch bleiben die zellulären und molekularen Mechanismen, durch die Zellen spüren und reagieren auf Ultraschall, unklar, klinische Übersetzung der LIPUŠ entgegensteht. Daher in den letzten Jahren Studien von künstlichen Membranen, kultivierten Zellen und Tieren mit Ultraschall angeregt haben zugenommen, biophysikalische offenbaren und physiologische Prozesse moduliert durch LIPUŠ12,13, 14,15.
Ton besteht aus einer Schwingung durch ein physikalisches Medium. Eine Ultraschalluntersuchung ist ein Ton mit einer Frequenz oberhalb der menschlichen Hörbereich (d. h. über 20 kHz). In einer Laborumgebung entstehen Ultraschallwellen in der Regel durch piezoelektrische Sensoren, die ein Material enthalten, das als Reaktion auf ein elektrisches Feld in eine bestimmte Bandbreite von Hochfrequenz-oszillierende schwingt. Es gibt zwei Arten von Sensoren: single Element Sensoren und Wandler-Arrays. Einzelelement piezoelektrische Sensoren besitzen eine gekrümmte Oberfläche wirkt wie eine Linse und damit akustische Energie in einer definierten Region namens der Fokuszone konzentriert. Einzelnes Element Wandler sind viel billiger und einfacher zu bedienen als Wandler-Arrays. Dieser Artikel konzentriert sich auf einzelnes Element Wandler.
Die Größe der Fokuszone einen fokussierten Einzelelement-Wandler richtet sich auf die geometrischen Eigenschaften der akustischen Linse und auf seine akustische Frequenz. Um einen Millimeter Größe Fokuszone mit ein einzelnes Element Wandler zu erreichen, sind Ultraschall-Frequenzen im MHz-Bereich in der Regel erforderlich. Akustische Wellen bei dieser Frequenz werden leider sehr schnell abgeschwächt, in einem dünn Mittel wie Luft weitergegeben. Daher müssen MHz Ultraschall-Wellen generiert und an die Probe in ein dichteres Material wie Wasser weitergegeben werden. Dies ist die erste Herausforderung bei der Integration von LIPUŠ Modalität an ein Mikroskop.
Eine zweite Herausforderung ist es, physikalische Schnittstellen zwischen Materialien mit unterschiedlichen akustischen Impedanzen (das ist ein Produkt der Materialdichte und der Schallgeschwindigkeit) den akustischen Weg zu minimieren. Diese Schnittstellen können reflektieren, brechen Sie, zerstreuen und absorbieren Sie akustische Wellen, so dass es schwer zu quantifizieren, die Höhe der akustischen Energie effektiv zu einer Probe geliefert. Sie können ebenfalls unerwünschte mechanische Artefakte erstellen. Zum Beispiel erzeugen Reflexionen produzierten senkrecht zur akustischen Fehlanpassung Impedanz Schnittstellen Backpropagating Wellen, die vorwärts-Vermehrung zu stören. Des Weges der Störungen abbrechen die Wellen gegenseitig bei festen Regionen von Räumen, die als Knoten und fassen an wechselnden Regionen Anti-Knoten genannt, erstellen sogenannte stehende Wellen (Abbildung 1). Es ist wichtig für den Experimentator in der Lage zu kontrollieren oder diese experimentellen Interfaces in Vitro zu beseitigen, da sie möglicherweise nicht in Vivovorhanden sein.
Fluoreszenzmessung der optischen Reporter ist eine bekannte Methode, transparente biologischen Proben in Echtzeit und mit keinen körperlichen Störung zu befragen. Dieser Ansatz ist somit ideal für LIPUŠ Studien wie jede physikalische Sonden in das beschallte Gebiet mechanische Artefakte einführen werden. Dieses Protokoll beschreibt die Implementierung und den Betrieb von LIPUŠ zu einem kommerziellen Epi-Fluoreszenz-Mikroskop.
Protokoll
1. wachsende Zellen auf akustisch transparente Polyesterfolie
- Bohren Sie ein 12 mm Lochgröße am unteren Rand ein standard 35 mm Kulturschale mit einem vertikalen Presse-Bohrer. Bewegen Sie den Bohrer langsam und tragen Sie Augenschutz. Entfernen Sie Stücke aus Kunststoff an der Unterseite der Schale mit einer Klinge erstelle ich eine glatte Oberfläche auf der externen Seite (Abbildung 2) befestigt.
- Der Marine-Grad Epoxy oder Klebstoff an der äußeren Boden Oberfläche der Schale dünn auftragen.
- Legen Sie eine Folie aus Polyester (2,5 µm Dicke) gegen die äußeren Boden Oberfläche der Schale und drücken Sie fest, um sicherzustellen, dass der Epoxy-Kleber gleichmäßig zwischen der Folie und der dicken Kunststoff-Oberfläche ausbreitet. Ziehen Sie vorsichtig den Film in einer zentrifugalen Weise mit den Fingern auf eine Ebene Fläche (Abbildung 2) zu erstellen.
- Wenn die Epoxy-Kleber getrocknet ist, kurz Spülen-Trocknen der Polyester-Unterseite Schale mit 95 % Ethanol und sterilisieren, indem man die Schale und das innere Oberfläche der Deckel unter einer starken 254 nm UV-Anregungsquelle. Stellen Sie die Dauer und Intensität, eine UV-Dosis von etwa 330 mJ cm-2 für vollständige Zerstörung der meisten Arten von Mikroorganismen zu liefern. Diese Energie entspricht etwa eine Dauer von 5 Minuten mit einem 1.000 µW cm-2 UV Beleuchtung.
- Aliquoten kommerziell verfügbare extrazelluläre Matrix Protein Mischungen (EMPM) in kleinen Tuben (50-100 µL) und speichern Sie bei-20 ° C oder weniger unter sterilen Bedingungen.
- Verdünnen Sie in einer sterilen Umgebung (z. B. innerhalb eines Biosafety cabinet) einen gefrorenen bestand von EMPM mit einem gewünschten Kulturmedium bis 1: 100. Arbeiten Sie auf Eis EMPM Polymerisation bei Raumtemperatur zu verhindern. Gelten Sie schnell 100 µL der mittlere Mischung auf die Polyesterfolie. Setzen Sie den Deckel wieder auf die Schüssel zu Sterilität.
- Inkubieren Sie EMPM-beschichteten Polyester unteren Gerichte in einer Zelle Kultur CO2 Inkubator bei 37 ° C für 6 bis 12 h.
- Aspirieren Sie nach der Inkubation das überschüssige Medium und Samen Sie direkt die Oberfläche mit Zellen auf die gewünschte Dichte. Arbeiten Sie unter sterilen Zustand zu Sterilität.
(2) LIPUŠ Umsetzung
- Setzen Sie einen Wassertank unter dem Ziel von einem aufrechten Mikroskop mit großen Arbeitsvolumen und ohne Beleuchtung Hardware im Übertragungsweg.
- Mit handelsüblichen optomechanische Komponenten, legen Sie einen Probenhalter unter dem Ziel und einem Wandler-Halter unter dem Probenhalter. Montieren Sie für die anschließende Probe Such- und Ultraschall Ausrichtung diese zwei Halter auf Übersetzung Bühnen.
- Legen Sie die beweglichen Teile und die Antriebe der Übersetzung Stufen außerhalb des Tanks oder oberhalb der Wasserlinie um Wasserschäden zu vermeiden. Nur verwenden Sie korrosionsbeständige Materialien wie eloxiertes Aluminium oder Edelstahl für eingetaucht optomechanische Komponenten.
- Füllen Sie den Tank mit entionisiertem und entgastes Wasser vor der Verwendung der Immersion-Wandlers. Die Wasserleitung sollte mit der Horizontalebene der Probenhalter (Abbildung 3) übereinstimmen.
Hinweis: Deionisiertes Wasser verhindert elektrische Kopplung in Gegenwart von hohen elektrischen Feldern. Entgasung verhindert auch Streuung und Veränderungen der Schallwellen. Lassen Sie Wasser nach jedem Experiment mit einer Pumpe oder einem Ventil, so dass die Position des Wandlers der Wasserlinie unterschreitet. Auch ersetzen oder häufig Wasser zu filtern und Bereinigung der Wassertank wie notwendig, um das Wachstum von Mikroorganismen zu vermeiden.
(3) schräg akustische Anregung
- Mit handelsüblichen optomechanische Komponenten, orientieren Sie sich die Wandler in eine schräge Position in Bezug auf den Strahlengang. Dadurch wird sichergestellt, dass alle widerspiegeln, dass Wellen Weg von der Probe (Abbildung 3 und Abbildung 4) geleitet werden.
4. fahren den Schallkopf
Hinweis: Ultraschall-Wandler wandeln oszillierenden elektrischen Energie in mechanische Expansion/Kontraktion eines piezoelektrischen Materials. Diese Umwandlung produziert Energieverlust in Form von Wärmeenergie. Daher, während Wandler eine Eingangsspannung Spitzenwertlimit besitzen, besitzen sie auch eine elektrische Leistungsgrenze um thermische Schäden das piezoelektrische Element zu vermeiden: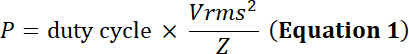
fahren Sie mit der Pflicht der relative Anteil der Zeit der elektrische Simulation, P die elektrische Leistung (in Watt), Vrms die Eingangsspannung Root-Mean-Square (in Volt) der alternativen Spannungsquelle und Z die elektrische Impedanz (in Ohm).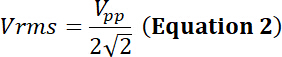
mit Vpp der Peak-to-Peak-Eingangsspannung auf den Schallkopf aufgetragen.
- Erstellen Sie eine sinusförmige Wellenform mit der gewünschten Frequenz, Anzahl der Zyklen pro Puls, und Wiederholung Pulsfrequenz mit einem kommerziellen Funktionsgenerator. Die relativ hohe Vpp benötigt, um effektiv standard Ultraschall-Wandler oft fahren erfordert jedoch die Zugabe von einer Endstufe, die Ausgabe der Funktionsgenerator (d. h. Erhöhung der Amplitude der Vpp) zu verstärken.
Hinweis: zum Beispiel einen Wandler Hersteller zeigt die Leistungsgrenze, für ein bestimmter Wandler 35 ist W. Wird eine sinusförmige Peak to Peak Eingangsspannung (Vin) von 500 mV bei einer Pflicht-Zyklus von 50 % und verstärkt durch 50 dB/100 W Verstärker werden im Rahmen der Macht dieser Wandler?- Um diese Frage zu beantworten, berechnen Sie die Spannung nach Verstärkung. Für eine Radiofrequenz (RF) Endstufe wird der Verstärkungsfaktor (dB) definiert durch:
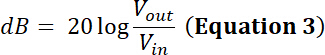
Die verstärkte Spannung hat also eine Amplitude Ausgabe Vpp (Vpp = Vout) von: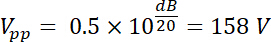
Mit Gleichungen 1 und 2, und mit 50 Ω als elektrische Impedanz, ist die entsprechende Kraft durch diese Spannung erzeugt: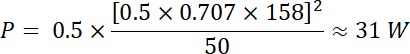
Diese Stimulation ist daher im Rahmen der Leistungsgrenze des Wandlers. - Mit dem obigen Beispiel, berechnen Sie die Wellenform-Parameter (Vpp, Frequenz und Impulsdauer Impulsfolgefrequenz), die die Leistung und Spannung Grenzen der Wandler-Herstellers entsprechen. Stellen Sie sicher, diese Grenzwerte zur Vermeidung von Schäden der Wandler und anderen angeschlossenen Geräte zu achten.
- Um diese Frage zu beantworten, berechnen Sie die Spannung nach Verstärkung. Für eine Radiofrequenz (RF) Endstufe wird der Verstärkungsfaktor (dB) definiert durch:
- Wählen Sie einen Funktionsgenerator, der in einem Frequenzbereich, der kompatibel mit der Ultraschall-Wandler arbeitet. Stellen Sie die Frequenz der Funktionsgenerator zur nominalen Höchststand Frequenz des Wandlers.
- Erstellen Sie einen sinusförmige Spannungsimpuls für die gewünschte Dauer und Wiederholung Frequenz mit der Burst-Modus von der Funktionsgenerator. Peak-to-Peak-Spannung auf einen gewünschten Wert einstellen. Stellen Sie sicher, dass die Pulsdauer kürzer als die verstrichene Zeit zwischen zwei aufeinander folgenden Impulsen.
- Überprüfen Sie, dass die Wellenform auf das gewünschte Signal entspricht, indem Sie den Eingang eines Oszilloskops die Ausgabe der Funktionsgenerator anschließen.
- Verbinden Sie den Ausgang von der Funktionsgenerator mit dem Eingang des RF Endverstärker (Abbildung 4). Stellen Sie sicher, dass die Stimulationsparameter innerhalb der Grenzen der Wandler Hersteller sind.
5. Strahl Ausrichtung
- Wählen Sie ein Hydrophon, das mit einer Frequenz Range und akustische Intensität kompatibel mit der Häufigkeit und Intensität der Ultraschall-Wandler arbeitet.
- Bringen Sie sorgfältig ein Hydrophon Sondenspitze in Fokus innerhalb der objektiven Sichtfeld an der Position entsprechend der Position der Probe (Abbildung 4).
- Stellen Sie sicher, dass die Sonde und Wandler in entionisiertem und entgastes Wasser eingetaucht sind. Stoßen Sie die Spitze des Hydrophon mit ein physisches Objekt außer Wasser nicht, da diese die Beschichtung zu verändern und die Messung beeinflussen.
- Durchführen Sie eine grobe Pre-Ausrichtung des Wandlers durch optisch Positionierung seiner akustischen Achse in Richtung der Hydrophon Sonde. Stellt sicher, dass der Abstand zwischen den Schallkopf Oberfläche und der Hydrophon Spitze ca. Brennweite der Wandler entsprechen.
- Verbinden Sie den Ausgang eines Signal-Eingang des Oszilloskops Hydrophon. Verbinden Sie die Synchronisation Trigger aus der Funktionsgenerator mit ein anderes Oszilloskop Eingang. Beide Signale gleichzeitig auf dem Oszilloskop zu visualisieren.
- Fahren Sie den Schallkopf mit Ultraschall Zyklen zu einem niedrigen Einschaltdauer und niedrige Amplitude um eine Beschädigung der Sonde. Erkundigen Sie sich bei der Hydrophon Hersteller sichere Betriebsbedingungen zu beschädigen die Hydrophon-Spitze.
- Passen Sie den s/Abteilung Regler entsprechend die Fahrzeit des Ultraschalls von der Wandler-Oberfläche, die Hydrophon. Suchen Sie ein Hydrophon-Signal auf dem Oszilloskop nach der Synchronisation-Trigger.
- Langsam betätigen der Wandlers mit einer motorisierten oder manuelle XYZ-Bühne. Verlassen Sie den Schallkopf in die Position, die korreliert mit dem maximalen Hydrophon-Signal (Abbildung 4).
Hinweis: Wenn kein Signal erkannt wird, ist es möglich, die die Intensität der akustische Impulse ist zu niedrig oder die der Strahl ist falsch ausgerichtet oder durch ein Objekt gestreut. Überprüfen Sie regelmäßig, dass die Hydrophon und Wandler visuell vorjustierten sind und keine Luftblasen oder physisches Objekt befinden sich im Pfad mit Ausnahme der Polyesterfolie. Wenn noch kein Signal erkannt wird, erhöhen Sie die Eingangsspannung um einen kleinen Betrag für die Amplitude des Signals Hydrophon erhöhen.
6. Bestimmung der Ultraschall Pulsdruck und Intensität
- Messen Sie mit dem Strahl ausgerichtet die Peak to Peak Amplitude der Hydrophon auf dem Oszilloskop für verschiedene Spannungen fahren die Wandler-Ausgang. Achten Sie darauf, nicht den Druck überschritten die Hydrophon vom Hersteller empfohlen wird.
- Wandeln Sie diese Messungen in Druck-und/oder akustischen Intensitätswerte der Kalibrierung Methode der Hydrophon-Herstellers.
Hinweis: Die akustische Intensität kann aus dem Druck und umgekehrt mit Hilfe der Formel ermittelt werden:
mit ich den Schalldruck (in W m-2), P der Schalldruck (in Pa), ρ die Dichte Material (1.000 kg m-3 für Wasser) und c die Schallgeschwindigkeit im Medium verbreiten zu propagieren (für Wasser, c = 1.500 m s-1). - Kalibrierkurven mit diesen Messungen zu erstellen.
Hinweis: Der Druck vs. Spannung und Intensität vs. Spannungskurven haben eine lineare, parabolische Form, beziehungsweise. - Bestimmen Sie die Druck-und/oder Intensität Wert einer gewünschten treibende Spannung mithilfe der entsprechenden Eichkurve.
(7) Calcium-Sensitive/LIPUŠ Live-Cell-Fluoreszenz-Bildgebung
- Ersetzen der Zellkulturmedium mit einem gewünschten imaging-Puffer mit 5 µM eine Zelle-permeationsfähigen Calcium-sensitiven Farbstoffs (z. B. Fluo-4 Uhr). Inkubieren Sie der Kulturschale in eine CO2 Inkubator bei 37 ° C für 1 h.
- Zellen mit dem gleichen Puffer frei von Farbstoff sorgfältig zu waschen.
- Legen Sie die Schale in der Probenhalter. Begeistern Sie die Zellen mit blauer Beleuchtung (490 nm) und Anregung Intensität und Kamera Belichtung zur Vermeidung von übermäßigen bleaching oder Pixel Sättigung anpassen.
- Durchführen Sie Time-Lapse Bildgebung mit Wunschmotiv Erwerb Einstellungen. Verwenden Sie objektiver eintauchen für bessere Bildqualität und mit langem Arbeitsabstand, um unerwünschte Reflexionen zu verringern (siehe Abbildung 4).
Ergebnisse
Abbildung 5 ist ein Beispiel für LIPUŠ Experiment mit Kalzium Imaging gemultiplext. Glioblastom-Zellen (A-172) wurden auf EMPM beschichtete Polyesterfolie in standard Kulturmedium (ergänzt mit 10 % Serum und 1 % Antibiotika) angebaut und inkubiert mit dem Calcium-Sensitive fluoreszierende Reporter Fluo-4 Uhr. Zellen wurden abgebildet, mit einem 10 X eintauchen Objektiv und mit einer weißen LED-Lichtquelle beleuchtet und Fluoreszenzlicht wurde mit einem St...
Diskussion
Ein Hauptvorteil des fokussierten Ultraschalls ist seine Fähigkeit, nicht-invasiv mechanischer und/oder thermischer Energie an biologischen Proben mit hoher räumlich-zeitliche Präzision zu liefern. Andere Techniken zur mechanisch anregen Zellen in der Regel beschäftigen invasive körperliche Sonden (z. B. Zelle stossen) oder erfordert das Zusammenspiel von hochenergetischen Laserstrahlen mit Fremdkörpern (z. B. optische Pinzette). Magnetische Heizung kann Heizen spezifischen räumliche Positionen i...
Offenlegungen
Die Autoren haben nichts preisgeben.
Danksagungen
Wir danken Dr. Mikhail Shapiro und Nikita Reznik für fruchtbare Diskussionen. Diese Arbeit wurde unterstützt von Startkapital von Western University of Health Sciences und NIH gewähren R21NS101384.
Materialien
| Name | Company | Catalog Number | Comments |
| upright microscope with large working volume | Thorlabs | CERNA | |
| upright microscope with large working volume | Scientifica | SliceScope | |
| optomechanical components | Thorlabs | n/a | |
| needle hydrophone | ONDA Corporation | HNP/C/R/A/T series + AH/G pre-amplifier | |
| needle hydrophone | Precision Acoustics | n/a | |
| fiber optic hydrophone | ONDA Corporation | HFO series | |
| fiber optic hydrophone | Precision Acoustics | n/a | |
| oscilloscope | Keysight Technology | DSOX2004A (4-channels 70MHz) | |
| function generator | Keysight Technology | 33500B (20MHz single-channel) | |
| RF power amplifier | Electronic Navigation Industries (ENI) | 325LA, 525LA, 240L, 350L, A075, 2100L, 3100LA | |
| RF power amplifier | Electronics & Innovation (E&I) | ||
| immersion ultrasound transducer | Olympus | focused immersion transdcuers | |
| immersion ultrasound transducer | Benthowave Instrument | HiFu transducer BII-76 series | |
| immersion ultrasound transducer | Precision Acoustics | Piezo-ceramic or HiFu transducers | |
| immersion ultrasound transducer | Ultrasonic-S-lab | HiFu transducers made to order | |
| high-density Matrigel | Corning | VWR 80094-330 | |
| Mylar film 2.5 microns | Chemplex | CAT.NO:107 |
Referenzen
- Elhelf, I. A. S., et al. High intensity focused ultrasound: The fundamentals, clinical applications and research trends. Diagnostic and Interventional Imaging. 99 (6), 349-359 (2018).
- Toccaceli, G., Delfini, R., Colonnese, C., Raco, A., Peschillo, S. . Emerging strategies and future perspective in neuro-oncology using Transcranial Focused Ultrasound Technology. , (2018).
- Duck, F. A. Medical and non-medical protection standards for ultrasound and infrasound. Progress in Biophysics and Molecular Biology. 93 (1-3), 176-191 (2007).
- Legon, W., et al. Transcranial focused ultrasound modulates the activity of primary somatosensory cortex in humans. Nature Neuroscience. 17 (2), 322-329 (2014).
- Tyler, W. J. The mechanobiology of brain function. Nature Reviews: Neuroscience. 13 (12), 867-878 (2012).
- Tyler, W. J. Noninvasive neuromodulation with ultrasound? A continuum mechanics hypothesis. Neuroscientist. 17 (1), 25-36 (2011).
- Tufail, Y., et al. Transcranial pulsed ultrasound stimulates intact brain circuits. Neuron. 66 (5), 681-694 (2010).
- Tyler, W. J., et al. Remote excitation of neuronal circuits using low-intensity, low-frequency ultrasound. PloS One. 3 (10), e3511 (2008).
- Suarez Castellanos, I., et al. Calcium-dependent ultrasound stimulation of secretory events from pancreatic beta cells. Journal of Therapeutic Ultrasound. 5, 30 (2017).
- Suarez Castellanos, I., Jeremic, A., Cohen, J., Zderic, V. Ultrasound Stimulation of Insulin Release from Pancreatic Beta Cells as a Potential Novel Treatment for Type 2 Diabetes. Ultrasound in Medicine and Biology. 43 (6), 1210-1222 (2017).
- Ibsen, S., Tong, A., Schutt, C., Esener, S., Chalasani, S. H. Sonogenetics is a non-invasive approach to activating neurons in Caenorhabditis elegans. Nature Communications. 6, 8264 (2015).
- Prieto, M. L., Firouzi, K., Khuri-Yakub, B. T., Maduke, M. Activation of Piezo1 but Not NaV1.2 Channels by Ultrasound at 43 MHz. Ultrasound in Medicine and Biology. 44 (6), 1217-1232 (2018).
- Kubanek, J., et al. Ultrasound modulates ion channel currents. Scientific Reports. 6, 24170 (2016).
- Prieto, M. L., Omer, O., Khuri-Yakub, B. T., Maduke, M. C. Dynamic response of model lipid membranes to ultrasonic radiation force. PloS One. 8 (10), e77115 (2013).
- Sato, T., Shapiro, M. G., Tsao, D. Y. Ultrasonic Neuromodulation Causes Widespread Cortical Activation via an Indirect Auditory Mechanism. Neuron. 98 (5), 1031-1041 (2018).
- O'Brien, W. D. Ultrasound-biophysics mechanisms. Progress in Biophysics and Molecular Biology. 93 (1-3), 212-255 (2007).
- Shapiro, M. G., Homma, K., Villarreal, S., Richter, C. P., Bezanilla, F. Corrigendum: Infrared light excites cells by changing their electrical capacitance. Nature Communications. 8, 16148 (2017).
- Shapiro, M. G., Homma, K., Villarreal, S., Richter, C. P., Bezanilla, F. Infrared light excites cells by changing their electrical capacitance. Nature Communications. 3, 736 (2012).
- Shapiro, M. G., Priest, M. F., Siegel, P. H., Bezanilla, F. Thermal mechanisms of millimeter wave stimulation of excitable cells. Biophysical Journal. 104 (12), 2622-2628 (2013).
- Hwang, J. Y., et al. Investigating contactless high frequency ultrasound microbeam stimulation for determination of invasion potential of breast cancer cells. Biotechnology and Bioengineering. 110 (10), 2697-2705 (2013).
- Nakano, M., et al. Genetically encoded ratiometric fluorescent thermometer with wide range and rapid response. PloS One. 12 (2), e0172344 (2017).
- Donner, J. S., Thompson, S. A., Kreuzer, M. P., Baffou, G., Quidant, R. Mapping intracellular temperature using green fluorescent protein. Nano Letters. 12 (4), 2107-2111 (2012).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten