このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
多重蛍光顕微鏡と超音波刺激を集中
要約
低出力パルス超音波刺激 (体表) は内因的あるいは人工的高時空間分解能細胞の非侵襲的な機械的刺激の様相です。この記事では、エピ蛍光顕微鏡に体表を実装する方法と、不要な機械工芸品を防ぐために超音波のパスに沿って音響インピー ダンスのミスマッチを最小限に抑える方法について説明します。
要約
軟部組織に浸透する低強度超音波パルスを中心に、体表はリモートでかつ安全に発火、ホルモン分泌、細胞の遺伝的再プログラムを操作するための有望な医療技術を表します。ただし、この医療技術の翻訳はによって妨げられている現在、生物物理学的メカニズムの欠如組織感覚を対象とし、体表に対応します。これらのメカニズムを識別するために適切なアプローチは、体表との組み合わせで光バイオ センサーを使用し、シグナル伝達経路の基になることでしょう。ただし、蛍光顕微鏡に体表を実装する物理インタ フェースを反映し、吸収し、弾性波の屈折が存在するため望ましくない機械工芸品を導入可能性があります。この記事は、音響経路の物理インタ フェースの影響を最小限に抑えながら市販の直立したエピ蛍光顕微鏡に体表を組み込むためのステップバイ ステップの手順を示します。単一素子超音波トランスデューサーを動作し、客観的のフォーカル ポイントにトランスデューサーの焦点ゾーンをもたらす簡単な手順を説明します。体表の使用は、ヒトグリオブラストーマ細胞のカルシウム イメージングを用いて体表誘起カルシウム過渡現象の例で示されています。
概要
多くの病気は、侵襲的な医療の介入のいくつかのフォームを必要とします。これらの手順は、高価で危険な回復期間を必要とする、従って健康管理システムに負担を追加します。非侵襲的治療戦略には、従来の外科手術を安全かつ安価な選択肢を提供する可能性があります。ただし、薬物療法や経頭蓋磁気刺激など現在の非侵襲的なアプローチはしばしば組織浸透、時空間分解能および不要なオフターゲット効果のトレードオフによって限られます。このコンテキストで集束超音波が生体機能を操作する可能性のある有望な非侵襲的技術を構成する時空間精度とターゲットを離れて影響が限定的組織の奥深く。
集束超音波刺激から成っている正確な位置に音響エネルギーを提供する生きている有機体の奥深く。音響パルス パラメーターによってこのエネルギーは、さまざまな医療用途を持つことができます。食品医薬品局が骨転移1 の神経終末の痛みの原因となる子宮筋腫、脳領域の振戦の原因となる前立腺腫瘍熱焼灼法に用いる高強度集束超音波 (HiFU) の使用を承認は、例えば、.HiFu を介したマイクロバブル キャビテーションはまた一時的治療薬の全身投与2のターゲットを絞った配信のため血液脳関門を開くに使用されます。局所ピーク パルス平均強度 (私sppa) と空間ピーク時間平均強度 (私のこぎり spta) HiFU いくつか kW cm-2上は、通常、MPa の数十の脈圧を生成するアプリケーションに使用されます。これらの強度値sppaと私 FDA 承認をはるかに上回っている私、超音波診断、190 W cm-2 720 mW cm-23それぞれスプタ制限。対照的に、最近の研究は、内または診断超音波強度制限 (体表) の範囲に近いことができますリモートでかつ安全に操作神経に効果的な発射4は、その非破壊パルス超音波刺激を示されています。 5,6,7,8, ホルモン分泌9,10 , 遺伝子組み換え細胞11。まだ、細胞が感知し、超音波応答細胞および分子メカニズムは不明、体表の臨床的翻訳を排除します。したがって、過去数年の人工膜、培養細胞と動物の超音波で刺激された研究生物物理を明らかにするはずみがつきましたが、生理的変調体表12,13、 14,15。
音は、物理的な媒体を介して伝播する振動で構成されています。超音波は、人間の可聴範囲 (すなわち、 20 kHz 以上) 以上の周波数を持つ音です。実験室の設定で、超音波は一般的に特定の高周波帯域で振動する電場に応答振動する物質を含む圧電トランスデューサー プロデュースします。探触子の 2 種類があります: 単一のエレメント ・ トランスデューサーと探。一振圧電トランスデューサーでは、焦点レンズとして機能し、それ故に音響エネルギーを集中して焦点のゾーンと呼ばれる定義済みの領域に曲面を所有しています。一振がはるかに安く、トランスデューサー配列よりも扱いやすいです。この記事は一振に焦点を当てます。
焦点を当てた一振の焦点ゾーンのサイズには、音響レンズの幾何学的性質とその音響周波数が決まります。一振をミリメートル サイズの焦点ゾーンを達成するため、MHz の範囲の超音波頻度が一般的に必要です。残念ながら、空気などの希薄な培地で伝達されるとき、そのような周波数の音波非常に急速に減衰されます。したがって、MHz の超音波は生成して水などより密な材料のサンプルに反映する必要があります。これは、顕微鏡に体表のモダリティを統合の最初の挑戦を構成します。
2 番目の課題は、異なる音響インピー ダンス (材料の密度および音響の速度の製品である) 音響のパスに沿って材料間の物理インタ フェースを最小化することです。これらのインタ フェースを反映することができます、屈折、散乱・ サンプルを効果的に配信される音響エネルギーの量を定量化するが難しく、音波を吸収します。彼らは、不要な機械工芸品を作成することも。例えば、反射作り出された音響に垂直な不一致インピー ダンス インターフェイスは、前方を伝播するものを妨げる逆伝搬波を作成します。干渉パスに沿って波互いを取り消すと呼ばれるノードと交互になる反ノードと呼ばれる地域を合計スペースの固定地域でいわゆる定在波 (図 1) を作成します。験者を制御または彼らがで生体内に存在しないこれらの実験的インターフェイス体外を排除できるように重要です。
光記者の蛍光測定は、ない物理的な妨害とリアルタイムで透明な試料を尋問するよく知られている方法です。この方法、任意の物理的なプローブの熱量の領域内に存在、機械工芸品を紹介する体表の研究に最適です。このプロトコルは、実装および商業エピ蛍光顕微鏡に体表の操作について説明します。
プロトコル
1. 音響的に透明なポリエステル フィルムに細胞の成長
- 垂直プレス ドリルを使用して標準の 35 mm ディッシュの下部に 12 mm の穴の大きさをドリルします。ドリルをゆっくりと移動し、眼用保護具を着用します。外部側 (図 2) で滑らかな表面を作成する刃を使用して皿の下部に接続されているプラスチックの部分を削除します。
- マリン グレード エポキシや料理の外部底面に接着剤の薄層を適用します。
- 料理の外部底面に対してポリエステル (2.5 μ m 厚) のフィルムを置き、フィルムと厚いプラスチック表面の間均等にエポキシ/接着剤を確認するしっかりと押します。平らな面 (図 2) を作成するため指で遠心的に映画をゆっくり引き抜きます。
- エポキシ/接着剤が乾燥しているとき簡単にリンス ドライ ポリエステル下 95% エタノール皿し、皿と内側を配置することによって殺菌しなさい強い 254 nm の紫外線励起ソースの下で、ふたの表面。時間と約 330 mJ cm-2マイクロ有機体のほとんどの種類の完全な破壊のための紫外線量を提供する強度を調整します。このエネルギーは、約 1,000 μ cm-2 UV 照明を使用して 5 分の期間に対応しています。
- 小さなチューブ (50-100 μ L)、-20 ° c または無菌状態で少ない店で市販の細胞外マトリックス蛋白質混合 (EMPM) を分注。
- 滅菌環境 (例えば、バイオ セーフティ キャビネットの中) で 1: 100 に必要な培養液中で EMPM の冷凍ストックを希釈します。常温 EMPM 重合を防ぐために氷で動作します。ポリエステル フィルム上に媒体混合物の 100 μ L をすばやく適用します。無菌性を維持するために皿にふたを配置します。
- 6-12 h の 37 ° C でセル文化 CO2インキュベーターで EMPM コーティング ポリエステル ボトムディッシュを孵化させなさい。
- インキュベーション後、余分な培地を吸引し、直接目的の密度で細胞表面をシードします。無菌性を維持するために無菌状態の下で働きます。
2. 体表実装
- 伝送路に大きな作業量と照明ハードウェアなし正立顕微鏡の目的の下に水槽を配置します。
- 市販のオプトメカニカル コンポーネントを使用して、目的の下の試料ホルダー、試料ホルダーの下に探触子ホルダーを配置します。以降のサンプル検索および超音波揃え、翻訳段階でこれらの 2 つのホルダーをマウントします。
- タンクの外、または水損傷を防ぐために水線の上の可動部品及び翻訳段階のアクチュエータを配置します。浸漬オプトメカニカル コンポーネントに陽極酸化アルミニウムやステンレスなどの非腐食性の材料を使用します。
- 水浸トランスデューサーを活用する前に脱脱イオン水でタンクを満たします。水行する必要があります (図 3) の試料ホルダーの水平面と一致します。
注: 脱イオン水は、高電界の存在の電気的結合を防ぎます。脱ガスと、散乱と弾性波の変更ができなくなります。水のラインを下回ると探触子の位置は、ポンプやバルブを使用して実験後排水します。また、交換または頻繁に水をフィルターとクリーンアップ水タンクの微生物の成長を避けるために必要に応じて。
3. 斜めの音響励振
- 市販のオプトメカニカル コンポーネントを使用すると、光路に対して斜めの位置に探触子を向けます。これは、いずれかのサンプル (図 3および図 4) から指示される波を反映されている保証されます。
4. 探触子を駆動
注: 超音波トランスデューサーは、圧電材料の機械的膨張/収縮に振動の電気エネルギーを変換します。この変換は、熱エネルギーの形でのエネルギー損失を生成します。したがって、一方、探触子は、最大入力電圧限界を所有して、圧電素子への熱損傷を防ぐために電力制限も所有します。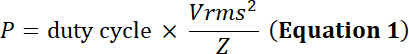
義務とP (でワット)、電力、電気シミュレーションの時間の相対的な割合をサイクルVrms入力二乗平均平方根電圧 (ボルト) で代替電圧源とZ電気のインピー ダンス (ω)。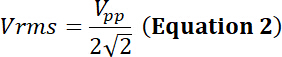
Vppピーク-ピーク電圧トランスデューサーに適用します。
- 目的の周波数、パルスごとのサイクル数を含む正弦波フォームを作成し、パルス繰返し周波数商業関数発生器を使用してください。ただし、効果的に多くの場合標準的な超音波探触子を駆動するために必要な比較的高い Vpp 関数発生器の出力 (すなわち、 Vppの振幅の増加) を増幅するための電力増幅器の追加が必要です。
メモ: たとえば、探触子のメーカーを電力制限任意のトランスデューサーは 35 w.正弦波のピーク ・ ツー ・ ピーク入力電圧 500 Vで100 W アンプ/パワー以内このトランスデューサーの義務で mV の 50% のサイクルし、50 dB を介して増幅ですか?- この質問に答えるためには、増幅後電圧を計算します。無線周波数 (RF) 電力増幅器の増幅率 (dB) によって定義されます。
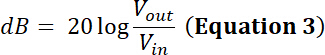
したがって、増幅された電圧は振幅出力 Vpp (Vpp をV =) の。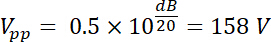
方程式 1 と 2 を使用して、電気インピー ダンスと 50 Ω を使用して、この電圧によって生成された対応する力はあります。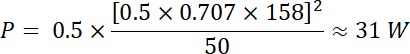
この刺激は探触子の力の限界の内でそのためです。 - 上記の例を使用して、探触子の製造業者によって提供される電力と負荷電圧の制限に対応する波形パラメーター (Vpp、周波数、パルス幅、パルス繰り返し周波数) を計算します。探触子およびその他の接続機器の損傷を避けるためにこれらの制限を尊重することを確認します。
- この質問に答えるためには、増幅後電圧を計算します。無線周波数 (RF) 電力増幅器の増幅率 (dB) によって定義されます。
- 超音波トランスデューサーと互換性のある周波数範囲で動作するファンクション ・ ジェネレーターを選択します。探触子の公称ピーク周波数の関数発生器の周波数を調整します。
- 希望の期間と繰り返し周波数の関数発生器のバースト モードを使用して正弦波電圧パルスを作成します。目的の値にピーク-ピーク電圧を調整します。脈拍の持続期間は 2 つの連続したパルス間の経過時間よりも短いことを確認します。
- 関数発生器の出力をオシロ スコープの入力に接続することで、波形が所望信号に対応することを確認します。
- 関数発生器の出力を電力 RF 増幅器 (図 4) の入力に接続します。刺激パラメーターが探触子の製造業者の範囲内であることを確認します。
5. 梁の配置
- 周波数と互換性のある周波数範囲と音響強度と超音波トランスデューサーの強度で動作するハイドロホンを選択します。
- 慎重にサンプル (図 4) の位置に対応する位置に客観的視野内のフォーカスにハイドロホン プローブの先端をもたらします。
- プローブと探触子が脱脱イオン水に没頭していることを確認します。そのコーティングを変更、計測に影響しますので水以外の物理オブジェクトとハイドロホンの先端をバンプしないでください。
- ハイドロホン プローブへの音響軸を視覚的に配置することで探触子の総事前配置を実行します。トランスデューサーの表面と水中聴音器先端間の距離が約トランスデューサーの焦点距離に対応するようになります。
- ハイドロ フォンの出力をオシロ スコープの入力端子の 1 つに接続します。関数発生器から同期トリガーを別のオシロ スコープ入力に接続します。オシロ スコープで同時に両方の信号を視覚化します。
- 低デューティ ・ サイクルとプローブを損傷を避けるために低振幅でいくつかの超音波サイクルで探触子を駆動します。ハイドロホンのメーカー安全な操作条件ハイドロホン ヒントを損傷を避けるために確認してください。
- 水中聴音器トランスデューサーの表面から超音波を用いた旅行時間によると s/部ノブを調整します。同期トリガー後オシロ スコープのハイドロ フォン信号を探します。
- ゆっくりと電動または手動 XYZ ステージを使用してトランスデューサーを作動させるため。最大ハイドロホン信号 (図 4) と相関の位置に探触子を残します。
注: ことができる信号が検出されない場合音響パルスの強度が低すぎるまたはビームのミスアライメントやオブジェクトによって散在しています。水中聴音器とトランスデューサーは視覚的に事前配置と泡または物理的なオブジェクトが存在しないことポリエステル フィルムを除いてパスで定期的にチェックしてください。信号をまだ検出されない場合は、ハイドロホン信号の振幅を高めるため少量で入力電圧を増加します。
6. 超音波パルス圧力と強度の定量
- 平行ビーム、ハイドロ フォンの探触子を駆動様々 な電圧のオシロ スコープで出力のピーク-ピーク振幅を測定します。ハイドロ フォンの製造元の推奨圧力制限を超えないことを確認します。
- 圧力やハイドロ フォンの製造元から提供された校正法を用いた音響インテンシティ値にこれらの測定値を変換します。
注: 数式を使用して圧力と逆から音響インテンシティを決定ことができます。
私(W m-2) で音圧をP音圧 (Pa) でρ材料 (1,000 kg m-3水) およびc中を伝搬する音の速度伝達する密度 (水、 c =1,500 m s-1)。 - これらの測定を使用して検量線を作成します。
注: 圧力対電圧と強度対電圧曲線それぞれ線形放物形があります。 - 対応する検量線を使用して、目的の駆動電圧の圧や強度の値を決定します。
7. カルシウム感受性/体表生細胞蛍光イメージング
- 細胞の培養液に置き換えますセル側の透過物のカルシウム感受性色素の 5 μ M を含む目的の画像バッファー (例えば、蛍光色 4 よ)。37 ° C で 1 時間の CO2インキュベーターで培養皿を孵化させなさい。
- 細胞性染料の自由の同じバッファーを慎重に洗います。
- サンプル ホルダーに皿を置きます。ブルーの照明を使用して細胞を刺激 (490 nm) 過度の漂白またはピクセルの飽和を避けるために励起強度およびカメラの露出を調整するとします。
- タイムラプス観察目的のイメージの取得の設定を使用してを実行します。優れた画像品質と長作動距離 (図 4参照) の不要な反射を低減するのに液浸対物レンズを使用します。
結果
図 5は、カルシウム イメージングによる多重体表実験の例です。神経膠芽腫細胞 (A-172) を (10% 血清と 1% 抗生物質添加) 標準培養液中で EMPM コーティング ポリエステル ・ フィルムに栽培され、インキュベートをカルシウム感受性蛍光レポーター蛍光 4 AM。10 X 浸漬レンズを使用し、白色 LED 光源で照らされた細胞をイメージしましたし、蛍光ライ?...
ディスカッション
集束超音波の主な利点は、非侵襲的時空間的精度の高い試料に機械的および/または熱エネルギーを提供する能力です。他の手法が機械的に刺激するために使用されて通常 (例えば、携帯つつく) 採用侵襲的な物理的なプローブを細胞や異物 (例えば、光学ピンセット) と高エネルギー レーザーの相互作用が必要です。磁気加熱生体試料中の特定の空間位置を熱することができる外...
開示事項
著者が明らかに何もありません。
謝辞
有意義な議論、夫妻ミハイル ・ シャピロとニキータ Reznik に感謝します。この作品は、西部保健大学からスタートアップ資金によって支えられたし、NIH は R21NS101384 を付与します。
資料
| Name | Company | Catalog Number | Comments |
| upright microscope with large working volume | Thorlabs | CERNA | |
| upright microscope with large working volume | Scientifica | SliceScope | |
| optomechanical components | Thorlabs | n/a | |
| needle hydrophone | ONDA Corporation | HNP/C/R/A/T series + AH/G pre-amplifier | |
| needle hydrophone | Precision Acoustics | n/a | |
| fiber optic hydrophone | ONDA Corporation | HFO series | |
| fiber optic hydrophone | Precision Acoustics | n/a | |
| oscilloscope | Keysight Technology | DSOX2004A (4-channels 70MHz) | |
| function generator | Keysight Technology | 33500B (20MHz single-channel) | |
| RF power amplifier | Electronic Navigation Industries (ENI) | 325LA, 525LA, 240L, 350L, A075, 2100L, 3100LA | |
| RF power amplifier | Electronics & Innovation (E&I) | ||
| immersion ultrasound transducer | Olympus | focused immersion transdcuers | |
| immersion ultrasound transducer | Benthowave Instrument | HiFu transducer BII-76 series | |
| immersion ultrasound transducer | Precision Acoustics | Piezo-ceramic or HiFu transducers | |
| immersion ultrasound transducer | Ultrasonic-S-lab | HiFu transducers made to order | |
| high-density Matrigel | Corning | VWR 80094-330 | |
| Mylar film 2.5 microns | Chemplex | CAT.NO:107 |
参考文献
- Elhelf, I. A. S., et al. High intensity focused ultrasound: The fundamentals, clinical applications and research trends. Diagnostic and Interventional Imaging. 99 (6), 349-359 (2018).
- Toccaceli, G., Delfini, R., Colonnese, C., Raco, A., Peschillo, S. . Emerging strategies and future perspective in neuro-oncology using Transcranial Focused Ultrasound Technology. , (2018).
- Duck, F. A. Medical and non-medical protection standards for ultrasound and infrasound. Progress in Biophysics and Molecular Biology. 93 (1-3), 176-191 (2007).
- Legon, W., et al. Transcranial focused ultrasound modulates the activity of primary somatosensory cortex in humans. Nature Neuroscience. 17 (2), 322-329 (2014).
- Tyler, W. J. The mechanobiology of brain function. Nature Reviews: Neuroscience. 13 (12), 867-878 (2012).
- Tyler, W. J. Noninvasive neuromodulation with ultrasound? A continuum mechanics hypothesis. Neuroscientist. 17 (1), 25-36 (2011).
- Tufail, Y., et al. Transcranial pulsed ultrasound stimulates intact brain circuits. Neuron. 66 (5), 681-694 (2010).
- Tyler, W. J., et al. Remote excitation of neuronal circuits using low-intensity, low-frequency ultrasound. PloS One. 3 (10), e3511 (2008).
- Suarez Castellanos, I., et al. Calcium-dependent ultrasound stimulation of secretory events from pancreatic beta cells. Journal of Therapeutic Ultrasound. 5, 30 (2017).
- Suarez Castellanos, I., Jeremic, A., Cohen, J., Zderic, V. Ultrasound Stimulation of Insulin Release from Pancreatic Beta Cells as a Potential Novel Treatment for Type 2 Diabetes. Ultrasound in Medicine and Biology. 43 (6), 1210-1222 (2017).
- Ibsen, S., Tong, A., Schutt, C., Esener, S., Chalasani, S. H. Sonogenetics is a non-invasive approach to activating neurons in Caenorhabditis elegans. Nature Communications. 6, 8264 (2015).
- Prieto, M. L., Firouzi, K., Khuri-Yakub, B. T., Maduke, M. Activation of Piezo1 but Not NaV1.2 Channels by Ultrasound at 43 MHz. Ultrasound in Medicine and Biology. 44 (6), 1217-1232 (2018).
- Kubanek, J., et al. Ultrasound modulates ion channel currents. Scientific Reports. 6, 24170 (2016).
- Prieto, M. L., Omer, O., Khuri-Yakub, B. T., Maduke, M. C. Dynamic response of model lipid membranes to ultrasonic radiation force. PloS One. 8 (10), e77115 (2013).
- Sato, T., Shapiro, M. G., Tsao, D. Y. Ultrasonic Neuromodulation Causes Widespread Cortical Activation via an Indirect Auditory Mechanism. Neuron. 98 (5), 1031-1041 (2018).
- O'Brien, W. D. Ultrasound-biophysics mechanisms. Progress in Biophysics and Molecular Biology. 93 (1-3), 212-255 (2007).
- Shapiro, M. G., Homma, K., Villarreal, S., Richter, C. P., Bezanilla, F. Corrigendum: Infrared light excites cells by changing their electrical capacitance. Nature Communications. 8, 16148 (2017).
- Shapiro, M. G., Homma, K., Villarreal, S., Richter, C. P., Bezanilla, F. Infrared light excites cells by changing their electrical capacitance. Nature Communications. 3, 736 (2012).
- Shapiro, M. G., Priest, M. F., Siegel, P. H., Bezanilla, F. Thermal mechanisms of millimeter wave stimulation of excitable cells. Biophysical Journal. 104 (12), 2622-2628 (2013).
- Hwang, J. Y., et al. Investigating contactless high frequency ultrasound microbeam stimulation for determination of invasion potential of breast cancer cells. Biotechnology and Bioengineering. 110 (10), 2697-2705 (2013).
- Nakano, M., et al. Genetically encoded ratiometric fluorescent thermometer with wide range and rapid response. PloS One. 12 (2), e0172344 (2017).
- Donner, J. S., Thompson, S. A., Kreuzer, M. P., Baffou, G., Quidant, R. Mapping intracellular temperature using green fluorescent protein. Nano Letters. 12 (4), 2107-2111 (2012).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved