Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Multiplexage axé Stimulation ultrason avec la microscopie en Fluorescence
Dans cet article
Résumé
Stimulation d’ultrasons pulsés faible intensité (LIPUS) est une modalité pour une stimulation mécanique non invasif des cellules endogènes ou machinés avec une haute résolution spatiale et temporelle. Cet article explique comment implémenter LIPUS à un microscope épifluorescente et comment minimiser les différences d’impédance acoustique sur le chemin de l’échographie pour empêcher des objets mécaniques non désirés.
Résumé
En se concentrant des pulsations d’ultrasons de basse intensité qui pénètrent dans les tissus mous, LIPUS représente une technologie biomédicale prometteuse à distance et en toute sécurité manipuler tir neuronaux, sécrétion hormonale et cellules reprogrammées génétiquement. Cependant, la traduction de cette technologie pour des applications médicales est actuellement entravée par un manque de mécanismes biophysiques qui ciblés sens de tissus et de répondre aux LIPUS. Une méthode adaptée pour identifier ces mécanismes serait d’utiliser des biocapteurs optiques en combinaison avec LIPUS pour déterminer qui sous-tendent les voies de signalisation. Toutefois, appliquer LIPUS à un microscope à fluorescence peut introduire des objets mécaniques indésirables en raison de la présence d’interfaces physiques qui reflètent, d’absorber et de réfraction des ondes acoustiques. Cet article présente une procédure pas à pas pour se lient LIPUS microscopes épifluorescente verticale disponible dans le commerce tout en minimisant l’influence des interfaces physiques le long de la trajectoire acoustique. On décrit une méthode simple pour l’exploitation d’un seul élément transducteur et à intégrer la zone focale du capteur de point focal objectif. L’utilisation de LIPUS est illustrée par un exemple de calcium induite par LIPUS transitoires dans les cellules de glioblastome humain cultivées mesurées à l’aide d’imagerie calcique.
Introduction
De nombreuses maladies nécessitent une forme quelconque d’intervention médicale invasive. Ces procédures sont souvent coûteux, risqué, exigent des périodes de récupération et donc ajouter un fardeau aux systèmes de soins de santé. Modalités thérapeutiques non invasifs sont susceptibles de fournir des solutions de rechange sûres et peu coûteuse pour des procédures chirurgicales conventionnelles. Toutefois, les approches actuelles non invasives telles que la stimulation magnétique transcrânienne ou de pharmacothérapie sont souvent limités par des compromis entre la pénétration tissulaire, résolution spatio-temporelle et des effets indésirables hors cible. Dans ce contexte, un ultrasons focalisés constituent une technologie non invasive prometteuse avec la possibilité de manipuler les fonctions biologiques profondément à l’intérieur des tissus avec haute précision spatio-temporelle et limité les effets hors cible.
Ultrasons focalisés stimulation consiste en délivrant une énergie acoustique à des emplacements précis profondément à l’intérieur des organismes vivants. En fonction des paramètres d’impulsions acoustiques, cette énergie peut avoir une variété d’utilisations médicales. Par exemple, la Food and Drug Administration a approuvé l’utilisation d’ultrasons de concentré de haute intensité (HiFU) pour ablation thermique de tumeurs prostatiques, causant des tremblements des régions du cerveau, les fibromes utérins et causant douleur de terminaisons nerveuses dans les métastases osseuses1 . Cavitation induite par HiFu microbulles est également utilisée pour ouvrir transitoirement la barrière hémato - encéphalique pour l’administration ciblée de produits thérapeutiques administrés par voie générale2. L’intensité moyenne des impulsions spatiale de pointe (j’aiLECL) et spatial-pic d’intensité moyenne temporelle (j’aispta) utilisé pour HiFU applications sont généralement au-dessus de plusieurs kW cm-2 et produisent la pression différentielle de plusieurs dizaines de MPa. Ces valeurs sont bien au-dessus de la FDA a approuvé ILECL et j’aispta limites d’échographie diagnostique, de 190 W cm-2 et de 720 mW cm-2, respectivement3. En revanche, les études récentes ont montré que la stimulation non destructifs ultrasons pulsés qui sont dans ou près de la plage des limites d’intensité de diagnostic par ultrasons (LIPUS) peut être efficace pour manipuler les neurones à distance et en toute sécurité de tir4, 5,6,7,8, sécrétion hormonale9,10 et génie génétique des cellules11. Pourtant, les mécanismes cellulaires et moléculaires par lesquels cellules détecter et répondent aux ultrasons restent floues, excluant la traduction clinique de LIPUS. Donc, dans quelques années, des études des membranes artificielles, des cellules cultivées et des animaux stimulés par des ultrasons ont pris de l’ampleur pour révéler biophysiques et processus physiologiques modulées par LIPUS12,13, 14,15.
Les sons composés d’une vibration se propageant à travers un support physique. Un ultrason est un son avec une fréquence supérieure à la gamme audible humaine (c'est-à-dire supérieures à 20 kHz). Dans un environnement de laboratoire, des ondes ultrasoniques sont généralement fabriqués par des transducteurs piézoélectriques qui contiennent un matériau qui vibre en réponse à un champ électrique oscillant dans une largeur de bande haute fréquence spécifique. Il existe deux types de transducteurs : simple monoéléments et transducteurs. Piézoélectrique monoéléments possèdent une surface courbée qui agit comme une lentille de focalisation et donc se concentre une énergie acoustique dans une région donnée, appelée la zone focale. Monoéléments sont beaucoup moins cher et plus facile à exploiter que les transducteurs. Cet article se concentrera sur monoéléments.
La taille de la zone focale d’un transducteur unique élément dépend des propriétés géométriques de la lentille acoustique et sa fréquence acoustique. Pour atteindre une zone focale millimètre-taille avec un monoélément, fréquences d’ultrasons dans la gamme MHz sont généralement nécessaires. Malheureusement, les ondes acoustiques à une fréquence sont atténués très rapidement lorsque se propageant dans un milieu fragile tel que l’air. Ainsi, des ondes ultrasoniques MHz doivent être générés et propagées à l’échantillon dans un matériau plus dense comme l’eau. Ceci constitue le premier défi en intégrant la modalité LIPUS à un microscope.
Un deuxième défi est de réduire au minimum les interfaces physiques entre les matériaux avec différentes impédances acoustiques (qui est un produit de masse volumique et la vitesse acoustique) le long de la trajectoire acoustique. Ces interfaces peuvent refléter, réfraction, dispersion et absorbent les ondes acoustiques, rendant difficile de quantifier la quantité d’énergie acoustique effectivement livrée à un échantillon. Ils peuvent également créer des objets mécaniques non désirés. Par exemple, les réflexions incompatibilité perpendiculaire à acoustique produit impédance interfaces créent des ondes de backpropagating qui interfèrent avec ceux de multiplication avant. Sur le chemin de l’interférence, les ondes s’annulent mutuellement à des régions fixes des espaces appelés nœuds et résumer en alternant zones appelées anti-noeuds, créant ce que l'on appelle ondes stationnaires (Figure 1). Il est important pour l’expérimentateur d’être en mesure de contrôler ou éliminer ces interfaces expérimentales in vitro comme ils peuvent ne pas exister in vivo.
Mesure de la fluorescence de reporters optiques est une méthode bien connue d’interroger des échantillons biologiques transparents en temps réel et avec aucune perturbation physique. Cette approche est donc idéale pour les études LIPUS car les sondes physiques présents dans la région aux ultrasons présentera des objets mécaniques. Ce protocole décrit la mise en œuvre et le fonctionnement du LIPUS à un microscope épifluorescente commerciale.
Protocole
1. croissance des cellules sur Film Polyester acoustiquement Transparent
- Percer une taille de trou de 12 mm au fond d’une boîte de Petri standard de 35 mm à l’aide d’un foret de presse vertical. Déplacez la perceuse lentement et porter une protection oculaire. Retirez les morceaux de plastique attachés au fond du plat à l’aide d’une lame pour créer une surface lisse sur la face externe (Figure 2).
- Appliquer une fine couche d’époxy de qualité marine ou de la colle à la surface externe de fond du plat.
- Placer un film de polyester (2,5 µm d’épaisseur) sur la surface externe bas du plat et appuyez fermement pour s’assurer que la colle époxy/se répand uniformément entre le film et la surface en plastique épaisse. Tirez doucement le film de façon centrifuge avec doigts pour créer une surface plane (Figure 2).
- Lorsque/la colle est sèche, brièvement rinçage séchage polyester-fond plat avec l’éthanol à 95 % et stériliser en plaçant le plat et à l’intérieur de son couvercle sous une forte source d’excitation de 254 nm UV. Ajuster la durée et l’intensité pour administrer une dose UV d’environ 330 mJ cm-2 pour la destruction complète de la plupart des types de micro-organismes. Cette énergie correspond approximativement à une durée de 5 min à l’aide d’un éclairage UV-2 de 1 000 µW cm.
- Aliquote mélanges de protéines disponibles dans le commerce de la matrice extracellulaire (EMPM) dans petits tubes (50-100 µL) et magasin à-20 ° C ou moins dans des conditions stériles.
- Dans un environnement stérile (par exemple, à l’intérieur d’une armoire de sécurité biologique), diluer un stock congelé de EMPM avec un milieu de culture souhaité au 1/100. Travailler sur la glace pour empêcher la polymérisation EMPM à température ambiante. Appliquer rapidement 100 µL de mélange moyen sur le film de polyester. Replacez le couvercle sur le plat pour maintenir la stérilité.
- Incuber les plats bas polyester enduit EMPM dans une étuve de cell culture CO2 à 37 ° C pendant 6 à 12 h.
- Après incubation, aspirer l’excès du milieu et des graines directement la surface avec des cellules à la densité voulue. Travailler dans des conditions stériles pour maintenir la stérilité.
2. LIPUS mise en œuvre
- Placer un réservoir d’eau sous l’objectif d’un microscope vertical avec grand volume de travail et sans matériel d’illumination dans la voie de transmission.
- Composants opto-mécaniques disponibles sur le marché, placer un porte-échantillon au-dessous de l’objectif et titulaire d’un transducteur sous le porte-échantillon. Pour l’alignement de rechercher et d’échographie échantillon suivant, monter ces deux titulaires sur les étapes de la traduction.
- Placez les pièces mobiles et les actionneurs des étapes de traduction, soit en dehors de la cuve, soit au-dessus de la ligne d’eau pour éviter les dégâts d’eau. Utilisez uniquement des matériaux non corrosifs tels que l’aluminium anodisé ou en acier inoxydable pour composants opto-mécaniques immergé.
- Remplissez le réservoir avec de l’eau désionisée et dégazé avant utilisant le transducteur de l’immersion. La ligne de flottaison doit coïncider avec le plan horizontal de la porte de l’échantillon (Figure 3).
Remarque : L’eau désionisée empêche couplage électrique en présence de champs électriques élevés. Dégazage n’empêchera également la diffusion et des altérations des ondes acoustiques. Vidanger l’eau après chaque expérience à l’aide d’une pompe ou une vanne pour que la ligne d’eau tombe au-dessous de la position du transducteur. Aussi, remplacer ou filtrer l’eau fréquemment et nettoyer le réservoir d’eau au besoin pour éviter la croissance des micro-organismes.
3. oblique Excitation acoustique
- À l’aide de composants opto-mécaniques disponibles dans le commerce, orientez le capteur dans une position oblique en ce qui concerne le trajet optique. Cela garantira que tout reflète vagues iront loin de l’échantillon (Figure 3 et Figure 4).
4. conduire le transducteur
NOTE : Les transducteurs ultrasons convertissent énergie électrique oscillant en expansion/contraction mécanique d’un matériau piézoélectrique. Cette conversion produit perte d’énergie sous forme d’énergie thermique. Par conséquent, tandis que les transducteurs possèdent une limite de tension d’entrée max., ils possèdent également une limite de puissance électrique pour éviter tout dommage thermique à l’élément piézoélectrique :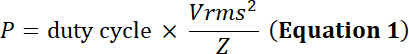
avec le duty cycle la fraction relative du temps de simulation électrique, P la puissance électrique (en Watts), Vrms la tension d’entrée de root-mean-square (en Volts) de la source de tension alternative Z électrique impédance (en Ohms).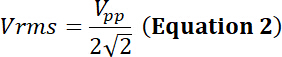
avec Vpp la tension d’entrée de crête à crête, appliquée à la sonde.
- Créer une forme d’onde sinusoïdale contenant la fréquence souhaitée, le nombre de cycles par impulsion, et à l’aide d’un générateur de fonctions commerciales de fréquence de répétition des impulsions. Toutefois, la Vpp relativement élevé nécessaire pour effectivement conduire transducteurs d’ultrasons standard souvent nécessite l’ajout d’un amplificateur pour amplifier la sortie (c.-à-d., augmentation de l’amplitude de Vpp) de l’appareil.
NOTE : par exemple, fabricant d’un transducteur indique la limite de puissance pour un transducteur donné est de 35 W. Sera une crête à crête sinusoïdal d’entrée tension (Vde) de 500 mV à un droit de 50 % du cycle et amplifié par un 50 dB/100 W amplificateur être dans la limite de la puissance de ce transducteur ?- Pour répondre à cette question, calculer la tension après amplification. Pour un amplificateur de puissance radio-fréquence (RF), le coefficient d’amplification (dB) est défini par :
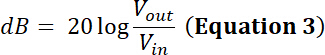
Ainsi, la tension amplifiée a une amplitude sortie Vpp (Vpp = Vout) de :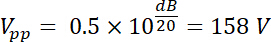
En utilisant les équations 1 et 2 et en utilisant 50 Ω comme impédance électrique, la puissance correspondante générée par cette tension est :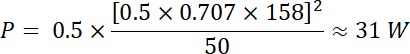
Cette stimulation est donc dans la limite de la puissance du transducteur. - À l’aide de l’exemple ci-dessus, calculer les paramètres de forme d’onde (Vpp, fréquence, durée de l’impulsion et la fréquence de répétition des impulsions) qui correspondent à des limites de puissance et tension fournies par le fabricant du transducteur. Veillez à respecter ces limites pour éviter d’endommager le transducteur et autres instruments connectés.
- Pour répondre à cette question, calculer la tension après amplification. Pour un amplificateur de puissance radio-fréquence (RF), le coefficient d’amplification (dB) est défini par :
- Choisissez un générateur de fonction qui opère dans une gamme de fréquences compatible avec le transducteur à ultrasons. Régler la fréquence du générateur de fonction de la fréquence de crête nominale du capteur.
- Créer une impulsion de tension sinusoïdale de la durée et la fréquence de répétition en utilisant le mode rafale de l’appareil. Ajustez la tension de crête à crête à une valeur désirée. Assurez-vous que la durée de l’impulsion est plus courte que le temps écoulé entre deux impulsions consécutives.
- Vérifier que la forme d’onde correspondant au signal désiré en connectant la sortie de l’appareil à l’entrée d’un oscilloscope.
- Connectez la sortie de l’appareil à l’entrée d’un amplificateur RF (Figure 4). Assurez-vous que les paramètres de stimulation sont dans les limites du constructeur de la sonde.
5. alignement du faisceau
- Choisissez un hydrophone qui fonctionne avec une fréquence acoustique et gamme intensité compatible avec la fréquence et l’intensité de la sonde d’échographie.
- Soigneusement, mettre l’extrémité d’une sonde d’hydrophone au point dans le champ de vue objectif sur la position correspondant à la position de l’échantillon (Figure 4).
- S’assurer que la sonde et le transducteur soient immergées dans de l’eau désionisée et dégazé. Ne cognez pas la pointe de l’hydrophone avec n’importe quel objet physique autres que l’eau que cela changera son revêtement et influent sur la mesure.
- Effectuer un alignement préalable brut du capteur de positionnement visuellement son axe acoustique vers la sonde de l’hydrophone. Permet de s’assurer que la distance entre la surface du transducteur et la pointe de l’hydrophone correspond approximativement à la longueur focale du capteur.
- Connectez l’hydrophone de sortie à l’une des entrée de signal de l’oscilloscope. Connectez le déclenchement de la synchronisation de l’appareil à une autre entrée de l’oscilloscope. Visualiser les deux signaux simultanément sur l’oscilloscope.
- Conduire le transducteur avec quelques cycles d’échographie à un faible rapport cyclique et de faible amplitude pour éviter d’endommager la sonde. Vérifier avec les conditions de fonctionnement sécuritaire de l’hydrophone fabricant pour éviter d’endommager l’extrémité de l’hydrophone.
- Réglez le bouton s/division selon le temps de voyage de l’échographie de surface du transducteur à l’hydrophone. Vous recherchez un signal hydrophone sur l’oscilloscope après le déclenchement de la synchronisation.
- Lentement, actionner le transducteur à l’aide d’un stade XYZ motorisé ou manuel. Laissez le transducteur dans la position qui est en corrélation avec le signal hydrophone maximale (Figure 4).
Remarque : Si aucun signal n’est détecté, il est possible que l’intensité des impulsions acoustiques est trop faible ou le faisceau mal aligné ou dispersé par un objet. Vérifier régulièrement que l’hydrophone et transducteur sont visuellement pré alignées et que sans bulles ou un objet sont présents dans le chemin d’accès à l’exception du film de polyester. Si aucun signal n’est détecté encore, augmenter la tension d’entrée par une petite quantité d’augmenter l’amplitude du signal de l’hydrophone.
6. détermination de la pression différentielle de l’échographie et l’intensité
- Avec le faisceau aligné, mesurer l’amplitude crête-à-crête de l’hydrophone à l’oscilloscope pour diverses tensions conduisant le transducteur de sortie. Veillez à ne pas dépasser la limite de la pression recommandée par le fabricant de l’hydrophone.
- Convertir ces mesures en pression et/ou les valeurs d’intensité acoustique à l’aide de la méthode d’étalonnage fournie par le fabricant de l’hydrophone.
Remarque : L’intensité acoustique peut être déterminée par la pression et vice versa selon la formule suivante :
j’ai la pression acoustique (en W m-2), P la pression acoustique (en Pa), ρ la masse volumique des matériels de multiplication (1 000 kg m-3 pour l’eau) et c la vitesse du son dans la propagation du milieu (pour l’eau, c = 1 500 m s-1). - Créer des courbes d’étalonnage à l’aide de ces mesures.
Remarque : Les pression vs tension et intensité vs tension les courbes ont une forme linéaire et parabolique, respectivement. - Déterminer la valeur de pression et/ou l’intensité d’une tension de conduite désirée à l’aide de la courbe d’étalonnage correspondantes.
7. imagerie de Fluorescence des cellules vivantes calcium-sensible/LIPUS
- Remplacer le milieu de culture de la cellule avec un tampon d’imagerie désiré contenant 5 µM d’un colorant sensible au calcium cellulaire perméable (p. ex., Fluo-4 AM). Incuber le plat de la culture dans un incubateur à CO2 à 37 ° C pendant 1 h.
- Se laver soigneusement les cellules avec le même tampon exempt de colorant.
- Placer la capsule dans le porte-échantillon. Excite les cellules à l’aide d’un éclairage lumineux bleu (490 nm) et ajuster l’excitation intensité et caméra exposition afin d’éviter la saturation excessive de blanchiment ou de pixel.
- Effectuer l’imagerie time-lapse utilisant des paramètres d’acquisition image désirée. Utiliser un objectif à immersion pour une meilleure qualité d’image et à longue distance de travail pour réduire les réflexions indésirables (voir Figure 4).
Résultats
La figure 5 est un exemple d’expérience LIPUS multiplexé avec imagerie calcique. Cellules de glioblastome (A-172) ont été cultivées sur film polyester EMPM enduit dans le milieu de culture standard (additionné de 10 % de sérum et de 1 % des antibiotiques) et incubés avec le journaliste fluorescent sensible au calcium Fluo-4 AM. Cellules ont été photographiés à l’aide d’un objectif d’immersion X 10 et éclairé par une source de lumière LE...
Discussion
Un avantage principal des ultrasons focalisés est sa capacité à livrer non invasive énergie mécanique ou thermique d’échantillons biologiques avec une grande précision temporelle. Autres techniques destinés à stimuler mécaniquement des cellules habituellement employer envahissantes sondes physiques (p. ex., cellule-piquer) ou requiert l’interaction des faisceaux lasers de haute énergie avec des objets étrangers (p. ex., les pinces optiques). Chauffage magnétique peut chauffer les emplac...
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
Nous remercions les Drs Mikhail Shapiro et Nikita Reznik de discussions fructueuses. Ce travail a été soutenu par des fonds de démarrage de la Western University of Health Sciences et NIH grant R21NS101384.
matériels
| Name | Company | Catalog Number | Comments |
| upright microscope with large working volume | Thorlabs | CERNA | |
| upright microscope with large working volume | Scientifica | SliceScope | |
| optomechanical components | Thorlabs | n/a | |
| needle hydrophone | ONDA Corporation | HNP/C/R/A/T series + AH/G pre-amplifier | |
| needle hydrophone | Precision Acoustics | n/a | |
| fiber optic hydrophone | ONDA Corporation | HFO series | |
| fiber optic hydrophone | Precision Acoustics | n/a | |
| oscilloscope | Keysight Technology | DSOX2004A (4-channels 70MHz) | |
| function generator | Keysight Technology | 33500B (20MHz single-channel) | |
| RF power amplifier | Electronic Navigation Industries (ENI) | 325LA, 525LA, 240L, 350L, A075, 2100L, 3100LA | |
| RF power amplifier | Electronics & Innovation (E&I) | ||
| immersion ultrasound transducer | Olympus | focused immersion transdcuers | |
| immersion ultrasound transducer | Benthowave Instrument | HiFu transducer BII-76 series | |
| immersion ultrasound transducer | Precision Acoustics | Piezo-ceramic or HiFu transducers | |
| immersion ultrasound transducer | Ultrasonic-S-lab | HiFu transducers made to order | |
| high-density Matrigel | Corning | VWR 80094-330 | |
| Mylar film 2.5 microns | Chemplex | CAT.NO:107 |
Références
- Elhelf, I. A. S., et al. High intensity focused ultrasound: The fundamentals, clinical applications and research trends. Diagnostic and Interventional Imaging. 99 (6), 349-359 (2018).
- Toccaceli, G., Delfini, R., Colonnese, C., Raco, A., Peschillo, S. . Emerging strategies and future perspective in neuro-oncology using Transcranial Focused Ultrasound Technology. , (2018).
- Duck, F. A. Medical and non-medical protection standards for ultrasound and infrasound. Progress in Biophysics and Molecular Biology. 93 (1-3), 176-191 (2007).
- Legon, W., et al. Transcranial focused ultrasound modulates the activity of primary somatosensory cortex in humans. Nature Neuroscience. 17 (2), 322-329 (2014).
- Tyler, W. J. The mechanobiology of brain function. Nature Reviews: Neuroscience. 13 (12), 867-878 (2012).
- Tyler, W. J. Noninvasive neuromodulation with ultrasound? A continuum mechanics hypothesis. Neuroscientist. 17 (1), 25-36 (2011).
- Tufail, Y., et al. Transcranial pulsed ultrasound stimulates intact brain circuits. Neuron. 66 (5), 681-694 (2010).
- Tyler, W. J., et al. Remote excitation of neuronal circuits using low-intensity, low-frequency ultrasound. PloS One. 3 (10), e3511 (2008).
- Suarez Castellanos, I., et al. Calcium-dependent ultrasound stimulation of secretory events from pancreatic beta cells. Journal of Therapeutic Ultrasound. 5, 30 (2017).
- Suarez Castellanos, I., Jeremic, A., Cohen, J., Zderic, V. Ultrasound Stimulation of Insulin Release from Pancreatic Beta Cells as a Potential Novel Treatment for Type 2 Diabetes. Ultrasound in Medicine and Biology. 43 (6), 1210-1222 (2017).
- Ibsen, S., Tong, A., Schutt, C., Esener, S., Chalasani, S. H. Sonogenetics is a non-invasive approach to activating neurons in Caenorhabditis elegans. Nature Communications. 6, 8264 (2015).
- Prieto, M. L., Firouzi, K., Khuri-Yakub, B. T., Maduke, M. Activation of Piezo1 but Not NaV1.2 Channels by Ultrasound at 43 MHz. Ultrasound in Medicine and Biology. 44 (6), 1217-1232 (2018).
- Kubanek, J., et al. Ultrasound modulates ion channel currents. Scientific Reports. 6, 24170 (2016).
- Prieto, M. L., Omer, O., Khuri-Yakub, B. T., Maduke, M. C. Dynamic response of model lipid membranes to ultrasonic radiation force. PloS One. 8 (10), e77115 (2013).
- Sato, T., Shapiro, M. G., Tsao, D. Y. Ultrasonic Neuromodulation Causes Widespread Cortical Activation via an Indirect Auditory Mechanism. Neuron. 98 (5), 1031-1041 (2018).
- O'Brien, W. D. Ultrasound-biophysics mechanisms. Progress in Biophysics and Molecular Biology. 93 (1-3), 212-255 (2007).
- Shapiro, M. G., Homma, K., Villarreal, S., Richter, C. P., Bezanilla, F. Corrigendum: Infrared light excites cells by changing their electrical capacitance. Nature Communications. 8, 16148 (2017).
- Shapiro, M. G., Homma, K., Villarreal, S., Richter, C. P., Bezanilla, F. Infrared light excites cells by changing their electrical capacitance. Nature Communications. 3, 736 (2012).
- Shapiro, M. G., Priest, M. F., Siegel, P. H., Bezanilla, F. Thermal mechanisms of millimeter wave stimulation of excitable cells. Biophysical Journal. 104 (12), 2622-2628 (2013).
- Hwang, J. Y., et al. Investigating contactless high frequency ultrasound microbeam stimulation for determination of invasion potential of breast cancer cells. Biotechnology and Bioengineering. 110 (10), 2697-2705 (2013).
- Nakano, M., et al. Genetically encoded ratiometric fluorescent thermometer with wide range and rapid response. PloS One. 12 (2), e0172344 (2017).
- Donner, J. S., Thompson, S. A., Kreuzer, M. P., Baffou, G., Quidant, R. Mapping intracellular temperature using green fluorescent protein. Nano Letters. 12 (4), 2107-2111 (2012).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon