Method Article
Ex vivo perfusion de la placenta de roedores
En este artículo
Resumen
Aquí se presenta un protocolo de perfusión vascular materno-fetal ex vivo para permitir la administración de un artículo de ensayo en vasculatura materna y para evaluar la transferencia placentaria de partículas xenobióticas o agentes farmacológicos, además de alteraciones en Fisiología placentaria.
Resumen
La placenta es un órgano clave durante el embarazo que sirve como barrera para la exposición xenobiótica fetal y media el intercambio de nutrientes para los desechos. Aquí se describe un ensayo para perfulizar una placenta de rata aislada y evaluar la translocación materno-fetal de xenobióticos ex vivo. Además, la evaluación de procesos fisiológicos como el flujo de fluidos al feto y el metabolismo placentario pueden realizarse con esta metodología. Esta técnica es adecuada para evaluar la cinética materno-fetal de los candidatos farmacéuticos o contaminantes ambientales. En contraste con los enfoques alternativos actuales, esta metodología permite la evaluación de la vasculatura aislada materno-fetal, con la afectación sistémica neuronal o inmune eliminada, permitiendo que cualquier cambio observado en la función fisiológica sea atribuibles a factores locales dentro del tejido aislado.
Introducción
Al mantener la estructura morfológica y la capacidad de respuesta fisiológica, la perfusión de órganos ha sido un método aceptado basado en el sistema o el tejido para analizar la función metabólica. Estas técnicas de perfusión permiten el examen ex vivo de las respuestas de los tejidos intactos a una variedad de estímulos farmacológicos y mecánicos. La perfusión de la placenta humana se describió inicialmente en 1958 para identificar los efectos hormonales sobre la actividad metabólica del ciclo del ácido cítrico; habiendo sido previamente identificados en homogeneizar tejidos, Troen y Gordon reconocieron la necesidad de aclarar la actividad endocrina utilizando un novedoso enfoque fisiológico1. En la misma época, se describieron estrategias de perfusión única (maternofetal o fetal a materna) en grandes modelos de2,3 y4 animales pequeños para comprender la transferencia placentaria de azúcares, sales y fármacos antipirinos. En vivo y ex vivo se describieron técnicas de perfusión dual (perfusión materna y fetal coordinada) para caracterizar aún más la transferencia placentaria utilizando las metodologías in vivo5 y ex vivo6,7,8 . Los avances tecnológicos en la microscopía electrónica de transmisión y escaneo permitieron a los investigadores verificar la integridad estructural y funcional de los tejidos placentarios humanos después de la perfusión9.
Mientras que la perfusión de los tejidos placentarios humanos y el cotiledón individual es más relevante, el rápido desarrollo de agentes farmacológicos y contaminantes ambientales requiere el uso de un modelo de perfusión animal para la detección temprana de xenobióticos transferencia a través de la barrera placentaria. Este método de perfusión placentaria permite la evaluación de la transferencia a través de la barrera placentaria utilizando la placenta de rata más fácilmente alcanzable y fisiológicamente relevante. Además, el flujo de fluido a través de la barrera placentaria durante un período de tiempo después de una exposición puede evaluarse midiendo el volumen de perfusato procedente de la arteria umbilical. En virtud de permitir la perfusión placentaria de las circulaciones maternas y fetales, este enfoque de órgano entero de doble flujo puede ser ventajoso en comparación con los enfoques actuales in vitro e in vivo. Este método permite medir la administración de un xenobiótico a través del aspecto materno a partir de un perfusato que emerge a través de la placenta a través de la vena umbilical, o viceversa. El protocolo presentado aquí describirá la transferencia de poliestireno de 20 Nm (un nanoplástico común utilizado en alimentos y productos médicos) de la arteria uterina materna al compartimiento fetal y una disminución asociada en el flujo de fluido a través de la placenta para ilustrar el uso de este método en múltiples entornos fisiológicos, farmacológicos y toxicológicos para evaluar la transferencia placentaria, el metabolismo y las alteraciones fisiológicas que afectan el flujo materno y/o fetal.
Protocolo
Todos los procedimientos experimentales fueron aprobados por el Comité institucional de cuidado y uso de animales de la Universidad de Rutgers.
1. preparación antes del experimento
Nota: estos pasos se pueden realizar en días/semanas antes del experimento.
- Modifique la cámara del recipiente.
Nota: figura 1A, B muestra la cámara de un solo recipiente modificada.- Mueva el sensor de termistor por debajo del clip y doble para que se cuelgue libremente en el baño de perfusión (figura 1B).
- Instale dos agujas de acero inoxidable de punta Romo de 4 pulgadas con concentradores de conexión Luer estándar, 1 25 g y 1 23 g asegurados debajo del clip de termistor y agregue un llave de 3 vías para permitir la cannulación de la vasculatura umbilical (figura 1B).
Nota: las conexiones más Luer de diferentes tamaños de medidor están codificadas por colores. Esto facilita la identificación fácil de los recipientes durante y después del experimento.
- Instale dos Micropipetas de vidrio de 70-100 μm. Para obtener más información sobre estos procedimientos, consulte las siguientes referencias10,11.
Nota: el diámetro de la punta comúnmente utilizado en estos experimentos está en el rango de 70 − 100 μm. los diámetros de punta más grandes que este rango pueden añadir dificultad al proceso de canulación, mientras que los diámetros de punta inferiores a 60 μm pueden perforar la pared vascular durante la canulación. - Prepare los lazos de la sutura de nylon estéril (para los extremos proximal y distal de la arteria uterina) y de la sutura no estéril de seda trenzada negra (para los vasos umbilicales). Hacer lazos individuales mediante la sutura de bucle como para iniciar un nudo cuadrado o atar un zapato, como se describió anteriormente11.
Nota: los lazos individuales se hacen comúnmente y se mantienen en una placa de Petri llena de una pequeña capa de caucho de silicona para ayudar a trabajar en un fondo pegajoso. - Prepare 2 L de solución salina fisiológica (PSS) que contenga, en mmol/L, 129,8 NaCl, 5,4 KCl, 0,5 NaH2po4, 0,83 MgSO4, 19 NaHCO3, 1,8 CaCl2y 5,5 glucosa. Ajuste el pH a 7,40 ± 0,02 añadiendo lentamente unas gotas de ácido (1 M de ácido clorhídrico) o base (1 N de hidróxido sódico) a la solución y espere al menos 20 s antes de leer la medida de pH ajustada. Almacene PSS hasta que esté listo para su uso en el refrigerador para reducir la contaminación, pero no almacene durante más de 2 semanas.
- Etiquetar tubos de microcentrífuga para recolectar efluentes "maternos" y "fetales" en cada momento, es decir, "MBaseline, M10, M20,..." hasta el punto de tiempo de 180 min. Prepare lo mismo para efluentes fetales (FBaseline, M10, M20,....).
- Calibrar todos los equipos utilizados en el sistema, incluyendo la temperatura del baño circulante y los monitores de presión arterial asociados con el mantenimiento de presiones uterinas (80 mmHg) y umbilicales (50 mmHg).
- Prepare una cámara de disección (4 "de diámetro x 1" de profundidad) o una antena calefactora de circulación llenando una capa (< 0,25 ") de caucho de silicona. Esta modificación debe hacerse por adelantado y ya que tomará 12 − 24 h para que el caucho se seque.
Nota: se recomienda el uso de un calentador/plato de enfriamiento recirculante para los cirujanos novatos, ya que el plato no se moverá y el tejido mantendrá una temperatura constante.
2. preparación de la estación quirúrgica y equilibrado del equipo
- Encienda todo el equipo que admita el sistema de perfusión para comprobar la función adecuada. Retire el PSS de la refrigeración y caliente a temperatura ambiente. El PSS se utilizará tanto como perfusate como superfusate.
- Coloque una pequeña piedra burbujeante para entregar una mezcla de gas en el depósito de superfusate. Las mezclas de uso común incluyen 21% O2, 8% o2, 3% o2, y 0% o2. Encienda el gas para proporcionar pequeñas burbujas a la solución superfusate. Ajuste la entrega de gas para evitar salpicaduras.
- Organice la estación de disección de animales comprobando la anestesia, arreglando el equipo quirúrgico y preparando los lazos de sutura. Prepare la cámara de disección recogiendo pasadores de disección, encendiendo el enfriador (o recuperando hielo) y llenando la cámara de disección (revestida con silicona de caucho) con PSS fríos.
- Llene suavemente todas las cámaras, agujas, Micropipetas de vidrio, tubos y embalses con PSS calentados, observando y eliminando cuidadosamente las burbujas de aire succionándolas con una piruleta de transferencia de puntas finas. Gire todos los tapones de 3 vías con "OFF" mirando hacia la dirección de la Piera para asegurar el fluido dentro de la picada.
- Coloque una sola corbata en cada una de las dos Micropipetas de vidrio preparadas para la canulación uterina y en las dos agujas de punta Romo designadas para la cannulación umbilical. Asegure los lazos con las pipetas y las agujas de punta Romo para evitar la pérdida durante los movimientos de la cámara (figura 1C).
3. la cosecha placentaria
- Anestesiar una rata hembra embarazada en el día de gestación 20 con 5% isoflurano durante aproximadamente 4 min o hasta que el animal exhibe respiración forzada. Mover el animal al cono de la nariz y administrar 2.5% − 3% isoflurano para mantener la anestesia. Confirme la inconsciencia por falta de reflejo de pellizco del dedo del pie.
Nota: el uso de una rata en el día gestacional 20 se presenta en este protocolo. Sin embargo, el protocolo sigue siendo el mismo si las condiciones experimentales requieren que la evaluación placentaria se lleve a cabo antes de la gestación. - Identifique y aísle el cuerno uterino (derecha o izquierda) de su elección levantando y esparciendo los caminos largos fuera de la carcasa de la rata. Usando una sutura de seda trenzada, amarre la arteria uterina en el extremo del ovario y el extremo vaginal del cuerno. Incluir el ovario dentro de la sutura con el cuerno uterino.
- El uso de tijeras quirúrgicas, reduce el consumo del cuerno uterino haciendo cortes en el lado proximal de la corbata del ovario y el lado distal del lazo vaginal, dejando el cuerno uterino atado con las suturas en ambos extremos. Transfiera el cuerno uterino al plato de disección recubierto con caucho de silicona y llenado con PSS frío (4 ° c). Independientemente de si se elige el cuerno derecho o izquierdo, mantenga ese mismo lado para la selección en cada experimento para la consistencia.
Nota: para la anestesia fetal, los cachorros se mantienen en PSS helada. Por lo tanto, la temperatura de PSS dentro de la cámara de disección se mantiene mediante un baño de circulación refrigerado o una cámara de disección debe mantenerse en hielo.
Nota: en este punto la presa anestesiada puede ser eutanasia por aprobación del protocolo IACUC de laboratorio. En este caso, la eutanasia se produce a través del neumotórax (cortando el diafragma) y la extirpación del corazón materno. - Empuje suavemente un pasador de disección a través del cuerno uterino hacia el caucho de silicona, con el lado del ovario a la izquierda y el lado vaginal a la derecha para visualizar la vasculatura uterina. Esto estabilizará el útero y evitará el movimiento del tejido durante la disección del compartimiento fetal. Seleccione una unidad central materno-placenta-fetal en el cuerno y ligar la arteria y la vena uterina con tijeras quirúrgicas. Corta el músculo uterino proximal y distal a la placenta y al feto seleccionados. El músculo uterino se puede retirar tirando hacia el costado; es importante dejarlo intacto, pero sacarlo de cubrir el cachorro fetal.
Nota: la selección de la unidad materno-placenta-fetal debe basarse en la longitud del segmento de la arteria uterina a ambos lados de la arteria arcuada. Los segmentos más largos permitirán una canulación más exitosa. - Usando fórceps finos y tijeras, retira la membrana amniótica de la superficie fetal de la placenta, cuidando de evitar el cordón umbilical.
- Desentrañar y ligar el cordón umbilical para separar el cachorro fetal.
- Identifique la arteria umbilical (recipiente más grueso) y la vena (recipiente más delgado). Marque la vena umbilical para una fácil identificación cortarla ligeramente más corta que la arteria umbilical.
- Separe suavemente la arteria y la vena umbilical entre sí.
- Se puede cortar y extirpar toda la unidad placentaria, incluyendo la vasculatura uterina, el músculo uterino, la placenta y el cordón umbilical.
4. perfusión placentaria
- Mantener el flujo sanguíneo anatómico conservando la orientación distal-proximal correcta de la arteria uterina, colocar la unidad placentaria (compuesta de la vasculatura uterina, músculo uterino, placenta, y cordón umbilical) en la cámara de recipiente aislado modificada llenado con PSS cálido y oxigenado.
- Usando un par de fórceps finos en cada mano, Acanale los extremos proximal y distal de la arteria uterina sobre las Micropipetas de vidrio.
- Asegure firmemente la arteria uterina utilizando el lazo de sutura de nylon estéril previamente asegurado en la micropila.
Nota: pueden ser necesarios dos lazos de lazo (nudo); sin embargo, un lazo único permite un mayor ajuste. - Cannulate la arteria umbilical (flujo sanguíneo fetal-materno) en la aguja 23 G (más grande) y asegúrela con sutura de seda trenzada negra.
- Cannulate la vena umbilical (flujo sanguíneo materno-fetal) en la aguja Roma 25 G (más pequeña) y asegúrela con sutura de seda trenzada negra.
- Pasar a la estación de perfusión placentaria y rellenar todos los tapones y tubos para evitar burbujas de aire. Conecte todas las tuberías de acuerdo con la figura 2.
- Coloque pequeños botes de pesaje bajo la cannulación distal de la arteria uterina materna y la canulación de la aguja de la vena umbilical fetal para atrapar el efluente que surgirá durante el procedimiento.
- Encienda la bomba peristótica, el controlador de presión y el monitor de presión y abra la llave para permitir el flujo de fluido a través de la tubería hacia el transductor de presión, pero aún no a la placenta. Aumente lentamente la presión a 80 mm Hg.
- Lentamente gire la llave a la placenta para abrirla y vigilar las fugas dentro de la cámara y alrededor de los lazos.
Nota: Si la bomba peristótica está funcionando a alta velocidad, vuelva a evaluar la cannulación uterina proximal y los lazos para fugas de fluido. Si se identifican, deben remediarse las fugas. También tenga en cuenta, mientras que la presión arterial uterina media permanecerá constante (fijado a 80 mmHg), el caudal de fluido puede ser variable dependiendo de las respuestas fisiológicas vasculares y placentarias. La cuantificación del flujo de fluido puede identificarse como una variable experimental en respuesta a la exposición xenobiótica. - Gire el llave para permitir el flujo de fluido en la arteria umbilical. Ajustar la presión a aproximadamente 50 mmHg, que se puede implementar con una bomba peristáltitica (figura 3) o una columna hidrostática.
- Rellene todos los reservorios (uterinos, umbilicales y superfusados) para mantener el volumen fluido durante todo el experimento.
Nota: una vez iniciada la perfusión y experimentando el experimento, los cachorros anestesiados que queden en el plato de disección pueden ser evaluados por su viabilidad tocando a los cachorros con fórceps para provocar una respuesta neurológica. La desangramiento de los cachorros se producirá a través de la histerectomía del cuerno uterino; se puede completar una mayor eutanasia mediante protocolos IACUC aprobados. En este caso, abrir el saco amniótico en el PSS frío y crear un neumotórax cortando las costillas.
5. experimento simulado
- Después de la canulación y el inicio de la perfusión de PSS, deje que los tejidos se equilibren durante 30 minutos para permitir que la vasculatura se ajuste al nuevo flujo de fluido. Succione el efluente con una picada y guárdelo en un tubo de microcentrífuga correspondientemente etiquetado.
- Después del equilibrado, establezca la perfusión basal recogiendo efluentes durante 10 min de ambos barcos de pesaje en tubos de microcentrífuga y midiendo el volumen de fluido que emerge a través de la arteria uterina y la vena umbilical.
- Inicie la recolección de muestras a intervalos de 10 minutos recogiendo los efluentes de la arteria uterina distal y la vena umbilical. Por ejemplo, administrar una dosis en bolo de 900 μl de nanopartículas de poliestireno etiquetadas con ródamina de 20 Nm (8 x 1014 partículas/ml) suspendidas en el 0,01% de tensioactivo a la línea perfundiendo la arteria uterina para identificar el paso del curso de tiempo de xenobióticos nanopartículas a través de la barrera placentaria.
Nota: estas muestras de efluentes permitirán la medición de contaminantes dentro del fluido (ya sea xenobiótico, farmacológico o metabolito) y proporcionarán la tasa de flujo de fluido a través de la arteria uterina o a través de la placenta y en el compartimiento fetal ( Figura 4). - Después de la perfusión en bolo, recoja las muestras de la arteria uterina distal y del efluente del feto de la vena umbilical cada 10 min durante un total de 180 min después de la perfusión.
6. limpieza del equipo
- Después de cada experimento, retira la unidad placentaria de las pipetas. Todas las suturas se pueden guardar para ser reutilizadas en futuros experimentos. El tejido placentario se puede guardar para estudios histológicos o mecanisticos adicionales.
- Limpie todas las tuberías y cánulas del sistema de perfusión con etanol al 70% seguido de agua destilada y seque al vacío.
Nota: si los tubos o pipetas empiezan a decolorarse o parecer dañados, sustituya antes del siguiente experimento. Además, después de completar una cohorte experimental (por ejemplo, todos los estudios pertenecientes a un solo contaminante), reemplace todas las tuberías dentro de la cámara para evitar la contaminación cruzada.
Resultados
La figura 5 muestra los experimentos de prueba de principio utilizando el tinte azul de Evan, lo que nos permite probar el sistema y visualizar la función de barrera placentaria y fluido adecuada y evitar la transferencia de contención al compartimento fetal. El tinte azul de Evan alcanzó y perfunde el tejido de la placenta dentro de este sistema (figura 5A). Tras una investigación más clara, es evidente que el tinte azul de Evan no se introduce en la vena umbilical fetal (figura 5b), que se espera que el tinte azul de Evan esté ligado a la albúmina.
La figura 6 muestra los datos del experimento simulado descrito en este protocolo. Se midieron muestras de efluentes del extremo distal de la arteria uterina y de la vena umbilical fetal en cada segmento de 10 minutos para evaluar el flujo de fluido a lo largo del tiempo después de administrar la dosis en bolo a la arteria uterina materna (figura 6). Se redujo la transferencia de fluido al compartimento fetal en 10 minutos después de que se identificó la perfusión de poliestireno. Para cuantificar la transferencia de poliestireno al compartimento fetal durante el curso de tiempo en que se produce, se colocaron 25 μL del fluido perfundido de cada punto de tiempo en una placa de pozo de 96 en duplicado para medir la fluorescencia de la muestra. La fluorescencia fue determinada por la lectura espectroscópica a 546/575 nm (ex/EM) utilizando un lector de microplacas fluorescentes. La transferencia de poliestireno al compartimiento fetal se produjo en 10 minutos y alcanzó un máximo de 20 minutos y continuó durante 90 minutos (Figura 6B).
Se ahorró un subconjunto de tejidos placentarios perfusionados para la histopatología y las evaluaciones morfológicas. Los tejidos fueron fijos en formol y hematoxilina y eosina manchados y revisados por un patólogo veterinario certificado por la Junta. Estos expertos no identificaron anomalías estructurales en en perfundidas por sólo PSS, o PSS con la dosis en bolo de poliestireno etiquetado con ródamina.

Figura 1: la cámara de un solo recipiente modificada. (A) un resumen de la cámara modificada. (B) una imagen de cerca de las agujas de punta Roma aseguradas dentro de la cámara del recipiente. La flecha roja indica el clip de termistor que ha sido alterado para sostener las agujas en su lugar para la canulación umbilical. (C) una imagen representativa de las cuatro cánulas preparadas para la canulación de los tejidos. Las flechas rojas apuntan a cada una de las cuatro cánulas. Por favor, haga clic aquí para ver una versión más grande de esta figura.

Figura 2: una vista más cercana de la cámara de perfusión placentaria. (A) esto representa el tubo adherido al transductor de presión y canulado la arteria uterina materna proximal, o el "inflow". La presión se fija a una constante 80 mmHg según lo definido por la literatura. (B) esto representa el puerto de drenaje de la cámara del superfusato que rodea el tejido placentario durante la perfusión. (C) esto representa el caudal de la cámara del superfusato para bañar la placenta con los PSS calentados durante la perfusión. (D) esto representa el puerto uterino materno distal donde se puede recoger el efluente de la perfusión uterina. (E) esto representa el puerto de temperatura, donde la cámara del recipiente se puede adjuntar a un termómetro y calentador para mantener una temperatura constante durante todo el experimento. (F) esto representa la canulación de la arteria umbilical. La arteria umbilical está presurizada a 50 mmHg para permitir el flujo de contracorriente a nivel de la placenta. (G) esto representa la colección de efluentes de venas umbilicales. El fluido que fluye hacia el compartimento fetal durante la perfusión se recolectará aquí. (H) este es el centro del sistema de perfusión, donde la placenta es cannulada y mantenida a lo largo de la perfusión. Por favor, haga clic aquí para ver una versión más grande de esta figura.

Figura 3: una vista del sistema de perfusión placentaria. ( A y B) el sistema de control de presión utilizado para monitorizar y mantener 80 mmHg de perfusato a través de la arteria uterina. (C) esto representa la termoregulación de la cámara de perfusión. (D) microscopio. (E) cámara de perfusión. (F) perfusión de la arteria umbilical alimentada por gravedad establecida en 50 mmHg. (G) una bomba peristótica utilizada para llenar y drenar los PSS superfusados de la placentaria. Por favor, haga clic aquí para ver una versión más grande de esta figura.
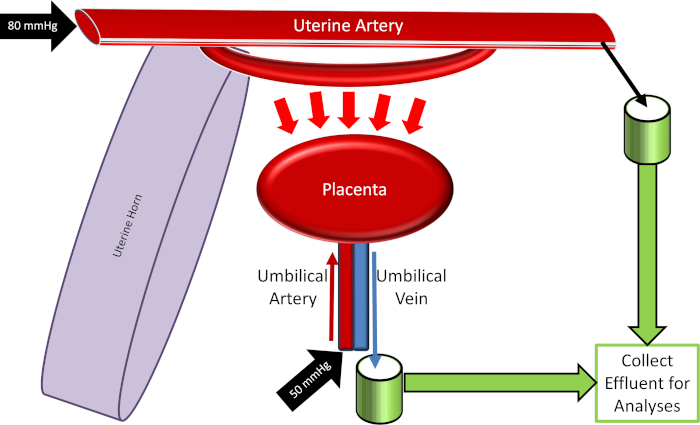
Figura 4: esquema del sistema de perfusión placentaria. Por favor, haga clic aquí para ver una versión más grande de esta figura.
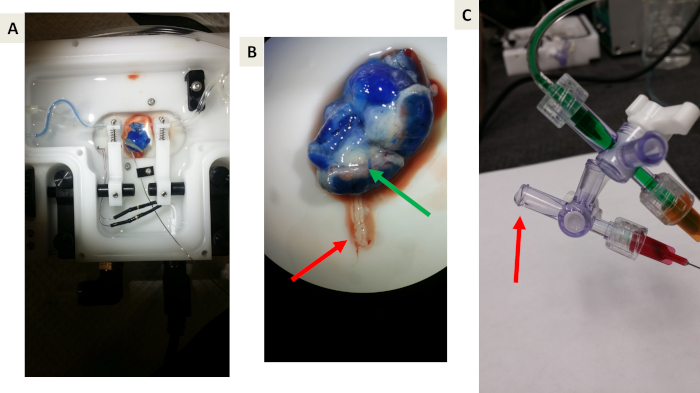
Figura 5: imágenes representativas de experimentos de prueba de principio usando el tinte azul de Evan. (A y B) prueba de principio de que el azul de Evan perfumará la vasculatura uterina, el músculo uterino y la placenta, pero no cruzará la barrera placentaria debido a la Unión a la albúmina. La flecha verde indica el drenaje venoso azul de la placenta de vuelta a la circulación materna. La flecha roja indica el efluente de la vena umbilical hacia el compartimiento fetal. Tenga en cuenta la falta de tinte azul. (C) una imagen representativa de la recogida de efluentes que drenan de la vena umbilical. La flecha roja indica la formación de gota antes de la recolección. Por favor, haga clic aquí para ver una versión más grande de esta figura.
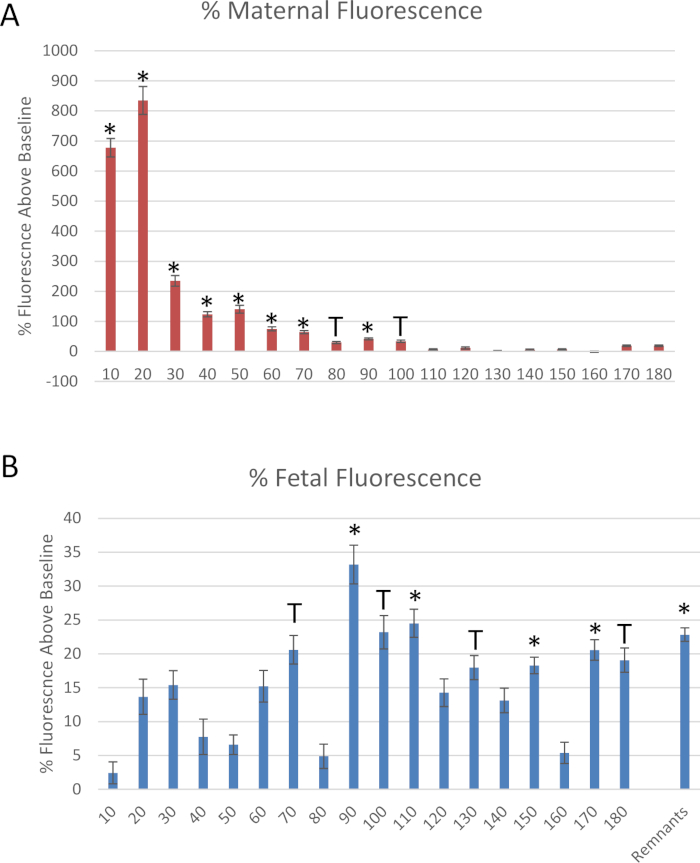
Figura 6: datos derivados del experimento simulado. Mediciones de fluorescencia de nanomateriales de poliestireno etiquetados con ródamina, normalizadas a la fluorescencia basal, a través de la recolección de (a) arteria uterina y (B) efluentes de la vena umbilical fetal. Media normalizada a la fluorescencia basal ± error estándar (SE). *: p < 0,05 y T: p < 0,1 a través del análisis de varianza (ANOVA). Por favor, haga clic aquí para ver una versión más grande de esta figura.
Discusión
Este método de perfusión permite una evaluación rápida de la barrera placentaria y la función fisiológica de la vasculatura uterina y la capa de trofrogranos. La cannulación y la perfusión de los extremos proximal a distal de la arteria uterina materna simula la fisiología del flujo sanguíneo materno a través de este importante buque responsable de enviar sangre al feto en desarrollo. Esta metodología permite la evaluación fisiológica de la vasculatura aislada materna, placentaria y umbilical, y por lo tanto los cambios en la fisiología pueden ser identificados como patología vascular; Las inervaciones inmunológicas y neuronales se eliminan en el procedimiento ex vivo. Para garantizar una evaluación adecuada, por lo tanto es fundamental para acanale estos recipientes cuidadosamente para no crear lágrimas o pinchazos en las paredes de los vasos, y para eliminar las burbujas de aire. La émbolos de gas puede causar daños a la capa endotelial de la vasculatura u obstruir los vasos sanguíneos. Al mantener las conexiones vasculares entre el útero, la placenta y el feto durante la disección, se puede observar la evaluación del fluido y la translocación al feto. Con la administración de un xenobiótico, en este caso de poliestireno de 20 nm, la cinética al extremo distal de la arteria uterina y a través de la placenta hasta el compartimiento fetal puede evaluarse mediante el análisis de efluentes durante un curso de tiempo de 180 minutos.
Mientras que se describió un modelo de perfusión dual y se supervisó la transferencia de partículas y fluidos desde el compartimiento materno al fetal, las evaluaciones también se pueden hacer en reversa desde el feto hasta el compartimiento materno. Una limitación del método descrito aquí es que la vena uterina distal no se cannuló ni se muestreó. En futuros estudios, especialmente aquellos centrados en la transferencia fetal-materna, será importante acanale y muestrear el vaso uterino distal. Los efluentes tomados de este simulacro experimento se utilizaron para evaluar la transferencia xenobiótica; sin embargo, se puede realizar una amplia gama de evaluaciones relacionadas con las funciones placentarias y la nutrición fetal.
Los puntos fuertes de este protocolo superan con creces sus limitaciones menores. La preparación mantiene la estructura fisiológica y la integridad de todo un órgano para evaluar las condiciones experimentales. La perfusión placentaria ex vivo es una progresión científica que se basa en el sistema celular in vitro a la exposición de animales enteros para determinar adecuadamente la evaluación del riesgo reproductivo. Esto puede considerarse una técnica valiosa para los estudios que evalúan la disposición farmacológica de los fármacos placentarios, la farmacocinética, la toxicología, la fisiología y la medicina materno-fetal.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Este trabajo fue apoyado por el Instituto Nacional de Ciencias de la salud ambiental (R00-ES024783), el centro Rutgers para exposiciones ambientales y enfermedades (P30-ES005022), y el programa de posgrado conjunto de Rutgers en Toxicología (T32-ES007148). También nos gustaría agradecer a los doctores Michael Goedken, Marianne Polunas y Pedro Louro por su experiencia técnica y al Dr. Adam Goodwill por su ayuda en el diseño de nuestro esquema de perfusión (figura 5).
Materiales
| Name | Company | Catalog Number | Comments |
| Black braided silk non-absorbable surgical suture non-sterile | Surgical Specialties Look | AACO805 | |
| Fine forceps | FST by Dumont Switzerland | 11252-20 | |
| Fine scissors | FST by Dumont Switzerland | 14060-10 | |
| Glass cannula pack | Living Systems Instrumentation (LSI) | GCP-75-100 | |
| Microcentrifuge Tubes 2.0mL polypropylene graduated tube with locking lid MIXED | Fisherbrand | 02-681-299 | |
| Non-serrated fine curved micro serrefine clamps | InterFocus | 18052-03 | |
| Perfusate pump | ISMATEC | ISM795C | |
| Pressure monitor | Living Systems Instrumentation (LSI) | Mode PM-4 | |
| Self-heating single vessel chamber | Living Systems Instrumentation (LSI) | CH-1 | |
| Servo Pump | Living Systems Instrumentation (LSI) | ModelPS-200-P | |
| Stainless steel blunt needle 23 gauge | Component Supply Co. | 04651-01 | |
| Stainless steel blunt needle 25 gauge | Component Supply Co. | 07116-01 | |
| STERILE Nylon Suture | AROSurgical Instruments Corporation | T04A00N07-13 | |
| Stopcock | Sedation Resource | 6-205-04 | |
| Temperature Controller | Living Systems Instrumentation (LSI) | Model TC-09S |
Referencias
- Troen, P., Gordon, E. E. Perfusion studies of the human placenta. I. Effect of estradiol and human chorionic gonadotropin on citric acid metabolism. Journal of Clinical Investigation. 37, 1516-1523 (1958).
- Alexander, D. P., Huggett, A. S., Nixon, D. A., Widdas, W. F. The placental transfer of sugars in the sheep: the influence of concentration gradient upon the rates of hexose formation as shown in umbilical perfusion of the placenta. Journal of Physiology. 129, 367-383 (1955).
- Alexander, D. P., Andrews, R. D., Huggett, A. S., Nixon, D. A., Widdas, W. F. The placental transfer of sugars in the sheep: studies with radioactive sugar. Journal of Physiology. 129, 352-366 (1955).
- Dancis, J., Money, W. L. Transfer of sodium and iodo-antipyrine across guinea pig placenta with an in situ perfusion technique. American Journal of Obstetrics and Gynecology. 80, 215-220 (1960).
- London, W. T., Money, W. L., Rawson, R. W. Placental Transport of I-131-Labeled Thyroxine and Triiodothyronine in the Guinea Pig. Endocrinology. 73, 205-209 (1963).
- Stulc, J., Stulcova, B., Svihovec, J. Transport of calcium across the dually perfused placenta of the rat. Journal of Physiology. 420, 295-311 (1990).
- Goeden, N., Bonnin, A. Ex vivo perfusion of mid-to-late-gestation mouse placenta for maternal-fetal interaction studies during pregnancy. Nature Protocols. 8, 66-74 (2013).
- Bond, H., et al. Artificial perfusion of the fetal circulation of the in situ mouse placenta: methodology and validation. Placenta. 27, (2006).
- Illsley, N. P., Fox, H., Van der Veen, F., Chawner, L., Penfold, P. Human placental ultrastructure after in vitro dual perfusion. Placenta. 6, 23-32 (1985).
- Davis, M. J., Kuo, L., Chilian, W. M., Muller, J. M., Barker, J. H., Anderson, G. L., Menger, M. D. Isolated, Perfused Microvessels. Clinically Applied Microcirculation Research. , 435-456 (1995).
- Butcher, J. T., Goodwill, A. G., Frisbee, J. C. The ex vivo isolated skeletal microvessel preparation for investigation of vascular reactivity. Journal of Visualized Experiments. (62), 3674 (2012).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados