Method Article
Perfusione ex vivo della placenta del roditore
In questo articolo
Riepilogo
Qui viene presentato un protocollo di perfusione vascolare materna-fetale ex vivo per consentire la somministrazione di un articolo di prova nella vascolarizzazione materna e per valutare il trasferimento placentare di particelle xenobiotiche o agenti farmacologici oltre alle alterazioni in fisiologia placentare.
Abstract
La placenta è un organo chiave durante la gravidanza che funge da barriera per l'esposizione fetale xenobiotica e media lo scambio di nutrienti per i rifiuti. Un saggio è descritto qui per profumi una placenta di ratto isolata e valutare la traslocazione materna-fetale di xenobiotici ex vivo. Inoltre, la valutazione dei processi fisiologici, come il flusso del fluido al feto e il metabolismo placentare, può essere condotta con questa metodologia. Questa tecnica è adatta per valutare la cinetica materna-fetale dei candidati farmaceutici o dei contaminanti ambientali. Contrariamente agli attuali approcci alternativi, questa metodologia consente di valutare la vascolarizzazione materna-fetale isolata, con il coinvolgimento neurale o immunitario sistemico rimosso, permettendo di rilevare eventuali cambiamenti osservati nella funzione fisiologica attribuibili a fattori locali all'interno del tessuto isolato.
Introduzione
Mantenendo la struttura morfologica e la reattività fisiologica, la perfusione degli organi è stato un approccio accettato basato su sistemi o tessuti per l'analisi della funzione metabolico. Queste tecniche di perfusione consentono l'esame ex vivo delle risposte tissutali intatte a una varietà di stimoli farmacologici e meccanici. La perfusione della placenta umana è stata inizialmente descritta in 1958 per identificare gli effetti ormonali sull'attività metabolica del ciclo dell'acido citrico; precedentemente identificato in omogeneiti tissutali, Troen e Gordon hanno riconosciuto la necessità di chiarire l'attività endocrina utilizzando un nuovo approccio fisiologico1. Nella stessa epoca, le strategie di monoperfusione (materna-fetale o fetale-materna) sono state descritte in grandi modelli di2,3 e4 animali per comprendere il trasferimento placentare di zuccheri, sali e farmaci antipirrini. Sono state descritte tecniche in vivo ed ex vivo Dual-perfusion (perfusione materna e fetale coordinata) per caratterizzare ulteriormente il trasferimento placentare utilizzando le metodologie in vivo5 ed ex vivo6,7,8 . I progressi tecnologici nella microscopia elettronica di trasmissione e scansione hanno permesso ai ricercatori di verificare l'integrità strutturale e funzionale dei tessuti placentali umani dopo la perfusione9.
Mentre la perfusione dei tessuti placentali umani e del Cotilio individuale è più rilevante, il rapido sviluppo di agenti farmacologici e contaminanti ambientali richiede l'uso di un modello di perfusione animale per lo screening precoce di xenobiotici trasferimento attraverso la barriera placentare. Questo metodo di perfusione placentare consente la valutazione del trasferimento attraverso la barriera placentare utilizzando placenta del ratto più facilmente raggiungibile e fisiologicamente pertinente. Inoltre, il flusso di fluido attraverso la barriera placentare per un periodo di tempo dopo un'esposizione può essere valutato misurando il volume di perfusato provenienti dall'arteria ombelicale. In virtù di consentire la perfusione placentare da entrambe le circolazioni materne e fetali, questo approccio a doppio flusso dell'organo intero può essere vantaggioso rispetto agli approcci attuali in vitro e in vivo. Questo metodo consente la somministrazione di uno xenobiotico attraverso l'aspetto materno da misurare da perfusato che emerge attraverso la placenta attraverso la vena ombelicale, o viceversa. Il protocollo qui presentato descriverà il trasferimento di 20 Nm di polistirene (una nanoplastica comune usata negli alimenti e nei prodotti medici) dall'arteria materna uterina allo scomparto fetale e una diminuzione associata del flusso di fluido attraverso la placenta per illustrare l'uso di questo metodo in molteplici contesti fisiologici, farmacologici e tossicologici per valutare il trasferimento placentare, il metabolismo e le alterazioni fisiologiche che influenzano il flusso materno e/o fetale.
Protocollo
Tutte le procedure sperimentali sono state approvate dal Comitato istituzionale per la cura e l'uso degli animali della Rutgers University.
1. preparazione prima dell'esperimento
Nota: questi passaggi possono essere eseguiti entro giorni/settimane prima dell'esperimento.
- Modificare la camera del recipiente.
Nota: la Figura 1a, B Mostra la camera singola di vaso modificata.- Spostare il sensore del termior da sotto la clip e piegarlo in modo che si blocchi liberamente nel bagno di perfusione (Figura 1B).
- Installare due aghi in acciaio inossidabile con punta smussata da 4 pollici con mozzi di collegamento Luer standard, 1 25 G e 1 23 G fissati sotto la clip termiagrumi e aggiungere un rubinetto a 3 vie per consentire la cannulazione della vascolarizzazione ombelicale (Figura 1B).
Nota: i collegamenti Luer di diverse dimensioni del calibro sono codificati a colori. Ciò facilita l'identificazione dei vasi durante e dopo l'esperimento.
- Installare due Micropipette in vetro da 70 − 100 μm. Per ulteriori informazioni su queste procedure, si prega di rivedere i seguenti riferimenti10,11.
Nota: il diametro della punta comunemente usato in questi esperimenti è compreso tra 70 e 100 μm. i diametri delle punte più grandi di questa gamma possono aggiungere difficoltà al processo di cannulazione, mentre i diametri delle punte inferiori a 60 μm possono perforare la parete vascolare durante la cannulazione. - Preparare i legami dalla sutura di nylon sterile (per le estremità prossimali e distali dell'arteria uterina) e dalla sutura non sterile di seta intrecciata nera (per i vasi ombelicali). Fare legami singoli per sutura looping come per avviare un nodo quadrato o legare una scarpa, come descritto in precedenza11.
Nota: i legami singoli sono comunemente fatti e conservati in una piastra di Petri riempita con un piccolo strato di gomma siliconica per aiutare a lavorare su uno sfondo appiccicoso. - Preparare 2 L di soluzione fisiologica salina (PSS) contenente, in mmol/L, 129,8 NaCl, 5,4 KCl, 0,5 NaH2po4, 0,83 MgSO4, 19 NaHCO3, 1,8 CAcl2e 5,5 glucosio. Regolare il pH a 7,40 ± 0,02 aggiungendo lentamente alcune gocce di acido (1 M di acido cloridrico) o di base (1 N di idrossido di sodio) alla soluzione e attendere almeno 20 s prima di leggere la misura di pH regolata. Conservare PSS fino a quando non è pronto per l'uso in frigorifero per ridurre la contaminazione, ma non conservare per più di 2 settimane.
- Etichettare provette per microcentrifuga per la raccolta di effluenti "materni" e "fetali" ad ogni punto temporale, cioè "MBaseline, M10, M20,..." fino al 180 min timepoint. Preparare lo stesso per gli effluenti fetali (FBaseline, M10, M20,....).
- Calibrare tutte le apparecchiature utilizzate all'interno del sistema, tra cui la temperatura del bagno circolante e i monitor della pressione sanguigna associati al mantenimento di pressioni perfusato uterina (80 mmHg) e ombelicali (50 mmHg).
- Preparare una camera di dissezione (4 "diametro x 1" profondo) o un piatto riscaldante circolante riempiendo uno strato (< 0,25 ") di gomma siliconica. Questa modifica deve essere fatta in anticipo e come ci vorrà 12 − 24 h per la gomma ad asciugare.
Nota: l'uso di un riscaldatore di ricircolo/piatto di refrigerazione è consigliato per i chirurghi principianti, in quanto il piatto non si muoverà e il tessuto manterrà una temperatura costante.
2. preparazione della stazione chirurgica e equilibratura delle attrezzature
- Accendere tutte le apparecchiature che supportano il sistema di perfusione per verificare la corretta funzione. Rimuovere il PSS dalla refrigerazione e dalla temperatura ambiente. Il PSS sarà utilizzato sia come perfusato che come superfusate.
- Posizionare una piccola pietra di gorgogliatura per consegnare una miscela di gas nel serbatoio superfusate. Le miscele comunemente utilizzate includono il 21% O2, 8% o 2, 3% o2e 0% o2. Accendere il gas per fornire piccole bolle alla soluzione superfusate. Regolare la consegna del gas per evitare spruzzi.
- Disporre la stazione di dissezione animale controllando anestetico, organizzando attrezzature chirurgiche e preparando legami di sutura. Preparare la camera di sezionamento raccogliendo i perni dissezione, accendendo il refrigeratore (o recuperando il ghiaccio) e riempiendo la camera dissezione (rivestita con silicone di gomma) con PSS freddo.
- Riempire delicatamente tutte le camere, gli aghi, le micropipette di vetro, i tubi e i serbatoi con PSS riscaldato, osservando attentamente ed eliminando le bolle d'aria, aspirandoli con una pipetta di trasferimento a punta fine. Girare tutti i rubinetti a 3 vie con "off" rivolto verso la direzione della pipetta per fissare il fluido all'interno della pipetta.
- Collocare una singola cravatta su ognuna delle due Micropipette di vetro preparate per la cannulazione uterina e sui due aghi a punta smussata designati per la cannulazione ombelicale. Fissare i legami con le pipette e gli aghi a punta smussata per evitare perdite durante i movimenti della camera (Figura 1C).
3. raccolta placentare
- Anestetizzare un ratto femmina incinta il giorno gestazionale 20 con 5% isoflurano per circa 4 min o fino a quando l'animale esibisce respiro affannosi. Spostare l'animale al cono del naso e somministrare il 2,5% − 3% di isoflurano per mantenere l'anestesia. Confermare la perdita di coscienza con una mancanza di punta pizzico riflesso.
Nota: l'uso di un ratto al giorno gestazionale 20 è presentato in questo protocollo. Tuttavia, il protocollo rimane lo stesso se le condizioni sperimentali richiedono che la valutazione placentare avvenga prima della gestazione. - Identificare e isolare il corno uterino (destra o sinistra) di scelta sollevando e diffondendo fuori lungo-vie al di fuori della carcassa del ratto. Utilizzando una sutura di seta intrecciata, legare l'arteria uterina all'estremità ovarica e alla fine vaginale del corno. Includere l'ovaio all'interno della sutura con il corno uterino.
- Usando le forbici chirurgiche, le accise via il corno uterino facendo tagli sul lato prossimale della cravatta ovaia e del lato distale della cravatta vaginale, lasciando il corno uterino legato con le suture su entrambe le estremità. Trasferire il corno uterino nel piatto dissezione rivestito in gomma siliconica e riempito con PSS freddo (4 ° c). Indipendentemente dal fatto che sia selezionato il corno destro o sinistro, mantenete lo stesso lato per la selezione in ogni esperimento per coerenza.
Nota: per l'anestesia fetale, i cuccioli sono conservati in PSS ghiacciato. Pertanto, la temperatura PSS all'interno della camera di dissezione viene mantenuta dal bagno circolante refrigerato o la camera dissezione deve essere mantenuta sul ghiaccio.
Nota: a questo punto la diga anestetizzata può essere eutanizzata per approvazione del protocollo IACUC di laboratorio. In questo caso, l'eutanasia avviene tramite pneumotorace (tagliando il diaframma) e la rimozione del cuore materno. - Spingere delicatamente un perno dissezione attraverso il corno uterino nella gomma siliconica, con il lato ovario a sinistra e il lato vaginale a destra per visualizzare la vascolarizzazione uterina. Questo stabilizzerà l'utero e impedirà il movimento del tessuto durante la dissezione dello scomparto fetale. Selezionare un'unità materna-placenta-fetale centrale al corno e ligare l'arteria uterina e la vena con le forbici chirurgiche. Tagliare il muscolo uterino prossimale e distale alla placenta e al feto selezionati. Il muscolo uterino può essere retratto tirando a lato; è importante lasciarlo intatto, ma tirarlo lontano da coprire il cucciolo fetale.
Nota: la selezione dell'unità materna-placenta-fetale deve essere basata sulla lunghezza del segmento dell'arteria uterina su entrambi i lati dell'arteria arcuata. Segmenti più lunghi permetteranno una maggiore riuscita della cannulazione. - Utilizzando pinze sottili e forbici, rimuovere la membrana amniotica dalla superficie fetale della placenta, avendo cura di evitare il cordone ombelicale.
- Svelare e ligare il cordone ombelicale per separare il cucciolo fetale.
- Identificare l'arteria ombelicale (vaso più spessa) e la vena (vaso più sottile). Contrassegnare la vena ombelicale per facilitarne l'identificazione tagliandolo leggermente più corto dell'arteria ombelicale.
- Separare delicatamente l'arteria ombelicale e la vena l'una dall'altra.
- L'intera unità placentare, compresa la vascolarizzazione uterina, il muscolo uterino, la placenta e il cordone ombelicale, può essere tagliata e rimossa.
4. perfusione placentare
- Mantenere il flusso sanguigno anatomico mantenendo il corretto orientamento distale-prossimale dell'arteria uterina, collocare l'unità placentare (composta da vascolarizzazione uterina, muscolo uterino, placenta e cordone ombelicale) nella camera di vaso isolata modificata riempita con PSS caldo e ossigenato.
- Utilizzando una coppia di pinze sottili in ogni mano, cannulare le estremità prossimali e distali dell'arteria uterina sulle Micropipette di vetro.
- Fissare saldamente l'arteria uterina utilizzando il legante di sutura in nylon sterile precedentemente fissato sulla micropipetta.
Nota: possono essere necessari anelli a due tiranti (nodo); Tuttavia, un singolo anello di cravatta consente una maggiore regolazione. - Cannulare l'arteria ombelicale (flusso sanguigno fetale-materno) sull'ago 23 G (più grande) e fissarlo con sutura di seta intrecciata nera.
- Cannulare la vena ombelicale (flusso sanguigno materno-fetale) sull'ago smussato da 25 G (più piccolo) e fissarlo con sutura di seta intrecciata nera.
- Spostarsi alla stazione di perfusione placentare e riempire tutti i rubinetti e i tubi per evitare bolle d'aria. Collegare tutti i tubi secondo la Figura 2.
- Collocare piccole imbarcazioni di pesatura sotto la cannulazione distale dell'arteria uterina materna e la cannulazione dell'ago della vena ombelicale fetale per catturare l'effluente che emergerà durante la procedura.
- Accendere la pompa peristaltica, il regolatore di pressione e il monitor di pressione e aprire il rubinetto di arresto per consentire il flusso di fluido attraverso il tubo verso il trasduttore di pressione, ma non ancora alla placenta. Aumentare lentamente la pressione a 80 mm Hg.
- Lentamente girare il rubinetto alla placenta per aprire e guardare per le perdite all'interno della camera e intorno ai legami.
Nota: se la pompa peristaltica è in funzione ad alta velocità, rivalutare la cannulazione uterina prossimale e i legami per le perdite di fluido. Se identificate, le fughe devono essere sanate. Si noti anche, mentre la pressione dell'arteria uterina media rimarrà costante (impostata su 80 mmHg), la portata del fluido può essere variabile a seconda delle risposte fisiologiche vascolari e placentare. La quantificazione del flusso del fluido può essere identificata come variabile sperimentale in risposta all'esposizione xenobiotica. - Ruotare il rubinetto di arresto per consentire il flusso di fluido nell'arteria ombelicale. Impostare la pressione a circa 50 mmHg, che può essere implementata con una pompa peristaltica (Figura 3) o una colonna idrostatica.
- Riempire tutti i serbatoi (uterine, ombelicali e superfusate) per mantenere il volume fluido durante l'esperimento.
Nota: una volta iniziata la perfusione ed è in corso l'esperimento, i cuccioli anestetizzati rimasti nel piatto dissezione possono essere valutati per la vitalità toccando i cuccioli con pinze per suscitare una risposta neurologica. L'espirazione dei cuccioli avverrà attraverso l'isterectomia del corno uterino; l'eutanasia può essere completata attraverso protocolli approvati IACUC. In questo caso, aprendo il sacco amniotico nel PSS freddo e creando un pneumotorace tagliando le costole.
5. esperimento finto
- Dopo la cannulazione e l'inizio della perfusione PSS, lasciare i tessuti equilibrare per 30 min per consentire la vascolarizzazione di adattarsi al nuovo flusso di fluido. Aspirare l'effluente da una pipetta e salvarlo in un tubo di microcentrifuga corrispondentemente etichettato.
- Dopo l'equilibratura, stabilire la perfusione di base raccogliendo gli effluenti per 10 minuti da entrambe le imbarcazioni di pesatura in provette per microcentrifuga e misurando il volume di fluido che emerge attraverso l'arteria uterina e la vena ombelicale.
- Avviare la raccolta dei campioni a intervalli di 10 minuti raccogliendo gli effluenti dall'arteria uterina distale e dalla vena ombelicale. Ad esempio, somministrare una dose di bolo di 900 μl di nanoparticelle di polistirene con etichetta di 20 Nm (8 x 1014 particelle/ml) sospese nel 0,01% di tensioattivi alla linea che irrora l'arteria uterina per identificare il passaggio del decorso del tempo di xenobiotico nanoparticelle attraverso la barriera placentare.
Nota: questi campioni di effluenti consentiranno la misurazione di contaminanti all'interno del fluido (xenobiotico, farmacologico o metabolita) e forniscono il tasso di flusso del fluido attraverso l'arteria uterina o attraverso la placenta e nello scomparto fetale ( Figura 4). - Dopo l'infusione in bolo, raccogliere campioni dall'arteria uterina distale e dall'effluente fetale della vena ombelicale ogni 10 minuti per un totale di 180 minuti dopo l'infusione.
6. pulizia dell'apparecchiatura
- Dopo ogni esperimento, rimuovere l'unità placentare dalle pipette. Tutte le suture possono essere salvate per essere riutilizzate in esperimenti futuri. Il tessuto placentare può essere salvato per ulteriori studi istologici o meccanicistici.
- Pulire tutti i tubi e le cannule del sistema di perfusione con 70% di etanolo seguito da acqua distillata e asciugare sottovuoto.
Nota: se i tubi o le pipette iniziano a scolorirsi o a comparire danneggiate, sostituire prima dell'esperimento successivo. Inoltre, dopo che una coorte sperimentale è completa (ad esempio, tutti gli studi relativi a un singolo contaminante), sostituire tutti i tubi all'interno della camera per evitare contaminazioni incrociate.
Risultati
La Figura 5 illustra gli esperimenti di proof-of-principio utilizzando il colorante blu di Evan, consentendoci di testare il sistema e visualizzare la funzione appropriata di barriera fluida e placentare e di prevenire il trasferimento del contenimento allo scomparto fetale. Il colorante blu di Evan raggiunse e perfezionò il tessuto della placenta all'interno di questo sistema (Figura 5a). Dopo ulteriori indagini, è chiaro che il colorante blu di Evan non è entrata nella vena ombelicale fetale (Figura 5b), che si prevede che il colorante blu di Evan sia legato all'albina.
Figura 6 Mostra i dati per l'esperimento fittizio descritto in questo protocollo. I campioni di effluenti dall'estremità distale dell'arteria uterina e della vena ombelicale fetale sono stati misurati in ogni segmento di 10 minuti per valutare il flusso di fluido nel tempo dopo la somministrazione della dose di bolo all'arteria uterina materna (Figura 6). Riduzione del trasferimento del fluido allo scomparto fetale entro 10 minuti dall'identificazione dell'infusione di polistirene. Per quantificare il trasferimento di polistirolo allo scomparto fetale durante il periodo di tempo in cui si verifica, 25 μL del fluido perfuso da ogni punto temporale è stato collocato in una piastra di 96 ben in duplicato per misurare la fluorescenza del campione. La fluorescenza è stata determinata dalla lettura spettroscopica a 546/575 Nm (ex/em) utilizzando un lettore di micropiastre fluorescente. Il trasferimento di polistirene allo scomparto fetale si è verificato entro 10 minuti e ha raggiunto un picco di 20 minuti e ha continuato per 90 minuti (Figura 6b).
Un sottoinsieme di tessuti placentali perfusati è stato salvato per le valutazioni istopatologiche e morfologiche. I tessuti sono stati fissati in formalina e ematossilina e eosina macchiati e esaminati da un patologo veterinario certificato della scheda. Questi esperti non hanno identificato anomalie strutturali in placenta perfuso da solo PSS, o PSS con la dose di bolo di polistirene con etichetta di rodamina.

Figura 1: la camera singola di vaso modificata. A) una panoramica della camera modificata. B) un'immagine ravvicinata degli aghi a punta smussato fissati all'interno della camera del recipiente. La freccia rossa indica la clip termistore che è stata modificata per tenere gli aghi in posizione per la cannulazione ombelicale. C) un'immagine rappresentativa delle quattro cannule preparate per la cannulazione tissutale. Le frecce rosse puntano a ognuna delle quattro cannule. Si prega di cliccare qui per visualizzare una versione più grande di questa cifra.

Figura 2: una visione più ravvicinata della camera di perfusione placentare. (A) questo rappresenta il tubo attaccato al trasduttore di pressione e cannulate l'arteria uterina materna prossimale, o il "afflusso". La pressione è impostata su una costante 80 mmHg come definito dalla letteratura. (B) questo rappresenta la porta di drenaggio della camera del superfusate che circonda il tessuto placentare durante la perfusione. (C) questo rappresenta l'afflusso di camera della superfusate per bagnare la placenta con PSS riscaldato durante la perfusione. D) questo rappresenta la porta uterina materna distale in cui possono essere raccolti effluenti dalla perfusione uterina. (E) questo rappresenta la porta della temperatura, dove la camera del vaso può essere attaccata a un termometro e riscaldatore per mantenere una temperatura costante durante l'esperimento. (F) questo rappresenta la cannulazione dell'arteria ombelicale. L'arteria ombelicale è pressurizzata a 50 mmHg per consentire il flusso di controcorrente a livello della placenta. G) questo rappresenta la raccolta di effluenti della vena ombelicale. Il fluido che scorre verso lo scomparto fetale durante la perfusione sarà raccolto qui. (H) questo è il centro del sistema di perfusione, dove la placenta è cannulata e mantenuta durante tutta la perfusione. Si prega di cliccare qui per visualizzare una versione più grande di questa cifra.

Figura 3: una vista del sistema di perfusione placentare. (A e B) il sistema di controllo della pressione utilizzato per monitorare e mantenere 80 mmHg di perfusato attraverso l'arteria uterina. (C) questo rappresenta la termo-regolazione della camera di perfusione. (D) microscopio. (E) camera di perfusione. F) perfusione dell'arteria ombelicale alimentata a gravità impostata a 50 mmHg. (G) una pompa peristaltica utilizzata per riempire e drenare placentare superfusate PSS. Si prega di cliccare qui per visualizzare una versione più grande di questa cifra.
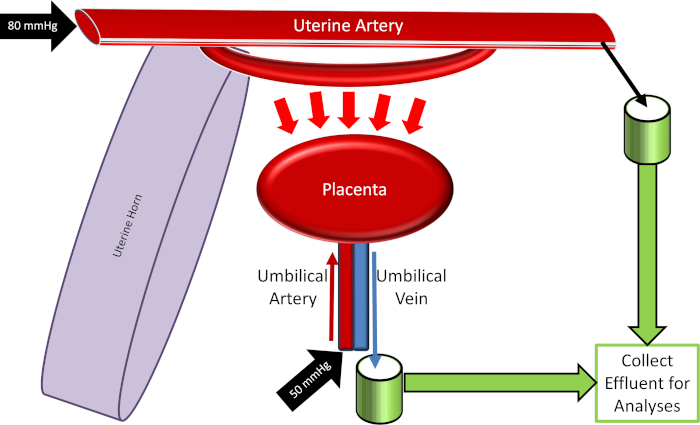
Figura 4: schema del sistema di perfusione placentare. Si prega di cliccare qui per visualizzare una versione più grande di questa cifra.
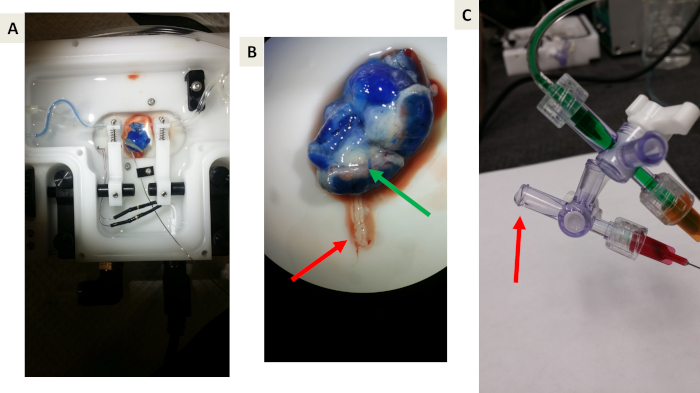
Figura 5: immagini rappresentative di esperimenti di prova di principio usando il colorante blu di Evan. (A e B) Proof-of-principio che il blu di Evan profumi la vascolarizzazione uterina, muscolo uterino, e placenta ma non attraversare la barriera placentare a causa di legame di albina. La freccia verde indica il drenaggio venoso blu dalla placenta alla circolazione materna. La freccia rossa indica l'effluente della vena ombelicale verso lo scomparto fetale. Notate la mancanza di colorante blu. C) un'immagine rappresentativa della raccolta di effluenti drenanti dalla vena ombelicale. La freccia rossa indica la formazione di goccia prima della raccolta. Si prega di cliccare qui per visualizzare una versione più grande di questa cifra.
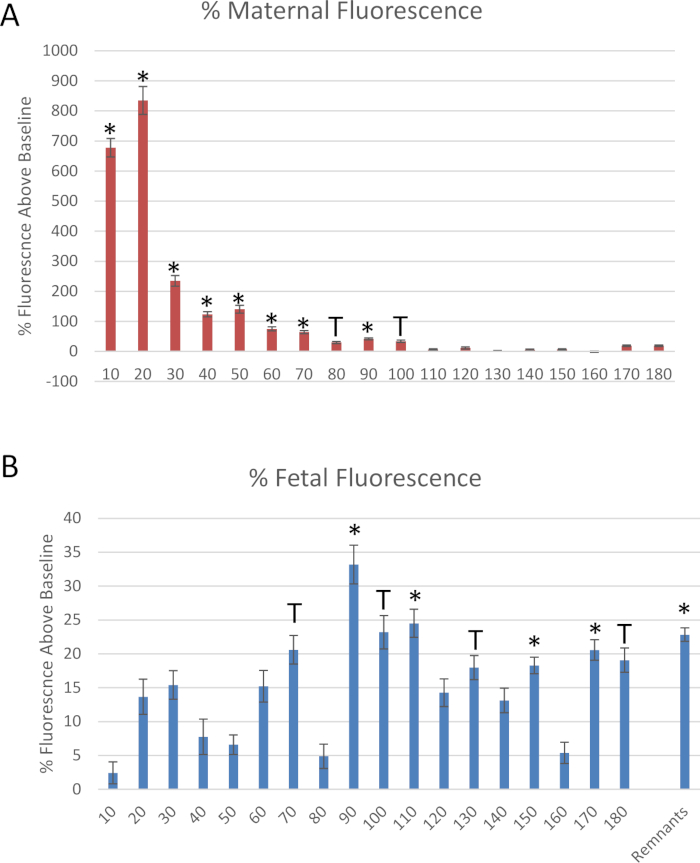
Figura 6: dati derivati dall'esperimento fittizio. Misurazioni di fluorescenza dei nanomateriali di polistirene etichettati con rodamina, normalizzati alla fluorescenza al basale, attraverso la raccolta di (A) arteria uterina e (B) effluenti fetali della vena ombelicale. Media normalizzata alla fluorescenza di base ± errore standard (SE). *: p < 0,05 e T: p < 0,1 tramite analisi della varianza (ANOVA). Si prega di cliccare qui per visualizzare una versione più grande di questa cifra.
Discussione
Questo metodo di perfusione consente una rapida valutazione della barriera placentare e della funzione fisiologica della vascolarizzazione uterina e dello strato di trofoblastica. La cannulazione e la perfusione delle estremità prossimali a quelle distali dell'arteria materna dell'utero simulano la fisiologia del flusso sanguigno materno attraverso questa grande nave responsabile dell'invio di sangue al feto in via di sviluppo. Questa metodologia consente una valutazione fisiologica della vascolarizzazione materna, placentare e ombelicale isolata, e pertanto i cambiamenti nella fisiologia possono essere identificati come patologia vascolare; le innervazioni immunitarie e neurali vengono rimosse nella procedura ex-vivo. Per garantire una corretta valutazione, è quindi fondamentale cannulare accuratamente questi vasi per non creare lacrime o forature nelle pareti dei vasi e per rimuovere le bolle d'aria. Il gas emboli può causare danni allo strato endoteliale della vascolarizzazione o ostruire i vasi sanguigni. Mantenendo le connessioni vascolari tra l'utero, la placenta e il feto durante la dissezione, si può osservare la valutazione del fluido e la traslocazione al feto. Con la somministrazione di uno xenobiotico, in questo caso 20 Nm di polistirene, la cinetica all'estremità distale dell'arteria uterina e attraverso la placenta allo scomparto fetale può essere valutata mediante analisi di effluenti in un corso temporale di 180 minuti.
Mentre è stato descritto un modello a doppia perfusione e il trasferimento di particelle e fluidi dal compartimento materno a quello fetale è stato monitorato in questo articolo, le valutazioni possono anche essere effettuate in retromarcia dal feto al compartimento materno. Una limitazione del metodo descritto qui è che la vena uterina distale non è stata cannulata o campionata. In studi futuri, in particolare quelli focalizzati sul trasferimento fetale-materno, sarà importante cannulare e assaggiare il vaso uterino distale. Gli effluenti prelevati da questo esperimento finto sono stati utilizzati per valutare il trasferimento xenobiotico; Tuttavia, può essere eseguita una vasta gamma di valutazioni relative alle funzioni placentare endocrine e molecolari o alla nutrizione fetale.
I punti di forza di questo protocollo superano di gran lunga le sue limitazioni minori. La preparazione mantiene la struttura fisiologica e l'integrità di un organo intero per valutare le condizioni sperimentali. La perfusione placentare ex vivo è una progressione scientifica dall'esposizione a base di cellule in vitro all'intera animale per determinare adeguatamente la valutazione del rischio riproduttivo. Questo può essere considerato una tecnica preziosa per gli studi che valutano la disposizione farmacologica placentare, la farmacocinetica, la tossicologia, la fisiologia e la medicina materna-fetale.
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
Questo lavoro è stato sostenuto dall'Istituto nazionale di Scienze della salute ambientale (R00-ES024783), Rutgers centro per le esposizioni ambientali e malattia (P30-ES005022), e Rutgers programma di laurea congiunta in tossicologia (T32-ES007148). Vorremmo anche ringraziare i DRS. Michael Goedken, Marianne Polunas, e Pedro Louro per la loro competenza tecnica e Dr. Adam goodwill per la sua assistenza nel progettare il nostro schema di perfusione (Figura 5).
Materiali
| Name | Company | Catalog Number | Comments |
| Black braided silk non-absorbable surgical suture non-sterile | Surgical Specialties Look | AACO805 | |
| Fine forceps | FST by Dumont Switzerland | 11252-20 | |
| Fine scissors | FST by Dumont Switzerland | 14060-10 | |
| Glass cannula pack | Living Systems Instrumentation (LSI) | GCP-75-100 | |
| Microcentrifuge Tubes 2.0mL polypropylene graduated tube with locking lid MIXED | Fisherbrand | 02-681-299 | |
| Non-serrated fine curved micro serrefine clamps | InterFocus | 18052-03 | |
| Perfusate pump | ISMATEC | ISM795C | |
| Pressure monitor | Living Systems Instrumentation (LSI) | Mode PM-4 | |
| Self-heating single vessel chamber | Living Systems Instrumentation (LSI) | CH-1 | |
| Servo Pump | Living Systems Instrumentation (LSI) | ModelPS-200-P | |
| Stainless steel blunt needle 23 gauge | Component Supply Co. | 04651-01 | |
| Stainless steel blunt needle 25 gauge | Component Supply Co. | 07116-01 | |
| STERILE Nylon Suture | AROSurgical Instruments Corporation | T04A00N07-13 | |
| Stopcock | Sedation Resource | 6-205-04 | |
| Temperature Controller | Living Systems Instrumentation (LSI) | Model TC-09S |
Riferimenti
- Troen, P., Gordon, E. E. Perfusion studies of the human placenta. I. Effect of estradiol and human chorionic gonadotropin on citric acid metabolism. Journal of Clinical Investigation. 37, 1516-1523 (1958).
- Alexander, D. P., Huggett, A. S., Nixon, D. A., Widdas, W. F. The placental transfer of sugars in the sheep: the influence of concentration gradient upon the rates of hexose formation as shown in umbilical perfusion of the placenta. Journal of Physiology. 129, 367-383 (1955).
- Alexander, D. P., Andrews, R. D., Huggett, A. S., Nixon, D. A., Widdas, W. F. The placental transfer of sugars in the sheep: studies with radioactive sugar. Journal of Physiology. 129, 352-366 (1955).
- Dancis, J., Money, W. L. Transfer of sodium and iodo-antipyrine across guinea pig placenta with an in situ perfusion technique. American Journal of Obstetrics and Gynecology. 80, 215-220 (1960).
- London, W. T., Money, W. L., Rawson, R. W. Placental Transport of I-131-Labeled Thyroxine and Triiodothyronine in the Guinea Pig. Endocrinology. 73, 205-209 (1963).
- Stulc, J., Stulcova, B., Svihovec, J. Transport of calcium across the dually perfused placenta of the rat. Journal of Physiology. 420, 295-311 (1990).
- Goeden, N., Bonnin, A. Ex vivo perfusion of mid-to-late-gestation mouse placenta for maternal-fetal interaction studies during pregnancy. Nature Protocols. 8, 66-74 (2013).
- Bond, H., et al. Artificial perfusion of the fetal circulation of the in situ mouse placenta: methodology and validation. Placenta. 27, (2006).
- Illsley, N. P., Fox, H., Van der Veen, F., Chawner, L., Penfold, P. Human placental ultrastructure after in vitro dual perfusion. Placenta. 6, 23-32 (1985).
- Davis, M. J., Kuo, L., Chilian, W. M., Muller, J. M., Barker, J. H., Anderson, G. L., Menger, M. D. Isolated, Perfused Microvessels. Clinically Applied Microcirculation Research. , 435-456 (1995).
- Butcher, J. T., Goodwill, A. G., Frisbee, J. C. The ex vivo isolated skeletal microvessel preparation for investigation of vascular reactivity. Journal of Visualized Experiments. (62), 3674 (2012).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon