Method Article
Ex Vivo Perfusion der Rodent Placenta
In diesem Artikel
Zusammenfassung
Hier wird ein Protokoll der ex vivo mütterlich-fetalen Gefäßperfusion vorgestellt, um die Verabreichung eines Testartikels in die mütterliche Vaskulatur zu ermöglichen und die plazentale Übertragung von xenobiotischen Partikeln oder pharmakologischen Wirkstoffen zu bewerten, zusätzlich zu den Veränderungen in Plazentale Physiologie.
Zusammenfassung
Die Plazenta ist ein Schlüsselorgan während der Schwangerschaft, das als Barriere für fetale Xenbiobiose dient und den Austausch von Nährstoffen gegen Abfall vermittelt. Hier wird ein Assay beschrieben, um eine isolierte Ratten-Plazenta zu perfektionieren und die mütterlich-fetale Translokation von xenobiotika ex vivo zu bewerten. Darüber hinaus kann mit dieser Methode die Auswertung physiologischer Prozesse wie Flüssigkeitsfluss zum Fötus und plakästigem Stoffwechsel durchgeführt werden. Diese Technik eignet sich zur Bewertung der kindlich-fetalen Kinetik von pharmazeutischen Kandidaten oder Umweltbelastungen. Im Gegensatz zu aktuellen alternativen Ansätzen ermöglicht diese Methodik die Bewertung der isolierten mütterlich-fetalen Vaskulatur, wobei die systemische neuronale oder Immunbeteiligung entfernt wird, so dass alle beobachteten Veränderungen in der physiologischen Funktion zu sein Aufgrund lokaler Faktoren im isolierten Gewebe.
Einleitung
Durch die Aufrechterhaltung der morphologischen Struktur und der physiologischen Reaktionsfähigkeit ist die Organperfusion ein anerkannter system-oder gewebebasierter Ansatz zur Analyse der Stoffwechselfunktion. Diese Perfusionstechniken ermöglichen die Ex-vivo-Untersuchung von intakten Gewebeanzeigen auf eine Vielzahl pharmakologischer und mechanischer Reize. Die Durchblutung der menschlichen Plazenta wurde ursprünglich 1958 beschrieben, um die hormonellen Wirkungen auf die Stoffwechselaktivität des Zitronensäurekreises zu identifizieren; Nachdem sie zuvor in Gewebehomogenaten identifiziert worden waren, erkannten Troen und Gordon die Notwendigkeit, die endokrine Aktivität mit einem neuartigen physiologischen Ansatzzuklären. In der gleichen Zeit wurden in großen Strategien von2, 3 und kleinen 4 Tiermodellen eine Einperfusions-(mütterlich-fett-oder fetalisch-zumütterliche) Strategien beschrieben, um die plazentäre Übertragung von Zucker, Salzen und Antipyrin-Medikamenten zu verstehen. In vivo und ex vivo Dual-Perfusion (koordinierte mütterliche und fetale Perfusion) Techniken wurden beschrieben, um die Plazental-Übertragung mit Hilfe von vivo 5und ex vivo 6,7,8 Methoden weiter zu charakterisieren. Technologische Fortschritte in der Übertragung und dem Scannen der Elektronenmikroskopie ermöglichten es Forschern, die strukturelle und funktionelle Integrität des menschlichen Plazenta-Gewebes nach der Perfusion zu überprüfen.
Während die Durchblutung von menschlichem Plazenta-Gewebe und individuellem Cotyledon am wichtigsten ist, erfordert die rasche Entwicklung pharmakologischer Wirkstoffe und Umweltbelastungen den Einsatz eines tierischen Perfusionsmodells für das frühe Screening von xenobiotischen Übertragung über die Plazenta-Barriere. Diese Plazenta-Perfusionsmethode ermöglicht die Auswertung der Übertragung über die Plazenta-Barriere mit leichter erreichbarer und physiologisch relevanter Ratten-Plazenta. Darüber hinaus kann der Flüssigkeitsfluss über die Plazenta-Barriere über einen längeren Zeitraum nach einer Exposition ausgewertet werden, indem das Volumen des Parusats aus der Nabelarterie gemessen wird. Durch die Möglichkeit der Plazenta-Perfusion sowohl aus den mütterlichen als auch aus den fetalen Kreisen kann dieser Dual-Flow-Ganzorgan-Ansatz im Vergleich zu aktuellen In-vitro und in vivo-Ansätzen von Vorteil sein. Diese Methode ermöglicht es, die Verabreichung eines Xenbiotikums durch den mütterlichen Aspekt aus dem Parfüm zu messen, das über die Plazenta durch die Nabelvene entsteht, oder umgekehrt. Das hier vorgestellte Protokoll beschreibt die Übertragung von 20 nm Polystyrol (ein häufiges Nanoplastikum, das in Lebensmitteln und Medizinprodukten verwendet wird) von der Gebärmutterarterie der Mutter in das fetale Fach und eine damit verbundene Abnahme des Flüssigkeitsflusses über die Plazenta zu illustrieren. Die Anwendung dieser Methode in mehreren physiologischen, pharmakologischen und toxikologischen Umgebungen zur Beurteilung der Plazenta-Übertragung, des Stoffwechsels und der physiologischen Veränderungen, die den mütterlichen und/fetalen Fluss betreffen.
Protokoll
Alle experimentellen Verfahren wurden vom Institutionellen Ausschuss für Tierpflege und-nutzung der Rutgers University genehmigt.
1. Vorbereitung vor dem Experiment
Hinweis: Diese Schritte können innerhalb von Tagen vor dem Experiment durchgeführt werden.
- Die Gefäßkammer ändern.
Hinweis: Abbildung 1A, B zeigt die modifizierte Einzelgefäßkammer.- Bewegen Sie den Thermistor-Sensor unter dem Clip und biegen Sie ihn so, dass er frei im Perfusionsbad hängt (Abbildung 1B).
- Installieren Sie zwei 4-Zoll-Blumen-Tipp-Edelstahlnadeln mit Standard-luer-Anschlusshummen, einer 25 G und einer 23 G, die unter dem Thermistor-Clip befestigt sind, und fügen Sie einen 3-Wege-Stopcock hinzu, um die Kanuation der Nabelvaskulatur zu ermöglichen (Abbildung 1B).
NOTE: Die luerbaren Anschlüsse verschiedener Spurgrößen sind farblich codiert. Dies ermöglicht eine einfache Identifizierung der Gefäße während und nach dem Experiment.
- Installieren Sie zwei 70 − 100 μm Glasmikropipetten. Weitere Informationen zu diesen Verfahren finden Sie in den folgenden Referenzen10,11.
Hinweis: Der bei diesen Experimenten häufig verwendete Spitzdurchmesser liegt im Bereich von 70 − 100 μm. Tippdurchmesser, die größer als dieser Bereich sind, kann dem Kanuationsprozess Schwierigkeiten verleihen, während Spitzendurchmesser kleiner als 60 μm die Gefäßwand während der Kanülung durchbrechen können. - Bereiten Sie die Bindungen aus der sterilen Nylonnaht (für proximale und distale Enden der Gebärmutterarterie) und aus schwarzer geflochtener Seide nicht-steril Naht (für die Nabelgefäße). Machen Sie einzelne Bindungen, indem Sie die Naht, um einen quadratischen Knoten zu initiieren oder binden Sieeinen Schuh, wie zuvor beschrieben 11.
Hinweis: Einzelne Bindungen werden in der Regel hergestellt und in einer Petrischale gehalten, die mit einer kleinen Schicht Silikonkautschuk gefüllt ist, um auf einem klebrigen Hintergrund zu arbeiten. - Bereiten Sie 2 L der physiologischen Salzlösung (PSS) vor, die in mmol/L, 129,8 NaCl, 5.4 KCl, 0,5NaH 2 PO4, 0,83 MgSO 4, 19 NaHCO3, 1,8 CaCl2und 5,5 Glukose enthält. Stellen Sie den pH-Wert auf 7,40 ± 0,02 ein, indem Sie langsam ein paar Tropfen Säure (1 M Salzsäure) oder Basis (1 N Natriumhydroxid) in die Lösung einfügen und mindestens 20 s warten, bevor Sie die eingestellte pH-Messung lesen. PSS so lange aufbewahren, wie es im Kühlschrank zum Einsatz kommt, um die Verunreinigung zu reduzieren, aber nicht länger als 2 Wochen lagern.
- Etiketten-Mikrozentrifugenröhren für das Sammeln von "mütterlichen" und "fetalen" Abwässern zu jedem Zeitpunkt, d.h. "MBaseline, M10, M20," ... Das bis zum 180-minütigen Timepoint. Bereiten Sie das gleiche für fetale Abwässer (FBaseline, M10, M20, ...).
- Kalibrieren Sie alle Geräte, die innerhalb des Systems verwendet werden, einschließlich der zirkulierenden Badetemperatur und Blutdruckmessgeräte, die mit der Aufrechterhaltung der Gebärmutter (80 mmHg) und Nabeldrücken (50 mmHg) verbunden sind.
- Bereiten Sie eine Sektionskammer (4 "Durchmesser x 1" tief) oder eine zirkulierende Heizschicht vor, indem Sie eine Schicht (< 0,25 ") aus Silikonkautschuk füllen. Diese Modifikation muss im Voraus erfolgen und es dauert 12 − 24 Stunden, bis der Gummi trocknet.
Hinweis: Die Verwendung einer umlaufenden Heiz-/Kühlschale wird für Anfänger empfohlen, da sich die Schale nicht bewegt und das Gewebe eine gleichbleibende Temperatur behält.
2. Vorbereitung der OP-Station und Ausgleichung der Ausrüstung
- Schalten Sie alle Geräte ein, die das Perfusionssystem unterstützen, um die richtige Funktion zu überprüfen. Entfernen Sie die PSS von der Kühlung und warm auf Raumtemperatur. Die PSS wird sowohl als Parfümeat als auch als Superfusat eingesetzt.
- Legen Sie einen kleinen Blasstein in das Superfusat-Staubecken. Die häufig verwendeten Mischungen umfassen 21% O2,8% O 2, 3% O2und 0% O2. Schalten Sie das Gas ein, um kleine Blasen für die Superfusatlösung zu liefern. Stellen Sie die Gaslieferung ein, um Spritzen zu vermeiden.
- Ordnen Sie die Tier-Sektionsstation durch die Überprüfung der Betäubung, die Anordnung von chirurgischen Geräten und die Vorbereitung von Nahtbindungen. Bereiten Sie die Sektionskammer vor, indem Sie die Trennstifte sammeln, den Kühler einschalten (oder Eis abholen), und die mit Gummissilikon ausgekleidete Sektkammer mit kaltem PSS füllen.
- Füllen Sie sanft alle Kammern, Nadeln, Glasmikropipetten, Schläuche und Behälter mit erwärmtem PSS, sorgfältig auf die Überwachung und Beseitigung von Luftblasen, indem Sie sie mit einer feinen Spitze Transferpipette. Drehen Sie alle 3-Wege-Stophähne mit "aus" in Richtung der Pipette, um die Flüssigkeit in der Pipette zu sichern.
- Legen Sie eine einzige Krawatte auf jedes der beiden Glasmikropipetten, die für die Gebärmutterkanüle vorbereitet sind, und auf die beiden Stumpfenspitzennadeln, die für die Nabelkanüschse bestimmt sind. Sichere Bindungen an die Pipetten und stumpfen Spitznadeln, um Verluste bei Kammerbewegungen zu verhindern (Abbildung 1C).
3. Placentaler Ernte
- Eine schwangere Ratte am Gestationstag 20 mit 5% isoflurane für ca. 4 min oder bis das Tier eine aufarbeitende Atmung aufweist. Bewegen Sie das Tier auf den Nasenkegel und verabreichen 2,5% − 3% isoflurane, um die Anästhesie zu erhalten. Bestätigen Sie das Unbewußtsein durch einen Mangel an Zehen Prise Reflex.
Hinweis: In diesem Protokoll wird die Verwendung einer Ratte am Gestationstag 20 dargestellt. Das Protokoll bleibt jedoch das gleiche, wenn experimentelle Bedingungen eine zarzentale Bewertung erfordern, die früher in der Schwangerschaft erfolgt. - Identifizieren und isolieren Sie das Gebärmutterhorn (rechts oder links) der Wahl, indem Sie die langen Wege außerhalb des Rattenkadavers ausheben und ausbreiten. Mit einer geflochtenen Seidennaht die Gebärmutterarterie am Eierstock-und vaginalen Ende des Horns abbinden. Mit dem Gebärmutterhorn den Eierstock in die Naht einschließen.
- Mit Hilfe einer chirurgischen Schere das Gebärmutterhorn abschalten, indem man auf der proximalen Seite der Eierstockbinde und der distalen Seite der Scheidenbinde schneidet und das Gebärmutterhorn an beiden Enden mit den Nähten abbindet. Das Gebärmutterhorn in die mit Silikonkautschuk ausgekleideten und mit kalten (4°C) PSS gefüllten Schale übertragen. Unabhängig davon, ob das rechte oder das linke Horn gewählt wird, halten Sie bei jedem Experiment die gleiche Seite für die Auswahl für die Konsistenz.
Achtung: Für fetale Anästhesie werden Welpen in eiskalter PSS gehalten. Daher wird die PSS-Temperatur innerhalb der Abschnittkammer durch gekühltes Umlaufbad gehalten oder die Abschnittkammer sollte auf Eis gehalten werden.
Hinweis: An dieser Stelle kann der Betäubungsdamm per IACUC-Protokoll euthaniert werden. In diesem Fall erfolgt die Sterbehilfe über Pneumothorax (durch Schneiden der Membran) und die Entfernung des mütterlichen Herzens. - Drücken Sie sanft einen Sektionsstift durch das Gebärmutterhorn in den Silikonkautschuk, mit der Eierstockseite nach links und der Scheidenseite nach rechts, um die Gebärmuttervaskulatur zu visualisieren. Dadurch wird die Gebärmutter stabilisiert und die Bewegung des Gewebes während der Aufteilung des fetalen Faches verhindert. Wählen Sie eine mütterlich-plakenta-fetale Einheit, die zentral am Horn liegt, und igmen Sie die Gebärmutterarterie und die Vene mit einer chirurgischen Schere. Schneiden Sie den Gebärmuttermuskel in der Nähe und distal auf die gewählte Plazenta und Fötus. Der Gebärmuttermuskel kann durch das Ziehen zur Seite gezogen werden; Es ist wichtig, es intakt zu lassen, aber es von der Deckung des fetalen Pup wegzuziehen.
Hinweis: Die Auswahl der Materie-Plazenta-fetalen Einheit sollte auf der Länge der Gebärmutterarterie Segment auf beiden Seiten der Arkularterie basieren. Längere Segmente werden eine erfolgreichere Kanülung ermöglichen. - Mit feinen Zangen und Scheren die Fruchtmembran von der fetalen Oberfläche der Plazenta entfernen und dabei darauf achten, die Nabelschnur zu vermeiden.
- Die Nabelschnur entwirren und ligieren, um den fetalen Pup zu trennen.
- Identifizieren Sie die Nabelarterie (dickes Gefäß) und die Venene (dünneres Gefäß). Markieren Sie die Nabelvene zur einfachen Identifikation, indem Sie sie etwas kürzer schneiden als die Nabelarterie.
- Die Nabelarterie und die Ader sanft voneinander trennen.
- Die gesamte Plazenta-Einheit mit der Gebärmuttervaskulatur, Gebärmuttermuskel, Plazenta und Nabelschnur kann geschnitten und entfernt werden.
4. Placentale Perfusion
- Halten Sie anatomische Blutflüsse mit der richtigen Distal-proximalen Orientierung der Gebärmutterarterie, legen Sie die Plazenta-Einheit (bestehend aus der Gebärmuttervaskulatur, Gebärmuttermuskel, Plazenta, und Nabelschnur) in die modifizierte isolierte Gefäßkammer gefüllt Mit warmem, sauerstoffhaltigen PSS.
- Mit einem Paar feiner Zange in jeder Hand, kanulieren die proximalen und distalen Enden der Gebärmutterarterie auf die Glasmikropipetten.
- Die Gebärmutterarterie mit der sterilen Nylonnahmen-Krawatte, die zuvor auf der Mikropipette befestigt war, fest sichern.
NOTE: Zwei-Krawatte-Schleifen (Knoten) können notwendig sein; Eine einzige Krawattenschleife ermöglicht jedoch eine größere Einstellung. - Die Nabelarterie (fettisch-mütterlicher Blutfluss) auf die 23 G (größere) Nadel kanieren und mit schwarzer geflochtener Seidennaht sichern.
- Die Nabelvene (mütterlich-fetaler Blutfluss) auf die 25 G (kleinere) stumpfe Nadel kanieren und mit schwarzer geflochtener Seidennaht sichern.
- Bewegen Sie sich zur Plazenta-Perfusionsstation und füllen Sie alle Stopfhosen und Schläuche, um Luftblasen zu verhindern. Schließen Sie alle Schläuche nach Abbildung 2 an .
- Platzieren Sie kleine Wiegeboote unter die distale Kanülanose der mütterlichen Gebärmutterarterie und die Nadelkanüle der fetalen Nabelvene, um das Abwasser zu fangen, das während des Eingriffs entstehen wird.
- Schalten Sie die peristaltische Pumpe, den Druckregler und den Druckmonitor ein und öffnen Sie den Stophahn, um den Flüssigkeitsfluss durch den Schlauch in Richtung Druckwandler zu ermöglichen, aber noch nicht auf die Plazenta. Erhöhen Sie den Druck langsam auf 80 mm Hg.
- Langsam drehen Sie den Stopcock auf die Plazenta, um sich zu öffnen und auf Lecks in der Kammer und um die Krawatten zu schauen.
Hinweis: Wenn die peristaltische Pumpe mit hoher Geschwindigkeit läuft, bewerten Sie die proximale Gebärmutterkanüte und Krawatten für Flüssigkeitslecks neu. Wenn sie identifiziert werden, müssen Lecks behoben werden. Beachten Sie auch, dass der durchschnittliche Gebärmutterarteriendruck konstant bleibt (auf 80 mmHg eingestellt), aber die Strömungsgeschwindigkeit kann je nach Gefäß-und Plazenta-physiologischen Reaktionen variabel sein. Die Quantifizierung des Flüssigkeitsflusses kann als experimentelle Variable als Reaktion auf die xenobiotische Exposition identifiziert werden. - Drehen Sie den Stophahn, um Flüssigkeit in die Nabelarterie fließen zu lassen. Stellen Sie den Druck auf etwa 50 mmHg, der mit einer Peristaltikpumpe (Abbildung3) oder einer hydrostatischen Säule umgesetzt werden kann.
- Alle Reservoirs (Gebärmutter, Nabelbecher und Superfusat) erfüllen, um das Flüssigkeitsvolumen während des gesamten Experiments zu erhalten.
Hinweis: Sobald die Perfusion eingeleitet wurde und Experimente im Gange sind, können betätigte Welpen, die in der Abschnittsschale verbleiben, auf Lebensfähigkeit hin bewertet werden, indem man die Welpen mit Zangen berührt, um eine neurologische Reaktion zu entlocken. Die Exsanierung der Welpen wird durch die Hysterektomie des Gebärmutterhorns auftreten; Weitere Sterbehilfe kann durch zugelassene IACUC-Protokolle abgeschlossen werden. In diesem Fall, das Öffnen der Frucht-Sack in der kalten PSS und die Schaffung eines Pneumothorax durch Schneiden der Rippen.
5. Mock-Experiment
- Nach der Kanüreulation und der Einleitung der PSS-Perfusion, lassen Sie das Gewebe für 30 Minuten ausgleichen, damit die Vaskulatur auf den neuen Flüssigkeitsfluss eingestellt werden kann. Den Abwasser durch eine Pipette aufsaugen und in einem entsprechend beschrifteten Mikrozentrifugenrohr speichern.
- Nach dem Gleichgleiten die Grundlagendurchblutung durch das Sammeln von Abwässern für 10 min aus beiden Wiegebooten in Mikrozentrifugenröhren und die Messung des Flüssigkeitsvolumens, das durch die Gebärmutterarterie und Nabelvene entsteht.
- Initiieren Sie die Probenentnahme in 10-Minuten-Abständen, indem Sie die Abwässer aus der distalen Gebärmutterarterie und der Nabelvene sammeln. Zum Beispiel eine 900 μL Bolus Dosis von 20 nm rhodamingekennzeichneten Polystyrol-Nanopartikeln (8 x 10 14 particles/mL), die in 0,01% Tensid an die Linie aufgehängt wird, die die Gebärmutterarterie perfektioniert, um den Zeitverlauf von Xenobiotika zu ermitteln. Nanopartikel über die Plazenta-Barriere.
NOTE: Diese Abwasserproben ermöglichen die Messung von Verunreinigungen innerhalb der Flüssigkeit (entweder xenobiotisch, pharmakologisch oder metabolitbar) und sorgen für die Rate des Flüssigkeitsflusses durch die Gebärmutterarterie oder über die Plazenta und in das fetale Fach ( Abbildung 4). - Sammeln Sie nach der Bolusinfusion Proben aus der distalen Gebärmutterarterie und fetalen Nabelvein-Abwässern alle 10 Minuten für insgesamt 180 Minuten nach der Infusion.
6. Reinigung der Geräte
- Nach jedem Experiment die Plazenta-Einheit aus den Pipetten entfernen. Alle Nähte können gespeichert werden, um sie in zukünftigen Experimenten wiederverwenden zu können. Das Plazenta-Gewebe kann für zusätzliche histologische oder mechanistische Untersuchungen gespeichert werden.
- Reinigen Sie alle Schläuche und Kanülen des Perfusion-Systems mit 70% Ethanol, gefolgt von destilliertem Wasser und Vakuumtrocken.
Hinweis: Wenn Schläuche oder Pipetten beginnen, sich zu verfärben oder beschädigt zu erscheinen, ersetzen Sie vor dem nächsten Experiment. Darüber hinaus ersetzen alle Schläuche innerhalb der Kammer, um Kreuzkontamination zu verhindern, nachdem eine experimentelle Kohorte abgeschlossen ist (z.B. alle Studien, die sich auf eine einzelne Verunreinigung beziehen).
Ergebnisse
Abbildung 5 zeigt die Proof-of-Pro-of-Print-Experimente mit Evans blauem Farbstoff, die es uns ermöglichen, das System zu testen und eine entsprechende Flüssigkeits-und Plazenta-Barrierefunktion zu visualisieren und eine Eindämmung in das fetale Fach zu verhindern. Der blaue Farbstoff des Evan erreichte und parierte das Gewebe der Plazenta in diesem System (Abbildung 5A). Bei weiteren Untersuchungen ist klar, dass der blaue Farbstoff des Evan nicht in die fetale Nabelvene (Abbildung 5B) gelangt ist, die erwartet wird, da Evans blauer Farbstoff an Albumin gebunden ist.
Abbildung 6 zeigt die Daten für das in diesem Protokoll beschriebene Mock-Experiment. In jedem 10-minütigen Segment wurden wirksame Proben aus dem distalen Ende der Gebärmutterarterie und der fetalen Nabelvase gemessen, um den Flüssigkeitsfluss im Laufe der Zeit zu bewerten, nachdem die Bolus-Dosis der Gebärmutterarterie der Mutter verabreicht wurde (Abbildung6). Reduzierte Flüssigkeitsübertragung in das fetale Fach innerhalb von 10 Minuten nach der Identifizierung der Polystyrol-Infusion. Um die Übertragung von Polystyrol in das fetale Fach während des Zeitablaufs zu quantifizieren, wurde 25 μL der perfused Flüssigkeit von jedem Zeitpunkt an in eine 96-Brunnenplatte in Duplikat gelegt, um die Probenfluoreszenz zu messen. Die Fluoreszenz wurde durch spektroskopisches Lesen bei 546/575 nm (ex/em) mit einem fluoreszierenden Mikroplattenleser bestimmt. Die Polystyrol-Übertragung in das fetale Fach erfolgte innerhalb von 10 Minuten und erreichte ihren Höhepunkt bei 20 Minuten und setzte sich 90 Minuten fort (Abbildung 6B).
Für die Histopathologie und morphologische Beurteilungen wurde eine Untergruppe von parviteten Plazenta-Geweben gespeichert. Das Gewebe wurde formalin-fixiert und Hämatoxylin und Eosin wurden von einem geprüften Tierpathologen der Kammer untersucht. Diese Experten identifizierten keine strukturellen Anomalien in Placentas, die nur von PSS oder PSS mit der Bolus-Dosis von Rhodamin-beschriftetem Polystyrol verwendet wurden.

Abbildung 1: Die modifizierte Einzelgefäßkammer. (A) Eine Übersicht über die modifizierte Kammer. (B) Ein Nahaufnahmebild der in der Gefäßkammer befesgten Blunkupfnadeln. Der rote Pfeil zeigt den Thermistor-Clip an, der geändert wurde, um die Nadeln für die Nabelkanüscherung an Ort und Stelle zu halten. C) Ein repräsentatives Bild der vier Kanülen, die für die Gewebekanüulation vorbereitet wurden. Rote Pfeile weisen auf jede der vier Kanülen hin. Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.

Abbildung 2: Ein genauerer Blick auf die plakative Perfusionskammer. (A) Dies stellt den Schlauchübergang dar, der am Druckwandler befestigt ist, und kanierte die proximale Mutterärterärterarterie, oder den "Zufluss." Der Druck wird auf konstante 80 mmHg eingestellt, wie sie in der Literatur definiert werden. B) Dies stellt den Kammerabflussport des Superfusats dar, der das Plazenta-Gewebe während der Perfusion umgibt. C) Dies stellt den Kammerzufluss des Superfusats dar, um die Plazenta mit erwärmtem PSS während der Perfusion zu baden. (D) Dies stellt den distalen uterinen Mutterhütterport dar, in dem Abwässer aus der Gebärmutterperfusion gesammelt werden können. E) Dies stellt den Temperaturanschluss dar, in dem die Gefäßkammer an einem Thermometer und einer Heizung befestigt werden kann, um während des gesamten Experiments eine gleichbleibende Temperatur zu erhalten. F) Dies stellt die Nabelarterie Kanulation dar. Die Nabelarterie wird auf 50 mmHg gedrückt, um einen Gegenstromfluss auf der Ebene der Plazenta zu ermöglichen. G) Dies stellt die Nabelvein-Abwassersammlung dar. Flüssigkeit, die während der Perfusion in Richtung des fetalen Faches fließt, wird hier gesammelt. (H) Dies ist das Zentrum des Perfusionssystems, wo die Plazenta kanoniert wird und während der gesamten Perfusion aufrechterhalten wird. Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.

Bild 3: Ein Blick auf das Plazenta-Perfusionssystem. (A und B) Das Druckkontrollsystem, das zur Überwachung und Aufrechterhaltung von 80 mmHg Parfümierung durch Gebärmutterarterie verwendet wird. C) Dies stellt die Thermomtherverordnung der Perfusionskammer dar. (D) Mikroskop. (E) Durchblutungskammer. (F) Nabelarterie mit Schwerelosionsdurchblutung auf 50 mmHg. G) Eine peristaltische Pumpe, die zum Befüllen und Ableiten von Plazenta-Superfusate PSS verwendet wird. Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.
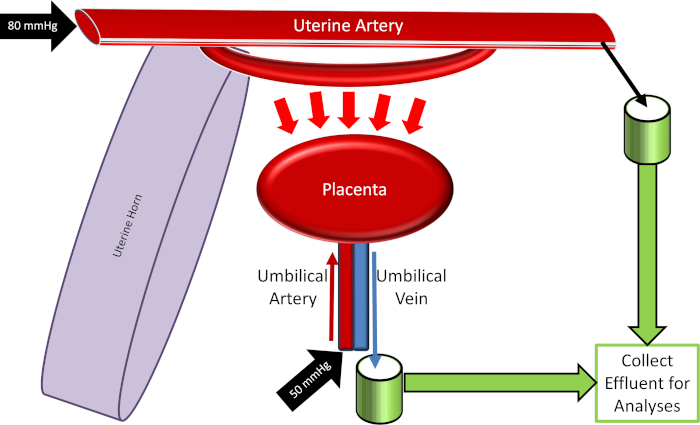
Abbildung 4: Schematik des plakativen Perfusionssystems. Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.
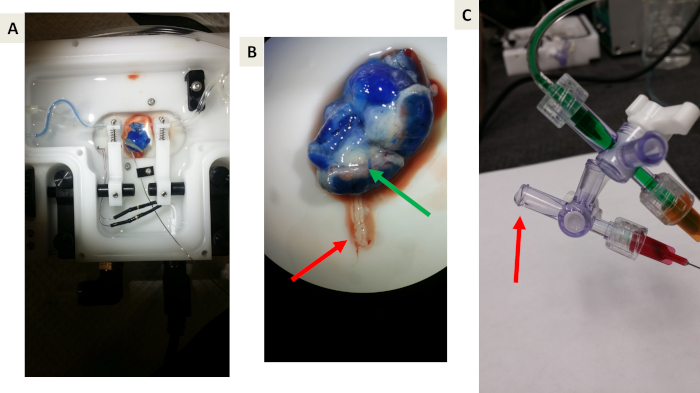
Abbildung 5: Repräsentative Bilder von Proof-of-Pro-of-Print-Experimenten mit Evans blauem Farbstoff. (A und B) Grundsatzangabe, dass Evans Blau die Gebärmuttervaskulatur, Gebärmuttermuskulatur und Plazenta perfektionieren wird, aber die Plazenta-Barriere nicht durch Albumin-Bindung überschreitet. Der grüne Pfeil zeigt die blaue Venenentwässerung von der Plazenta zurück in den mütterlichen Kreislauf. Der Rote Pfeil zeigt das Nabelvein-Abwasser in Richtung des fetalen Faches. Man beachte den Mangel an blauem Farbstoff. (C) Ein repräsentatives Bild des Sammels von Abwasser aus der Nabelvene. Der rote Pfeil zeigt die Tropfenbildung vor der Sammlung an. Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.
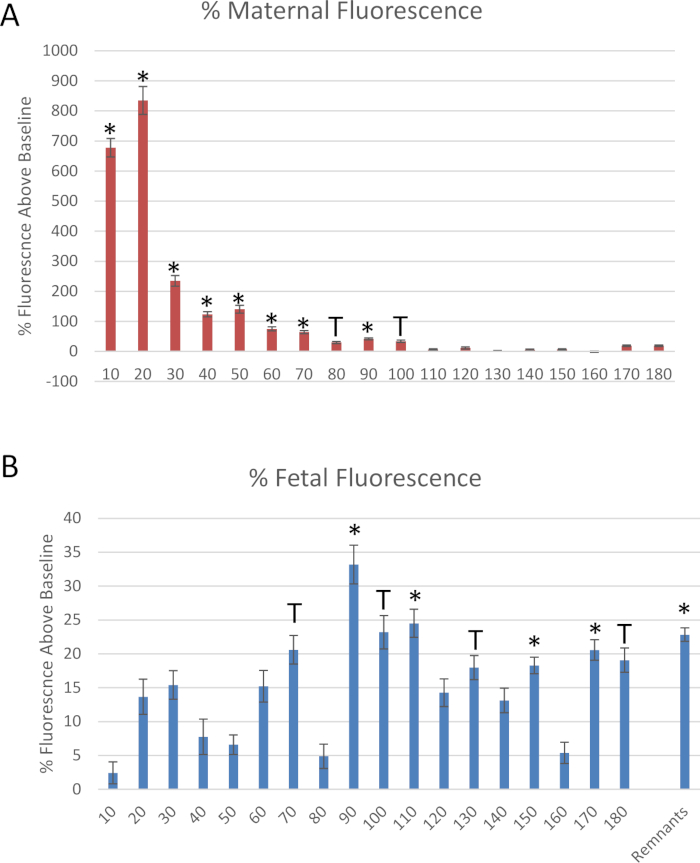
Abbildung 6: Daten aus dem Mock-Experiment. Fluoreszenzmessungen von rhodamingekennzeichneten Polystyrol-Nanomaterialien, die zu Baseloreszenz normalisiert wurden, durch die Sammlung von (A) Gebärmutterarterie und (B) fetalen Nabelvein-Abflüssigkeiten. Mean normalisiert zu Baseline Fluoreszenz ± Standard-Fehler (SE). *: p < 0.05 und T: p < 0.1 durch Varianzanalyse (ANOVA). Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.
Diskussion
Diese Perfusionsmethode ermöglicht eine schnelle Beurteilung der Plazenta-Barriere und der physiologischen Funktion der Gebärmuttervaskulatur und der Trophoblastschicht. Die Konfektions-und Durchblutung der proximalen bis distalen Enden der Gebärmutterarterie der Mutter simuliert die Physiologie des mütterlichen Blutflusses durch dieses Hauptgefäß, das für die Blutung an den sich entwickelnden Fötus verantwortlich ist. Diese Methodik ermöglicht die physiologische Bewertung der isolierten mütterlichen, plazentären und umtriebigen Vaskulatur, und daher können Veränderungen in der Physiologie als Gefäßpathologie identifiziert werden; Die Immun-und neuronalen Innereien werden im Ex-vivo-Verfahren entfernt. Um eine ordnungsgemäße Auswertung zu gewährleisten, ist es daher wichtig, diese Schiffe sorgfältig zu kanülen, um keine Tränen oder Pünktchen in den Gefäßwänden zu erzeugen und Luftblasen zu entfernen. Gasemboli kann Schäden an der Endothelschicht der Vaskulatur verursachen oder Blutgefäße behindern. Durch die Aufrechterhaltung der Gefäßverbindungen zwischen Gebärmutter, Plazenta und Fötus während der Trennung kann die Beurteilung von Flüssigkeit und Translokation zum Fötus beobachtet werden. Mit der Verabreichung eines xenobiotischen, in diesem Fall 20 nm Polystyrol, kann die Kinetik bis zum distalen Ende der Gebärmutterarterie und durch die Plazenta zum fetalen Fach durch eine Analyse von Abwässern über einen Zeitverlauf von 180 Minuten ausgewertet werden.
Während in diesem Artikel ein Dual-Perfusionsmodell beschrieben und die Übertragung von Partikeln und Flüssigkeit aus dem Mutter-in das Fetalfach überwacht wurde, können auch umgekehrt vom Fetal-zum mütterlichen Fach beurteilungen vorgenommen werden. Eine Einschränkung der hier beschriebenen Methode ist, dass die distale Gebärmuttervene nicht kanalisiert oder gesampelt wurde. In zukünftigen Studien, insbesondere solche, die sich auf die fetal-mütterliche Übertragung konzentrieren, wird es wichtig sein, das distale Gebärmuttergefäß zu kanulieren und zu proben. Die Abwässer, die aus diesem Scheinversuch entnommen wurden, wurden verwendet, um den fremdebiotischen Transfer zu bewerten; Es kann jedoch eine Vielzahl von Beurteilungen zu endokrinen und molekularen Plazenta-Funktionen oder fetaler Ernährung durchgeführt werden.
Die Stärken dieses Protokolls überwiegen bei weitem seine geringfügigen Einschränkungen. Das Präparat bewahrt die physiologische Struktur und Integrität eines ganzen Organs, um experimentelle Bedingungen zu beurteilen. Ex vivo Plazentale Perfusion ist eine wissenschaftliche Weiterentwicklung von zellularhaltigen In-vitro-basierten zu einer ganzen tierischen Exposition, um die reproduktive Risikobewertung richtig zu bestimmen. Dies kann als eine wertvolle Technik für Studien angesehen werden, die die Plazenta-Pharmazie, Pharmakokinetik, Toxikologie, Physiologie und mütterlich-fetale Medizin bewerten.
Offenlegungen
Die Autoren haben nichts zu offenbaren.
Danksagungen
Diese Arbeit wurde unterstützt vom Nationalen Institut für Umweltgesundheitswissenschaften (R00-ES024783), dem Rutgers Center for Environmental Exposures and Disease (P30-ES005022) und dem Rutgers Joint Graduate Program in Toxicology (T32-ES007148). Wir bedanken uns auch bei Dr. Michael Goedken, Marianne Polunas und Pedro Louro für die technische Expertise und Dr. Adam Goodwill für die Unterstützung bei der Gestaltung unseres Perfusionsschemas (Abbildung5).
Materialien
| Name | Company | Catalog Number | Comments |
| Black braided silk non-absorbable surgical suture non-sterile | Surgical Specialties Look | AACO805 | |
| Fine forceps | FST by Dumont Switzerland | 11252-20 | |
| Fine scissors | FST by Dumont Switzerland | 14060-10 | |
| Glass cannula pack | Living Systems Instrumentation (LSI) | GCP-75-100 | |
| Microcentrifuge Tubes 2.0mL polypropylene graduated tube with locking lid MIXED | Fisherbrand | 02-681-299 | |
| Non-serrated fine curved micro serrefine clamps | InterFocus | 18052-03 | |
| Perfusate pump | ISMATEC | ISM795C | |
| Pressure monitor | Living Systems Instrumentation (LSI) | Mode PM-4 | |
| Self-heating single vessel chamber | Living Systems Instrumentation (LSI) | CH-1 | |
| Servo Pump | Living Systems Instrumentation (LSI) | ModelPS-200-P | |
| Stainless steel blunt needle 23 gauge | Component Supply Co. | 04651-01 | |
| Stainless steel blunt needle 25 gauge | Component Supply Co. | 07116-01 | |
| STERILE Nylon Suture | AROSurgical Instruments Corporation | T04A00N07-13 | |
| Stopcock | Sedation Resource | 6-205-04 | |
| Temperature Controller | Living Systems Instrumentation (LSI) | Model TC-09S |
Referenzen
- Troen, P., Gordon, E. E. Perfusion studies of the human placenta. I. Effect of estradiol and human chorionic gonadotropin on citric acid metabolism. Journal of Clinical Investigation. 37, 1516-1523 (1958).
- Alexander, D. P., Huggett, A. S., Nixon, D. A., Widdas, W. F. The placental transfer of sugars in the sheep: the influence of concentration gradient upon the rates of hexose formation as shown in umbilical perfusion of the placenta. Journal of Physiology. 129, 367-383 (1955).
- Alexander, D. P., Andrews, R. D., Huggett, A. S., Nixon, D. A., Widdas, W. F. The placental transfer of sugars in the sheep: studies with radioactive sugar. Journal of Physiology. 129, 352-366 (1955).
- Dancis, J., Money, W. L. Transfer of sodium and iodo-antipyrine across guinea pig placenta with an in situ perfusion technique. American Journal of Obstetrics and Gynecology. 80, 215-220 (1960).
- London, W. T., Money, W. L., Rawson, R. W. Placental Transport of I-131-Labeled Thyroxine and Triiodothyronine in the Guinea Pig. Endocrinology. 73, 205-209 (1963).
- Stulc, J., Stulcova, B., Svihovec, J. Transport of calcium across the dually perfused placenta of the rat. Journal of Physiology. 420, 295-311 (1990).
- Goeden, N., Bonnin, A. Ex vivo perfusion of mid-to-late-gestation mouse placenta for maternal-fetal interaction studies during pregnancy. Nature Protocols. 8, 66-74 (2013).
- Bond, H., et al. Artificial perfusion of the fetal circulation of the in situ mouse placenta: methodology and validation. Placenta. 27, (2006).
- Illsley, N. P., Fox, H., Van der Veen, F., Chawner, L., Penfold, P. Human placental ultrastructure after in vitro dual perfusion. Placenta. 6, 23-32 (1985).
- Davis, M. J., Kuo, L., Chilian, W. M., Muller, J. M., Barker, J. H., Anderson, G. L., Menger, M. D. Isolated, Perfused Microvessels. Clinically Applied Microcirculation Research. , 435-456 (1995).
- Butcher, J. T., Goodwill, A. G., Frisbee, J. C. The ex vivo isolated skeletal microvessel preparation for investigation of vascular reactivity. Journal of Visualized Experiments. (62), 3674 (2012).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten