Method Article
Perfusão ex vivo da placenta de roedores
Neste Artigo
Resumo
Aqui é apresentado um protocolo de perfusão vascular materno-fetal ex vivo para possibilitar a administração de um artigo de teste na vasculatura materna e avaliar a transferência placentária de partículas xenobióticas ou agentes farmacológicos, além de alterações na Fisiologia placentária.
Resumo
A placenta é um órgão chave durante a gravidez que serve como uma barreira à exposição xenobióticos fetal e Medeia a troca de nutrientes para o desperdício. Um ensaio é descrito aqui para perfuse uma placenta isolada do rato e avalie o translocação materno-à-fetal de xenobióticos ex vivo. Além disso, a avaliação de processos fisiológicos como o fluxo de fluidos para o feto e o metabolismo placentário pode ser realizada com essa metodologia. Esta técnica é adequada para avaliar a cinética materno-fetal de candidatos farmacêuticos ou contaminantes ambientais. Em contraste com as abordagens alternativas atuais, esta metodologia permite a avaliação da vasculatura materna-fetal isolada, com o comprometimento neural ou imune sistêmico removido, permitindo que quaisquer alterações observadas na função fisiológica sejam atribuíveis a factores locais dentro do tecido isolado.
Introdução
Ao manter a estrutura morfológica e a responsividade fisiológica, a perfusão de órgãos tem sido uma abordagem aceita baseada em sistema ou tecido para análise da função metabólica. Estas técnicas da perfusão permitem o exame ex vivo de respostas intactas do tecido a uma variedade de estímulos farmacológicos e mecânicos. A perfusão da placenta humana foi descrita inicialmente em 1958 para identificar os efeitos hormonais na atividade metabólica do ciclo do ácido cítrico; previamente identificados em homogeneatos teciduais, Troen e Gordon reconheceram a necessidade de esclarecer a atividade endócrina usando uma nova abordagem fisiológica1. Na mesma época, as estratégias de perfusão única (materno-fetal ou fetal-materna) foram descritas em grandes modelos animais2,3 e pequenos4 para compreender a transferência placentária de açúcares, sais e antipirinos. Técnicas in vivo e ex vivo de perfusão dupla (perfusão materna e fetal coordenada) foram descritas para caracterizar ainda mais a transferência placentária utilizando metodologias in vivo5 e ex vivo6, 7,8. Os avanços tecnológicos na microscopia eletrônica de transmissão e varredura permitiram aos pesquisadores verificar a integridade estrutural e funcional dos tecidos placentários humanos após a perfusão9.
Enquanto a perfusão de tecidos placentários humanos e cotiledôneas individuais é mais relevante, o rápido desenvolvimento de agentes farmacológicos e contaminantes ambientais requer o uso de um modelo de perfusão animal para a triagem precoce de xenobióticos transferência através da barreira placentária. Este método placentária da perfusão permite a avaliação da transferência através da barreira placentária usando a placenta mais facilmente atingível e fisiologicamente relevante do rato. Além, o fluxo fluido através da barreira placentária durante um período de tempo depois que uma exposição pode ser avaliada medindo o volume de perfusato que vem da artéria do cordão umbilical. Em virtude de permitir a perfusão placentária das circulações maternas e fetal, esta aproximação do órgão do duplo-fluxo pode ser vantajosa comparada às aproximações in vitro e in vivo atuais. Este método permite a administração de um xenobiótico através do aspecto materno a ser medido a partir de perfusato que emerge através da placenta através da veia umbilical, ou vice-versa. O protocolo aqui apresentado descreverá a transferência de poliestireno de 20 nm (um nanoplástico comum usado em alimentos e produtos médicos) da artéria uterina materna para o compartimento fetal e uma diminuição associada no fluxo de fluido através da placenta para ilustrar o uso desse método em múltiplos ajustes fisiológicos, farmacológicos e toxicológicos para avaliar a transferência placentária, o metabolismo e as alterações fisiológicas que afetam o fluxo materno e/ou fetal.
Protocolo
Todos os procedimentos experimentais foram aprovados pelo Comitê institucional de cuidados e uso de animais da Universidade Rutgers.
1. preparação antes do experimento
Observação: essas etapas podem ser executadas dentro de dias/semanas antes do experimento.
- Modifique a câmara do vaso.
Nota: a Figura 1a, B mostra a câmara de vaso único modificada.- Mova o sensor de termistor de baixo do clipe e dobre-o para que ele pendure livremente no banho de perfusão (Figura 1b).
- Instale duas agulhas de aço inoxidável Blunt-Tip de 4 polegadas com os cubos padrão da conexão do luer, 1 25 g e 1 23 g fixados abaixo do grampo do termistor e adicione um torneira de 3 vias para permitir o canulação da vasculatura do cordão umbilical (Figura 1b).
Nota: as conexões do luer de tamanhos diferentes do calibre são cor codificadas. Isso facilita a fácil identificação dos vasos durante e após o experimento.
- Instale dois micropipettes de vidro de 70 − 100 μm. Para obter mais informações sobre esses procedimentos, revise as seguintes referências10,11.
Nota: o diâmetro da ponta comumente utilizado nestes experimentos está na faixa de 70 − 100 μm. os diâmetros da ponta maiores do que esta escala podem adicionar a dificuldade ao processo do canulação quando os diâmetros da ponta menores do que 60 μm podem perfurar a parede vascular durante o canulação. - Prepare laços da sutura de nylon estéril (para extremidades proximal e longe do ponto de origem da artéria uterine) e da sutura não-estéril de seda trançada preta (para os vasos do cordão umbilical). Faça laços únicos por sutura looping como para iniciar um nó quadrado ou amarrar um sapato, como descrito anteriormente11.
Nota: as únicas gravatas são feitas geralmente e mantidas em uma placa de Petri enchida com uma camada pequena de borracha de silicone para ajudar a trabalhar em um fundo pegajoso. - Preparar 2 L de solução salina fisiológica (PSS) contendo, em mmol/L, 129,8 NaCl, 5,4 KCl, 0,5 NaH2po4, 0,83 MgSO4, 19 NaHCO3, 1,8 CAcl2e 5,5 glicose. Ajuste o pH para 7,40 ± 0, 2 Adicionando lentamente algumas gotas de ácido (1 M de ácido clorídrico) ou base (1 N hidróxido de sódio) à solução e aguarde pelo menos 20 s antes de ler a medição de pH ajustada. Armazene o PSS até estar pronto para uso na geladeira para reduzir a contaminação, mas não armazene por mais de 2 semanas.
- Tubos de microcentrífuga de etiquetas para coleta de efluentes "maternos" e "fetais" em cada ponto de tempo, ou seja, "MBaseline, M10, M20,..." até o ponto de tempo de 180 min. Prepare o mesmo para efluentes fetais (FBaseline, M10, M20,....).
- Calibrar todos os equipamentos utilizados no sistema, incluindo a temperatura do banho circulante e os monitores de pressão arterial associados à manutenção das pressões uterinas (80 mmHg) e do cordão umbilical (50 mmHg).
- Prepare uma câmara de dissecção (4 "de diâmetro x 1" de profundidade) ou um prato aquecedor circulante preenchendo uma camada (< 0,25 ") de borracha de silicone. Esta modificação deve ser feita adiantado e como tomará 12 − 24 h para que a borracha seque.
Nota: o uso de um aquecedor de recirculação/prato de refrigeração é recomendado para cirurgiões novatos, como o prato não se moverá e o tecido manterá uma temperatura consistente.
2. preparação da estação cirúrgica e equilibração do equipamento
- Ligue todos os equipamentos que suportam o sistema de perfusão para verificar a função adequada. Retire o PSS da refrigeração e aqueça à temperatura ambiente. O PSS será usado como um perfusato e um superfusate.
- Coloc uma pedra borbulhando pequena para entregar uma mistura do gás no reservatório do superfusate. As misturas comumente usadas incluem 21% O2,3% o 2,3% o2e 0% o2. Ligue o gás para fornecer pequenas bolhas para a solução superfusate. Ajuste a entrega do gás para evitar espirrar.
- Organize a estação de dissecação de animais, verificando o anestésico, organizando equipamentos cirúrgicos e preparando laços de sutura. Prepare a câmara de dissecação coletando os pinos de dissecação, girando sobre o refrigerador (ou recuperando o gelo), e enchendo a câmara de dissecação (alinhada com o silicone de borracha) com PSS frio.
- Encha delicadamente todas as câmaras, agulhas, micropipettes de vidro, tubulação, e reservatórios com o PSS aquecido, observando com cuidado para e eliminando bolhas de ar aspiração os para fora com uma pipeta fina da transferência da ponta. Gire todos os stopcocks de 3 vias com "off" voltado para a direção da pipeta para fixar o fluido dentro da pipeta.
- Coloque um único empate em cada uma das duas Micropipetas de vidro preparadas para canulação uterina e nas duas agulhas de pontas sem corte designadas para canulação umbilical. Fixe os laços com as pipetas e as agulhas de pontas sem corte para evitar perdas durante os movimentos das câmaras (Figura 1C).
3. colheita placental
- Anestesiam um rato fêmea grávido no dia gestational 20 com o isoflurano de 5% por aproximadamente 4 minutos ou até que o animal apresente a respiração trabalhada. Mova o animal para o cone do nariz e administre 2,5% − 3% de isoflurano para manter a anestesia. Confirme a inconsciência por uma falta de reflexo de pitada de dedo do pé.
Nota: o uso de um rato no dia gestacional 20 é apresentado neste protocolo. No entanto, o protocolo permanece o mesmo se as condições experimentais exigirem que a avaliação placentária ocorra precocemente na gestação. - Identifique e isole o chifre uterine (direito ou esquerdo) da escolha levantando para fora e espalhando para fora longo-maneiras fora da carcaça do rato. Usando uma sutura de seda trançada, amarre a artéria uterina na extremidade do ovário e na extremidade vaginal do chifre. Inclua o ovário dentro da sutura com o chifre uterine.
- Usando tesouras cirúrgicas, extirpar afastado o chifre uterine fazendo cortes no lado proximal do laço do ovário e do lado longe do ponto de origem do laço vaginal, deixando o chifre uterine amarrado fora com as suturas em ambas as extremidades. Transfira o chifre uterine no prato de dissecação alinhado com a borracha de silicone e enchido com o PSS frio (de 4 ° c). Independentemente de se escolher a buzina direita ou esquerda, mantenha esse mesmo lado para seleção em cada experimento para consistência.
Nota: para a anestesia fetal, filhotes são mantidos em gelo-frio PSS. Conseqüentemente, a temperatura de PSS dentro da câmara de dissecação é mantida pelo banho de circulação refrigerados ou a câmara de dissecação deve ser mantida no gelo.
Nota: neste ponto a represa anestesiada pode ser eutanalizada por aprovação do protocolo IACUC de laboratório. Neste caso, a eutanásia ocorre através de pneumotórax (cortando o diafragma) e remoção do coração materno. - Empurre delicadamente um pino de dissecação através do chifre uterine na borracha de silicone, com o lado do ovário à esquerda e ao lado vaginal à direita para visualizar o vasculature uterine. Isso estabilizará o útero e evitará o movimento do tecido durante a dissecção do compartimento fetal. Selecione uma unidade materno-placenta-fetal central ao chifre e ligadura a artéria e a veia uterine com tesouras cirúrgicas. Corte o músculo uterino proximal e distal à placenta e ao feto selecionados. O músculo uterino pode ser retraído puxando-o para o lado; é importante deixá-lo intacto, mas afastá-lo de cobrir o filhote fetal.
Nota: a seleção da unidade materno-placenta-fetal deve basear-se no comprimento do segmento da artéria uterina em ambos os lados da artéria arcubada. Segmentos mais longos permitirão canulação mais bem-sucedida. - Usando pinças finas e tesouras, retire a membrana amniótica da superfície fetal da placenta, tendo o cuidado de evitar o cordão umbilical.
- Desvendar e ligadura o cordão umbilical para separar o filhote fetal.
- Identifique a artéria umbilical (vaso mais espesso) e a veia (vaso mais fino). Marque a veia umbilical para fácil identificação cortando-a ligeiramente mais curta do que a artéria umbilical.
- Separe suavemente a artéria umbilical e a veia um do outro.
- Toda a unidade placentária, incluindo a vasculatura uterina, o músculo uterino, a placenta e o cordão umbilical, podem ser cortadas e removidas.
4. perfusão placentária
- Manter a circulação sanguínea anatômica que retém a orientação distal-à-proximal correta da artéria uterine, coloc a unidade placentária (compor do vasculature uterine, do músculo uterine, da placenta, e do cabo de cordão umbilical) na câmara isolada modificada do vaso enchida com PSS quente e oxigenado.
- Usando um par de fórceps fino em cada mão, canular as extremidades proximal e longe do ponto de origem da artéria uterine nas micropipettes de vidro.
- Fixe firmemente a artéria uterine usando o laço de sutura de nylon estéril fixado previamente na micropipeta.
Nota: os laços do dois-laço (nó) podem ser necessários; Entretanto, um único laço do laço permite um ajuste mais grande. - Cannulate a artéria do cordão umbilical (fluxo fetal-à-materno do sangue) na agulha de 23 G (maior) e prenda-a com a sutura de seda trançada preta.
- Cannulate a veia do cordão umbilical (fluxo de sangue materno-à-fetal) na agulha Blunt de 25 G (menor) e prenda-a com a sutura de seda trançada preta.
- Mova-se para a estação de perfusão placentária e preencha todos os stopcocks e Tubings para evitar bolhas de ar. Conecte todos os Tubings de acordo com a Figura 2.
- Coloc os barcos de peso pequenos o canulação longe do ponto de origem da artéria uterine materna e a canulação da agulha da veia de cordão umbilical fetal para travar o efluente que emergirá durante o procedimento.
- Gire sobre a bomba peristáltica, o controlador de pressão, e o monitor da pressão e abra o torneira para permitir o fluxo fluido através da tubulação para o transdutor de pressão, mas não ainda à placenta. Aumente lentamente a pressão para 80 mm Hg.
- Gire lentamente o torneira à placenta para abrir e prestar atenção para fugas dentro da câmara e em torno dos laços.
Nota: se a bomba peristáltica estiver a funcionar a alta velocidade, reavalie a canulação uterina proximal e os laços para fugas de fluido. Se identificado, os vazamentos devem ser remediados. Observe também, enquanto a pressão média da artéria uterina permanecerá constante (definida para 80 mmHg), a vazão do fluido pode ser variável dependendo das respostas fisiológicas vasculares e placentárias. A quantificação do fluxo de fluido pode ser identificada como uma variável experimental em resposta à exposição xenobiótica. - Gire o torneira para permitir o fluxo fluido na artéria do cordão umbilical. Definir a pressão para aproximadamente 50 mmHg, que pode ser implementado com uma bomba peristáltica (Figura 3) ou uma coluna hidrostática.
- Reabasteça todos os reservatórios (uterino, umbilical e superfusato) para manter o volume de fluido durante todo o experimento.
Nota: uma vez iniciada a perfusão e o experimento está em andamento, os filhotes anestesiados que permanecem no prato de dissecação podem ser avaliados quanto à viabilidade, tocando os filhotes com fórceps para provocar uma resposta neurológica. A exsanguação dos filhotes ocorrerá por meio da histerectomia do chifre uterino; a eutanásia mais adicional pode ser terminada através dos protocolos aprovados de IACUC. Neste caso, abrindo o saco amniótico no PSS frio e criando um pneumotórax cortando as costelas.
5. experimento simulado
- Após a canulação e a iniciação da perfusão de PSS, deixe os tecidos equilibram por 30 minutos para permitir que o vasculatura ajuste ao fluxo fluido novo. Sucção até o efluente por uma pipeta e salvá-lo em um tubo de microcentrífuga correspondentemente rotulado.
- Após a equilibração, estabelecer a perfusão basal através da coleta de efluentes por 10 min de ambos os barcos de pesagem em tubos de microcentrífuga e medindo o volume de fluido que emerge através da artéria uterina e da veia umbilical.
- Iniciar a coleta da amostra em intervalos de 10 minutos coletando-se os efluentes da artéria uterina distal e da veia umbilical. Por exemplo, administrar uma dose de 900 μL de bolus de 20 nm de nanopartículas de poliestireno com rótulo de rhodamina (8 x 1014 partículas/ml) suspenso em 0, 1% surfactante para a linha perfusing a artéria uterina para identificar a passagem do curso de tempo de xenobiótico nanopartículas através da barreira placentária.
Nota: estas amostras de efluente permitirão a medição de contaminantes dentro do fluido (tanto xenobiótico, farmacológico ou metabólito) e fornecer a taxa de fluxo de fluido através da artéria uterina ou através da placenta e para o compartimento fetal ( Figura 4). - Após a infusão de bolus, coletar amostras da artéria uterina distal e efluente da veia umbilical fetal a cada 10 min para um total de 180 min após a infusão.
6. limpeza do equipamento
- Após cada experimento, retire a unidade placentária das pipetas. Todas as suturas podem ser salvas para serem reutilizadas em experimentos futuros. O tecido placentário pode ser guardado para estudos histológicos ou mecanísticos adicionais.
- Limpe todos os Tubings e cânulas do sistema de perfusão com 70% de etanol seguido de água destilada e vácuo seco.
Nota: se Tubings ou pipetas começarem a descolorir ou aparecerem danificados, substitua antes do próximo experimento. Além disso, após a conclusão de uma coorte experimental (por exemplo, todos os estudos pertencentes a um único contaminante), substitua todos os Tubings dentro da câmara para evitar a contaminação cruzada.
Resultados
A Figura 5 mostra os experimentos de prova de princípio usando o corante azul de Evan, o que nos permite testar o sistema e visualizar a função de barreira fluida e placentária apropriada e evitar a transferência de contenção para o compartimento fetal. O corante azul de Evan atingiu e perfundidos o tecido da placenta dentro deste sistema (Figura 5a). Após a investigação, é evidente que o corante azul de Evan não entra na veia umbilical fetal (Figura 5b), o que é esperado como corante azul de Evan está ligado à albumina.
A Figura 6 mostra os dados para o experimento simulado descrito neste protocolo. Amostras de efluente da extremidade distal da artéria uterina e da veia umbilical fetal foram mensuradas em cada segmento de 10 minutos para avaliar o fluxo de fluido ao longo do tempo após a administração da dose de bolus na artéria uterina materna (Figura 6). Transferência fluida reduzida ao compartimento fetal dentro de 10 minutos depois que a infusão do poliestireno foi identificada. Para quantificar a transferência de poliestireno para o compartimento fetal durante o tempo de curso, quando ocorre, 25 μL do fluido perfundidos de cada ponto de tempo foi colocado em uma placa de 96 poços em duplicado para medir a fluorescência da amostra. A fluorescência foi determinada por leitura espectroscópica a 546/575 nm (ex/em) usando um leitor de microplacas fluorescentes. A transferência de poliestireno para o compartimento fetal ocorreu dentro de 10 minutos e atingiu o pico em 20 minutos e continuou por 90 minutos (Figura 6B).
Um subconjunto de tecidos placentária perfundidos foi conservado para A histopatologia e as avaliações morfológicas. Os tecidos eram formalin-fixos e hematoxilina e eosina manchados e revistos por um patologista veterinário certificado placa. Estes peritos não identificaram nenhuma anomalia estrutural nas placentas perfundidos por somente PSS, ou PSS com a dose do bolus do poliestireno RHODAMINE-etiquetado.

Figura 1: a câmara de vaso único modificada. (A) uma visão geral da câmara modificada. (B) uma imagem do close-up das agulhas Blunt-Tip fixadas dentro da câmara do vaso. A seta vermelha indica o grampo do termistor que foi alterado para prender as agulhas no lugar para o cannulation do cordão umbilical. (C) uma imagem representativa das quatro cânulas preparadas para a canulação tecidual. As setas vermelhas apontam para cada uma das quatro cânulas. Por favor clique aqui para ver uma versão maior desta figura.

Figura 2: uma visão mais próxima da câmara de perfusão placentária. (A) isto representa a tubulação acoplada ao transdutor de pressão e canulados a artéria uterine materna proximal, ou o "Inflow". A pressão é ajustada a uma constante 80 mmHg como definido pela literatura. (B) isto representa a porta de dreno da câmara do superfusate que circunda o tecido placentária durante a perfusão. (C) isto representa o entrada da câmara do superfusate para banhar a placenta com o PSS aquecido durante a perfusão. (D) isto representa o porto uterine materno longe do ponto de origem onde o efluente da perfusão uterine pode ser coletado. (E) isto representa o porto da temperatura, onde a câmara do vaso pode ser unida a um termômetro e a um calefator para manter uma temperatura consistente durante todo o experimento. (F) isto representa o cannulation da artéria do cordão umbilical. A artéria umbilical é pressurizada a 50 mmHg para permitir o fluxo da contratual ao nível da placenta. (G) isso representa a coleta de efluente da veia umbilical. O fluido que flui em direção ao compartimento fetal durante a perfusão será coletado aqui. (H) este é o centro do sistema de perfusão, onde a placenta é canulada e mantida ao longo da perfusão. Por favor clique aqui para ver uma versão maior desta figura.

Figura 3: uma visão do sistema de perfusão placentária. ( A e B) o sistema de controle de pressão utilizado para monitorar e manter 80 mmHg de perfusato através da artéria uterina. (C) isso representa a termoregulação da câmara de perfusão. (D) microscópio. E) câmara de perfusão. (F) perfusão de artéria umbilical alimentada por gravidade definida em 50 mmHg. (G) uma bomba peristáltica usada para encher e drenar o superfusate placentária PSS. Por favor clique aqui para ver uma versão maior desta figura.
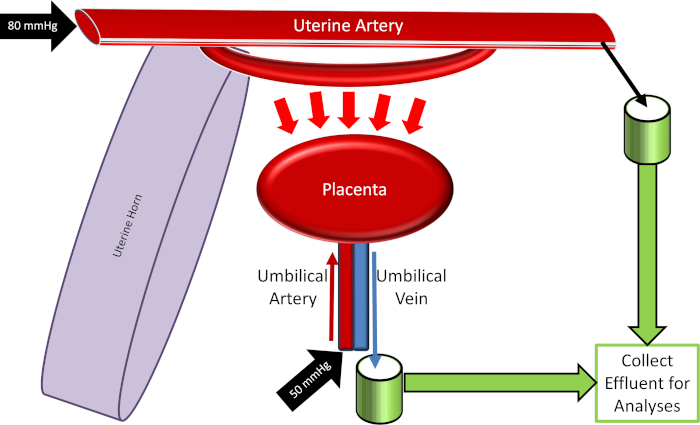
Figura 4: esquema do sistema de perfusão placentária. Por favor clique aqui para ver uma versão maior desta figura.
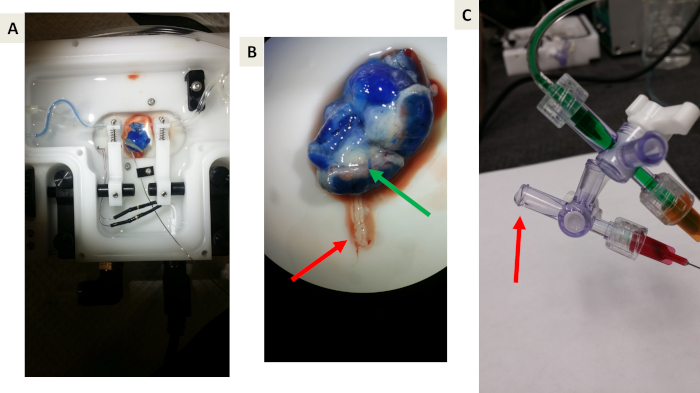
Figura 5: imagens representativas de experimentos de prova de princípio usando o corante azul de Evan. (A e B) prova-de-princípio que o azul de Evan perfuse o vasculature uterine, o músculo uterine, e a placenta mas não atravessará a barreira placentária devido à ligação da albumina. A seta verde indica a drenagem venosa azul da placenta de volta à circulação materna. A seta vermelha indica o efluente da veia umbilical em direção ao compartimento fetal. Observe a falta de corante azul. (C) uma imagem representativa de coleta de efluente drenante da veia umbilical. A seta vermelha indica a formação de queda antes da coleta. Por favor clique aqui para ver uma versão maior desta figura.
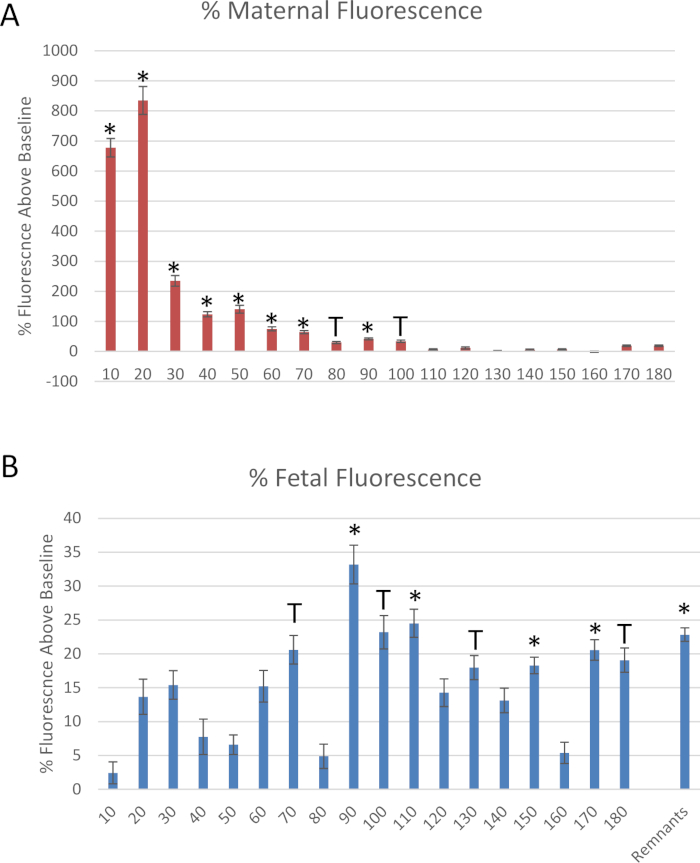
Figura 6: dados derivados do experimento simulado. Medições de fluorescência de nanomateriais de poliestireno rotulados com rodamina, normalizadas para fluorescência basal, através da coleta de (a) artéria uterina e (B) efluentes da veia umbilical fetal. Média normalizada para fluorescência basal ± erro padrão (SE). *: p < 0, 5 e T: p < 0,1 via análise de variância (ANOVA). Por favor clique aqui para ver uma versão maior desta figura.
Discussão
Este método da perfusão permite a avaliação rápida da barreira placentária e da função physiological da camada uterine do vasculatura e do trofoblasto. A canulação e a perfusão das extremidades proximal a distal da artéria uterina materna simulam a fisiologia do fluxo sanguíneo materno através desta grande embarcação responsável pelo envio de sangue para o feto em desenvolvimento. Esta metodologia permite a avaliação fisiológica da vasculatura materna, placentária e umbilical isolada e, portanto, alterações na fisiologia podem ser identificadas como patologia vascular; as inervação imunológica e neural são removidas no procedimento ex vivo. Para garantir uma avaliação adequada, é, portanto, fundamental canular estes vasos cuidadosamente para não criar quaisquer lágrimas ou perfurações nas paredes dos vasos, e para remover as bolhas de ar. Os êmbolos de gás podem causar danos à camada endotelial da vasculatura ou obstruir os vasos sanguíneos. Mantendo as conexões vasculares entre o útero, a placenta e o feto durante a dissecção, a avaliação do líquido e do translocação ao feto pode ser observada. Com a administração de um xenobiótico, neste caso o poliestireno de 20 nanômetro, a cinética à extremidade longe do ponto de origem da artéria uterine e através da placenta ao compartimento fetal podem ser avaliados pela análise dos efluentes sobre um curso do tempo de 180 minutos.
Quando um modelo da duplo-perfusão foi descrito e a transferência das partículas e do líquido do compartimento materno ao fetal foi monitorada neste artigo, as avaliações podem igualmente ser feitas no reverso do fetal ao compartimento materno. Uma limitação do método descrito aqui é que a veia uterina distal não foi canulada ou amostrado. Em estudos futuros, especialmente aqueles focados na transferência fetal-para-materna, será importante canular e amostra do vaso uterino distal. Os efluentes retirados deste experimento simulado foram utilizados para avaliar a transferência xenobiótica; no entanto, pode ser realizada uma ampla gama de avaliações relativas a funções endócrinas e placentárias moleculares ou nutrição fetal.
Os pontos fortes deste protocolo superam muito as suas limitações menores. A preparação mantém a estrutura fisiológica e a integridade de um órgão inteiro para avaliar as condições experimentais. A perfusão placentária ex vivo é uma progressão científica da exposição de animais in vitro à base celular para determinar adequadamente a avaliação do risco reprodutivo. Isso pode ser considerado uma técnica valiosa para estudos avaliando a disposição farmacológica da medicina placentária, a farmacocinética, a toxicologia, a fisiologia e a medicina materno-fetal.
Divulgações
Os autores não têm nada a revelar.
Agradecimentos
Este trabalho foi apoiado pelo Instituto Nacional de Ciências da saúde ambiental (r00-ES024783), centro de Rutgers para exposições ambientais e doença (p30-ES005022), e programa de pós-graduação conjunta Rutgers em toxicologia (T32-ES007148). Gostaríamos também de agradecer aos Drs. Michael Goedken, Marianne Polunas, e Pedro Louro por sua expertise técnica e Dr. Adam goodwill por sua ajuda na concepção do nosso esquema de perfusão (Figura 5).
Materiais
| Name | Company | Catalog Number | Comments |
| Black braided silk non-absorbable surgical suture non-sterile | Surgical Specialties Look | AACO805 | |
| Fine forceps | FST by Dumont Switzerland | 11252-20 | |
| Fine scissors | FST by Dumont Switzerland | 14060-10 | |
| Glass cannula pack | Living Systems Instrumentation (LSI) | GCP-75-100 | |
| Microcentrifuge Tubes 2.0mL polypropylene graduated tube with locking lid MIXED | Fisherbrand | 02-681-299 | |
| Non-serrated fine curved micro serrefine clamps | InterFocus | 18052-03 | |
| Perfusate pump | ISMATEC | ISM795C | |
| Pressure monitor | Living Systems Instrumentation (LSI) | Mode PM-4 | |
| Self-heating single vessel chamber | Living Systems Instrumentation (LSI) | CH-1 | |
| Servo Pump | Living Systems Instrumentation (LSI) | ModelPS-200-P | |
| Stainless steel blunt needle 23 gauge | Component Supply Co. | 04651-01 | |
| Stainless steel blunt needle 25 gauge | Component Supply Co. | 07116-01 | |
| STERILE Nylon Suture | AROSurgical Instruments Corporation | T04A00N07-13 | |
| Stopcock | Sedation Resource | 6-205-04 | |
| Temperature Controller | Living Systems Instrumentation (LSI) | Model TC-09S |
Referências
- Troen, P., Gordon, E. E. Perfusion studies of the human placenta. I. Effect of estradiol and human chorionic gonadotropin on citric acid metabolism. Journal of Clinical Investigation. 37, 1516-1523 (1958).
- Alexander, D. P., Huggett, A. S., Nixon, D. A., Widdas, W. F. The placental transfer of sugars in the sheep: the influence of concentration gradient upon the rates of hexose formation as shown in umbilical perfusion of the placenta. Journal of Physiology. 129, 367-383 (1955).
- Alexander, D. P., Andrews, R. D., Huggett, A. S., Nixon, D. A., Widdas, W. F. The placental transfer of sugars in the sheep: studies with radioactive sugar. Journal of Physiology. 129, 352-366 (1955).
- Dancis, J., Money, W. L. Transfer of sodium and iodo-antipyrine across guinea pig placenta with an in situ perfusion technique. American Journal of Obstetrics and Gynecology. 80, 215-220 (1960).
- London, W. T., Money, W. L., Rawson, R. W. Placental Transport of I-131-Labeled Thyroxine and Triiodothyronine in the Guinea Pig. Endocrinology. 73, 205-209 (1963).
- Stulc, J., Stulcova, B., Svihovec, J. Transport of calcium across the dually perfused placenta of the rat. Journal of Physiology. 420, 295-311 (1990).
- Goeden, N., Bonnin, A. Ex vivo perfusion of mid-to-late-gestation mouse placenta for maternal-fetal interaction studies during pregnancy. Nature Protocols. 8, 66-74 (2013).
- Bond, H., et al. Artificial perfusion of the fetal circulation of the in situ mouse placenta: methodology and validation. Placenta. 27, (2006).
- Illsley, N. P., Fox, H., Van der Veen, F., Chawner, L., Penfold, P. Human placental ultrastructure after in vitro dual perfusion. Placenta. 6, 23-32 (1985).
- Davis, M. J., Kuo, L., Chilian, W. M., Muller, J. M., Barker, J. H., Anderson, G. L., Menger, M. D. Isolated, Perfused Microvessels. Clinically Applied Microcirculation Research. , 435-456 (1995).
- Butcher, J. T., Goodwill, A. G., Frisbee, J. C. The ex vivo isolated skeletal microvessel preparation for investigation of vascular reactivity. Journal of Visualized Experiments. (62), 3674 (2012).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados