Method Article
Perfusion ex vivo du placenta de rongeurs
Dans cet article
Résumé
On présente ici un protocole de perfusion vasculaire fœtale ex vivo pour permettre l’administration d’un article d’essai dans la vascularisation maternelle et pour évaluer le transfert placentaire de particules xénobiotiques ou d’agents pharmacologiques en plus des altérations de physiologie placentaire.
Résumé
Le placenta est un organe clé pendant la grossesse qui sert de barrière à l’exposition xénobiotique fœtale et médie l’échange de nutriments pour les déchets. On décrit ici un dosage pour perfuser un placenta isolé de rat et pour évaluer la translocation maternelle à fœtale des xénobiotiques ex vivo. En outre, l’évaluation des processus physiologiques tels que le flux de fluide vers le fœtus et le métabolisme placentaire peut être effectuée avec cette méthodologie. Cette technique est adaptée à l’évaluation de la cinétique maternelle à fœtale des candidats pharmaceutiques ou des contaminants environnementaux. Contrairement aux approches alternatives actuelles, cette méthodologie permet l’évaluation de la vascularisation maternelle-fœtale isolée, avec l’implication systémique neuronale ou immunitaire enlevée, permettant à tous les changements observés dans la fonction physiologique d’être attribuable aux facteurs locaux dans le tissu isolé.
Introduction
En conservant la structure morphologique et la réactivité physiologique, la perfusion d’organe a été une approche acceptée du système ou du tissu pour l’analyse de la fonction métabolique. Ces techniques de perfusion permettent l’examen ex vivo des réponses tissulaires intactes à une variété de stimuli pharmacologiques et mécaniques. La perfusion de placenta humain a été décrite initialement en 1958 pour identifier les effets hormonaux sur l’activité métabolique du cycle de l’acide citrique; ayant déjà été identifiés dans des homotrates tissulaires, Troen et Gordon ont reconnu la nécessité de clarifier l’activité endocrinienne à l’aide d’une nouvelle approche physiologique1. Dans la même période, des stratégies de perfusion unique (maternelle à fœtale ou fœtale à maternelle) ont été décrites dans les grands modèles2,3 et4 petits animaux pour comprendre le transfert placentaire des sucres, des sels et des médicaments antipyrine. On a décrit les techniques in vivo et ex vivo de double perfusion (coordination maternelle et fœtale) pour caractériser davantage le transfert placentaire en utilisant les méthodologies in vivo5 et ex vivo6,7,8 . Les progrès technologiques en microscopie électronique par transmission et par balayage ont permis aux chercheurs de vérifier l’intégrité structurelle et fonctionnelle des tissus placentaires humains après perfusion9.
Bien que la perfusion des tissus placentaires humains et du cotylédon individuel soit la plus pertinente, le développement rapide d’agents pharmacologiques et de contaminants environnementaux nécessite l’utilisation d’un modèle de perfusion animale pour le dépistage précoce des transfert à travers la barrière placentaire. Cette méthode de perfusion placentaire permet l’évaluation du transfert à travers la barrière placentaire à l’aide d’un placenta de rat plus facilement réalisable et physiologiquement pertinent. En outre, le débit de fluide à travers la barrière placentaire sur une période de temps après une exposition peut être évalué en mesurant le volume de perfusat provenant de l’artère ombilicale. En raison de la perfusion placentaire des circulations maternelles et fœtales, cette approche à double flux d’organes entiers peut être avantageuse par rapport aux approches in vitro et in vivo actuelles. Cette méthode permet l’administration d’un xénobiotique par l’aspect maternel à mesurer à partir du perfusat qui émerge à travers le placenta à travers la veine ombilicale, ou inversement. Le protocole présenté ici décrira le transfert du polystyrène de 20 nm (un nanoplastique commun utilisé dans les aliments et les produits médicaux) de l’artère utérine maternelle au compartiment fœtal et une diminution associée du débit de fluide à travers le placenta pour illustrer l’utilisation de cette méthode dans de multiples paramètres physiologiques, pharmacologiques et toxicologiques pour évaluer le transfert placentaire, le métabolisme et les altérations physiologiques affectant le flux maternel et/ou fœtal.
Protocole
Toutes les procédures expérimentales ont été approuvées par le Comité institutionnel de soins et d’utilisation des animaux de l’Université Rutgers.
1. préparation avant l’expérimentation
Remarque: ces étapes peuvent être effectuées dans les jours/semaines précédant l’expérience.
- Modifier la chambre du vaisseau.
Remarque: la figure 1a, B montre la chambre à un seul récipient modifiée.- Déplacez le capteur de thermistance sous le clip et pliez-le de façon à ce qu’il se bloque librement dans le bain de perfusion (figure 1b).
- Installer deux aiguilles en acier inoxydable à pointe arrondie de 4 pouces avec des moyeux de raccordement Luer standard, 1 25 G et 1 23 G fixés sous le clip de thermistance et ajouter un robinet à 3 voies pour permettre la canulation du vascularisation ombilical (figure 1b).
Remarque: les raccords Luer de différentes tailles de jauge sont codés en couleur. Cela facilite l’identification des vaisseaux pendant et après l’expérimentation.
- Installer deux micropipettes de verre de 70 − 100 μM. Pour de plus amples informations sur ces procédures, veuillez consulter les références suivantes10,11.
Remarque: le diamètre de pointe couramment utilisé dans ces expériences est de l’intervalle de 70 − 100 μM. les diamètres de pointes supérieurs à cette plage peuvent ajouter de la difficulté au processus de canulation, tandis que les diamètres de pointes inférieurs à 60 μm peuvent percer la paroi vasculaire pendant la canulation. - Préparez les attaches de suture en nylon stérile (pour les extrémités proximales et distale de l’artère utérine) et de suture non stérile en soie tressée noire (pour les vaisseaux ombilicaux). Faire des attaches uniques par suture en boucle pour initier un nœud carré ou attacher une chaussure, comme décrit précédemment11.
Remarque: les attaches simples sont couramment faites et conservées dans une boîte de Petri remplie d’une petite couche de caoutchouc de silicone pour aider à travailler sur un fond collant. - Préparer 2 L de solution saline physiologique (PSS) contenant, en mmol/L, 129,8 NaCl, 5,4 KCl, 0,5 NaH2po4, 0,83 MgSO4, 19 NaHCO3, 1,8 CaCl2et 5,5 glucose. Ajuster le pH à 7,40 ± 0,02 en ajoutant lentement quelques gouttes d’acide (1 M d’acide chlorhydrique) ou de base (1 N d’hydroxyde de sodium) à la solution et attendre au moins 20 s avant de lire la mesure de pH ajustée. Conservez le PSS jusqu’à ce qu’il soit prêt à être utilisé au réfrigérateur pour réduire la contamination, mais ne stockez pas pendant plus de 2 semaines.
- Étiqueter les tubes de microcentrifugation pour collecter les effluents «maternels» et «fœtales» à chaque point de temps, c.-à-d. «MBaseline, M10, M20,... jusqu’au point de temps de 180 min. Préparer la même chose pour les effluents fœtaux (FBaseline, M10, M20,....).
- Calibrer tous les équipements utilisés dans le système, y compris la température du bain circulatoire et les moniteurs de pression artérielle associés au maintien des pressions de perfusat utérine (80 mmHg) et ombilical (50 mmHg).
- Préparer une chambre de dissection (4 "de diamètre x 1" de profondeur) ou un plat chauffant en remplissant une couche (< 0,25 ") de caoutchouc de silicone. Cette modification doit être faite à l’avance et comme il faudra 12 − 24 h pour que le caoutchouc sèche.
Remarque: l’utilisation d’un appareil de chauffage/réfrigération de recirculation est recommandée pour les chirurgiens novices, car le plat ne bouge pas et le tissu maintiendra une température constante.
2. préparation de la station chirurgicale et équilibration de l’équipement
- Allumez tous les équipements qui supportent le système de perfusion pour vérifier la bonne fonction. Retirer le PSS de la réfrigération et réchauffer à la température ambiante. Le PSS sera utilisé à la fois comme un perfusat et un superfusate.
- Placez une petite pierre bouillonnante pour livrer un mélange gazeux dans le réservoir superfusé. Les mélanges couramment utilisés comprennent 21%o 2,8% o2,3% o2et 0% o2. Allumez le gaz pour fournir de petites bulles à la solution superfusat. Réglez la livraison du gaz pour éviter les éclaboussures.
- Organiser la station de dissection des animaux en vérifiant l’anesthésie, en organisant l’équipement chirurgical et en préparant les attaches de suture. Préparer la chambre de dissection en collectant des goupilles de dissection, en tournant le refroidisseur (ou en récupérant de la glace), et en remplissant la chambre de dissection (doublée de silicone en caoutchouc) avec un PSS froid.
- Remplissez délicatement toutes les chambres, les aiguilles, les micropipettes en verre, les tubes et les réservoirs avec un PSS chauffé, en observant attentivement et en éliminant les bulles d’air en les suctionant avec une pipette de transfert de pointe fine. Tournez tous les robinets à 3 voies avec "OFF" face à la direction de la pipette pour fixer le fluide dans la pipette.
- Placer une seule cravate sur chacune des deux micropipettes en verre préparées pour la canulation utérine et sur les deux aiguilles à pointes émoussées désignées pour la canulation ombilicale. Fixez les attaches aux pipettes et aux aiguilles des pointes émoussées afin d’éviter toute perte pendant les mouvements de la chambre (figure 1c).
3. récolte placentaire
- Anesthésier un rat femelle enceinte le jour gestationnel 20 avec 5% d’isoflurane pendant environ 4 min ou jusqu’à ce que l’animal exhibe une respiration laborieuse. Déplacez l’animal vers le cône nasal et administrez 2,5% − 3% d’isoflurane pour maintenir l’anesthésie. Confirmez l’inconscience par un manque de réflexe de pincement des orteils.
NOTE: l’utilisation d’un rat au jour gestationnel 20 est présentée dans ce protocole. Cependant, le protocole reste le même si les conditions expérimentales exigent que l’évaluation placentaire se déroule plus tôt en gestation. - Identifiez et isolez le cor utérin (à droite ou à gauche) du choix en soulevant et écartant les longues voies à l’extérieur de la carcasse du rat. À l’aide d’une suture en soie tressée, attachez l’artère utérine à l’extrémité de l’ovaire et à l’extrémité vaginale de la corne. Inclure l’ovaire à l’intérieur de la suture avec la corne utérine.
- En utilisant des ciseaux chirurgicaux, on enlève la corne utérine en faisant des coupes sur le côté proximale de la cravate de l’ovaire et du côté distale de la cravate vaginale, laissant la corne utérine attachée avec les sutures sur les deux extrémités. Transférer la corne utérine dans le plat disséquant recouvert de caoutchouc de silicone et rempli de PSS froid (4 ° c). Peu importe si le klaxon droit ou gauche est choisi, maintenez le même côté pour la sélection dans chaque expérience pour la cohérence.
Remarque: pour l’anesthésie fœtale, les chiots sont gardés en PSS froid glacé. Par conséquent, la température de PSS dans la chambre de dissection est maintenue par le bain de circulation réfrigéré ou la chambre de dissection doit être maintenue sur la glace.
NOTE: à ce stade, le barrage anesthésié peut être euthanasié par l’approbation du protocole IACUC de laboratoire. Dans ce cas, l’euthanasie se produit par pneumothorax (en coupant le diaphragme) et l’ablation du coeur maternel. - Poussez doucement une goupille de dissection à travers la corne utérine dans le caoutchouc de silicone, avec le côté ovaire vers la gauche et le côté vaginal vers la droite pour visualiser le vasculature utérin. Cela stabilisera l’utérus et empêchera le mouvement du tissu pendant la dissection du compartiment fœtal. Sélectionnez une unité maternelle-placenta-fœtale au centre de la corne et ligez l’artère utérine et la veine avec des ciseaux chirurgicaux. Coupez le muscle utérin proximale et distal au placenta et au fœtus sélectionnés. Le muscle utérin peut être rétracté en le tirant sur le côté; Il est important de le laisser intact, mais tirez-le loin de couvrir le chiot fœtal.
NOTE: la sélection de l’unité maternelle-placenta-fœtale doit être basée sur la longueur du segment de l’artère utérine de chaque côté de l’artère aréale. Des segments plus longs permettront une canulation plus réussie. - En utilisant des pinces fines et des ciseaux, enlevez la membrane amniotique de la surface fœtale du placenta, en prenant soin d’éviter le cordon ombilical.
- Démêler et Liger le cordon ombilical pour séparer le chiot fœtal.
- Identifiez l’artère ombilicale (récipient plus épais) et la veine (récipient plus mince). Marquez la veine ombilicale pour faciliter l’identification en la coupant légèrement plus courte que l’artère ombilicale.
- Séparer délicatement l’artère ombilicale et la veine les unes des autres.
- La totalité de l’unité placentaire, y compris le vascularisation utérin, le muscle utérin, le placenta et le cordon ombilical, peut être coupée et enlevée.
4. perfusion placentaire
- Maintenir le débit sanguin anatomique en conservant l’orientation distale-proximale correcte de l’artère utérine, placer l’unité placentaire (composée de la vascularisation utérine, du muscle utérin, du placenta et du cordon ombilical) dans la chambre isolée de récipient modifiée remplie avec un PSS chaud et oxygéné.
- À l’aide d’une paire de pinces fines dans chaque main, Cathétériser les extrémités proximale et distale de l’artère utérine sur les micropipettes de verre.
- Fixez fermement l’artère utérine en utilisant l’attache de suture en nylon stérile préalablement fixée sur la micropipette.
Remarque: les boucles à deux attaches (nœud) peuvent être nécessaires; Cependant, une seule boucle de cravate permet un ajustement plus important. - Canuler l’artère ombilicale (flux sanguin fœtal à maternel) sur l’aiguille de 23 G (plus grande) et la fixer avec une suture en soie tressée noire.
- Canule la veine ombilicale (flux sanguin maternel-fœtal) sur l’aiguille arrondie de 25 G (plus petite) et la fixer avec une suture en soie tressée noire.
- Déplacez-vous à la station de perfusion placentaire et Remblayez tous les robinets et les tubages pour éviter les bulles d’air. Raccorder toutes les tubulures selon la figure 2.
- Placer de petits bateaux de pesage sous la canule distale de l’artère utérine maternelle et la canulation de l’aiguille de la veine ombilical fœtale pour attraper l’effluent qui émergera au cours de la procédure.
- Allumez la pompe péristaltique, le régulateur de pression et le tensiomètre et ouvrez le robinet pour permettre le passage du fluide à travers le tube vers le transducteur de pression, mais pas encore au placenta. Augmentez lentement la pression à 80 mm Hg.
- Tournez lentement le robinet vers le placenta pour ouvrir et surveillez les fuites à l’intérieur de la chambre et autour des traverses.
Remarque: si la pompe péristaltique fonctionne à une vitesse élevée, réévaluer la canule utérine proximale et les attaches pour les fuites de liquide. En cas d’identification, les fuites doivent être réparées. Notez également, alors que la pression artérielle moyenne de l’artère utérine restera constante (réglée à 80 mmHg), le débit du fluide peut être variable en fonction des réponses physiologiques vasculaires et placentaires. La quantification du débit du fluide peut être identifiée comme une variable expérimentale en réponse à une exposition xénobiotique. - Tournez le robinet pour permettre l’écoulement du fluide dans l’artère ombilicale. Réglez la pression sur environ 50 mmHg, qui peut être mis en œuvre avec une pompe péristaltique (figure 3) ou une colonne hydrostatique.
- Remplissez tous les réservoirs (utérin, ombilical, et superfusate) pour maintenir le volume de liquide tout au long de l’expérience.
Remarque: une fois que la perfusion a été initiée et que l’expérience est en cours, les chiots anesthésiés restant dans le plat de dissection peuvent être évalués pour la viabilité en touchant les chiots avec des pinces pour susciter une réponse neurologique. L’exsanguination des chiots se produira par hystérectomie de la corne utérine; l’euthanasie peut être complétée par des protocoles approuvés par l’IACUC. Dans ce cas, l’ouverture du sac amniotique dans le PSS froid et la création d’un pneumothorax en coupant les côtes.
5. simulation d’expérience
- Après la canulation et l’initiation de la perfusion PSS, laisser les tissus s’équilibrer pendant 30 min pour permettre au vascularisation de s’ajuster au nouveau flux de fluide. Aspirer l’effluent par une pipette et l’enregistrer dans un tube de microcentrifugation étiqueté en conséquence.
- Après l’équilibration, établir la perfusion de base en collectant des effluents pendant 10 min des deux bateaux de pesage dans des tubes de microcentrifugation et en mesurant le volume de liquide qui émerge à travers l’artère utérine et la veine ombilicale.
- Initier la collecte d’échantillons à intervalles de 10 minutes en collectant les effluents de l’artère utérine distale et de la veine ombilical. Par exemple, administrer une dose de bolus de 900 μl de nanoparticules de polystyrène étiquetées à 20 nm de rhodamine (8 x 1014 particules/ml) en suspension dans 0,01% de surfactant à la ligne perfusant l’artère utérine pour identifier le passage du cours temporel de xénobiotique nanoparticules à travers la barrière placentaire.
NOTE: ces échantillons d’effluents permettront de mesurer les contaminants dans le fluide (soit xénobiotique, pharmacologique ou métabolite) et de fournir le débit de fluide à travers l’artère utérine ou à travers le placenta et dans le compartiment fœtal ( Figure 4). - Après perfusion de bolus, prélever des échantillons de l’artère utérine distale et de l’effluent de veine ombilical fœtale toutes les 10 min pour un total de 180 min après perfusion.
6. nettoyage de l’équipement
- Après chaque expérience, retirez l’unité placentaire des pipettes. Toutes les sutures peuvent être sauvegardées pour être réutilisées dans les expériences futures. Le tissu placentaire peut être sauvé pour d’autres études histologiques ou mécanistiques.
- Nettoyez tous les tubages et canules du système de perfusion avec 70% d’éthanol suivi de l’eau distillée et sécher à vide.
Remarque: si les tubulures ou les pipettes commencent à se décolorer ou s’ils sont endommagés, remplacez-les avant la prochaine expérience. De plus, après la fin d’une cohorte expérimentale (p. ex., toutes les études se rapportant à un seul contaminant), remplacer tous les tubages dans la chambre pour prévenir la contamination croisée.
Résultats
La figure 5 montre les expériences de la preuve de principe utilisant le colorant bleu d’Evan, nous permettant de tester le système et de visualiser la fonction de barrière fluide et placentaire appropriée et d’empêcher le transfert de confinement dans le compartiment fœtal. Le colorant bleu d’Evan a atteint et perfusés le tissu du placenta dans ce système (figure 5A). Après une enquête plus approfondie, il est clair que le colorant bleu d’Evan n’est pas entré dans la veine ombilicale fœtale (figure 5B), ce qui est attendu que le colorant bleu d’Evan est lié à l’albumine.
La figure 6 montre les données pour l’expérience fictive décrite dans ce protocole. Des échantillons d’effluents provenant de l’extrémité distale de l’artère utérine et de la veine ombilical fœtale ont été mesurés à chaque segment de 10 minutes pour évaluer le débit du fluide au fil du temps après l’administration de la dose de bolus à l’artère utérine maternelle (figure 6). Réduction du transfert de liquide dans le compartiment fœtal dans les 10 minutes suivant l’identification de la perfusion de polystyrène. Pour quantifier le transfert de polystyrène dans le compartiment fœtal pendant la période de temps où il se produit, 25 μL du fluide perfusés de chaque point de temps a été placé dans une plaque de puits 96 en double pour mesurer la fluorescence de l’échantillon. La fluorescence a été déterminée par une lecture spectroscopique à 546/575 nm (ex/EM) à l’aide d’un lecteur de microplaques fluorescentes. Le transfert de polystyrène dans le compartiment fœtal s’est produit dans les 10 minutes et a culminé à 20 minutes et s’est poursuivi pendant 90 minutes (figure 6B).
Un sous-ensemble de tissus placentaires perfusés a été sauvé pour l’histopathologie et les évaluations morphologiques. Les tissus étaient de forme fixe et l’hématoxyline et l’éosine ont été colorés et examinés par un pathologiste vétérinaire certifié par un Conseil d’administration. Ces experts n’ont identifié aucune anomalie structurale dans les placentas perfusés par seulement PSS, ou PSS avec la dose de bolus de polystyrène étiqueté rhodamine.

Figure 1: la chambre à un seul récipient modifiée. A) une vue d’ensemble de la chambre modifiée. Bune image rapprochée des aiguilles à bout pointu fixées dans la chambre du navire. La flèche rouge indique le clip de thermistance qui a été modifié pour tenir les aiguilles en place pour la canulation ombilicale. Cune image représentative des quatre canules préparées pour la canulation tissulaire. Les flèches rouges pointent sur chacune des quatre canules. S’il vous plaît cliquez ici pour voir une version plus grande de ce chiffre.

Figure 2: une vue plus rapprochée de la chambre de perfusion placentaire. (A) Ceci représente la tubulure attachée au transducteur de pression et canule l’artère utérine maternelle proximale, ou «l’influx». La pression est réglée sur une constante 80 mmHg telle que définie par la littérature. (B) Ceci représente le port de vidange de la chambre du superfusat entourant le tissu placentaire pendant la perfusion. (C) Ceci représente l’afflux de chambre du superfusat pour baigner le placenta avec le PSS réchauffé pendant la perfusion. (D) Ceci représente le port utérin distal de la mère où les effluents de la perfusion utérine peuvent être collectés. (E) Ceci représente le port de température, où la chambre du récipient peut être attachée à un thermomètre et à un chauffe-eau pour maintenir une température constante tout au long de l’expérience. (F) cela représente la canulation de l’artère ombilicale. L’artère ombilicale est pressurisée à 50 mmHg pour permettre le flux de contre-courant au niveau du placenta. G) cela représente la collecte des effluents des veines ombilicales. Le liquide qui coule vers le compartiment fœtal pendant la perfusion sera collecté ici. (H) c’est le centre du système de perfusion, où le placenta est canulé et maintenu pendant toute la perfusion. S’il vous plaît cliquez ici pour voir une version plus grande de ce chiffre.

Figure 3: vue du système de perfusion placentaire. (A et B) le système de contrôle de la pression utilisé pour surveiller et maintenir 80 mmHg de perfusat par l’artère utérine. C) cela représente la thermorégulation de la chambre de perfusion. D) microscope. E) chambre de perfusion. F) perfusion d’artère ombilicale alimentée par gravité fixée à 50 mmHg. (G) une pompe péristaltique utilisée pour remplir et drainer le PSS superfusé placentaire. S’il vous plaît cliquez ici pour voir une version plus grande de ce chiffre.
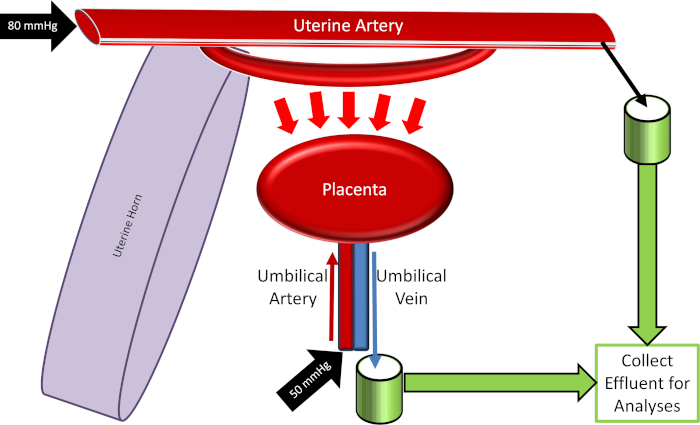
Figure 4: schéma du système de perfusion placentaire. S’il vous plaît cliquez ici pour voir une version plus grande de ce chiffre.
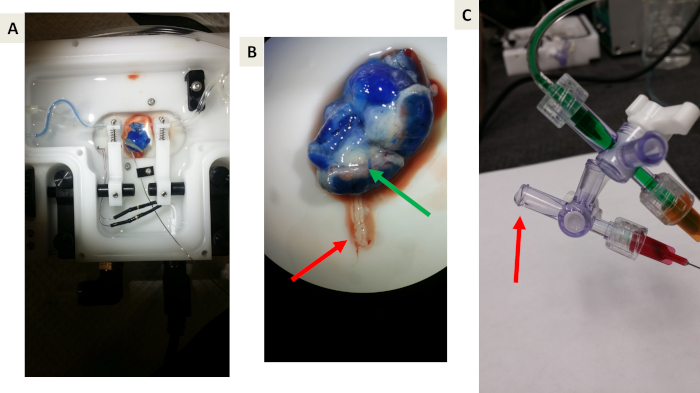
Figure 5: images représentatives d’expériences de preuve de principe utilisant le colorant bleu d’Evan. (A et B) preuve de principe que le bleu d’Evan perfuser la vasculature utérine, le muscle utérin et le placenta, mais ne traversera pas la barrière placentaire en raison de la liaison de l’albumine. La flèche verte indique le drainage veineux bleu du placenta de retour à la circulation maternelle. La flèche rouge indique l’effluent de la veine ombilical vers le compartiment fœtal. Notez l’absence de colorant bleu. C) une image représentative de la collecte des effluents drainant de la veine ombilical. La flèche rouge indique la formation de chute avant la collecte. S’il vous plaît cliquez ici pour voir une version plus grande de ce chiffre.
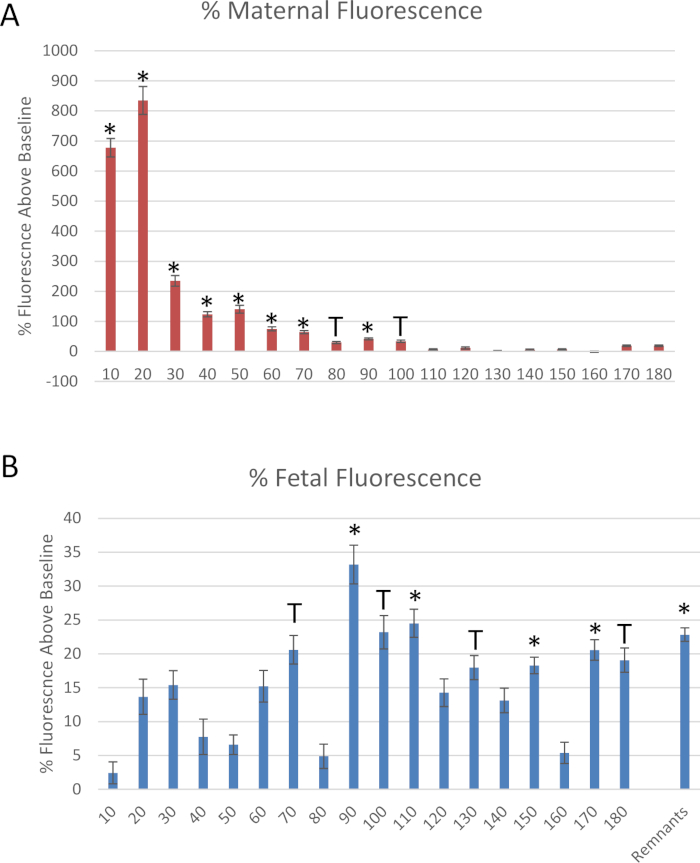
Figure 6: données dérivées de l’expérience fictive. Mesures de fluorescence des nanomatériaux de polystyrène étiquetés en rhodamine, normalisés à la fluorescence de base, par la collecte de (A) l’artère utérine et (B) les effluents des veines ombilicales fœtales. Moyenne normalisée à la fluorescence de base ± erreur standard (SE). *: p < 0,05 et T: p < 0,1 par analyse de variance (ANOVA). S’il vous plaît cliquez ici pour voir une version plus grande de ce chiffre.
Discussion
Cette méthode de perfusion permet une évaluation rapide de la barrière placentaire et de la fonction physiologique du vascularisation utérin et de la couche trophoblastique. La canulation et la perfusion des extrémités proximale à distale de l’artère utérine maternelle simulant la physiologie du flux sanguin maternel à travers ce grand vaisseau responsable de l’envoi du sang au fœtus en développement. Cette méthodologie permet l’évaluation physiologique de la vascularisation maternelle, placentaire et ombilicale isolée et, par conséquent, les changements de physiologie peuvent être identifiés comme Pathologie vasculaire; les innervations immunitaires et neuronales sont éliminées dans la procédure ex vivo. Pour assurer une évaluation appropriée, il est donc essentiel de cannuler ces vaisseaux avec précaution afin de ne pas créer de larmes ou de perforations dans les parois du vaisseau et d’enlever les bulles d’air. L’embolie gazeuse peut endommager la couche endothéliale de la vascularisation ou obstruer les vaisseaux sanguins. En maintenant les connexions vasculaires entre l’utérus, le placenta et le fœtus pendant la dissection, l’évaluation du liquide et de la translocation au fœtus peut être observée. Avec l’administration d’un xénobiotique, dans ce cas, le polystyrène à 20 nm, la cinétique à l’extrémité distale de l’artère utérine et par le placenta au compartiment fœtal peut être évaluée par l’analyse des effluents sur un cours de temps de 180 minutes.
Alors qu’un modèle à double perfusion a été décrit et que le transfert de particules et de fluides de la mère au compartiment fœtal a été contrôlé dans cet article, des évaluations peuvent également être effectuées à l’envers du fœtus jusqu’au compartiment maternel. Une des limitations de la méthode décrite ici est que la veine utérine distale n’a pas été cannulée ou échantillonnée. Dans les études futures, en particulier celles axées sur le transfert fœtal à maternel, il sera important de cannuler et d’échantillonner le vaisseau utérin distal. Les effluents prélevés dans ce simulacre d’expérimentation ont été utilisés pour évaluer le transfert xénobiotique; Cependant, un large éventail d’évaluations se rapportant aux fonctions placentaires endocriniennes et moléculaires ou à la nutrition fœtale peut être effectuée.
Les points forts de ce protocole dépassent de loin ses limitations mineures. La préparation maintient la structure physiologique et l’intégrité d’un organe entier pour évaluer les conditions expérimentales. La perfusion placentaire ex vivo est une progression scientifique de l’exposition in vitro à l’animal entier à base cellulaire pour déterminer correctement l’évaluation du risque de reproduction. Cela peut être considéré comme une technique précieuse pour les études évaluant la disposition pharmacologique placentaire de médicaments, la pharmacocinétique, la toxicologie, la physiologie, et la médecine maternelle-fœtale.
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
Ce travail a été appuyé par l’Institut national des sciences de la santé de l’environnement (R00-ES024783), le centre Rutgers pour les expositions et les maladies environnementales (ES005022), et le programme conjoint d’études supérieures de Rutgers en toxicologie (s-ES007148). Nous aimerions également remercier les Drs Michael Goedken, Marianne Polunas et Pedro Louro pour leur expertise technique et le Dr Adam goodwill pour son aide à la conception de notre schéma de perfusion (figure 5).
matériels
| Name | Company | Catalog Number | Comments |
| Black braided silk non-absorbable surgical suture non-sterile | Surgical Specialties Look | AACO805 | |
| Fine forceps | FST by Dumont Switzerland | 11252-20 | |
| Fine scissors | FST by Dumont Switzerland | 14060-10 | |
| Glass cannula pack | Living Systems Instrumentation (LSI) | GCP-75-100 | |
| Microcentrifuge Tubes 2.0mL polypropylene graduated tube with locking lid MIXED | Fisherbrand | 02-681-299 | |
| Non-serrated fine curved micro serrefine clamps | InterFocus | 18052-03 | |
| Perfusate pump | ISMATEC | ISM795C | |
| Pressure monitor | Living Systems Instrumentation (LSI) | Mode PM-4 | |
| Self-heating single vessel chamber | Living Systems Instrumentation (LSI) | CH-1 | |
| Servo Pump | Living Systems Instrumentation (LSI) | ModelPS-200-P | |
| Stainless steel blunt needle 23 gauge | Component Supply Co. | 04651-01 | |
| Stainless steel blunt needle 25 gauge | Component Supply Co. | 07116-01 | |
| STERILE Nylon Suture | AROSurgical Instruments Corporation | T04A00N07-13 | |
| Stopcock | Sedation Resource | 6-205-04 | |
| Temperature Controller | Living Systems Instrumentation (LSI) | Model TC-09S |
Références
- Troen, P., Gordon, E. E. Perfusion studies of the human placenta. I. Effect of estradiol and human chorionic gonadotropin on citric acid metabolism. Journal of Clinical Investigation. 37, 1516-1523 (1958).
- Alexander, D. P., Huggett, A. S., Nixon, D. A., Widdas, W. F. The placental transfer of sugars in the sheep: the influence of concentration gradient upon the rates of hexose formation as shown in umbilical perfusion of the placenta. Journal of Physiology. 129, 367-383 (1955).
- Alexander, D. P., Andrews, R. D., Huggett, A. S., Nixon, D. A., Widdas, W. F. The placental transfer of sugars in the sheep: studies with radioactive sugar. Journal of Physiology. 129, 352-366 (1955).
- Dancis, J., Money, W. L. Transfer of sodium and iodo-antipyrine across guinea pig placenta with an in situ perfusion technique. American Journal of Obstetrics and Gynecology. 80, 215-220 (1960).
- London, W. T., Money, W. L., Rawson, R. W. Placental Transport of I-131-Labeled Thyroxine and Triiodothyronine in the Guinea Pig. Endocrinology. 73, 205-209 (1963).
- Stulc, J., Stulcova, B., Svihovec, J. Transport of calcium across the dually perfused placenta of the rat. Journal of Physiology. 420, 295-311 (1990).
- Goeden, N., Bonnin, A. Ex vivo perfusion of mid-to-late-gestation mouse placenta for maternal-fetal interaction studies during pregnancy. Nature Protocols. 8, 66-74 (2013).
- Bond, H., et al. Artificial perfusion of the fetal circulation of the in situ mouse placenta: methodology and validation. Placenta. 27, (2006).
- Illsley, N. P., Fox, H., Van der Veen, F., Chawner, L., Penfold, P. Human placental ultrastructure after in vitro dual perfusion. Placenta. 6, 23-32 (1985).
- Davis, M. J., Kuo, L., Chilian, W. M., Muller, J. M., Barker, J. H., Anderson, G. L., Menger, M. D. Isolated, Perfused Microvessels. Clinically Applied Microcirculation Research. , 435-456 (1995).
- Butcher, J. T., Goodwill, A. G., Frisbee, J. C. The ex vivo isolated skeletal microvessel preparation for investigation of vascular reactivity. Journal of Visualized Experiments. (62), 3674 (2012).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon