Method Article
Un modelo de conejo de enfermedad ocular seca acuosa-deficiente inducida por la inyección de Concanavalin A en las glándulas lagrimales: Aplicación a estudios de eficacia de fármacos
En este artículo
Resumen
Este artículo describe el desarrollo de un método para inducir la enfermedad aguda o crónica del ojo seco en conejos mediante la inyección de concanavalina A a todas las porciones del sistema de glándulas lagrimales orbitales. Este método, superior a los ya reportados, genera un modelo reproducible y estable de ojo seco adecuado para el estudio de agentes farmacológicos.
Resumen
La enfermedad del ojo seco (DED), una enfermedad inflamatoria multifactorial de la superficie ocular, afecta a 1 de cada 6 seres humanos en todo el mundo con implicaciones asombrosas para la calidad de vida y los costos de atención médica. La falta de modelos animales informativos que recapitulen sus características clave impide la búsqueda de nuevos agentes terapéuticos para DED. Los modelos animales DED disponibles tienen una reproducibilidad y eficacia limitadas. Aquí se presenta un modelo en el que se induce DED inyectando el mitógeno concanavalina A (Con A) en las glándulas lagrimales orbitales de los conejos. Aspectos innovadores de este modelo son el uso de la guía de ultrasonido (EE.UU.) para asegurar la inyección óptima y reproducible de Con A en la glándula lagrimal inferior; inyección de Con A en todas las glándulas lagrimales orbitales que limita la producción compensatoria de lágrimas; y el uso de inyecciones periódicas de repetición de Con A que prolongan el estado de DED a voluntad. DED y su respuesta a los agentes de ensayo son monitoreados con un panel de parámetros que evalúan la producción de lágrimas, la estabilidad de la película lagrimal y el estado de la mucosa corneal y conjuntival. Incluyen osmolaridad lagrimal, tiempo de ruptura de desgarro, prueba de desgarro de Schirmer, tinción de bengala rosa y niveles de lactoferrina lagrimal. La inducción de DED y el seguimiento de sus parámetros se describen en detalle. Este modelo es simple, robusto, reproducible e informativo. Este modelo animal es adecuado para el estudio de la fisiología lagrimal y de la fisiopatología de DED, así como para la evaluación de la eficacia y seguridad de los agentes candidatos para el tratamiento de DED.
Introducción
La enfermedad del ojo seco (DED) es una afección crónica con alta prevalencia y morbilidad1,2,3,4. La inflamación juega un papel clave en su patogénesis5,6. La fisiopatología de DED se conceptualiza como derivada de la subproducción o la excesiva evaporación de las lágrimas; el primero también se conoce como DED7aqueo-deficiente. El síndrome de Sjogren, una causa prototípica ampliamente estudiada de la DED, afecta principalmente a las glándulas lagrimales (NG) y es un ejemplo sorprendente de su importancia en la patogénesis de la DED. DeD a menudo se trata con lágrimas artificiales que proporcionan alivio temporal, o con ciclosporina o lifitegrast, que suprimen la inflamación ocular. Ninguno de los tratamientos disponibles para DED son óptimos, lo que requiere el desarrollo de nuevos agentes8,9.
La búsqueda de nuevos agentes terapéuticos para deSDe se ve obstaculizada por tres grandes desafíos: la falta de un objetivo molecular farmacológico reconocido, que puede ser esquiva dada la complejidad fisiopatológica de la DED; la sparsidad de los agentes prometedores; y la falta de modelos animales que recapitulen las características clave de DED.
Al igual que con la mayoría de los esfuerzos de desarrollo de drogas, los modelos informativos de animales de DED son una herramienta de investigación crucial, a pesar de la declaración axiomética de que ningún modelo animal recapitula completamente una enfermedad humana. Los modelos de ratón, rata y conejo de DED son los más utilizados, mientras que los perros y primates se utilizan con poca frecuencia10,11. La mayoría de los más de 12 modelos de CONEJO DED reportados hasta la fecha intentan reducir la producción de lágrimas eliminando LGs o impidiendo su función12,13,14,15,16. Tales enfoques incluyen la resección quirúrgica del ILG; cierre de su conducto excretorio; y deteriorar la función de LG mediante irradiación o inyección de uno de los siguientes: linfocitos activados, mitógenos, toxina botulínica, atropina o benzalklonio. Las principales limitaciones de estos métodos son su incoherencia y la frecuente supresión parcial de la producción de lágrimas.
Concanavalina A (Con A), una lectina de origen vegetal, es un potente estimulador de los subconjuntos de células T y se ha utilizado en modelos experimentales de hepatitis17 y DED18. Se informó que el modelo original basado en Con A ofrece ventajas significativas, incluyendo su relativa simplicidad; afluencia de células inflamatorias en los gnl, imitando enfermedades como la de Sjogren; estimulación de las citoquinas proinflamatorias IL-1, IL-8 y TGF-1; reducción de la función de desgarro supervisada mediante la medición del aclaramiento de fluoresceína de desgarro y el tiempo de rotura del desgarro (TBUT); y la capacidad de respuesta de los medicamentos se muestra para un corticosteroide antiinflamatorio.
Cuando se aplicó este método prometedor, además de sus ventajas, se identificaron limitaciones que requerían su revisión general y mejoras drásticas. Se documentan tres deficiencias críticas del método. En primer lugar, el modelo era agudo; el DED inducido disminuyó después de aproximadamente 1 semana. En segundo lugar, la respuesta de los animales fue inconsistente. Como se ha demostrado, en las inyecciones transcutáneas "ciegas" a la Inferior LG (ILG), Con A se entregó sólo al azar a la glándula objetivo. El estudio detallado de la anatomía del ILG reveló que su tamaño podría variar hasta 4 veces19 haciendo tales inyecciones "hit-or-miss" esfuerzos. Finalmente, incluso cuando se inyectó el ILG, el LG superior (SLG) compensó con frecuencia el flujo de desgarro reducido, haciendo que el modelo fuera problemático.
Estas limitaciones clave se superaron introduciendo tres modificaciones en el método, generando un modelo animal superior de DED. En primer lugar, la inyección de Con A en el ILG se realizó bajo guía de ultrasonido (EE.UU.), asegurando que Con A entró en la glándula. El éxito de la inyección se confirmó mediante la obtención de una imagen de EE. UU. post-inyección, como se muestra en la Figura 1. En segundo lugar, para eliminar la contribución de desgarro compensatorio del SLG, tanto las porciones palpebrales como orbitales de esta glándula se inyectaron con Con A. Finalmente, este modelo agudo de DED se convirtió en uno crónico por inyecciones repetidas de Con A cada 7-10 días. DED de 2 meses de duración se logra fácilmente en estos conejos. El éxito de este enfoque ha sido ampliamente documentado19.
Como ya se ha mencionado, una aplicación importante de los modelos animales de DED es determinar la eficacia y seguridad de los agentes terapéuticos candidatos. La utilidad de este modelo fue demostrada por el estudio de fosfosulindaco (OXT-328), una novedosa molécula pequeña antiinflamatoria20,21 administrada como gotas para los ojos. Su eficacia se demostró sobre la base de un panel de parámetros de DED19. La relativa simplicidad y la naturaleza informativa de este modelo también permitieron la comparación lado a lado de fosfosulindac a los dos medicamentos aprobados por la FDA para DED, ciclosporina y lifitegrast, demostrando su fuerte superioridad preclínica.
Protocolo
Todos los estudios en animales fueron aprobados por la Junta de Revisión Institucional de la Universidad Stony Brook y realizados de acuerdo con la Declaración ARVO para el Uso de Animales en Investigación Oftálmica y De Visión.
1. Animales y alojamiento
- Adquirir conejos blancos de Nueva Zelanda (NZW) que pesan 2-3 kg.
- Casa de los conejos por separado en jaulas con temperatura estricta (65 o5 oF) y humedad (45 x 5%) Control. La iluminación debe tener un ciclo de encendido/apagado de 12 h.
- Proporcionar acceso ilimitado al agua y la comida estándar de conejo. Elimine los enriquecimientos dietéticos, ya que pueden contener vitamina A que afecta el ojo.
- Aclimatar a los animales durante al menos 2 semanas antes de las medidas de referencia o la inducción del ojo seco.
2. Métodos de anestesia y eutanasia
NOTA: Todos los procedimientos requieren sedación leve, excepto la inyección de Con A que requiere sedación moderada.
- Para una sedación leve, inyectar acepromazina (1 mg/kg) por vía subcutánea sobre los hombros utilizando una aguja calibre 26. Punto final para la sedación leve: los animales mantienen una posición relajada en la cabeza con lóbulos auditivos que ya no están completamente erguidos.
NOTA: Si no se alcanza el punto final adecuado, se puede administrar una inyección adicional de acepromaz. Los animales siempre deben permanecer despiertos, receptivos al tocar sus bigotes, y nunca mostrar respiración lenta. - Para la sedación moderada, primero dar a los animales acepromazina como arriba. Una vez alcanzado el punto final (véase la nota anterior), dé isoflurano usando una máscara de gas con el flujo O2 establecido en 1 L/min y la entrega de isoflurano establecida en 5%(Figura 2).
- Administrar isoflurano hasta que el tono corporal del conejo esté completamente relajado y las orejas estén completamente flojos.
NOTA: No se deben producir movimientos musculares compensatorios cuando el animal se gira de lado; la respiración siempre permanece espontánea. - La recuperación espontánea ocurre dentro de 2-5 min: los signos incluyen movimientos espontáneos de la cabeza y un tono muscular creciente o normal. Después de que el procedimiento experimental se complete con sedación moderada, observe a los conejos durante unos 30 minutos o hasta que su comportamiento vuelva a la normalidad.
NOTA: La pomada oftálmica no es necesaria durante ninguna de las dos formas de sedación. 1) En la sedación leve, los animales siguen estando alerta y mantienen un reflejo de parpadeo. En la sedación moderada, la inhibición del reflejo del parpadeo es tan corta que la superficie ocular no está en riesgo. 2) La colocación de pomada oftálmica en la superficie ocular impide la visualización de las estructuras evaluadas durante las pruebas. - Eutanasia: Utilice una sobredosis de pentobarbital intravenoso (100 mg/kg).
3. Extirpación de la membrana nictiladora
- Realizar la extracción durante el período de aclimatación (generalmente la primera semana) para permitir una evaluación completa y precisa de la córnea.
-
Inyección a la membrana nictinada derecha
NOTA: Si se va a eliminar la membrana nictiante de ambos ojos, es más sencillo hacerlo en una sola sesión. Comience con un ojo y proceda como se describe. Para mayor claridad de descripción, este método comienza con el ojo derecho.- Coloque el conejo en una bolsa de sujeción de tamaño adecuado.
- Inducir sedación leve como se describe en el paso 2.1.
- Aplicar 25 ml de lidocaína sin conservantes en el ojo derecho con una micropipeta.
- Coloque un espéculo flexible de la tapa del alambre entre los párpados.
- Usando 0.3 fórceps (o equivalente), agarre la membrana nictinada en su ápice y extiéndala sobre la córnea.
- Inyectar lidocaína 1% con 1:100,000 subconjuntina de epinefrina en la base de la membrana nictiatante utilizando una aguja afilada de calibre 26(Figura 3A). Se debe formar un bleb moderado sobre la membrana nictiladora.
- Retire el espéculo.
- Realice una inyección idéntica a la membrana nictiatante izquierda.
-
Cortar la membrana nictiante
- Después de aproximadamente 5 minutos, coloque el espéculo de la tapa en el ojo derecho. Agarre y retraiga la membrana nictinada en su ápice usando 0,3 fórceps (o similar).
- Cortar la membrana nictiante en su base usando tijeras Westcott o equivalente(Figura 3B).
NOTA: El sangrado es mínimo y normalmente no requiere cauterio. Sin embargo, una batería de alta temperatura cautery siempre se mantiene cerca en caso de que se necesite hemostasis adicional. - Retire el espéculo.
- Coloque un pomada antibiótica tópica en el ojo (p. ej., neomicina, polimicina, bacitracina e hidrocortisona).
- Deje intacta la glándula Harderiana. La glándula harderiana a veces se ve cuando la membrana nictitatante se retrae.
NOTA: Si se observa una gran elevación de masa blanca o tejido en la región subconjuntival nasal o superior después de que se extrae la membrana nictiladora, la membrana se resecó demasiado cerca de su base permitiendo que la glándula harderiana prolapso espontáneamente. Para evitar esto en procedimientos posteriores, deje más de la membrana nictiante en la base. - Permita que la superficie ocular sane durante al menos 1 semana antes de que se realicen más manipulaciones o se realicen ensayos de superficie ocular.
4. Medición de los parámetros del ojo seco y recogida de muestras de lagrimal
NOTA: Mida los parámetros DED en función de las necesidades del protocolo de estudio (por ejemplo, en la línea de base y los puntos de tiempo especificados a partir de entonces). Las mediciones para DED deben realizarse en el siguiente orden, con un esfuerzo riguroso para replicarlas fielmente cada vez. Pruebe todos los animales aproximadamente a la misma hora del día (1 h) para minimizar las variaciones circadianas. Estas mediciones generalmente requieren un equipo de dos investigadores.
- Coloque el conejo en una bolsa de sujeción. Inducir sedación leve.
- Osmolaridad lagrimal22
- Parpadea manualmente los párpados 5-10 veces para distribuir uniformemente la capa lagrimal en la superficie ocular.
- Retraiga suavemente el párpado inferior.
- Muestra las lágrimas con el osmómetro TearLab en la unión de la conjuntiva palpebral y bulbar a lo largo del fornix inferior, justo después de la base de la membrana nictinada truncada.
- Mida la osmolaridad utilizando la prueba de osmolaridad TearLab siguiendo las instrucciones del fabricante.
- Tiempo de rotura de desgarro (TBUT)
- Oscurece la habitación para este ensayo.
- Coloque un espéculo de tapa de alambre entre los párpados.
- Aplicar una gota de fluoresceína de 50 l sobre la superficie corneal utilizando una micropipette. Si incluso la distribución de la fluoresceína sobre la córnea no se obtiene con la primera gota, coloque una segunda gota.
- Inicie inmediatamente un temporizador.
- Observe la película lagrimal pre-corneal bajo una luz azul. El TBUT se define como el tiempo necesario para desarrollar puntos negros, líneas o interrupción obvia de la película de fluoresceína(Figura 4). Si es necesario, utilice las loupes quirúrgicas que proporcionen +1.50 aumento para visualizar mejor los primeros signos de ruptura. Monitor de hasta 1 min; si la ruptura como se define aquí se produce después de 1 min, registre TBUT para sólo 60 s.
- Prueba de desgarro de Schirmer (STT)
- Aplicar una gota de 25 ml de lidocaína sin conservantes sobre la superficie ocular.
- Coloque una lanza quirúrgica de células Weck en el fornix inferior para absorber lidocaína residual y cualquier líquido lagrimal. Si es necesario, utilice el párpado inferior para cubrir el extremo proximal de la esponja para ayudar a mantenerlo en su lugar(Figura 5A).
- Después de aproximadamente 30 s, retire la esponja Weck.
- Inserte inmediatamente una tira de prueba lagrimal de Schirmer en el espacio entre la córnea y la conjuntiva palpebral en el punto medio del párpado inferior.
- Inicie inmediatamente un temporizador(Figura 5B).
- Después de 5 min, mida la longitud de la porción humedecida de la tira; este es el valor STT.
- Realizar medidas en triplicado e informar el promedio de las 3 lecturas como el valor STT.
- Colección de muestras de lágrimas
- Para recoger muestras de lágrimas para los niveles de ensayo de varios analitos en ellos como la ctoferrina, después de que el valor STT se registra en 5 min, dejar la tira en su lugar hasta que se obtenga la humectación de al menos 20 mm.
NOTA: Si no se produce una humectación adecuada después de que se haya inducido DED, avance la tira más profundamente en el fornix inferior para ayudar a alcanzar este punto final en un tiempo razonable. - Cortar la tira humedecida y colocar inmediatamente en 490 ol de tampón de recolección de lágrimas refrigerada (4% BSA, 1M NaCl, 0.1% Tween-20 en PBS con cóctel inhibidor de la proteinasa).
- Conservar las muestras en hielo hasta que puedan almacenarse a -80 oC, donde deben permanecer hasta que se ensayen.
- Para recoger muestras de lágrimas para los niveles de ensayo de varios analitos en ellos como la ctoferrina, después de que el valor STT se registra en 5 min, dejar la tira en su lugar hasta que se obtenga la humectación de al menos 20 mm.
- Tinción de Bengala Rosa (RBS)
- Aplicar 50 ml de lidocaína sin conservantes al 1% de lidocaína sin conservantes en la córnea utilizando una micropipeta.
- Después de 30 s, coloque 25 s de bengala rosa del 1% en la superficie ocular y parpadee manualmente el párpado para distribuirlo uniformemente.
- Inicie inmediatamente un temporizador.
- A 3,5 min, coloque un espéculo de la tapa del alambre entre las tapas.
- A 4,0 min, fotografíe la superficie conjuntival y corneal superior(Figura 6).
NOTA: Ajuste al tipo de cámara que se está utilizando. Ajustes típicos: cámara réflex digital de una sola lente, modo de prioridad de apertura (apertura 13 o superior), ISO 6000, lente macro de 100 mm conectada con dos tubos de extensión de 12,5 mm, modo de enfoque manual, lente con aumento máximo e iluminación de flash macro/anillo establecido en automático con modo de lente. La lámpara de enfoque del flash de anillo está encendida para ayudar a centrarse en la córnea. - Completa todas las fotos para ambos ojos en 1 min.
- Puntuar la tinción de superficie ocular utilizando el método NEI23 modificado de la siguientemanera. No califique las zonas conjuntivales separadas de grado 6. Puntuar la conjuntiva superior de cada ojo. Esta es la porción de la superficie conjuntival fácilmente fotografiada sin manipular el globo. La manipulación podría cambiar de arte la tinción de la superficie ocular.
- Los niveles de lactoferrina lagrimal son una medida sustituta de la producción de lágrimas a partir de las glándulas lagrimales. Ensayo de lactoferrina lagrimal en lágrimas recogidas como arriba mediante el uso de un ensayo inmunoabsorbente ligado a enzimas24 kit siguiendo las instrucciones del fabricante.
5. Inducción y tratamiento del ojo seco
NOTA: Se inyectan tres porciones del sistema de glándulas lagrimales orbitales.
- Sedar los conejos con acepromaz 0,2 mg/kg por vía subcutánea.
- Corte el pelaje en el área periorbital y del cuero cabelludo y elimine por completo cualquier pelaje residual usando Nair. Deje la piel completamente lisa para una mejor visualización de las señas de identidad anatómicas y la inyección guiada por Estados Unidos de concanavalina A (Figura 7).
- Inducir sedación moderada como se describió anteriormente.
- Inyección de la porción palpebral de la glándula lagrimal superior (PSLG)
NOTA: Realice primero la inyección de PSLG.- Aplicar en el ojo adecuado 25 l de lidocaína sin conservantes 1% con una micropipette.
- Evert el párpado superior y aplicar suave presión medial en el borde orbital posterior hasta que se ve la protuberancia que marca la porción palpebral de la glándula. El PSLG aparece como una pequeña elevación bulbosa en la parte posterior (temporal) del párpado superior.
NOTA: Para ver el tejido de la glándula durante el proceso de aprendizaje, aplique 5% de fluoresceína en el área(Figura 8A). Las lágrimas se pueden ver fluyendo desde el bulboso PSLG. La aplicación de fluoresceína no es necesaria para la administración de Con A; se hace sólo con fines ilustrativos para mostrar el tejido de la glándula. - Usando fórceps de dientes finos y una aguja de calibre 27 en una jeringa de tuberculina, penetra directamente en la glándula usando un enfoque transconjuntival. Avance la aguja 2 mm en el tejido e inyecte 500 g de Con A en un volumen de 0,1 ml(Figura 8B).
NOTA: Esta inyección a veces puede ser dolorosa. Si es necesario, mantenga los animales bajo isoflurano hasta que se complete esta inyección.
- Inyección de la glándula lagrimal superior orbital (OSLG)
NOTA: OSLG sigue en rápida sucesión.- Aplique presión medial en el globo terráqueo haciendo que el OSLG sobresalga de la incisión posterior (verref 25 para la anatomía, si es necesario). Aplique presión medial al globo terráqueo(Figura 9, flecha roja)con la protuberancia del OSLG de la incisión posterior. La protuberancia sirve como localización bruta para encontrar la incisión posterior.
- Utilice fórceps curvos con puntas cerradas para aplicar sangría al área hasta que se sienta la abertura ósea en el cráneo. Esto será similar a una hendidura con una dirección anterior/posterior bajo la protuberancia.
- Aplicar una presión modesta con fórceps para dejar una hendidura en la piel, que servirá como punto de referencia para la colocación de la aguja(Figura 10A).
- Inserte una aguja (jeringa de tuberculina con una aguja de calibre 27, de 5/8 pulgadas) perpendicular a la piel sobre la marca de sangría(Figura 10B) a 1/4 pulgadas en la incisión, luego redirija la aguja posterior y externamente hacia el canthus lateral apuntando hacia el punto medio entre el sitio de inyección y el borde orbital óseo.
NOTA: Si la incisión no se dirige con precisión con la aguja, el cráneo bloquea su avance. - Una vez alcanzado el cubo de la aguja, inyectar lentamente 1000 g de Con A en un volumen de 0,2 ml(Figura 10C).
- Complete la inyección de PSLG y OSLG en un plazo de 2-3 min.
- Retire el animal de la sedación de isoflurano (si aún no se ha hecho). La inyección de la glándula lagrimal inferior (ILG) generalmente se puede completar sin más sedación.
- Inyección de la glándula lagrimal inferior
- Ver el animal desde el lado. La prominencia del ILG se puede ver a lo largo de la parte anterior inferior de la órbita(Figura 11A).
- Dibuje una línea vertical usando un bolígrafo de marcado quirúrgico o un marcador permanente adecuado en la piel donde la parte superficial de la glándula ILG pasa de su lugar de descanso superficial (más externo) en el hueso cigomático a su ubicación más medial en la órbita. Esto es típicamente inferior al limbo anterior(Figura 11A).
- Identifique el extremo del hueso cigomático barriendo la sonda estadounidense de control vertical a través de esta línea en la piel. La transición ILG ocurre cuando la imagen de la glándula cambia de claramente circunscrita (la línea hiperecoica del hueso cigomático se ve a lo largo del borde inferior de la glándula en la imagen) a una sin un borde medial reconocible (el eco óseo cigomático ya no está presente, Figura 1).
- Observe la posición relativa de la pieza de mano a la línea dibujada en la piel cuando la pantalla de EE. UU. muestre este cambio. Este es el "sitio de inyección" donde se debe administrar Con A.
- Controlar la profundidad de la inyección para colocar Con A en la glándula en un punto sólo medial al hueso del arco cigomático.
- Determinar la profundidad de la inyección de la siguiente manera: Establezca la profundidad de inyección deseada como la profundidad del hueso cigomático (señal hiperecoica) más 1 mm. Reste este valor de la longitud conocida de la aguja (15 mm en este ejemplo).
- Inserte la aguja en la glándula en el "sitio de inyección" de 12 mm, luego retírela lentamente hasta que la longitud de la aguja expuesta fuera del cuerpo (medida con pinzas quirúrgicas) sea igual a la diferencia calculada en 5.8.6(Figura 12). Inyectar 1000 g de Con A en 0,2 ml.
NOTA: Para asegurarse de que la cápsula de la glándula está perforada y no simplemente empujada por la aguja, la aguja debe insertarse de 12 mm o casi en el cubo antes de que comience su retirada. - Repita los EE.UU. para confirmar el éxito de la inyección. El ILG debe mostrar un espacio hipoecoico característico(Figura 1).
NOTA: La inyección de ILG es la mejor tolerada por los animales26 y, por lo tanto, se realiza en último lugar.
- Complete todo el procedimiento para inyectar todas las glándulas de ambos ojos dentro de 10 min. Esto requerirá el logro de la competencia en el procedimiento.
NOTA: Un solo conjunto de inyecciones en las 2 glándulas lagrimales orbitales inducirá DED agudo que dura 1-2 semanas. - Para DED de mayor duración, inyecte Con A exactamente como se ha indicado anteriormente cada 7 días. Hasta 6 inyecciones de este tipo se han realizado con éxito.
6. Atención post-procedimiento
- Después de la inyección de Con A, controlar los animales en sus bolsas de sujeción durante al menos 10-20 min, o hasta que el efecto anestésico se haya desgastado.
- No deje a los animales desatendidos hasta que hayan recuperado la conciencia suficiente para mantener la recumbencia esternal. No los devuelvaa a sus jaulas individuales hasta que estén completamente recuperados.
- El dolor post-procedimiento suele ser leve y dura menos de 48 h. Evaluar el dolor con la escala de mueca de conejo. Si es necesario, dé una dosis única de ketorolaco subcutáneo (5 mg/kg). Para un dolor más intenso, dar buprenorfina subcutánea 0,1 mg/kg cada 8 h.
Resultados
Con A inyecciones indujeron una fuerte respuesta inflamatoria en las glándulas lagrimales caracterizadas por un infiltrado linfocítico denso(Figura 13), acompañado de disminución de la producción de lágrimas. Todos los parámetros de desgarro se modificaron notablemente(Tabla 1 y Tabla 2). Además, se suprimieron los niveles de lactoferrina lagrimal (control de 3,1 x 0,45 frente a Con A inyectado a 2,7 x 0,02 ng/mg de proteína (media de SEM); p<0,03). El resultado final fue un epitelio corneal y conjuntival comprometido, evidenciado por el aumento de la tinción de bengala rosa(Figura 6).
La inyección de los tres tejidos LG orbitales produjo un estado DED consistente y uniforme a diferencia de los estados alcanzados por los métodos anteriores18,27. Los principales contribuyentes a este resultado fueron la inyección guiada por los Estados Unidos del ILG y la inyección del OSLG. La Tabla 1 resume los resultados destacados de este método. Todos los cambios son consistentes con DED severo.
Un solo conjunto de inyecciones de Con A produce DED que dura aproximadamente 1 semana; todos los parámetros clínicos se normalizan antes del día 10 (Tabla 2). Las inyecciones secuenciales de Con A se extienden aproximadamente con 1 semana de diferencia, extienden la duración de DED en consecuencia. Por ejemplo, el segundo conjunto de inyecciones de Con A en el día 7 mantiene DED durante 2 semanas y así sucesivamente. Después de aproximadamente 5 conjuntos de inyecciones, el estado DED a menudo se convierte en permanente sin necesidad de inyecciones adicionales.
Cuando los conejos con DED inducido por Con A fueron tratados con el nuevo agente fosfosulindaco, suprimió notablemente la enfermedad. Por ejemplo, Después de una semana de tratamiento con este agente TBUT aumentó notablemente en comparación con los animales tratados con vehículos (43,6 x 4,0 frente a 12,2 x 2,8 s; p<0,001; media de SEM, respectivamente, para estos y siguientes valores) mientras que la osmolaridad lagrimal se normalizó (294 x 4,6 frente a 311 x 2,0 mOsm/L, p<02). Mecanísticamente, fosfosulindaco disminuyó los niveles de dos interleukins cruciales, IL-1 ( 8,4 x 1,2 frente a proteína de 21,2 x 6,6 pg/mg; p<0,03) e IL-8 (4,9 x 1,7 frente a 13,5 x 5,0 pg/proteína mg; p<0,05)19.
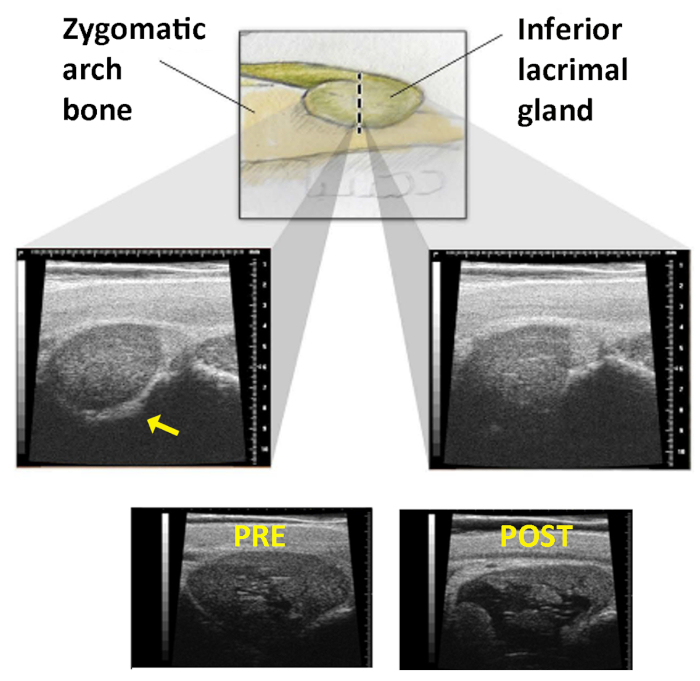
Figura 1: Imagen por ultrasonido de la glándula lagrimal inferior. Panel superior: El ILG a medida que se mueve más profundo en órbita para estar debajo del arco cigomático. La línea discontinua representa la línea en la piel a través de la cual se barre la sonda de EE. UU. Paneles intermedios: A medida que la pieza de mano se barre a través de esta línea, el examinador busca la pérdida del eco óseo cigomático que está presente en la imagen izquierda (flecha) y desaparece en la derecha. Paneles inferiores: Imágenes del ILG tomadas antes (izquierda) y después (derecha) inyección de Con A. Desarrollo de un gran espacio quístico dentro de la glándula confirma la administración adecuada. Reimpreso con permiso19. Haga clic aquí para ver una versión más grande de esta figura.

Figura 2: Sedación de máscara de gas. Esta fotografía muestra la máscara de gas proporcionando una breve sedación moderada con isoflurano. Haga clic aquí para ver una versión más grande de esta figura.
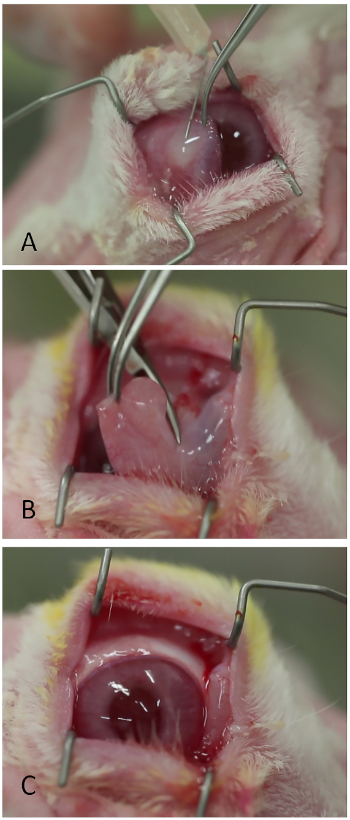
Figura 3: Extirpación de la membrana nictiladora. (A) Inyección de lidocaína/epinefrina. (B) Truncamiento de la membrana nictizante en su base con tijeras Westcott. (C) La superficie ocular visualizada más fácilmente después de la eliminación de la membrana nictiante. Haga clic aquí para ver una versión más grande de esta figura.
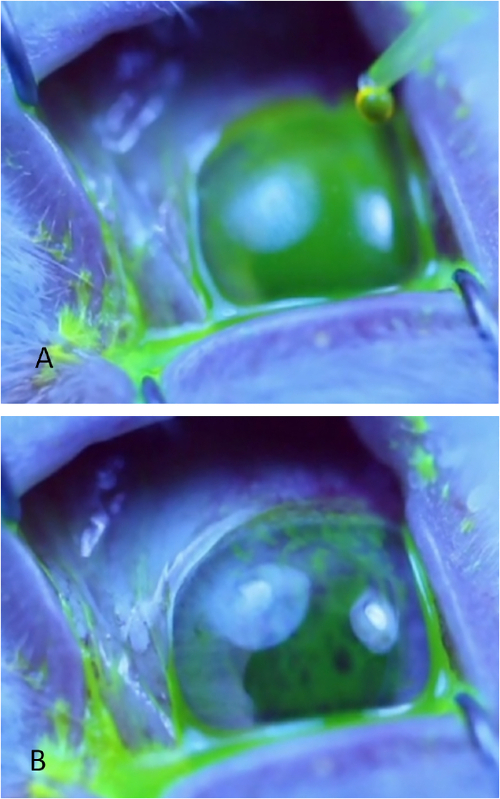
Figura 4: Medición del tiempo de rotura de desgarro. (A) Apariencia uniforme de la película lagrimal verde de la superficie corneal bajo luz azul inmediatamente después de la aplicación de gotas de fluoresceína. (B) Superficie corneal que ya ha sufrido una marcada ruptura evidenciada por múltiples ojeras y rayas lineales en la fluoresceína. El tiempo de ruptura se registra tan pronto como se desarrolla la primera mancha oscura o línea. Los dos círculos azules claros son reflejos de la fuente de luz fuera de la córnea. Haga clic aquí para ver una versión más grande de esta figura.
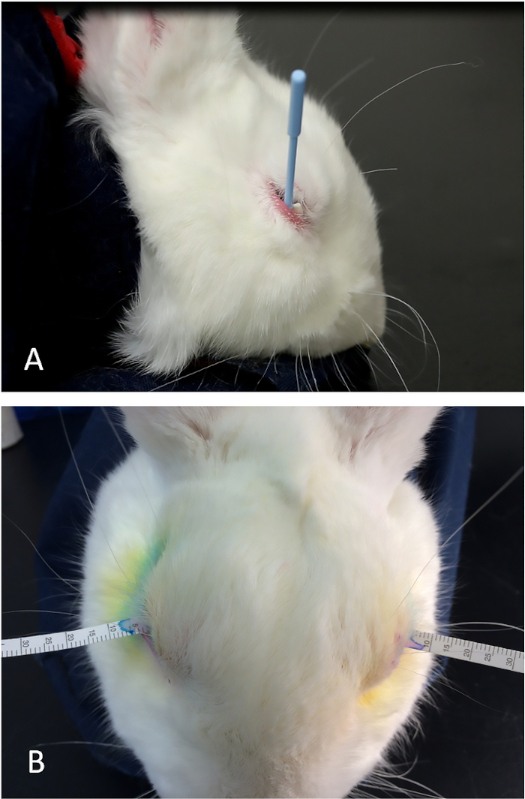
Figura 5: Prueba de desgarro de Schirmer. (A) La colocación adecuada de la esponja Weck-Cel en el fornix inferior para eliminar cualquier solución de lidocaína tópica residual y desgarros basales. Al colocar el borde posterior de la esponja triangular debajo del margen inferior del párpado, se puede mantener una técnica muy uniforme para secar la superficie ocular antes de la colocación de las tiras lagrimales. (B) Una tira lagrimal colocada adecuadamente en la posición media del párpado inferior entre el globo y el párpado inferior (conjuntiva palpebral). Haga clic aquí para ver una versión más grande de esta figura.

Figura 6: Tinción de bengala rosa. Superior: Fotografías de la superficie corneal. Izquierda: No hay tinción de bengala rosa antes del tratamiento con Con A. Derecha: La tinción corneal y conjuntival difusa se ve en el cuadrante nasal superior después de la inyección (arriba a la derecha). Inferior: Citología de impresión conjuntival de la conjuntiva bulbar superior. Izquierda: Numerosas células de copa están presentes antes del tratamiento. Derecha: Las células epiteliales están presentes, pero las células de copa están ausentes después del tratamiento. Haga clic aquí para ver una versión más grande de esta figura.

Figura 7: Preparación de conejo para inyecciones de concanavalina A. (A) Las tijeras pequeñas se utilizan para eliminar el pelaje, lo que permite una visualización más fácil de los puntos de referencia para identificar la glándula lagrimal superior orbital. (B) Nair se utiliza para eliminar el cabello que queda después del cizallamiento. Haga clic aquí para ver una versión más grande de esta figura.
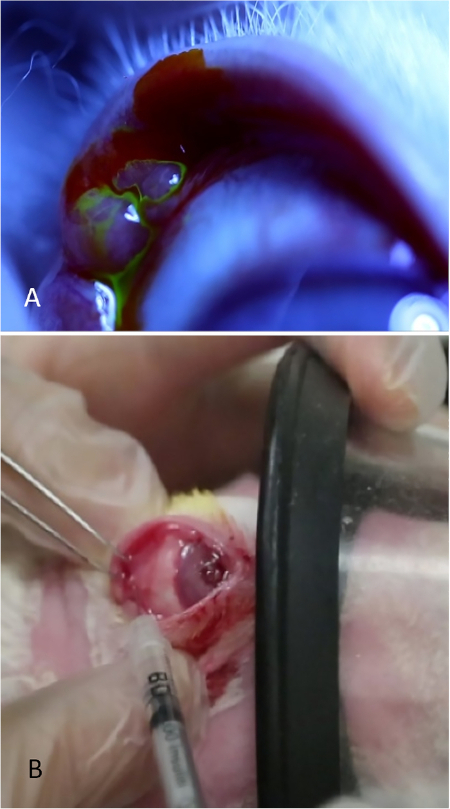
Figura 8: Inyección de la glándula lagrimal palpebral. (A) La glándula lagrimal palpebral, que aparece como una elevación bulbosa en la parte temporal posterior del párpado superior. Las lágrimas se ven fluyendo desde la superficie de esta glándula después de aplicar una gota de 2% de fluoresceína. (B) La glándula lagrimal palpebral se inyecta mientras el conejo recibe sedación moderada. Un investigador retrae el párpado, optimiza la exposición de la glándula y asegura la máscara mientras el segundo investigador inyecta la glándula. Haga clic aquí para ver una versión más grande de esta figura.

Figura 9: Localización de la glándula lagrimal superior orbital. Los cambios en los contornos de la piel indican la ubicación del OSLG, ya que sobresale a través de la incisión posterior. La presión medial alterna en el globo(flecha grande)hace que la glándula orbital superior prolapso, que se ve como una pequeña elevación en la piel. Esta elevación aumentará de tamaño cada vez que se aplique la presión(flechas pequeñas). La ubicación de esta glándula suele estar en línea con el borde orbital posterior. Haga clic aquí para ver una versión más grande de esta figura.
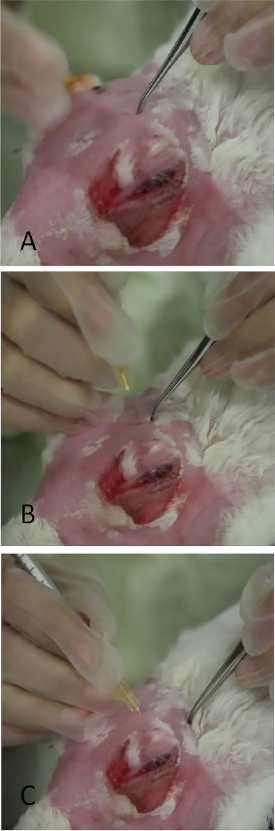
Figura 10: Inyección de la glándula lagrimal superior orbital. (A) Aplicación de presión suave al cráneo con fórceps de dientes finos en la zona que prolavó como en la Figura 9. Una abertura delgada en forma de hendidura en el cráneo puede palparse. Dejar una pequeña marca de indentación con los fórceps ayuda en gran medida a la colocación de la aguja durante la inyección. (B) La aguja se está insertando perpendicularmente a través de la incisión. Si se coloca incorrectamente, su paso es detenido por el cráneo óseo. (C) La aguja está en posición final en ángulo hacia el canthus lateral. Haga clic aquí para ver una versión más grande de esta figura.
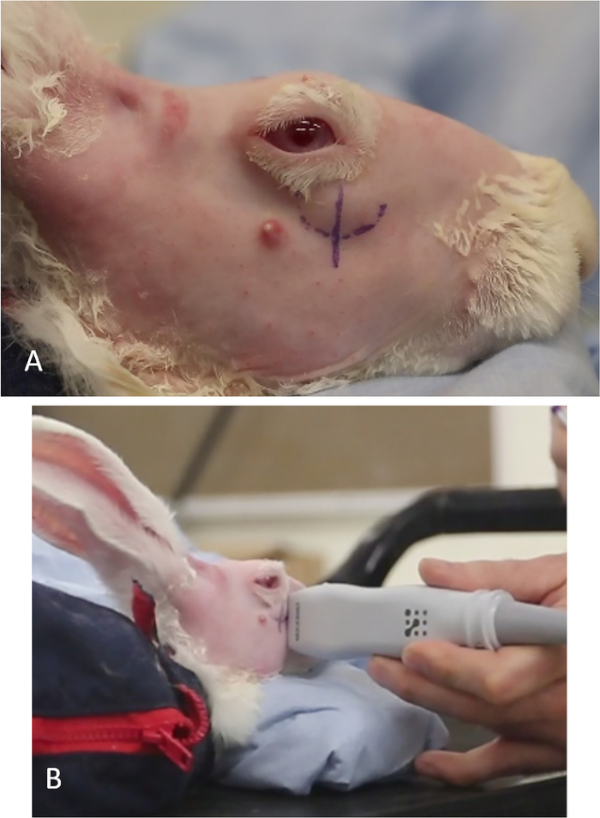
Figura 11: Localización de la glándula lagrimal inferior. (A) La prominencia de la parte superficial del ILG vista a través del párpado inferior. La marca de lápiz curvilínea indica la posición inferior de la glándula. La línea vertical, bajo el limbo nasal, denota la posición aproximada donde el ILG pasa a una posición más profunda dentro de la órbita y sirve como una referencia visual para los Estados Unidos. (B) barrido de piezas de mano de los Estados Unidos a través del área de la línea vertical; el monitor de los Estados Unidos mostrará dónde termina el hueso cigomático, dónde cambia el ILG y dónde se debe administrar la inyección con A ("sitio de inyección"). Haga clic aquí para ver una versión más grande de esta figura.
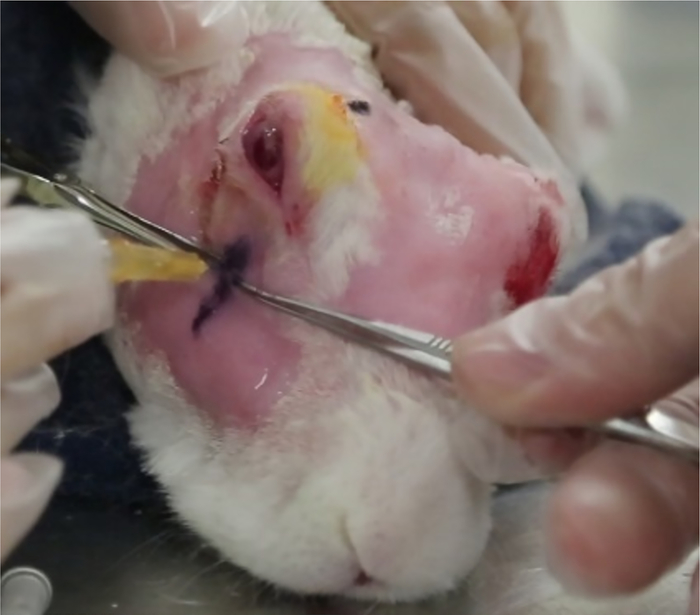
Figura 12: Inyección de la glándula lagrimal inferior. La inyección del ILG se realiza en la ubicación identificada por los EE.UU. La profundidad de la inyección se calcula como se describe en el texto (paso 5.8.6). Las pinzas (que se ven detrás de la aguja) aseguran que la aguja se coloca a la profundidad adecuada antes de la inyección. Haga clic aquí para ver una versión más grande de esta figura.
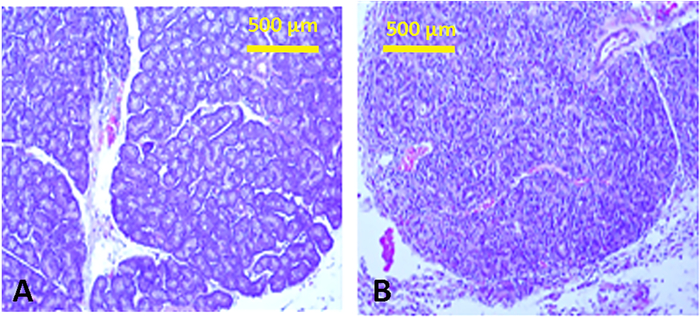
Figura 13: Histología de las glándulas lagrimales. Secciones tisulares de una glándula lagrimal inferior normal con estructura tubulo-alveolar típica (A) y después de la inyección de Con A (B),mostrando marcado infiltrado linfocítico con efluya de la estructura. Se ven infiltrados inflamatorios similares en las glándulas lagrimales superiores. Haga clic aquí para ver una versión más grande de esta figura.
| Método de inyección | TBUT, seg | Osmolalidad lagrimalística, Osm/L | STT, mm | |||
| Base | Post-inyección | Base | Post-inyección | Base | Post-inyección | |
| media: SEM, % de cambio | ||||||
| ILG sin guía de EE. UU. | 58,5 x 1,5 | 44,5 a 7,7 | 297 x 4,9 | 300 x 3,8 | 15,2 a 0,9 | 12,9 x 2,2 |
| %cambio | -23% | 1% | -15% | |||
| pág. 0,05 | pág. 0,36 | pág. 0,21 | ||||
| ILG + PSLG guiado por EE. UU. | 59,4 á 0,6 | 11,4 x 4,2 | 296 x 4,7 | 326 x 3,7 | 15,1 a 1,3 | 10,7 a 1,8 |
| % de cambio | -81% | 10% | -29% | |||
| p<0.0001 | p<0.0001 | p<0.03 | ||||
| ILG + PSLG + OSLG guiado por EE. UU. | 60 x 0,0 | 6,2 x 1,3 | 299 x 2,9 | 309 x 2,8 | 14,6 a 0,9 | 9,9 x 1,3 |
| % de cambio | -90% | 3% | -32% | |||
| p<0.0001 | p<0.008 | p<0.002 | ||||
| Todos los valores se midieron el día 6 después de una sola inyección de Con A en las glándulas enumeradas. Todas las comparaciones se hicieron con la línea de base. * ILG, glándula lagrimal inferior; PSLG, porción palpebral de la glándula lagrimal superior; OSLG, porción orbital de la glándula lagrimal superior; EE.UU., ultrasonido. | ||||||
Tabla 1: Efecto de la técnica de inyección y número de lugares de inyección sobre la gravedad del ojo seco.
| Base | Día 6 | Día 13 | Día 21 | |
| 1 inyección | 2 inyecciones | 3 inyecciones | ||
| TBUT, seg | 58,5 x 1,5 | 44,5 a 7,7 | 29,2 a 7,8 | 12,8 x 3,9 |
| % de cambio | -24% | -50% | -78% | |
| pág. 0,17 | pág. 0,001 | p<0.0001 | ||
| TOsm, Osm/L | 297 x 4,9 | 300 x 3,9 | 308 x 4,9 | 313 x 2,7 |
| % de cambio | 1% | 4% | 5% | |
| pág. 0,36 | pág. 0,04 | pág. 0,003 | ||
| STT, mm | 15,2 a 0,9 | 9,3 x 1,6 | 12,9 x 1,6 | 7,4 x 1,1 |
| % de cambio | -39% | -15% | -51% | |
| pág. 0,17 | pág. 0,13 | pág. 0,008 | ||
| Se hicieron comparaciones con la línea de base. | ||||
Tabla 2: Efecto de las inyecciones repetidas de Con A en ILG en la duración de DED.
Discusión
Los conejos son muy atractivos para el estudio de DED. Su córnea y conjuntiva tienen una superficie más cercana a la de los seres humanos en comparación con ratones y ratas; su complemento de enzimas metabolizadoras de fármacos como la esterasa, y la histología de sus glándulas lagrimales son similares a los de los seres humanos, y sus ojos son lo suficientemente grandes como para estudios farmacocinéticos informativos. En comparación con los cerdos y monos, con los que comparten características similares, cuestan menos y su manipulación experimental es más fácil. Si se contemplan estudios mecánicos, un inconveniente relativo del conejo, en comparación con los ratones, es que hay menos reactivos (por ejemplo, anticuerpos monoclonales). Por otro lado, el conejo es muy superior a los ratones para estudios farmacocinéticos y de biodistribución porque los tejidos individuales se diseccionan fácilmente y de tamaño suficiente para el trabajo analítico, evitando la "agrupación de muestras".
Un parámetro general crítico es el período de aclimatación de los conejos. Los animales son enviados desde el vendedor en condiciones que a menudo no aseguran un ambiente de transporte de la temperatura o humedad adecuada. Es posible que algunos animales ya hayan desarrollado el ojo seco a su llegada. Se recomienda un período de aclimatación de dos semanas. Igualmente importante es la atención escrupulosa a la humedad y temperatura del espacio donde los conejos del estudio se alojan en el vivarium. Las desviaciones en cualquiera de las dos condiciones pueden inducir enormes variaciones en su estado ocular. Tenga a mano humidificadores y deshumidificadores de respaldo. Si el sistema central falla, actúe rápidamente para restaurar la humedad ambiental utilizando el equipo de respaldo. Tenga en cuenta que tales acontecimientos desafortunados son más comunes en los meses de verano. Los tres pasos más críticos, sin embargo, para inducir con éxito DED en conejos son: 1) el uso hábil de imágenes estadounidenses para identificar el ILG y para dirigir y confirmar la inyección de Con A; 2) asegurar la inyección tanto del ILG como de las dos partes del SLG; y 3) la asacción fiable y reproducible de los parámetros de DED.
Desarrollar la habilidad experimental requerida no es trivial, pero no debe disuadir a ningún investigador serio. Espere que la curva de aprendizaje se complete en cinco iteraciones. Un sistema de imágenes de los Estados Unidos de calidad razonable es esencial. El reconocimiento de las señas de identidad anatómicas por parte de Estados Unidos es importante, por lo tanto, el investigador debe revisar la anatomía del conejo. La excelente descripción de la anatomía del conejo por Davis25, un clásico, puede ser inmensamente útil. También tenga en cuenta la variación en el tamaño del ILG. El corolario de esto es que el éxito de Con A siempre debe ser confirmado con imágenes de seguimiento. Variaciones en la respuesta a Con A en un grupo de conejos se debe más a menudo a la técnica de inyección (inyección fallida o parcialmente exitosa) o a ignorar la capacidad de los tejidos residuales de la glándula lagrimal para compensar con la sobreproducción de lágrimas. Para aquellos que desean dominar la técnica de inyección, inyectar azul de metileno seguido de una rápida disección anatómica puede ser útil; la visualización se logra si llega a la glándula lagrimal o se derrama sobre los tejidos vecinos. Hasta la fecha, este método de inyección ha sido realizado más de 270 veces por los autores sin una sola complicación.
Decir los cinco parámetros de DED presentados anteriormente puede ser tan complicado como es su determinación en la práctica clínica. Aunque las variaciones circadianas aún no se han documentado formalmente en ninguna de ellas, hay suficiente evidencia de fondo de tales fenómenos en el ojo28 que deben ser ensayadas a la misma hora del día (1 h), especialmente cuando se deben realizar ensayos repetidos y en comparación entre sí. La consistencia en la realización de estos ensayos es esencial. Se requiere un equipo de dos. Cuatro o más investigadores en la misma sala que participan en los ensayos pueden ser disruptivos, dado que algunos pasos requieren un tiempo estricto. La documentación fotográfica adecuada y de alta calidad, donde se indique, es importante.
Este modelo es ideal para estudios de desarrollo de fármacos. El dominio del modelo animal y las técnicas de ensayo aseguraron una excelente reproducibilidad19 de los estudios de eficacia y seguridad.
Este es un enfoque experimental potente porque elimina la variabilidad de confunción de modelos anteriores, ha simplificado el modelo animal y esencialmente estandarizado los cinco parámetros de DED. La aplicación exitosa de este modelo al estudio de un agente terapéutico candidato ha afirmado su utilidad práctica como modelo informativo animal para una enfermedad en necesidad desesperada de agentes novedosos y de una comprensión más profunda de su patogénesis.
Divulgaciones
Los autores no declaran intereses en competencia excepto BR que tiene una posición de capital en Medicon Pharmaceuticals, Inc. y Apis Therapeutics, LLC; y LH, un empleado de Medicon Pharmaceuticals, Inc. con un puesto de capital en Apis Therapeutics, LLC.
Agradecimientos
Todos los estudios en animales se completaron de acuerdo y cumplen con todas las directrices reglamentarias e institucionales pertinentes. Todos los estudios fueron aprobados por la Junta de Revisión Institucional de la Universidad Stony Brook y realizados de acuerdo con la Declaración DE ARVO para el Uso de Animales en Investigación Oftálmica y de La Visión.
Estos estudios fueron apoyados en parte por una subvención de Oportunidades de Investigación Dirigida de la Escuela de Medicina de la Universidad Stony Brook (Número de subvención 1149271-1-82502) y una beca de investigación de Medicon Pharmaceuticals, Inc., Setauket, NY. Los autores agradecen a Michele McTernan por su apoyo editorial.
Materiales
| Name | Company | Catalog Number | Comments |
| 100 mm macro lens | Canon EF 100mm f/2.8L IS USM | 3554B002 | |
| 26 gauge needles (5/8) | Becton Dickinson and Company, Franklin Lakes, NJ | 305115 | Needles for injecting ConA into the lacrimal glands |
| 27 gauge needles (5/8) | Becton Dickinson and Company, Franklin Lakes, NJ | 305921 | Needles for injecting ConA into the lacrimal glands |
| Aceproinj (acepromazine) | Henry Schein Animal Health, Dublin, OH | NDC11695-0079-8 | 0.1ml/kg subcutaneously injection for rabbit sedation |
| Anesthesia vaporizer | VetEquip, Pleasanton, CA | Item #911103 | |
| Bishop Harmon Forceps | Bausch and Lomb (Storz), Bridgewater, NJ | E1500-C | Tissue forceps |
| Caliper | Bausch and Lomb (Storz), Bridgewater, NJ | E-2404 | Caliper used to measure length of needle during ConA injection |
| Concanavalin A | Sigma, St. Louis, MO | C2010 | Make 5mg/ml in PBS for injection into rabbit lacrimal glands |
| DSLR camera | Canon EOS 7D DSLR | 3814B004 | Digital single lens reflex camera |
| fluorescein | AKRON, Lake Forest, IL | NDC17478-253 | Dilute to 0.2% with PBS to measure TBUT |
| Isoflurane | Henry Schein, Melville, NY | 29405 | |
| Lactoferrin ELISA kit | MyBiosource, San Diego, CA | MBS032049 | Measure tear lactoferrin level |
| lidocaine | Sigma, St. Louis, MO | L5647 | 1% in PBS for anesthesia agent |
| macro/ring flash | Canon Macro Ring Lite MR-14EXII | 9389B002AA | |
| Osmolarity tips | TearLab Corp., San Diego, CA | #100003 REV R | Measure tear osmolarity |
| PBS (phosphate buffered saline) | Mediatech, Inc. Manassas, VA | 21-031-CV | |
| Rabbit, New Zealand White or Dutch Belted (as described in text) | Charles River Labs, Waltham, MA | 2-3 kg | Research animals |
| Rose Bengal | Amcon Laboratories Inc., St. Louis, MO | NDC51801-004-40 | 1% in PBS, stain the ocular surface |
| Schirmer strips | Eaglevision, Katena products. Denville, NJ | AX13613 | Measure tear production |
| Surgical Loupes +1.50 | Designs for Vision, Bohemia, NY | Specialty item | Provide magnificantion of ocular surface while observing tear break up and performing Concanavalin A injections. |
| TearLab Osmometer | TearLab Corp., San Diego, CA | Model #200000W REV A | Measure tear osmolarity |
| Ultrasound probe | VisualSonics Toronto, Ont | MX 550 S | Untrasonography-guide Con A injection for inferior lacrimal gland |
Referencias
- Paulsen, A. J., et al. Dry eye in the Beaver Dam Offspring Study: prevalence, risk factors, and health-related quality of life. American Journal of Ophthalmology. 157 (4), 799-806 (2014).
- Vehof, J., Kozareva, D., Hysi, P. G., Hammond, C. J. Prevalence and risk factors of dry eye disease in a British female cohort. British Journal of Ophthalmology. 98 (12), 1712-1717 (2014).
- Tan, L. L., Morgan, P., Cai, Z. Q., Straughan, R. A. Prevalence of and risk factors for symptomatic dry eye disease in Singapore. Clinical and Experimental Optometry. 98 (1), 45-53 (2015).
- Craig, J. P., et al. TFOS DEWS II Report Executive Summary. The Ocular Surface. 15 (4), 802-812 (2017).
- Baudouin, C., et al. Clinical impact of inflammation in dry eye disease: proceedings of the ODISSEY group meeting. Acta Ophthalmologica (Copenhagen). 96 (2), 111-119 (2018).
- Calonge, M., et al. Dry eye disease as an inflammatory disorder. Ocular Immunology and Inflammation. 18 (4), 244-253 (2010).
- Pflugfelder, S. C., de Paiva, C. S. The Pathophysiology of Dry Eye Disease: What We Know and Future Directions for Research. Ophthalmology. 124 (11S), S4-S13 (2017).
- Buckley, R. J. Assessment and management of dry eye disease. Eye (London, England). 32 (2), 200-203 (2018).
- Clayton, J. A. Dry Eye. New England Journal of Medicine. 378 (23), 2212-2223 (2018).
- Barabino, S. Animal models of dry eye. Archivos de la Sociedad Española de Oftalmología. 80 (12), 695-696 (2005).
- Stern, M. E., Pflugfelder, S. C. What We Have Learned From Animal Models of Dry Eye. International Ophthalmology Clinics. 57 (2), 109-118 (2017).
- Chen, Z. Y., Liang, Q. F., Yu, G. Y. Establishment of a rabbit model for keratoconjunctivitis sicca. Cornea. 30 (9), 1024-1029 (2011).
- Gilbard, J. P., Rossi, S. R., Gray, K. L. A new rabbit model for keratoconjunctivitis sicca. Investigative Ophthalmology & Visual Science. 28 (2), 225-228 (1987).
- Guo, Z., et al. Autologous lacrimal-lymphoid mixed-cell reactions induce dacryoadenitis in rabbits. Experimenal Eye Research. 71 (1), 23-31 (2000).
- Burgalassi, S., Panichi, L., Chetoni, P., Saettone, M. F., Boldrini, E. Development of a simple dry eye model in the albino rabbit and evaluation of some tear substitutes. Ophthalmic Research. 31 (3), 229-235 (1999).
- Xiong, C., et al. A rabbit dry eye model induced by topical medication of a preservative benzalkonium chloride. Investigative Ophthalmology & Visual Science. 49 (5), 1850-1856 (2008).
- Heymann, F., Hamesch, K., Weiskirchen, R., Tacke, F. The concanavalin A model of acute hepatitis in mice. Lab Animal. 49 (1 Suppl), 12-20 (2015).
- Nagelhout, T. J., Gamache, D. A., Roberts, L., Brady, M. T., Yanni, J. M. Preservation of tear film integrity and inhibition of corneal injury by dexamethasone in a rabbit model of lacrimal gland inflammation-induced dry eye. Journal of Ocular Pharmacology and Therapeutics. 21 (2), 139-148 (2005).
- Honkanen, R. A., Huang, L., Xie, G., Rigas, B. Phosphosulindac is efficacious in an improved concanavalin A-based rabbit model of chronic dry eye disease. Translational Research. 198, 58-72 (2018).
- Huang, L., et al. The novel phospho-non-steroidal anti-inflammatory drugs, OXT-328, MDC-22 and MDC-917, inhibit adjuvant-induced arthritis in rats. British Journal of Pharmacology. 162 (7), 1521-1533 (2011).
- Mattheolabakis, G., et al. Topically applied phospho-sulindac hydrogel is efficacious and safe in the treatment of experimental arthritis in rats. Pharmaceutical Research. 30 (6), 1471-1482 (2013).
- Osmalek, T., Froelich, A., Tasarek, S. Application of gellan gum in pharmacy and medicine. International Journal of Pharmaceutics. 466 (1-2), 328-340 (2014).
- Lemp, M. A. Report of the National Eye Institute/Industry workshop on Clinical Trials in Dry Eyes. Contact Lens Association of Ophthalmologists Journal. 21 (4), 221-232 (1995).
- Dal Piaz, F., Braca, A., Belisario, M. A., De Tommasi, N. Thioredoxin system modulation by plant and fungal secondary metabolites. Current Medicinal Chemistry. 17 (5), 479-494 (2010).
- Davis, F. A. The Anatomy and Histology of the Eye and Orbit of the Rabbit. Transactions of the American Ophthalmological Society. 27, 402-441 (1929).
- Lima, L., Lange, R. R., Turner-Giannico, A., Montiani-Ferreira, F. Evaluation of standardized endodontic paper point tear test in New Zealand white rabbits and comparison between corneal sensitivity followed tear tests. Veterinary Ophthalmology. 18 (Suppl 1), 119-124 (2015).
- Zheng, W., et al. Therapeutic efficacy of fibroblast growth factor 10 in a rabbit model of dry eye. Mol Med Report. 12 (5), 7344-7350 (2015).
- Wiechmann, A. F., Summers, J. A. Circadian rhythms in the eye: the physiological significance of melatonin receptors in ocular tissues. Progress in Retinal and Eye Research. 27 (2), 137-160 (2008).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados