Method Article
Кролик Модель Aqueous-дефицитных сухих заболеваний глаз индуцированных Concanavalin инъекции в Lacrimal Glands: Применение к наркотикам эффективности исследований
В этой статье
Резюме
Эта статья описывает развитие метода для того чтобы навести акутовую или хроническую сухую болезнь глаза в кроликах путем впрыскивать concanavalin a к всем частям орбитальной системы lacrimal железы. Этот метод, превосходящий уже сообщенные, генерирует воспроизводимую, стабильную модель сухого глаза, подходящую для изучения фармакологических агентов.
Аннотация
Сухие заболевания глаз (DED), многофакторное воспалительное заболевание глазной поверхности, поражает 1 из 6 людей во всем мире с ошеломляющими последствиями для качества жизни и расходов на здравоохранение. Отсутствие информативных моделей животных, которые резюмируют его ключевые особенности препятствует поиску новых терапевтических агентов для DED. Доступные модели DED животных имеют ограниченную воспроизводимость и эффективность. Модель представлена здесь, в которой DED индуцируется путем введения mitogen concanavalin A (Con A) в орбитальные лакримальные железы кроликов. Инновационными аспектами этой модели являются использование ультразвукового (американского) руководства для обеспечения оптимального и воспроизводимого впрыска Con A в нижнюю лакримальную железу; инъекция Con A во все орбитальные лакримальные железы, что ограничивает компенсационное производство слез; и использование периодических повторных инъекций Con A, которые продлевают состояние DED по своей воле. DED и его ответ на испытательные агенты контролируются с помощью панели параметров, которые оценивают слезоточивую продукцию, стабильность слезной пленки, а также состояние роговицы и конъюнктивальной слизистой оболочки. Они включают слезную осмограритность, время разрыва слезы, слезоточивый тест Ширмера, розовая бенгальская окрашивание, и слезоточивый уровень лактоферрин. Подробно описана индукция DED и мониторинг его параметров. Эта модель проста, надежна, воспроизводима и информативна. Эта модель животного подходит для изучения физиологии слез и патофизиологии DED, а также для оценки эффективности и безопасности агентов-кандидатов для лечения DED.
Введение
Сухое заболевание глаз (DED) является хроническим заболеванием с высокой распространенностью и заболеваемостью1,2,3,4. Воспаление играет ключевую роль в его патогенеза5,6. Патофизиология DED концептуально, как производные от либо недопроизводства или чрезмерного испарения слез; первый также известен как aqueous-дефицит DED7. Синдром Шегрена, широко изученная прототипная причина DED, влияет в первую очередь на лакримальные железы (ЛГ) и является ярким примером их важности в патогенеза DED. DED часто лечится искусственными слезами, которые обеспечивают временное облегчение, или с циклоспорином или лифитеграстом, оба из которых подавляют воспаление глаз. Ни один из доступных методов лечения DED являются оптимальными, что требует разработки новых агентов8,9.
Поиску новых терапевтических агентов для DED препятствуют три основные проблемы: отсутствие признанной молекулярной цели, которая может быть неуловимой, учитывая патофизиологическую сложность DED; редкость перспективных агентов; и отсутствие моделей животных, которые резюмируют ключевые особенности DED.
Как и в большинстве усилий по разработке лекарственных средств, информативные модели животных DED являются важнейшим инструментом расследования, несмотря на аксиоматическое заявление о том, что ни одна модель животных полностью не перечняет болезнь человека. Мыши, крысы, и кролика модели DED являются наиболее часто используемыми в то время как собаки и приматы используются нечасто10,11. Большинство из более чем 12 кролика DED модели сообщили на сегодняшний день попытка сократить производство слез либо удаление LGs или препятствуя их функции12,13,14,15,16. Такие подходы включают хирургическую резекцию ILG; закрытие выделительного протока; и ухудшает функцию LG путем облучения или инъекции одного из следующих: активированных лимфоцитов, митогенов, ботулинического токсина, атропина или бензалклония. Основными ограничениями этих методов являются их непоследовательность и частое частичное подавление слезоточивого производства.
Конкананавалин A (Con A), лектин растительного происхождения, является мощным стимулятором Т-клеточных подмножеств и был использован в экспериментальных моделях гепатита17 и DED18. Сообщалось, что оригинальная модель на основе Con A дает значительные преимущества, включая ее относительную простоту; приток воспалительных клеток в ЛГ, имитируя такие заболевания, как УСГ; стимуляция провоспалительных цитокинов ИЛ-1, Ил-8 и TGF-No1; снижение функции слезы контролируется путем измерения слезоточивый флуоресцеин клиренс и время разрыва слезы (TBUT); и отзывчивость препарата, показанная при противовоспалительном кортикостероиде.
Когда этот перспективный метод был применен, в дополнение к его преимуществам были выявлены ограничения, которые потребовали его общего пересмотра и резкого улучшения. Задокументированы три критических недостатка метода. Во-первых, модель была острой; индуцированных DED утихла примерно через 1 неделю. Во-вторых, реакция животных была непоследовательной. Как показано на примере ,слепых" транскожных инъекций inferior LG (ILG), Con A доставлялся лишь случайным образом в целевую железу. Детальное изучение анатомии ILG показало, что ее размер может варьироваться в 4 раза19 решений таких инъекций "хит-или-мисс" усилия. Наконец, даже когда ILG был введен, превосходный LG (SLG) часто компенсировал снижение потока слез, что делает модель проблематичной.
Эти ключевые ограничения были преодолены путем введения трех модификаций метода, создавая превосходную модель животных DED. Во-первых, инъекция Con A в ILG была выполнена под ультразвуковым руководством (США), гарантируя, что Con A вошел в железу. Успех инъекции был подтвержден получением после инъекции изображения США, как показано на рисунке 1. Во-вторых, для удаления компенсационного слезы вклад SLG, как palpebral и орбитальных частей этой железы были введены с Con A. Наконец, эта острая модель DED была преобразована в хроническую путем повторных инъекций Con A каждые 7-10 дней. DED 2 месяцев продолжительность легко достигается в этих кроликов. Успех этого подхода был в значительной степени документально19.
Как уже упоминалось, важным применением животных моделей DED является определение эффективности и безопасности кандидатов терапевтических агентов. Полезность этой модели была продемонстрирована изучением фосфосулиндака (OXT-328), новой противовоспалительной малой молекулы20,21 вводят в качестве глазных капель. Его эффективность была продемонстрирована на основе панели параметров DED19. Относительная простота и информативный характер этой модели также позволили бок о бок сравнение фосфосулиндак два FDA утвержденных препаратов для DED, циклоспорина и lifitegrast, демонстрируя свое сильное доклиническое превосходство.
протокол
Все исследования на животных были одобрены Институциональным наблюдательным советом Университета Стоуни-Брук и проведены в соответствии с Заявлением ARVO об использовании животных в исследованиях офтальмологических и дальнохих исследований.
1. Животные и жилье
- Приобретите новозеландских белых кроликов весом 2-3 кг.
- Дом кроликов поговоли в клетках со строгой температурой (65 и 5 градусов по Фаренгейту) и влажностью (45 х 5%) Управления. Освещение должно иметь цикл включаемых/выключенных в 12 ч.
- Обеспечить неограниченный доступ к воде и стандартный кролик чау. Устраните диетические обогащения, поскольку они могут содержать витамин А, который влияет на глаз.
- Акклиматизировать животных, по крайней мере 2 недели до базовых мер или индукции сухого глаза.
2. Методы анестезии и эвтаназии
ПРИМЕЧАНИЕ: Все процедуры требуют мягкой седации, за исключением инъекции Con A, которая требует умеренной седации.
- Для мягкой седации, вводить ацепромазин (1 мг/кг) подкожно над плечами с помощью 26-калиберной иглы. Конечная точка для мягкой седации: животные поддерживают расслабленное положение головы с мочками уха больше не полностью вертикально.
ПРИМЕЧАНИЕ: Если соответствующая конечная точка не достигнута, может быть введена дополнительная инъекция ацепромазина. Звери должны всегда бодрствовать, реагировать на прикосновение к усы, и никогда не показывать замедленное дыхание. - Для умеренной седации, сначала дать животным ацепромазин, как указано выше. После конечной точки достигается (см. примечание выше), дать изофлуран с помощью противогаза с O2 потока установлен на 1 л / мин и изофлуран доставки установить до 5%(Рисунок 2).
- Администрирование изофлуран до тех пор, пока тон тела кролика полностью расслаблен и уши полностью дискеты.
ПРИМЕЧАНИЕ: Никакие компенсационные движения мышц не должны происходить, когда животное включено на бок; дыхание всегда остается спонтанным. - Спонтанное восстановление происходит в течение 2-5 минут: признаки включают спонтанные движения головы и повышенный или нормальный мышечный тонус. После того, как экспериментальная процедура завершается умеренной седляцией, наблюдайте за кроликами около 30 мин или до тех пор, пока их поведение не нормализуется.
ПРИМЕЧАНИЕ: Офтальмологическая мазь не требуется во время любой формы седативных. 1) В мягкой седаации, животные по-прежнему оповещения и поддерживать рефлекс мигать. При умеренной седации ингибирование рефлекса мига настолько короток, что глазная поверхность не находится под угрозой. 2) Размещение офтальмологических мазей на глазной поверхности исключает визуализацию структур, оцененных в ходе тестирования. - Эвтаназия: Используйте передозировку внутривенного пентобарбитала (100 мг/кг).
3. Удаление nictitating мембраны
- Выполните удаление в период акклиматизации (обычно в первую неделю), чтобы обеспечить полную и точную оценку роговицы.
-
Инъекция в правой nictitating мембраны
ПРИМЕЧАНИЕ: Если nictitating мембраны обоих глаз должен быть удален, это просто сделать это в один сеанс. Начните с одного глаза и продолжить, как описано. Для ясности описания, этот метод начинается с правого глаза.- Поместите кролика в соответствующий размер удерживающей сумке.
- Индуцировать мягкое седава, как описано в шаге 2.1.
- Нанесите 25 л лидокаина без консервантов на правый глаз с помощью микропипети.
- Поместите гибкую проволочную крышку speculum между веками.
- Используя 0,3 щипцы (или эквивалент), схватить nictitating мембраны на вершине и расширить его над роговицей.
- Впрыск лидокаин 1% с 1:100,000 эпинефрина субконъюнктивально в основание nictitating мембраны с помощью 26-калиберной острой иглы (Рисунок 3A). Умеренный bleb должен сформировать над nictitating мембраной.
- Удалите спектрум.
- Выполните идентичную инъекцию левой nictitating мембраны.
-
Резка nictitating мембраны
- Примерно через 5 минут поместите крышку спекулум обратно в правый глаз. Схватите и убирайте nictitating мембрану на своем вершине используя 0.3 щипцы (или подобное).
- Отрежьте nictitating мембрану на своей базе используя ножницы Westcott или эквивалент(рисунок 3B).
ПРИМЕЧАНИЕ: Кровотечение является минимальным и, как правило, не требуют каутерии. Тем не менее, высокотемпературная катерия батареи всегда держится рядом на случай, если потребуется дополнительный гемостаз. - Удалите спектрум.
- Поместите на глаз актуальные антибиотики (например, неомицин, полимиксин, бацитрацин и гидрокортизон).
- Оставьте Хардериан железу нетронутой. Хардерская железа иногда видна, когда nictitating мембраны убирается.
ПРИМЕЧАНИЕ: Если большая белая масса или высота ткани рассматривается в носовой или превосходной субконъюнктивальной области после nictitating мембраны удаляется, мембрана была resected слишком близко к своей базе позволяет Хардерелианской железы спонтанно выпадение. Чтобы предотвратить это в последующих процедурах, оставьте больше nictitating мембраны на базе. - Разрешить глазной поверхности, чтобы исцелить, по крайней мере 1 неделю до дальнейших манипуляций или глазной поверхности анализы выполняются.
4. Измерение параметров сухого глаза и сбор проб слез
ПРИМЕЧАНИЕ: Измерение параметров DED на основе потребностей протокола исследования (например, на базовом уровне и указанных временных точках после этого). Измерения для DED должны быть сделаны в следующем заказе, с пристойными усилием верно воспроизвести их each time. Проверьте всех животных примерно в одно и то же время суток (1 ч), чтобы свести к минимуму циркадные вариации. Эти измерения обычно требуют команды из двух следователей.
- Поместите кролика в удерживающую сумку. Вызвать легкое успокание.
- Слеза Осмоларити22
- Вручную мигает веки 5-10 раз, чтобы равномерно распределить слезоточивый слой по глазной поверхности.
- Аккуратно утяните нижнюю крышку.
- Образец слезы с Осмометром TearLab на стыке palpebral и bulbar конъюнктивы вдоль нижней fornix, просто задний к основанию усеченной nictitating мембраны.
- Измерьте осмоляритность с помощью теста осмолярности TearLab в соответствии с инструкциями производителя.
- Время разрыва слезы (TBUT)
- Темнее комнату для этого асссея.
- Поместите проводной крышкой speculum между веками.
- Нанесите на поверхность роговицы флуоресцеин на 50 л флуоресцеина на 0,2% с помощью микропипетта. Если даже распределение флуоресцеина над роговицей не получено с первой капли, поместите вторую каплю.
- Немедленно запустите таймер.
- Наблюдайте за пленкой слезы до роговицы под синим светом. TBUT определяется как время, затрачаемое на разработку черных точек, линий или очевидное нарушение флуоресцеина(рисунок 4). При необходимости используйте хирургические лупы, которые обеспечивают увеличение на 1,50 евро, чтобы лучше визуализировать ранние признаки распада. Монитор до 1 мин; если распад, как определено здесь происходит после 1 мин, запись TBUT всего за 60 с.
- Слезоточивый тест Ширмера (STT)
- Нанесите на глазную поверхность каплю лидокаина без консервантов на 25 л.
- Поместите Weck клетки хирургического копья в нижней fornix поглощать остаточный лидокаин и любой слезной жидкости. При необходимости используйте нижнее веко, чтобы покрыть проксимальный конец губки, чтобы помочь сохранить его на месте(Рисунок 5А).
- Примерно через 30 с удалите губку Weck.
- Немедленно вставьте слезную тест-полоску Ширмера в пространство между роговицой и бледно-брюдальной конъюнктивы в середине точки нижней крышки.
- Немедленно запустите таймер(рисунок 5B).
- Через 5 минут измерьте длину увлажненной части полосы; это значение STT.
- Выполняйте измерения в тройном и сообщите среднее значение 3 чтения как значение STT.
- Сбор образцов слез
- Для сбора слезных образцов для оценки уровней различных аналитов в них, таких как лактоферрин, после того, как значение STT регистрируется на 5 мин, оставьте полосу на месте до тех пор, пока смачивание не менее 20 мм не будет получено.
ПРИМЕЧАНИЕ: Если адекватное смачивание не происходит после DED был индуцирован, заранее полосы глубже в нижней fornix, чтобы помочь достичь этой точки в разумные сроки. - Вырезать увлажненной полосы и место сразу в 490 л охлажденного слеза Коллекция буфера (4% BSA, 1M NaCl, 0,1% Tween-20 в PBS с протеиназовый ингибитор коктейль).
- Храните образцы на льду до тех пор, пока они не будут храниться при -80 градусов по Цельсию, где они должны оставаться до тех пор, пока они не будут опрокидыны.
- Для сбора слезных образцов для оценки уровней различных аналитов в них, таких как лактоферрин, после того, как значение STT регистрируется на 5 мин, оставьте полосу на месте до тех пор, пока смачивание не менее 20 мм не будет получено.
- Роза Бенгалия Окрашивание (RBS)
- Нанесите 50 л 1% лидокаина без консервантов на роговицу с помощью микропипетки.
- После 30 с, место 25 л 1% розы бенгали на глазной поверхности и вручную мигать веком, чтобы распределить его равномерно.
- Немедленно запустите таймер.
- На 3,5 мин, поместите проволоки крышкой speculum между крышками.
- На 4,0 мин, сфотографировать превосходную конъюнктивальную и роговицу поверхности(рисунок 6).
ПРИМЕЧАНИЕ: Отрегулируйте тип используемой камеры. Типичные настройки: цифровая однолинзовая рефлекторная камера, режим приоритета диафрагмы (апертура 13 и больше), ISO 6000, 100-мм макрообъектив, присоединенный с двумя 12,5-мм удлинителями, ручной режим фокусировки, объектив при максимальном увеличении и освещение от макро-кольца flash set to automatic с помощью режима объектива. Лампа фокуса вспышки кольца включена, чтобы помочь сосредоточиться на роговице. - Заполните все фотографии для обоих глаз в течение 1 мин.
- Оценка окулярной поверхности окрашивания с помощью метода NEI23 изменены следующимобразом. Не класс 6 отдельных конъюнктивных зон. Оценка превосходной конъюнктивы каждого глаза. Это часть конъюнктивной поверхности, легко сфотографированной без манипулирования земного шара. Манипуляция может артефactuallyично изменить окрашивание глазной поверхности.
- Уровни слезоточивого лактоферрина являются суррогатной мерой производства слез из лакримальных желез. Анализ слезы лактоферрин в слезах собраны, как выше, с помощью фермента связанных иммуносорбент анализ24 комплект аудит следуя инструкциям производителя.
5. Индукция и лечение сухого глаза
ПРИМЕЧАНИЕ: Вводятся три части орбитальной системы лакримальной железы.
- Успокоите кроликов с ацепромазином 0,2 мг/кг подкожно.
- Стрижьте мех в периорбитальной и области кожи головы и полностью удалить любой остаточный мех с помощью Nair. Оставьте кожу полностью гладкой для лучшей визуализации анатомических признаков и инъекции конкановалина А на us(рисунок 7).
- Индуцировать умеренное седава, как описано выше.
- Инъекция пальпебраальной части верхней лакримальной железы (PSLG)
ПРИМЕЧАНИЕ: Выполните инъекции PSLG в первую очередь.- Нанесите на соответствующий глаз 25 л лидокаина без консерванта 1% с помощью микропипетта.
- Эверт верхнего века и применять нежное медиальное давление на задний орбитальный обод, пока выступ маркировки palpebral часть железы видно. PSLG появляется как небольшая луковичная высота в задней (временной) части верхней крышки.
ПРИМЕЧАНИЕ: Для просмотра ткани железы во время учебного процесса, применять 5% флуоресцеина в области(рисунок 8A). Слезы можно увидеть потокового из луковичные PSLG. Применение флуоресцеина не требуется для администрирования Con A; это делается только для иллюстрации целей, чтобы показать ткани железы. - Используя мелкозубые щипцы и 27-калиберную иглу на туберкулинашном шприцах, непосредственно проникают в железу с помощью трансконъюнктивного подхода. Предварительный иглы 2 мм в ткани и ввести 500 мкг Con A в объеме 0,1 мл(рисунок 8B).
ПРИМЕЧАНИЕ: Эта инъекция иногда может быть болезненным. При необходимости держите животных под изофлураном до тех пор, пока эта инъекция не будет завершена.
- Инъекция орбитальной верхней лакримальной железы (OSLG)
ПРИМЕЧАНИЕ: OSLG следует в быстрой последовательности.- Примените медиальное давление на земной шар, заставляя OSLG выступать из заднего зазора (см. реф25 для анатомии, если это необходимо). Применить медиальное давление на глобус(Рисунок 9, красная стрелка) с выступом OSLG от заднего инспектировать. Выступ служит валовой локализации, чтобы найти заднюю застрахование.
- Используйте изогнутые щипцвыстые с наконечниками закрыты для отступа области до костлявого открытия в черепе ощущается. Это будет щель, как с передней / задней направлении под выступом.
- Применить скромное давление с щипками, чтобы оставить отступ в коже, которая будет служить ориентиром для размещения иглы(рисунок 10A).
- Вставьте иглу (трубакулиновый шприц с 27-калиберной, 5/8-дюймовой иглой) перпендикулярно коже над отступным знаком(рисунок 10B) - 1/4 дюйма в застрахование, затем перенаправите иглу задним и внешней стороной боковой канис, направленный на середину между местом инъекции и костляным орбитальным ободом.
ПРИМЕЧАНИЕ: Если страх не точно ориентированы с иглой, череп блокирует его продвижение. - Как только концентратор иглы достигнут, медленно впрысните 1000 мкг Con A в объеме 0,2 мл(рисунок 10C).
- Завершите инъекцию как PSLG, так и OSLG в течение 2-3 минут.
- Удалить животное из изофлуран седативных (если еще не сделано). Инъекция нижней лакримальной железы (ILG) обычно может быть завершена без дальнейшего седации.
- Инъекция нижней лакримальной железы
- Вид на животное со стороны. Значение ILG можно увидеть вдоль нижней передней части орбиты(рисунок 11A).
- Нарисуйте вертикальную линию с помощью хирургической герметичной ручки или подходящего перманентного маркера на коже, где поверхностная часть железы ILG переходит от ее поверхностного (более внешнего) места отдыха на зигоматической кости к ее более медийному расположению на орбите. Это, как правило, уступает передней неопределенности(рисунок 11A).
- Определите конец зигоматической кости, подметая вертикально удерживаемый американский зонд через эту линию на коже. Переход ILG происходит там, где изображение железы меняется от четко ограниченной (гиперехоическая линия зигоматической кости видна вдоль нижнего края железы на изображении) к тому, что без узнаваемой медиальной границы (зигоматического костного эха больше нет, рисунок 1).
- Обратите внимание на относительное положение руки кусок к линии обращается на коже, когда экран США показывает это изменение. Это "инъекция сайт", где Con A должны быть даны.
- Контролируйте глубину инъекций, чтобы поместить Con A в железу в точке просто медиальной к зигоматической арочной кости.
- Определите глубину инъекции следующим образом: Установите нужную глубину инъекции как глубину зигоматической кости (гиперехотический сигнал) плюс 1 мм. Вычтите это значение из известной длины иглы (15 мм в этом примере).
- Вставьте иглу в железу на "место инъекции" 12 мм, затем медленно снять его до тех пор, пока длина открытой иглы вне тела (измеряется хирургическими калибровки) равна разнице рассчитывается в 5.8.6 (Рисунок 12). Впрыск100 мкг Con A в 0,2 мл.
ПРИМЕЧАНИЕ: Для того, чтобы капсула железы прокалывалась, а не просто толкнул иглой, игла должна быть вставлена 12 мм или почти в концентратор до начала ее вывода. - Повторите США, чтобы подтвердить успех инъекции. ILG должен показать характерное гипоехотическое пространство(рисунок 1).
ПРИМЕЧАНИЕ: Инъекция ILG является одним лучше всего переносится животных26 и, следовательно, сделано в последнюю сторону.
- Завершите всю процедуру, чтобы ввести все железы обоих глаз в течение 10 минут. Это потребует достижения компетентности в процедуре.
ПРИМЕЧАНИЕ: Один набор инъекций в 2 орбитальных лакримальных желез вызовет острый DED продолжительностью 1-2 недели. - Для DED более длительной продолжительности, вводить Con точно как выше каждые 7 дней. Успешно выполнено до 6 таких инъекций.
6. Постпроцедурный уход
- После инъекции Con A, контролировать животных в их сдерживающих мешках, по крайней мере 10-20 мин, или до анестезии эффект стирается.
- Не оставляйте животных без присмотра, пока они не пришли в себя достаточно еде для поддержания строгого recumbency. Не возвращайте их в свои отдельные клетки, пока они полностью не выздоровеют.
- Пост-процедурная боль, как правило, мягкая и длится менее 48 ч. Оцените боль с кроличьим гримасой. При необходимости дайте одну дозу подкожного кеторолака (5 мг/кг). Для более сильной боли, дать подкожный бупренорфин 0,1 мг/кг каждые 8 ч.
Результаты
Con инъекции индуцированных сильной воспалительной реакции в лакримальных желез характеризуется плотной лимфоцитарной инфильтра(рисунок 13), сопровождается снижением производства слезы. Все параметры разрыва были заметно изменены(таблица 1 и таблица 2). Кроме того, были подавлены уровни слезоточивого лактоферрина (контроль ный и 3,1 х 0,45 против впрыскиваемого Кон-А 2,7 х 0,02 нг/мг белка (средний - SEM); p'lt;0.03). Конечным результатом был скомпрометирован роговицы и конъюнктивальных эпителия, о чем свидетельствует увеличение розы бенгальского окрашивания(рисунок 6).
Инъекции трех орбитальных тканей LG произвели последовательное и равномерное состояние DED в отличие от состояний, достигнутых предыдущими методами18,27. Ключевыми факторами, способствующими этому результату, были инъекция ILG в США и инъекция OSLG. В таблице 1 кратко излагаются основные результаты этого метода. Все изменения согласуются с тяжелым DED.
Один набор инъекций Con A производит DED продолжительностью около 1 недели; все клинические параметры нормализуют к 10-му дню(таблица 2). Последовательные Инъекции Con около 1 недели друг от друга продлить продолжительность DED соответственно. Например, второй набор инъекций Con A на 7-й день поддерживает DED в течение 2 недель и так далее. После примерно 5 наборов инъекций, состояние DED часто становится постоянным без необходимости дальнейших инъекций.
Когда кролики с Con-индуцированной DED были обработаны с новым агентом фосфосулиндак, он заметно подавил болезнь. Например, после лечения за неделю с этим агентом TBUT заметно увеличилось по сравнению с транспортными животными (43,6 х 4,0 против 12,2 х 2,8 с; стр.л.;0.001; среднее SEM соответственно, для этих и следующих значений), в то время как слеза osmolarity была нормализована (294'4.6 против 311'2.0m/l, p.2). Механически фосфосулиндак снизил уровень двух важнейших интерлейкинов, ИЛ-1з (8,4 х 1,2 против 21,2 х 6,6 пг/мг белка; p'lt;0.03) и IL-8 (4,9 х 1,7 против13,5 х 5,0 пг/м белка; стр.0; 0.05)
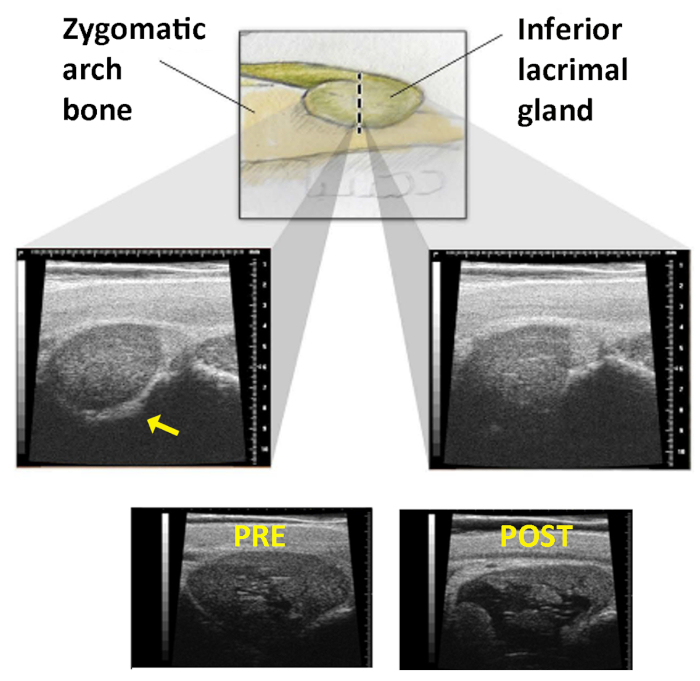
Рисунок 1: Ультразвуковое изображение нижней лакримальной железы. Верхняя панель: ILG, как она движется глубже по орбите, чтобы лежать под zygomatic арки. Пунктирной линии представляет линию на коже, через которую сша зонд прокатилась. Средние панели: Как ручная часть прокатилась по этой линии, эксперт ищет потерю зигоматического отголоска кости, которая присутствует в левом изображении(стрелка)и исчезает в правой. Нижние панели: Изображения ILG, сделанные до(слева)и после(справа)инъекции Con A. Развитие большого кистозного пространства в железе подтверждает правильную доставку. Перепечатано с разрешения19. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.

Рисунок 2: Седация газовой маски. На этой фотографии показана противогаз, обеспечивающий краткое умеренное успокой с изофлюраном. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
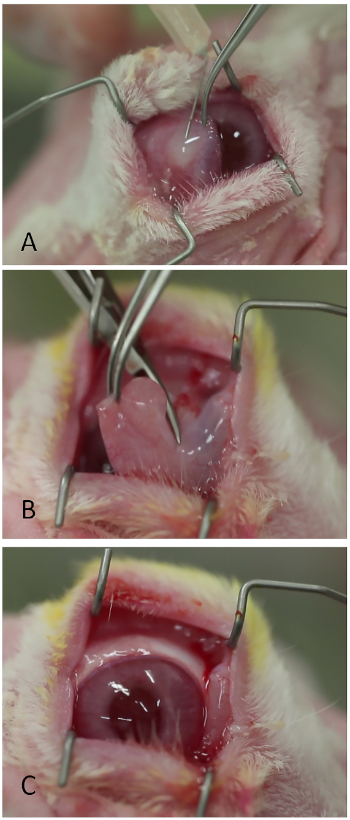
Рисунок 3: Удаление nictitating мембраны. (A) Инъекция лидокаина/эпинефрина. (B) Переплетение nictitating мембраны на его базе с ножницами Westcott. (C) Глазная поверхность визуализируется более легко после удаления nictitating мембраны. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
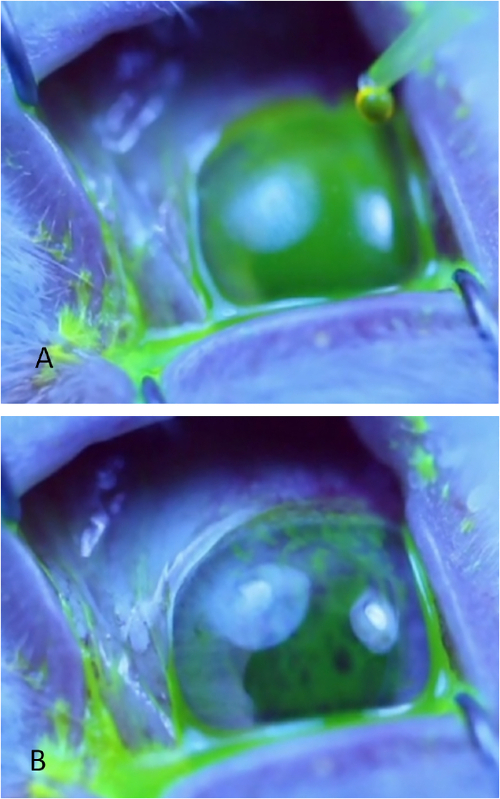
Рисунок 4: Измерение времени разрыва разрыва. (A) Единая зеленая слезная пленка появление поверхности роговицы под синим светом сразу же после применения флуоресцеина капель. (B) Корнальная поверхность, которая уже подверглась заметному распаду, о чем свидетельствуют многочисленные темные круги и линейные полосы флуоресцеина. Время разрыва записывается, как только развивается первое темное пятно или линия. Два светло-голубых круга являются отражением источника света от роговицы. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
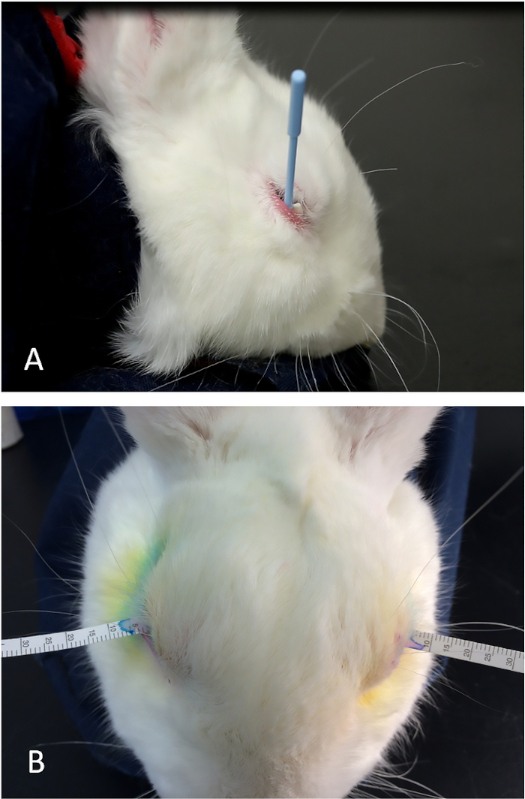
Рисунок 5: слезоточивый тест Ширмера. (A) Правильное размещение Губки Weck-Cel в нижней форникс, чтобы удалить любые остаточные актуальные раствор лидокаина и базовые слезы. Поместив задний край треугольной губки под нижней крышкой края, можно поддерживать очень однородную технику, чтобы высушить глазную поверхность до размещения слезящими полосками. (B) слезоточивая полоса, соответствующим образом помещенная в средней позиции нижней крышки между глобусом и нижней крышкой (палпебральная конъюнктива). Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.

Рисунок 6: Роза бенгальского окрашивания. Верхний: Фотографии поверхности роговицы. Слева: Нет розы бенгальского окрашивания присутствует перед лечением с Con A. Справа: Диффузное роговицы и конъюнктивальная окрашивание наблюдается в верхнем носовом квадранте после инъекции (вверху справа). Нижняя часть: Конъюнктивное впечатление цитологии от верхней конъюнктивы bulbar. Слева: Многочисленные клетки кубок присутствуют перед лечением. Справа: Эпителиальные клетки присутствуют, но клетки кубок отсутствуют после лечения. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.

Рисунок 7: Подготовка кролика для инъекций конкановалина А. (A) Небольшие ножницы используются для удаления меха, что позволяет легче визуализации ориентиров для идентификации орбитальной верхней лакримальной железы. (B) Наир используется для удаления волос, которые остаются после стрижки. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
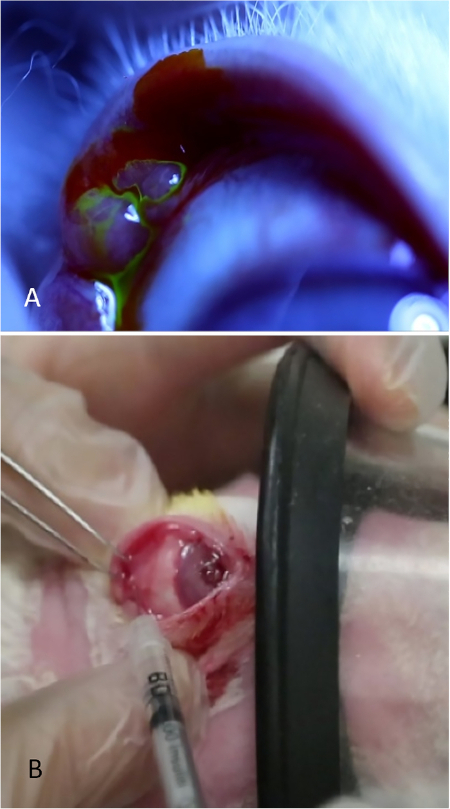
Рисунок 8: Инъекция бледно-лакримальной железы. (A) бледно-лакримальная железа, появляющаяся как луковичная высота в задней височной части верхней крышки. Слезы видны потоковое с поверхности этой железы после применения капли 2% флуоресцеина. (B) Бледная лакримальная железа вводится в то время как кролик получает умеренное успокоительное. Один следователь втягивает веко, оптимизирует экспозицию железы, и обеспечивает маску в то время как второй следователь вводит железу. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.

Рисунок 9: Локализация орбитальной верхней лакримальной железы. Изменения в контурах кожи указывают на расположение OSLG, когда он выступает через задний зазор. Чередование медиального давления на земной шар(большая стрелка)приводит к выпадению верхней орбитальной железы, которая рассматривается как небольшая высота кожи. Эта высота будет увеличиваться в размерах каждый раз, когда давление применяется(маленькие стрелки). Расположение этой железы, как правило, в соответствии с задней орбитальной обода. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
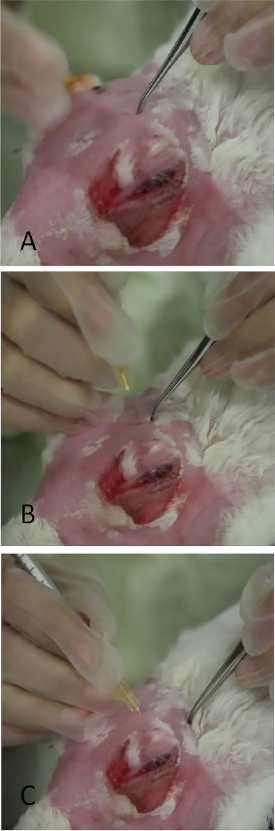
Рисунок 10: Инъекция орбитальной верхней лакримальной железы. (A) Применение мягкого давления на череп с мелкозубыми щипками в области, которая выпотела, как на рисунке 9. Тонкая щель, как отверстие в черепе может быть palpated. Оставляя небольшой отступ знак с щипками значительно способствует размещению иглы во время инъекции. (B) Игла вставляется перпендикулярно через застрахование. Если поместить неправильно, его прохождение останавливаеткостный череп. (C) Игла находится в конечном положении под углом к боковой canthus. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
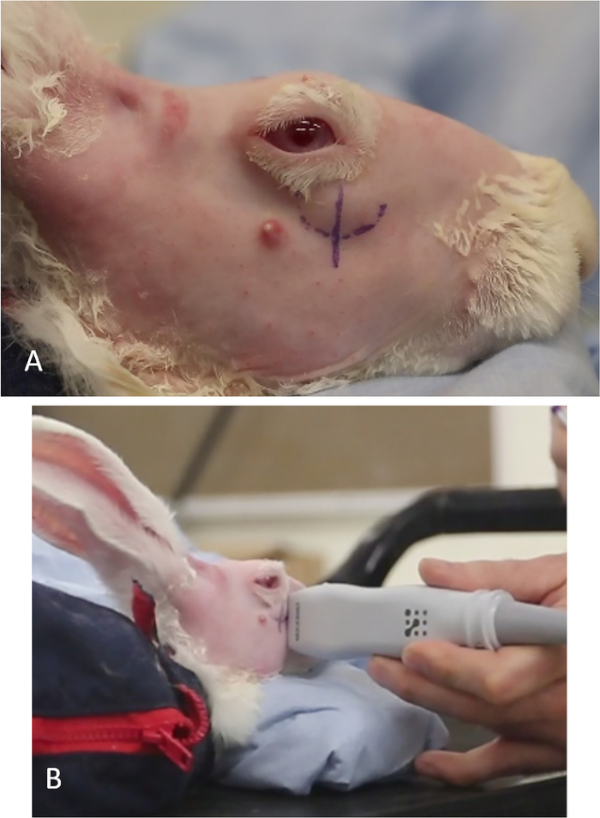
Рисунок 11: Локализация низшей лакримальной железы. (A) Известность поверхностной части ILG видел через нижнюю крышку. Кривилинейная ручка обозначает нижнее положение железы. Вертикальная линия, под носовой лимб, обозначает приблизительное положение, где ILG переходит в более глубокое положение в орбите и служит визуальной ссылкой для США. (B) США ручной части радикальных через область вертикальной линии; американский монитор покажет, где заканчивается зигоматическая кость, где iLG переходит и где должна быть сделана инъекция Con A ("место инъекции"). Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
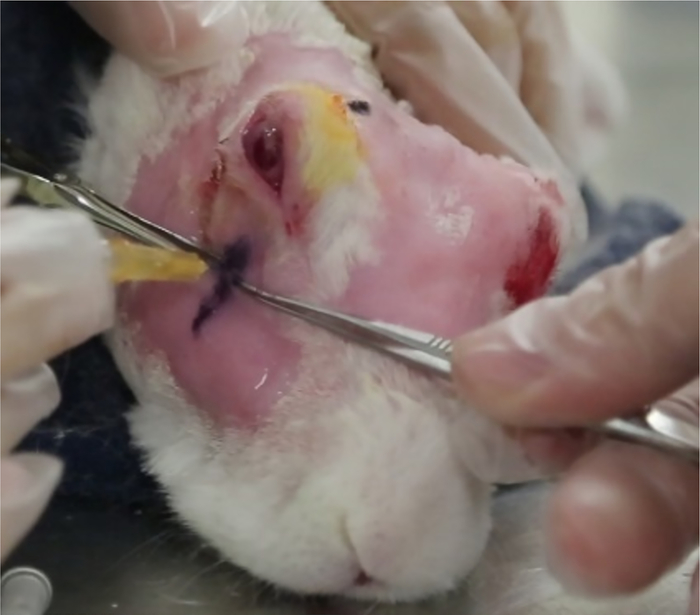
Рисунок 12: Инъекция нижней лакримальной железы. Инъекция ILG осуществляется в месте, указанном США. Глубина инъекции рассчитывается, как описано в тексте (шаг 5.8.6). Калиперы (видимые за иглой) гарантируют, что игла помещается на надлежащую глубину перед инъекцией. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
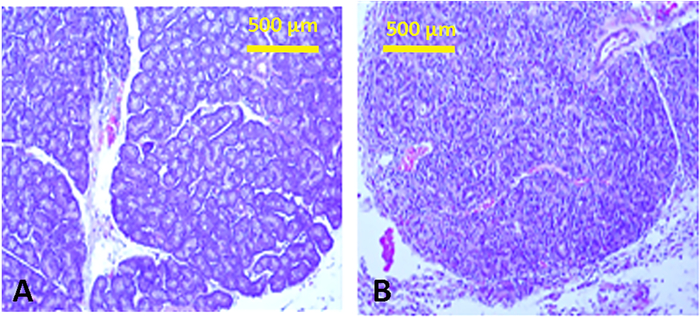
Рисунок 13: Гистология лакримальных желез. Ткань разделы нормальной нижней лакримальной железы с типичной тубуло-альвеолярной структуры (A) и после инъекции Con A (B), показывая отмеченные лимфоцитарные инфильтра с увековечением структуры. Подобные воспалительные инфильтраты наблюдаются в высших лакриальных железах. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
| Метод инъекций | TBUT, сек | Слеза осмолинность, Osm/L | STT, мм | |||
| Базовой линии | После инъекции | Базовой линии | После инъекции | Базовой линии | После инъекции | |
| означает SEM, % изменение | ||||||
| ILG без руководства США | 58,5 и 1,5 | 44,5 и 7,7 | 297 и 4,9 | 300 и 3,8 | 15,2 и 0,9 | 12,9 и 2,2 |
| %изменение | -23% | 1% | -15% | |||
| стр. 0,05 | стр. 0,36 | стр. 0,21 | ||||
| Управляемая США ILG и PSLG | 59,4 и 0,6 | 11,4 и 4,2 | 296 и 4,7 | 326 и 3,7 | 15.1 и 1,3 | 10,7 и 1,8 |
| % изменение | -81% | 10% | -29% | |||
| стр/т;0,0001 | стр/т;0,0001 | стр/т;0,03 | ||||
| Направимая в США ILG - PSLG - OSLG | 60 и 0,0 | 6,2 и 1,3 | 299 х 2,9 | 309 х 2,8 | 14,6 и 0,9 | 9,9 и 1,3 |
| % изменение | -90% | 3% | -32% | |||
| стр/т;0,0001 | стр/т;0,008 | стр/т;0,002 | ||||
| Все значения были измерены на 6-й день после одной инъекции Con A в перечисленные железы. Все сравнения были сделаны с базовым уровнем. «ILG, нижняя лакримальная железа; PSLG, palpebral часть превосходной лакримальной железы; OSLG, орбитальная часть превосходной лакримальной железы; США, УЗИ. | ||||||
Таблица 1: Влияние метода инъекций и количество участков инъекций на сухость глаз.
| Базовой линии | День 6 | День 13 | День 21 | |
| 1 инъекция | 2 инъекции | 3 инъекции | ||
| TBUT, сек | 58,5 и 1,5 | 44,5 и 7,7 | 29,2 и 7,8 | 12,8 и 3,9 |
| % изменение | -24% | -50% | -78% | |
| стр. 0,17 | стр. 0,001 | стр/т;0,0001 | ||
| Тосм, Осм/Л | 297 и 4,9 | 300 и 3,9 | 308 и 4,9 | 313 х 2,7 |
| % изменение | 1% | 4% | 5% | |
| стр. 0,36 | стр. 0,04 | стр. 0,003 | ||
| STT, мм | 15,2 и 0,9 | 9,3 и 1,6 | 12,9 и 1,6 | 7,4 и 1,1 |
| % изменение | -39% | -15% | -51% | |
| стр. 0,17 | стр. 0,13 | стр. 0,008 | ||
| Были проведены сравнения с базовыми. | ||||
Таблица 2: Влияние повторных инъекций Con A в ILG на продолжительность DED.
Обсуждение
Кролики высоки привлекательны для изучения DED. Их роговица и конъюнктива имеют площадь поверхности ближе к области людей по сравнению с мышами и крысами; их дополнение препарата метаболизирующих ферментов, таких как эстеразы, и гистологии их lacrimal желез ы похожи на те из людей, и их глаза достаточно велики для информативных фармакокинетических исследований. По сравнению со свиньями и обезьянами, с которыми они имеют схожие черты, они стоят дешевле и их экспериментальные манипуляции легче. Если рассматривать механистические исследования, то относительный недостаток кролика, по сравнению с мышами, заключается в том, что имеется меньше реагентов (например, моноклональных антител). С другой стороны, кролик намного превосходит мышей для фармакокинетических и биораспределения исследований, потому что отдельные ткани легко расчленяются и достаточного размера для аналитической работы, избегая "образец объединения".
Критическим общим параметром является период акклиматизации кроликов. Эти животные отправляются от поставщика в условиях, которые зачастую не обеспечивают транспортную среду соответствующей температуры или влажности. Некоторые животные, возможно, уже разработали сухой глаз по прибытии. Рекомендуется двухнедельный период акклиматизации. Не менее важно ежесообразное внимание к влажности и температуре пространства, где исследуемые кролики размещаются в виварии. Отклонения в любом состоянии могут вызвать огромные изменения в их состоянии глаз. Иметь резервные увлажнители и обезвоживания под рукой. Если центральная система выходит из строя, действуйте быстро, чтобы восстановить влажность окружающей среды с помощью резервного оборудования. Имейте в виду, что такие неудачные события являются более распространенными в летние месяцы. Три наиболее важных шага, однако, для успешного индуцирования DED у кроликов являются: 1) умелое использование изображений США для идентификации ILG и прямого и подтверждения инъекций Con A; 2) обеспечение инъекций как ILG, так и двух частей SLG; и 3) надежно и воспроизводимо, проявляя параметры DED.
Разработка необходимых экспериментальных навыков не тривиальна, но не должна сдерживать любого серьезного следователя. Ожидайте, что кривая обучения будет завершена в течение пяти итераций. Сша система визуализации разумного качества имеет важное значение. Признание анатомических признаков сша имеет важное значение, поэтому, следователь должен рассмотреть анатомии кролика. Отличное описание анатомии кролика Дэвис25, классика, может быть чрезвычайно полезным. Также имейте в виду изменение размера ILG. Следствием этого является то, что успех Con A всегда должны быть подтверждены с последующей визуализации. Вариации в ответ на Con A в группе кроликов чаще всего из-за техники инъекций (неудачная или частично успешная инъекция) или игнорирования способности остаточных тканей лакримальной железы, чтобы компенсировать перепроизводство слез. Для тех, кто хочет освоить технику инъекций, инъекционные метиленовый синий следуют быстрое анатомическое вскрытие может быть полезным; визуализация достигается, если она достигает лакримальной железы или разливов на соседние ткани. На сегодняшний день этот метод инъекции был выполнен более 270 раз авторами без единого осложнения.
При прояснение пяти параметров DED, представленных выше, может быть столь же сложным, как и их определение в клинической практике. Хотя циркадные вариации еще не были официально задокументированы ни в одном из них, есть достаточно фоновых доказательств таких явлений вглазу 28, что они должны быть показаны в то же время суток (1 ч), особенно когда повторяющиеся анализы должны быть выполнены и по сравнению друг с другом. Последовательность в выполнении этих анализов имеет важное значение. Требуется команда из двух человек. Четыре или более следователей в одной комнате, участвующих в анализможет может быть разрушительным, учитывая, что некоторые шаги требуют строгого времени. Важна соответствующая и качественная фотодокументация, где указано.
Эта модель идеально подходит для исследований по разработке лекарственных средств. Мастерство животной модели и методов анализа обеспечило отличную воспроизводимость19 исследований эффективности и безопасности.
Это мощный экспериментальный подход, поскольку он устраняет запутанную изменчивость предыдущих моделей, упорядочил модель животных и, по сути, стандартизировал асспоме пять параметров DED. Успешное применение этой модели для изучения кандидата терапевтического агента подтвердило свою практическую полезность в качестве информативной модели животных для болезни, отчаянно нуждавшейся в новых агентах и более глубокого понимания его патогенеза.
Раскрытие информации
Авторы заявляют, что не конкурируют интересы, за исключением BR, который имеет позицию акционерного капитала в Medicon Pharmaceuticals, Inc. и Apis Therapeutics, LLC; и LH, сотрудник Medicon Pharmaceuticals, Inc. с позиции акционерного капитала в Apis Therapeutics, LLC.
Благодарности
Все исследования на животных были завершены в соответствии со всеми соответствующими нормативными и институциональными руководящими принципами. Все исследования были одобрены Институциональным наблюдательным советом Университета Стоуни-Брук и проведены в соответствии с заявлением ARVO об использовании животных в офтальмологических исследованиях и исследованиях зрения.
Эти исследования были частично поддержаны целевых научно-исследовательских возможностей гранта от Стоуни Брук университета школы медицины (Грант номер 1149271-1-82502) и научно-исследовательский грант от Medicon Pharmaceuticals, Inc, Setauket, NY. Авторы благодарят Мишель МакТернан за редакционную поддержку.
Материалы
| Name | Company | Catalog Number | Comments |
| 100 mm macro lens | Canon EF 100mm f/2.8L IS USM | 3554B002 | |
| 26 gauge needles (5/8) | Becton Dickinson and Company, Franklin Lakes, NJ | 305115 | Needles for injecting ConA into the lacrimal glands |
| 27 gauge needles (5/8) | Becton Dickinson and Company, Franklin Lakes, NJ | 305921 | Needles for injecting ConA into the lacrimal glands |
| Aceproinj (acepromazine) | Henry Schein Animal Health, Dublin, OH | NDC11695-0079-8 | 0.1ml/kg subcutaneously injection for rabbit sedation |
| Anesthesia vaporizer | VetEquip, Pleasanton, CA | Item #911103 | |
| Bishop Harmon Forceps | Bausch and Lomb (Storz), Bridgewater, NJ | E1500-C | Tissue forceps |
| Caliper | Bausch and Lomb (Storz), Bridgewater, NJ | E-2404 | Caliper used to measure length of needle during ConA injection |
| Concanavalin A | Sigma, St. Louis, MO | C2010 | Make 5mg/ml in PBS for injection into rabbit lacrimal glands |
| DSLR camera | Canon EOS 7D DSLR | 3814B004 | Digital single lens reflex camera |
| fluorescein | AKRON, Lake Forest, IL | NDC17478-253 | Dilute to 0.2% with PBS to measure TBUT |
| Isoflurane | Henry Schein, Melville, NY | 29405 | |
| Lactoferrin ELISA kit | MyBiosource, San Diego, CA | MBS032049 | Measure tear lactoferrin level |
| lidocaine | Sigma, St. Louis, MO | L5647 | 1% in PBS for anesthesia agent |
| macro/ring flash | Canon Macro Ring Lite MR-14EXII | 9389B002AA | |
| Osmolarity tips | TearLab Corp., San Diego, CA | #100003 REV R | Measure tear osmolarity |
| PBS (phosphate buffered saline) | Mediatech, Inc. Manassas, VA | 21-031-CV | |
| Rabbit, New Zealand White or Dutch Belted (as described in text) | Charles River Labs, Waltham, MA | 2-3 kg | Research animals |
| Rose Bengal | Amcon Laboratories Inc., St. Louis, MO | NDC51801-004-40 | 1% in PBS, stain the ocular surface |
| Schirmer strips | Eaglevision, Katena products. Denville, NJ | AX13613 | Measure tear production |
| Surgical Loupes +1.50 | Designs for Vision, Bohemia, NY | Specialty item | Provide magnificantion of ocular surface while observing tear break up and performing Concanavalin A injections. |
| TearLab Osmometer | TearLab Corp., San Diego, CA | Model #200000W REV A | Measure tear osmolarity |
| Ultrasound probe | VisualSonics Toronto, Ont | MX 550 S | Untrasonography-guide Con A injection for inferior lacrimal gland |
Ссылки
- Paulsen, A. J., et al. Dry eye in the Beaver Dam Offspring Study: prevalence, risk factors, and health-related quality of life. American Journal of Ophthalmology. 157 (4), 799-806 (2014).
- Vehof, J., Kozareva, D., Hysi, P. G., Hammond, C. J. Prevalence and risk factors of dry eye disease in a British female cohort. British Journal of Ophthalmology. 98 (12), 1712-1717 (2014).
- Tan, L. L., Morgan, P., Cai, Z. Q., Straughan, R. A. Prevalence of and risk factors for symptomatic dry eye disease in Singapore. Clinical and Experimental Optometry. 98 (1), 45-53 (2015).
- Craig, J. P., et al. TFOS DEWS II Report Executive Summary. The Ocular Surface. 15 (4), 802-812 (2017).
- Baudouin, C., et al. Clinical impact of inflammation in dry eye disease: proceedings of the ODISSEY group meeting. Acta Ophthalmologica (Copenhagen). 96 (2), 111-119 (2018).
- Calonge, M., et al. Dry eye disease as an inflammatory disorder. Ocular Immunology and Inflammation. 18 (4), 244-253 (2010).
- Pflugfelder, S. C., de Paiva, C. S. The Pathophysiology of Dry Eye Disease: What We Know and Future Directions for Research. Ophthalmology. 124 (11S), S4-S13 (2017).
- Buckley, R. J. Assessment and management of dry eye disease. Eye (London, England). 32 (2), 200-203 (2018).
- Clayton, J. A. Dry Eye. New England Journal of Medicine. 378 (23), 2212-2223 (2018).
- Barabino, S. Animal models of dry eye. Archivos de la Sociedad Española de Oftalmología. 80 (12), 695-696 (2005).
- Stern, M. E., Pflugfelder, S. C. What We Have Learned From Animal Models of Dry Eye. International Ophthalmology Clinics. 57 (2), 109-118 (2017).
- Chen, Z. Y., Liang, Q. F., Yu, G. Y. Establishment of a rabbit model for keratoconjunctivitis sicca. Cornea. 30 (9), 1024-1029 (2011).
- Gilbard, J. P., Rossi, S. R., Gray, K. L. A new rabbit model for keratoconjunctivitis sicca. Investigative Ophthalmology & Visual Science. 28 (2), 225-228 (1987).
- Guo, Z., et al. Autologous lacrimal-lymphoid mixed-cell reactions induce dacryoadenitis in rabbits. Experimenal Eye Research. 71 (1), 23-31 (2000).
- Burgalassi, S., Panichi, L., Chetoni, P., Saettone, M. F., Boldrini, E. Development of a simple dry eye model in the albino rabbit and evaluation of some tear substitutes. Ophthalmic Research. 31 (3), 229-235 (1999).
- Xiong, C., et al. A rabbit dry eye model induced by topical medication of a preservative benzalkonium chloride. Investigative Ophthalmology & Visual Science. 49 (5), 1850-1856 (2008).
- Heymann, F., Hamesch, K., Weiskirchen, R., Tacke, F. The concanavalin A model of acute hepatitis in mice. Lab Animal. 49 (1 Suppl), 12-20 (2015).
- Nagelhout, T. J., Gamache, D. A., Roberts, L., Brady, M. T., Yanni, J. M. Preservation of tear film integrity and inhibition of corneal injury by dexamethasone in a rabbit model of lacrimal gland inflammation-induced dry eye. Journal of Ocular Pharmacology and Therapeutics. 21 (2), 139-148 (2005).
- Honkanen, R. A., Huang, L., Xie, G., Rigas, B. Phosphosulindac is efficacious in an improved concanavalin A-based rabbit model of chronic dry eye disease. Translational Research. 198, 58-72 (2018).
- Huang, L., et al. The novel phospho-non-steroidal anti-inflammatory drugs, OXT-328, MDC-22 and MDC-917, inhibit adjuvant-induced arthritis in rats. British Journal of Pharmacology. 162 (7), 1521-1533 (2011).
- Mattheolabakis, G., et al. Topically applied phospho-sulindac hydrogel is efficacious and safe in the treatment of experimental arthritis in rats. Pharmaceutical Research. 30 (6), 1471-1482 (2013).
- Osmalek, T., Froelich, A., Tasarek, S. Application of gellan gum in pharmacy and medicine. International Journal of Pharmaceutics. 466 (1-2), 328-340 (2014).
- Lemp, M. A. Report of the National Eye Institute/Industry workshop on Clinical Trials in Dry Eyes. Contact Lens Association of Ophthalmologists Journal. 21 (4), 221-232 (1995).
- Dal Piaz, F., Braca, A., Belisario, M. A., De Tommasi, N. Thioredoxin system modulation by plant and fungal secondary metabolites. Current Medicinal Chemistry. 17 (5), 479-494 (2010).
- Davis, F. A. The Anatomy and Histology of the Eye and Orbit of the Rabbit. Transactions of the American Ophthalmological Society. 27, 402-441 (1929).
- Lima, L., Lange, R. R., Turner-Giannico, A., Montiani-Ferreira, F. Evaluation of standardized endodontic paper point tear test in New Zealand white rabbits and comparison between corneal sensitivity followed tear tests. Veterinary Ophthalmology. 18 (Suppl 1), 119-124 (2015).
- Zheng, W., et al. Therapeutic efficacy of fibroblast growth factor 10 in a rabbit model of dry eye. Mol Med Report. 12 (5), 7344-7350 (2015).
- Wiechmann, A. F., Summers, J. A. Circadian rhythms in the eye: the physiological significance of melatonin receptors in ocular tissues. Progress in Retinal and Eye Research. 27 (2), 137-160 (2008).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены