Method Article
Un modèle de lapin de la maladie sèche aqueuse-déficiente d'oeil induite par concanavalin une injection dans les glandes lacrimal : application aux études d'efficacité de drogue
Dans cet article
Résumé
Cet article décrit le développement d'une méthode pour induire la maladie sèche ou chronique d'oeil aigu dans des lapins en injectant le concanavalin A à toutes les parties du système lacrimal orbital de glande. Cette méthode, supérieure à celles déjà signalées, génère un modèle reproductible et stable d'œil sec adapté à l'étude d'agents pharmacologiques.
Résumé
La maladie oculaire sèche (DED), une maladie inflammatoire multifactorielle de la surface oculaire, affecte 1 homme sur 6 dans le monde avec des implications stupéfiantes pour la qualité de vie et les coûts des soins de santé. L'absence de modèles animaux informatifs qui récapitulent ses caractéristiques clés empêche la recherche de nouveaux agents thérapeutiques pour deDe. Les modèles animaux DED disponibles ont une reproductibilité et une efficacité limitées. Un modèle est présenté ici dans lequel DED est induit en injectant le mitogène concanavalin A (Con A) dans les glandes lacrimal orbitales des lapins. Les aspects novateurs de ce modèle sont l'utilisation du guidage d'ultrason (US) pour assurer l'injection optimale et reproductible de Con A dans la glande lacrimale inférieure ; injection de Con A dans toutes les glandes lacrimal orbitales qui limite la production compensatoire de larmes; et l'utilisation d'injections périodiques répétées de Con A qui prolongent l'état de DED à volonté. DeD et sa réponse aux agents d'essai sont surveillés avec un panneau de paramètres qui évaluent la production de déchirure, la stabilité du film de déchirure, et l'état de la muqueuse cornéenne et conjonctivale. Ils incluent l'osmolarité de déchirure, le temps de rupture de déchirure, l'essai de déchirure de Schirmer, la coloration de bengal de rose, et les niveaux de lactoferrine de déchirure. L'induction de DED et la surveillance de ses paramètres sont décrites en détail. Ce modèle est simple, robuste, reproductible et informatif. Ce modèle animal convient à l'étude de la physiologie des déchirures et de la physiopathologie de la DED ainsi qu'à l'évaluation de l'efficacité et de l'innocuité des agents candidats pour le traitement de la DED.
Introduction
La maladie oculaire sèche (DED) est une condition chronique avec la prédominance et la morbidité élevées1,2,3,4. L'inflammation joue un rôle clé dans sa pathogénie5,6. La pathophysiologie de DED est conceptualisée comme dérivant de la sous-production ou de la surévaporation des larmes ; le premier est également connu sous le nom aqueuse-déficiente DED7. Le syndrome de Sj-gren, une cause prototypique largement étudiée de DED, affecte principalement les glandes lacrimales (LGs) et est un exemple frappant de leur importance dans la pathogénie de DED. DED est souvent traitée avec des larmes artificielles qui fournissent le soulagement provisoire, ou avec la cyclosporine ou lifitegrast, qui suppriment l'inflammation oculaire. Aucun des traitements disponibles pour DED sont optimaux, nécessitant le développement de nouveaux agents8,9.
La recherche de nouveaux agents thérapeutiques pour le DED est entravée par trois défis majeurs : l'absence d'une cible moléculaire médicamentelable reconnue, qui peut être insaisissable compte tenu de la complexité pathophysiologique de delade ; la rareté des agents prometteurs; et l'absence de modèles animaux qui récapitulent les principales caractéristiques de DED.
Comme avec la plupart des efforts de développement de médicaments, les modèles animaux informatifs de DED sont un outil d'investigation crucial, en malgré la déclaration axiomatique qu'aucun modèle animal ne récapitule complètement une maladie humaine. Les modèles de souris, de rats et de lapins de DED sont les plus couramment utilisés tandis que les chiens et les primates sont utilisés rarement10,11. La plupart des plus de 12 modèles de LAPIN DED signalés à ce jour tentent de réduire la production de déchirures soit en supprimant les LG ou en empêchant leur fonction12,13,14,15,16. Ces approches comprennent la résection chirurgicale de l'ILG; fermeture de son conduit excréteur; et altérant la fonction de LG par irradiation ou injection de l'un des suivants : lymphocytes activés, mitogènes, toxine botulique, atropine, ou benzalklonium. Les principales limites de ces méthodes sont leur incohérence et la suppression partielle fréquente de la production de déchirures.
Concanavalin A (Con A), une lectine d'origine végétale, est un stimulateur puissant T-cell sous-ensembles et a été utilisé dans des modèles expérimentaux de l'hépatite17 et DED18. Le modèle original basé sur Con A aurait d'importants avantages, y compris sa relative simplicité; l'afflux de cellules inflammatoires dans les LG, imitant des maladies telles que Sjogren; la stimulation des cytokines proinflammatoires IL-1, IL-8, et TGF-1; fonction de déchirure réduite surveillée en mesurant le dégagement de fluorescéine de déchirure et le temps de rupture de déchirure (TBUT); et la réactivité de drogue montrée pour un corticostéroïde anti-inflammatoire.
Lorsque cette méthode prometteuse a été appliquée, en plus de ses avantages, des limitations ont été identifiées qui ont nécessité sa révision globale et des améliorations drastiques. Trois lacunes critiques de la méthode sont documentées. Premièrement, le modèle était aigu; le DED induit s'est calmé après environ 1 semaine. Deuxièmement, la réponse des animaux était incohérente. Comme démontré, dans les injections transcutanées « aveugles » au LG inférieur (ILG), Con A n'a été livré qu'au hasard à la glande ciblée. Une étude détaillée de l'anatomie de l'ILG a révélé que sa taille pouvait varier jusqu'à 4 fois19 faisant de telles injections "hit-or-miss" efforts. Enfin, même lorsque l'ILG a été injecté, le LG supérieur (SLG) a souvent compensé la réduction du flux de déchirure, ce qui rend le modèle problématique.
Ces principales limitations ont été surmontées en introduisant trois modifications à la méthode, générant un modèle animal supérieur de DED. Tout d'abord, l'injection de Con A dans l'ILG a été effectuée sous la direction d'ultrason (US), s'assurant que Con A est entré dans la glande. Le succès de l'injection a été confirmé par l'obtention d'une image américaine post-injection, comme le montre la figure 1. Deuxièmement, pour enlever la contribution compensatoire de déchirure du SLG, les parties palpebral et orbitales de cette glande ont été injectées avec Con A. Enfin, ce modèle aigu de DED a été converti en un chronique par des injections répétées de Con A tous les 7-10 jours. DED de 2 mois de durée est facilement atteint dans ces lapins. Le succès de cette approche a été amplement documenté19.
Comme nous l'avons déjà mentionné, une application importante des modèles animaux de DED est de déterminer l'efficacité et l'innocuité des agents thérapeutiques candidats. L'utilité de ce modèle a été démontrée par l'étude du phosphosulindac (OXT-328), une nouvelle petite molécule anti-inflammatoire20,21 administrée sous forme de gouttes pour les yeux. Son efficacité a été démontrée sur la base d'un panel de paramètres de DED19. La simplicité relative et la nature informative de ce modèle ont également permis la comparaison côte à côte du phosphosulindac aux deux médicaments approuvés par fda pour DED, cyclosporine et lifitegrast, démontrant sa forte supériorité préclinique.
Protocole
Toutes les études sur les animaux ont été approuvées par la Commission d'examen institutionnel de l'Université Stony Brook et effectuées conformément à l'Énoncé ARVO pour l'utilisation des animaux dans la recherche sur l'ophtalmlogie et la vision.
1. Animaux et logement
- Acquérir des lapins blancs néo-zélandais (NZW) pesant 2-3 kg.
- Loger les lapins individuellement dans des cages à température stricte (65 '5 'F) et l'humidité (45 ' 5%) Contrôle. L'éclairage doit avoir un cycle de 12 h sur/hors tension.
- Fournir un accès illimité à l'eau et chow lapin standard. Éliminez les enrichissements alimentaires car ils peuvent contenir de la vitamine A qui affecte l'œil.
- Acclimater les animaux pendant au moins 2 semaines avant les mesures de base ou l'induction de l'œil sec.
2. Méthodes d'anesthésie et d'euthanasie
REMARQUE: Toutes les procédures nécessitent une sédation légère, sauf pour l'injection Con A qui nécessite une sédation modérée.
- Pour une sédation légère, injecter de l'acépromazine (1 mg/kg) sous-cutanée sur les épaules à l'aide d'une aiguille de calibre 26. Point d'évaluation pour une sédation légère : les animaux maintiennent une position de tête détendue avec des lobes d'oreille qui ne sont plus entièrement droits.
REMARQUE : Si le point final approprié n'est pas atteint, une injection supplémentaire d'acépromazine peut être administrée. Les animaux doivent toujours rester éveillés, réceptifs aux touchers de leurs moustaches, et ne jamais montrer la respiration ralentie. - Pour une sédation modérée, donnez d'abord aux animaux de l'acépromazine comme ci-dessus. Une fois le point de terminaison atteint (voir la note ci-dessus), donnez isoflurane à l'aide d'un masque à gaz avec o2 flux réglé à 1 L/min et la livraison d'isoflurane fixé à 5% (Figure 2).
- Administrer l'isoflurane jusqu'à ce que le toit du corps du lapin soit complètement détendu et que les oreilles soient complètement disquettes.
REMARQUE : Aucun mouvement musculaire compensatoire ne doit se produire lorsque l'animal est tourné sur le côté; la respiration reste toujours spontanée. - Le rétablissement spontané se produit dans les 2-5 minutes : les signes incluent des mouvements spontanés de tête et le tont musculaire accru ou normal. Après la procédure expérimentale est terminée avec une sédation modérée, observer les lapins pendant environ 30 min ou jusqu'à ce que leur comportement revient à la normale.
REMARQUE : L'onnémicique ophtalmique n'est pas nécessaire pendant l'une ou l'autre forme de sédation. 1) Dans la sédation douce, les animaux sont toujours alertes et maintiennent un réflexe de clignotement. Dans la sédation modérée, l'inhibition du réflexe de clignotement est si courte que la surface oculaire n'est pas en danger. 2) Le placement de l'onduleur ophtalmique sur la surface oculaire empêche la visualisation des structures évaluées pendant l'essai. - Euthanasie : Utiliser une surdose de pentobarbital par voie intraveineuse (100 mg/kg).
3. Enlèvement de la membrane nictitating
- Effectuer l'enlèvement pendant la période d'acclimatation (généralement la première semaine) pour permettre une évaluation complète et précise de la cornée.
-
Injection à la membrane de nictitating droite
REMARQUE: Si la membrane nictitating des deux yeux doit être enlevée, il est plus simple de le faire en une seule session. Commencez par un œil et procédez comme décrit. Pour plus de clarté de description, cette méthode commence par l'œil droit.- Placez le lapin dans un sac de retenue de taille appropriée.
- Induire la sédation douce comme décrit dans l'étape 2.1.
- Appliquer 25 ll de lidocaïne sans agent de conservation sur l'œil droit à l'aide d'une micropipette.
- Placez un spéculum flexible de couvercle de fil entre les paupières.
- À l'aide de 0,3 forceps (ou équivalent), saisissez la membrane nictitating à son sommet et étendez-la sur la cornée.
- Injecter de la lidocaïne 1 % avec 1:100 000 épinéphrinesubconjonctivally dans la base de la membrane nictitating à l'aide d'une aiguille pointue de 26 calibres (Figure 3A). Un bleb modéré devrait se former au-dessus de la membrane nictitating.
- Retirez le spéculum.
- Effectuez une injection identique à la membrane de nictitating gauche.
-
Couper la membrane nictitating
- Après environ 5 min, remettre le spéculum du couvercle dans l'œil droit. Saisir et rétracter la membrane nictitating à son sommet en utilisant 0,3 forceps (ou similaires).
- Coupez la membrane nictitating à sa base à l'aide de ciseaux Westcott ou équivalents (Figure 3B).
REMARQUE : Le saignement est minime et ne nécessite généralement pas de cautérisation. Néanmoins, une cautérisation de batterie à haute température est toujours maintenue à proximité au cas où une hémostase supplémentaire serait nécessaire. - Retirez le spéculum.
- Placez l'onguent antibiotique topique sur l'oeil (par exemple, néomycine, polymyxine, bacitracin, et hydrocortisone).
- Laissez la glande harderienne intacte. La glande harderienne est parfois vu quand la membrane nictitating est rétractée.
REMARQUE : Si une grande masse blanche ou élévation de tissu est vue dans la région sous-conjonctive nasale ou supérieure après que la membrane nictitante soit enlevée, la membrane a été réséquée trop près de sa base permettant à la glande Harderian de prolapsus spontanément. Pour éviter cela dans les procédures ultérieures, laissez plus de la membrane nictitating à la base. - Laisser la surface oculaire guérir pendant au moins 1 semaine avant que d'autres manipulations ne soient effectuées ou que des essais oculaires de surface ne soient effectués.
4. Mesure des paramètres des yeux secs et collecte d'échantillons de déchirure
REMARQUE : Mesurer les paramètres de DED en fonction des besoins du protocole d'étude (p. ex., à la ligne de base et aux points de temps spécifiés par la suite). Les mesures pour DED doivent être faites dans l'ordre suivant, avec un effort rigoureux pour les reproduire fidèlement à chaque fois. Testez tous les animaux à peu près à la même heure de la journée (1 h) afin de minimiser les variations circadiennes. Ces mesures nécessitent habituellement une équipe de deux enquêteurs.
- Placer le lapin dans un sac de retenue. Induire une sédation légère.
- Osmolarité de déchirure22
- Clignotez manuellement les paupières 5 à 10 fois pour répartir uniformément la couche de déchirure sur la surface oculaire.
- Rétractez doucement le couvercle inférieur.
- Échantillonnez les larmes avec l'osmomètre TearLab à la jonction de la conjonctive palpébrale et bulbar le long du fornix inférieur, juste postérieur e à la base de la membrane nictitating tronquée.
- Mesurer l'osmolarité à l'aide du test d'osmolarité TearLab suivant les instructions du fabricant.
- Temps de rupture des déchirures (TBUT)
- Assombrir la pièce pour cet assay.
- Placez un spéculum de couvercle de fil entre les paupières.
- Appliquer une goutte de fluorescéine de 0,2 % sur la surface cornéenne à l'aide d'une micropipette. Si même la distribution de la fluorescéine sur la cornée n'est pas obtenue avec la première goutte, placez une deuxième goutte.
- Démarrez immédiatement une minuterie.
- Observez le film pré-cornéen sous une lumière bleue. Le TBUT est défini comme le temps pris pour développer des points noirs, des lignes ou une perturbation évidente du film de fluorescéine (Figure 4). Si nécessaire, utilisez des loupes chirurgicales qui fournissent un grossissement de 1,50 pour mieux visualiser les premiers signes de rupture. Surveiller jusqu'à 1 min; si la rupture telle que définie ici se produit après 1 min, enregistrez TBUT pour seulement 60 s.
- Test de déchirure de Schirmer (STT)
- Appliquer une goutte de lidocaïne sans agent de conservation de 25 ll sur la surface oculaire.
- Placez une lance chirurgicale de cellules de Weck dans le fornix inférieur pour absorber la lidocaïne résiduelle et n'importe quel fluide de déchirure. Si nécessaire, utilisez la paupière inférieure pour couvrir l'extrémité proximale de l'éponge pour aider à la maintenir en place (Figure 5A).
- Après environ 30 s, retirer l'éponge Weck.
- Insérez immédiatement la bandelette d'essai de déchirure d'un Schirmer dans l'espace entre la cornée et la conjonctive palpébrale au milieu du couvercle inférieur.
- Démarrer immédiatement une minuterie (Figure 5B).
- Après 5 min, mesurer la longueur de la partie humidifiée de la bande; c'est la valeur STT.
- Effectuer des mesures dans le tripleet et rapporter la moyenne des 3 lectures comme valeur STT.
- Collecte d'échantillons de déchirure
- Pour recueillir des échantillons de déchirure pour les niveaux d'analyse de divers analytes en eux tels que la lactoferrine, après que la valeur STT est enregistrée à 5 min, laissez la bande en place jusqu'à ce que le mouillage d'au moins 20 mm est obtenu.
REMARQUE : Si le mouillage adéquat ne se produit pas après que deD ait été induit, avancez la bande plus profondément dans le fornix inférieur pour aider à atteindre ce point final dans le temps raisonnable. - Couper la bande humidifiée et la placer immédiatement dans 490 l de tampon de collecte de larmes réfrigérée (4 % de BSA, 1 M DeCl, 0,1 % de Tween-20 en PBS avec cocktail inhibiteur de la protéase).
- Conserver les échantillons sur la glace jusqu'à ce qu'ils puissent être conservés à -80 oC, où ils doivent rester jusqu'à ce qu'ils soient analysés.
- Pour recueillir des échantillons de déchirure pour les niveaux d'analyse de divers analytes en eux tels que la lactoferrine, après que la valeur STT est enregistrée à 5 min, laissez la bande en place jusqu'à ce que le mouillage d'au moins 20 mm est obtenu.
- Rose Bengal Staining (RBS)
- Appliquer 50 ll de 1 % de lidocaïne sans agent de conservation sur la cornée à l'aide d'une micropipette.
- Après 30 s, placez 25 'L de 1% de bengale de rose sur la surface oculaire et clignotez manuellement la paupière pour la répartir uniformément.
- Démarrez immédiatement une minuterie.
- À 3,5 min, placez un spéculum de couvercle de fil entre les couvercles.
- À 4,0 min, photographiez la surface conjonctivale et cornéenne supérieure (figure 6).
REMARQUE : Ajustez-vous au type de caméra utilisée. Paramètres typiques : appareil photo reflex numérique à objectif unique, mode priorité d'ouverture (ouverture 13 ou plus), objectif macro ISO 6000, 100 mm attaché avec deux tubes d'extension de 12,5 mm, mode de mise au point manuelle, objectif au grossissement maximal, et illumination du flash macro/anneau réglé à automatique avec le mode à travers l'objectif. La lampe de mise au point du flash d'anneau est allumée pour aider à se concentrer sur la cornée. - Complétez toutes les photos pour les deux yeux en 1 min.
- Score de coloration de surface oculaire en utilisant la méthode NEI23 modifié comme suit. Ne pas classer les zones conjonctives séparées. Marquez la conjonctive supérieure de chaque œil. C'est la partie de la surface conjonctive facilement photographiée sans manipuler le globe. La manipulation pourrait changer artefactually la coloration de la surface oculaire.
- Les niveaux de lactoferrine de déchirure sont une mesure de substitution de la production de déchirure des glandes lacrimales. Assay lactoferrine lacrymogène dans les larmes recueillies comme ci-dessus en utilisant une enzyme liée immunosorbent essai24 kit suivant les instructions du fabricant.
5. Induction et traitement des yeux secs
REMARQUE : Trois parties du système orbital de glande lacrimale sont injectées.
- Sédatez les lapins avec de l'acépromazine 0,2 mg/kg sous-cutanée.
- Encaillez la fourrure dans la zone périorbitale et du cuir chevelu et enlevez complètement toute fourrure résiduelle à l'aide de Nair. Laissez la peau entièrement lisse pour une meilleure visualisation des caractéristiques anatomiques et de l'injection guidée par les États-Unis de concanavalinE A (Figure 7).
- Induire la sédation modérée comme décrit ci-dessus.
- Injection de la partie palpebrale de la glande lacrimale supérieure (PSLG)
REMARQUE : Effectuez d'abord l'injection de PSLG.- Appliquer sur l'œil approprié 25 l l lidocaïne sans agent de conservation 1% avec une micropipette.
- Evert la paupière supérieure et appliquer une pression médiale douce à la jante orbitale postérieure jusqu'à ce que la protubérance marquant la partie palpébrale de la glande est vu. Le PSLG apparaît comme une petite élévation bulbeuse dans la partie postérieure (temporelle) du couvercle supérieur.
REMARQUE : Pour voir le tissu glande pendant le processus d'apprentissage, appliquez 5 % de fluorescéine sur la région(figure 8A). Les larmes peuvent être vus en streaming à partir de la PSLG bulbeux. L'application de la fluorescéine n'est pas nécessaire pour l'administration de Con A; il est fait seulement à des fins d'illustration pour montrer le tissu de glande. - À l'aide de forceps à dentés fins et d'une aiguille de calibre 27 sur une seringue de tubercutine, pénétrer directement dans la glande à l'aide d'une approche transconjonctivale. Avancez l'aiguille de 2 mm dans le tissu et injectez 500 g de Con A dans un volume de 0,1 ml (figure 8B).
REMARQUE : Cette injection peut parfois être douloureuse. Si nécessaire, gardez les animaux sous l'isoflurane jusqu'à ce que cette injection soit terminée.
- Injection de la glande lacrimale supérieure orbitale (OSLG)
REMARQUE : L'OSLG suit en succession rapide.- Appliquer une pression médiale sur le globe, ce qui fait dépasser l'OSLG de l'incisure postérieure (voir l'arbitre25 pour l'anatomie, si nécessaire). Appliquer une pression médiale sur le globe (Figure 9, flèche rouge) avec la protubérance de l'OSLG de l'incisure postérieure. La protubérance sert de localisation brute pour trouver l'incisure postérieure.
- Utilisez des forceps incurvés avec des pointes fermées pour indent erre la zone jusqu'à ce que l'ouverture osseuse dans le crâne soit ressentie. Ce sera élitoire avec une direction antérieure/postérieure sous la protubérance.
- Appliquer une pression modeste avec des forceps pour laisser une indentation dans la peau, qui servira de point de repère pour le placement de l'aiguille (figure 10A).
- Insérer une aiguille (seringue de tubercule avec une aiguille de 27 calibres, 5/8 pouces) perpendiculaire à la peau au-dessus de la marque d'indentation (Figure 10B) - 1/4 pouce dans l'incisure, puis rediriger l'aiguille postérieurement et extérieurement vers le canthus latéral visant le point médian entre le site d'injection et la jante orbitale osseuse.
REMARQUE : Si l'incisure n'est pas précisément ciblée avec l'aiguille, le crâne bloque son avancement. - Une fois que le moyeu de l'aiguille est atteint, injectez lentement 1000 g de Con A dans un volume de 0,2 ml (figure 10C).
- Terminer l'injection de la PSLG et OSLG dans les 2-3 minutes.
- Retirer l'animal de la sédation à l'isoflurane (si ce n'est pas encore fait). L'injection de la glande lacrimale inférieure (ILG) peut habituellement être accomplie sans davantage de sédation.
- Injection de la glande lacrimale inférieure
- Voir l'animal sur le côté. L'importance de l'ILG peut être vue le long de la partie antérieure inférieure de l'orbite (Figure 11A).
- Tracez une ligne verticale à l'aide d'un stylo de marquage chirurgical ou d'un marqueur permanent approprié sur la peau où la partie superficielle de la glande ILG passe de sa place de repos superficielle (plus externe) sur l'os zygomatique à son emplacement plus médial dans l'orbite. Ceci est généralement inférieur au limbus antérieur (figure 11A).
- Identifiez l'extrémité de l'os zygomatique en balayant la sonde américaine verticalement tenue à travers cette ligne sur la peau. La transition ILG se produit lorsque l'image de la glande change de clairement circonscrite (ligne hyperéchoïque de l'os zygomatique est vu le long du bord inférieur de la glande dans l'image) à un sans une frontière médiale reconnaissable (l'écho oszymatique n'est plus présent, Figure 1).
- Observez la position relative de la pièce à main à la ligne tracée sur la peau lorsque l'écran américain montre ce changement. C'est le "site d'injection" où Con A devrait être donné.
- Contrôlez la profondeur de l'injection afin de placer Con A dans la glande à un point juste médial à l'os de l'arc zygomatique.
- Déterminer la profondeur de l'injection comme suit : Définir la profondeur d'injection désirée comme la profondeur de l'os zygomatique (signal hyperéchoïque) plus 1 mm. Soustrayez cette valeur de la longueur connue de l'aiguille (15 mm dans cet exemple).
- Insérer l'aiguille dans la glande au « site d'injection » de 12 mm, puis la retirer lentement jusqu'à ce que la longueur de l'aiguille exposée à l'extérieur du corps (mesurée avec des étriers chirurgicaux) soit égale à la différence calculée en 5,8,6 (figure 12). Injecter 1000 g de Con A dans 0,2 ml.
REMARQUE : Pour s'assurer que la capsule de la glande est percée et non pas simplement poussée par l'aiguille, l'aiguille doit être insérée 12 mm ou presque au moyeu avant que son retrait ne commence. - Répétez les États-Unis pour confirmer le succès de l'injection. L'ILG doit montrer un espace hypoéchoïque caractéristique (Figure 1).
REMARQUE: L'injection ILG est la mieux tolérée par les animaux26 et est, par conséquent, fait en dernier.
- Terminer l'ensemble de la procédure pour injecter toutes les glandes des deux yeux dans les 10 minutes. Cela nécessitera l'accomplissement de la compétence dans la procédure.
REMARQUE : Un seul ensemble d'injections dans les 2 glandes lacrimal orbitales induira le DED aigu durant 1-2 semaines. - Pour deD de plus longue durée, injectez Con A exactement comme ci-dessus tous les 7 jours. Jusqu'à 6 de telles injections ont été exécutées avec succès.
6. Soins post-procédure
- Après l'injection de Con A, surveillez les animaux dans leurs sacs de retenue pendant au moins 10-20 min, ou jusqu'à ce que l'effet anesthésique ait disparu.
- Ne laissez pas les animaux sans surveillance jusqu'à ce qu'ils aient retrouvé une conscience suffisante pour maintenir la charge sternale. Ne les retournez pas dans leurs cages individuelles jusqu'à ce qu'ils soient complètement récupérés.
- La douleur post-procédure est généralement légère et dure moins de 48 h. Évaluer la douleur avec l'échelle de grimace du lapin. Si nécessaire, donner une seule dose de kétorolac sous-cutané (5 mg/kg). Pour une douleur plus intense, donnez de la buprénorphine sous-cutanée 0,1 mg/kg toutes les 8 h.
Résultats
Les injections de Con A ont induit une forte réponse inflammatoire dans les glandes lacrimales caractérisées par une infiltration lymphocytique dense (Figure 13), accompagnée d'une diminution de la production de déchirures. Tous les paramètres de déchirure ont été nettement modifiés(tableau 1 et tableau 2). En outre, les niveaux de lactoferrine lacrymale ont été supprimés (contrôle de 3,1 à 0,45 vs Con A injectés 2,7 à 0,02 ng/mg de protéines (moyenne - SEM); p-lt;0,03). Le résultat final a été un épithélium cornéen et conjonctival compromis, comme en témoigne l'augmentation de la coloration du bengale rose (figure 6).
L'injection des trois tissus orbitaux de LG a produit un état cohérent et uniforme de DED contrairement aux états réalisés par les méthodes précédentes18,27. Les principaux contributeurs à ce résultat ont été l'injection guidée par les États-Unis de l'ILG et l'injection de l'OSLG. Le tableau 1 résume les résultats les plus marquants de cette méthode. Tous les changements sont compatibles avec deD grave.
Un seul ensemble d'injections Con A produit DED d'une durée d'environ 1 semaine; tous les paramètres cliniques se normalisent au jour 10 (tableau 2). Les injections séquentielles de Con A à environ 1 semaine d'intervalle prolongent la durée de DED en conséquence. Par exemple, la deuxième ensemble d'injections de Con A le jour 7 maintient DED pendant 2 semaines et ainsi de suite. Après environ 5 séries d'injections, l'état DED devient souvent permanent sans avoir besoin d'injections supplémentaires.
Quand les lapins avec Con A-induit DED ont été traités avec l'agent nouveau phosphosulindac, il a nettement supprimé la maladie. Par exemple, après une semaine de traitement avec cet agent TBUT a augmenté de façon marquée par rapport aux animaux traités par véhicule (43,6-4,0 vs 12,2,8 s; p-lt;0,001; moyenne - SEM respectivement, pour ces valeurs et les valeurs suivantes) tandis que l'osmolarité larmoyante a été normalisée (294-4,6 vs 311-2,0 mOsm/L, plt;0,02). Mécaniquement, le phosphosulindac a diminué les niveaux de deux interleukines cruciales, il-1MD (8,4-1,2 vs 21,2 à 6,6 pg/mg protéines; p-lt;0,03) et IL-8 (4,9 1,7 vs 13,5-5,0 pg/mg protéines; plt;0,05)19.
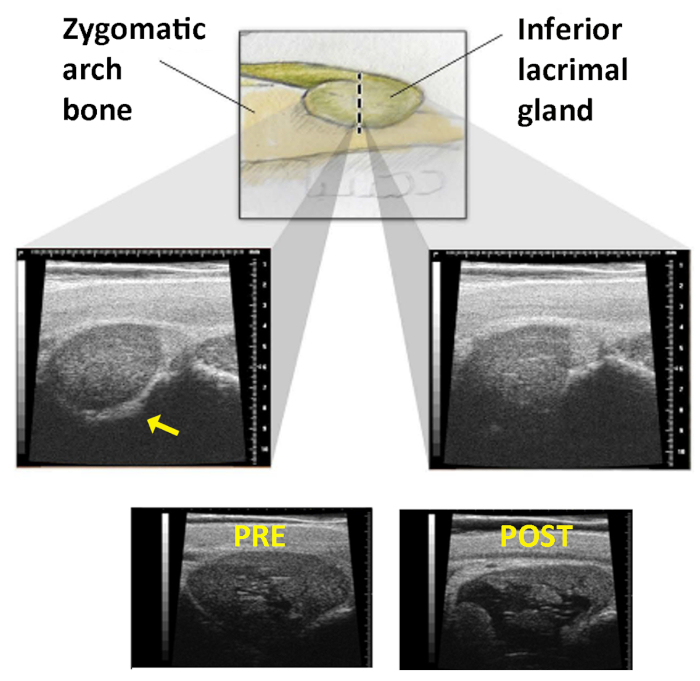
Figure 1 : Image d'ultrason de la glande lacrimale inférieure. Panneau supérieur: L'ILG comme il se déplace plus profond en orbite pour se trouver sous l'arc zygomatique. La ligne pointillée représente la ligne sur la peau à travers laquelle la sonde américaine est balayée. Panneaux moyens: Comme la pièce à main est balayé à travers cette ligne, l'examinateur cherche la perte de l'écho oszymatique qui est présent dans l'image de gauche (flèche) et disparaît dans la droite. Panneaux inférieurs : Les images de l'ILG prises avant (àgauche) et après(à droite) l'injection de Con A. Développement d'un grand espace cystique dans la glande confirme la livraison appropriée. Réimprimé avec la permission19. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.

Figure 2 : Sédation du masque à gaz. Cette photographie montre le masque à gaz fournissant une brève sédation modérée avec de l'isoflurane. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
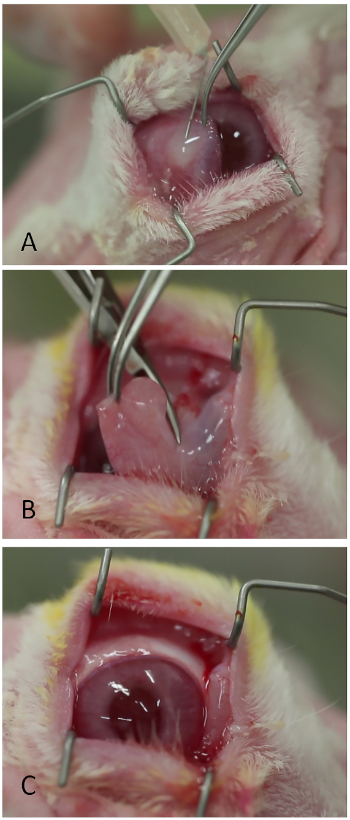
Figure 3 : Enlèvement de la membrane nictitating. (A) Injection de lidocaïne/épinéphrine. (B) Truncation de la membrane nictitating à sa base avec des ciseaux Westcott. (C) La surface oculaire visualisée plus facilement après l'enlèvement de la membrane nictitating. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
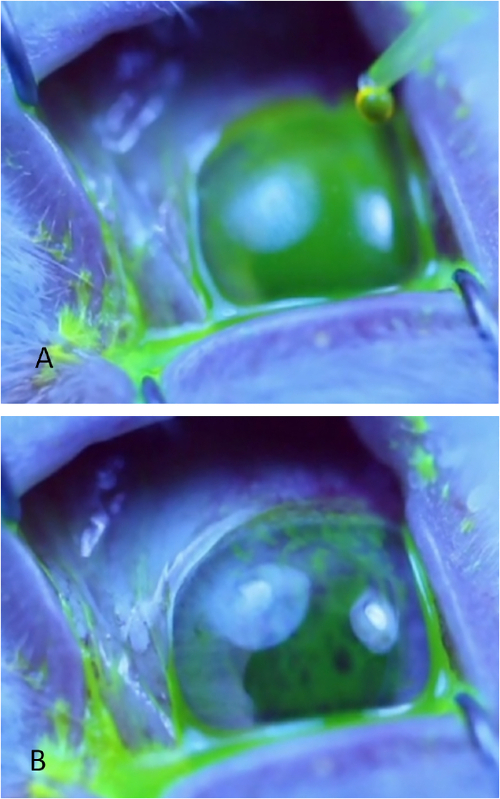
Figure 4 : Mesure du temps de rupture des déchirures. (A) Aspect uniforme de film de déchirure verte de la surface cornéenne sous la lumière bleue immédiatement après application des gouttes de fluorescéine. (B) Surface cornéenne qui a déjà subi une rupture marquée, comme en témoignent de multiples cernes et de stries linéaires dans la fluorescéine. Le temps de rupture est enregistré dès que la première tache ou ligne sombre se développe. Les deux cercles bleu clair sont des reflets de la source lumineuse de la cornée. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
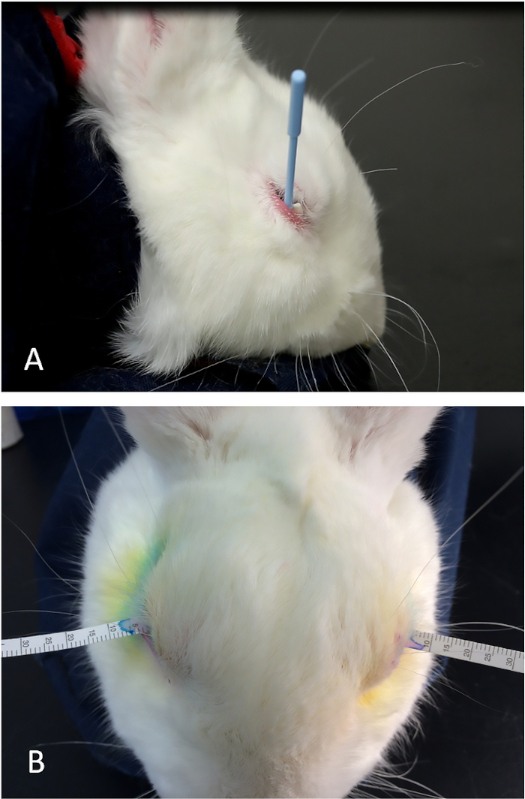
Figure 5 : Le test de déchirure de Schirmer. (A) Le placement approprié de l'éponge Weck-Cel dans le fornix inférieur pour enlever toute solution topique résiduelle de lidocaïne et les larmes de base. En plaçant le bord postérieur de l'éponge triangulaire sous la marge inférieure du couvercle, on peut maintenir une technique très uniforme pour sécher la surface oculaire avant le placement des bandes de déchirure. (B) Une bande de déchirure placée de façon appropriée à la position médiane du couvercle inférieur entre le globe et le couvercle inférieur (conjonctive palpébrale). Veuillez cliquer ici pour voir une version plus grande de ce chiffre.

Figure 6 : Coloration rose bengal. Haut: Photographies de la surface cornéenne. Gauche : Aucune coloration de bengal de rose n'est présente avant le traitement avec Con A. Droite : La coloration cornéenne et conjonctive diffuse est observée dans le quadrant nasal supérieur post-injection (en haut à droite). Plus bas: Cytologie d'impression conjonctivale de la conjonctive bulbar supérieure. Gauche : De nombreuses cellules de gobelet sont présentes avant le traitement. Droite : Les cellules épithéliales sont présentes, mais les cellules de gobelet sont absentes après le traitement. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.

Figure 7 : Préparation du lapin pour les injections de concanavaline A. (A) De petits cisailles sont utilisés pour enlever la fourrure, ce qui permet une visualisation plus facile des repères pour identifier la glande lacrimale supérieure orbitale. (B) Nair est utilisé pour enlever les cheveux qui restent après le tonte. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
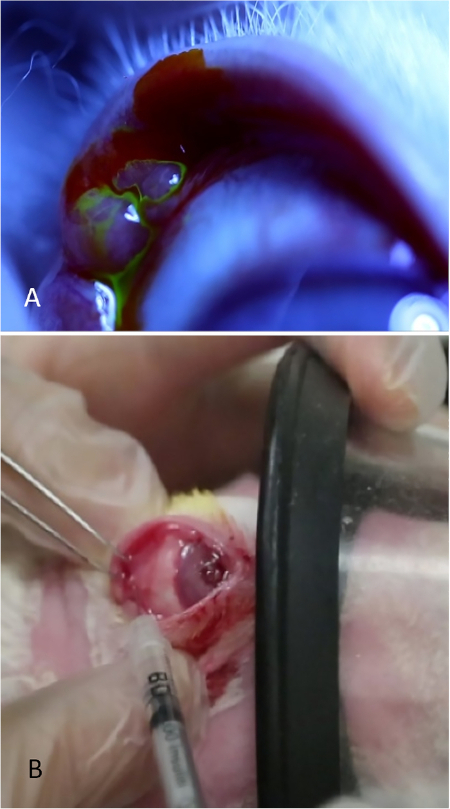
Figure 8 : Injection de la glande lacrimale palpébrale. (A) La glande lacrimale palpébrale, apparaissant comme une élévation bulbeuse dans la partie temporelle postérieure du couvercle supérieur. Les larmes sont vus coulant de la surface de cette glande après l'application d'une goutte de 2% de fluorescéine. (B) La glande lacrymale palpébrale est injectée pendant que le lapin reçoit une sédation modérée. Un chercheur rétracte la paupière, optimise l'exposition de la glande, et fixe le masque tandis que le deuxième chercheur injecte la glande. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.

Figure 9 : Localisation de la glande lacrimale supérieure orbitale. Les changements dans les contours de la peau indiquent l'emplacement de l'OSLG comme il dépasse à travers l'incisure postérieure. L'alternance de pression médiale sur le globe(grande flèche) provoque le prolapsus de la glande orbitale supérieure, qui est considérée comme une petite élévation de la peau. Cette élévation augmentera en taille chaque fois que la pression est appliquée(petites flèches). L'emplacement de cette glande est généralement en ligne avec la jante orbitale postérieure. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
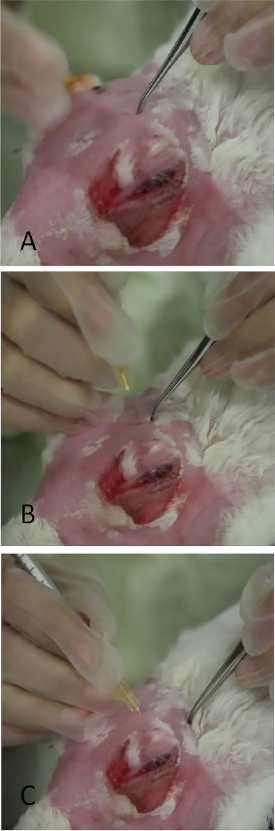
Figure 10 : Injection de la glande lacrimale supérieure orbitale. (A) Application d'une légère pression sur le crâne avec des forceps à dentés fins dans la zone qui prolapsus comme dans la figure 9. Une mince ouverture en fines et moyennes extrémités dans le crâne peut être palpée. Laisser une petite marque d'indentation avec les forceps facilite grandement le placement de l'aiguille pendant l'injection. (B) L'aiguille est insérée perpendiculairement par l'incisure. S'il est mal placé, son passage est arrêté par le crâne osseux. (C) L'aiguille est en position finale inclinée vers le canthus latéral. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
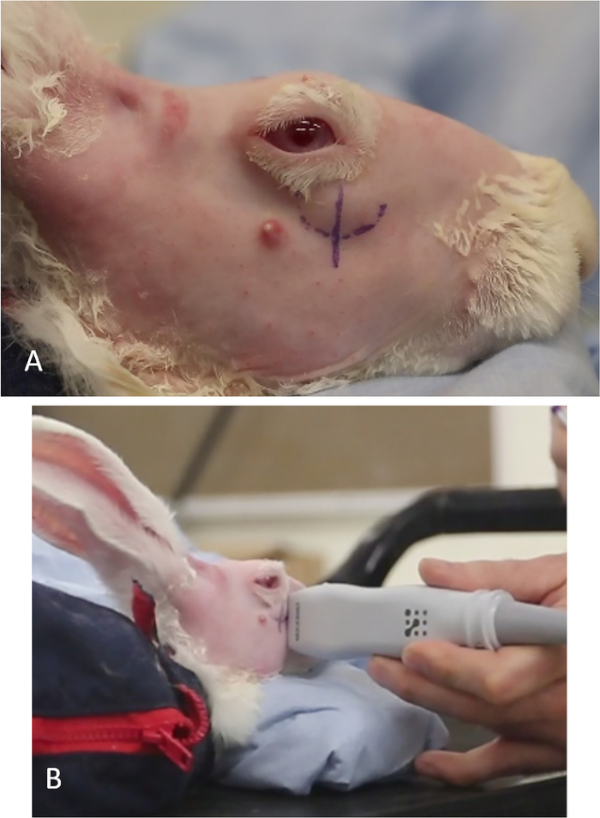
Figure 11 : Localisation de la glande lacrimale inférieure. (A) L'importance de la partie superficielle de l'ILG vue à travers le couvercle inférieur. La marque de stylo curviligne indique la position inférieure de la glande. La ligne verticale, sous le limbus nasal, désigne la position approximative où l'ILG passe à une position plus profonde dans l'orbite et sert de référence visuelle pour les États-Unis. (B) Pièce à main des États-Unis balayant la zone de la ligne verticale; le moniteur américain montrera où l'os zygomatique se termine, où l'ILG transitions et où l'injection Con A doit être donnée ("site d'injection"). Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
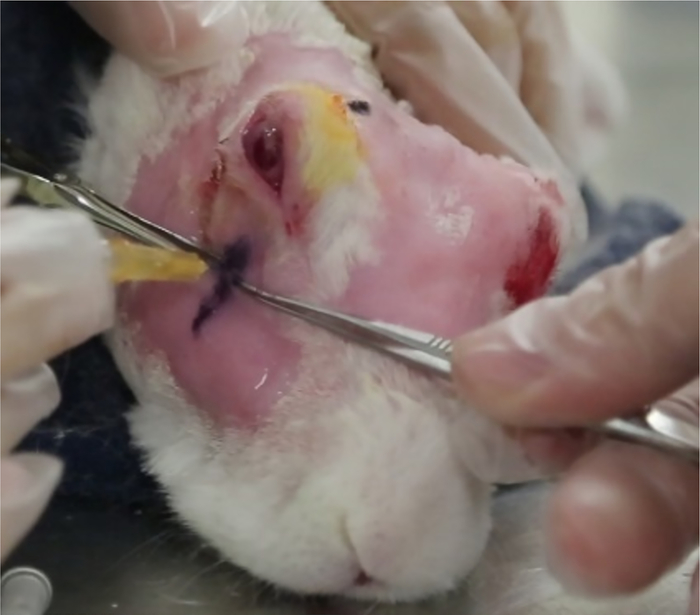
Figure 12 : Injection de la glande lacrimale inférieure. L'injection de l'ILG se fait à l'endroit identifié par les États-Unis. La profondeur de l'injection est calculée comme décrit dans le texte (étape 5.8.6). Calipers (vu derrière l'aiguille) s'assurer que l'aiguille est placée à la profondeur appropriée avant l'injection. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
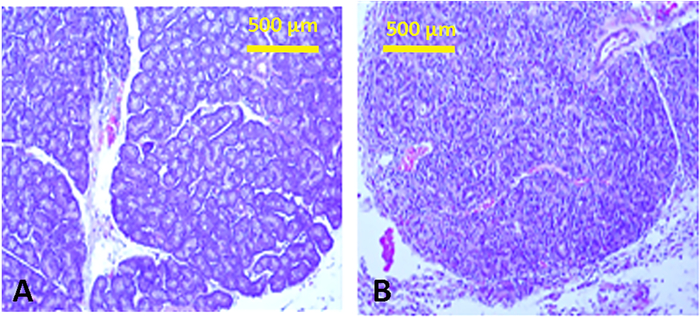
Figure 13 : Histologie des glandes lacrimales. Sections tissulaires d'une glande lacrimal inférieure normale avec la structure tubulo-alvéolaire typique (A) et l'injection suivante de Con A (B), montrant l'infiltration lymphocytique marquée avec effacement de la structure. Des infiltrations inflammatoires similaires sont observées dans les glandes lacrimales supérieures. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
| Méthode d'injection | TBUT, sec | Osmolalité de déchirure, Osm/L | STT, mm | |||
| Base | Après l'injection | Base | Après l'injection | Base | Après l'injection | |
| moyenne - SEM, % de changement | ||||||
| ILG sans orientation américaine | 58,5 à 1,5 | 44,5 à 7,7 | 297 à 4,9 | 300 à 3,8 | De 15,2 à 0,9 | 12,9 à 2,2 |
| %de changement | -23% | 1% | -15% | |||
| 0,05 p. 0,05 | 0,36 p. | 0,21 p. | ||||
| ILG guidé par les États-Unis - PSLG | 59,4 à 0,6 | 11,4 à 4,2 | 296 à 4,7 | 326 à 3,7 | 15,1 à 1,3 | 10,7 à 1,8 |
| % de variation | -81% | 10% | -29% | |||
| p-lt;0,0001 | p-lt;0,0001 | p-lt;0,03 | ||||
| ILG guidé par les États-Unis - PSLG - OSLG | De 60 à 0,0 | De 6,2 à 1,3 | 299 à 2,9 | 309 à 2,8 | 14,6 à 0,9 | 9,9 à 1,3 |
| % de variation | -90% | 3% | -32% | |||
| p-lt;0,0001 | p-lt;0,008 | p-lt;0,002 | ||||
| Toutes les valeurs ont été mesurées le jour 6 suivant une injection simple de Con A dans les glandes énumérées. Toutes les comparaisons ont été faites à la ligne de base. L'ILG, glande lacrimale inférieure ; PSLG, partie palpebral de la glande lacrimale supérieure ; OSLG, partie orbitale de la glande lacrimale supérieure ; États-Unis, échographie. | ||||||
Tableau 1 : Effet de la technique d'injection et nombre de sites d'injection sur la gravité des yeux secs.
| Base | Jour 6 | Jour 13 | Jour 21 | |
| 1 injection | 2 injections | 3 injections | ||
| TBUT, sec | 58,5 à 1,5 | 44,5 à 7,7 | 29,2 à 7,8 | De 12,8 à 3,9 |
| % de variation | -24% | -50% | -78% | |
| 0,17 p. | 0,001 p. 0,001 | p-lt;0,0001 | ||
| TOsm, Osm/L | 297 à 4,9 | 300 à 3,9 | 308 à 4,9 | 313 à 2,7 |
| % de variation | 1% | 4% | 5% | |
| 0,36 p. | 0,04 p. 0,04 | 0,003 p. 0,003 | ||
| STT, mm | De 15,2 à 0,9 | 9,3 à 1,6 | 12,9 à 1,6 | 7,4 à 1,1 |
| % de variation | -39% | -15% | -51% | |
| 0,17 p. | 0,13 p. | 0,008 p. 0,008 | ||
| Des comparaisons ont été faites à la ligne de base. | ||||
Tableau 2 : Effet des injections répétées de Con A dans L'ILG sur la durée de DED.
Discussion
Les lapins sont très attrayants pour l'étude de DED. Leur cornée et conjonctive ont une surface plus proche de celle des humains par rapport aux souris et aux rats; leur complément d'enzymes métabolisantes de drogue telles que des esterases, et l'histologie de leurs glandes lacrimales sont semblables à ceux des humains, et leurs yeux sont assez grands pour des études pharmacocinétiques informatives. Comparés aux porcs et aux singes, avec lesquels ils partagent des caractéristiques similaires, ils coûtent moins cher et leur manipulation expérimentale est plus facile. Si des études mécanistes sont envisagées, un inconvénient relatif du lapin, par rapport aux souris, est que moins de réactifs (par exemple, des anticorps monoclonaux) sont disponibles. D'autre part, le lapin est de loin supérieur aux souris pour les études pharmacocinétiques et biodistribution parce que les tissus individuels sont facilement disséqués et de taille suffisante pour le travail d'analyse, en évitant la « mise en commun des échantillons ».
Un paramètre général critique est la période d'acclimatation des lapins. Les animaux sont expédiés du vendeur dans des conditions qui, souvent, n'assurent pas un environnement de transport de la température ou de l'humidité appropriée. Certains animaux ont peut-être déjà développé l'œil sec à l'arrivée. Une période d'acclimatation de deux semaines est recommandée. Tout aussi important est l'attention scrupuleuse à l'humidité et la température de l'espace où les lapins d'étude sont logés dans le vivarium. Les déviations dans l'un ou l'autre état peuvent induire d'énormes variations dans leur statut d'oeil. Ayez à portée de main des humidificateurs et déshumidificateurs de recul. Si le système central tombe en panne, agissez rapidement pour rétablir l'humidité ambiante à l'aide de l'équipement de recul. Gardez à l'esprit que ces développements malheureux sont plus fréquents pendant les mois d'été. Les trois étapes les plus critiques, cependant, pour induire avec succès de DED dans des lapins sont : 1) l'utilisation habile de l'imagerie américaine pour identifier l'ILG et pour diriger et confirmer l'injection de Con A ; 2) assurer l'injection de l'ILG et des deux parties du SLG; et 3) d'assouidre de façon fiable et fiable les paramètres de DED.
Développer les compétences expérimentales requises n'est pas anodin, mais ne devrait pas dissuader un enquêteur sérieux. Attendez-vous à ce que la courbe d'apprentissage soit complétée dans les cinq itérations. Un système d'imagerie américain de qualité raisonnable est essentiel. La reconnaissance des marques anatomiques par les États-Unis est importante, par conséquent, l'enquêteur devrait examiner l'anatomie du lapin. L'excellente description de l'anatomie du lapin par Davis25, un classique, peut être extrêmement utile. Gardez également à l'esprit la variation de la taille de l'ILG. Le corollaire est que le succès de Con A doit toujours être confirmé par l'imagerie de suivi. Les variations dans la réponse à Con A dans un groupe de lapins sont le plus souvent dues à la technique d'injection (injection infructueuse ou partiellement réussie) ou à ignorer la capacité des tissus lacrimal résiduels de glande pour compenser avec la surproduction des larmes. Pour ceux qui souhaitent maîtriser la technique d'injection, l'injection de bleu de méthylène suivie d'une dissection anatomique rapide peut être utile; la visualisation est réalisée si elle atteint la glande lacrimale ou se renverse sur les tissus voisins. À ce jour, cette méthode d'injection a été réalisée plus de 270 fois par les auteurs sans une seule complication.
L'analyse des cinq paramètres de DED présentés ci-dessus peut être aussi délicate que leur détermination dans la pratique clinique. Bien que les variations circadiennes n'aient pas encore été formellement documentées dans aucun d'entre eux, il y a suffisamment d'évidence de fond de tels phénomènes dans l'oeil28 qu'ils devraient être exécutés à la même heure de la journée (1 h), particulièrement quand des essais répétés doivent être exécutés et comparés les uns aux autres. La cohérence dans l'exécution de ces essais est essentielle. Une équipe de deux personnes est nécessaire. Quatre enquêteurs ou plus dans la même pièce participant aux essais peuvent être perturbateurs, étant donné que certaines étapes exigent un calendrier strict. Une documentation photographique appropriée et de haute qualité, lorsqu'elle est indiquée, est importante.
Ce modèle est idéal pour les études de développement de médicaments. La maîtrise du modèle animal et des techniques d'essais ont assuré une excellente reproductibilité19 des études d'efficacité et de sécurité.
Il s'agit d'une approche expérimentale puissante parce qu'elle élimine la variabilité confondante des modèles antérieurs, a rationalisé le modèle animal et essentiellement standardisé l'essai des cinq paramètres de DED. L'application réussie de ce modèle à l'étude d'un agent thérapeutique candidat a affirmé son utilité pratique en tant que modèle animal informatif pour une maladie dans le besoin désespéré d'agents nouveaux et d'une compréhension plus profonde de sa pathogénie.
Déclarations de divulgation
Les auteurs ne déclarent aucun intérêt concurrent, sauf pour BR qui a une participation dans Medicon Pharmaceuticals, Inc. et Apis Therapeutics, LLC; et LH, un employé de Medicon Pharmaceuticals, Inc. avec une participation dans Apis Therapeutics, LLC.
Remerciements
Toutes les études sur les animaux ont été réalisées conformément à toutes les lignes directrices réglementaires et institutionnelles pertinentes. Toutes les études ont été approuvées par la Commission d'examen institutionnel de l'Université Stony Brook et exécutées conformément à l'Énoncé ARVO pour l'utilisation des animaux dans la recherche ophtalmique et visuelle.
Ces études ont été appuyées en partie par une subvention d'opportunités de recherche ciblée de la Stony Brook University School of Medicine (Grant Number 1149271-1-82502) et une subvention de recherche de Medicon Pharmaceuticals, Inc., Setauket, NY. Les auteurs remercient Michele McTernan pour son soutien éditorial.
matériels
| Name | Company | Catalog Number | Comments |
| 100 mm macro lens | Canon EF 100mm f/2.8L IS USM | 3554B002 | |
| 26 gauge needles (5/8) | Becton Dickinson and Company, Franklin Lakes, NJ | 305115 | Needles for injecting ConA into the lacrimal glands |
| 27 gauge needles (5/8) | Becton Dickinson and Company, Franklin Lakes, NJ | 305921 | Needles for injecting ConA into the lacrimal glands |
| Aceproinj (acepromazine) | Henry Schein Animal Health, Dublin, OH | NDC11695-0079-8 | 0.1ml/kg subcutaneously injection for rabbit sedation |
| Anesthesia vaporizer | VetEquip, Pleasanton, CA | Item #911103 | |
| Bishop Harmon Forceps | Bausch and Lomb (Storz), Bridgewater, NJ | E1500-C | Tissue forceps |
| Caliper | Bausch and Lomb (Storz), Bridgewater, NJ | E-2404 | Caliper used to measure length of needle during ConA injection |
| Concanavalin A | Sigma, St. Louis, MO | C2010 | Make 5mg/ml in PBS for injection into rabbit lacrimal glands |
| DSLR camera | Canon EOS 7D DSLR | 3814B004 | Digital single lens reflex camera |
| fluorescein | AKRON, Lake Forest, IL | NDC17478-253 | Dilute to 0.2% with PBS to measure TBUT |
| Isoflurane | Henry Schein, Melville, NY | 29405 | |
| Lactoferrin ELISA kit | MyBiosource, San Diego, CA | MBS032049 | Measure tear lactoferrin level |
| lidocaine | Sigma, St. Louis, MO | L5647 | 1% in PBS for anesthesia agent |
| macro/ring flash | Canon Macro Ring Lite MR-14EXII | 9389B002AA | |
| Osmolarity tips | TearLab Corp., San Diego, CA | #100003 REV R | Measure tear osmolarity |
| PBS (phosphate buffered saline) | Mediatech, Inc. Manassas, VA | 21-031-CV | |
| Rabbit, New Zealand White or Dutch Belted (as described in text) | Charles River Labs, Waltham, MA | 2-3 kg | Research animals |
| Rose Bengal | Amcon Laboratories Inc., St. Louis, MO | NDC51801-004-40 | 1% in PBS, stain the ocular surface |
| Schirmer strips | Eaglevision, Katena products. Denville, NJ | AX13613 | Measure tear production |
| Surgical Loupes +1.50 | Designs for Vision, Bohemia, NY | Specialty item | Provide magnificantion of ocular surface while observing tear break up and performing Concanavalin A injections. |
| TearLab Osmometer | TearLab Corp., San Diego, CA | Model #200000W REV A | Measure tear osmolarity |
| Ultrasound probe | VisualSonics Toronto, Ont | MX 550 S | Untrasonography-guide Con A injection for inferior lacrimal gland |
Références
- Paulsen, A. J., et al. Dry eye in the Beaver Dam Offspring Study: prevalence, risk factors, and health-related quality of life. American Journal of Ophthalmology. 157 (4), 799-806 (2014).
- Vehof, J., Kozareva, D., Hysi, P. G., Hammond, C. J. Prevalence and risk factors of dry eye disease in a British female cohort. British Journal of Ophthalmology. 98 (12), 1712-1717 (2014).
- Tan, L. L., Morgan, P., Cai, Z. Q., Straughan, R. A. Prevalence of and risk factors for symptomatic dry eye disease in Singapore. Clinical and Experimental Optometry. 98 (1), 45-53 (2015).
- Craig, J. P., et al. TFOS DEWS II Report Executive Summary. The Ocular Surface. 15 (4), 802-812 (2017).
- Baudouin, C., et al. Clinical impact of inflammation in dry eye disease: proceedings of the ODISSEY group meeting. Acta Ophthalmologica (Copenhagen). 96 (2), 111-119 (2018).
- Calonge, M., et al. Dry eye disease as an inflammatory disorder. Ocular Immunology and Inflammation. 18 (4), 244-253 (2010).
- Pflugfelder, S. C., de Paiva, C. S. The Pathophysiology of Dry Eye Disease: What We Know and Future Directions for Research. Ophthalmology. 124 (11S), S4-S13 (2017).
- Buckley, R. J. Assessment and management of dry eye disease. Eye (London, England). 32 (2), 200-203 (2018).
- Clayton, J. A. Dry Eye. New England Journal of Medicine. 378 (23), 2212-2223 (2018).
- Barabino, S. Animal models of dry eye. Archivos de la Sociedad Española de Oftalmología. 80 (12), 695-696 (2005).
- Stern, M. E., Pflugfelder, S. C. What We Have Learned From Animal Models of Dry Eye. International Ophthalmology Clinics. 57 (2), 109-118 (2017).
- Chen, Z. Y., Liang, Q. F., Yu, G. Y. Establishment of a rabbit model for keratoconjunctivitis sicca. Cornea. 30 (9), 1024-1029 (2011).
- Gilbard, J. P., Rossi, S. R., Gray, K. L. A new rabbit model for keratoconjunctivitis sicca. Investigative Ophthalmology & Visual Science. 28 (2), 225-228 (1987).
- Guo, Z., et al. Autologous lacrimal-lymphoid mixed-cell reactions induce dacryoadenitis in rabbits. Experimenal Eye Research. 71 (1), 23-31 (2000).
- Burgalassi, S., Panichi, L., Chetoni, P., Saettone, M. F., Boldrini, E. Development of a simple dry eye model in the albino rabbit and evaluation of some tear substitutes. Ophthalmic Research. 31 (3), 229-235 (1999).
- Xiong, C., et al. A rabbit dry eye model induced by topical medication of a preservative benzalkonium chloride. Investigative Ophthalmology & Visual Science. 49 (5), 1850-1856 (2008).
- Heymann, F., Hamesch, K., Weiskirchen, R., Tacke, F. The concanavalin A model of acute hepatitis in mice. Lab Animal. 49 (1 Suppl), 12-20 (2015).
- Nagelhout, T. J., Gamache, D. A., Roberts, L., Brady, M. T., Yanni, J. M. Preservation of tear film integrity and inhibition of corneal injury by dexamethasone in a rabbit model of lacrimal gland inflammation-induced dry eye. Journal of Ocular Pharmacology and Therapeutics. 21 (2), 139-148 (2005).
- Honkanen, R. A., Huang, L., Xie, G., Rigas, B. Phosphosulindac is efficacious in an improved concanavalin A-based rabbit model of chronic dry eye disease. Translational Research. 198, 58-72 (2018).
- Huang, L., et al. The novel phospho-non-steroidal anti-inflammatory drugs, OXT-328, MDC-22 and MDC-917, inhibit adjuvant-induced arthritis in rats. British Journal of Pharmacology. 162 (7), 1521-1533 (2011).
- Mattheolabakis, G., et al. Topically applied phospho-sulindac hydrogel is efficacious and safe in the treatment of experimental arthritis in rats. Pharmaceutical Research. 30 (6), 1471-1482 (2013).
- Osmalek, T., Froelich, A., Tasarek, S. Application of gellan gum in pharmacy and medicine. International Journal of Pharmaceutics. 466 (1-2), 328-340 (2014).
- Lemp, M. A. Report of the National Eye Institute/Industry workshop on Clinical Trials in Dry Eyes. Contact Lens Association of Ophthalmologists Journal. 21 (4), 221-232 (1995).
- Dal Piaz, F., Braca, A., Belisario, M. A., De Tommasi, N. Thioredoxin system modulation by plant and fungal secondary metabolites. Current Medicinal Chemistry. 17 (5), 479-494 (2010).
- Davis, F. A. The Anatomy and Histology of the Eye and Orbit of the Rabbit. Transactions of the American Ophthalmological Society. 27, 402-441 (1929).
- Lima, L., Lange, R. R., Turner-Giannico, A., Montiani-Ferreira, F. Evaluation of standardized endodontic paper point tear test in New Zealand white rabbits and comparison between corneal sensitivity followed tear tests. Veterinary Ophthalmology. 18 (Suppl 1), 119-124 (2015).
- Zheng, W., et al. Therapeutic efficacy of fibroblast growth factor 10 in a rabbit model of dry eye. Mol Med Report. 12 (5), 7344-7350 (2015).
- Wiechmann, A. F., Summers, J. A. Circadian rhythms in the eye: the physiological significance of melatonin receptors in ocular tissues. Progress in Retinal and Eye Research. 27 (2), 137-160 (2008).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon