Method Article
コンカナバリンによる涙腺への注射によって誘発される水性欠損性ドライアイ病のウサギモデル:薬物有効性研究への応用
要約
この記事では、眼窩涙腺系のすべての部分にコンカナリンAを注入することによって、ウサギの急性または慢性ドライアイ病を誘発する方法の開発について説明します。この方法は、既に報告されているものよりも優れ、薬理剤の研究に適したドライアイの再現性、安定モデルを生成する。
要約
ドライアイ病(DED)は、眼表面の多因子性炎症性疾患であり、世界中の人間の6人に1人に影響を及ぼし、生活の質と医療費に驚異的な影響を及ぼします。その主要な特徴を再現する有益な動物モデルの欠如は、DEDのための新しい治療薬の探索を妨げる。利用可能なDED動物モデルは限られた再現性および有効性を有する。ここでは、DEDがマイトゲンコンカナリンA(Con A)をウサギの眼窩涙腺に注入することによって誘導されるモデルを提示する。このモデルの革新的な側面は、劣った涙腺へのCon Aの最適かつ再現可能な注入を確実にするために超音波(米国)ガイダンスの使用である。涙の代償生産を制限するすべての眼窩涙腺へのCon Aの注入;そして、DEDの状態を不本に延長するコンAの定期的な繰り返し注射の使用。DEDおよび試験剤に対する応答は、涙液の生成、涙液膜の安定性、角膜および結膜粘膜の状態を評価するパラメータのパネルで監視される。彼らは涙の浸透モル濃度を含みます, 涙の解散時間, シルマーの涙のテスト, バラベンガル染色, 涙ラクトフェリンレベル.DEDの誘導とそのパラメータのモニタリングについて詳しく説明します。このモデルは、シンプルで堅牢で再現性があり、情報を提供します。この動物モデルは、DEDの涙液生理学および病態生理学の研究、ならびにDEDの治療のための候補薬剤の有効性および安全性の評価に適している。
概要
ドライアイ病(DED)は、有病率および罹患率が高い慢性疾患である1、2、3、4.炎症は、その病因5、6において重要な役割を果たす。DEDの病態生理学は、生産不足または涙の過剰蒸発のいずれかから導出されるとして概念化される。前者は水性欠乏性DED7としても知られています。シェーグレン症候群は、DEDの原型的原因を広く研究し、主に涙腺(LG)に影響を及ぼし、DEDの病因におけるその重要性の顕著な例である。DEDは、一時的な救済を提供する人工涙、または眼の炎症を抑制するシクロスポリンまたはリフィテグラストで治療されることが多い。DEDに利用可能な治療法のどれも最適ではなく、新しい薬剤8、9の開発を必要とする。
DEDの新しい治療薬の探索は、DEDの病態生理学的複雑さを考えるとわかりにくい薬物分子標的の欠如という3つの大きな課題によって妨げられている。有望な薬剤の格差;そして、DEDの主要な特徴を再現する動物モデルの欠如。
ほとんどの医薬品開発の取り組みと同様に、DEDの有益な動物モデルは、動物モデルが人間の病気を完全に再現していないという公理的な声明にもかかわらず、重要な調査ツールです。DEDのマウス、ラット、ウサギのモデルは最も一般的に使用され、犬や霊長類は10、11を使用しない。これまでに報告された12匹を超えるウサギDEDモデルのほとんどは、LGを除去するか、またはその機能12、13、14、15、16を妨害することによって、涙の産生を減らそうと試みる。そのようなアプローチには、ILGの外科的切除が含まれる。その排泄管の閉鎖;リンパ球、マイトジェン、ボツリヌス毒素、アトロピン、またはベンザルクロニウムの照射または注入によるLG機能の障害。これらの方法の主な制限は、それらの矛盾と涙の生産の頻繁な部分的な抑制です。
植物起源のレクチンであるコンカラバリンA(Con A)は、強力な刺激T細胞サブセットであり、肝炎17およびDED18の実験モデルで使用されている。元の Con A ベースのモデルは、相対的な単純性を含む重要な利点を提供すると報告されました。LGsにおける炎症性細胞の流入, シェーグレンのような疾患を模倣;炎症促進性サイトカインの刺激 IL-1β, IL-8, TGF-β1;涙液のクリアランスと涙液の破綻時間(TBUT)を測定することによってモニターされる涙機能の低下;抗炎症コルチコステロイドに対して示される薬物応答性。
この有望な方法を適用すると、その利点に加えて、その全体的な改訂と抜本的な改善を必要とする制限が特定されました。この方法の 3 つの重要な欠点が文書化されています。まず、モデルは急性モデルでした。約1週間後に誘導されたDEDが沈静化した。第二に、動物の応答は一貫性がなかった。実証されているように、下LG(ILG)への「盲目」経皮注射では、Con Aは標的腺に無作為にのみ送達された。ILGの解剖学の詳細な研究は、そのサイズがそのような注射を「ヒット・オア・ミス」の努力をする4倍の19まで変化する可能性があることを明らかにしました。最後に、ILGを注入しても、優れたLG(SLG)は頻繁に減少した涙流を補償し、モデルを問題にしました。
これらの重要な制限は、3つの改変を方法に導入することによって克服され、DEDの優れた動物モデルを生成した。まず、ILGへのコンAの注入は、超音波(米国)の指導の下で行われ、コンAが腺に入っていることを保証した。注射の成功は、図1に示すように、注射後のUS画像を得ることによって確認された。第2に、SLGの代償性涙液寄与を除去し、この腺のパルペブラル部分と眼窩部分の両方にコンAを注入した。最後に、DEDのこの急性モデルは、7-10日ごとにCon Aの繰り返し注射によって慢性モデルに変換された。2ヶ月の持続時間のDEDは、これらのウサギで容易に達成される。このアプローチの成功は十分に文書化されています19.
既に述べたように、DEDの動物モデルの重要な適用は、候補治療薬の有効性および安全性を決定することです。このモデルの有用性は、眼薬として投与される新規の抗炎症性低分子20,21であるホスホススリンダック(OXT-328)の研究によって実証された。その有効性は、DED19のパラメータのパネルに基づいて実証されました。このモデルの相対的なシンプルさと有益な性質はまた、ホスホススリンダックをDED、シクロスポリンおよびリフィテグラストの2つのFDA承認薬と並べて比較することができ、その強力な前臨床的優位性を実証した。
プロトコル
すべての動物研究は、ストーニーブルック大学の機関審査委員会によって承認され、眼科および視覚研究における動物の使用に関するARVO声明に従って行われました。
1. 動物と住宅
- 体重2~3kgのニュージーランド・ホワイト(NZW)ウサギを獲得。
- ウサギを厳しい温度(65±5 °F)と湿度(45±5%)でケージに一匹収容するコントロール。照明のオン/オフサイクルは 12 時間にする必要があります。
- 水と標準的なウサギのチャウへの無制限のアクセスを提供します。彼らは目に影響を与えるビタミンAを含んでいる可能性があるため、食事の豊かさを排除します。
- ベースライン対策またはドライアイの誘導の前に少なくとも2週間動物を順応させる。
2. 麻酔法と安楽死
注:すべての手順は、中程度の沈下を必要とするCon A注射を除いて、軽度の沈血を必要とします。
- 軽度の沈血の場合は、26ゲージの針を使用して肩の上にアセプロマジン(1mg/kg)を皮下に注入する。軽度の沈血のためのエンドポイント:動物は耳葉がもはや完全に直立しないリラックスした頭部の位置を維持する。
注: 適切なエンドポイントに達していない場合、アセプロマジンの追加の注入が与えられる。動物は常に目を覚まし、ひげの触れに反応し、呼吸が遅くなることは決してありません。 - 適度な沈食のために、まず動物に上記のようにアセプロマジンを与える。エンドポイントに到達すると(上記の注を参照)、O2フローが1 L/minに設定され、イソフルラン送達量が5%に設定されたガスマスクを使用してイソフルランを与える(図2)。
- ウサギの体の調子が完全にリラックスし、耳が完全にフロッピーになるまでイソファフルランを投与します。
注:動物が横に回っているとき、補正筋肉の動きは起こるべきではありません。呼吸は常に自発的なままです。 - 自然回復は2〜5分以内に起こる:徴候は、自発的な頭部運動および増加または正常な筋肉の緊張を含む。実験手順が中程度の沈座で完了した後、ウサギの行動が正常に戻るまで約30分間観察します。
注:いずれの形態の沈血中も、眼用軟膏は必要ありません。1)軽度の沈血では、動物はまだ警戒し、瞬く間反射を維持しています。中程度の沈血では、瞬き反射の阻害は非常に短く、眼表面が危険にさらされない。2) 眼表面上の眼用軟膏の配置は、試験中に評価された構造の可視化を妨げる。 - 安楽死: 静脈内ペントバルビタールの過剰摂取を使用します (100 mg/kg).
3. ニチタ性膜の除去
- 順応期間中(通常は最初の週)に除去を行い、角膜の完全かつ正確な評価を可能にする。
-
右のニシタリング膜への注入
注:両眼のnictating膜を取り除く場合は、1回のセッションでこれを行うのが最も簡単です。片目から始め、説明に従って進みます。説明をわかりやすくするために、この方法は右目から始まります。- 適切なサイズの拘束袋にウサギを入れます。
- ステップ2.1で説明したように軽度の沈降を誘発する。
- マイクロピペットを使用して、右目に25 μLの防腐剤フリーリドカインを塗布します。
- 柔軟なワイヤー蓋鏡を瞼の間に置きます。
- 0.3鉗子(または同等)を使用して、その頂点で刺激膜をつかみ、角膜の上に伸ばします。
- リドカイン1%、1:100,000エピネフリンを26ゲージ鋭い針を用いてニチタティング膜の基部に結膜下に注入する(図3A)。適度なブレブは、ニチタリング膜の上に形成する必要があります.
- 鏡を取り外します。
- 左のニチタ膜と同一の注入を行う。
-
ニチタリング膜を切断する
- 約5分後、蓋の鏡を右目に戻します。0.3鉗子(または類似)を使用して、頂点でnictating膜をつかみ、引き込む。
- ウェストコットはさみまたは同等のシストを使用して、そのベースでnictating膜を切り落とします(図3B)。
注:出血は最小限であり、通常は焼灼を必要としません。それにもかかわらず、高温電池焼灼は、追加の止止めが必要な場合に備えて、常に近くに保管されています。 - 鏡を取り外します。
- 眼に外用抗生物質軟膏(例えば、ネオマイシン、ポリミキシン、バシトラシン、ヒドロコルチゾン)を配置する。
- ハーダーランド腺はそのままにしておきます。硬膜が後退すると、硬膜腺が時々見られる。
注:ニチア性膜を除去した後、鼻または上の結膜領域に大きな白い塊または組織の標高が見られる場合、膜は、難解腺が自発的に脱出することを可能にし、その基に近すぎる切除された。後続の手順でこれを防ぐために、ベースに刺激膜の多くを残します。 - さらに操作を行うか、眼表面アッセイが行われる前に、少なくとも1週間は眼表面を治癒させます。
4. ドライアイパラメータの測定と涙液サンプルの収集
注: DED パラメータは、スタディ プロトコルのニーズに基づいて測定します(例えば、ベースラインとその後の指定された時点で)。DEDの測定は、毎回忠実に複製するために厳密な努力で、次の順序で行われるべきです。概日変動を最小限に抑えるために、ほぼ同じ時刻(±1時間)にすべての動物をテストします。これらの測定には通常、2人の調査員のチームが必要です。
- ウサギを拘束袋に入れます。軽度の沈血を誘発する。
- ティアオスモルシティ22
- まぶたを5~10回手動で点滅して、眼表面に涙層を均等に分配します。
- 下蓋を軽く引き込みます。
- 下部フォルニックスに沿ってパルペブラルとバルバー結膜の接合部にTearLabオスマメーターで涙をサンプリング, ちょうど切り捨てられたニキタ膜の基部に後部.
- 製造元の指示に従って TearLab オスモルシティ テストを使用して浸透度を測定します。
- 涙の破綻時間(TBUT)
- このアッセイのために部屋を暗くする。
- まぶたの間にワイヤー蓋の鏡を置きます。
- マイクロピペットを使用して、角膜表面に0.2%のフルオレセインの50μLの低下を加えます。角膜上のフルオレセインの分布が最初のドロップで得られない場合は、2回目のドロップを配置する。
- 即時にタイマーを開始します。
- 青い光の下で前角膜の涙フィルムを観察します。TBUT は、黒いドット、線、またはフルオレセインフィルムの明らかな破壊を開発するのに要する時間として定義されます (図 4)。必要に応じて、+1.50倍率を提供する外科ルーペを使用して、早期の破綻の兆候をよりよく視覚化します。最大1分間監視します。ここで定義されているブレークアップが 1 分後に発生した場合は、60 s のみの TBUT を記録します。
- シルマーの涙のテスト(STT)
- 25 μLの防腐剤を含まないリドカインを眼表面に塗布します。
- 残留リドカインおよび任意の涙液を吸収するために、劣ったフォルニックスにウェック細胞外科用槍を置きます。必要に応じて、下まぶたをスポンジの近位端を覆って所定の位置に保つのを助けます(図5A)。
- 約30sの後、Weckスポンジを取り外します。
- すぐに下蓋の中間点で角膜と手脈結膜の間のスペースにシルマーの涙のテストストリップを挿入します。
- タイマーをすぐに起動します(図5B)。
- 5分後、ストリップの湿った部分の長さを測定します。これは STT 値です。
- 三重で測定を実行し、3つの測定値の平均をSTT値として報告します。
- 涙液サンプルの収集
- ラクトフェリンなどの各種の分析物のレベルをアッテ言う涙液サンプルを採取するために、STT値が5分で記録された後、少なくとも20mmの湿潤が得られるまでストリップを所定の位置に残す。
注: DED が誘発された後に十分な濡れが生じない場合は、ストリップを下側のフォルニックスに深く進めて、このエンドポイントに妥当な時間内に到達できるようにしてください。 - 湿ったストリップを切り、すぐに490 μLのチルドティアコレクションバッファ(4%BSA、1M NaCl、0.1%Tween-20 PBSでプロテイナーゼ阻害剤カクテル)に入れます。
- サンプルは-80°Cで保存できるまで氷の上に保管し、アッセイされるまで残ります。
- ラクトフェリンなどの各種の分析物のレベルをアッテ言う涙液サンプルを採取するために、STT値が5分で記録された後、少なくとも20mmの湿潤が得られるまでストリップを所定の位置に残す。
- ローズ ベンガル染色(RBS)
- マイクロピペットを使用して角膜に1%の防腐剤フリーリドカインの50 μLを塗布します。
- 30秒後、1%のバラベンガルの25μLを眼表面に置き、まぶたを手動で点滅させ、均等に分配します。
- 即時にタイマーを開始します。
- 3.5分で、蓋の間にワイヤー蓋の鏡を置きます。
- 4.0分で、上の結膜と角膜の表面を撮影します(図6)。
メモ:使用するカメラのタイプに合わせて調整します。標準的な設定:デジタル一眼レフカメラ、絞り優先モード(絞り13以上)、ISO 6000、100mmマクロレンズ2本の12.5mm延長チューブ、手動焦点モード、最大倍率のレンズ、およびスルー・ザ・スルー・ザ・レンズ・モードで自動設定されたマクロ/リング・フラッシュからのイルミネーション。リングフラッシュのフォーカスランプは、角膜に焦点を当てるのを助けるためにオンになっています。 - 1分以内に両目のすべての写真を完成させます。
- スコア眼面染色NEI法23を用いて以下のように修正した。6の別々の結膜ゾーンを等級で指定しないでください。各目の優れた結膜をスコア。これは、地球を操作することなく簡単に撮影された結膜面の部分です。操作は、実際に眼表面の染色を変更する可能性があります。
- 涙ラクトフェリンレベルは、涙腺からの涙液産生の代理尺度である。アッセイ涙ラクトフェリンは、上記のように回収された涙液中に、製造者の指示に従って酵素結合免疫吸着アッセイ24キットを用いた。
5. ドライアイの誘導と治療
注:眼窩涙腺系の3つの部分が注入されます。
- アセプロマジン0.2mg/kg皮下でウサギを鎮静させます。
- 眼窩周囲および頭皮領域の毛皮をせん断し、ナイルを使用して残留毛皮を完全に取り除きます。解剖学的特徴とコンカナリンAの米国ガイド注入のより良い視覚化のために完全に滑らかな肌を残します (図7).
- 上述のように中等度の沈座を誘発する。
- 上涙腺(PSLG)のパルペブラル部分の注入
メモ:最初にPSLGのインジェクションを実行します。- マイクロピペットで適切な眼25μLの防腐剤フリーリドカイン1%を塗布します。
- 上まぶたをエベトし、腺のパルペブラル部分を示す突起が見られるまで後方眼窩に穏やかな内側圧を加える。PSLGは、上蓋の後部(時間)部分に小さな球根高として現れます。
注: 学習プロセス中に腺組織を表示するには、領域に 5% のフルオレセインを適用します (図 8A)。球根PSLGから涙が流れているのが見えます。蛍光管の適用はCon Aの管理のために必要ではない;腺組織を示すために、それは、イラストレーションの目的のためにのみ行われます。 - 細歯の鉗子と27ゲージの注射器注射器の針を使用して、直結型アプローチを使用して腺を直接貫通する。針を組織に2mm進め、0.1 mLの体積で500μgのコンAを注入します(図8B)。
注: この注射は時々痛みを伴うことがあります。.必要に応じて、この注射が完了するまで動物をイソファフルランの下に保管してください。
- 眼上涙腺の注入(OSLG)
注: OSLG は、連続して続けて続きます。- 内側圧を地球に適用し、OSLG が後面の強制から突き出ます(必要に応じて解剖学については ref25を参照)。後部の振動から OSLG の突起を使用して、内側の圧力を地球に適用します (図 9、赤い矢印) 。プロチューブは、後の強制を見つけるための総局在化として機能します。
- 頭蓋骨の骨の開口部が感じられるまで、先端を閉じた湾曲した鉗子を使用して領域をインデントします。これは、突起下の前/後方向を持つスリット状になります。
- 鉗子を使ってささやかな圧力をかけ、皮膚にくぼみを残し、針の配置の目印となる(図10A)。
- インデントマークの上に皮膚に垂直な針(27ゲージ、5/8インチ針のツベルクリンジ)を挿入し(図10B)〜1/4インチをインシュアに挿入し、注射部位と骨状軌道リムの中間点を目指して後方および外部に針を方向に向けます。
注:インシカルが針で正確に標的にされていない場合、頭蓋骨はその進歩を妨げ、 - 針のハブに達したら、1000 μgのコンAを0.2 mLの体積でゆっくりと注入します(図10C)。
- PSLG と OSLG の両方の注入を 2-3 分以内に完了します。
- イソファフルランのセドレーションから動物を取り除きます(まだ行われていない場合)。下垂体腺(ILG)の注射は、通常、さらなる沈着なしで完了することができる。
- 下涙腺の注射
- 横から動物を見る。ILGの目立ちは、軌道の下側の前部に沿って見ることができます(図11A)。
- ILG腺の表面部分が頬骨上の表面的な(より外部の)休息場所から軌道上のより内側の位置に移行する皮膚上の外科的マーキングペンまたは適切な永久的なマーカーを使用して垂直線を引く。これは通常、前肢に劣っています(図11A)。
- 皮膚上のこの線を横切って垂直に保持された米国のプローブを掃引することによって、頬骨の端を特定します。ILG遷移は、腺の像が明らかに外接する(ザイゴマティック骨の超エコー線が画像の腺の下端に沿って見られる)から、認識可能な内側の境界のないものに変化する場合に起こる(ザイゴマティック骨エコーはもはや存在しない)。.
- 米国の画面がこの変化を示すときに、スキンに描かれた線に対するハンドピースの相対位置を観察します。これは、Con Aを与える必要がある「注射部位」です。
- 射状アーチの骨の内側のポイントでCon Aを腺に入れるように注射の深さを制御します。
- 注入の深さを次のように決定する:必要な注入深度を、ザイゴマティックボーンの深さ(超EchoIc)+1mmに設定します。
- 針を「注射部位」〜12mmの腺に挿入し、体外の露出した針の長さ(外科用キャリパーで測定)が5.8.6で計算された差と等しくなるまでゆっくりと引き出す(図12)。0.2 mLで1000μgのコンAを注入します。
注:腺のカプセルが穿孔され、単に針で押されないようにするために、針は、その撤退が始まる前に、〜12mmまたはハブにほぼ挿入する必要があります。 - 米国を繰り返して、注射の成功を確認します。ILG は、特徴的な低響空間を示すはずです (図 1)。
注:ILG注射は、動物26によって最もよく許容されるものであり、したがって、最後に行われます。
- 10分以内に両眼のすべての腺を注入するために全体の手順を完了します。これには、手順の能力の達成が必要になります。
注:2眼窩涙腺への注射の単一のセットは、1〜2週間持続する急性DEDを誘発します。 - より長い期間のDEDの場合、7日ごとに上記とまったく同じようにCon Aを注入します。このような注射が正常に行われている 6 まで。
6. 手続き後のケア
- Con Aの注射後、少なくとも10〜20分間、または麻酔効果が消耗するまで、拘束袋に入っている動物を監視します。
- 彼らは胸骨の回復を維持するために十分な意識を取り戻すまで、動物を放置しないでください。完全に回復するまで、それらを個々のケージに戻さないで下します。
- 処置後の痛みは通常軽度であり、48時間未満続く。必要に応じて、皮下ケトロラック(5 mg/kg)の単回投与を与える。より激しい痛みのために、皮下ブプレノルフィンを8時間ごとに0.1mg/kg与える。
結果
Con A注射は、密なリンパ球浸潤を特徴とする涙腺で強い炎症反応を誘発した(図13)、涙液産生の減少を伴う。すべての破傷パラメータが著しく変更されました(表1および表2)。さらに、涙液ラクトフェリンレベルが抑制された(コントロール= 3.1±0.45対コンA注入= 2.7±0.02 ng/mgタンパク質(平均±SEM);p<0.03)。最終的な結果は、角膜および結膜上皮を損ない、バラベンガル染色の増加によって証明された(図6)。
3つの軌道LG組織の注入は、以前の方法18、27によって達成された状態とは異なり、一貫した均一なDED状態を生じた。この結果の主な貢献者は、ILGの米国ガイド注入とOSLGの注入でした。表1は、この方法の顕著な結果をまとめたものである。すべての変更は、重大な DED と一致しています。
コン A 注射の単一のセットは、約 1 週間持続する DED を生成します。;すべての臨床パラメータは10日目(表2)によって正常化します。シーケンA注射は、約1週間離れてDEDの持続時間を延長します。たとえば、7 日目の 2 番目の Con A 注射では、2 週間の DED が維持されます。約5セットの注射後、DED状態は、多くの場合、さらなる注射を必要とせずに永久的になります。
コンA誘導DEDを有するウサギを新しい薬剤ホスホススリンダックで治療した際、この疾患を著しく抑制した。たとえば、 この薬剤TBUTによる1週間の治療に続いて、車両処理動物(43.6±4.0対12.2±2.8s;p<0.001;平均±SEM、これらの値および以下の値)と比較して著しく増加し、涙の浸透度は正規化された(2944±4.6対311±2.0mM/L&0;l2)。機械学的には、ホスホスリンダックは、IL-1β(8.4±1.2対21.2±6.6 pg/mgタンパク質;p<0.03)およびIL-8(4.9±1.7対13.5±5.0 pg/mgタンパク質;p<0.05)の2つの重要なインターロイキンのレベルを低下させる。
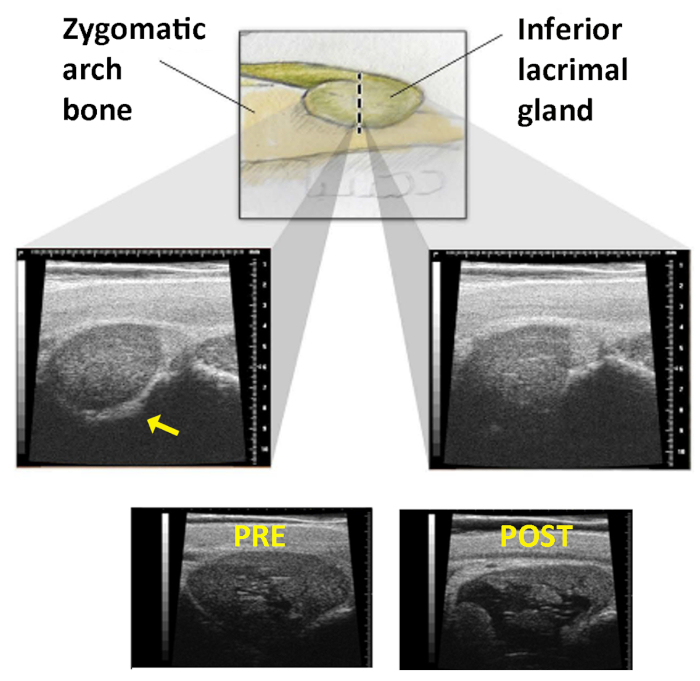
図1:下涙腺の超音波画像。上部パネル:ILGは、円状のアーチの下に横たわるように軌道上でより深く移動します。破線は、米国のプローブがスイープされるスキン上の線を表します。ミドルパネル:ハンドピースがこの線を越えると、検査者は左の画像(矢印)に存在し、右側に消える頬骨エコーの損失を探します。下部パネル:コンAの注射前(左)と(右)注射後に撮影されたILGの画像は、腺内の大きな嚢胞腔の発達が適切な送達を確認する。許可を得て転載19.この図の大きなバージョンを表示するには、ここをクリックしてください。

図2:ガスマスクの沈座。この写真は、イソフルランを用いて短い適度な沈食を提供するガスマスクを示す。この図の大きなバージョンを表示するには、ここをクリックしてください。
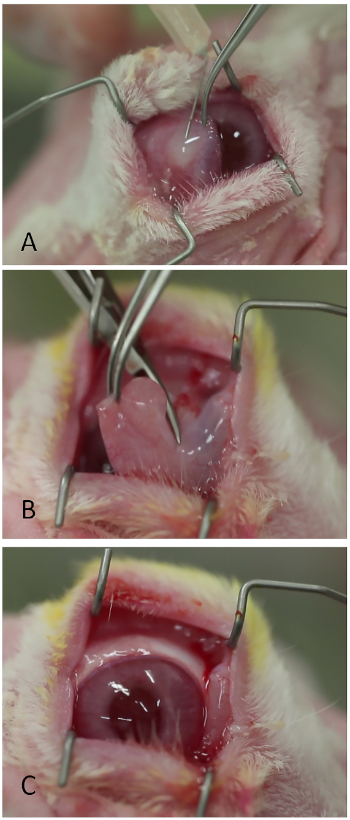
図3:nictating膜の除去。(A)リドカイン/エピネフリンの注射(B)ウェストコットはさみによる根元でのnictating膜の切り詰め。(C)眼表面は、刺激性膜を除去した後より容易に可視化した。この図の大きなバージョンを表示するには、ここをクリックしてください。
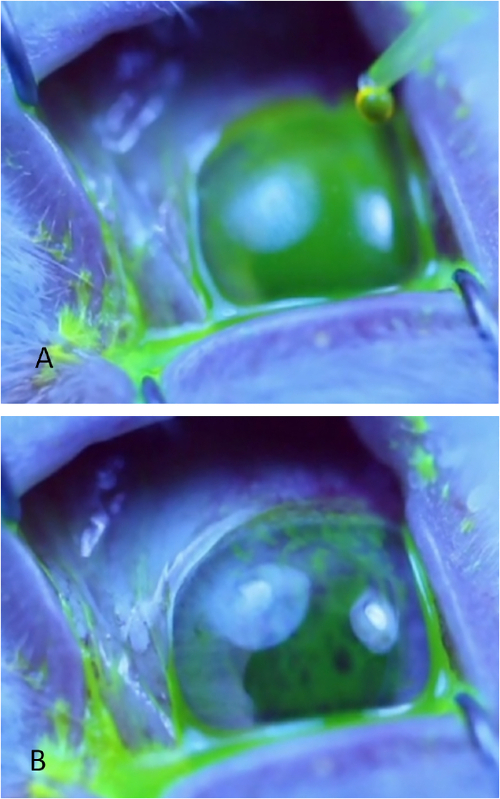
図4:涙液の破断時間測定(A)フルオレセイン滴の塗布直後の青色光下の角膜表面の均一緑色涙液フィルム出現。(B)すでに顕著な分裂を受けている角膜表面は、フルオレセイン内の複数の暗い円と線筋によって証明される。最初の暗いスポットまたは線が発達するとすぐに、解散時間が記録されます。2つの水色の円は、角膜の光源の反射です。この図の大きなバージョンを表示するには、ここをクリックしてください。
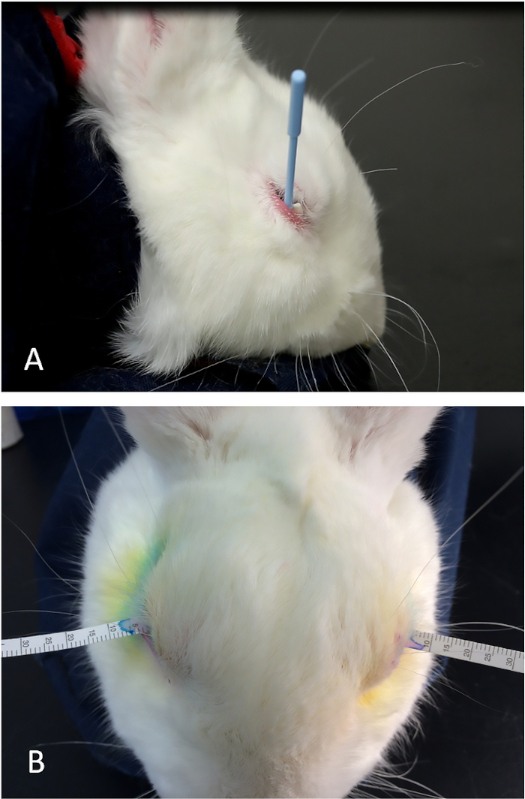
図5:シルマーの涙のテスト。(A)残存局所リドカイン溶液およびベースライン涙液を除去するために、下のフォルニックスにWeck-Celスポンジを適切に配置する。三角スポンジの後縁を下蓋のマージンの下に置くことによって、涙片の配置前に眼表面を乾燥させる非常に均一な技術を維持することができる。(B)A涙片は、グローブと下蓋(パルペブラル結膜)との間の下蓋の中間位置に適宜配置される。この図の大きなバージョンを表示するには、ここをクリックしてください。

図6:ローズベンガル染色アッパー:角膜表面の写真。左:コンAで治療する前にバラのベンガル染色は存在しない。右:拡散角膜および結膜染色は、注射後の上鼻象限(右上)に見られる。低い:上のバルバー結膜からの結膜印象細胞学。左:治療前に多数のゴブレット細胞が存在する。右:上皮細胞は存在するが、ゴブレット細胞は治療後に存在しない。この図の大きなバージョンを表示するには、ここをクリックしてください。

図7:コンカナリン注射のためのウサギの調製。(A)小さなせん断を使って毛皮を除去し、ランドマークを容易に可視化して、眼窩上涙腺を識別できます。(B)ナイルは、せん断後に残っている毛を除去するために使用されます。この図の大きなバージョンを表示するには、ここをクリックしてください。
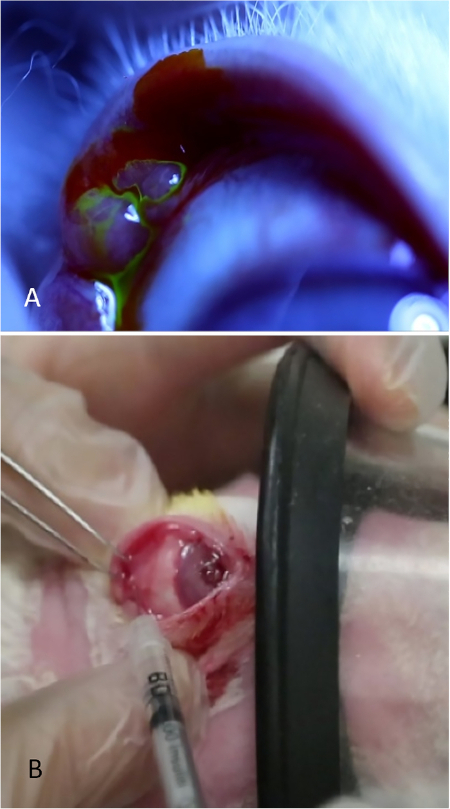
図8:椎間部涙腺の注射(A)前記パルペブラル涙腺は、上蓋の後側側頭部に球根状の高さとして現れる。2%のフルオレセインの滴を適用した後、この腺の表面から涙が流れているのが見られます。(B)ウサギが中程度の沈液を受けている間に、椎間体性涙腺が注入されている。ある調査員はまぶたを引き込み、腺の露出を最適化し、2人目の研究者が腺を注入する間にマスクを固定する。この図の大きなバージョンを表示するには、ここをクリックしてください。

図9:眼窩上涙腺の局在化皮膚輪郭の変化は、後部インシアルを突き抜けるOSLGの位置を示す。地球の内側の圧力を交互に(大きな矢印)すると、皮膚の小さな標高と見なされる上方眼球が脱出する。この標高は、圧力が加えられるたびにサイズが大きくなります (小さな矢印)。この腺の位置は、通常、後方軌道リムに沿った位置にあります。この図の大きなバージョンを表示するには、ここをクリックしてください。
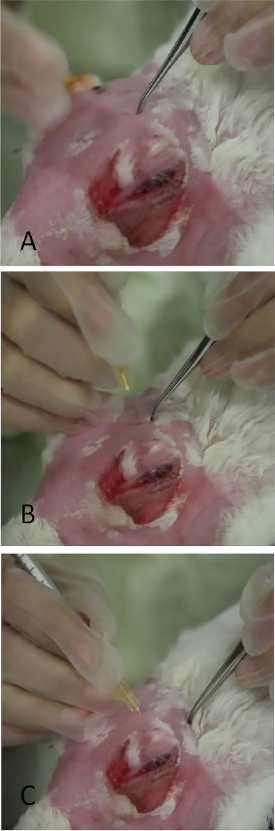
図10:眼窩上涙腺の注入(A) 図9のように脱がれた領域に細歯の鉗子を用いて頭蓋骨に優しい圧力を加える。頭蓋骨の薄いスリット状の開口部は触診することができます。鉗子が付く小さいくぼみマークを残すことは注射の間に針の配置を大いに助ける。(B)針は、インシデンを介して垂直に挿入されている。誤って配置された場合、その通路は骨の頭蓋骨によって停止されます。(C)針は、横方向カンサスに向かって角度を付けた最終位置にある。この図の大きなバージョンを表示するには、ここをクリックしてください。
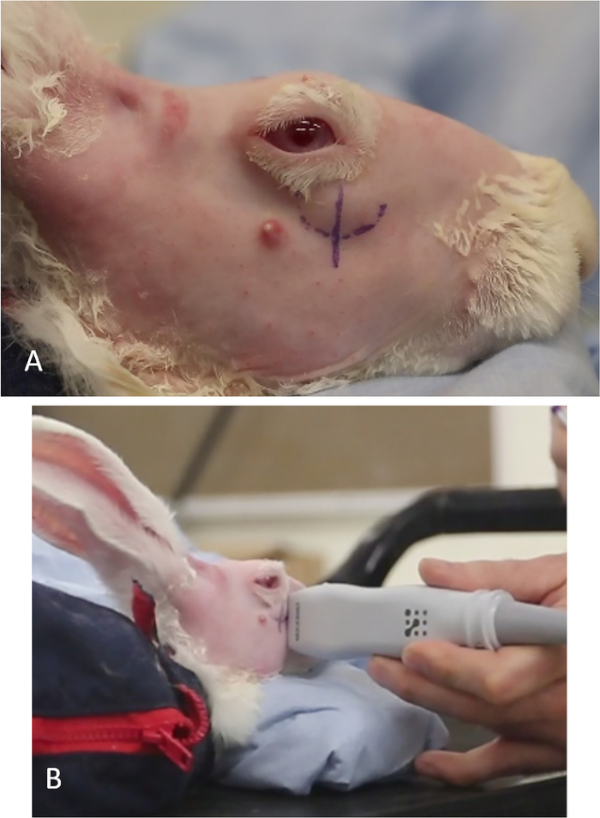
図11:下涙腺の局在化(A)下蓋を通して見たILGの表面部分の顕著さ。曲線ペンマークは、腺の下の位置を示します。垂直線は、鼻辺縁部の下で、ILGが軌道内のより深い位置に遷移するおおよその位置を示し、米国の視覚的な参照として機能します。(B)垂直線の領域を横切る米国のハンドピース。米国のモニターは、ザイゴマティック骨がどこで終わるか、ILGが遷移する場所、およびCon A注射を与える必要がある場所(「注射部位」)を示します。この図の大きなバージョンを表示するには、ここをクリックしてください。
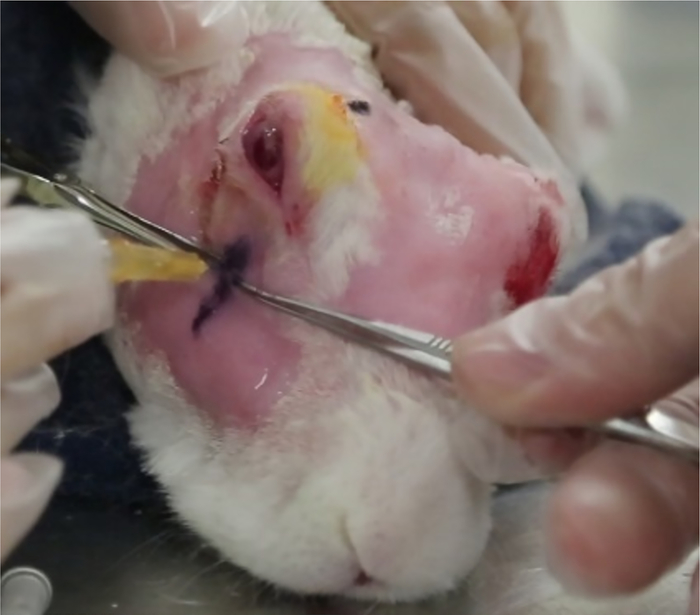
図12:下涙腺の注射ILGの注入は米国によって識別される場所で行われる。インジェクションの深さは、テキストに記述されているとおりに計算されます(ステップ5.8.6)。カリパー(針の後ろに見える)は、注射前に針が適切な深さに置かれていることを確認します。この図の大きなバージョンを表示するには、ここをクリックしてください。
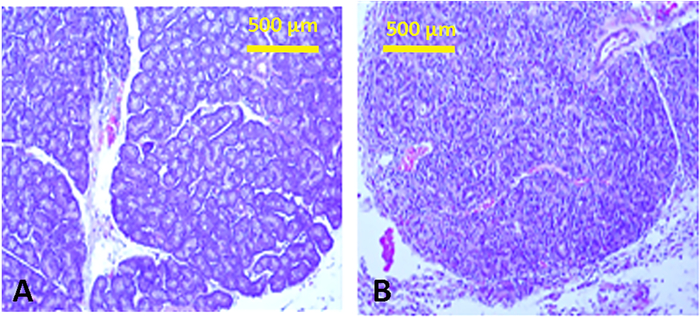
図13:涙腺のヒストロジー。典型的なチューブーロ肺胞構造(A)およびCon A(B)の注射後の正常な下層涙腺の組織切片は、構造の浸透で顕著なリンパ球浸潤を示す。同様の炎症性浸潤は、上の涙腺に見られる。この図の大きなバージョンを表示するには、ここをクリックしてください。
| 射出方法 | TBUT、秒 | ティアオスモラリティ、オスム/L | STT, mm | |||
| ベースライン | ポストインジェクション | ベースライン | ポストインジェクション | ベースライン | ポストインジェクション | |
| 平均値 ± SEM、 % 変化 | ||||||
| 米国のガイダンスなしの ILG | 58.5 ± 1.5 | 44.5 ± 7.7 | 297 ± 4.9 | 300± 3.8 | 15.2 ± 0.9 | 12.9 ± 2.2 |
| %変更 | -23% | 1% | -15% | |||
| p=0.05 | p=0.36 | p=0.21 | ||||
| 米国ガイド付き ILG + PSLG | 59.4 ± 0.6 | 11.4 ± 4.2 | 296 ± 4.7 | 326 ± 3.7 | 15.1 ± 1.3 | 10.7 ± 1.8 |
| % 変化率 | -81% | 10% | -29% | |||
| p<0.0001 | p<0.0001 | p<0.03 | ||||
| 米国ガイド付き ILG + PSLG + OSLG | 60 ± 0.0 | 6.2 ± 1.3 | 299 ± 2.9 | 309 ± 2.8 | 14.6 ± 0.9 | 9.9 ± 1.3 |
| % 変化率 | -90% | 3% | -32% | |||
| p<0.0001 | p<0.008 | p<0.002 | ||||
| すべての値は、記載されている腺にCon Aを1回注射した後、6日目に測定した。すべての比較はベースラインに対して行われました。*ILG、下垂体涙腺;PSLG、上の涙腺のパルペブラル部分;OSLG、上の涙腺の軌道部分;米国、超音波。 | ||||||
表1:ドライアイ重症度に対する注射技術および注射部位の数の影響。
| ベースライン | 6日目 | 13日目 | 21日目 | |
| 1インジェクション | 2回の注射 | 3回の注射 | ||
| TBUT、秒 | 58.5 ± 1.5 | 44.5 ± 7.7 | 29.2 ± 7.8 | 12.8 ± 3.9 |
| % 変化率 | -24% | -50% | -78% | |
| p=0.17 | p=0.001 | p<0.0001 | ||
| オスム、オスム/L | 297 ± 4.9 | 300±3.9 | 308 ± 4.9 | 313 ± 2.7 |
| % 変化率 | 1% | 4% | 5% | |
| p=0.36 | p=0.04 | p=0.003 | ||
| STT, mm | 15.2 ± 0.9 | 9.3 ± 1.6 | 12.9 ± 1.6 | 7.4 ± 1.1 |
| % 変化率 | -39% | -15% | -51% | |
| p=0.17 | p=0.13 | p=0.008 | ||
| ベースラインとの比較が行われました。 | ||||
表2:DEDの持続時間に対するILGへの繰り返しのCon A注射の効果。
ディスカッション
ウサギはDEDの研究にとって非常に魅力的です。角膜と結膜は、マウスやラットと比較して、ヒトの表面領域に近い領域を有する。エステラーゼなどの薬物代謝酵素の補完、および涙腺の組織学はヒトの組織学に似ており、目は有益な薬物動態研究に十分な大きさである。豚やサルと比較して、彼らは同様の特徴を共有し、彼らはより少ない費用がかかり、彼らの実験的な操作が容易です。機械学的研究が考えられる場合、ウサギの相対的な欠点は、マウスと比較して、より少ない試薬(例えば、モノクローナル抗体)が利用可能であるということです。一方、ウサギは、個々の組織が容易に解剖され、分析作業に十分な大きさであり、「サンプルプーリング」を避けるため、薬物動態および生体分布研究のためのマウスよりもはるかに優れています。
重要な一般パラメータはウサギの順応期間です。動物は、多くの場合、適切な温度や湿度の輸送環境を確保しない条件下でベンダーから出荷されます。一部の動物は到着時に既にドライアイを開発している可能性があります。2週間の順応期間をお勧めします。同様に重要なのは、研究ウサギがビバリウムに収容されている空間の湿度と温度に細心の注意を払うことだ。どちらの状態の偏差は、彼らの目の状態に大きな変化を誘発することができます。バックアップ用の加湿器と除湿器を手元に持っています。セントラルシステムに障害が発生した場合は、バックアップ機器を使用して周囲の湿度を復元するために迅速に動作します。このような不幸な展開は、夏の間にはより一般的であることを覚えておいてください。しかし、ウサギのDEDを正常に誘導するための3つの最も重要なステップは、1)ILGを識別し、Con Aの注射を指示し、確認するために米国イメージングを巧みに使用する方法です。2)ILGとSLGの2つの部分の両方の注入を保証する。そして3)DEDのパラメータを確実かつ再現的にアッテで言う。
必要な実験スキルを開発することは些細なことではありませんが、深刻な研究者を抑止すべきではありません。学習曲線は 5 回の反復で完了することを期待してください。妥当な品質の米国のイメージングシステムが不可欠です。米国による解剖学的特徴の認識は重要であるため、研究者はウサギの解剖学を見直すべきである。古典、Davis25によるウサギの解剖学の優れた説明は、非常に役に立ちます。また、ILGのサイズの変動を念頭に置いてください。これに対する結果は、Con Aの成功は常にフォローアップイメージングで確認されなければならないということです。ウサギのグループにおけるCon Aへの応答の変動は、注射技術(注射に失敗または部分的に成功した)または涙の過剰産生で補うために残留涙腺組織の能力を無視することによることが最も多い。注射技術を習得したい人のために, 迅速な解剖解剖に続いてメチレンブルーを注入すると役立ちます;それは涙腺に達するか、隣接する組織にこぼれた場合、可視化が達成されます。現在までに、この注射法は、単一の合併症を伴わずに著者によって270回以上行われてきた。
上記のDEDの5つのパラメータを言うことは、臨床現場での決定と同じくらい難しいかもしれません。概日変動はいずれも正式に文書化されていないが、特に繰り返しアッセイを行い、互いに比較する場合に、同じ時刻(±1時間)にアッセイされるべきという、眼28におけるそのような現象の十分な背景証拠がある。これらのアッセイを行う上での一貫性は必須である。2人のチームが必要です。一部のステップでは厳密なタイミングが必要なため、同じ部屋の4人以上の調査官がアッセイに参加すると混乱を引き起こす可能性があります。適切で高品質な写真ドキュメントが示されている場合は、重要です。
このモデルは薬剤開発研究に理想的に適している。動物モデルとアッセイ技術の習得により、有効性および安全性試験の再現性19に優れた再現性を確保した。
これは、以前のモデルの交わし変動性を排除し、動物モデルを合理化し、本質的にDEDの5つのパラメータをアッテに標準化しているため、強力な実験的アプローチです。候補治療薬の研究にこのモデルの成功したアプリケーションは、新しい薬剤の絶望的な必要性とその病因のより深い理解の疾患のための有益な動物モデルとしての実用的な有用性を確認しています。
開示事項
著者らは、メディコン・ファーマシューティカルズ社およびアピス・セラピューティクス(LLC)に株式を持つBRを除き、競合する利益を宣言していない。そして、株式会社アピス・セラピューティクスに株式を持つメディコン・ファーマシューティカルズ社の従業員であるLH。
謝辞
すべての動物研究は、関連するすべての規制および制度上のガイドラインに従って完了しました。すべての研究は、ストーニーブルック大学の機関審査委員会によって承認され、眼科および視力研究における動物の使用に関するARVO声明に従って行われました。
これらの研究は、ストーニーブルック大学医学部(グラント番号1149271-1-82502)からのターゲット研究機会助成金と、ニューヨーク州セタウケットのメディコン・ファーマシューティカルズ社からの研究助成金によって部分的に支持されました。著者はミケーレ・マクターナンの編集支援に感謝している。
資料
| Name | Company | Catalog Number | Comments |
| 100 mm macro lens | Canon EF 100mm f/2.8L IS USM | 3554B002 | |
| 26 gauge needles (5/8) | Becton Dickinson and Company, Franklin Lakes, NJ | 305115 | Needles for injecting ConA into the lacrimal glands |
| 27 gauge needles (5/8) | Becton Dickinson and Company, Franklin Lakes, NJ | 305921 | Needles for injecting ConA into the lacrimal glands |
| Aceproinj (acepromazine) | Henry Schein Animal Health, Dublin, OH | NDC11695-0079-8 | 0.1ml/kg subcutaneously injection for rabbit sedation |
| Anesthesia vaporizer | VetEquip, Pleasanton, CA | Item #911103 | |
| Bishop Harmon Forceps | Bausch and Lomb (Storz), Bridgewater, NJ | E1500-C | Tissue forceps |
| Caliper | Bausch and Lomb (Storz), Bridgewater, NJ | E-2404 | Caliper used to measure length of needle during ConA injection |
| Concanavalin A | Sigma, St. Louis, MO | C2010 | Make 5mg/ml in PBS for injection into rabbit lacrimal glands |
| DSLR camera | Canon EOS 7D DSLR | 3814B004 | Digital single lens reflex camera |
| fluorescein | AKRON, Lake Forest, IL | NDC17478-253 | Dilute to 0.2% with PBS to measure TBUT |
| Isoflurane | Henry Schein, Melville, NY | 29405 | |
| Lactoferrin ELISA kit | MyBiosource, San Diego, CA | MBS032049 | Measure tear lactoferrin level |
| lidocaine | Sigma, St. Louis, MO | L5647 | 1% in PBS for anesthesia agent |
| macro/ring flash | Canon Macro Ring Lite MR-14EXII | 9389B002AA | |
| Osmolarity tips | TearLab Corp., San Diego, CA | #100003 REV R | Measure tear osmolarity |
| PBS (phosphate buffered saline) | Mediatech, Inc. Manassas, VA | 21-031-CV | |
| Rabbit, New Zealand White or Dutch Belted (as described in text) | Charles River Labs, Waltham, MA | 2-3 kg | Research animals |
| Rose Bengal | Amcon Laboratories Inc., St. Louis, MO | NDC51801-004-40 | 1% in PBS, stain the ocular surface |
| Schirmer strips | Eaglevision, Katena products. Denville, NJ | AX13613 | Measure tear production |
| Surgical Loupes +1.50 | Designs for Vision, Bohemia, NY | Specialty item | Provide magnificantion of ocular surface while observing tear break up and performing Concanavalin A injections. |
| TearLab Osmometer | TearLab Corp., San Diego, CA | Model #200000W REV A | Measure tear osmolarity |
| Ultrasound probe | VisualSonics Toronto, Ont | MX 550 S | Untrasonography-guide Con A injection for inferior lacrimal gland |
参考文献
- Paulsen, A. J., et al. Dry eye in the Beaver Dam Offspring Study: prevalence, risk factors, and health-related quality of life. American Journal of Ophthalmology. 157 (4), 799-806 (2014).
- Vehof, J., Kozareva, D., Hysi, P. G., Hammond, C. J. Prevalence and risk factors of dry eye disease in a British female cohort. British Journal of Ophthalmology. 98 (12), 1712-1717 (2014).
- Tan, L. L., Morgan, P., Cai, Z. Q., Straughan, R. A. Prevalence of and risk factors for symptomatic dry eye disease in Singapore. Clinical and Experimental Optometry. 98 (1), 45-53 (2015).
- Craig, J. P., et al. TFOS DEWS II Report Executive Summary. The Ocular Surface. 15 (4), 802-812 (2017).
- Baudouin, C., et al. Clinical impact of inflammation in dry eye disease: proceedings of the ODISSEY group meeting. Acta Ophthalmologica (Copenhagen). 96 (2), 111-119 (2018).
- Calonge, M., et al. Dry eye disease as an inflammatory disorder. Ocular Immunology and Inflammation. 18 (4), 244-253 (2010).
- Pflugfelder, S. C., de Paiva, C. S. The Pathophysiology of Dry Eye Disease: What We Know and Future Directions for Research. Ophthalmology. 124 (11S), S4-S13 (2017).
- Buckley, R. J. Assessment and management of dry eye disease. Eye (London, England). 32 (2), 200-203 (2018).
- Clayton, J. A. Dry Eye. New England Journal of Medicine. 378 (23), 2212-2223 (2018).
- Barabino, S. Animal models of dry eye. Archivos de la Sociedad Española de Oftalmología. 80 (12), 695-696 (2005).
- Stern, M. E., Pflugfelder, S. C. What We Have Learned From Animal Models of Dry Eye. International Ophthalmology Clinics. 57 (2), 109-118 (2017).
- Chen, Z. Y., Liang, Q. F., Yu, G. Y. Establishment of a rabbit model for keratoconjunctivitis sicca. Cornea. 30 (9), 1024-1029 (2011).
- Gilbard, J. P., Rossi, S. R., Gray, K. L. A new rabbit model for keratoconjunctivitis sicca. Investigative Ophthalmology & Visual Science. 28 (2), 225-228 (1987).
- Guo, Z., et al. Autologous lacrimal-lymphoid mixed-cell reactions induce dacryoadenitis in rabbits. Experimenal Eye Research. 71 (1), 23-31 (2000).
- Burgalassi, S., Panichi, L., Chetoni, P., Saettone, M. F., Boldrini, E. Development of a simple dry eye model in the albino rabbit and evaluation of some tear substitutes. Ophthalmic Research. 31 (3), 229-235 (1999).
- Xiong, C., et al. A rabbit dry eye model induced by topical medication of a preservative benzalkonium chloride. Investigative Ophthalmology & Visual Science. 49 (5), 1850-1856 (2008).
- Heymann, F., Hamesch, K., Weiskirchen, R., Tacke, F. The concanavalin A model of acute hepatitis in mice. Lab Animal. 49 (1 Suppl), 12-20 (2015).
- Nagelhout, T. J., Gamache, D. A., Roberts, L., Brady, M. T., Yanni, J. M. Preservation of tear film integrity and inhibition of corneal injury by dexamethasone in a rabbit model of lacrimal gland inflammation-induced dry eye. Journal of Ocular Pharmacology and Therapeutics. 21 (2), 139-148 (2005).
- Honkanen, R. A., Huang, L., Xie, G., Rigas, B. Phosphosulindac is efficacious in an improved concanavalin A-based rabbit model of chronic dry eye disease. Translational Research. 198, 58-72 (2018).
- Huang, L., et al. The novel phospho-non-steroidal anti-inflammatory drugs, OXT-328, MDC-22 and MDC-917, inhibit adjuvant-induced arthritis in rats. British Journal of Pharmacology. 162 (7), 1521-1533 (2011).
- Mattheolabakis, G., et al. Topically applied phospho-sulindac hydrogel is efficacious and safe in the treatment of experimental arthritis in rats. Pharmaceutical Research. 30 (6), 1471-1482 (2013).
- Osmalek, T., Froelich, A., Tasarek, S. Application of gellan gum in pharmacy and medicine. International Journal of Pharmaceutics. 466 (1-2), 328-340 (2014).
- Lemp, M. A. Report of the National Eye Institute/Industry workshop on Clinical Trials in Dry Eyes. Contact Lens Association of Ophthalmologists Journal. 21 (4), 221-232 (1995).
- Dal Piaz, F., Braca, A., Belisario, M. A., De Tommasi, N. Thioredoxin system modulation by plant and fungal secondary metabolites. Current Medicinal Chemistry. 17 (5), 479-494 (2010).
- Davis, F. A. The Anatomy and Histology of the Eye and Orbit of the Rabbit. Transactions of the American Ophthalmological Society. 27, 402-441 (1929).
- Lima, L., Lange, R. R., Turner-Giannico, A., Montiani-Ferreira, F. Evaluation of standardized endodontic paper point tear test in New Zealand white rabbits and comparison between corneal sensitivity followed tear tests. Veterinary Ophthalmology. 18 (Suppl 1), 119-124 (2015).
- Zheng, W., et al. Therapeutic efficacy of fibroblast growth factor 10 in a rabbit model of dry eye. Mol Med Report. 12 (5), 7344-7350 (2015).
- Wiechmann, A. F., Summers, J. A. Circadian rhythms in the eye: the physiological significance of melatonin receptors in ocular tissues. Progress in Retinal and Eye Research. 27 (2), 137-160 (2008).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved