Method Article
Um modelo de coelho da doença aquosa-deficiente do olho seco induzida pela concanavalina Uma injeção nas glândulas lacrimal: aplicação a estudos de eficácia de drogas
Neste Artigo
Resumo
Este artigo descreve o desenvolvimento de um método para induzir doenças agudas ou crônicas do olho seco em coelhos injetando concanavalina A a todas as porções do sistema de glândula lacrimal orbital. Esse método, superior aos já relatados, gera um modelo reprodutível e estável de olho seco adequado para o estudo de agentes farmacológicos.
Resumo
A doença ocular seca (DED), doença inflamatória multifatorial da superfície ocular, afeta 1 em cada 6 humanos em todo o mundo com implicações surpreendentes para a qualidade de vida e os custos de saúde. A falta de modelos animais informativos que recapitulam suas principais características impede a busca por novos agentes terapêuticos para o DED. Modelos animais DED disponíveis têm reprodutibilidade e eficácia limitadas. Um modelo é apresentado aqui no qual o DED é induzido injetando a concanavalina mitogena a (Con A) nas glândulas lacrimals orbitais dos coelhos. Aspectos inovadores deste modelo são o uso de orientação de ultrassom (EUA) para garantir a injeção ideal e reprodutível de Con A na glândula lacrimal inferior; injeção de Con A em todas as glândulas lacrimal orbitais que limita a produção compensatória de lágrimas; e uso de injeções repetitivas periódicas de Con A que prolongam o estado de DED à vontade. O DED e sua resposta aos agentes de teste são monitorados com um painel de parâmetros que avaliam a produção de lágrimas, a estabilidade do filme lacrimogêneo e o status da mucosa córnea e conjuntival. Eles incluem osmolaridade rasgada, tempo de rompimento de lágrimas, teste de lágrima schirmer, coloração de bengala rosa e níveis de lactoferrina lacrimal. A indução do DED e o monitoramento de seus parâmetros são descritos detalhadamente. Este modelo é simples, robusto, reprodutível e informativo. Este modelo animal é adequado para o estudo da fisiologia das lágrimas e da fisiopatologia do DED, bem como para a avaliação da eficácia e segurança dos agentes candidatos para o tratamento do DED.
Introdução
A doença ocular seca (DD) é uma condição crônica com alta prevalência e morbidade1,2,3,4. A inflamação desempenha um papel fundamental em sua patogênese5,6. A fisiopatologia do DED é conceituada como deriva da subprodução ou da superevaporação das lágrimas; o primeiro também é conhecido como Aquos-deficiente DED7. A síndrome de Sjögren, uma causa prototípica extensivamente estudada do DED, afeta principalmente as glândulas lacrimalas (LGs) e é um exemplo marcante de sua importância na patogênese do DED. O DED é frequentemente tratado com lágrimas artificiais que proporcionam alívio temporário, ou com ciclosporina ou lifitegrast, ambos suprimem a inflamação ocular. Nenhum dos tratamentos disponíveis para DED são ótimos, necessitando do desenvolvimento de novos agentes8,9.
A busca por novos agentes terapêuticos para o DED é dificultada por três grandes desafios: a falta de um alvo molecular drogado reconhecido, que pode ser evasivo dada a complexidade fisiológica do DED; a esparsidade de agentes promissores; e a falta de modelos animais que recapitulam características-chave do DED.
Como na maioria dos esforços de desenvolvimento de drogas, os modelos animais informativos do DED são uma ferramenta investigativa crucial, apesar da afirmação axiomática de que nenhum modelo animal recapitula completamente uma doença humana. Os modelos de rato, rato e coelho de DED são os mais usados, enquanto cães e primatas são usados com pouca frequência10,11. A maioria dos mais de 12 modelos de DED de coelho relatados até agora tentam reduzir a produção de lágrimas, removendo LGs ou impedindo sua função12,13,14,15,16. Tais abordagens incluem a ressecção cirúrgica do ILG; fechamento de seu duto excretório; e prejudicando a função LG por irradiação ou injeção de um dos seguintes: linfócitos ativados, mitogens, toxina botulínica, atropina ou benzaklonium. As principais limitações desses métodos são sua inconsistência e a frequente supressão parcial da produção de lágrimas.
A concanavalina A (Con A), uma lectina de origem vegetal, é um potente estimulador de subconjuntos de células T e tem sido usado em modelos experimentais de hepatite17 e18de DEZEMBRO . O modelo original baseado em Con A foi relatado para oferecer vantagens significativas, incluindo sua relativa simplicidade; fluxo celular inflamatório nos LGs, imitando doenças como a de Sjogren; estimulação das citocinas proinflamatórias IL-1β, IL-8 e TGF-β1; função de lágrima reduzida monitorada pela medição da liberação de fluoresceina lacrimal e tempo de rompimento de lágrimas (TBUT); e responsividade de drogas mostrada para um corticosteroide anti-inflamatório.
Quando esse método promissor foi aplicado, além de suas vantagens, foram identificadas limitações que necessitavam de sua revisão geral e melhorias drásticas. Três deficiências críticas do método estão documentadas. Primeiro, o modelo foi agudo; o DED induzido diminuiu após cerca de 1 semana. Segundo, a resposta dos animais foi inconsistente. Como demonstrado, em injeções transcutâneas "cegas" para o LG Inferior (ILG), o Con A foi entregue apenas aleatoriamente na glândula alvo. Um estudo detalhado da anatomia do ILG revelou que seu tamanho pode variar até 4 vezes19 fazendo tais injeções "hit-or-miss". Finalmente, mesmo quando o ILG foi injetado, o SUPERIOR LG (SLG) frequentemente compensava o fluxo de lágrimareduzido, tornando o modelo problemático.
Essas limitações-chave foram superadas introduzindo três modificações no método, gerando um modelo animal superior de DED. Primeiro, a injeção de Con A no ILG foi realizada orientação de ultrassom (EUA), garantindo que Con A entrasse na glândula. O sucesso da injeção foi confirmado pela obtenção de uma imagem pós-injeção dos EUA, como mostrado na Figura 1. Segundo, para remover a contribuição compensatória do SLG, tanto as porções palpebral quanto orbital desta glândula foram injetadas com Con A. Finalmente, este modelo agudo de DED foi convertido em crônico por injeções repetidas de Con A a cada 7-10 dias. Ded de 2 meses de duração é prontamente alcançado nestes coelhos. O sucesso desta abordagem foi amplamente documentado19.
Como já mencionado, uma importante aplicação dos modelos animais do DED é determinar a eficácia e segurança dos agentes terapêuticos candidatos. A utilidade desse modelo foi demonstrada pelo estudo da fosfosulindac (OXT-328), uma nova molécula anti-inflamatóriade 20,21 administrada sem colírios. Sua eficácia foi demonstrada com base em um painel de parâmetros de19DED . A relativa simplicidade e natureza informativa deste modelo também permitiram comparação lado a lado da fosfosulindac com os dois medicamentos aprovados pela FDA para DED, ciclosporina e lifitegrast, demonstrando sua forte superioridade pré-clínica.
Protocolo
Todos os estudos em animais foram aprovados pelo Conselho de Revisão Institucional da Universidade de Stony Brook e realizados de acordo com a Declaração ARVO para o Uso de Animais em Pesquisa Oftalmica e Visão.
1. Animais e habitação
- Adquirir coelhos brancos da Nova Zelândia (NZW) pesando 2-3 kg.
- Abrigar os coelhos em gaiolas com temperatura estrita (65 ± 5 °F) e umidade (45 ± 5%) Controle. A iluminação deve ter um ciclo de 12 h on/off.
- Fornecer acesso ilimitado à água e à comida de coelho padrão. Elimine os enriquecimentos alimentares, pois podem conter vitamina A que afeta o olho.
- Aclimata os animais por pelo menos 2 semanas antes das medidas de linha de base ou indução do olho seco.
2. Métodos de anestesia e eutanásia
NOTA: Todos os procedimentos requerem sedação leve, exceto para injeção Con A que requer sedação moderada.
- Para sedação leve, injete a acepromazina (1 mg/kg) subcutâneamente sobre os ombros usando uma agulha calibre 26. Ponto final para sedação leve: os animais mantêm uma posição de cabeça relaxada com lóbulos auditivos não mais totalmente eretos.
NOTA: Se o ponto final apropriado não for alcançado, uma injeção adicional de acepromazina pode ser dada. Os animais devem sempre permanecer acordados, responsivos ao toque de seus bigodes, e nunca mostrar respiração lenta. - Para sedação moderada, primeiro dê aos animais acepromazina como acima. Após o ponto final ser alcançado (veja a nota acima), dê isoflurane usando uma máscara de gás com fluxo O2 definido em 1 L/min e entrega isoflurane definida para 5%(Figura 2).
- Administrar isoflurane até que o tom corporal do coelho esteja completamente relaxado e as orelhas fiquem completamente disquetes.
NOTA: Nenhum movimento muscular compensatório deve ocorrer quando o animal é virado para o lado; respirar sempre permanece espontâneo. - A recuperação espontânea ocorre dentro de 2-5 min: os sinais incluem movimentos espontâneos da cabeça e tom muscular aumentado ou normal. Após o procedimento experimental ser concluído com sedação moderada, observe os coelhos por cerca de 30 min ou até que seu comportamento volte ao normal.
NOTA: A pomada oftalmómica não é necessária durante qualquer forma de sedação. 1) Na sedação leve, os animais ainda estão alertas e mantêm um reflexo de piscar. Na sedação moderada, a inibição do reflexo de piscar é tão curta que a superfície ocular não está em risco. 2) Colocação de pomada oftalmómica na superfície ocular impede a visualização das estruturas avaliadas durante os testes. - Eutanásia: Use uma overdose de pentobarbital intravenoso (100 mg/kg).
3. Remoção da membrana nictitante
- Realizar a remoção durante o período de aclimatação (geralmente na primeira semana) para permitir uma avaliação completa e precisa da córnea.
-
Injeção na membrana nictitante direita
NOTA: Se a membrana nicatitante de ambos os olhos for removida, é mais simples fazer isso em uma sessão. Comece com um olho e prossiga como descrito. Para clareza da descrição, este método começa com o olho direito.- Coloque o coelho em um saco de contenção de tamanho apropriado.
- Induzir sedação leve como descrito na etapa 2.1.
- Aplique 25 μL de lidocaína sem conservante no olho direito usando uma micropipeta.
- Coloque um espéculo flexível da tampa do fio entre as pálpebras.
- Usando 0,3 fórceps (ou equivalente), segure a membrana nictitante em seu ápice e estique-a sobre a córnea.
- Injete lidocaína 1% com 1:100.000 subconjuntivamente epinefrina na base da membrana nictitante usando uma agulha afiada de 26 bitoslas(Figura 3A). Um bleb moderado deve se formar sobre a membrana nictitante.
- Remova o espéculo.
- Faça uma injeção idêntica à membrana nictitante esquerda.
-
Cortando a membrana nicatitante
- Depois de aproximadamente 5 min, coloque o espéculo da tampa de volta no olho direito. Segure e retraia a membrana nicatitante em seu ápice usando fórceps 0,3 (ou similares).
- Corte a membrana nicatitante em sua base usando tesouras westcott ou equivalente(Figura 3B).
NOTA: O sangramento é mínimo e normalmente não requer cautery. No entanto, um cautery de bateria de alta temperatura é sempre mantido por perto no caso de hemostasia adicional ser necessária. - Remova o espéculo.
- Coloque pomada tópica de antibióticos no olho (por exemplo, neomicina, polimicina, bacitracina e hidrocortisona).
- Deixe a glândula harderiana intacta. A glândula harderiana às vezes é vista quando a membrana nictitante é retraída.
NOTA: Se uma grande massa branca ou elevação tecidual for vista na região subconjuntiva nasal ou superior após a remoção da membrana nictitante, a membrana foi ressecada muito perto de sua base permitindo que a glândula harderiana prolapso espontaneamente. Para evitar isso nos procedimentos subsequentes, deixe mais da membrana nicatitante na base. - Permita que a superfície ocular se cure por pelo menos 1 semana antes que novas manipulações sejam feitas ou ensaios de superfície ocular sejam realizados.
4. Medição dos parâmetros do olho seco e coleta de amostras de lágrimas
NOTA: Meça os parâmetros de DED com base nas necessidades do protocolo de estudo (por exemplo, na linha de base e pontos de tempo especificados posteriormente). As medidas para o DED devem ser feitas na seguinte ordem, com esforço rigoroso para replicá-las fielmente todas as vezes. Teste todos os animais aproximadamente na mesma hora do dia (± 1 h) para minimizar variações circadianas. Essas medidas geralmente requerem uma equipe de dois investigadores.
- Coloque o coelho em um saco de contenção. Induzir sedação leve.
- Osmolaridade Rasgar22
- Pisqueia manualmente das pálpebras 5-10 vezes para distribuir uniformemente a camada de lágrima na superfície ocular.
- Retire delicadamente a tampa inferior.
- Prove lágrimas com o Osmômetro TearLab na junção da conjuntiva palpebral e bulbar ao longo da fornix inferior, apenas posterior à base da membrana titating truncada.
- Meça a osmolaridade usando o Teste de Osmolaridade TearLab seguindo as instruções do fabricante.
- Tempo de rompimento de lágrimas (TBUT)
- Escureça o quarto para este ensaio.
- Coloque um espéculo da tampa do fio entre as pálpebras.
- Aplique uma queda de 50 μL de 0,2% de fluoresceína sobre a superfície da córnea usando uma micropipeta. Se mesmo a distribuição da fluoresceina sobre a córnea não for obtida com a primeira gota, coloque uma segunda queda.
- Comece imediatamente um temporizador.
- Observe o filme de lágrima pré-córnea uma luz azul. O TBUT é definido como o tempo levado para desenvolver os tais, linhas pretas ou interrupção óbvia do filme de fluoresceína (Figura 4). Se necessário, use loupes cirúrgicos que forneçam +1,50 ampliação para visualizar melhor os sinais iniciais de rompimento. Monitore até 1 min; se o rompimento conforme definido aqui ocorre após 1 min, recorde tbut para apenas 60 s.
- Teste de Lágrimas de Schirmer (STT)
- Aplique uma gota de 25 μL de lidocaína sem conservante sem conservação na superfície ocular.
- Coloque uma lança cirúrgica de célula weck na fornix inferior para absorver lidocaína residual e qualquer fluido lacrimogêneo. Se necessário, use a pálpebra inferior para cobrir a extremidade proximal da esponja para ajudar a mantê-la no lugar (Figura 5A).
- Depois de aproximadamente 30 s, remova a esponja Weck.
- Insira imediatamente a tira de teste de lágrima de Schirmer no espaço entre a córnea e a conjuntiva palpebral no ponto médio da tampa inferior.
- Comece imediatamente um temporizador(Figura 5B).
- Após 5 minutos, meça o comprimento da porção umedecida da tira; este é o valor STT.
- Realizar medidas triplicadas e informar a média das 3 leituras como valor STT.
- Coleta de amostras de lágrimas
- Para coletar amostras de lágrimas para atribuir níveis de vários análites, como lactoferrina, após o valor STT ser registrado a 5 minutos, deixe a faixa no lugar até que se obtenha molhar pelo menos 20 mm.
NOTA: Se a maquete adequada não ocorrer após a induzida deD, avance a faixa mais profunda na fornix inferior para ajudar a alcançar esse ponto final em tempo razoável. - Corte a tira e coloque imediatamente em 490 μL de Buffer de Coleta de Lágrimas resfriado (4% BSA, 1M NaCl, 0,1% Tween-20 em PBS com coquetel inibidor de proteinase).
- Mantenha as amostras no gelo até que possam ser armazenadas a -80 °C, onde devem permanecer até serem avaliadas.
- Para coletar amostras de lágrimas para atribuir níveis de vários análites, como lactoferrina, após o valor STT ser registrado a 5 minutos, deixe a faixa no lugar até que se obtenha molhar pelo menos 20 mm.
- Rose Bengal Staining (RBS)
- Aplique 50 μL de 1% de lidocaína sem conservante sem conservantes na córnea usando uma micro-pipeta.
- Depois dos 30 s, coloque 25 μL de 1% de bengala rosa na superfície ocular e pisque manualmente a pálpebra para distribuí-la uniformemente.
- Comece imediatamente um temporizador.
- A 3,5 min, coloque um espéculo de tampa de arame entre as tampas.
- Aos 4,0 min, fotografe a superfície conjuntiva superior e córnea(Figura 6).
NOTA: Ajuste-se ao tipo de câmera que está sendo usada. Configurações típicas: câmera reflexo digital de lente única, modo prioritário de abertura (abertura 13 ou superior), ISO 6000, lente macro de 100 mm anexada com dois tubos de extensão de 12,5 mm, modo de foco manual, lente na ampliação máxima e iluminação do flash macro/anel definido automaticamente com o modo através da lente. A lâmpada de foco do flash do anel é ligada para ajudar o foco na córnea. - Complete todas as fotos para ambos os olhos dentro de 1 min.
- Pontuação de coloração ocular de superfície usando o método NEI23 modificado da seguinte forma. Não seja classificada 6 zonas conjuntivas separadas. Marque a conjuntiva superior de cada olho. Esta é a parte da superfície conjuntiva facilmente fotografada sem manipular o globo. A manipulação pode mudar a coloração da superfície ocular.
- Os níveis de lactoferrina lacrimal são uma medida de barriga de aluguel das glândulas lacrimal. Assay lactoferrina rasga em lágrimas coletadas como acima usando um kit de contra-orto de imunosorbent ligado à enzima24 seguindo as instruções do fabricante.
5. Indução e tratamento do olho seco
NOTA: Três porções do sistema de glândula lacrimal orbital são injetadas.
- Separem os coelhos com acemazina 0,2 mg/kg subcutâneamente.
- Cortar a pele na área periorbital e do couro cabeludo e remover completamente qualquer pele residual usando Nair. Deixe a pele totalmente lisa para melhor visualização das marcas anatômicas e injeção guiada pelos EUA de concanavalina A (Figura 7).
- Induzir sedação moderada como descrito acima.
- Injeção da porção palpebral da glândula lacrimal superior (PSLG)
NOTA: Realizar a injeção do PSLG primeiro.- Aplique no olho apropriado 25 μL de lidocaína livre de conservantes 1% com uma micropipette.
- Evert a pálpebra superior e aplicar pressão medial suave à borda orbital posterior até que o protuberância marcando a porção palpebral da glândula seja visto. O PSLG aparece como uma pequena elevação bulbosa na porção posterior (temporal) da tampa superior.
NOTA: Para ver o tecido glândula durante o processo de aprendizagem, aplique 5% de fluoresceína na área (Figura 8A). Lágrimas podem ser vistas fluindo do PSLG bulboso. A aplicação da fluoresceína não é necessária para a administração da Con A; é feito apenas para fins de ilustração para mostrar o tecido glândula. - Usando fórceps de dentes finos e uma agulha calibre 27 em uma seringa de tubécula, penetre diretamente na glândula usando uma abordagem transconjuntiva. Avance a agulha 2 mm no tecido e injete 500 μg de Con A em um volume de 0,1 mL (Figura 8B).
NOTA: Esta injeção às vezes pode ser dolorosa. Se necessário, mantenha os animais isoflurano até que esta injeção seja concluída.
- Injeção da glândula lacrimal superior orbital (OSLG)
NOTA: A OSLG segue em rápida sucessão.- Aplique pressão medial ao globo fazendo com que o OSLG se prostruta da incisegura posterior (veja o ref25 para anatomia, se necessário). Aplique pressão medial ao globo (Figura 9, seta vermelha) com a protuberância do OSLG a partir da incisure posterior. A protuberância serve como localização grosseira para encontrar a incicerteza posterior.
- Use fórceps curvos com pontas fechadas para identificar a área até que a abertura óssea no crânio seja sentida. Isso será parecido com uma fenda com uma direção anterior/posterior o protuberância.
- Aplique pressão modesta com fórceps para deixar um recuo na pele, que servirá de marco para colocação de agulha(Figura 10A).
- Insira uma agulha (seringa de tubércula com uma agulha de 27 mm, 5/8 polegadas) perpendicular na pele sobre a marca de recuo(Figura 10B) ~ 1/4 polegada na incisegura, em seguida, redirecione a agulha posterior mente e externamente para o canto lateral visando o ponto médio entre o local da injeção e a borda orbital óssea.
NOTA: Se a incisure não for precisamente alvo da agulha, o crânio bloqueia seu avanço. - Uma vez que o centro da agulha é atingido, injete lentamente 1000 μg de Con A em um volume de 0,2 mL (Figura 10C).
- Complete a injeção tanto do PSLG quanto da OSLG dentro de 2-3 min.
- Retire o animal da sedação isoflurano (se ainda não estiver feito). A injeção da glândula lacrimal inferior (ILG) geralmente pode ser completada sem maior sedação.
- Injeção da glândula lacrimal inferior
- Veja o animal de lado. O destaque do ILG pode ser visto ao longo da parte anterior inferior da órbita (Figura 11A).
- Desenhe uma linha vertical usando uma caneta de marcação cirúrgica ou marcador permanente adequado na pele onde a parte superficial da glândula ILG transita de seu lugar de descanso superficial (mais externo) no osso zigomático para sua localização mais medial na órbita. Isso é tipicamente inferior ao limbus anterior (Figura 11A).
- Identifique a extremidade do osso zigomático varrendo a sonda verticalmente controlada pelos EUA através desta linha na pele. A transição iLG ocorre onde a imagem da glândula muda de claramente circunscrito (linha hiperecoica do osso zigomático é vista ao longo da borda inferior da glândula na imagem) para uma sem uma borda medial reconhecível (o eco ósseo zigomático não está mais presente, Figura 1).
- Observe a posição relativa da peça de mão para a linha desenhada na pele quando a tela dos EUA mostrar essa mudança. Este é o "local de injeção" onde con A deve ser dado.
- Controle a profundidade da injeção de modo a colocar Con A na glândula em um ponto apenas medial para o osso arco zigomático.
- Determine a profundidade da injeção da seguinte forma: Coloque a profundidade desejada da injeção como a profundidade do osso zigomático (sinal hiperecoico) mais 1 mm. Subtrai esse valor do comprimento conhecido da agulha (15 mm neste exemplo).
- Insira a agulha na glândula no "local da injeção" ~12 mm, depois retire-a lentamente até que o comprimento da agulha exposta fora do corpo (medido com pinças cirúrgicas) seja igual à diferença calculada em 5,8.6(Figura 12). Injete 1000 μg de Con A em 0,2 mL.
NOTA: Para garantir que a cápsula da glândula seja perfurada e não simplesmente empurrada pela agulha, a agulha deve ser inserida ~12 mm ou quase no centro antes de sua retirada começar. - Repita os EUA para confirmar o sucesso da injeção. O ILG deve mostrar um espaço hipoecológico característico(Figura 1).
NOTA: A injeção iLG é a mais tolerada pelos animais26 e é, portanto, feita por último.
- Complete todo o procedimento para injetar todas as glândulas de ambos os olhos dentro de 10 minutos. Isso exigirá realização de competência no procedimento.
NOTA: Um único conjunto de injeções nas 2 glândulas lacrimal sustricais orbitais induzirá ded agudo com duração de 1-2 semanas. - Para ded de maior duração, injete Con A exatamente como acima a cada 7 dias. Até 6 dessas injeções foram realizadas com sucesso.
6. Cuidados pós-procedimento
- Após a injeção de Con A, monitore os animais em seus sacos de contenção por pelo menos 10-20 min, ou até que o efeito anestésico tenha desgastado.
- Não deixe os animais desacompanhados até que tenham recuperado a consciência suficiente para manter a rerecência severa. Não os devolva às suas gaiolas individuais até que estejam totalmente recuperados.
- A dor pós-procedimento geralmente é leve e dura menos de 48 h. Avalie a dor com a escala da careta do coelho. Se necessário, dê uma única dose de ketorolac subcutânea (5 mg/kg). Para dor mais severa, dê buprenorfina subcutânea 0,1 mg/kg a cada 8 h.
Resultados
As injeções Con A induziram uma forte resposta inflamatória nas glândulas lacrimalcaracterizadas por um denso infiltrado linfócito (Figura 13),acompanhado pela diminuição da produção de lágrimas. Todos os parâmetros lacrimais foram alterados marcadamente (Tabela 1 e Tabela 2). Além disso, os níveis de lactoferrina lacrimal foram suprimidos (controle = 3,1±0,45 vs. Con A injetado = 2,7±0,02 ng/mg de proteína (média ± SEM); p<0,03). O resultado final foi um epitélio cocórneo comprometido e conjunctival, evidenciado pelo aumento da coloração rosa bengala (Figura 6).
A injeção dos três tecidos LG orbitais produziu um estado DED consistente e uniforme ao contrário dos estados alcançados pelos métodos anteriores18,27. Os principais contribuintes para este resultado foram a injeção guiada pelos EUA do ILG e a injeção do OSLG. A Tabela 1 resume os resultados mais importantes deste método. Todas as mudanças são consistentes com o DED grave.
Um único conjunto de injeções Con A produz DED com duração de cerca de 1 semana; todos os parâmetros clínicos normalizam até o dia 10 (Tabela 2). As injeções sequencial de Con A com cerca de 1 semana de intervalo estendem a duração do DED em conformidade. Por exemplo, o segundo conjunto de injeções Con A no dia 7 mantém o DED por 2 semanas e assim por diante. Após aproximadamente 5 conjuntos de injeções, o estado de DED muitas vezes se torna permanente sem a necessidade de novas injeções.
Quando os coelhos com ded induzido por Con A foram tratados com o novo agente fosfosulindac, isso suprimiu a doença. Por exemplo, após uma semana de tratamento com este agente TBUT aumentou acentuadamente em relação aos animais tratados com veículos (43,6±4,0 vs. 12,2±2,8 s; p<0,001; média ± SEM respectivamente, para esses e seguintes valores) enquanto a osmolaridade lacrimal foi normalizada (294±4,6 vs. 311±2,0 mOsm/L, p<002). Mecanisticamente, a fosfosulindac diminuiu os níveis de duas interleucinas cruciais, IL-1β (8,4±1,2 vs 21,2±6,6 pg/mg de proteína; p<0,03) e IL-8 (4,9±1,7 vs. 13,5±5,0 pg/mg de proteína; p<0,05)19.
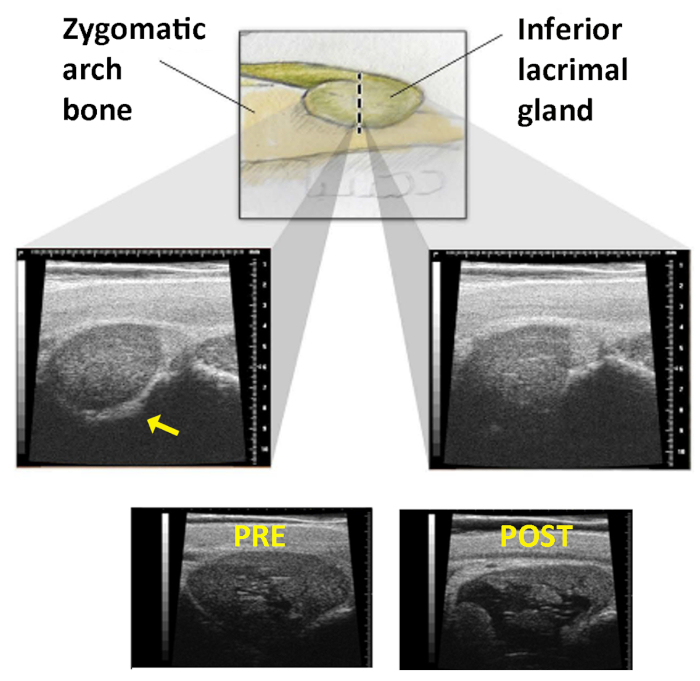
Figura 1: Imagem de ultrassom da glândula lacrimal inferior. Painel Superior: O ILG à medida que se move mais fundo em órbita para ficar o arco zigomático. A linha tracejada representa a linha na pele através da qual a sonda dos EUA é varrida. Painéis do Meio: À medida que a peça de mão é varrida através desta linha, o examinador procura a perda do eco ósseo zigomático que está presente na imagem esquerda(seta) e desaparece à direita. Painéis inferiores: Imagens do ILG tiradas antes(esquerda) e depois(direita)injeção de Con A. Desenvolvimento de um grande espaço cístico dentro da glândula confirma a devida entrega. Reimpresso com permissão19. Clique aqui para ver uma versão maior deste valor.

Figura 2: Sedação de máscara sedação. Esta fotografia mostra a máscara de gás fornecendo breve sedação moderada com isoflurane. Clique aqui para ver uma versão maior deste valor.
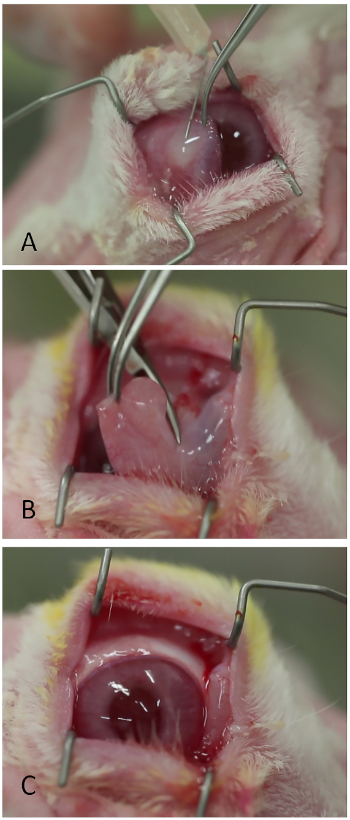
Figura 3: Remoção da membrana nicatitante. (A) Injeção de lidocaína/epinefrina. (B) Truncação da membrana nicatitante em sua base com tesouras Westcott. (C) A superfície ocular visualizada mais facilmente após a remoção da membrana nictitante. Clique aqui para ver uma versão maior deste valor.
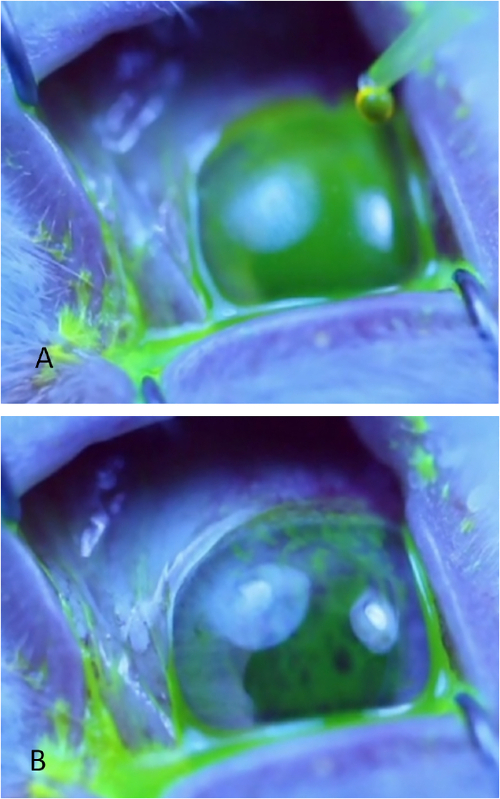
Figura 4: Medição de tempo de rompimento de lágrimas. (A) Uniforme filme de lágrima verde aparência da superfície córnea luz azul imediatamente após a aplicação de gotas de fluoresceína. (B) A superfície córnea que já sofreu um rompimento acentuado evidenciado por múltiplos círculos escuros e listras lineares na fluoresceína. O tempo de separação é registrado assim que o primeiro ponto escuro ou linha se desenvolver. Os dois círculos azuis claros são reflexos da fonte de luz fora da córnea. Clique aqui para ver uma versão maior deste valor.
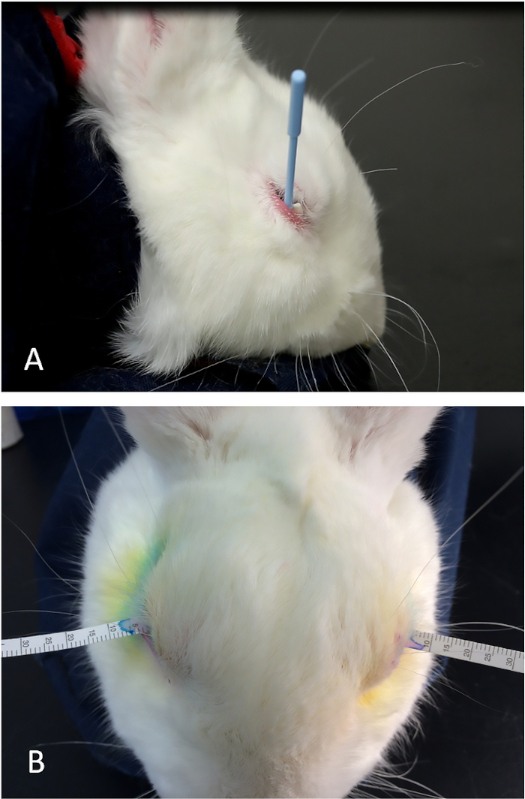
Figura 5: O teste de lágrima de Schirmer. (A) A colocação adequada da esponja Weck-Cel na fornix inferior para remover qualquer solução de lidocaína tópica residual e lágrimas de linha de base. Ao colocar a borda posterior da esponja triangular a margem inferior da tampa, pode-se manter uma técnica muito uniforme para secar a superfície ocular antes da colocação das tiras de lágrima. (B) Uma tira de lágrima adequadamente colocada na posição média da tampa inferior entre o globo e a tampa inferior (conjuntiva palpebral). Clique aqui para ver uma versão maior deste valor.

Figura 6: Rose bengala staining. Superior: Fotografias da superfície córnea. Esquerda: Nenhuma mancha de bengala rosa está presente antes do tratamento com Con A. Direito: A coloração difusa de córnea e conjuntiva é vista no quadrante nasal superior após a injeção (superior direito). Mais abaixo: Citologia de impressão conjuntiva da conjuntiva superior bulbar conjuntiva. Esquerda: Numerosas células de cálice estão presentes antes do tratamento. Certo: As células epiteliais estão presentes, mas as células de cálice estão ausentes após o tratamento. Clique aqui para ver uma versão maior deste valor.

Figura 7: Preparação de coelho para injeções de concanavalina A. (A) Pequenas tesouras são usadas para remover peles, permitindo uma visualização mais fácil de marcos para identificar a glândula lacrimal superior orbital. (B) Nair é usado para remover cabelos que permanecem após a cisalhamento. Clique aqui para ver uma versão maior deste valor.
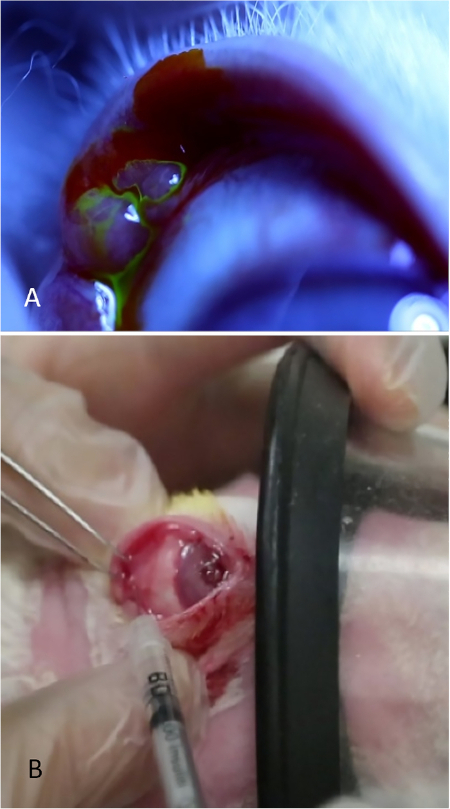
Figura 8: Injeção da glândula lacrimal palpebral. (A) A glândula lacrimal palpebral, aparecendo como uma elevação bulbosa na porção temporal posterior da tampa superior. Lágrimas são vistas fluindo da superfície desta glândula depois de aplicar uma queda de 2% de fluoresceína. (B) A glândula lacrimal palpebral está sendo injetada enquanto o coelho está recebendo sedação moderada. Um investigador retrai a pálpebra, otimiza a exposição da glândula e segura a máscara enquanto o segundo investigador injeta a glândula. Clique aqui para ver uma versão maior deste valor.

Figura 9: Localização da glândula lacrimal superior orbital. Alterações nos contornos da pele indicam a localização do OSLG à medida que ele se projeta através da incisegura posterior. A pressão medial alternada no globo(grande seta) faz com que a glândula orbital superior prolapsa, que é vista como uma pequena elevação na pele. Esta elevação aumentará de tamanho cada vez que a pressão for aplicada (pequenas setas). A localização desta glândula geralmente está em linha com a borda orbital posterior. Clique aqui para ver uma versão maior deste valor.
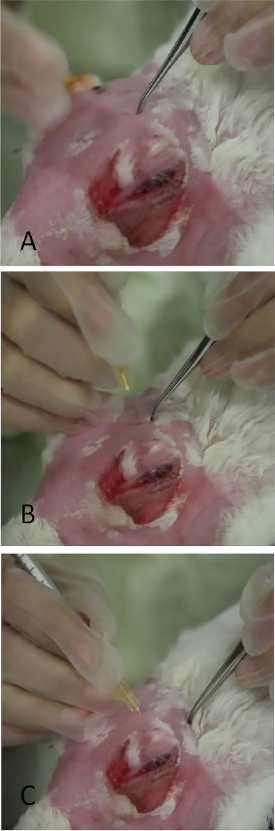
Figura 10: Injeção da glândula lacrimal superior orbital. (A) Aplicação de pressão suave ao crânio com fórceps finos na área que prolapsed como na Figura 9. Uma fina abertura de fenda no crânio pode ser empalida. Deixar uma pequena marca de recuo com os fórceps ajuda muito a colocação da agulha durante a injeção. (B) A agulha está sendo inserida perpendicularmente através da incicerteza. Se colocada incorretamente, sua passagem é interrompida pelo crânio ósseo. (C) A agulha está em posição final em ângulo para o canthus lateral. Clique aqui para ver uma versão maior deste valor.
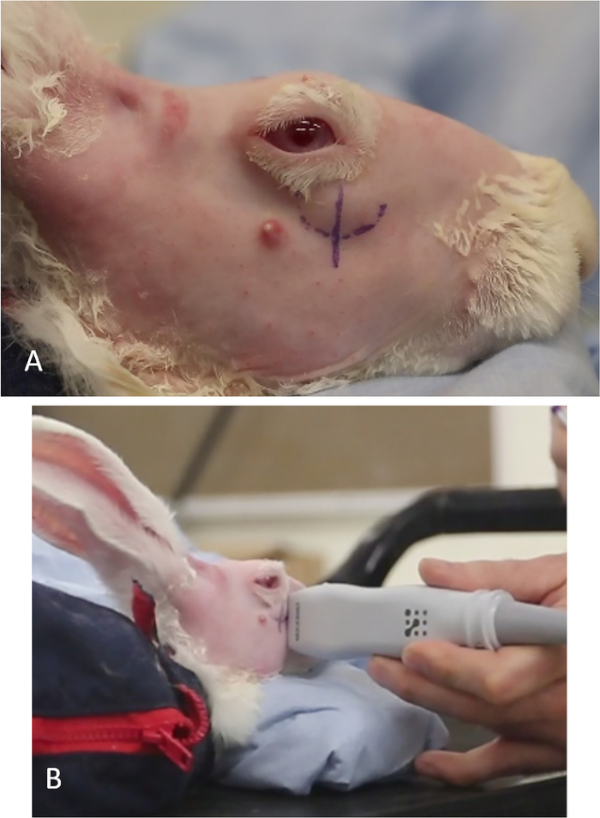
Figura 11: Localização da glândula lacrimal inferior. (A) A proeminência da parte superficial do ILG vista através da tampa inferior. A marca da caneta curvilínea denota a posição inferior da glândula. A linha vertical, o limbus nasal, denota a posição aproximada onde o ILG passa para uma posição mais profunda dentro da órbita e serve como referência visual para os EUA. (B) Peça manual dos EUA varrendo toda a área da linha vertical; o monitor dos EUA mostrará onde termina o osso zigomático, onde a transição do ILG e onde a injeção Con A deve ser dada ("local de injeção"). Clique aqui para ver uma versão maior deste valor.
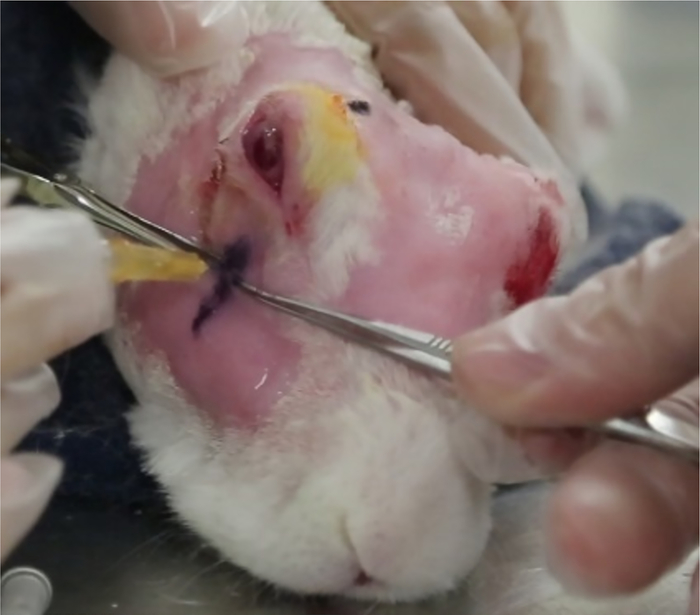
Figura 12: Injeção da glândula lacrimal inferior. A injeção do ILG é feita no local identificado pelos EUA. A profundidade da injeção é calculada conforme descrito no texto (passo 5.8.6). Pinças (vistas atrás da agulha) garantem que a agulha seja colocada na profundidade adequada antes da injeção. Clique aqui para ver uma versão maior deste valor.
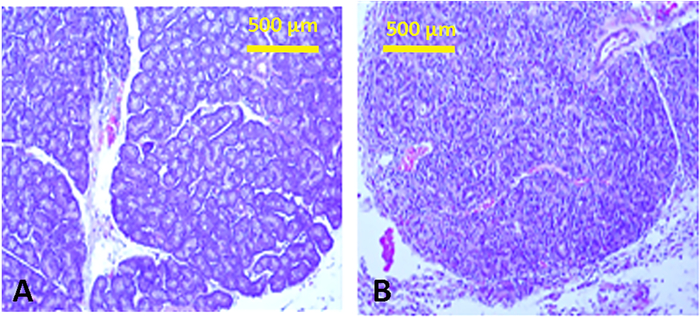
Figura 13: Histologia das glândulas lacrimal. Seções teciduais de uma glândula lacrimal inferior normal com estrutura típica tubulo-alveolar (A) e após injeção de Con A (B),mostrando infiltração linfocítica marcada com efusacito da estrutura. Infiltrações inflamatórias semelhantes são vistas nas glândulas lacrimalsuperiors. Clique aqui para ver uma versão maior deste valor.
| Método de injeção | TBUT, seg | Osmolalidade tear, Osm/L | STT, mm | |||
| Base | Pós-injeção | Base | Pós-injeção | Base | Pós-injeção | |
| média ± SEM, % mudança | ||||||
| ILG sem orientação dos EUA | 58,5 ± 1,5 | 44,5 ± 7,7 | 297 ± 4,9 | 300 ± 3,8 | 15,2 ± 0,9 | 12,9 ± 2,2 |
| %mudança | -23% | 1% | -15% | |||
| p=0,05 | p=0,36 | p=0,21 | ||||
| ILG + PSLG guiado nos EUA | 59,4 ± 0,6 | 11,4 ± 4,2 | 296 ± 4,7 | 326 ± 3,7 | 15,1 ± 1,3 ± | 10,7 ± 1,8 ± 1,8 |
| % mudança | -81% | 10% | -29% | |||
| p<0.0001 | p<0.0001 | p<0.03 | ||||
| ILG guiado nos EUA + PSLG + OSLG | 60 ± 0,0 | 6,2 ± 1,3 | 299 ± 2,9 | 309 ± 2,8 | 14,6 ± 0,9 | 9,9 ± 1,3 ± |
| % mudança | -90% | 3% | -32% | |||
| p<0.0001 | p<0.008 | p<0.002 | ||||
| Todos os valores foram medidos no sexto dia após uma única injeção de Con A nas glândulas listadas. Todas as comparações foram feitas com a linha de base. *ILG, glândula lacrimal inferior; PSLG, parcela palpebral de glândula lacrimal superior; OSLG, porção orbital de glândula lacrimal superior; EUA, ultrassom. | ||||||
Tabela 1: Efeito da técnica de injeção e número de locais de injeção na gravidade dos olhos secos.
| Base | Dia 6. | Dia 13. | Dia 21. | |
| 1 injeção | 2 injeções | 3 injeções | ||
| TBUT, seg | 58,5 ± 1,5 | 44,5 ± 7,7 | 29,2 ± 7,8 | 12,8 ± 3,9 |
| % mudança | -24% | -50% | -78% | |
| p=0,17 | p=0,001 | p<0.0001 | ||
| TOsm, Osm/L | 297 ± 4,9 | 300 ± 3,9 | 308 ± 4,9 | 313 ± 2,7 |
| % mudança | 1% | 4% | 5% | |
| p=0,36 | p=0,04 | p=0,003 | ||
| STT, mm | 15,2 ± 0,9 | 9,3 ± 1,6 | 12,9 ± 1,6 | 7,4 ± 1,1 |
| % mudança | -39% | -15% | -51% | |
| p=0,17 | p=0,13 | p=0,008 | ||
| Comparações foram feitas com a linha de base. | ||||
Tabela 2: Efeito das repetidas injeções Con A em ILG na duração do DED.
Discussão
Coelhos são altamente atraentes para o estudo do DED. Sua córnea e conjuntiva têm uma área de superfície mais próxima da dos humanos em comparação com ratos e ratos; seu complemento de enzimas metabolizantes de drogas, como esterases, e histologia de suas glândulas lacrimal são semelhantes aos dos humanos, e seus olhos são grandes o suficiente para estudos farmacocinéticos informativos. Em comparação com porcos e macacos, com os quais compartilham características semelhantes, custam menos e sua manipulação experimental é mais fácil. Se estudos mecanicistas são contemplados, uma relativa desvantagem do coelho, em comparação com ratos, é que menos reagentes (por exemplo, anticorpos monoclonais) estão disponíveis. Por outro lado, o coelho é muito superior aos camundongos para estudos farmacocinéticos e biodistributivos porque os tecidos individuais são facilmente dissecados e de tamanho suficiente para o trabalho analítico, evitando a "agrupamento de amostras".
Um parâmetro geral crítico é o período de aclimatação dos coelhos. Os animais são enviados do fornecedor em condições que muitas vezes não garantem um ambiente de transporte da temperatura ou umidade adequadas. Alguns animais podem já ter desenvolvido olho seco na chegada. Recomenda-se um período de duas semanas de aclimatação. Igualmente importante é a atenção escrupulosa à umidade e temperatura do espaço onde os coelhos do estudo estão alojados no vivarium. Desvios em ambas as condições podem induzir enormes variações em seu estado ocular. Tenha umidificadores e desumidificadores na mão. Se o sistema central falhar, agir rapidamente para restaurar a umidade ambiente usando o equipamento de backup. Tenha em mente que tais desenvolvimentos infelizes são mais comuns nos meses de verão. Os três passos mais críticos, no entanto, para induzir com sucesso o DED em coelhos são: 1) o uso hábil de imagens dos EUA para identificar o ILG e direcionar e confirmar a injeção de Con A; 2) garantir a injeção tanto do ILG quanto das duas partes do SLG; e 3) de forma confiável e reprodutível atribuindo os parâmetros do DED.
Desenvolver a habilidade experimental necessária não é trivial, mas não deve deter nenhum investigador sério. Espere que a curva de aprendizado seja concluída dentro de cinco iterações. Um sistema de imagem dos EUA de qualidade razoável é essencial. O reconhecimento das marcas anatômicas pelos EUA é importante, portanto, o investigador deve rever a anatomia do coelho. A excelente descrição da anatomia do coelho por Davis25, um clássico, pode ser imensamente útil. Tenha também em mente a variação do tamanho do ILG. O corolário para isso é que o sucesso da Con A deve ser sempre confirmado com imagens de acompanhamento. Variações na resposta a Con A em um grupo de coelhos são mais frequentemente devido à técnica de injeção (injeção mal sucedida ou parcialmente bem sucedida) ou para ignorar a capacidade de tecidos lacrimal residuais de glândulas lacrimals as cilindo para compensar com a superprodução de lágrimas. Para aqueles que desejam dominar a técnica de injeção, injetar azul de metileno seguido de dissecação anatômica rápida pode ser útil; visualização é alcançada se atingir a glândula lacrimal ou derramar sobre tecidos vizinhos. Até o momento, esse método de injeção foi realizado mais de 270 vezes pelos autores sem uma única complicação.
Atribuir os cinco parâmetros do DED apresentados acima pode ser tão complicado quanto sua determinação na prática clínica. Embora as variações circadianas ainda não tenham sido formalmente documentadas em nenhuma delas, há evidências suficientes de tais fenômenos no olho28 que devem ser ensaios na mesma hora do dia (± 1 h), especialmente quando ensaios repetidos devem ser realizados e comparados uns com os outros. Consistência na realização desses ensaios é essencial. Uma equipe de dois é necessária. Quatro ou mais investigadores na mesma sala que participam dos ensaios podem ser perturbadores, dado que algumas etapas requerem um timing rigoroso. Documentação fotográfica adequada e de alta qualidade, quando indicada, é importante.
Este modelo é idealpara estudos de desenvolvimento de drogas. A maestria do modelo animal e técnicas de ensaio garantiram excelente reprodutibilidade19 de estudos de eficácia e segurança.
Esta é uma abordagem experimental poderosa porque elimina a variabilidade confusa de modelos anteriores, agilizou o modelo animal e essencialmente padronizada atribuindo os cinco parâmetros do DED. A aplicação bem-sucedida desse modelo ao estudo de um agente terapêutico candidato tem afirmado sua utilidade prática como modelo animal informativo para uma doença em necessidade desesperada de novos agentes e de uma compreensão mais profunda de sua patogênese.
Divulgações
Os autores não declaram interesses concorrentes, exceto a BR, que tem uma posição acionária na Medicon Pharmaceuticals, Inc. e Apis Therapeutics, LLC; e LH, um funcionário da Medicon Pharmaceuticals, Inc. com uma posição acionária na Apis Therapeutics, LLC.
Agradecimentos
Todos os estudos em animais foram concluídos de acordo com todas as diretrizes regulatórias e institucionais relevantes. Todos os estudos foram aprovados pelo Conselho de Revisão Institucional da Universidade de Stony Brook e realizados de acordo com a Declaração ARVO para o Uso de Animais em Pesquisa Oftalmica e Visão.
Esses estudos foram apoiados em parte por uma bolsa targeted Research Opportunities da Stony Brook University School of Medicine (Grant Número 1149271-1-82502) e uma bolsa de pesquisa da Medicon Pharmaceuticals, Inc., Setauket, NY. Os autores agradecem michele McTernan por apoio editorial.
Materiais
| Name | Company | Catalog Number | Comments |
| 100 mm macro lens | Canon EF 100mm f/2.8L IS USM | 3554B002 | |
| 26 gauge needles (5/8) | Becton Dickinson and Company, Franklin Lakes, NJ | 305115 | Needles for injecting ConA into the lacrimal glands |
| 27 gauge needles (5/8) | Becton Dickinson and Company, Franklin Lakes, NJ | 305921 | Needles for injecting ConA into the lacrimal glands |
| Aceproinj (acepromazine) | Henry Schein Animal Health, Dublin, OH | NDC11695-0079-8 | 0.1ml/kg subcutaneously injection for rabbit sedation |
| Anesthesia vaporizer | VetEquip, Pleasanton, CA | Item #911103 | |
| Bishop Harmon Forceps | Bausch and Lomb (Storz), Bridgewater, NJ | E1500-C | Tissue forceps |
| Caliper | Bausch and Lomb (Storz), Bridgewater, NJ | E-2404 | Caliper used to measure length of needle during ConA injection |
| Concanavalin A | Sigma, St. Louis, MO | C2010 | Make 5mg/ml in PBS for injection into rabbit lacrimal glands |
| DSLR camera | Canon EOS 7D DSLR | 3814B004 | Digital single lens reflex camera |
| fluorescein | AKRON, Lake Forest, IL | NDC17478-253 | Dilute to 0.2% with PBS to measure TBUT |
| Isoflurane | Henry Schein, Melville, NY | 29405 | |
| Lactoferrin ELISA kit | MyBiosource, San Diego, CA | MBS032049 | Measure tear lactoferrin level |
| lidocaine | Sigma, St. Louis, MO | L5647 | 1% in PBS for anesthesia agent |
| macro/ring flash | Canon Macro Ring Lite MR-14EXII | 9389B002AA | |
| Osmolarity tips | TearLab Corp., San Diego, CA | #100003 REV R | Measure tear osmolarity |
| PBS (phosphate buffered saline) | Mediatech, Inc. Manassas, VA | 21-031-CV | |
| Rabbit, New Zealand White or Dutch Belted (as described in text) | Charles River Labs, Waltham, MA | 2-3 kg | Research animals |
| Rose Bengal | Amcon Laboratories Inc., St. Louis, MO | NDC51801-004-40 | 1% in PBS, stain the ocular surface |
| Schirmer strips | Eaglevision, Katena products. Denville, NJ | AX13613 | Measure tear production |
| Surgical Loupes +1.50 | Designs for Vision, Bohemia, NY | Specialty item | Provide magnificantion of ocular surface while observing tear break up and performing Concanavalin A injections. |
| TearLab Osmometer | TearLab Corp., San Diego, CA | Model #200000W REV A | Measure tear osmolarity |
| Ultrasound probe | VisualSonics Toronto, Ont | MX 550 S | Untrasonography-guide Con A injection for inferior lacrimal gland |
Referências
- Paulsen, A. J., et al. Dry eye in the Beaver Dam Offspring Study: prevalence, risk factors, and health-related quality of life. American Journal of Ophthalmology. 157 (4), 799-806 (2014).
- Vehof, J., Kozareva, D., Hysi, P. G., Hammond, C. J. Prevalence and risk factors of dry eye disease in a British female cohort. British Journal of Ophthalmology. 98 (12), 1712-1717 (2014).
- Tan, L. L., Morgan, P., Cai, Z. Q., Straughan, R. A. Prevalence of and risk factors for symptomatic dry eye disease in Singapore. Clinical and Experimental Optometry. 98 (1), 45-53 (2015).
- Craig, J. P., et al. TFOS DEWS II Report Executive Summary. The Ocular Surface. 15 (4), 802-812 (2017).
- Baudouin, C., et al. Clinical impact of inflammation in dry eye disease: proceedings of the ODISSEY group meeting. Acta Ophthalmologica (Copenhagen). 96 (2), 111-119 (2018).
- Calonge, M., et al. Dry eye disease as an inflammatory disorder. Ocular Immunology and Inflammation. 18 (4), 244-253 (2010).
- Pflugfelder, S. C., de Paiva, C. S. The Pathophysiology of Dry Eye Disease: What We Know and Future Directions for Research. Ophthalmology. 124 (11S), S4-S13 (2017).
- Buckley, R. J. Assessment and management of dry eye disease. Eye (London, England). 32 (2), 200-203 (2018).
- Clayton, J. A. Dry Eye. New England Journal of Medicine. 378 (23), 2212-2223 (2018).
- Barabino, S. Animal models of dry eye. Archivos de la Sociedad Española de Oftalmología. 80 (12), 695-696 (2005).
- Stern, M. E., Pflugfelder, S. C. What We Have Learned From Animal Models of Dry Eye. International Ophthalmology Clinics. 57 (2), 109-118 (2017).
- Chen, Z. Y., Liang, Q. F., Yu, G. Y. Establishment of a rabbit model for keratoconjunctivitis sicca. Cornea. 30 (9), 1024-1029 (2011).
- Gilbard, J. P., Rossi, S. R., Gray, K. L. A new rabbit model for keratoconjunctivitis sicca. Investigative Ophthalmology & Visual Science. 28 (2), 225-228 (1987).
- Guo, Z., et al. Autologous lacrimal-lymphoid mixed-cell reactions induce dacryoadenitis in rabbits. Experimenal Eye Research. 71 (1), 23-31 (2000).
- Burgalassi, S., Panichi, L., Chetoni, P., Saettone, M. F., Boldrini, E. Development of a simple dry eye model in the albino rabbit and evaluation of some tear substitutes. Ophthalmic Research. 31 (3), 229-235 (1999).
- Xiong, C., et al. A rabbit dry eye model induced by topical medication of a preservative benzalkonium chloride. Investigative Ophthalmology & Visual Science. 49 (5), 1850-1856 (2008).
- Heymann, F., Hamesch, K., Weiskirchen, R., Tacke, F. The concanavalin A model of acute hepatitis in mice. Lab Animal. 49 (1 Suppl), 12-20 (2015).
- Nagelhout, T. J., Gamache, D. A., Roberts, L., Brady, M. T., Yanni, J. M. Preservation of tear film integrity and inhibition of corneal injury by dexamethasone in a rabbit model of lacrimal gland inflammation-induced dry eye. Journal of Ocular Pharmacology and Therapeutics. 21 (2), 139-148 (2005).
- Honkanen, R. A., Huang, L., Xie, G., Rigas, B. Phosphosulindac is efficacious in an improved concanavalin A-based rabbit model of chronic dry eye disease. Translational Research. 198, 58-72 (2018).
- Huang, L., et al. The novel phospho-non-steroidal anti-inflammatory drugs, OXT-328, MDC-22 and MDC-917, inhibit adjuvant-induced arthritis in rats. British Journal of Pharmacology. 162 (7), 1521-1533 (2011).
- Mattheolabakis, G., et al. Topically applied phospho-sulindac hydrogel is efficacious and safe in the treatment of experimental arthritis in rats. Pharmaceutical Research. 30 (6), 1471-1482 (2013).
- Osmalek, T., Froelich, A., Tasarek, S. Application of gellan gum in pharmacy and medicine. International Journal of Pharmaceutics. 466 (1-2), 328-340 (2014).
- Lemp, M. A. Report of the National Eye Institute/Industry workshop on Clinical Trials in Dry Eyes. Contact Lens Association of Ophthalmologists Journal. 21 (4), 221-232 (1995).
- Dal Piaz, F., Braca, A., Belisario, M. A., De Tommasi, N. Thioredoxin system modulation by plant and fungal secondary metabolites. Current Medicinal Chemistry. 17 (5), 479-494 (2010).
- Davis, F. A. The Anatomy and Histology of the Eye and Orbit of the Rabbit. Transactions of the American Ophthalmological Society. 27, 402-441 (1929).
- Lima, L., Lange, R. R., Turner-Giannico, A., Montiani-Ferreira, F. Evaluation of standardized endodontic paper point tear test in New Zealand white rabbits and comparison between corneal sensitivity followed tear tests. Veterinary Ophthalmology. 18 (Suppl 1), 119-124 (2015).
- Zheng, W., et al. Therapeutic efficacy of fibroblast growth factor 10 in a rabbit model of dry eye. Mol Med Report. 12 (5), 7344-7350 (2015).
- Wiechmann, A. F., Summers, J. A. Circadian rhythms in the eye: the physiological significance of melatonin receptors in ocular tissues. Progress in Retinal and Eye Research. 27 (2), 137-160 (2008).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados