Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Un enfoque de aprendizaje automático para diseñar un examen selectivo eficiente del deterioro cognitivo leve
En este artículo
Resumen
Esta metodología produce árboles de decisión que se dirigen a grupos de población más propensos a sufrir de deterioro cognitivo leve y son útiles para la detección selectiva rentable de la enfermedad.
Resumen
El deterioro cognitivo leve (MCI) es el primer signo de demencia entre las poblaciones de edad avanzada y su detección temprana es crucial en nuestras sociedades envejecidas. Las pruebas comunes de MCI consumen mucho tiempo, de manera que el cribado masivo indiscriminado no sería rentable. Aquí, describimos un protocolo que utiliza técnicas de aprendizaje automático para seleccionar rápidamente candidatos para su posterior selección a través de una prueba de MCI basada en preguntas. Esto minimiza el número de recursos necesarios para el cribado porque solo los pacientes que son potencialmente positivos para la ICM se prueban más a fondo.
Esta metodología se aplicó en un estudio inicial de investigación de MCI que formó el punto de partida para el diseño de un árbol de decisión de cribado selectivo. El estudio inicial recopiló muchas variables demográficas y de estilo de vida, así como detalles sobre los medicamentos para pacientes. El Cuestionario de Estado Mental Portátil Corto (SPMSQ) y el Examen de Estado Mini-Mental (MMSE) se utilizaron para detectar posibles casos de MCI. Por último, utilizamos este método para diseñar un proceso eficiente para clasificar a las personas en riesgo de MCI. Este trabajo también proporciona información sobre los factores relacionados con el estilo de vida asociados con la ICM que podrían aprovecharse en la prevención y detección temprana de ICM entre las poblaciones de edad avanzada.
Introducción
El envejecimiento de la población está aumentando la prevalencia de enfermedades crónicas y degenerativas, especialmente demencias degenerativas, que se espera que afecten a más de 131 millones de personas en todo el mundo para 20501. Entre todas las demencias degenerativas, la enfermedad de Alzheimer es la más común con una prevalencia general en Europa del 6,88%2. Debido a la independencia cada vez más en declive de los pacientes con AD, este grupo debe comenzar a recibir apoyo tan pronto como ad comienza a manifestarse. Por lo tanto, la detección temprana de signos prodrómicos de AD, como deterioro cognitivo leve (MCI), es esencial.
LA ICM se define como una etapa de deterioro cognitivo intermedio correspondiente al envejecimiento normal y al deterioro grave debido a la demencia3. Según estimaciones de Petersen et al.4, la prevalencia de IMC es del 8,4% entre las personas de 65 a 69 años y alcanza el 25,2% para las mayores de 80 años. MCI resulta en individuos experimentando más dificultades de lo esperado en la ejecución de habilidades cognitivas de bajo nivel, especialmente aquellos relacionados con la memoria y el lenguaje, pero no interfiere con las actividades de la vida diaria.
La detección no es sinónimo de diagnóstico; el diagnóstico de ICM siempre será una tarea clínica, mientras que los métodos de cribado sólo pueden informarnos que un paciente tiene una mayor probabilidad de sufrir esta patología y que hay una sospecha fundada de ICM que debe confirmarse clínicamente. Por lo tanto, los trabajadores de la atención primaria (médicos, farmacéuticos, enfermeros, etc.) podrían beneficiarse de la disponibilidad de métodos de cribado simples (breves pruebas cognitivas) que se pueden aplicar en cuestión de minutos. Idealmente, estos identificarían objetivamente a los pacientes con una alta probabilidad de sufrir un MCI para que luego puedan ser clínicamente probados por médicos generales o especializados.
Dado que la detección precoz de la ICM se está convirtiendo en una tarea esencial en el contexto de la salud pública, este trabajo tenía como objetivo identificar qué características son útiles en la identificación específica de la ICM en las pruebas de detección de poblaciones de edad avanzada. Estos grupos se probarían más a fondo para detectar la ICM en las pruebas administradas por los proveedores de atención primaria de salud. Esta metodología proporciona un árbol de decisiones con los algoritmos adecuados para identificar los grupos de población a los que se va a destinar.
Entre estas características, la edad es uno de los factores más consistentes asociados con el desarrollo de esta patología. Otras características relevantes están relacionadas con la demografía o el estilo de vida5. Entre estos últimos, algunos estudios han identificado la duración del sueño diurno o nocturno como un factor de riesgo que puede conducir al diagnóstico de MCI5,6,7,8,9. El consumo prolongado de medicamentos como las benzodiazepinas, consumidas por un estimado del 20%-25% de los adultos mayores10,11,también puede influir en las horas de sueño y el desarrollo de MCI12,13. De hecho, los tratamientos prolongados para enfermedades crónicas pueden ser características importantes útiles en la preselección de individuos con un alto riesgo de padecer MCI.
Aquí, desarrollamos modelos basados en datos que utilizan algoritmos de aprendizaje automático, un árbol de decisión y una herramienta predictiva para aumentar la eficiencia de la metodología para detectar MCI discriminando qué características juegan un papel importante en los primeros detección de MCI. El árbol de decisión resultante presentado aquí se produjo utilizando una cohorte específica de pacientes españoles utilizando farmacias comunitarias. Sin embargo, este método también sería útil entre otras poblaciones con características diferentes.
Este trabajo se completó en colaboración con médicos especializados y de atención primaria. Las farmacias comunitarias eran ideales para probar este algoritmo porque están cerca de los pacientes, tienen un horario de apertura largo y son visitadas y consultadas con frecuencia. Las demencias degenerativas son condiciones complejas que no siempre son bien comprendidas por los proveedores de atención primaria14. Por lo tanto, involucrarse en el proceso aumentará la conciencia de las personas que sufren de ICM y demencias.
Protocolo
La metodología aplicada en este estudio se ha publicado previamente5 en trabajos realizados en la Universidad CEU Cardenal Herrera junto con farmacias comunitarias de la Región Valenciana (España) asociadas a la Sociedad Española de Farmacia Familiar y Comunitaria (SEFAC). Este estudio actual fue revisado y aprobado por el Comité de Etica de Investigación de la Universidad CEU Cardenal Herrera (aprobación no. CEI11/001) en marzo de 2011. Todas las personas involucradas en el estudio dieron su consentimiento informado por escrito a la participación de conformidad con la Declaración de Helsinki.
1. Selección de factores asociados con deterioro cognitivo leve
- Buscar términos relacionados con MCI para su uso en la detección de revisiones sistemáticas de Cochrane (por ejemplo, deterioro cognitivo, demencia, factores de riesgo, etc.).
- Búsqueda de términos para los cuales hay alguna evidencia de una relación con el deterioro cognitivo o demencia publicado en la base de datos PubMed; estos incluyen factores demográficos (sexo, edad, nivel educativo y estado económico), factores sociales (actividades cognitivas y sociales), patologías crónicas (colesterol, depresión, hipertensión, diabetes y obesidad), y comportamientos de estilo de vida (alcohol hábito de fumar, dieta, actividad física y horas de sueño).
- Calcular la relación de probabilidades para las variables cualitativas o el tamaño del efecto d de Cohen para las variables cuantitativas15. Seleccione las variables con tamaños de efecto más grandes para el deterioro cognitivo o la demencia para su uso en la elaboración de un cuestionario.
2. Diseño de los cuestionarios
- Diseñar un cuestionario para recopilar información sobre las variables seleccionadas, siguiendo las directrices proporcionadas por Nardi16. Por ejemplo, las variables utilizadas en Climent et al.5 fueron demográficas (edad, peso y altura [medidas con procedimientos estandarizados utilizando escalas calibradas y estadómetros], sexo, nivel educativo y tipo de empleo), estilo de vida (ejercicio físico, lectura, tiempo pasado durmiendo durante la noche y durante el día, rompecabezas, juegos, tiempo de consumo de TV y consumo de tabaco y alcohol), y patologías crónicas (hipertensión, hiperlipidemia y diabetes). Además, registre la presencia o ausencia de depresión, que con frecuencia se asocia con el deterioro cognitivo.
- Diseñar una hoja de seguimiento de farmacoterapia para informar de todos los medicamentos consumidos por los participantes en el momento de la entrevista, como en Climent et al.5, que utilizó el método17 de Dader para diseñar esta hoja.
3. Selección de pruebas para la detección de MCI
- Determinar todas las pruebas utilizadas para detectar la ICM que podrían ser administradas por los trabajadores de la atención primaria de la salud (por ejemplo, farmacéuticos). Rechazar cualquier prueba que deba ser administrada por un especialista. Algunas de las pruebas que cumplen estas condiciones son el Cuestionario de Estado Mental Portátil Corto (SPMSQ)18, Mini Mental State Examination (MMSE)19, Memory Impairment Screen (MIS)20, Picture Memory Impairment Screen (PMIS)21, Montreal Cognitive Assessment (MoCA)22, Saint Louis University Mental Status (SLUMS)23, y Quick Mild Cognitive Impairment (QMci)24. Una revisión exhaustiva de cada prueba de MCI está disponible en Cullen et al.25.
- Buscar una buena estimación de las sensibilidades y especificidades de las pruebas en la literatura científica.
- Calcule el tiempo necesario para administrar estas pruebas a individuos sanos.
- Considere las características básicas del paciente requeridas para la realización de estas pruebas. Por ejemplo, puede ser necesario un nivel de educación mínimo porque muchas pruebas de MCI no son adecuadas para los participantes analfabetos. Por lo general, se aplica un conjunto de pruebas de detección de ICM para aumentar la sensibilidad; sin embargo, el número mínimo de pruebas debe ser administrado rápidamente por los farmacéuticos si el cribado selectivo final está destinado a una población grande. 5evaluaron el MCI utilizando las pruebas MMSE y SPMSQ, siendo este último adecuado para el gran número de personas que vivieron la guerra civil española que son analfabetas.
- Utilizar una variante del SPMSQ por Pfeiffer18 fue validado en español por Martínez de la Iglesia26. Esta prueba tiene una puntuación máxima de 10 y el punto de corte para establecer el deterioro cognitivo es de 3 o más errores (4 o más para personas analfabetas). Esta prueba tarda entre 8 y 10 minutos en completarse.
- Utiliza una versión NORMACODERM de la MMSE validada para hablantes de español por Blesa27 adaptando la versión original de Folstein19. Esta prueba de detección tiene una puntuación máxima de 30 y se corrige de acuerdo con los años de escolaridad de los pacientes y las edades. Los participantes que puntúen menos o igual que 24 se consideran casos de MCI. El MMSE es una medida de la función cognitiva general e incluye orientación al tiempo y al lugar, lenguaje escrito y hablado, capacidad de atención, cálculo y memoria. Se administró a todos los participantes en este estudio porque es una prueba muy corta que tarda sólo unos 5 minutos en completarse.
4. Reclutamiento de temas
- Encuentre farmacéuticos dispuestos a reclutar personas no institucionalizadas para formar la población del estudio. El estudio mencionado por Climent et al.5 incluyó a personas de 65 años o más que fueron regularmente a la farmacia y que aceptaron participar en este estudio. Excluir a los pacientes con cualquier dificultad para realizar estas pruebas de evaluación (por ejemplo, debido a la ceguera, sordera, etc.) o que ya estaban siendo tratados para la demencia.
- Proporcionar a los farmacéuticos participantes formularios de consentimiento informado, que deben ser completados por cada persona que participe en el estudio. Este formulario de consentimiento especifica el título de la investigación, los objetivos del proyecto, una explicación comprensible de todos los procedimientos en los que el participante participaría, la ausencia de riesgos específicos, la confidencialidad de todos los datos recogidos y la derecho a retirarse del estudio por cualquier motivo en cualquier momento.
- Capacitar a los farmacéuticos para administrar entrevistas personales estructuradas a los participantes, que deben durar aproximadamente media hora por persona. Recopilar datos durante 1 año y enviar todos los formularios a los investigadores responsables de la protección de datos en el estudio. Posteriormente seguimiento con los pacientes durante 3 meses.
- Indique a los farmacéuticos cómo identificar un caso probable de MCI utilizando pruebas de McI. Sobre la base de Climent et al.5 utilizamos puntuaciones SPMSQ de 4 o más puntos (para participantes analfabetos) o 3 o más puntos para los otros participantes y se utilizaron puntuaciones de 24 puntos o menos en la prueba MMSE corregida.
- Instruir a los farmacéuticos cómo derivar los casos de McI a un especialista médico (un neurólogo) para su diagnóstico clínico, el último paso en el diagrama de flujo utilizado en este estudio de investigación(Figura 1).
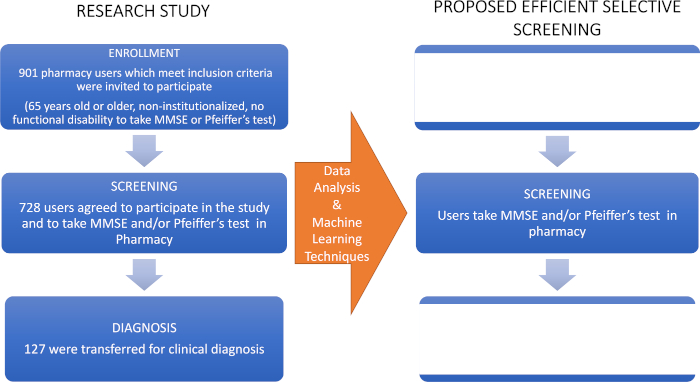
Figura 1: Diagrama de flujo del estudio de investigación y el cribado selectivo propuesto. El lado izquierdo representa el estudio inicial cuyos datos fueron analizados con técnicas de aprendizaje automático para proponer el cribado selectivo para la detección temprana de MCI que se muestra en el panel derecho. Esta cifra fue modificada desde Climent34. Haga clic aquí para ver una versión más grande de esta figura.
5. Formación de investigadores farmacéuticos
- Póngase en contacto con especialistas para organizar sesiones de formación de los farmacéuticos participantes en conocimientos básicos relacionados con el deterioro cognitivo y en la gestión de sus herramientas de cribado, por ejemplo, el SPMSQ y MMSE.
- Asegúrese de que los farmacéuticos participantes conozcan los procedimientos, el protocolo de recopilación de datos y todas las posibles cuestiones relacionadas con la protección de datos. Informarles de que el proyecto fue aprobado por un Comité de ética de la investigación y de la importancia del formulario de consentimiento de acuerdo con la Declaración de Helsinki.
NOTA: Para realizar el estudio descrito por Climent et al.5, se celebraron talleres en el Colegio Oficial de Farmacéuticos y la Universidad Cardenal-Herrera CEU (UCH-CEU), y se cubrieron lo siguiente: MCI y demencia; enfoques diagnósticos de MCI y gestión del SPMQP y MMSE (impartido por el Servicio de Neurología del Hospital La Plana de Castellón); presentación del proyecto y explicación de la metodología por investigadores farmacéuticos de la comunidad superior; y la educación sanitaria y la formación cognitiva por parte de investigadores del Departamento de Farmacia de la Universidad UCH-CEU.
6. Diseño del estudio
- Calcule un tamaño de muestra para evaluar la viabilidad del proyecto. Debido a que se trataba de un estudio observacional, una muestra más grande producirá herramientas más eficaces. Hay dos maneras de determinar el tamaño de la muestra: una se basa en la estimación de la prevalencia y la otra es más precisa, teniendo en cuenta los tamaños de los efectos.
- Calcular una estimación precisa de la prevalencia de la condición en la población
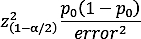
donde el valor de á es el nivel de significancia, p0 es la estimación inicial y el error es el error máximo esperado con una confianza del 100(1 - ) %. - De acuerdo con los tamaños de efecto que se encuentran en la literatura para cada factor, utilice herramientas como el paquete pwr en R para estimar cuánta potencia se requiere para detectar diferencias15,28.
NOTA: Por ejemplo, en nuestro estudio5 diseñamos la primera propuesta con un error del 3% al 95% de confianza y una estimación inicial de la prevalencia de ICM al 15% en la población de 65 años o más, lo que resulta en un tamaño estimado de la muestra requerida de 541 individuos.
- Calcular una estimación precisa de la prevalencia de la condición en la población
7. Red de comunicación interdisciplinaria, farmacéuticos, médicos de atención primaria y especialistas
- Diseñar cartas para comunicar información sobre el proyecto a los centros de salud involucrados.
- Explicar a los farmacéuticos participantes cómo informar a sus médicos asignados sobre los resultados de los exámenes a través de una carta al centro de atención primaria de salud.
- Enviar comunicaciones escritas a los coordinadores médicos de los centros de salud relacionados con las farmacias participantes y a los Servicios de Neurología de los hospitales a los que están asignados.
- Póngase en contacto con los neurólogos participantes para conocer el diagnóstico definitivo de cada paciente obtenido a través de pruebas específicas realizadas por proveedores de atención médica especializados. Antes de esto, los proveedores de atención primaria de salud deben llevar a cabo el siguiente protocolo, según lo resumido por las directrices clínicas(Figura 2).

Figura 2: Protocolo para la acción de la atención primaria de la salud. Un ejemplo de las acciones de atención primaria que deben considerarse para la detección temprana de LA ICM antes de que el paciente sea referido para un diagnóstico médico por especialistas. Haga clic aquí para ver una versión más grande de esta figura.
8. Análisis estadístico y preprocesamiento
NOTA: Antes de aplicar las técnicas de aprendizaje automático, se requiere un paso preparatorio para transformar los datos originales en un nuevo conjunto de datos de acuerdo con el objetivo final del estudio y los procedimientos que se van a aplicar. Para esta transformación, se deben tener en cuenta varias cosas, incluidas las características de los algoritmos. Esto se debe a que algunos de ellos son sensibles a la falta de variabilidad o el intercambio de información entre columnas, aunque los algoritmos utilizados para generar árboles de decisión son particularmente robustos contra estos problemas. Esta fase inicial tiene como objetivo categorizar variables cualitativas y recopilar valores con suficientes casos para cada variable. Para un cribado eficiente es importante elegir variables cuya adquisición ha demostrado ser fácil y precisa. Los participantes son seleccionados por una breve entrevista en la que los algoritmos utilizados estaban restringidos a un modelo de caja blanca, lo que facilita la comprobación de los criterios utilizados para decidir si la persona debe tomar la prueba. Sugerimos usar el paquete rpart29 en el software R para estos algoritmos, e implementar particiones recursivas.
- Recoger todos los formularios de las farmacias participantes y convertirlos en una tabla en la que cada columna es una variable y cada individuo participante es una fila.
- Asigne un número de identificación a cada participante. Guarde el número de identificación y la información de contacto en un documento diferente para que no lo utilice el algoritmo de aprendizaje automático.
- Generar variables para clasificar si cada medicamento que toma el paciente corresponde al segundo o tercer códigos de nivel ATC30 (Químico Terapéutico Anatómico), de acuerdo con los ingredientes principales activos en la hoja de seguimiento de farmacoterapia.
- Realice un análisis descriptivo inicial.
- Para cada variable ordinal, elija un contraste adecuado para la variable. Para variables categóricas, seleccione el valor considerado como línea base.
- Para variables categóricas, calcule una regresión logística univariada con una variable de respuesta para la detección de MCI. Analice el resultado de la regresión con una tabla de contingencia, el valor p,la relación de cuotas de muestra y el intervalo de confianza del 95% de la relación de probabilidades.
- Para las variables cuantitativas, calcule la media, la desviación estándar, el coeficiente de regresión logística y el intervalo de confianza del 95% de sus coeficientes.
- Rechazar variables con valores faltantes (no disponibles), teniendo en cuenta que estas variables son difíciles de recopilar con precisión.
- Seleccione solo las variables para las que haya al menos una categoría estadísticamente significativa( ?lt; 0.01) de acuerdo con el análisis de regresión logística. El resultado de este paso produce un conjunto de datos reducido en comparación con el inicial.
9. Algoritmos para crear un árbol de decisión
NOTA: Los algoritmos de aprendizaje automático deben estar correctamente parametrizados para predecir qué individuos es probable que tengan un resultado positivo de la prueba de MCI. Uno de los principales problemas durante la detección de una condición es que se espera que los datos originales estén desequilibrados (es decir, pocos casos positivos en comparación con los negativos). Para obtener modelos con datos equilibrados utilizamos una técnica llamada down-sampling, o muestreo aleatorio, para igualar la frecuencia con la de la clase de frecuencia más baja31. El cribado eficiente también requiere reducir el número de falsos negativos tanto como sea posible (es decir, aumentar la sensibilidad de la selección de participantes que sufren de MCI). Una de las técnicas utilizadas para lograr una mayor sensibilidad es la introducción de sanciones en el cálculo del índice de impurezade Gini (es decir, el índice utilizado por el algoritmo para seleccionar la mejor división para el árbol de decisión)32.
- Genere un conjunto de datos de entrenamiento y prueba con el 80% y el 20% de todo el conjunto de datos, respectivamente, utilizando la función createDataPartition en la biblioteca de intercalación33.
- Aplique los algoritmos utilizados para generar árboles de decisión al conjunto de datos de entrenamiento. Utilice la función train again en la biblioteca de el programa33. Los siguientes pasos son diferentes parámetros de la función; por ejemplo, el árbol utilizado en este papel se generó con rpart29 (método " rpart"), pero hay otros algoritmos disponibles.
- Seleccione el método de muestreo de "muestreo hacia abajo" e introduzca el parámetro de muestreo "abajo" en el intercalador.
- Establezca las probabilidades anteriores para ambas clases.
- Proporcione una matriz de pérdidas con las penalizaciones del índice de impurezas de Gini aplicadas con el fin de centrarse en la creciente sensibilidad.
- Para cada parámetro del algoritmo, elija una cuadrícula de valores adecuada.
- Utilice una estimación de validación cruzada de los valores de la curva de funcionamiento del receptor (ROC) para seleccionar los mejores modelos dentro de la cuadrícula de parámetros.
- Calcule una matriz de confusión y el área bajo la curva ROC (AUC) para la predicción del conjunto de pruebas para evaluar el verdadero rendimiento del modelo.
Resultados
Las farmacias participantes recopilaron datos de 728 usuarios y recopilaron variables demográficas además de los medicamentos prescritos a los participantes. Se realizó una regresión logística univariada para todas las variables34; los gráficos de barras de error que se muestran en la Figura 3 y la Figura 4 son representaciones gráficas convenientes del intervalo de confianza de la relación de prob...
Discusión
Después de buscar términos asociados con MCI en estudios de Cochrane en la base de datos PubMed, se creó un cuestionario específico para este estudio que utilizó las variables más evidentes con una asociación probada con MCI. También se registraron factores demográficos, de estilo de vida y sociales, así como farmacoterapia del paciente y algunas patologías relevantes. Además, también se seleccionaron las pruebas SPMSQ y MMSE MCI. Es importante destacar que el SPMSQ no se vio afectado por el nivel de escolar...
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Este trabajo fue posible gracias al apoyo de la Fundación Know Alzheimer y la ayuda del servicio de producción multimedia de la Universidad CEU Cardenal Herrera, especialmente Enrique Giner. Nos gustaría reconocer el trabajo de todas las farmacias participantes (SEFAC), y de los médicos colaboradores de la Sociedad de Médicos de Atención Primaria (SEMERGEN) y de la Sociedad de Neurología (SVN) que ayudaron con los diagnósticos de MCI, especialmente Vicente Gassull, Rafael Sánchez, y Jordi Pérez. Por último, damos las gracias a todos los que aceptaron participar en este estudio.
Materiales
| Name | Company | Catalog Number | Comments |
| caret | Max Kuhn | R package | |
| rpart | Terry Therneau, Beth Atkinson, Brian Ripley | R package | |
| SPMSQ in Spanish | Farmaceuticoscomunitarios.org | http://farmaceuticoscomunitarios.org/anexos/vol11_n1/ANEXO1.pdf | |
| SPMSQ in English | geriatrics.stanford.edu | https://geriatrics.stanford.edu/culturemed/overview/assessment/assessment_toolkit/spmsq.html | |
| MMSE in Spanish | Farmaceuticoscomunitarios.org | http://farmaceuticoscomunitarios.org/anexos/vol11_n1/ANEXO2.pdf | |
| MMSE in English | oxfordmedicaleducation.com | http://www.oxfordmedicaleducation.com/geriatrics/mini-mental-state-examination-mmse/ |
Referencias
- . World Alzheimer report 2016: improving healthcare for people living with dementia: coverage, quality and costs now and in the future Available from: https://scholar.google.com/scholar.bib?q=info:mEGpcpLHEIMJ:scholar.google.com (2016)
- Niu, H., Álvarez-Álvarez, I., Guillén-Grima, F., Aguinaga-Ontoso, I. Prevalence and incidence of Alzheimer's disease in Europe: A meta-analysis. Neurología (English Edition). 32 (8), 523-532 (2017).
- Petersen, R. C., et al. Mild Cognitive Impairment: Clinical Characterization and Outcome. Archives of Neurology. 56 (3), 303 (1999).
- Petersen, R. C., et al. Practice guideline update summary: Mild cognitive impairment: Report of the Guideline Development, Dissemination, and Implementation Subcommittee of the American Academy of Neurology. Neurology. 90 (3), 126-135 (2018).
- Climent, M. T., Vilaplana, A. M., Arnedo, A., Vilar, J., Moreno-Royo, L. Life styles associated cognitive impairment. Study from the community pharmacy [Estilos de vida asociados a deterioro cognitivo. Estudio preliminar desde la farmacia comunitaria]. Revista de Investigacion Clinica. 65 (6), 500-509 (2013).
- Faubel, R., et al. Usual sleep duration and cognitive function in older adults in Spain. Journal of Sleep Research. 18 (4), 427-435 (2009).
- Benito-León, J., Louis, E. D., Bermejo-Pareja, F. Cognitive decline in short and long sleepers: A prospective population-based study (NEDICES). Journal of Psychiatric Research. 47 (12), 1998-2003 (2013).
- Ramos, A. R., et al. Association between Sleep Duration and the Mini-Mental Score: The Northern Manhattan Study. Journal of Clinical Sleep Medicine. 9 (7), 669 (2013).
- Gabelle, A., et al. Excessive Sleepiness and Longer Nighttime in Bed Increase the Risk of Cognitive Decline in Frail Elderly Subjects: The MAPT-Sleep Study. Frontiers in Aging Neuroscience. 9, 312 (2017).
- Fernández, M., et al. Prevalence of dementia in the elderly aged above 65 in a district in the Basque Country. Revista de Neurologia. 46 (2), 89-96 (2008).
- Velert Vila, J., et al. Suitability of the use of benzodiazepines prescribed by the pharmacist in the elderly. A doctor-pharmacist collaboration study. Atención Primaria. 44 (7), 402-410 (2012).
- Ranstam, J., et al. Impaired cognitive function in elderly men exposed to benzodiazepines or other anziolytics. The European Journal of Public Health. 7 (2), 149-152 (1997).
- Airagnes, G., Pelissolo, A., Lavallée, M., Flament, M., Limosin, F. Benzodiazepine Misuse in the Elderly: Risk Factors, Consequences, and Management. Current Psychiatry Reports. 18 (10), 89 (2016).
- Alacreu, M., et al. Importance of Increasing Modifiable Risk Factors Knowledge on Alzheimer's Disease Among Community Pharmacists and General Practitioners in Spain. Frontiers in Pharmacology. 10, 860 (2019).
- Cohen, J. . Statistical Power Analysis for the Behavioral Sciences. , (2013).
- Nardi, P. M. . Doing Survey Research: A Guide To Quantitative Methods. , (2018).
- Sabater Hernández, D., Silva Castro, M. M., Faus Dáder, M. J. . Método Dáder: guía de seguimiento farmacoterapéutico. , (2017).
- Pfeiffer, E. A Short Portable Mental Status Questionnaire for the Assessment of Organic Brain Deficit in Elderly Patients. Journal of the American Geriatrics Society. 23 (10), 433-441 (1975).
- Folstein, M. F., Folstein, S. E., McHugh, P. R. "Mini-mental state." A practical method for grading the cognitive state of patients for the clinician. Journal of Psychiatric Research. 12 (3), 189-198 (1975).
- Buschke, H., et al. Screening for dementia with the memory impairment screen. Neurology. 52 (2), 231-238 (1999).
- Verghese, J., et al. Picture-based memory impairment screen for dementia. Journal of the American Geriatrics Society. 60 (11), 2116-2120 (2012).
- Nasreddine, Z. S., et al. The Montreal Cognitive Assessment, MoCA: A Brief Screening Tool For Mild Cognitive Impairment. Journal of the American Geriatrics Society. 53 (4), 695-699 (2005).
- Kaya, D., et al. The Saint Louis University Mental Status Examination Is Better than the Mini-Mental State Examination to Determine the Cognitive Impairment in Turkish Elderly People. Journal of the American Medical Directors Association. 17 (4), e11-e15 (2016).
- O'Caoimh, R., et al. Comparison of the quick mild cognitive impairment (Qmci) screen and the SMMSE in screening for mild cognitive impairment. Age and Ageing. 41 (5), 624-629 (2012).
- Cullen, B., ONeill, B., Evans, J. J., Coen, R. F., Lawlor, B. A. A review of screening tests for cognitive impairment. Journal of Neurology, Neurosurgery & Psychiatry. 78 (8), 790-799 (2007).
- Martínez de la Iglesia, J., et al. Adaptación y validación al castellano del cuestionario de Pfeiffer (SPMSQ) para detectar la existencia de deterioro cognitivo en personas mayores e 65 años. Medicina Clínica. 117 (4), 129-134 (2001).
- Blesa, R., et al. Clinical validity of the 'mini-mental state' for Spanish speaking communities. Neuropsychologia. 39 (11), 1150-1157 (2001).
- . pwr: Basic Functions for Power Analysis Available from: https://cran.r-project.org/web/packages/pwr/index.html (2018)
- . rpart: Recursive Partitioning and Regression Trees Available from: https://cran.r-project.org/web/packages/rpart (2018)
- . ATC/DDD Index Available from: https://www.whocc.no/atc_ddd_index (2018)
- Kuhn, M., Johnson, K. . Applied Predictive Modeling. 26, (2013).
- Kuhn, M. Building Predictive Models in R Using the caret Package. Journal of Statistical Software. 28 (5), 1-26 (2008).
- Climent, M. T., Pardo, J., Muñoz-Almaraz, F. J., Guerrero, M. D., Moreno, L. Decision Tree for Early Detection of Cognitive Impairment by Community Pharmacists. Frontiers in Pharmacology. 9, 1-12 (2018).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados