Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Ein machine Learning-Ansatz zur Entwicklung eines effizienten selektiven Screenings leichter kognitiver Beeinträchtigungen
In diesem Artikel
Zusammenfassung
Diese Methode produziert Entscheidungsbäume, die auf Bevölkerungsgruppen abzielen, die anfälliger für leichte kognitive Beeinträchtigungen sind und für ein kostengünstiges selektives Screening der Krankheit nützlich sind.
Zusammenfassung
Leichte kognitive Beeinträchtigung (MCI) ist das erste Anzeichen von Demenz bei älteren Bevölkerungsgruppen und seine Früherkennung ist entscheidend in unserer alternden Gesellschaft. Gemeinsame MCI-Tests sind zeitaufwändig, so dass ein wahlloses massives Screening nicht kosteneffektiv wäre. Hier beschreiben wir ein Protokoll, das Machine Learning-Techniken verwendet, um schnell Kandidaten für das weitere Screening über einen fragebasierten MCI-Test auszuwählen. Dadurch wird die Anzahl der für das Screening erforderlichen Ressourcen minimiert, da nur Patienten, die potenziell MCI-positiv sind, weiter getestet werden.
Diese Methode wurde in einer ersten MCI-Forschungsstudie angewandt, die den Ausgangspunkt für die Gestaltung eines selektiven Screening-Entscheidungsbaums bildete. Die erste Studie sammelte viele demografische und Lebensstil-Variablen sowie Details über Patientenmedikamente. Der Short Portable Mental Status Questionnaire (SPMSQ) und das Mini-Mental State Examination (MMSE) wurden verwendet, um mögliche Fälle von MCI zu erkennen. Schließlich haben wir diese Methode verwendet, um einen effizienten Prozess zur Klassifizierung von Personen zu entwerfen, die von MCI bedroht sind. Diese Arbeit bietet auch Einblicke in Lifestyle-bezogene Faktoren im Zusammenhang mit MCI, die bei der Prävention und Früherkennung von MCI bei älteren Bevölkerungsgruppen genutzt werden könnten.
Einleitung
Die Bevölkerungsalterung erhöht die Prävalenz chronischer und degenerativer Erkrankungen, insbesondere degenerativer Demenzerkrankungen, von denen bis 2050 weltweit mehr als 131 Millionen Menschen betroffen sein dürften 10501. Unter allen degenerativen Demenzerkrankungen ist die Alzheimer-Krankheit (AD) am häufigsten mit einer Gesamtprävalenz in Europa von 6,88%2. Aufgrund der ständig abnehmenden Unabhängigkeit von AD-Patienten sollte diese Gruppe Unterstützung erhalten, sobald AD beginnt, sich zu manifestieren. Daher ist die Früherkennung von prodromalen Anzeichen von AD, wie leichte kognitive Beeinträchtigung (MCI), wichtig.
MCI ist definiert als ein mittleres kognitives Abnahmestadium, das dem normalen Altern und einer schweren Verschlechterung durch Demenz entspricht3. Nach Schätzungen von Petersen et al.4beträgt die Prävalenz von MCI 8,4 % bei den 65- bis 69-Jährigen und bei den über 80-Jährigen 25,2 %. MCI führt dazu, dass Personen mehr Schwierigkeiten haben als erwartet bei der Ausführung von kognitiven Fähigkeiten auf niedrigem Niveau, insbesondere solche, die mit Gedächtnis und Sprache zusammenhängen, aber nicht mit den Aktivitäten des täglichen Lebens stören.
Screening ist nicht gleichbedeutend mit Diagnose; die Diagnose von MCI wird immer eine klinische Aufgabe sein, während Screening-Methoden uns nur darüber informieren können, dass ein Patient eine höhere Wahrscheinlichkeit hat, an dieser Pathologie zu leiden, und dass es einen begründeten Verdacht auf MCI gibt, der klinisch bestätigt werden sollte. Daher könnten medizinische Sicherheitskräfte (Ärzte, Apotheker, Krankenschwestern usw.) von der Verfügbarkeit einfacher Screening-Methoden (kurze kognitive Tests) profitieren, die in wenigen Minuten angewendet werden können. Im Idealfall würden diese Patienten mit hoher Wahrscheinlichkeit, an einem MCI zu leiden, objektiv identifizieren, so dass sie dann von Allgemein- oder Fachärzten klinisch getestet werden können.
Da die Früherkennung von MCI zu einer wesentlichen Aufgabe im Kontext der öffentlichen Gesundheit wird, zielte diese Arbeit darauf ab, herauszufinden, welche Merkmale bei der gezielten Identifizierung von MCI bei Screening-Tests älterer Bevölkerungsgruppen nützlich sind. Diese Gruppen würden dann gründlicher auf MCI in Tests getestet, die von primären Gesundheitsdienstleistern durchgeführt werden. Diese Methode stellt eine Entscheidungsstruktur mit den geeigneten Algorithmen zum Identifizieren der Zielgruppen bereit, auf die abzielen soll.
Unter diesen Merkmalen ist das Alter einer der konsequentesten Faktoren, die mit der Entwicklung dieser Pathologie verbunden sind. Andere relevante Merkmale beziehen sich auf demographische n. Chr. oder Lebensstil5. Unter den letzteren, einige Studien haben die Dauer des Tages- oder Nachtschlafs als Risikofaktor identifiziert, der zur Diagnose von MCI5,6,7,8,9führen kann. Der längere Konsum von Medikamenten wie Benzodiazezepine, die von schätzungsweise 20%-25% der älteren Erwachsenen10,11, konsumiert werden, kann auch die Schlafstunden und die Entwicklung von MCI12,13beeinflussen. In der Tat, längere Behandlungen für chronische Krankheiten können wichtige Merkmale nützlich bei der Vorauswahl von Personen mit einem hohen Risiko, an MCI leiden.
Hier entwickelten wir datenbasierte Modelle, die automatische Lernalgorithmen, einen Entscheidungsbaum und ein Vorhersageinstrument verwenden, um die Effizienz der Methodik zur Erkennung von MCI zu erhöhen, indem sie diskriminieren, welche Merkmale eine wichtige Rolle in der Frühzeit spielen. Erkennung von MCI. Der hier vorgestellte Entscheidungsbaum wurde mit einer speziellen Kohorte spanischer Patienten in Gemeinschaftsapotheken erstellt. Diese Methode wäre jedoch auch bei anderen Populationen mit unterschiedlichen Merkmalen nützlich.
Diese Arbeit wurde in Zusammenarbeit mit der medizinischen Grundversorgung und spezialisierten Ärzten abgeschlossen. Gemeinschaftsapotheken waren ideal, um diesen Algorithmus zu testen, da sie patientennah sind, lange Öffnungszeiten haben und häufig besucht und konsultiert werden. Degenerative Demenz erkrankungen, die von den primären Gesundheitsdienstleistern nicht immer gut verstanden werden14. Daher wird die Beteiligung an diesem Prozess das Bewusstsein für Menschen mit MCI und Demenz schärfen.
Protokoll
Die in dieser Studie angewandte Methodik wurde zuvor5 in Arbeiten veröffentlicht, die an der Universität CEU Cardenal Herrera zusammen mit Gemeinschaftsapotheken in der Region Valencia (Spanien) durchgeführt wurden, die mit der Spanischen Gesellschaft für Familien- und Gemeinschaftsapotheke (SEFAC) verbunden sind. Diese aktuelle Studie wurde von der Forschungsethikkommission der Universidad CEU Cardenal Herrera (Zulassungs-Nr. CEI11/001) im März 2011. Alle an der Studie beteiligten Personen gaben ihre schriftliche Zustimmung zur Teilnahme gemäß der Erklärung von Helsinki.
1. Auswahl der Faktoren im Zusammenhang mit einer leichten kognitiven Beeinträchtigung
- Suche nach Begriffen im Zusammenhang mit MCI für das Screening Cochrane Systematic Reviews (z. B. kognitive Beeinträchtigung, Demenz, Risikofaktoren, etc.).
- Suche nach Begriffen, für die es Hinweise auf einen Zusammenhang mit kognitiver Verschlechterung oder Demenz in der PubMed-Datenbank veröffentlicht; Dazu gehören demografische Faktoren (Geschlecht, Alter, Bildungsniveau und wirtschaftlicher Status), soziale Faktoren (kognitive und soziale Aktivitäten), chronische Pathologien (Cholesterin, Depression, Bluthochdruck, Diabetes und Adipositas) und Lebensstilverhalten (Alkohol Konsum, Rauchgewohnheit, Ernährung, körperliche Aktivität und Schlafstunden).
- Berechnen Sie das Odds-Verhältnis für qualitative Variablen oder Cohens d-Effektgröße für quantitative Variablen15. Wählen Sie die Variablen mit größeren Effektgrößen für kognitive Verschlechterung oder Demenz für die Ausarbeitung eines Fragebogens aus.
2. Gestaltung der Fragebögen
- Entwerfen Sie einen Fragebogen, um Informationen über die ausgewählten Variablen gemäß den Richtlinien von Nardi16zu sammeln. Zum Beispiel waren die variablen in Climent et al.5 verwendet wurden demographische (Alter, Gewicht und Höhe [gemessen mit standardisierten Verfahren mit kalibrierten Waagen und Stadieniometern], Geschlecht, Bildungsniveau und Beschäftigungstyp), Lebensstil (körperliche Bewegung, Lesen, Schlafzeit über Nacht und tagsüber, Rätsel, Spiele, TV-Konsumzeit, und Tabak- und Alkoholkonsum) und chronische Pathologien (Hypertonie, Hyperlipidämie und Diabetes). Darüber hinaus erfassen Sie das Vorhandensein oder Fehlen von Depressionen, die häufig mit kognitiver Verschlechterung verbunden ist.
- Entwerfen Sie ein Pharmakotherapie-Follow-up-Blatt, um alle Medikamente zu melden, die von den Teilnehmern zum Zeitpunkt des Interviews konsumiert wurden, wie in Climent et al.5, das Daders Methode17 verwendet hat, um dieses Blatt zu entwerfen.
3. Auswahl der Tests für das MCI-Screening
- Bestimmen Sie alle Tests, die zum Screenen auf MCI verwendet werden und von medizinischen Fachkräften (z. B. Apothekern) verabreicht werden könnten. Lehnen Sie alle Tests ab, die von einem Spezialisten durchgeführt werden müssen. Einige der Tests, die diese Bedingungen erfüllen, sind der Short Portable Mental State Questionnaire (SPMSQ)18, Mini Mental State Examination (MMSE)19, Memory Impairment Screen (MIS)20, Picture Memory Impairment Screen (PMIS)21, Montreal Cognitive Assessment (MoCA)22, Saint Louis University Mental Status (SLUMS)23, und Quick Mild Cognitive Impairment (Qmci)24. Eine ausführliche Übersicht über jeden MCI-Test finden Sie in Cullen et al.25.
- Suche nach einer guten Einschätzung der Prüfempfindlichkeiten und Besonderheiten in der wissenschaftlichen Literatur.
- Schätzen Sie die Zeit, die für die Verabreichung dieser Tests an gesunde Personen erforderlich ist.
- Berücksichtigen Sie die grundlegenden Patienteneigenschaften, die für den Abschluss dieser Tests erforderlich sind. Beispielsweise kann ein Mindestbildungsniveau erforderlich sein, da viele MCI-Tests nicht für Analphabeten geeignet sind. Eine Reihe von MCI-Screening-Tests wird in der Regel angewendet, um die Empfindlichkeit zu erhöhen; Die Mindestanzahl der Tests muss jedoch schnell von Apothekern durchgeführt werden, wenn das endgültige selektive Screening für eine große Population bestimmt ist. Climent et al.5 bewerteten MCI anhand der MMSE- und SPMSQ-Tests, wobei letztere für die große Anzahl von Personen geeignet waren, die den spanischen Bürgerkrieg durchlebten und Analphabeten sind.
- Verwenden Sie eine Variante des SPMSQ von Pfeiffer18 wurde auf Spanisch validiert von Martinez de la Iglesia26. Dieser Test hat eine maximale Punktzahl von 10 und der Cut-off-Punkt für die Feststellung kognitiver Beeinträchtigung ist 3 oder mehr Fehler (4 oder mehr für Analphabeten Personen). Dieser Test dauert zwischen 8 und 10 Minuten.
- Verwenden Sie eine NORMACODERM-Version des MMSE validiert für Spanisch-Lautsprecher von Blesa27 durch Anpassung der Originalversion von Folstein19. Dieser Screening-Test hat eine maximale Punktzahl von 30 und wird entsprechend den Schuljahren und dem Alter der Patienten korrigiert. Teilnehmer, die weniger als oder gleich 24 Punkten erhalten, werden als MCI-Fälle betrachtet. Das MMSE ist ein Maß für die allgemeine kognitive Funktion und umfasst die Orientierung an Zeit und Ort, geschriebene und gesprochene Sprache, Aufmerksamkeitsspanne, Berechnung und Gedächtnis. Es wurde allen Teilnehmern dieser Studie verabreicht, da es sich um einen sehr kurzen Test handelt, der nur etwa 5 Minuten dauert.
4. Betreff-Rekrutierung
- Finden Sie Apotheker, die bereit sind, nicht institutionalisierte Personen zu rekrutieren, um die Studienbevölkerung zu bilden. Die erwähnte Studie von Climent et al.5 umfasste Personen im Alter von 65 Jahren oder mehr, die regelmäßig in die Apotheke gingen und sich bereit erklärten, an dieser Studie teilzunehmen. Auszuschließen Patienten mit Schwierigkeiten bei der Durchführung dieser Evaluierungstests (z. B. wegen Blindheit, Taubheit usw.) oder patienten bereits wegen Demenz behandelt.
- Stellen Sie den teilnehmenden Apothekern informierte Zustimmungsformulare zur Verfügung, die von jeder an der Studie teilnehmenden Person ausgefüllt werden müssen. Dieses Einwilligungsformular legt den Titel der Forschung, die Ziele des Projekts, eine verständliche Erläuterung aller Verfahren, an denen der Teilnehmer teilnehmen würde, das Fehlen spezifischer Risiken, die Vertraulichkeit aller gesammelten Daten und die jederzeit aus beliebigem Grund von der Studie zurücktreten.
- Schulung der Apotheker zur Durchführung strukturierter persönlicher Interviews für die Teilnehmer, die etwa eine halbe Stunde pro Person dauern sollten. Sammeln Sie Daten für 1 Jahr und senden Sie alle Formulare an die für den Datenschutz zuständigen Forscher in der Studie. Anschließend Nachbeobachtung mit den Patienten für 3 Monate.
- Weisen Sie die Apotheker an, einen wahrscheinlichen MCI-Fall anhand von MCI-Tests zu identifizieren. Basierend auf Climent et al.5 verwendeten wir SPMSQ-Scores von 4 oder mehr Punkten (für Analphabeten) oder 3 oder mehr Punkte für die anderen Teilnehmer und Im korrigierten MMSE-Test wurden Punkte von 24 Punkten oder weniger verwendet.
- Weisen Sie Apotheker an, MCI-Fälle an einen Facharzt (einen Neurologen) für ihre klinische Diagnose zu verweisen – der letzte Schritt in der Flusstabelle, die in dieser Forschungsstudie verwendet wird (Abbildung 1).
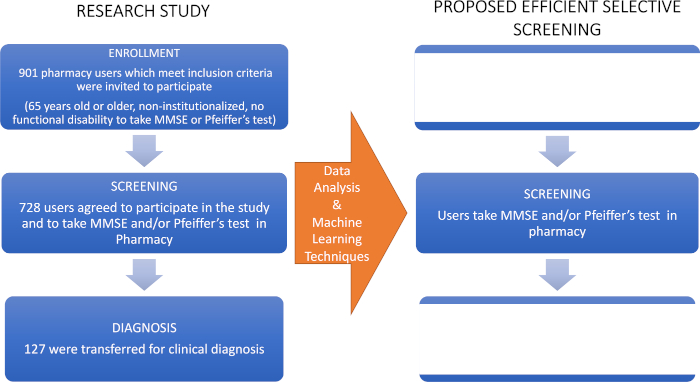
Abbildung 1: Flussdiagramm der Forschungsstudie und des vorgeschlagenen selektiven Screenings. Die linke Seite stellt die erste Studie dar, deren Daten mit maschinellen Lerntechniken analysiert wurden, um das selektive Screening zur Früherkennung von MCI vorzuschlagen, das im rechten Bereich gezeigt wird. Diese Zahl wurde von Climent34geändert. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
5. Apotheker-Forscher-Ausbildung
- Wenden Sie sich an Spezialisten, um Sitzungen zur Schulung der teilnehmenden Apotheker in Grundkenntnissen im Zusammenhang mit kognitiven Beeinträchtigungen und in der Verwaltung ihrer Screening-Tools, z. B. SPMSQ und MMSE, zu organisieren.
- Stellen Sie sicher, dass die teilnehmenden Apotheker über die Verfahren, das Datenerfassungsprotokoll und alle möglichen Fragen im Zusammenhang mit dem Datenschutz informiert sind. Informieren Sie sie, dass das Projekt von einer Forschungsethikkommission genehmigt wurde und wie wichtig das Zustimmungsformular gemäß der Erklärung von Helsinki ist.
ANMERKUNG: Um die von Climent et al.5beschriebene Studie durchzuführen, fanden Workshops an der Offiziellen Hochschule für Apotheker und der Cardenal-Herrera CEU-Universität (UCH-CEU) statt und deckten Folgendes ab: MCI und Demenz; diagnostische Ansätze für MCI und Management des SPMQP und MMSE (unterrichtet vom Neurologie-Service am La Plana Hospital in Castellon); Projektpräsentation und Erläuterung der Methodik durch leitende Apothekerforscher; Gesundheitserziehung und kognitive Ausbildung durch Forscher des Department of Pharmacy der UCH-CEU University.
6. Studiendesign
- Berechnen Sie einen Stichprobenumfang, um die Durchführbarkeit des Projekts zu bewerten. Da es sich um eine Beobachtungsstudie handelte, wird eine größere Stichprobe effektivere Werkzeuge hervorbringen. Es gibt zwei Möglichkeiten, die Stichprobengröße zu bestimmen: Eine basiert auf der Schätzung der Prävalenz, die andere ist präziser, unter Berücksichtigung der Effektgrößen.
- Berechnen Sie eine genaue Schätzung der Prävalenz des Zustandes in der Bevölkerung
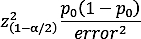
wobei das Signifikanzniveau , p0 ist die erste Schätzung und Fehler ist der maximale Fehler erwartet mit einem 100(1 - b) % Vertrauen. - Verwenden Sie gemäß den Effektgrößen, die in der Literatur für jeden Faktor zu finden sind, Werkzeuge wie das pwr-Paket in R, um zu schätzen, wie viel Leistung benötigt wird, um Unterschiede zu erkennen15,28.
HINWEIS: In unserer Studie5 haben wir beispielsweise den ersten Vorschlag mit einem Fehler von 3 % bei 95 % Vertrauen und einer ersten Schätzung der Prävalenz von MCI bei 15 % in der Bevölkerung im Alter von 65 Jahren oder älter entworfen, was zu einer geschätzten erforderlichen Stichprobengröße von 541 Personen führt.
- Berechnen Sie eine genaue Schätzung der Prävalenz des Zustandes in der Bevölkerung
7. Interdisziplinäres Kommunikationsnetz, Apotheker, medizinische Fachärzte und Spezialisten
- Entwerfen Sie Briefe, um Informationen über das Projekt an die beteiligten Gesundheitszentren zu übermitteln.
- Erklären Sie den teilnehmenden Apothekern, wie sie ihre beauftragten Ärzte über die Ergebnisse der Screenings informieren können, indem Sie einen Brief an das medizinische Zentrum für die Primärversorgung schreiben.
- Senden Sie schriftliche Mitteilungen an die medizinischen Koordinatoren der Gesundheitszentren im Zusammenhang mit den teilnehmenden Apotheken und an die Neurologiedienste der Krankenhäuser, denen sie zugeordnet sind.
- Wenden Sie sich an die teilnehmenden Neurologen, um die endgültige Diagnose jedes Patienten zu ermitteln, die durch spezifische Tests von spezialisierten Gesundheitsdienstleistern erhalten wurde. Zuvor sollten die medizinischen Versorgungsunternehmen das folgende Protokoll durchführen, wie in den klinischen Leitlinien zusammengefasst (Abbildung 2).

Abbildung 2: Protokoll für Maßnahmen im Bereich der primären Gesundheitsversorgung. Ein Beispiel für maßnahmen im Bereich der primären Gesundheitsversorgung, die für die frühe MCI-Erkennung in Betracht gezogen werden sollten, bevor der Patient von Spezialisten zur medizinischen Diagnose überwiesen wird. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
8. Statistische Analyse und Vorverarbeitung
ANMERKUNG: Vor der Anwendung maschineller Lerntechniken ist ein vorbereitender Schritt erforderlich, um die ursprünglichen Daten entsprechend dem endgültigen Studienziel und den anzuwendenden Verfahren in einen neuen Datensatz umzuwandeln. Bei dieser Transformation sollten mehrere Dinge berücksichtigt werden, einschließlich der Eigenschaften der Algorithmen. Dies liegt daran, dass einige von ihnen empfindlich auf einen Mangel an Variabilität oder den Austausch von Informationen über Spalten hinweg reagieren, obwohl die Algorithmen, die zur Generierung von Entscheidungsbäumen verwendet werden, besonders robust gegen diese Probleme sind. Diese Anfangsphase zielt darauf ab, qualitative Variablen zu kategorisieren und Werte mit genügend Fällen für jede Variable zu sammeln. Für ein effizientes Screening ist es wichtig, Variablen auszuwählen, deren Erfassung sich als einfach und genau erwiesen hat. Die Teilnehmer werden durch ein kurzes Interview ausgewählt, in dem die verwendeten Algorithmen auf ein White-Box-Modell beschränkt wurden, was es leicht macht, die Kriterien zu überprüfen, anhand derer entschieden werden soll, ob die Person den Test machen soll. Wir empfehlen, das rpart29-Paket in der R-Software für diese Algorithmen zu verwenden und rekursive Partitionierung zu implementieren.
- Sammeln Sie alle Formulare aus den teilnehmenden Apotheken und wandeln Sie sie in eine Tabelle um, in der jede Spalte eine Variable und jede teilnehmende Person eine Zeile ist.
- Weisen Sie jedem Teilnehmer eine Identifikationsnummer zu. Speichern Sie die Identifikationsnummer und die Kontaktinformationen in einem anderen Dokument, damit sie nicht vom Machine-Learning-Algorithmus verwendet werden.
- Generieren Sie Variablen, um zu klassifizieren, ob jedes Medikament, das der Patient nimmt, den zweiten oder dritten ATC30 (Anatomical Therapeutic Chemical) Levelcodes entspricht, entsprechend den Wirkstoffen auf dem Pharmakotherapie-Follow-up-Blatt.
- Führen Sie eine erste beschreibende Analyse durch.
- Wählen Sie für jede Ordinalvariable einen geeigneten Kontrast für die Variable aus. Wählen Sie bei kategorialen Variablen den als Basiswert betrachteten Wert aus.
- Berechnen Sie für kategoriale Variablen eine univariate logistische Regression mit einer Antwortvariablen für das Screening für MCI. Analysieren Sie das Ergebnis der Regression mit einer Notfalltabelle, dem p-Wert, dem Verhältnis der Stichprobenquoten und dem 95%-Konfidenzintervall des Quotenverhältnisses.
- Berechnen Sie für quantitative Variablen den Mittelwert, die Standardabweichung, den Koeffizienten der logistischen Regression und das 95%-Konfidenzintervall ihrer Koeffizienten.
- Lehnen Sie Variablen mit fehlenden (nicht verfügbaren) Werten ab, da diese Variablen schwer zu erfassen sind.
- Wählen Sie nur Variablen aus, für die es gemäß der logistischen Regressionsanalyse mindestens eine statistisch signifikante Kategorie(< 0,01) gibt. Das Ergebnis dieses Schritts führt zu einem reduzierten Datensatz im Vergleich zum ursprünglichen.
9. Algorithmen zum Erstellen eines Entscheidungsbaums
HINWEIS: Machine-Learning-Algorithmen müssen richtig parametriert werden, um vorherzusagen, welche Personen wahrscheinlich ein positives MCI-Testergebnis haben. Eines der Hauptprobleme beim Screening auf eine Bedingung besteht darin, dass die ursprünglichen Daten voraussichtlich unausgewogen sind (d. h. nur wenige positive Fälle im Vergleich zu den negativen). Um Modelle mit symmetrischen Daten zu erhalten, verwendeten wir eine Technik namens Down-Sampling oder Zufallsstichprobe, um die Frequenz mit der der niedrigsten Frequenzklasse31gleichzustellen. Ein effizientes Screening erfordert auch, die Anzahl der falschen Negative so weit wie möglich zu reduzieren (d. h. die Empfindlichkeit der Auswahl der Teilnehmer, die an MCI leiden). Eine der Techniken, die verwendet werden, um eine höhere Empfindlichkeit zu erreichen, ist die Einführung von Strafen bei der Berechnung des Gini-Verunreinigungsindex (d. h. der Index, der vom Algorithmus verwendet wird, um die beste Aufteilung für den Entscheidungsbaum auszuwählen)32.
- Generieren Sie einen Trainings- und Testdatensatz mit 80 % bzw. 20 % des gesamten Datensatzes, bzw. verwenden Sie die createDataPartition-Funktion in der Caret-Bibliothek33.
- Wenden Sie die Algorithmen an, die zum Generieren von Entscheidungsstrukturen verwendet werden, auf den Trainingsdatensatz. Verwenden Sie die Zugfunktion wieder in der Einserbibliothek33. Die folgenden Schritte sind verschiedene Parameter der Funktion; Zum Beispiel wurde der in diesem Papier verwendete Baum mit rpart29 (Methode = "rpart") erzeugt, aber es sind andere Algorithmen verfügbar.
- Wählen Sie die Probenahmemethode "Down Sampling" aus, und führen Sie den Parameter Sampling = "down" in die Einserstelle ein.
- Legen Sie die vorherigen Wahrscheinlichkeiten für beide Klassen fest.
- Stellen Sie eine Verlustmatrix mit den Unreinheiten-Indexstrafen des Gini bereit, um sich auf die zunehmende Empfindlichkeit zu konzentrieren.
- Wählen Sie für jeden Parameter im Algorithmus ein geeignetes Werteraster aus.
- Verwenden Sie eine Kreuzvalidierungsschätzung der ROC-Werte (Empfängerbetriebskurve), um die besten Modelle innerhalb des Parameterrasters auszuwählen.
- Berechnen Sie eine Verwechslungsmatrix und den Bereich unter der ROC-Kurve (AUC) für die Testsatzvorhersage, um die tatsächliche Leistung des Modells zu bewerten.
Ergebnisse
Die teilnehmenden Apotheken sammelten Daten von 728 Konsumenten und sammelten demografische Variablen zusätzlich zu den den Teilnehmern verschriebenen Medikamenten. Für alle Variablen34wurde eine univariate logistische Regression durchgeführt; Die in Abbildung 3 und Abbildung 4 dargestellten Fehlerbalkendiagramme sind praktische grafische Darstellungen des Konfidenzintervalls des Quotenverhältnisses (f...
Diskussion
Nach der Suche nach Begriffen, die mit MCI in Cochrane-Studien in der PubMed-Datenbank verbunden sind, wurde ein spezifischer Fragebogen für diese Studie erstellt, der die offensichtlichsten Variablen mit einer nachgewiesenen Assoziation mit MCI verwendete. Demographische, Lebensstil und soziale Faktoren, sowie die Pharmakotherapie des Patienten und einige relevante Pathologien wurden ebenfalls aufgezeichnet. Zusätzlich wurden die SPMSQ- und MMSE-MCI-Tests ausgewählt. Wichtig ist, dass der SPMSQ nicht vom Schulniveau ...
Offenlegungen
Die Autoren haben nichts zu verraten.
Danksagungen
Möglich wurde diese Arbeit durch die Unterstützung der Know Alzheimer Foundation und die Unterstützung des Multimedia-Produktionsdienstes an der Universidad CEU Cardenal Herrera, insbesondere Enrique Giner. Wir möchten die Arbeit aller teilnehmenden Apotheken (SEFAC) und der kooperierenden Ärzte der Gesellschaft der Primärmediziner (SEMERGEN) und der Neurology Society (SVN) würdigen, die bei den MCI-Diagnosen geholfen haben, insbesondere Vicente Gassull, Rafael Und Jordi Pérez. Abschließend danken wir allen, die sich bereit erklärt haben, an dieser Studie teilzunehmen.
Materialien
| Name | Company | Catalog Number | Comments |
| caret | Max Kuhn | R package | |
| rpart | Terry Therneau, Beth Atkinson, Brian Ripley | R package | |
| SPMSQ in Spanish | Farmaceuticoscomunitarios.org | http://farmaceuticoscomunitarios.org/anexos/vol11_n1/ANEXO1.pdf | |
| SPMSQ in English | geriatrics.stanford.edu | https://geriatrics.stanford.edu/culturemed/overview/assessment/assessment_toolkit/spmsq.html | |
| MMSE in Spanish | Farmaceuticoscomunitarios.org | http://farmaceuticoscomunitarios.org/anexos/vol11_n1/ANEXO2.pdf | |
| MMSE in English | oxfordmedicaleducation.com | http://www.oxfordmedicaleducation.com/geriatrics/mini-mental-state-examination-mmse/ |
Referenzen
- . World Alzheimer report 2016: improving healthcare for people living with dementia: coverage, quality and costs now and in the future Available from: https://scholar.google.com/scholar.bib?q=info:mEGpcpLHEIMJ:scholar.google.com (2016)
- Niu, H., Álvarez-Álvarez, I., Guillén-Grima, F., Aguinaga-Ontoso, I. Prevalence and incidence of Alzheimer's disease in Europe: A meta-analysis. Neurología (English Edition). 32 (8), 523-532 (2017).
- Petersen, R. C., et al. Mild Cognitive Impairment: Clinical Characterization and Outcome. Archives of Neurology. 56 (3), 303 (1999).
- Petersen, R. C., et al. Practice guideline update summary: Mild cognitive impairment: Report of the Guideline Development, Dissemination, and Implementation Subcommittee of the American Academy of Neurology. Neurology. 90 (3), 126-135 (2018).
- Climent, M. T., Vilaplana, A. M., Arnedo, A., Vilar, J., Moreno-Royo, L. Life styles associated cognitive impairment. Study from the community pharmacy [Estilos de vida asociados a deterioro cognitivo. Estudio preliminar desde la farmacia comunitaria]. Revista de Investigacion Clinica. 65 (6), 500-509 (2013).
- Faubel, R., et al. Usual sleep duration and cognitive function in older adults in Spain. Journal of Sleep Research. 18 (4), 427-435 (2009).
- Benito-León, J., Louis, E. D., Bermejo-Pareja, F. Cognitive decline in short and long sleepers: A prospective population-based study (NEDICES). Journal of Psychiatric Research. 47 (12), 1998-2003 (2013).
- Ramos, A. R., et al. Association between Sleep Duration and the Mini-Mental Score: The Northern Manhattan Study. Journal of Clinical Sleep Medicine. 9 (7), 669 (2013).
- Gabelle, A., et al. Excessive Sleepiness and Longer Nighttime in Bed Increase the Risk of Cognitive Decline in Frail Elderly Subjects: The MAPT-Sleep Study. Frontiers in Aging Neuroscience. 9, 312 (2017).
- Fernández, M., et al. Prevalence of dementia in the elderly aged above 65 in a district in the Basque Country. Revista de Neurologia. 46 (2), 89-96 (2008).
- Velert Vila, J., et al. Suitability of the use of benzodiazepines prescribed by the pharmacist in the elderly. A doctor-pharmacist collaboration study. Atención Primaria. 44 (7), 402-410 (2012).
- Ranstam, J., et al. Impaired cognitive function in elderly men exposed to benzodiazepines or other anziolytics. The European Journal of Public Health. 7 (2), 149-152 (1997).
- Airagnes, G., Pelissolo, A., Lavallée, M., Flament, M., Limosin, F. Benzodiazepine Misuse in the Elderly: Risk Factors, Consequences, and Management. Current Psychiatry Reports. 18 (10), 89 (2016).
- Alacreu, M., et al. Importance of Increasing Modifiable Risk Factors Knowledge on Alzheimer's Disease Among Community Pharmacists and General Practitioners in Spain. Frontiers in Pharmacology. 10, 860 (2019).
- Cohen, J. . Statistical Power Analysis for the Behavioral Sciences. , (2013).
- Nardi, P. M. . Doing Survey Research: A Guide To Quantitative Methods. , (2018).
- Sabater Hernández, D., Silva Castro, M. M., Faus Dáder, M. J. . Método Dáder: guía de seguimiento farmacoterapéutico. , (2017).
- Pfeiffer, E. A Short Portable Mental Status Questionnaire for the Assessment of Organic Brain Deficit in Elderly Patients. Journal of the American Geriatrics Society. 23 (10), 433-441 (1975).
- Folstein, M. F., Folstein, S. E., McHugh, P. R. "Mini-mental state." A practical method for grading the cognitive state of patients for the clinician. Journal of Psychiatric Research. 12 (3), 189-198 (1975).
- Buschke, H., et al. Screening for dementia with the memory impairment screen. Neurology. 52 (2), 231-238 (1999).
- Verghese, J., et al. Picture-based memory impairment screen for dementia. Journal of the American Geriatrics Society. 60 (11), 2116-2120 (2012).
- Nasreddine, Z. S., et al. The Montreal Cognitive Assessment, MoCA: A Brief Screening Tool For Mild Cognitive Impairment. Journal of the American Geriatrics Society. 53 (4), 695-699 (2005).
- Kaya, D., et al. The Saint Louis University Mental Status Examination Is Better than the Mini-Mental State Examination to Determine the Cognitive Impairment in Turkish Elderly People. Journal of the American Medical Directors Association. 17 (4), e11-e15 (2016).
- O'Caoimh, R., et al. Comparison of the quick mild cognitive impairment (Qmci) screen and the SMMSE in screening for mild cognitive impairment. Age and Ageing. 41 (5), 624-629 (2012).
- Cullen, B., ONeill, B., Evans, J. J., Coen, R. F., Lawlor, B. A. A review of screening tests for cognitive impairment. Journal of Neurology, Neurosurgery & Psychiatry. 78 (8), 790-799 (2007).
- Martínez de la Iglesia, J., et al. Adaptación y validación al castellano del cuestionario de Pfeiffer (SPMSQ) para detectar la existencia de deterioro cognitivo en personas mayores e 65 años. Medicina Clínica. 117 (4), 129-134 (2001).
- Blesa, R., et al. Clinical validity of the 'mini-mental state' for Spanish speaking communities. Neuropsychologia. 39 (11), 1150-1157 (2001).
- . pwr: Basic Functions for Power Analysis Available from: https://cran.r-project.org/web/packages/pwr/index.html (2018)
- . rpart: Recursive Partitioning and Regression Trees Available from: https://cran.r-project.org/web/packages/rpart (2018)
- . ATC/DDD Index Available from: https://www.whocc.no/atc_ddd_index (2018)
- Kuhn, M., Johnson, K. . Applied Predictive Modeling. 26, (2013).
- Kuhn, M. Building Predictive Models in R Using the caret Package. Journal of Statistical Software. 28 (5), 1-26 (2008).
- Climent, M. T., Pardo, J., Muñoz-Almaraz, F. J., Guerrero, M. D., Moreno, L. Decision Tree for Early Detection of Cognitive Impairment by Community Pharmacists. Frontiers in Pharmacology. 9, 1-12 (2018).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten