Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Une approche d'apprentissage automatique pour concevoir un dépistage sélectif efficace de l'affaiblissement cognitif léger
Dans cet article
Résumé
Cette méthodologie produit des arbres de décision qui ciblent les groupes de population plus enclins à souffrir d'une déficience cognitive légère et sont utiles pour le dépistage sélectif rentable de la maladie.
Résumé
L'affaiblissement cognitif doux (MCI) est le premier signe de démence parmi des populations âgées et son détection tôt est crucial dans nos sociétés vieillissantes. Les tests mcI courants prennent beaucoup de temps, de sorte que le dépistage massif sans discrimination ne serait pas rentable. Ici, nous décrivons un protocole qui utilise des techniques d'apprentissage automatique pour sélectionner rapidement les candidats pour une présélection ultérieure par le biais d'un test MCI basé sur les questions. Cela minimise le nombre de ressources nécessaires pour le dépistage, car seuls les patients potentiellement positifs à l'ICM sont testés davantage.
Cette méthodologie a été appliquée dans une étude de recherche initiale MCI qui a formé le point de départ pour la conception d'un arbre de décision de dépistage sélectif. L'étude initiale a recueilli de nombreuses variables démographiques et de style de vie ainsi que des détails sur les médicaments pour les patients. Le Questionnaire sur l'état mental portatif court (SPMSQ) et le Mini-Mental State Examination (MMSE) ont été utilisés pour détecter d'éventuels cas d'ICM. Enfin, nous avons utilisé cette méthode pour concevoir un processus efficace pour classer les personnes à risque de MCI. Ce travail fournit également un aperçu des facteurs liés au mode de vie associés à l'ICM qui pourraient être mis à profit dans la prévention et la détection précoce de l'ICM chez les populations âgées.
Introduction
Le vieillissement de la population augmente la prévalence des maladies chroniques et dégénératives, en particulier les démences dégénératives, qui devraient toucher plus de 131 millions de personnes dans le monde d'ici 20501. Parmi toutes les démences dégénératives, la maladie d'Alzheimer (MA) est la plus fréquente avec une prévalence globale en Europe de 6,88 %2. En raison de l'indépendance toujours en déclin des patients atteints de la MA, ce groupe devrait commencer à recevoir du soutien dès que la MA commence à se manifester. Par conséquent, la détection tôt des signes prodromiques de l'AI, tels que l'affaiblissement cognitif doux (MCI), est essentielle.
MCI est défini comme un stade de déclin cognitif intermédiaire correspondant au vieillissement normal et à la détérioration grave due à la démence3. Selon les estimations de Petersen et coll.4, la prévalence de l'ICM est de 8,4 % chez les personnes âgées de 65 à 69 ans et atteint 25,2 % chez les personnes âgées de plus de 80 ans. L'ICM entraîne des difficultés plus grandes que prévu dans l'exécution des compétences cognitives de bas niveau, en particulier celles liées à la mémoire et au langage, mais n'interfère pas avec les activités de la vie quotidienne.
Le dépistage n'est pas synonyme de diagnostic; le diagnostic de MCI sera toujours une tâche clinique tandis que les méthodes de criblage peuvent seulement nous informer qu'un patient a une plus grande probabilité de souffrir de cette pathologie et qu'il y a un soupçon fondé de MCI qui devrait être confirmé médicalement. Ainsi, les travailleurs de la santé primaire (médecins, pharmaciens, infirmières, etc.) pourraient bénéficier de la disponibilité de méthodes de dépistage simples (tests cognitifs brefs) qui peuvent être appliquées en quelques minutes. Idéalement, ceux-ci identifieraient objectivement les patients présentant une forte probabilité de souffrir d'un MCI de sorte qu'ils puissent alors être médicalement examinés par des médecins généraux ou spécialisés.
Étant donné que la détection précoce de l'ICM devient une tâche essentielle dans le contexte de la santé publique, ce travail visait à identifier les caractéristiques qui sont utiles dans l'identification ciblée de l'ICM dans les tests de dépistage des populations âgées. Ces groupes seraient ensuite testés plus minutieusement pour l'ICM dans les tests administrés par les fournisseurs de soins de santé primaires. Cette méthodologie fournit à un arbre de décision les algorithmes appropriés pour identifier les groupes de population à cibler.
Parmi ces caractéristiques, l'âge est l'un des facteurs les plus constants associés au développement de cette pathologie. D'autres caractéristiques pertinentes sont liées à la démographie ou au mode de vie5. Parmi ces derniers, certaines études ont identifié la durée du sommeil diurne ou nocturne comme un facteur de risque qui peut conduire au diagnostic de MCI5,6,7,8,9. La consommation prolongée de médicaments tels que les benzodiazépines, consommées par environ 20%-25% des personnes âgées10,11, peut également influencer les heures de sommeil et le développement de MCI12,13. En effet, les traitements prolongés pour les maladies chroniques peuvent être des caractéristiques importantes utiles dans la présélection des personnes présentant un risque élevé de souffrir de MCI.
Ici, nous avons développé des modèles basés sur des données qui utilisent des algorithmes d'apprentissage automatique, un arbre de décision et un outil prédictif pour augmenter l'efficacité de la méthodologie de détection de l'ICM en discriminant les caractéristiques qui jouent un rôle important au début détection de MCI. L'arbre de décision qui en a résulté présenté ici a été produit à l'aide d'une cohorte spécifique de patients espagnols utilisant des pharmacies communautaires. Cependant, cette méthode serait également utile parmi d'autres populations ayant des caractéristiques différentes.
Ce travail a été réalisé en collaboration avec des médecins de première santé et des médecins spécialisés. Les pharmacies communautaires étaient idéales pour tester cet algorithme parce qu'elles sont proches des patients, ont de longues heures d'ouverture et sont fréquemment visitées et consultées. Les démences dégénératives sont des affections complexes qui ne sont pas toujours bien comprises par les fournisseurs de soins de santé primaires14. Par conséquent, s'impliquer dans le processus permettra de sensibiliser les gens souffrant de MCI et les démences.
Protocole
La méthodologie appliquée dans cette étude a déjà été publiée5 dans les travaux effectués à l'Université CEU Cardenal Herrera avec les pharmacies communautaires de la région de Valence (Espagne) associés à la Société espagnole de pharmacie familiale et communautaire (SEFAC). Cette étude en cours a été examinée et approuvée par le Comité d'éthique de la recherche de l'Universidad CEU Cardenal Herrera (approbation no. CEI11/001) en mars 2011. Toutes les personnes impliquées dans l'étude ont donné leur consentement écrit éclairé à la participation conformément à la Déclaration d'Helsinki.
1. Sélection des facteurs associés à une déficience cognitive légère
- Rechercher les termes liés à l'ICM pour l'utilisation dans le dépistage Cochrane Systematic Reviews (p. ex., déficience cognitive, démence, facteurs de risque, etc.).
- Rechercher des termes pour lesquels il existe des preuves d'une relation avec la détérioration cognitive ou la démence publié dans la base de données PubMed; il s'agit notamment des facteurs démographiques (sexe, âge, niveau d'éducation et situation économique), des facteurs sociaux (activités cognitives et sociales), des pathologies chroniques (cholestérol, dépression, hypertension, diabète et obésité) et des comportements liés au mode de vie (alcool consommation, habitude de fumer, alimentation, activité physique et heures de sommeil).
- Calculer le rapport de cotes pour les variables qualitatives ou la taille de l'effet de Cohen pour les variables quantitatives15. Sélectionnez les variables avec des tailles d'effet plus grandes pour la détérioration cognitive ou la démence pour l'élaboration d'un questionnaire.
2. Conception des questionnaires
- Concevoir un questionnaire pour recueillir des informations sur les variables sélectionnées, selon les directives fournies par Nardi16. Par exemple, les variables utilisées dans Climent et coll.5 étaient démographiques (âge, poids et taille [mesurées avec des procédures normalisées à l'aide d'échelles et de stadiomètres calibrés], sexe, niveau d'éducation et type d'emploi), mode de vie (exercice physique, lecture, temps passé à dormir pendant la nuit et pendant la journée, puzzles, jeux, temps de consommation de télévision, et consommation de tabac et d'alcool), et pathologies chroniques (hypertension, hyperlipidémie et diabète). En outre, enregistrez la présence ou l'absence de dépression, qui est fréquemment associée à la détérioration cognitive.
- Concevoir une fiche de suivi de pharmacothérapie pour signaler tous les médicaments consommés par les participants au moment de l'entrevue, comme dans Climent et al.5, qui a utilisé la méthode17 de Dader pour concevoir cette feuille.
3. Sélection des tests pour le dépistage MCI
- Déterminer tous les tests utilisés pour dépister l'ICM qui pourraient être administrés par les travailleurs de la santé primaire (p. ex., les pharmaciens). Rejetez tous les tests qui doivent être administrés par un spécialiste. Certains des tests qui remplissent ces conditions sont le Court Portable Mental State Questionnaire (SPMSQ)18, Mini Mental State Examination (MMSE)19, Memory Impairment Screen (MIS)20, Picture Memory Impairment Screen (PMIS)21, Montreal Cognitive Assessment (MoCA)22, Saint Louis University Mental Status (SLUMS)23, et Quick Mild Cognitive Impairment (Qmci)24. Un examen exhaustif de chaque test MCI est disponible dans Cullen et al.25.
- Rechercher une bonne estimation des sensibilités et spécificités des tests dans la littérature scientifique.
- Estimer le temps nécessaire pour administrer ces tests à des personnes en bonne santé.
- Considérez les caractéristiques de base du patient requises pour l'achèvement de ces tests. Par exemple, un niveau d'éducation minimum peut être nécessaire parce que de nombreux tests MCI ne conviennent pas aux participants analphabètes. Un ensemble de tests de dépistage MCI est habituellement appliqué pour augmenter la sensibilité; toutefois, le nombre minimum de tests doit être rapidement administré par les pharmaciens si le dépistage sélectif final est destiné à une grande population. Climent et coll.5 ont évalué l'ICM à l'aide des tests MMSE et SPMSQ, ces derniers étant adaptés au grand nombre de personnes qui ont vécu la guerre civile espagnole et qui sont analphabètes.
- L'utilisation d'une variante du SPMSQ par Pfeiffer18 a été validée en espagnol par Martinez de la Iglesia26. Ce test a un score maximum de 10 et le point de coupure pour établir l'affaiblissement cognitif est 3 erreurs ou plus (4 ou plus pour les individus analphabètes). Ce test prend entre 8 et 10 minutes.
- Utilisez une version NORMACODERM du MMSE validée pour les hispanophones par Blesa27 en adaptant la version originale de Folstein19. Ce test de dépistage a un score maximum de 30 et est corrigé en fonction des années de scolarité et de l'âge des patients. Les participants qui obtiennent un score inférieur ou égal à 24 sont considérés comme des cas d'ICM. Le MMSE est une mesure de la fonction cognitive générale et comprend l'orientation vers le temps et le lieu, le langage écrit et parlé, la durée d'attention, le calcul et la mémoire. Il a été administré à tous les participants à cette étude parce qu'il s'agit d'un test très court qui ne prend qu'environ 5 minutes.
4. Recrutement de sujets
- Trouver des pharmaciens prêts à recruter des personnes non institutionnalisées pour former la population étudiée. L'étude mentionnée par Climent et coll.5 portait sur des personnes âgées de 65 ans ou plus qui se rendaient régulièrement à la pharmacie et qui acceptaient de participer à cette étude. Exclure les patients ayant des difficultés à effectuer ces tests d'évaluation (p. ex., en raison de la cécité, de la surdité, etc.) ou qui étaient déjà traités pour la démence.
- Fournir aux pharmaciens participants des formulaires de consentement éclairé, qui doivent être remplis par chaque personne participant à l'étude. Ce formulaire de consentement précise le titre de la recherche, les objectifs du projet, une explication compréhensible de toutes les procédures auxquelles le participant participerait, l'absence de risques spécifiques, la confidentialité de toutes les données collectées et le droit de se retirer de l'étude pour quelque raison que ce soit.
- Former les pharmaciens à administrer des entrevues personnelles structurées aux participants, qui devraient durer environ une demi-heure par personne. Recueillir des données pendant 1 an et envoyer tous les formulaires aux chercheurs responsables de la protection des données dans l'étude. Suivi par la suite avec les patients pendant 3 mois.
- Instruire les pharmaciens sur la façon d'identifier un cas probable d'ICM à l'aide de tests MCI. Sur la base de Climent et coll.5, nous avons utilisé des scores SPMSQ de 4 points ou plus (pour les participants analphabètes) ou 3 points ou plus pour les autres participants et des scores de 24 points ou moins ont été utilisés dans le test MMSE corrigé.
- Instruire les pharmaciens sur la façon de diriger les cas d'ICM à un médecin spécialiste (un neurologue) pour leur diagnostic clinique - la dernière étape du diagramme de débit utilisé dans cette étude de recherche (figure 1).
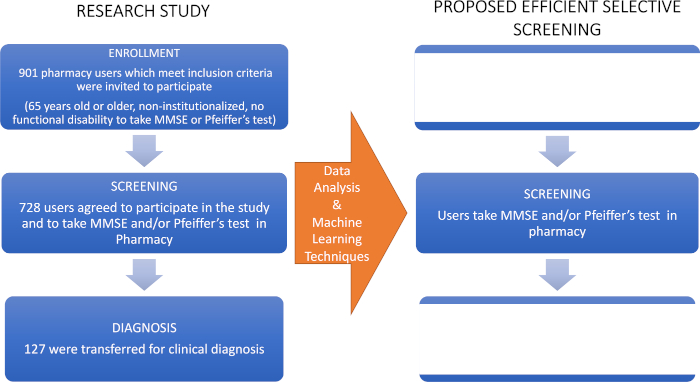
Figure 1 : Diagramme de flux de l'étude de recherche et du dépistage sélectif proposé. Le côté gauche représente l'étude initiale dont les données ont été analysées avec des techniques d'apprentissage automatique pour proposer le criblage sélectif pour la détection précoce de MCI montré dans le panneau droit. Ce chiffre a été modifié à partir de Climent34. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
5. Formation des chercheurs pharmaciens
- Communiquez avec des spécialistes pour organiser des séances de formation des pharmaciens participants aux connaissances de base liées aux déficiences cognitives et à la gestion de ses outils de dépistage, par exemple le SPMSQ et le MMSE.
- Assurez-vous que les pharmaciens participants sont au courant des procédures, du protocole de collecte de données et de toutes les questions possibles liées à la protection des données. Informez-les que le projet a été approuvé par un comité d'éthique de la recherche et de l'importance du formulaire de consentement conformément à la Déclaration d'Helsinki.
REMARQUE : Pour réaliser l'étude décrite par Climent et coll.5, des ateliers ont eu lieu à l'Ordre officiel des pharmaciens et à l'Université Cardenal-Herrera CEU (UCH-CEU), et ont couvert les éléments suivants : MCI et démence; approches diagnostiques de l'ICM et de la gestion du SPMQP et du MMSE (enseignés par le Service de neurologie de l'hôpital La Plana à Castellon); présentation du projet et explication de la méthodologie par les chercheurs principaux des pharmaciens communautaires; et l'éducation à la santé et la formation cognitive par des chercheurs du Département de pharmacie de l'Université UCH-CEU.
6. Conception d'étude
- Calculer la taille d'un échantillon pour évaluer la faisabilité du projet. Comme il s'agissait d'une étude observationnelle, un échantillon plus important produira des outils plus efficaces. Il y a deux façons de déterminer la taille de l'échantillon : l'une est basée sur l'estimation de la prévalence et l'autre est plus précise, en tenant compte de la taille des effets.
- Calculer une estimation précise de la prévalence de la maladie dans la population
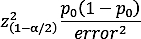
où est le niveau d'importance, p0 est l'estimation initiale et l'erreur est l'erreur maximale attendue avec une confiance de 100(1 - ) %. - Selon les tailles d'effet trouvées dans la littérature pour chaque facteur, utilisez des outils comme le paquet de pwr dans R pour estimer combien de puissance est nécessaire pour détecter les différences15,28.
REMARQUE : Par exemple, dans notre étude5, nous avons conçu la première proposition avec une erreur de 3 % à 95 % de confiance et une estimation initiale de la prévalence de l'ICM à 15 % de la population âgée de 65 ans ou plus, ce qui a donné lieu à une estimation de la taille de l'échantillon requis de 541 personnes.
- Calculer une estimation précise de la prévalence de la maladie dans la population
7. Réseau de communication interdisciplinaire, pharmaciens, médecins de soins primaires et spécialistes
- Concevoir des lettres pour communiquer des informations sur le projet aux centres de santé concernés.
- Expliquez aux pharmaciens participants comment informer les médecins qui leur ont été assignés des résultats des dépistages par le biais d'une lettre adressée au centre de soins primaires.
- Envoyer des communications écrites aux coordonnateurs médicaux des centres de santé liés aux pharmacies participantes et aux services de neurologie des hôpitaux auxquels ils sont affectés.
- Communiquez avec les neurologues participants pour connaître le diagnostic définitif de chaque patient obtenu au moyen de tests spécifiques effectués par des fournisseurs de soins de santé spécialisés. Avant cela, les fournisseurs de soins de santé primaires devraient exécuter le protocole suivant, tel que résumé par les lignes directrices cliniques (figure 2).

Figure 2 : Protocole d'action en soins de santé primaires. Un exemple d'actions de soins de santé primaires qui devraient être considérées pour la détection tôt de MCI avant que le patient soit référé pour un diagnostic médical par des spécialistes. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
8. Analyse statistique et prétraitement
REMARQUE : Avant d'appliquer des techniques d'apprentissage automatique, une étape préparatoire est nécessaire pour transformer les données originales en un nouvel ensemble de données en fonction de l'objectif final de l'étude et des procédures à appliquer. Pour cette transformation, plusieurs choses doivent être envisagées, y compris les caractéristiques des algorithmes. C'est parce que certains d'entre eux sont sensibles à un manque de variabilité ou de partage d'informations entre les colonnes, bien que les algorithmes utilisés pour générer des arbres de décision sont particulièrement robustes contre ces problèmes. Cette phase initiale vise à catégoriser les variables qualitatives et à recueillir des valeurs avec suffisamment de cas pour chaque variable. Pour un dépistage efficace, il est important de choisir des variables dont l'acquisition s'avère facile et précise. Les participants sont sélectionnés par une courte entrevue au cours de laquelle les algorithmes utilisés ont été limités à un modèle de boîte blanche, ce qui facilite la vérification des critères utilisés pour décider si l'individu doit passer le test. Nous vous suggérons d'utiliser le paquet rpart29 dans le logiciel R pour ces algorithmes, et d'implémenter le partitionnement récursif.
- Recueillir tous les formulaires des pharmacies participantes et les convertir en une table dans laquelle chaque colonne est une variable et chaque personne participante est une rangée.
- Attribuez un numéro d'identification à chaque participant. Enregistrez le numéro d'identification et les coordonnées dans un document différent afin qu'il ne soit pas utilisé par l'algorithme d'apprentissage automatique.
- Générer des variables pour classer si chaque médicament que le patient prend correspond au deuxième ou troisième ATC30 (Anatomical Therapeutic Chemical) codes de niveau, selon les principaux ingrédients actifs sur la feuille de suivi de pharmacothérapie.
- Effectuez une analyse descriptive initiale.
- Pour chaque variable ordinale, choisissez un contraste adéquat pour la variable. Pour les variables catégorielles, sélectionnez la valeur considérée comme la référence.
- Pour les variables catégorielles, calculez une régression logistique univariée avec une variable de réponse pour le dépistage de l'ICM. Analyser les résultats de la régression à l'issue d'un tableau d'urgence, le rapport p-valeur, le rapport de cotes de l'échantillon et l'intervalle de confiance de 95 % du rapport de cotes.
- Pour les variables quantitatives, calculez la moyenne, l'écart type, le coefficient de régression logistique et l'intervalle de confiance de 95 % de leurs coefficients.
- Rejeter les variables dont les valeurs manquantes (non disponibles) sont manquantes, compte tenu de ces variables difficiles à collecter avec précision.
- Sélectionnez uniquement les variables pour lesquelles il existe au moins une catégorie statistiquement significative (lt; 0,01) selon l'analyse de régression logistique. Le résultat de cette étape produit un ensemble de données réduit par rapport à l'ensemble initial.
9. Algorithmes pour créer un arbre de décision
REMARQUE : Les algorithmes d'apprentissage automatique doivent être correctement paramétrés pour prédire quelles personnes sont susceptibles d'avoir un résultat positif au test MCI. L'un des principaux problèmes lors du dépistage d'une condition est que les données originales devraient être déséquilibrées (c.-à-d. peu de cas positifs par rapport aux cas négatifs). Pour obtenir des modèles avec des données équilibrées, nous avons utilisé une technique appelée down-sampling, ou échantillonnage aléatoire, pour égaliser la fréquence avec celle de la classe de fréquence la plus basse31. Un dépistage efficace exige également de réduire autant que possible le nombre de faux négatifs (c.-à-d. accroître la sensibilité de la sélection des participants souffrant d'ICM). Une des techniques utilisées pour atteindre une plus grande sensibilité est l'introduction de pénalités dans le calcul de l'indice d'impureté de Gini (c.-à-d., l'index utilisé par l'algorithme pour sélectionner la meilleure fente pour l'arbre de décision)32.
- Générer un ensemble de données de formation et de test avec 80% et 20% de l'ensemble de données, respectivement en utilisant la fonction createDataPartition dans la bibliothèque de caret33.
- Appliquer les algorithmes utilisés pour générer des arbres de décision à l'ensemble de données de formation. Utilisez à nouveau la fonction de train dans la bibliothèque de caret33. Les étapes suivantes sont des paramètres différents de la fonction; par exemple, l'arbre utilisé dans ce document a été généré avec rpart29 (méthode - "rpart"), mais d'autres algorithmes sont disponibles.
- Sélectionnez la méthode d'échantillonnage vers le bas et introduisez le paramètre d'échantillonnage « vers le bas » dans le caret.
- Définir les probabilités antérieures pour les deux catégories.
- Fournir une matrice de perte avec les pénalités de l'indice d'impureté du Gini appliquées afin de se concentrer sur la sensibilité croissante.
- Pour chaque paramètre de l'algorithme, choisissez une grille de valeurs appropriée.
- Utilisez une estimation de validation croisée des valeurs de la courbe d'exploitation du récepteur (ROC) pour sélectionner les meilleurs modèles dans la grille de paramètres.
- Calculer une matrice de confusion et la zone sous la courbe ROC (AUC) pour la prévision de l'ensemble de test afin d'évaluer la performance réelle du modèle.
Résultats
Les pharmacies participantes ont recueilli des données auprès de 728 utilisateurs et recueilli des variables démographiques en plus des médicaments prescrits aux participants. Une régression logistique univariée a été effectuée pour toutes les variables34; les graphiques à barres d'erreur indiqués à la figure 3 et à la figure 4 sont des représentations graphiques pratiques de l'intervalle de ...
Discussion
Après avoir cherché des termes associés à L'ICM dans les études Cochrane dans la base de données PubMed, un questionnaire spécifique a été créé pour cette étude qui a utilisé les variables les plus évidentes avec une association prouvée avec MCI. Des facteurs démographiques, de mode de vie et sociaux, ainsi que la pharmacothérapie du patient et certaines pathologies pertinentes ont également été enregistrés. De plus, les tests MCI SPMSQ et MMSE ont également été sélectionnés. Fait important, le ...
Déclarations de divulgation
Les auteurs n'ont rien à révéler.
Remerciements
Ce travail a été rendu possible grâce au soutien de la Fondation Know Alzheimer et à l'aide du service de production multimédia de l'Universidad CEU Cardenal Herrera, en particulier Enrique Giner. Nous tenons à souligner le travail de toutes les pharmacies participantes (SEFAC), et les médecins collaborateurs de la Société des médecins de soins primaires (SEMERGEN) et la Société de neurologie (SVN) qui ont aidé avec les diagnostics MCI, en particulier Vicente Gassull, Rafael et Jordi Pérez. Enfin, nous remercions tous ceux qui ont accepté de participer à cette étude.
matériels
| Name | Company | Catalog Number | Comments |
| caret | Max Kuhn | R package | |
| rpart | Terry Therneau, Beth Atkinson, Brian Ripley | R package | |
| SPMSQ in Spanish | Farmaceuticoscomunitarios.org | http://farmaceuticoscomunitarios.org/anexos/vol11_n1/ANEXO1.pdf | |
| SPMSQ in English | geriatrics.stanford.edu | https://geriatrics.stanford.edu/culturemed/overview/assessment/assessment_toolkit/spmsq.html | |
| MMSE in Spanish | Farmaceuticoscomunitarios.org | http://farmaceuticoscomunitarios.org/anexos/vol11_n1/ANEXO2.pdf | |
| MMSE in English | oxfordmedicaleducation.com | http://www.oxfordmedicaleducation.com/geriatrics/mini-mental-state-examination-mmse/ |
Références
- . World Alzheimer report 2016: improving healthcare for people living with dementia: coverage, quality and costs now and in the future Available from: https://scholar.google.com/scholar.bib?q=info:mEGpcpLHEIMJ:scholar.google.com (2016)
- Niu, H., Álvarez-Álvarez, I., Guillén-Grima, F., Aguinaga-Ontoso, I. Prevalence and incidence of Alzheimer's disease in Europe: A meta-analysis. Neurología (English Edition). 32 (8), 523-532 (2017).
- Petersen, R. C., et al. Mild Cognitive Impairment: Clinical Characterization and Outcome. Archives of Neurology. 56 (3), 303 (1999).
- Petersen, R. C., et al. Practice guideline update summary: Mild cognitive impairment: Report of the Guideline Development, Dissemination, and Implementation Subcommittee of the American Academy of Neurology. Neurology. 90 (3), 126-135 (2018).
- Climent, M. T., Vilaplana, A. M., Arnedo, A., Vilar, J., Moreno-Royo, L. Life styles associated cognitive impairment. Study from the community pharmacy [Estilos de vida asociados a deterioro cognitivo. Estudio preliminar desde la farmacia comunitaria]. Revista de Investigacion Clinica. 65 (6), 500-509 (2013).
- Faubel, R., et al. Usual sleep duration and cognitive function in older adults in Spain. Journal of Sleep Research. 18 (4), 427-435 (2009).
- Benito-León, J., Louis, E. D., Bermejo-Pareja, F. Cognitive decline in short and long sleepers: A prospective population-based study (NEDICES). Journal of Psychiatric Research. 47 (12), 1998-2003 (2013).
- Ramos, A. R., et al. Association between Sleep Duration and the Mini-Mental Score: The Northern Manhattan Study. Journal of Clinical Sleep Medicine. 9 (7), 669 (2013).
- Gabelle, A., et al. Excessive Sleepiness and Longer Nighttime in Bed Increase the Risk of Cognitive Decline in Frail Elderly Subjects: The MAPT-Sleep Study. Frontiers in Aging Neuroscience. 9, 312 (2017).
- Fernández, M., et al. Prevalence of dementia in the elderly aged above 65 in a district in the Basque Country. Revista de Neurologia. 46 (2), 89-96 (2008).
- Velert Vila, J., et al. Suitability of the use of benzodiazepines prescribed by the pharmacist in the elderly. A doctor-pharmacist collaboration study. Atención Primaria. 44 (7), 402-410 (2012).
- Ranstam, J., et al. Impaired cognitive function in elderly men exposed to benzodiazepines or other anziolytics. The European Journal of Public Health. 7 (2), 149-152 (1997).
- Airagnes, G., Pelissolo, A., Lavallée, M., Flament, M., Limosin, F. Benzodiazepine Misuse in the Elderly: Risk Factors, Consequences, and Management. Current Psychiatry Reports. 18 (10), 89 (2016).
- Alacreu, M., et al. Importance of Increasing Modifiable Risk Factors Knowledge on Alzheimer's Disease Among Community Pharmacists and General Practitioners in Spain. Frontiers in Pharmacology. 10, 860 (2019).
- Cohen, J. . Statistical Power Analysis for the Behavioral Sciences. , (2013).
- Nardi, P. M. . Doing Survey Research: A Guide To Quantitative Methods. , (2018).
- Sabater Hernández, D., Silva Castro, M. M., Faus Dáder, M. J. . Método Dáder: guía de seguimiento farmacoterapéutico. , (2017).
- Pfeiffer, E. A Short Portable Mental Status Questionnaire for the Assessment of Organic Brain Deficit in Elderly Patients. Journal of the American Geriatrics Society. 23 (10), 433-441 (1975).
- Folstein, M. F., Folstein, S. E., McHugh, P. R. "Mini-mental state." A practical method for grading the cognitive state of patients for the clinician. Journal of Psychiatric Research. 12 (3), 189-198 (1975).
- Buschke, H., et al. Screening for dementia with the memory impairment screen. Neurology. 52 (2), 231-238 (1999).
- Verghese, J., et al. Picture-based memory impairment screen for dementia. Journal of the American Geriatrics Society. 60 (11), 2116-2120 (2012).
- Nasreddine, Z. S., et al. The Montreal Cognitive Assessment, MoCA: A Brief Screening Tool For Mild Cognitive Impairment. Journal of the American Geriatrics Society. 53 (4), 695-699 (2005).
- Kaya, D., et al. The Saint Louis University Mental Status Examination Is Better than the Mini-Mental State Examination to Determine the Cognitive Impairment in Turkish Elderly People. Journal of the American Medical Directors Association. 17 (4), e11-e15 (2016).
- O'Caoimh, R., et al. Comparison of the quick mild cognitive impairment (Qmci) screen and the SMMSE in screening for mild cognitive impairment. Age and Ageing. 41 (5), 624-629 (2012).
- Cullen, B., ONeill, B., Evans, J. J., Coen, R. F., Lawlor, B. A. A review of screening tests for cognitive impairment. Journal of Neurology, Neurosurgery & Psychiatry. 78 (8), 790-799 (2007).
- Martínez de la Iglesia, J., et al. Adaptación y validación al castellano del cuestionario de Pfeiffer (SPMSQ) para detectar la existencia de deterioro cognitivo en personas mayores e 65 años. Medicina Clínica. 117 (4), 129-134 (2001).
- Blesa, R., et al. Clinical validity of the 'mini-mental state' for Spanish speaking communities. Neuropsychologia. 39 (11), 1150-1157 (2001).
- . pwr: Basic Functions for Power Analysis Available from: https://cran.r-project.org/web/packages/pwr/index.html (2018)
- . rpart: Recursive Partitioning and Regression Trees Available from: https://cran.r-project.org/web/packages/rpart (2018)
- . ATC/DDD Index Available from: https://www.whocc.no/atc_ddd_index (2018)
- Kuhn, M., Johnson, K. . Applied Predictive Modeling. 26, (2013).
- Kuhn, M. Building Predictive Models in R Using the caret Package. Journal of Statistical Software. 28 (5), 1-26 (2008).
- Climent, M. T., Pardo, J., Muñoz-Almaraz, F. J., Guerrero, M. D., Moreno, L. Decision Tree for Early Detection of Cognitive Impairment by Community Pharmacists. Frontiers in Pharmacology. 9, 1-12 (2018).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon