È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Un approccio di Machine Learning alla progettazione di uno screening selettivo efficiente di un lieve danno cognitivo
In questo articolo
Riepilogo
Questa metodologia produce alberi delle decisioni che prendono di mira gruppi di popolazione più inclini a soffrire di lievi disturbi cognitivi e sono utili per uno screening selettivo della malattia conveniente.
Abstract
Il lieve danno cognitivo (MCI) è il primo segno di demenza tra le popolazioni anziane e la sua diagnosi precoce è cruciale nelle nostre società di invecchiamento. I test comuni dell'MCI richiedono molto tempo tale che uno screening massiccio indiscriminato non sarebbe conveniente. In questo articolo viene descritto un protocollo che utilizza tecniche di apprendimento automatico per selezionare rapidamente i candidati per un ulteriore screening tramite un test MCI basato su domande. Questo riduce al minimo il numero di risorse necessarie per lo screening perché solo i pazienti che sono potenzialmente MCI positivi sono ulteriormente testati.
Questa metodologia è stata applicata in uno studio di ricerca iniziale sulla MCI che ha costituito il punto di partenza per la progettazione di un albero decisionale di screening selettivo. Lo studio iniziale ha raccolto molte variabili demografiche e di stile di vita, nonché dettagli sui farmaci per i pazienti. Il Short Portable Mental Status Questionnaire (SPMSQ) e il Mini-Mental State Examination (MMSE) sono stati utilizzati per rilevare possibili casi di MCI. Infine, abbiamo utilizzato questo metodo per progettare un processo efficiente per classificare gli individui a rischio di MCI. Questo lavoro fornisce anche informazioni sui fattori legati allo stile di vita associati a MCI che potrebbero essere sfruttati nella prevenzione e nella diagnosi precoce di MCI tra le popolazioni anziane.
Introduzione
L'invecchiamento della popolazione sta aumentando la prevalenza di malattie croniche e degenerative, in particolare demenze degenerative, che dovrebbero colpire più di 131 milioni di persone in tutto il mondo entro il 20501. Tra tutte le demenze degenerative, il morbo di Alzheimer (AD) è il più comune con una prevalenza complessiva in Europa del 6,88%2. A causa della sempre più declinata indipendenza dei pazienti affetti da AD, questo gruppo dovrebbe iniziare a ricevere supporto non appena l'AD inizia a manifestarsi. Pertanto, la diagnosi precoce di segni prodromici di AD, come un lieve danno cognitivo (MCI), è essenziale.
MCI è definito come una fase di declino cognitivo intermedio corrispondente al normale invecchiamento e grave deterioramento a causa della demenza3. Secondo le stime di Petersen et al.4, la prevalenza di MCI è dell'8,4% tra le persone di età compresa tra 65 e 69 anni e raggiunge il 25,2% per le persone di età superiore agli 80 anni. MCI si traduce in individui che sperimentano più difficoltà del previsto nell'esecuzione di abilità cognitive di basso livello, in particolare quelli legati alla memoria e al linguaggio, ma non interferisce con le attività della vita quotidiana.
Lo screening non è sinonimo di diagnosi; la diagnosi di MCI sarà sempre un compito clinico, mentre i metodi di screening possono solo informarci che un paziente ha una maggiore probabilità di soffrire di questa patologia e che c'è un fondato sospetto di MCI che dovrebbe essere confermato clinicamente. Di conseguenza, gli operatori sanitari primari (medici, farmacisti, infermieri, ecc.) potrebbero beneficiare della disponibilità di semplici metodi di screening (test cognitivi brevi) che possono essere applicati in pochi minuti. Idealmente, questi identificherebbero oggettivamente i pazienti con un'alta probabilità di soffrire di una MCI in modo che possano essere testati clinicamente da medici generici o specializzati.
Dato che la diagnosi precoce di MCI sta diventando un compito essenziale nel contesto della salute pubblica, questo lavoro mirava a identificare quali caratteristiche sono utili nell'identificazione mirata dell'MCI nei test di screening delle popolazioni anziane. Questi gruppi sarebbero quindi testati in modo più approfondito per mCI nei test gestiti dai fornitori di assistenza sanitaria primaria. Questa metodologia fornisce a un albero delle decisioni gli algoritmi appropriati per identificare i gruppi di popolazione di destinazione.
Tra queste caratteristiche, l'età è uno dei fattori più consistenti associati allo sviluppo di questa patologia. Altre caratteristiche rilevanti sono relative ai dati demografici o allo stile di vita5. Tra questi ultimi, alcuni studi hanno identificato la durata del sonno diurno o notturno come un fattore di rischio che può portare alla diagnosi di MCI5,6,7,8,9. Il consumo prolungato di farmaci come le benzodiazepine, consumato da una stima del 20%-25% degli adulti più anziani10,11, può anche influenzare le ore di sonno e lo sviluppo di MCI12,13. Infatti, trattamenti prolungati per le malattie croniche possono essere caratteristiche importanti utili nella preselezione di individui con un alto rischio di soffrire di MCI.
Qui, abbiamo sviluppato modelli basati su dati che utilizzano algoritmi di apprendimento automatico, un albero delle decisioni e uno strumento predittivo per aumentare l'efficienza della metodologia per rilevare l'MCI discriminando quali caratteristiche svolgono un ruolo importante nei primi anni rilevamento di MCI. L'albero delle decisioni qui presentato è stato prodotto utilizzando una coorte specifica di pazienti spagnoli che utilizzano farmacie comunitarie. Tuttavia, questo metodo sarebbe utile anche tra le altre popolazioni con caratteristiche diverse.
Questo lavoro è stato completato in collaborazione con l'assistenza sanitaria primaria e medici specializzati. Le farmacie comunitarie erano ideali per testare questo algoritmo perché sono vicine ai pazienti, hanno orari di apertura lunghi e sono spesso visitate e consultate. Le demenze degenerative sono condizioni complesse che non sono sempre ben comprese dagli operatori sanitari primari14. Pertanto, essere coinvolti nel processo aumenterà la consapevolezza delle persone affette da MCI e demenza.
Protocollo
La metodologia applicata in questo studio è stata precedentemente pubblicata5 nel lavoro svolto presso l'Università CEU Cardenal Herrera insieme alle farmacie comunitarie nella regione di Valencia (Spagna) associata alla Società Spagnola di Farmaco della Famiglia e della Comunità (SEFAC). Lo studio attuale è stato esaminato e approvato dal Comitato Etico della Ricerca presso l'Universidad CEU Cardenal Herrera (approvazione n. CEI11/001) nel marzo 2011. Tutte le persone coinvolte nello studio hanno dato il loro consenso scritto informato alla partecipazione in conformità con la dichiarazione di Helsinki.
1. Selezione dei fattori associati a un lieve danno cognitivo
- Cercare i termini relativi a MCI per l'uso nello screening Cochrane Systematic Reviews (ad esempio, danno cognitivo, demenza, fattori di rischio, ecc.).
- Ricerca di termini per i quali vi è qualche prova di una relazione con deterioramento cognitivo o demenza pubblicata nel database PubMed; questi includono fattori demografici (sesso, età, livello di istruzione e stato economico), fattori sociali (attività cognitive e sociali), patologie croniche (colesterolo, depressione, ipertensione, diabete e obesità) e comportamenti di stile di vita (alcol consumo, abitudine al fumo, dieta, attività fisica e ore di sonno).
- Calcolare il rapporto di probabilità per le variabili qualitative o la dimensione dell'effetto d di Cohen per le variabili quantitative15. Selezionare le variabili con effetti di dimensioni maggiori per il deterioramento cognitivo o la demenza da utilizzare nell'elaborazione di un questionario.
2. Progettazione dei questionari
- Progettare un questionario per raccogliere informazioni sulle variabili selezionate, seguendo le linee guida fornite da Nardi16. Ad esempio, le variabili utilizzate in Climent et al.5 erano demografiche (età, peso e altezza [misurate con procedure standardizzate utilizzando scale calibrate e stadiometri], sesso, livello di istruzione e tipo di occupazione), stile di vita (esercizio fisico, lettura, tempo trascorso durante la notte e durante il giorno, puzzle, giochi, tempo di consumo televisivo e consumo di tabacco e alcol), e patologie croniche (ipertensione, iperlipidemia e diabete). Inoltre, registrare la presenza o l'assenza di depressione, che è spesso associata al deterioramento cognitivo.
- Progettare un foglio di follow-up di farmacoterapia per segnalare tutti i farmaci consumati dai partecipanti al momento dell'intervista, come in Climent et al.5, che ha utilizzato il metodo di Dader17 per progettare questo foglio.
3. Selezione dei test per lo screening MCI
- Determinare tutti i test utilizzati per lo screening per MCI che potrebbero essere somministrati da operatori sanitari primari (ad esempio, farmacisti). Rifiutare tutti i test che devono essere somministrati da uno specialista. Alcuni dei test che soddisfano queste condizioni sono il Breve Portable Mental State Questionnaire (SPMSQ)18, Mini Mental State Examination (MMSE)19, Memory Impairment Screen (MIS)20, Picture Memory Impairment Screen (PMIS)21, Montreal Cognitive Assessment (MoCA)22, Saint Louis University Mental Status (SLUMS)23, e Quick Mild Cognitive Impairment (Qmci)24. Una revisione esaustiva di ogni test MCI è disponibile in Cullen et al.25.
- Ricerca di una buona stima delle sensibilità e delle specificità delle prove nella letteratura scientifica.
- Stimare il tempo necessario per amministrare questi test a individui sani.
- Considerare le caratteristiche di base del paziente necessarie per il completamento di questi test. Ad esempio, potrebbe essere necessario un livello minimo di istruzione perché molti test MCI non sono adatti ai partecipanti analfabeti. Una serie di test di screening MCI viene solitamente applicata per aumentare la sensibilità; tuttavia, il numero minimo di test deve essere rapidamente somministrato dai farmacisti se lo screening selettivo finale è destinato a una grande popolazione. Il Climent et al.5 ha valutato l'MCI utilizzando i test MMSE e SPMSQ, con quest'ultimo adatto al gran numero di individui che hanno vissuto la guerra civile spagnola che sono analfabeti.
- Utilizzare una variante della SPMSQ di Pfeiffer18 è stato convalidato in spagnolo da Martènez de la Iglesia26. Questo test ha un punteggio massimo di 10 e il punto di cut-off per stabilire un danno cognitivo è di 3 o più errori (4 o più per gli individui analfabeti). Il completamento di questo test richiede da 8 a 10 minuti.
- Utilizzare una versione NORMACODERM del MMSE convalidata per gli altoparlanti spagnoli da Blesa27 adattando la versione originale di Folstein19. Questo test di screening ha un punteggio massimo di 30 ed è corretto in base agli anni di scolarismo e all'età dei pazienti. I partecipanti che hanno un punteggio inferiore o uguale a 24 sono considerati casi MCI. MMSE è una misura della funzione cognitiva generale e include l'orientamento al tempo e al luogo, la lingua scritta e parlata, la capacità di attenzione, il calcolo e la memoria. È stato somministrato a tutti i partecipanti a questo studio perché è un test molto breve che richiede solo circa 5 minuti per essere completato.
4. Assunzione di materie
- Trova farmacisti disposti a reclutare persone non istituzionalizzate per formare la popolazione studiata. Lo studio citato da Climent et al.5 ha incluso persone di età pari o superiore a 65 anni che sono andate regolarmente in farmacia e che hanno accettato di partecipare a questo studio. Escludere i pazienti con difficoltà nell'eseguire questi test di valutazione (ad esempio, a causa di cecità, sordità, ecc.) o che erano già in trattamento per demenza.
- Fornire ai farmacisti partecipanti moduli di consenso informato, che devono essere completati da ogni individuo che partecipa allo studio. Il presente modulo di consenso specifica il titolo della ricerca, gli obiettivi del progetto, una spiegazione comprensibile di tutte le procedure a cui il partecipante prenderebbe parte, l'assenza di rischi specifici, la riservatezza di tutti i dati raccolti e la diritto di recedere dallo studio per qualsiasi motivo in qualsiasi momento.
- Formare i farmacisti per amministrare colloqui personali strutturati ai partecipanti, che dovrebbero durare circa mezz'ora a persona. Raccogliere dati per 1 anno e inviare tutti i moduli ai ricercatori responsabili della protezione dei dati nello studio. Successivamente follow-up con i pazienti per 3 mesi.
- Indicare ai farmacisti come identificare un probabile caso MCI utilizzando test MCI. Sulla base di Climent et al.5 abbiamo utilizzato punteggi SPMSQ di 4 o più punti (per i partecipanti analfabeti) o 3 o più punti per gli altri partecipanti e punteggi di 24 punti o meno sono stati utilizzati nel test MMSE corretto.
- Istruiscii recare ai farmacisti come indirizzare i casi di MCI a uno specialista medico (un neurologo) per la loro diagnosi clinica- l'ultimo passo nella tabella di flusso utilizzata in questo studio di ricerca (Figura 1).
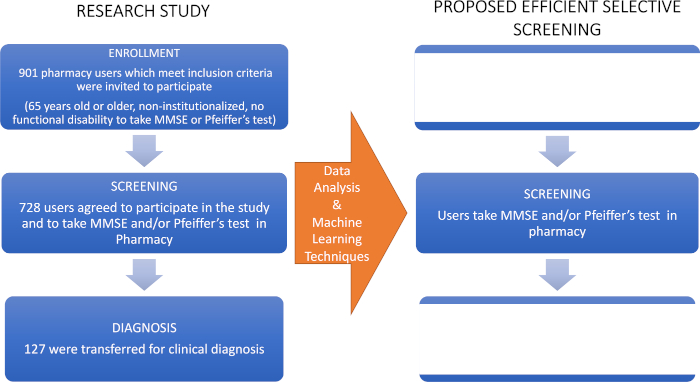
Figura 1: Diagramma di flusso dello studio di ricerca e dello screening selettivo proposto. Il lato sinistro rappresenta lo studio iniziale i cui dati sono stati analizzati con tecniche di apprendimento automatico per proporre lo screening selettivo per la diagnosi precoce dell'MCI mostrato nel pannello di destra. Questa cifra è stata modificata da Climent34. Fare clic qui per visualizzare una versione più grande di questa figura.
5. Formazione dei ricercatori farmacisti
- Contattare specialisti per organizzare sessioni di formazione dei farmacisti partecipanti nelle conoscenze di base relative al danno cognitivo e nella gestione dei suoi strumenti di screening, ad esempio SPMSQ e MMSE.
- Assicurarsi che i farmacisti partecipanti siano a conoscenza delle procedure, del protocollo di raccolta dei dati e di tutte le possibili questioni relative alla protezione dei dati. Informare il progetto che il progetto è stato approvato da un comitato etico della ricerca e dell'importanza del modulo di consenso secondo la dichiarazione di Helsinki.
NOTA: Per eseguire lo studio descritto da Climent et al.5, si sono svolti workshop presso il Collegio Ufficiale dei Farmacisti e l'Università Cardenal-Herrera CEU (UCH-CEU) e riguardavano quanto segue: MCI e demenza; approcci diagnostici all'MCI e alla gestione dello SPMQP e del MMSE (insegnati dal Servizio di Neurologia presso l'Ospedale La Plana di Castellàn); presentazione del progetto e spiegazione della metodologia da parte di ricercatori farmacisti anziani della comunità; e educazione sanitaria e formazione cognitiva da parte dei ricercatori del Dipartimento di Farmacia presso l'Università UCH-CEU.
6. Progettazione dello studio
- Calcolare le dimensioni di un campione per valutare la fattibilità del progetto. Poiché si trattava di uno studio osservazionale, un campione più grande produrrà strumenti più efficaci. Ci sono due modi per determinare la dimensione del campione: uno si basa sulla stima della prevalenza e l'altro è più preciso, tenendo conto delle dimensioni degli effetti.
- Calcolare una stima accurata della prevalenza della condizione nella popolazione
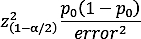
dove il valore è il valore, p0 è la stima iniziale ed errore è l'errore massimo previsto con una confidenza 100(1 - ) %. - Secondo le dimensioni degli effetti presenti nella letteratura per ogni fattore, utilizzare strumenti come il pacchetto pwr in R per stimare quanta potenza è necessaria per rilevare le differenze15,28.
NOTA: Nel nostro studio5, ad esempio, abbiamo progettato la prima proposta con un errore del 3% al 95% di confidenza e una stima iniziale della prevalenza di MCI al 15% nella popolazione di età pari o superiore a 65 anni, con una dimensione stimata del campione richiesta di 541 individui.
- Calcolare una stima accurata della prevalenza della condizione nella popolazione
7. Rete di comunicazione interdisciplinare, farmacisti, medici sanitari primari e specialisti
- Progettare lettere per comunicare informazioni sul progetto ai centri sanitari interessati.
- Spiegare ai farmacisti partecipanti come informare i loro medici assegnati sui risultati degli screening attraverso una lettera al centro sanitario primario.
- Inviare comunicazioni scritte ai coordinatori medici dei centri sanitari relativi alle farmacie partecipanti e ai Servizi di Neurologia degli ospedali a cui sono assegnati.
- Contatta i neurologi partecipanti per scoprire la diagnosi definitiva di ogni paziente ottenuta tramite test specifici condotti da operatori sanitari specializzati. Prima di questo, gli operatori sanitari primari dovrebbero eseguire il seguente protocollo, come riassunto dalle linee guida cliniche (Figura 2).

Figura 2: Protocollo per l'azione sanitaria primaria. Un esempio di azioni sanitarie primarie che dovrebbero essere considerate per il rilevamento precoce dell'MCI prima che il paziente venga indirizzato per una diagnosi medica da specialisti. Fare clic qui per visualizzare una versione più grande di questa figura.
8. Analisi statistica e pre-elaborazione
NOTA: prima di applicare le tecniche di apprendimento automatico è necessario un passaggio preparatorio per trasformare i dati originali in un nuovo set di dati in base all'obiettivo dello studio finale e alle procedure da applicare. Per questa trasformazione, è necessario considerare diversi aspetti, incluse le caratteristiche degli algoritmi. Ciò è dovuto al fatto che alcuni di essi sono sensibili alla mancanza di variabilità o alla condivisione delle informazioni tra le colonne, anche se gli algoritmi utilizzati per generare alberi delle decisioni sono particolarmente affidabili contro questi problemi. Questa fase iniziale ha lo scopo di classificare le variabili qualitative e raccogliere i valori con abbastanza casi per ogni variabile. Per uno screening efficiente è importante scegliere le variabili la cui acquisizione si dimostra facile e precisa. I partecipanti sono selezionati da un breve colloquio in cui gli algoritmi utilizzati sono stati vincolati a un modello di white-box, rendendo più facile controllare i criteri utilizzati per decidere se l'individuo deve fare il test. Si consiglia di utilizzare il pacchetto rpart29 nel software R per questi algoritmi e di implementare il partizionamento ricorsivo.
- Raccogliere tutti i moduli dalle farmacie partecipanti e convertirli in una tabella in cui ogni colonna è una variabile e ogni individuo partecipante è una riga.
- Assegnare un numero di identificazione a ciascun partecipante. Salvare il numero di identificazione e le informazioni di contatto in un documento diverso in modo che non vengano utilizzati dall'algoritmo di apprendimento automatico.
- Generare variabili per classificare se ogni farmaco che il paziente prende corrisponde al secondo o terzo codice di livello ATC30 (Anatomical Therapeutic Chemical), secondo i principali ingredienti attivi sul foglio di follow-up della farmacoterapia.
- Eseguire un'analisi descrittiva iniziale.
- Per ogni variabile ordinale, scegliere un contrasto adeguato per la variabile. Per le variabili di categoria, selezionare il valore considerato come linea di base.
- Per le variabili di categoria, calcolare una regressione logistica univariata con una variabile di risposta per lo screening per MCI. Analizzare il risultato della regressione con una tabella di contingenza, il valore p,il rapporto di quote campione e l'intervallo di confidenza del 95% del rapporto quote.
- Per le variabili quantitative, calcolare la media, deviazione standard, coefficiente di regressione logistica e l'intervallo di confidenza del 95% dei loro coefficienti.
- Rifiutare le variabili con valori mancanti (non disponibili), considerando queste variabili difficili da raccogliere con precisione.
- Selezionare solo le variabili per le quali è presente almeno una categoria statisticamente significativa(Sezione < 0,01) in base all'analisi di regressione logistica. Il risultato di questo passaggio produce un set di dati ridotto rispetto a quello iniziale.
9. Algoritmi per creare un albero delle decisioni
NOTA: gli algoritmi di apprendimento automatico devono essere adeguatamente parametrizzati per prevedere quali individui potrebbero avere un risultato positivo del test MCI. Uno dei problemi principali durante lo screening di una condizione è che i dati originali dovrebbero essere squilibrati (cioè pochi casi positivi rispetto a quelli negativi). Per ottenere modelli con dati bilanciati abbiamo usato una tecnica chiamata down-sampling, o campionamento casuale, per equalizzare la frequenza con quella della classe di frequenza più bassa31. Uno screening efficiente richiede anche la riduzione del numero di falsi negativi il più possibile (cioè aumentare la sensibilità della selezione dei partecipanti affetti da MCI). Una delle tecniche utilizzate per ottenere una maggiore sensibilità è l'introduzione di sanzioni nel calcolo dell'indice di impurità di Gini (cioè l'indice utilizzato dall'algoritmo per selezionare la migliore divisione per l'albero delle decisioni)32.
- Generare un set di dati di training e test con l'80% e il 20% dell'intero set di dati, rispettivamente utilizzando la funzione createDataPartition nella libreria di dati di inserimento33.
- Applicare gli algoritmi usati per generare alberi delle decisioni al set di dati di training. Utilizzare di nuovo la funzione traino nella libreria del custode33. I seguenti passaggi sono diversi parametri della funzione; ad esempio, l'albero utilizzato in questo documento è stato generato con rpart29 (metodo : "rpart"), ma sono disponibili altri algoritmi.
- Selezionare il metodo di campionamento 'down sampling' e introdurre il parametro di campionamento - "down" nel punto di inserimento.
- Impostare le probabilità precedenti per entrambe le classi.
- Fornire una matrice di perdita con le penalità dell'indice di impurità del Gini applicate al fine di concentrarsi sulla crescente sensibilità.
- Per ogni parametro nell'algoritmo, scegliere una griglia di valori appropriata.
- Utilizzare una stima di convalida incrociata dei valori ROC (Receiver Operating Curve) per selezionare i modelli migliori all'interno della griglia dei parametri.
- Calcolare una matrice di confusione e l'area sotto la curva ROC (AUC) per la previsione del set di test per valutare le prestazioni reali del modello.
Risultati
Le farmacie partecipanti hanno raccolto dati da 728 utenti e raccolto variabili demografiche oltre ai farmaci prescritti ai partecipanti. È stata eseguita una regressione logistica univariate per tutte le variabili34; i grafici della barra di errore illustrati nella Figura 3 e nella Figura 4 sono rappresentazioni grafiche convenienti dell'intervallo di confidenza del rapporto di probabilità (per le varia...
Discussione
Dopo aver cercato termini associati a MCI negli studi di Cochrane nel database PubMed, è stato creato un questionario specifico per questo studio che ha utilizzato le variabili più evidenti con una comprovata associazione con MCI. Sono stati registrati anche fattori demografici, di stile di vita e sociali, nonché la farmacoterapia del paziente e alcune patologie rilevanti. Inoltre, sono stati selezionati anche i test SPMSQ e MMSE MCI. È importante sottolineare che la SPMSQ non è stata influenzata dal livello di scol...
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
Questo lavoro è stato reso possibile dal sostegno della Know Alzheimer Foundation e dall'aiuto del servizio di produzione multimediale presso l'Universidad CEU Cardenal Herrera, in particolare Enrique Giner. Vorremmo riconoscere il lavoro di tutte le farmacie partecipanti (SEFAC), e dei medici collaboratori della Society of Primary Care Doctors (SEMERGEN) e Neurology Society (SVN) che hanno aiutato con le diagnosi MCI, in particolare Vicente Gassull, Rafael E Jordi Pérez. Infine, ringraziamo tutti coloro che hanno accettato di partecipare a questo studio.
Materiali
| Name | Company | Catalog Number | Comments |
| caret | Max Kuhn | R package | |
| rpart | Terry Therneau, Beth Atkinson, Brian Ripley | R package | |
| SPMSQ in Spanish | Farmaceuticoscomunitarios.org | http://farmaceuticoscomunitarios.org/anexos/vol11_n1/ANEXO1.pdf | |
| SPMSQ in English | geriatrics.stanford.edu | https://geriatrics.stanford.edu/culturemed/overview/assessment/assessment_toolkit/spmsq.html | |
| MMSE in Spanish | Farmaceuticoscomunitarios.org | http://farmaceuticoscomunitarios.org/anexos/vol11_n1/ANEXO2.pdf | |
| MMSE in English | oxfordmedicaleducation.com | http://www.oxfordmedicaleducation.com/geriatrics/mini-mental-state-examination-mmse/ |
Riferimenti
- . World Alzheimer report 2016: improving healthcare for people living with dementia: coverage, quality and costs now and in the future Available from: https://scholar.google.com/scholar.bib?q=info:mEGpcpLHEIMJ:scholar.google.com (2016)
- Niu, H., Álvarez-Álvarez, I., Guillén-Grima, F., Aguinaga-Ontoso, I. Prevalence and incidence of Alzheimer's disease in Europe: A meta-analysis. Neurología (English Edition). 32 (8), 523-532 (2017).
- Petersen, R. C., et al. Mild Cognitive Impairment: Clinical Characterization and Outcome. Archives of Neurology. 56 (3), 303 (1999).
- Petersen, R. C., et al. Practice guideline update summary: Mild cognitive impairment: Report of the Guideline Development, Dissemination, and Implementation Subcommittee of the American Academy of Neurology. Neurology. 90 (3), 126-135 (2018).
- Climent, M. T., Vilaplana, A. M., Arnedo, A., Vilar, J., Moreno-Royo, L. Life styles associated cognitive impairment. Study from the community pharmacy [Estilos de vida asociados a deterioro cognitivo. Estudio preliminar desde la farmacia comunitaria]. Revista de Investigacion Clinica. 65 (6), 500-509 (2013).
- Faubel, R., et al. Usual sleep duration and cognitive function in older adults in Spain. Journal of Sleep Research. 18 (4), 427-435 (2009).
- Benito-León, J., Louis, E. D., Bermejo-Pareja, F. Cognitive decline in short and long sleepers: A prospective population-based study (NEDICES). Journal of Psychiatric Research. 47 (12), 1998-2003 (2013).
- Ramos, A. R., et al. Association between Sleep Duration and the Mini-Mental Score: The Northern Manhattan Study. Journal of Clinical Sleep Medicine. 9 (7), 669 (2013).
- Gabelle, A., et al. Excessive Sleepiness and Longer Nighttime in Bed Increase the Risk of Cognitive Decline in Frail Elderly Subjects: The MAPT-Sleep Study. Frontiers in Aging Neuroscience. 9, 312 (2017).
- Fernández, M., et al. Prevalence of dementia in the elderly aged above 65 in a district in the Basque Country. Revista de Neurologia. 46 (2), 89-96 (2008).
- Velert Vila, J., et al. Suitability of the use of benzodiazepines prescribed by the pharmacist in the elderly. A doctor-pharmacist collaboration study. Atención Primaria. 44 (7), 402-410 (2012).
- Ranstam, J., et al. Impaired cognitive function in elderly men exposed to benzodiazepines or other anziolytics. The European Journal of Public Health. 7 (2), 149-152 (1997).
- Airagnes, G., Pelissolo, A., Lavallée, M., Flament, M., Limosin, F. Benzodiazepine Misuse in the Elderly: Risk Factors, Consequences, and Management. Current Psychiatry Reports. 18 (10), 89 (2016).
- Alacreu, M., et al. Importance of Increasing Modifiable Risk Factors Knowledge on Alzheimer's Disease Among Community Pharmacists and General Practitioners in Spain. Frontiers in Pharmacology. 10, 860 (2019).
- Cohen, J. . Statistical Power Analysis for the Behavioral Sciences. , (2013).
- Nardi, P. M. . Doing Survey Research: A Guide To Quantitative Methods. , (2018).
- Sabater Hernández, D., Silva Castro, M. M., Faus Dáder, M. J. . Método Dáder: guía de seguimiento farmacoterapéutico. , (2017).
- Pfeiffer, E. A Short Portable Mental Status Questionnaire for the Assessment of Organic Brain Deficit in Elderly Patients. Journal of the American Geriatrics Society. 23 (10), 433-441 (1975).
- Folstein, M. F., Folstein, S. E., McHugh, P. R. "Mini-mental state." A practical method for grading the cognitive state of patients for the clinician. Journal of Psychiatric Research. 12 (3), 189-198 (1975).
- Buschke, H., et al. Screening for dementia with the memory impairment screen. Neurology. 52 (2), 231-238 (1999).
- Verghese, J., et al. Picture-based memory impairment screen for dementia. Journal of the American Geriatrics Society. 60 (11), 2116-2120 (2012).
- Nasreddine, Z. S., et al. The Montreal Cognitive Assessment, MoCA: A Brief Screening Tool For Mild Cognitive Impairment. Journal of the American Geriatrics Society. 53 (4), 695-699 (2005).
- Kaya, D., et al. The Saint Louis University Mental Status Examination Is Better than the Mini-Mental State Examination to Determine the Cognitive Impairment in Turkish Elderly People. Journal of the American Medical Directors Association. 17 (4), e11-e15 (2016).
- O'Caoimh, R., et al. Comparison of the quick mild cognitive impairment (Qmci) screen and the SMMSE in screening for mild cognitive impairment. Age and Ageing. 41 (5), 624-629 (2012).
- Cullen, B., ONeill, B., Evans, J. J., Coen, R. F., Lawlor, B. A. A review of screening tests for cognitive impairment. Journal of Neurology, Neurosurgery & Psychiatry. 78 (8), 790-799 (2007).
- Martínez de la Iglesia, J., et al. Adaptación y validación al castellano del cuestionario de Pfeiffer (SPMSQ) para detectar la existencia de deterioro cognitivo en personas mayores e 65 años. Medicina Clínica. 117 (4), 129-134 (2001).
- Blesa, R., et al. Clinical validity of the 'mini-mental state' for Spanish speaking communities. Neuropsychologia. 39 (11), 1150-1157 (2001).
- . pwr: Basic Functions for Power Analysis Available from: https://cran.r-project.org/web/packages/pwr/index.html (2018)
- . rpart: Recursive Partitioning and Regression Trees Available from: https://cran.r-project.org/web/packages/rpart (2018)
- . ATC/DDD Index Available from: https://www.whocc.no/atc_ddd_index (2018)
- Kuhn, M., Johnson, K. . Applied Predictive Modeling. 26, (2013).
- Kuhn, M. Building Predictive Models in R Using the caret Package. Journal of Statistical Software. 28 (5), 1-26 (2008).
- Climent, M. T., Pardo, J., Muñoz-Almaraz, F. J., Guerrero, M. D., Moreno, L. Decision Tree for Early Detection of Cognitive Impairment by Community Pharmacists. Frontiers in Pharmacology. 9, 1-12 (2018).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon