Method Article
Análisis de alto rendimiento de datos de asignación óptica mediante electromap
En este artículo
Resumen
Este protocolo describe la configuración y el uso de ElectroMap, una plataforma de software de código abierto basada en MATLAB para el análisis de datos de mapeo óptico cardíaco. ElectroMap proporciona una herramienta versátil de alto rendimiento para el análisis de voltaje de mapeo óptico y conjuntos de datos de calcio en una amplia gama de modelos experimentales cardíacos.
Resumen
El mapeo óptico es una técnica establecida para el estudio de alta resolución espacio-temporal de la electrofisiología cardíaca en preparaciones multicelulares. Aquí presentamos, en una guía paso a paso, el uso de ElectroMap para el análisis, cuantificación y mapeo de conjuntos de datos de voltaje y calcio de alta resolución adquiridos por mapeo óptico. Las opciones de análisis de ElectroMap cubren una amplia variedad de parámetros electrofisiológicos clave, y la interfaz gráfica de usuario permite una modificación directa del preprocesamiento y las definiciones de parámetros, haciendo que ElectroMap sea aplicable a una amplia gama de modelos experimentales. Mostramos cómo la detección de frecuencia de ritmo integrada y la segmentación de la señal permiten el análisis de alto rendimiento de grabaciones experimentales completas, respuestas agudas y variabilidad de ritmo a ritmo único. Además, ElectroMap incorpora un promedio automatizado de varios latidos para mejorar la calidad de la señal de conjuntos de datos ruidosos, y aquí demostramos cómo esta característica puede ayudar a dilucidar los cambios electrofisiológicos que de otro modo podrían pasar desapercibidos al usar un solo conjunto de datos análisis de ritmo. Los módulos personalizados se incluyen dentro del software para la investigación detallada de la conducción, el análisis de un solo archivo y las alternancias, como se muestra aquí. Esta plataforma de software se puede utilizar para permitir y acelerar el procesamiento, análisis y mapeo de electrofisiología cardíaca compleja.
Introducción
El mapeo óptico utiliza reporteros fluorescentes de voltaje y/o concentración de calcio para interrogar la electrofisiología cardíaca (EP) y el manejo del calcio en preparaciones multicelulares, con mayor resolución espacial que alcanzable con la tradicional técnicas1,2,3. Por lo tanto, el mapeo óptico ha surgido como una técnica importante y cada vez más utilizada, proporcionando información clave sobre el comportamiento eléctrico fisiológico y fisiopatológico en el corazón3,4,5 ,6,7,8. El procesamiento y análisis eficaces de los datos obtenidos de experimentos de mapeo óptico se complica por varios factores. La alta naturaleza de resolución espaciotemporal de los conjuntos de datos de mapeo óptico da como resultado archivos de vídeos sin procesar compuestos por miles de marcos de imagen, cada uno compuesto por un número de píxeles individuales, dando lugar a archivos de datos de gran tamaño que requieren un alto rendimiento y automatizados procesamiento9. Los tamaños de píxeles pequeños, la carga de tinte deficiente y desigual y los pequeños cambios fraccionarios en fluorescencia dan como resultado señales ópticas con baja relación señal/ruido (SNR), que requieren preprocesamiento antes de que el análisis efectivo sea alcanzable10. El procesamiento y el análisis pueden complicarse aún más mediante el uso de protocolos de ritmo optogenéticos que utilizan la luz para iniciar la activación, lo que podría distorsionar la señal registrada de los sensores fluorescentes11,12. Además, una vez procesados los datos, se pueden aplicar varias técnicas y definiciones no coherentes para medir los parámetros de interés, y las técnicas más aplicables varían en función de la configuración experimental, el modelo y la pregunta2, 10,13. Estas limitaciones impiden una mayor aceptación de la tecnología y dificultan el análisis verdaderamente objetivo.
Para superar estas limitaciones, varios grupos de investigación han diseñado tuberíasde procesamiento personalizadas adaptadas a su modelo experimental, pregunta y hardware 7,14,15,16. Otros utilizan software comercial propietario donde los algoritmos subyacentes pueden ser difíciles de acceder4,17. Como resultado, existe una clara necesidad de una plataforma de software de código abierto disponible libremente para el procesamiento y análisis de datos de mapeo óptico. Es importante que este software sea de código abierto, fácil de usar, flexible a ajuste de parámetros, aplicable a una gama de modelos experimentales con propiedades EP distintas y que permita una cuantificación directa y ajustable de la gama de cardiacos parámetros que se pueden estudiar mediante mapeo óptico.
Recientemente hemos publicado y lanzado una plataforma de software integral, ElectroMap, para el procesamiento, análisis y mapeo semiautomáticos de conjuntos de datos de mapeo óptico cardíaco13. Aquí, presentamos un manual de vídeo para la utilización de ElectroMap y demostramos cómo se puede utilizar para procesar, analizar y mapear varios conjuntos de datos de mapeo óptico. Nos centramos en el uso de ElectroMap para cuantificar las variables estándar de manejo de EP y calcio y demostrar el uso de la velocidad de conducción independiente, el análisis de un solo archivo y los módulos alternans.
Protocolo
1. Recopilación de datos de mapeo óptico
- Realizar mapeo óptico cardíaco utilizando uno de una amplia gama de modelos experimentales incluyendo corazones enteros intactos y aislados6,18, aislamiento de la ría14,19, cuñas ventriculares20, rebanadas cardíacas 21 , 22, y monocapas celulares23. Consulte las referencias asociadas para diseños experimentales para recopilar datos de mapeo óptico sin procesar de estos preparativos. Siempre que los datos obtenidos se puedan convertir en una pila tiff o guardarse en un archivo . MAT, debe ser analizable usando ElectroMap. Esto incluye datos de dimensiones variables (cuadradas/rectangulares) y resoluciones (máximo probado actualmente 2048 píxeles x 2048 píxeles).
2. Instalación y puesta en marcha del software
NOTA: A continuación se detallan los dos métodos para instalar y ejecutar ElectroMap, ya sea dentro de MATLAB ejecutar desde el código de origen (.m) o como un archivo ejecutable independiente (.exe para Windows). El software final y su funcionalidad son invariables entre las dos opciones de configuración (excepto algunas diferencias en la navegación de directorios). Por lo tanto, las principales consideraciones para elegir la versión para instalar son el acceso a MATLAB y las cajas de herramientas necesarias y si se desea el acceso al código fuente. Siempre que sea posible, se recomienda utilizar la versión de MATLAB para tiempos de inicio más rápidos, tiempos de procesamiento más cortos e informes de errores más sencillos.
-
Configuración 1: Ejecución de electromapa dentro de MATLAB
- Instale MATLAB. ElectroMap fue diseñado en MATLAB 2017a, sin embargo, el software ha sido probado para su uso en todas las versiones posteriores de MATLAB (hasta 2018b en el momento de la escritura). Se requieren las siguientes cajas de herramientas: Procesamiento de imágenes, Procesamiento de señales, Estadísticas y aprendizaje automático y Ajuste de curva.
- Descargue/clone todos los archivos de la última versión de 'código fuente' de ElectroMap desde el repositorio GitHub (https://github.com/CXO531/ElectroMap). Descomprima el contenido descargado en la ubicación deseada.
- Abra MATLAB y vaya a la ubicación de la carpeta que aloja el código fuente de ElectroMap. A continuación, abra el archivo ElectroMap.m y pulse ejecutar en el editor, o bien escriba ElectroMap en la ventana de comandos y pulse RETURN. Esto iniciará la interfaz de usuario de ElectroMap, Figura 1A.
-
Configuración 2: Archivo .exe independiente
- Descargue el archivo de instalación: https://drive.google.com/open?id=1nJyI07w9WIt5zWcit0aEyIbtg31tANxI.
- Siga las instrucciones del instalador, que descargará el tiempo de ejecución de MATLAB necesario de la web junto con el software ElectroMap.
- Ejecute ElectroMap.exe.
NOTA: El tiempo de inicio de la versión independiente puede ser de varios minutos.
3. Carga y preprocesamiento de imágenes
- Pulse Seleccionar carpeta y desplácese hasta la ubicación de los archivos de datos que se van a analizar. Esto rellenará el cuadro de lista de la izquierda con todos los archivos dentro de ese directorio que son del tipo de archivo correcto (.tif o . MAT). . Los archivos MAT solo deben contener la variable de pila de imágenes.
NOTA: Solo las carpetas y no los archivos individuales aparecerán a medida que navegue por el selector de directorios. - Seleccione el archivo que desea cargar desde la interfaz y pulse Cargar imágenes.
- Una vez cargado, aparecerá el primer fotograma, y el contorno rojo indicará el umbral automático de la imagen. Si es necesario, vuelva a cargar los ROI utilizados anteriormente seleccionando Guardar/Cargar ROI. En este caso, omita el paso 3.3.
- De forma predeterminada, el umbral se basa en las intensidades de píxeles del primer fotograma. Si lo desea, modifique esto a un umbral basado en la amplitud del curso de tiempo de señal cambiando la opción en el menú desplegable Imagen para umbral. Tenga en cuenta que una vez seleccionado el umbral, se aplica para toda la pila de imágenes.
- Si lo desea, cambie la opción de umbral a manual, que activará el control deslizante para ajustar manualmente el umbral de imagen. Además, recorte imágenes (Recortar imagen) y/o dibuje una región de interés personalizada (ROI personalizado) para su análisis seleccionando las casillas de verificación adecuadas por debajo de las opciones de umbral. Tenga en cuenta que las opciones avanzadas para la selección de regiones de interés, como el número de áreas, están disponibles en Selección de ROI en el menú superior.
- Una vez que se haya aplicado un umbral adecuado, presione Procesar imágenes para aplicar el procesamiento. Los ajustes para el procesamiento se detallan a continuación (paso 3.4.1-3.4.5). En este punto, asegúrese de que se han introducido los ajustes correctos de la cámara. Estos son el tamaño de píxel en m (IMPORTANTE: este es el tamaño de píxel de la imagen, y no el tamaño de los píxeles que componen el chip o hardware equivalente en el dispositivo de imagen) y La velocidad de fotogramas en kHz.
- Para la inversión de señal, marque la casilla Invertir datos para habilitar. Si la señal fluorescente notificada es inversamente proporcional al parámetro de interés (como con los colorantes potenciométricos de uso común), la señal se puede invertir.
- Para el filtrado espacial, seleccione Gaussian o Average en el menú del kernel. El tamaño del área promediada espacialmente se controla mediante la entrada Tamaño adyacente al menú desplegable Kernel (es decir, 3 da como resultado un kernel de filtro de 3 píxeles x 3 píxeles). Al aplicar un filtro gaussiano, la desviación estándar también se puede establecer desde la entrada Sigma.
- Para la corrección de línea base, seleccione Corrección top-hat24 o polinomio (4o u 11o grado)en el menú Línea base. La corrección se puede aplicar a cada píxel individualmente (tiempo de procesamiento largo) o como un promedio de toda la imagen (más rápido pero asume alteraciones de línea base homogéneas). La corrección del sombrero superior también se puede modificar estableciendo la longitud del sombrero superior en milisegundos, adyacente al menú desplegable de selección de línea base. La longitud del núcleo Top-Hat debe ser mayor que la escala de tiempo de los potenciales de acción individuales/transitorios de calcio.
- Para el filtrado temporal, seleccione Filtrado de savitzky-Goaly o impulso infinito (IIR) en el menú Filtrado.
NOTA: Aparte de la señal promediada de tejido que aparece en la parte inferior izquierda, el filtrado temporal se aplica a cada píxel individualmente en el momento de la cuantificación de parámetros a partir de rangos de imagen promediados del conjunto. Esto se ha implementado para reducir el tiempo de procesamiento filtrando pequeñas secciones de datos cuando sea necesario en lugar de archivos completos. - Para la eliminación de fotogramas, tenga en cuenta que si se selecciona la opción Eliminar fotogramas, se pueden eliminar del conjunto de imágenes picos grandes con una amplitud mayor que la señal de interés. Esto puede ser útil en conjuntos de datos de ritmo óptico, como el ritmo optogenético, donde la despolarización se inicia mediante la activación óptica de opsins como channelrhodopsin 211,12.
NOTA: Como la eliminación de fotogramas potencialmente introducirá cambios de paso no fisiológicos en las señales de imagen, el filtrado temporal puede introducir artefactos en los datos y, por lo tanto, no se recomienda aquí.
- Tenga en cuenta que la señal se segmentará una vez que se haya seleccionado Procesar imágenes de acuerdo con las opciones en Opciones de segmentación,sin embargo, esto se puede cambiar rápidamente sin volver a procesar todo el dataset (consulte la sección 4).
4. Segmentación de datos y promediación del conjunto
NOTA: Una vez procesado el archivo, los picos en la señal promediada del tejido (traza inferior derecha, Figura 1A)habrán sido detectados y etiquetados por círculos rojos. Solo se cuentan los picos por encima de un umbral establecido (línea azul en el trazado establecido por Umbral depico). Además, los picos solo se cuentan si están suficientemente retrasados en comparación con los picos anteriores, establecidos por la entrada Distancia de pico mínimo. La señal se segmenta en función de los picos detectados. En primer lugar, la longitud del ciclo efectivo (CL) de cada pico se calcula midiendo el tiempo entre él y el siguiente pico. Si un número de picos (establecidos por la entrada Min Number of Peaks) tienen CLs similares (umbral para los cuales se establece mediante la entrada Límite mínimo), entonces se agrupan y se calcula el CL promedio para esos picos.
- Para una mayor segmentación de los datos, pulse Señal de segmento. Las opciones de subsegmentación son: Ninguno: todos los picos con el mismo CL agrupados; Todos: se identifican segmentos de npicos dentro de los tiempos CL constantes (npicos se establece n mediante la entrada Tamaño de segmento); Last: los picos finales n antes de identificar y agrupar un cambio CL, y no se analizan todos los demás; y Single Beat – Esto equivale a aplicar la segmentación Todo con npicos 1, por lo que no se aplica ningún promedio de agrupación o conjunto (ver 4.5). Esto se puede aplicar seleccionando el botón De un solo golpe.
- Aplique la segmentación personalizada de la señal acercando un momento de interés y seleccionando Segment Signal. Esto agregará una opción adicional titulada Sección ampliada al cuadro de lista de la sección, correspondiente a los puntos de tiempo seleccionados.
- Los resultados de la segmentación aparecerán en el cuadro de lista adyacente a la señal promediada del tejido, y mostrarán el número de sección y el CL estimado. Todas las secciones de tiempo segmentadas se indican con diferentes colores. Seleccione un segmento del cuadro de lista para resaltar esa sección en rojo. Esto también activará automáticamente los análisis de esta sección, como si se hubiera seleccionado el botón Producir mapas (ver sección 5).
- Los análisis de los picos agrupados se realizarán en los datos "promediados por conjunto". Esto implica promediar los picos en un segmento juntos, siendo los tiempos de referencia los picos identificados en el paso 4.2. Actualice la ventana de tiempo a la media modificando las entradas de antes y después y presionando Señal de segmento.
5. Potencial de acción/duración transitoria de calcio y análisis de velocidad de conducción
- Una vez procesadas las imágenes, el botón Producir mapas se activará. Pulse Producir mapas para aplicar la duración potencial de la acción (APD), el tiempo de activación, la velocidad de conducción y el análisis SNR. De forma predeterminada, el análisis se aplicará al primer segmento de señal. Seleccione otros segmentos del cuadro de lista aplicará el análisis al segmento elegido.
NOTA: Los resultados del análisis se muestran en la tabla de resultados, incluida la media, la desviación estándar, el error estándar, la varianza y el análisis del percentil 5 al 95. Sin embargo, los mapas de duración se denominan mapas de "APD", las señales de calcio procesadas con los mismos ajustes medirán la duración transitoria del calcio. - Seleccione Obtener información de píxeles para ver una visualización detallada de la señal desde cualquier píxel de la imagen y Comparar píxeles para trazar simultáneamente señales de hasta 6 ubicaciones.
- Utilice el panel Procesamiento de señales para ajustar la configuración del análisis de duración. Estos son: Duración – Tiempo de repolarización porcentual / decaimiento para medir desde el pico; Línea de base 'APD': período de tiempo de la señal que se define como línea de base de referencia para las mediciones de amplitud; y 'APD' Hora de inicio: hora de inicio para las mediciones de duración. Estas son las mismas opciones para decidir el tiempo de activación de los mapas isocronales (que se describen a continuación) y se denominan: Inicio ( d2F/dt2max), Upstroke (dF/dtmax), Punto medio de despolarización (tiempo de amplitud del 50%), Pico (tiempo de amplitud máxima). Estas definiciones aplicadas a los potenciales de acción del ratón y del conejillo de indias se muestran en la Figura 2A.
NOTA: Al cambiar cualquiera de estas opciones, se actualizará automáticamente el mapa de duración y la tabla de resultados. También están disponibles las opciones de eliminación de escala de mapa y de valores atípicos.
- Utilice el panel Procesamiento de señales para ajustar la configuración del análisis de duración. Estos son: Duración – Tiempo de repolarización porcentual / decaimiento para medir desde el pico; Línea de base 'APD': período de tiempo de la señal que se define como línea de base de referencia para las mediciones de amplitud; y 'APD' Hora de inicio: hora de inicio para las mediciones de duración. Estas son las mismas opciones para decidir el tiempo de activación de los mapas isocronales (que se describen a continuación) y se denominan: Inicio ( d2F/dt2max), Upstroke (dF/dtmax), Punto medio de despolarización (tiempo de amplitud del 50%), Pico (tiempo de amplitud máxima). Estas definiciones aplicadas a los potenciales de acción del ratón y del conejillo de indias se muestran en la Figura 2A.
- La velocidad de conducción también se mide automáticamente dentro de la interfaz principal del software. Esto se logra utilizando el método multi-vector de Bayly et al26 del mapa isocronal definido por la medida de activación elegida (discutido en el paso 5.4). Pulse Puntos de activación para representar una representación 3D del mapa de activación.
- El método de medición de velocidad de conducción multivectorsegmenta espacialmente el mapa isocronal en regiones de n x n píxeles. Establezca el valor de n utilizando la entrada Tamaño de ventana local y establezca el intervalo de tiempos de activación para aplicar el análisis mediante las entradas Tiempos de activación de ajuste.
NOTA: Para cada región local, se ajusta una superficie polinómica, f, que mejor describe la relación entre el tiempo de activación y la posición espacial, (x,y). El vector de degradado, CVlocal, de esta superficie se calcula como: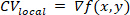 ①
①
donde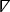 denota el operador diferencial espacial cartesiano bidimensional26.
denota el operador diferencial espacial cartesiano bidimensional26. - Para cada píxel del mapa isocronal, se calcula un vector local que representa la velocidad y la dirección de conducción. Seleccione Mapa isocronal con vectores en el menú desplegable de visualización para ver este análisis.
- El SNR se calcula como la relación de la amplitud máxima en comparación con la desviación estándar de la señal en la línea de base. Este análisis se realiza para contabilizar todos los pasos de procesamiento. Pulse cálculo SNR en el menú superior para editar los ajustes del período de la señal definida como línea base.
6. Módulo de análisis de conducción
- Presione Conducción para acceder a un análisis más detallado de la velocidad de conducción. Esto abre un módulo separado donde la conducción se puede cuantificar utilizando el método multivector Bayly como en la interfaz principal, métodos vectoriales únicos y como una curva de activación.
- Pulse Vector único para analizar la conducción utilizando el método de vector único, donde el CV se calcula a partir del retardo en el tiempo de activación entre dos puntos. Esto se puede hacer usando métodos Automático o Manual, seleccionable debajo del botón Vector único.
- Para el método automático de vector único, seleccione una distancia y un punto de inicio desde el que medir la conducción. A continuación, el software realizará un barrido de 360 grados desde el punto seleccionado, midiendo el retardo de tiempo y calculando la velocidad de conducción asociada a lo largo de todas las direcciones en incrementos de 1 grado. Los resultados de este análisis se muestran en el gráfico adyacente al mapa, y la dirección de la conducción más lenta se muestra en rojo.
- Para el método vectorial único manual, elija un punto inicial y final del mapa isocronal para calcular la velocidad de conducción. Para seleccionar un nuevo punto de inicio, pulse Borrar punto de inicio.
- Presione Vector local para aplicar el método multivector, con los ajustes que coinciden con los de la interfaz principal. Dentro del módulo de conducción, se puede visualizar la distribución de las velocidades de conducción, así como la distribución angular de vectores calculados y la dependencia angular de la velocidad de conducción.
- Presione la curva de activación para trazar el porcentaje de tejido activado en función del tiempo. El tiempo hasta el 100% de activación se muestra automáticamente, mientras que también se pueden seleccionar los valores personalizados para los porcentajes de activación mínimos (azul) y máximos (rojos) entre los que se puede medir.
7. Análisis y módulos adicionales
- Aparte de los análisis de duración y velocidad de conducción realizados automáticamente, se pueden cuantificar varios otros parámetros mediante ElectroMap. Estos análisis se pueden seleccionar en el menú desplegable situado encima del mapa de visualización. Seleccione una de estas opciones para realizar el análisis, y los resultados aparecerán en la 4a fila de la tabla de resultados: 1) Intervalo diastólico – Tiempo de repolarización del 90% al tiempo de activación del siguiente potencial de acción; 2) Frecuencia dominante – El espectro de frecuencia de cada píxel se calcula utilizando la transformación rápida de Fourier, y la frecuencia con más potencia se define como la frecuencia dominante. Los ajustes avanzados de rango y ventana para el análisis de frecuencia dominante están disponibles seleccionando Asignaciónde frecuencia; 3) Tiempo hasta el pico – El tiempo de aumento entre dos porcentajes seleccionados por el usuario (por defecto 10 a 90%) fase de despolarización del potencial de acción o la liberación de calcio. Los valores de porcentaje se pueden cambiar seleccionando Configuración de TTP; y 4) Constante de relajación ()– La constante de relajación se calcula ajustando una decadencia monoexponencial de la forma de la forma:
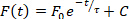 ②
②
donde el nivel de fluorescencia en el tiempo t depende del pico de fluorescencia, F0, y la decadencia posterior (C es una constante)27. El valor entre el que se ajustará la ecuación 2 se pueden seleccionar dentro de las interfaces de usuario principales de ElectroMap, así como una bondad de criterios de exclusión de ajuste basados en el valor r 2. - Pulse Análisis de archivo único para abrir un módulo dedicado para la duración de alto rendimiento y el análisis de conducción de cada segmento identificado en un archivo. El análisis se puede realizar en toda la imagen (duración, conducción y tiempo de activación) o en regiones o puntos de interés seleccionados (solo duración actual). Los resultados se generan en un archivo .csv.
NOTA: Para los valores APD de toda la imagen, la primera columna del archivo .csv es la media, mientras que la segunda columna es la desviación estándar. - Presione Alternans para iniciar un módulo independiente para el análisis dedicado y el mapeo de la variabilidad beat-to-beat. 201913 para obtener más información sobre las opciones de procesamiento y análisis de alternancias. Específicamente, este módulo está diseñado para identificar dos oscilaciones de período, conocidas como alternancias. Los alternancias de duración y amplitud se calculan y se generan.
NOTA: Los alternadores de duración se miden comparando la medición de duración de un pico al siguiente; es decir, si el pico uno y dos y APD1 y APD2 respectivamente, entonces la alternancia de duración (APD) se calcula como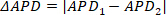 ③
③
La medición de la duración se realiza utilizando los ajustes de la interfaz principal. Mientras tanto, los alternadores de amplitud se pueden cuantificar y mapear a través de preparaciones multicelulares como un cambio absoluto (definido como un porcentaje en el que el 0% es la misma amplitud entre un latido y el siguiente). Además, los efectos de fenómenos como la carga de calcio pueden investigarse más a fondo midiendo y comparando alternadores de carga y liberación, como se ha informado anteriormente28. Si L se define como la amplitud máxima de los latidos grandes (es decir, donde la amplitud es mayor que el latido anterior), S la amplitud de los latidos pequeños, yD la carga diastólica de los latidos pequeños, la liberación alterna (
mayor que el latido anterior), S la amplitud de los latidos pequeños, yD la carga diastólica de los latidos pequeños, la liberación alterna ( 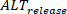 ) se definen como:
) se definen como: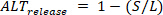 (4)
(4)
Por el contrario, los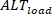 alternadores de carga ( ) se definen como:
alternadores de carga ( ) se definen como: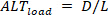 (5)
(5)
Las mediciones de Alternans se pueden hacer a través de todo el tejido, y los resultados del análisis se muestran en la parte inferior derecha del módulo. Cuando se utiliza por primera vez el módulo, el análisis se realiza en todo el archivo experimental, y los resultados mostrados son una diferencia de ritmo promedio en todo el archivo. Sin embargo, el análisis se puede restringir a tiempos específicos en el archivo anulando la selección de Mantener zoom, ampliando un período de tiempo específico y seleccionando Analizar sección ampliada. Esto actualizará el panel de resultados para mostrar el análisis del período de tiempo seleccionado.- Seleccione play para mostrar un vídeo de ritmo a ritmo del análisis de alternans. Además, seleccione Crear mapa medio para exportar un mapa del comportamiento de alternancias promediado desde los puntos de tiempo de selección, que se establecen en el menú emergente al utilizar esta función.
- Presione Mapa de fase para iniciar el módulo de asignación de fase. Se realiza una transformación Hilbert para calcular la fase instantánea (entre - - y + ) de las señales en cada punto de tiempo. Presione el control deslizante play o drag para visualizar el comportamiento de fase a lo largo del tiempo y haga clic en un píxel para representar un diagrama de fases.
8. Exportación de datos
- Los datos se exportan desde ElectroMap en una variedad de formas. Pulse Exportar valores para guardar los valores del mapa que se muestra actualmente en la interfaz utilizada principal. Los valores medidos se pueden guardar como un mapa (conservando ubicaciones de píxeles) o condensarse en una sola lista, y se pueden guardar como .csv, .txt o . Archivos MAT.
- Pulse Exportar mapa para abrir una ventana emergente que contenga el mapa que se muestra actualmente, que luego se puede guardar en una variedad de formatos de imagen. Las opciones de visualización del mapa se controlan seleccionando Configuración del mapa, pero también se pueden editar una vez que se ha seleccionado Exportar mapa. Por ejemplo, se puede agregar una barra de colores seleccionando este icono en el menú superior, y la escala se puede establecer seleccionando Edición > Mapa decolores .
- Pulse Vídeo de activación para representar una animación de la secuencia de activación, que se puede guardar como un archivo .gif animado.
- Pulse Segmento de vídeo para guardar un archivo de vídeo .avi del parámetro que se muestra actualmente de cada segmento identificado.
Resultados
Todo el trabajo realizado como parte de este estudio se llevó a cabo de conformidad con las directrices éticas establecidas por la Ley de 1986 sobre animales del Reino Unido (procedimientos científicos) y la Directiva 2010/63/UE del Parlamento Europeo sobre la protección de los animales utilizados con fines científicos. Los experimentos fueron aprobados por la oficina en casa (ratón: PPL 30/2967 y PFDAAF77F, conejillo de indias: PPL PF75E5F7F) y las juntas de revisión institucional en la Universidad de Birmingham (ratón) y el King's College de Londres (conejillo de indias). Los métodos detallados para la recopilación de los datos sin procesar que se han analizado aquí se pueden encontrar en nuestras publicaciones anteriores5,6,14,19.
La interfaz principal desde la que se controla ElectroMap se muestra en la Figura 1A. Los pasos necesarios para analizar un conjunto de datos se controlan principalmente mediante los botones Cargar imágenes, Procesar imágenesy Generar mapas y se muestran resaltados en verde, azul y rojo, respectivamente en la Figura 1A. La figura 1B-D muestra las operaciones que se producen en la selección de cada uno de estos botones. Cargar imágenes aplica las opciones de umbral de imagen seleccionadas por el usuario (figura1B),mientras que procesar imágenes (figura1C) aplica el filtrado y la corrección de línea base. Por último, Produce Maps primero promediará los datos de acuerdo con la ventana de tiempo y la configuración de segmentación (a menos que se elija la segmentación de un solo ritmo) y, a continuación, realizará los análisis descritos anteriormente.
Un aspecto clave de ElectroMap es su flexibilidad con respecto al tipo de cámara y modelo experimental. Esto es crucial para la utilidad de un software de mapeo óptico debido a los distintos EP cardíacos y características anatómicas que existen entre los modelos ampliamente utilizados. La Figura 2A, por ejemplo, muestra la morfología potencial de acción de las aurículas murinas en comparación con el ventrículo del conejillo de indias, registrada utilizando detenciones sensibles al voltaje como se informó anteriormente6,14. A pesar de la forma distintiva del potencial de acción, y el uso de dos cámaras de mapeo óptico independientes con diferentes velocidades de fotogramas y tamaños de píxeles, ElectroMap se puede utilizar para analizar con éxito ambos conjuntos de datos. Sin embargo, esto requiere la modificación de algunos parámetros dentro de la interfaz de usuario (figura2B). Tenga en cuenta que el potencial prolongado de acción de conejillo de indias requiere una ventana de tiempo más grande. Además, para evitar la corrección de línea de base del sombrero superior modificando fisiológicamente las señales registradas ópticamente, su longitud de tiempo debe aumentarse para que sea mayor que el curso de tiempo del potencial de acción.
ElectroMap ofrece una multitud de opciones de procesamiento para ayudar a mejorar el SNR de señales grabadas ópticamente que pueden ser necesarias para recuperar eficazmente los parámetros del EP. Un ejemplo es el promedio automatizado del conjunto de picos después de la segmentación de datos. La Figura 3A-C muestra cómo la aplicación del promediado de conjunto, en lugar de otros métodos, puede mejorar el SNR de las árilos aislados de la izquierda murina (n .13). Esto reduce la heterogeneidad de la medición y la probabilidad de fallo de análisis (Figura3D). Por ejemplo, un cambio de frecuencia de ritmo de 3 Hz a 10 Hz no alteró APD50, cuando no se lleva a cabo un promedio de conjunto, sin embargo, se observó una disminución esperada de29 en APD50 a 10 Hz de ritmo cuando se midió a partir de datos promediados del conjunto ( Figura 3E).
La Figura 4 demuestra la eficacia y utilidad de la detección y segmentación automatizada de frecuencias de ritmo ofrecida según ElectroMap. Aquí, las atrias izquierdas del ratón (n a 5) se relacionaron con una longitud de ciclo de 120 ms y la longitud del ciclo se acortó gradualmente en 10 ms hasta que llegó a 50 ms. ElectroMap identificó automáticamente la longitud del ciclo de ritmo y los picos promediados del tejido agrupado en consecuencia (Figura4A ). Esto se logró con alta precisión en todos los conjuntos de datos (Figura4B). La segmentación automatizada de los datos permitió un análisis sencillo y de alto rendimiento de la ralentización de la velocidad de conducción con una mayor frecuencia de ritmo/longitud de ciclo acortada (Figura4C,D). Simultáneamente, APD50 (Figura4E)y intervalo diastólico (Figura 4F) acortado. La amplitud de los picos medidos ópticamente disminuyó, mientras que el tiempo hasta el pico aumentó (Figura 4G,H). Estas son de nuevo las respuestas de restitución esperadas en el tejido cardíaco29,30 y el uso de ElectroMap puede ayudar, por lo tanto, a dilucidar los cambios en respuesta a la frecuencia de ritmo en presencia de agentes farmacológicos, modificación genética, o los estados de la enfermedad.
Una consideración importante en el uso de un software como ElectroMap es la presencia de artefactos en los datos subyacentes. Figura 5, por ejemplo, demuestra que los artefactos de movimiento (la distorsión de la señal registrada ópticamente por el movimiento del tejido) pueden impedir mediciones precisas de la activación y especialmente la repolarización dentro de ElectroMap. Consulte Debate para más consideraciones.
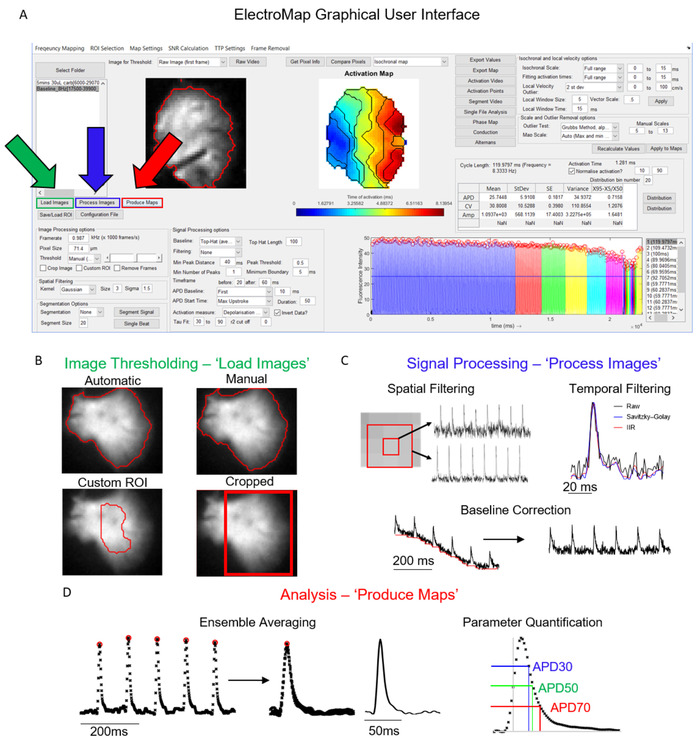
Figura 1: Pasos principales de procesamiento de ElectroMap. (A) Interfaz gráfica de usuario de ElectroMap, con los botones Cargar imágenes (verde), Procesar imágenes (azul) y Producir mapas (rojo) resaltados. (B) Opciones de umbral de imagen que se pueden aplicar al seleccionar Cargar imágenes. (C) Las opciones de procesamiento de señales disponibles para el usuario incluyen el filtrado espacial y temporal y la corrección de línea base y se pueden aplicar a la pila de imágenes pulsando Procesar imágenes. (D) Promediación del conjunto y cuantificación de parámetros (medida APD mostrada) que se activa seleccionando Producir mapas. Figura adaptada de O'Shea et al., 201913. Haga clic aquí para ver una versión más grande de esta figura.
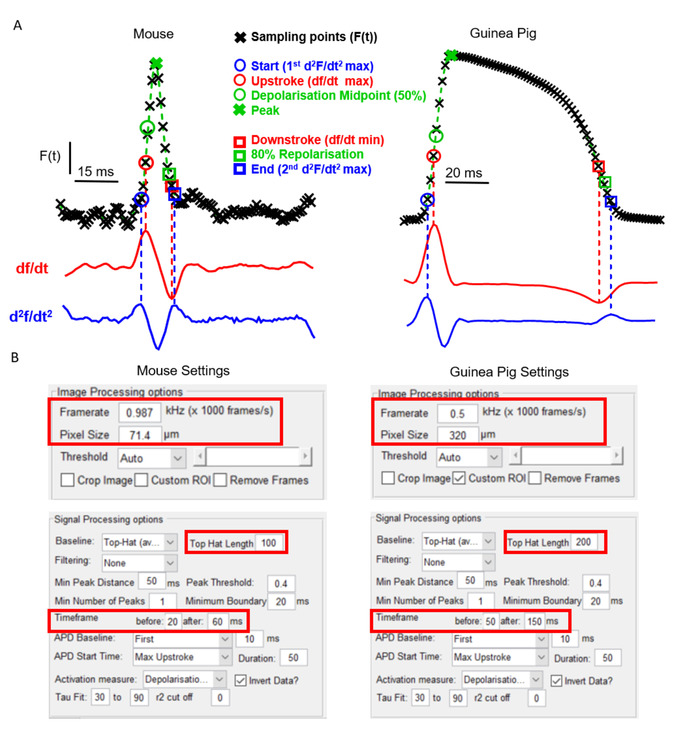
Figura 2: Análisis de los datos del ratón y del conejillo de indias utilizando ElectroMap. (A) Potencial de acción grabado ópticamente de las aurículas de ratón y los ventrículos de conejillo de indias, junto con el primero (df/dt) y el segundo (d2f/dt2)derivado de estas señales. Se resaltan las diversas definiciones para los tiempos de activación y repolarización empleables dentro de ElectroMap. (B) Capturas de pantalla de la configuración de procesamiento de imágenes y señales utilizadas en la interfaz de ElectroMaps. Las casillas rojas resaltan los ajustes que requieren modificación entre los análisis de los datos del ratón y del conejillo de indias. Figura adaptada de O'Shea et al., 201913. Haga clic aquí para ver una versión más grande de esta figura.
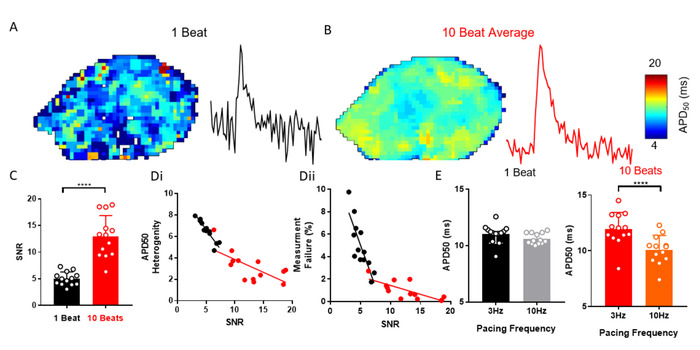
Figura 3: Promediación del conjunto para resolver los cambios de APD. (A) APD50 mapa y ejemplo de señal de un solo píxel de potenciales de acción óptica de un solo ritmo. (B) APD50 mapa y ejemplo de señal de un solo píxel de potenciales de acción óptica generados por el conjunto promediando 10 latidos sucesivos (método de pico). (C) SNR de un solo ritmo en comparación con 10 señales promediadas de ritmo. (D) APD50 heterogeneidad (i) y número de fallas de medición (ii) en función de SNR para un solo ritmo y 10 latidos promediados APD50 mapas. (E) APD50 a 3 y 10 Hz frecuencia de ritmo, medida a partir de mapas de un solo ritmo y 10 ritmos. (Datos mostrados como media s error estándar, n a 13 a la izquierda de las arículas, ****p < 0.001 por la prueba t-test emparejada del estudiante). Haga clic aquí para ver una versión más grande de esta figura.
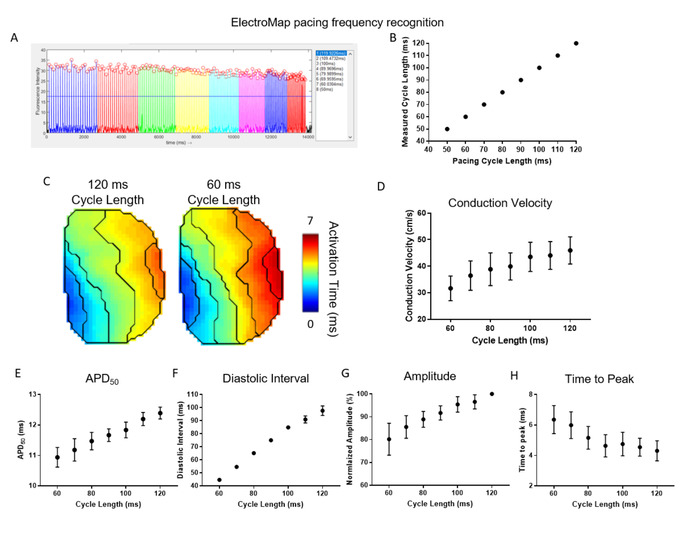
Figura 4: Uso de ElectroMap para estudiar las respuestas de frecuencia de ritmo en el tejido cardíaco. (A) Ejemplo de captura de pantalla electroMap de ritmo de reconocimiento de frecuencia y segmentación. (B) Comparación de longitudes de ciclo de ritmo conocidas y medidas por ElectroMap. (C) Mapas de activación a 120 ms y 60 ms longitudes de ciclo de ritmo. (D-H) Datos agrupados de velocidadde conducción (D ), APD50 (E), intervalo diastólico (F), amplitud (G) y tiempo hasta el pico (H) en función de la longitud del ciclo de ritmo disminuyendo de 120 ms a 60 ms en incrementos de 10 ms. (Datos mostrados como media - error estándar, n a 5 a la izquierda de las arículas) Haga clic aquí para ver una versión más grande de esta figura.
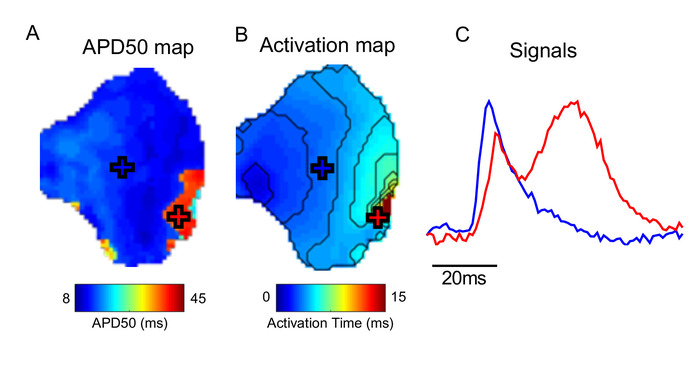
Figura 5: Efecto de los artefactos de movimiento. (A) APD50 mapa. (B) Mapa de activación. (C) Señales de ejemplo de ubicaciones marcadas (cruces) en aPD y mapas de activación. En el área del tejido marcado con la cruz roja, la contracción no se ha desacoplado con éxito, distorsionando la señal óptica medida. Haga clic aquí para ver una versión más grande de esta figura.
Discusión
Aquí, presentamos una guía paso a paso para la utilización del software de código abierto ElectroMap para el análisis flexible y multivariable de conjuntos de datos de mapeo óptico cardíaco. Para un uso exitoso de ElectroMap, se requiere que los datos de imagen estén en .tif o . Formatos MAT. ElectroMap incorpora varios ajustes de usuario modificables. Como se muestra en la Figura 2A,esto es necesario debido a la amplia heterogeneidad que existe entre los modelos experimentales y el hardware de imagen. Sin embargo, esto significa que la configuración predeterminada dentro del software no siempre será óptima, por lo que un paso crítico en el uso del software es para que el usuario ajuste la configuración para su configuración experimental particular. Estos incluyen la configuración de la cámara y las escalas de tiempo, tal y como se muestra en de la figura 2B. Una vez que se han encontrado los ajustes óptimos, estos se pueden guardar y volver a cargar más adelante seleccionando Archivo de configuración.
La incorporación de la medición CL automatizada y la segmentación de la señal son las principales ventajas del software. Estas características permiten el análisis de respuestas agudas en grabaciones experimentales y un análisis ensanchamiento desde el enfoque en ritmos únicos aislados. Una vez lograda la segmentación deseada, el módulo Análisis de archivo único permite el análisis automatizado de cada segmento individual (incluidos los latidos individuales), realizando análisis de alto rendimiento de múltiples variables a través de la grabación único archivo .csv. En conjunto, el promedio de conjunto de picos agrupados es un método eficaz para mejorar la calidad de las señales ruidosas que se realiza automáticamente en ElectroMap. Sin embargo, el promedio del conjunto no es ubicuamente beneficioso, por ejemplo en estudios de variabilidad beat-to-beat. Por lo tanto, ElectroMap integra la segmentación de un solo ritmo para evitar el promediado de conjunto, opciones de procesamiento alternativas para mejorar el SNR (filtrado espacial y temporal) e incluye el módulo de análisis Alternans para investigar y mapear más a fondo variabilidad de ritmo a ritmo.
Los datasets de asignación óptica a menudo exhiben artefactos como la deriva de línea base y los artefactos de movimiento. Del mismo modo, las señales generadas pueden ser de baja calidad debido a pequeños tamaños de píxeles, tiempos de exposición cortos y cambios fluorescentes fraccionarios bajos2. Estos factores impiden un análisis eficaz y preciso del comportamiento del PE subyacente. Como se describe, ElectroMap tiene varias estrategias de procesamiento para superar estos problemas. Sin embargo, la aplicación de estos algoritmos a datos distorsionados/de calidad fundamentalmente deficientes seguirá impidiendo un análisis eficaz. SNR es por lo tanto uno de los parámetros que se mide y se muestra en ElectroMap. Del mismo modo, el usuario puede seleccionar y comparar las señales de regiones específicas de la muestra utilizando los módulos Pixel Info y Compare, lo que permite identificar fenómenos como artefactos de movimiento que se muestran en la Figura5, y apropiado exclusión de datos.
En la actualidad, ElectroMap no admite la eliminación de artefactos de movimiento de datos sin procesar de la misma manera que la corrección de línea base. Por lo tanto, un posible desarrollo futuro del software es la inclusión de la eliminación de artefactos de movimiento por métodos computacionales como se ha informado31,32. Además, ElectroMap se limita actualmente al estudio de una señal óptica. Sin embargo, para los dedos ratiométricos y el uso simultáneo de voltaje y destaño de calcio27,se requiere el procesamiento simultáneo de dos canales de longitud de onda. Por lo tanto, la integración del análisis de señal dual es una importante adición futura al software. La extensión de las opciones de análisis aplicables a conjuntos de datos arritmicos, como el seguimiento de la singularidad de fase, ampliaría igualmente el alcance del software33,34. Por último, varias de las opciones de análisis descritas también pueden ser útiles en el análisis de los datos de mapeo de electrodos. De hecho, ElectroMap se ha utilizado para analizar los datos de mapeo de electrodos a pesar de la contrastación de la forma de onda de electrograma20,35,y una mayor optimización ampliará su uso para esta modalidad.
Divulgaciones
P.K. recibe apoyo de investigación de varias compañías de medicamentos y dispositivos activas en la fibrilación auricular y ha recibido honorarios de varias de estas compañías. L.F. ha recibido becas institucionales de investigación de la UE, BHF, MRC, DFG y Gilead. P.K. y L.F. figuran como inventores en dos patentes en poder de la Universidad de Birmingham (Terapia de Fibrilación Auricular WO 2015140571, Marcadores para la Fibrilación Auricular WO 2016012783).
Todos los demás autores no declaran un posible conflicto de intereses.
Agradecimientos
Este trabajo fue financiado por el estudiante de la EPSRC (Sci-Phy-4-Health Centre for Doctoral Training L016346) a D.P., K.R. y L.F., Wellcome Trust Seed Award Grant (109604/Z/15/Z) a D.P., British Heart Foundation Grants (PG/17/55/33087, RG/17/15/33106) a D.P. , Unión Europea (acuerdo de subvención no 633196 [CATCH ME] a P.K. y L.F.), British Heart Foundation (FS/13/43/30324 a P.K. y L.F.; PG/17/30/32961 a P.K. y A.H.), y la Fundación Leducq a P.K. J.W. cuenta con el apoyo de la Fundación Británica del Corazón (FS/16/35/31952).
Materiales
| Name | Company | Catalog Number | Comments |
| MATLAB and Simulink R2018a | Mathworks, Inc, Natick, MA | MATLAB software |
Referencias
- Efimov, I. R., Nikolski, V. P., Salama, G. Optical Imaging of the Heart. Circulation Research. 94, 21-33 (2004).
- Herron, T. J., Lee, P., Jalife, J. Optical imaging of voltage and calcium in cardiac cells & tissues. Circulation Research. 110, 609-623 (2012).
- Boukens, B. J., Efimov, I. R. A century of optocardiography. IEEE Reviews in Biomedical Engineering. 7, 115-125 (2014).
- Myles, R. C., Wang, L., Kang, C., Bers, D. M., Ripplinger, C. M. Local β-adrenergic stimulation overcomes source-sink mismatch to generate focal arrhythmia. Circulation Research. 110, 1454-1464 (2012).
- Syeda, F., et al. PITX2 Modulates Atrial Membrane Potential and the Antiarrhythmic Effects of Sodium-Channel Blockers. Journal of the American College of Cardiology. 68, 1881-1894 (2016).
- Winter, J., et al. Sympathetic nervous regulation of cardiac alternans in the intact heart. Frontiers in Physiology. 9, 1-12 (2018).
- Faggioni, M., et al. Suppression of spontaneous ca elevations prevents atrial fibrillation in calsequestrin 2-null hearts. Circulation: Arrhythmia and Electrophysiology. 7, 313-320 (2014).
- Sato, P. Y., et al. Loss of Plakophilin-2 Expression Leads to Decreased Sodium Current and Slower Conduction Velocity in Cultured Cardiac Myocytes. Circulation Research. 105, 523-526 (2009).
- Yu, T. Y., et al. Optical mapping design for murine atrial electrophysiology. Computer Methods in Biomechanics and Biomedical Engineering: Imaging & Visualization. 5, 368-378 (2017).
- Laughner, J. I., Ng, F. S., Sulkin, M. S., Arthur, R. M., Efimov, I. R. Processing and analysis of cardiac optical mapping data obtained with potentiometric dyes. American Journal of Physiology. Heart and Circulatory Physiology. 303, H753-H765 (2012).
- Crocini, C., Ferrantini, C., Pavone, F. S., Sacconi, L. Optogenetics gets to the heart: A guiding light beyond defibrillation. Progress in Biophysics and Molecular Biology. 130, 132-139 (2017).
- Entcheva, E., Bub, G. All-optical control of cardiac excitation: Combined high-resolution optogenetic actuation and optical mapping. The Journal of Physiology. 9, 2503-2510 (2016).
- O’Shea, C., et al. ElectroMap: High-throughput open-source software for analysis and mapping of cardiac electrophysiology. Scientific Reports. 9, 1-13 (2019).
- Yu, T. Y., et al. An automated system using spatial oversampling for optical mapping in murine atria. Development and validation with monophasic and transmembrane action potentials. Progress in Biophysics and Molecular Biology. 115, 340-348 (2014).
- Jaimes, R., et al. Functional response of the isolated, perfused normoxic heart to pyruvate dehydrogenase activation by dichloroacetate and pyruvate. Pflugers Archiv. 468, 131-142 (2016).
- Wang, K., et al. Cardiac tissue slices: preparation, handling, and successful optical mapping. American Journal of Physiology. Heart and Circulatory Physiology. 308, H1112-H1125 (2015).
- Parrish, D. C., et al. Transient denervation of viable myocardium after myocardial infarction does not alter arrhythmia susceptibility. American Journal of Physiology. Heart and Circulatory. , (2017).
- Ihara, K., et al. Electrophysiological Assessment of Murine Atria with High-Resolution Optical Mapping. Journal of Visualized Experiments. (132), e56478 (2018).
- Holmes, A. P., et al. A Regional Reduction in Ito and IKACh in the Murine Posterior Left Atrial Myocardium Is Associated with Action Potential Prolongation and Increased Ectopic Activity. Plos One. 11, e0154077 (2016).
- Lang, D., et al. Arrhythmogenic remodeling of β2 versus β1 adrenergic signaling in the human failing heart. Circulation: Arrhythmia and Electrophysiology. 8, 409-419 (2015).
- Kang, C., et al. Human Organotypic Cultured Cardiac Slices: New Platform For High Throughput Preclinical Human Trials. Scientific Reports. 6, 1-13 (2016).
- Wen, Q., et al. Transverse cardiac slicing and optical imaging for analysis of transmural gradients in membrane potential and Ca2+ transients in murine heart. The Journal of Physiology. 596, 3951-3965 (2018).
- Houston, C., et al. Characterisation of re-entrant circuit (or rotational activity) in vitro using the HL1-6 myocyte cell line. Journal of Molecular and Cellular Cardiology. 119, 155-164 (2018).
- Yu, T. Y., et al. Optical mapping design for murine atrial electrophysiology. Computer Methods in Biomechanics and Biomedical Engineering: Imaging and Visualization. 5, 368-376 (2017).
- Laughner, J. I., Ng, F. S., Sulkin, M. S., Arthur, R. M., Efimov, I. R. Processing and analysis of cardiac optical mapping data obtained with potentiometric dyes. AJP: Heart and Circulatory Physiology. 303, H753-H765 (2012).
- Bayly, P. V., et al. Estimation of Conduction Velocity Vector Fields from Epicardial Mapping Data. IEEE Transactions on Bio-Medical Engineering. 45, 563-571 (1998).
- Jaimes, R., et al. A technical review of optical mapping of intracellular calcium within myocardial tissue. American Journal of Physiology. Heart and Circulatory Physiology. 310, H1388-H1401 (2016).
- Wang, L., et al. Optical mapping of sarcoplasmic reticulum Ca2+ in the intact heart: Ryanodine receptor refractoriness during alternans and fibrillation. Circulation Research. 114, 1410-1421 (2014).
- Winter, J., Shattock, M. J. Geometrical considerations in cardiac electrophysiology and arrhythmogenesis. Europace. , (2016).
- Mironov, S., Jalife, J., Tolkacheva, E. G. Role of conduction velocity restitution and short-term memory in the development of action potential duration alternans in isolated rabbit hearts. Circulation. 118, 17-25 (2008).
- Khwaounjoo, P., et al. Image-Based Motion Correction for Optical Mapping of Cardiac Electrical Activity. Annals of Biomedical Engineering. 43, 1235-1246 (2014).
- Christoph, J., Luther, S. Marker-Free Tracking for Motion Artifact Compensation and Deformation Measurements in Optical Mapping Videos of Contracting Hearts. Frontiers in Physiology. 9, (2018).
- Umapathy, K., et al. Phase Mapping of Cardiac Fibrillation. Circulation: Arrhythmia and Electrophysiology. 3, 105-114 (2010).
- Tomii, N., et al. Detection Algorithm of Phase Singularity Using Phase Variance Analysis for Epicardial Optical Mapping Data. IEEE Transactions on Biomedical Engineering. 63, 1795-1803 (2016).
- Cantwell, C. D., et al. Techniques for automated local activation time annotation and conduction velocity estimation in cardiac mapping. Computers in Biology and Medicine. 65, (2015).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados