Method Article
Análise de alto throughput de dados de mapeamento óptico usando o ElectroMap
Neste Artigo
Resumo
Este protocolo descreve a configuração e o uso do ElectroMap, uma plataforma de software de código aberto baseada em MATLAB para análise de dados de mapeamento óptico cardíaco. O ElectroMap fornece uma ferramenta versátil de alta produtividade para análise de conjuntos de dados de tensão e cálcio de mapeamento óptico através de uma vasta gama de modelos experimentais cardíacos.
Resumo
O mapeamento óptico é uma técnica estabelecida para o estudo de alta resolução espaço-temporal da eletrofisiologia cardíaca em preparações multicelulares. Aqui apresentamos, em um guia passo a passo, o uso do ElectroMap para análise, quantificação e mapeamento de conjuntos de dados de tensão e cálcio de alta resolução adquiridos por mapeamento óptico. As opções da análise de ElectroMap cobrem uma grande variedade de parâmetros electrofisiológicos chaves, e a interface gráfica do usuário permite a modificação direta do Pre-Processing e das definições do parâmetro, fazendo o ElectroMap aplicável a uma escala larga de modelos experimentais. Mostramos como a detecção de frequência de estimulação e a segmentação de sinal integradas permitem a análise de alta taxa de transferência de gravações experimentais inteiras, respostas agudas e uma única variabilidade de batida para batida. Adicionalmente, o electromap incorpora a média multibatida automatizada para melhorar a qualidade do sinal de conjuntos de dados barulhentos, e aqui nós demonstramos como esta característica pode ajudar a elucidar mudanças electrofisiológicas que poderiam de outra maneira ir sem ser detectado ao usar o único análise de batida. Módulos personalizados são incluídos dentro do software para investigação detalhada de condução, análise de arquivo único, e alternans, como demonstrado aqui. Esta plataforma de software pode ser usada para permitir e acelerar o processamento, análise e mapeamento de eletrofisiologia cardíaca complexa.
Introdução
O mapeamento óptico utiliza repórteres fluorescentes de tensão e/ou concentração de cálcio para interrogar eletrofisiologia cardíaca (EP) e manuseio de cálcio em preparações multicelulares, com maior resolução espacial do que realizável com a tradicional técnicas1,2,3. Portanto, o mapeamento óptico surgiu como uma técnica importante e cada vez mais utilizada, proporcionando insights-chave sobre o comportamento elétrico fisiológico e fisiopatológico no coração3,4,5 ,6,7,8. O processamento e a análise eficazes dos dados obtidos dos experimentos de mapeamento óptico são complicados por vários fatores. A alta natureza de resolução espaciotemporal dos conjuntos de dados de mapeamento óptico resulta em arquivos de vídeos brutos compostos por milhares de quadros de imagens, cada um composto por um número de pixels individuais, dando origem a grandes arquivos de dados que necessitam de alta taxa de transferência e automatizado processamento de9. Os tamanhos pequenos do pixel, o carregamento pobre e desigual da tintura e as mudanças fracionárias pequenas na fluorescência resultam em sinais óticos com baixo sinal à relação de ruído (SNR), exigindo o Pre-Processing antes que a análise eficaz seja alcançável10. O processamento e a análise podem ser ainda mais complicados com o uso de protocolos de estimulação optogenética que utilizam a luz para iniciar a ativação, potencialmente distorando o sinal gravado dos sensores fluorescentes11,12. Além disso, uma vez que os dados foram processados, várias técnicas e definições não consistentes podem ser aplicadas para medir parâmetros de interesse, com as técnicas mais aplicáveis variando dependendo da configuração experimental, modelo e pergunta2, 10,13. Essas limitações impedem uma maior captação da tecnologia e dificultam a análise verdadeiramente objetiva.
Para superar essas limitações, vários grupos de pesquisa projetaram pipelines de processamento personalizado adaptados para seu modelo experimental, pergunta e hardware7,14,15,16. Outros utilizam software proprietário comercial onde os algoritmos subjacentes podem ser difíceis de acessar4,17. Como resultado, há uma clara necessidade de uma plataforma de software livre de código aberto disponível para processamento e análise de dados de mapeamento óptico. É importante que este software seja de código aberto, fácil de usar, flexível ao ajuste do parâmetro, aplicável a uma escala de modelos experimentais com propriedades distintas do EP e permita crucialmente a quantificação direta e sintonável da escala do cardíaco parâmetros que podem ser estudados usando o mapeamento óptico.
Temos recentemente publicou e lançou uma plataforma de software abrangente, ElectroMap, para alta-em todo, semi-automatizado de processamento, análise e mapeamento de cardiopatias mapeamento óptico de dados13. Aqui, apresentamos um manual de vídeo para a utilização do ElectroMap e demonstramos como ele pode ser usado para processar, analisar e mapear vários conjuntos de dados de mapeamento óptico. Nós nos concentramos no uso de electromap para quantificar as variáveis padrão de manuseio de cálcio e EP e demonstrar o uso de velocidade de condução autônoma, análise de arquivo único e módulos Brachinus.
Protocolo
1. coleta de dados de mapeamento óptico
- Realizar mapeamento óptico cardíaco usando uma de uma ampla gama de modelos experimentais, incluindo corações inteiros intactos e isolados6,18, átrios isolados14,19, cunhas ventriculares20, fatias cardíacas 21 anos de , 22, e monocamadas celulares23. Consulte referências associadas para projetos experimentais para coletar dados de mapeamento óptico brutos dessas preparações. Desde que os dados obtidos podem ser convertidos em uma pilha TIFF ou salvos em um. Mat arquivo, ele deve ser analisáveis usando electromap. Isso inclui dados de dimensões variadas (quadradas/retangulares) e resoluções (máximo testado atualmente 2048 pixels x 2048 pixels).
2. instalação e arranque do software
Nota: abaixo estão detalhados os dois métodos para instalar e executar o ElectroMap – seja no MATLAB executado a partir do código de origem (. m) ou como um ficheiro executável autónomo (. exe para Windows). O software final e sua funcionalidade são invariável entre as duas opções de configuração (diferente de algumas diferenças na navegação de diretório). Portanto, as principais considerações para escolher a versão a ser instalado são o acesso ao MATLAB e as caixas de ferramentas necessárias e se o acesso ao código-fonte é desejado. Sempre que possível, é recomendável usar a versão MATLAB para tempos de inicialização mais rápidos, tempos de processamento mais curtos e relatórios de erros mais fáceis.
-
Configuração 1: executando o Atlas no MATLAB
- Instale o MATLAB. O ElectroMap foi concebido em MATLAB 2017a, no entanto, o software foi testado para utilização em todas as versões subsequentes do MATLAB (até 2018B no momento da escrita). As seguintes caixas de ferramentas são necessárias: processamento de imagens, processamento de sinais, estatísticas e aprendizado de máquina e encaixe de curva.
- Download/clonar todos os arquivos do mais recente lançamento do "código fonte" do electromap a partir do repositório GitHub (https://github.com/CXO531/ElectroMap). Descompacte o conteúdo baixado para um local desejado.
- Abra o MATLAB e navegue até o local da pasta que hospeda o código-fonte do ElectroMap. Em seguida, abra o arquivo electromap. m e pressione executar no editor, ou, alternativamente, digite electromap na janela de comando e pressione Return. Isso iniciará a interface do usuário do ElectroMap, Figura 1a.
-
Configuração 2: arquivo standalone. exe
- Baixe o arquivo do instalador: https://drive.google.com/open?id=1nJyI07w9WIt5zWcit0aEyIbtg31tANxI.
- Siga as instruções no instalador, que fará o download necessário o tempo de execução do MATLAB da Web ao lado do software ElectroMap.
- Executar Electromap. exe.
Nota: o tempo de arranque para a versão autónoma pode ser de vários minutos.
3. carregamento e Pre-Processing da imagem
- Pressione Selecionar pasta e navegue até o local dos arquivos de dados a serem analisados. Isso preencherá a caixa de listagem do lado esquerdo com todos os arquivos dentro desse diretório que são do tipo de arquivo correto (. tif ou. MAT). . Arquivos MAT devem conter apenas a variável de pilha de imagem.
Observação: somente pastas e arquivos não individuais aparecerá como você navegar pelo seletor de diretório. - Selecione o arquivo a ser carregado de dentro da interface e pressione Load images.
- Uma vez carregado, o primeiro quadro aparecerá, e o contorno vermelho indicará o limiarização automático da imagem. Se necessário, recarregue ROIs usados anteriormente selecionando salvar/carregar ROI. Nesse caso, pule a etapa 3,3.
- Como padrão, a limiarização é baseada nas intensidades de pixel no primeiro quadro. Se desejar, modifique-o para um limite com base na amplitude do curso do tempo de sinal alterando a opção no menu suspenso imagem para limite . Por favor, note que uma vez que o limiarização é selecionado, ele é então aplicado para toda a pilha de imagem.
- Se desejar, altere a opção de limite para manual, que ativará o controle deslizante para ajustar manualmente o limite da imagem. Além disso, recortar imagens (recortar imagem) e/ou desenhar uma região personalizada de interesse (ROI personalizado) para análise selecionando a caixa de seleção apropriada (es) abaixo das opções de limite. Observe que as opções avançadas para a seleção de região de interesse, como o número de áreas, estão disponíveis na seleção de ROI no menu superior.
- Depois que um limite apropriado tiver sido aplicado, pressione processar imagens para aplicar o processamento. As configurações para processamento são detalhadas abaixo (etapa 3.4.1-3.4.5). Neste ponto, assegure-se de que as configurações corretas da câmera tenham sido inseridas. Estes são pixel tamanho em ΜM (importante: Este é o tamanho do pixel de imagem, e não o tamanho dos pixels que compõem o chip ou hardware equivalente no dispositivo de imagem) e framerate em kHz.
- Para inversão de sinal, marque a caixa de seleção inverter dados para ativar. Se o sinal fluorescente relatado for inversamente proporcional ao parâmetro de interesse (como com corantes potenciométricos comumente usados), o sinal pode ser invertido.
- Para filtragem espacial, selecione Gaussian ou Average no menu do kernel. O tamanho da área de média espacialmente é controlado pela entrada de tamanho adjacente ao menu suspenso do kernel (ou seja, 3 resulta em 3 pixel x 3 pixel kernel do filtro). Ao aplicar um filtro Gaussian, o desvio padrão também pode ser definido a partir da entrada Sigma .
- Para correção de linha de base, selecione o Top-Hat24 ou polinomial (4ª ou 11º grau) correção25 do menu de linha de base . A correção pode ser aplicada a cada pixel individualmente (tempo de processamento longo) ou como uma média de toda a imagem (mais rápido, mas assume alterações de linha de base homogêneas). A correção do Top-Hat também pode ser modificada definindo o comprimento do Top-Hat em milissegundos, adjacente ao menu suspenso de seleção de linha de base. O comprimento do kernel Top-Hat deve ser maior do que a escala temporal dos potenciais de ação individuais/transientes de cálcio.
- Para a filtragem temporal, selecione Savitzky-Goaly ou o impulso infinito (IIR) que filtra do menu de filtração .
Nota: a não ser para o sinal de média de tecido que aparece no canto inferior esquerdo, a filtragem temporal é aplicada a cada pixel individualmente no momento da quantificação dos parâmetros dos intervalos de imagens com média de Ensemble. Isso foi implementado para reduzir o tempo de processamento filtrando pequenas seções de dados quando necessário em vez de arquivos inteiros. - Para a remoção do quadro, observe que, se a opção remover quadros estiver selecionada, grandes picos com amplitude maior do que o sinal de interesse podem ser removidos do conjunto de imagens. Isso pode ser útil em conjuntos de dados opticamente passeado, como a estimulação optogenética, onde a despolarização é iniciada pela ativação óptica de opsinas, como channelrhodopsin 211,12.
Observação: como remoção de quadro potencialmente introduzirá alterações de etapa não fisiológicas nos sinais de imagem, a filtragem temporal pode introduzir artefatos para os dados e, portanto, não é recomendado aqui.
- Observe que o sinal será segmentado uma vez que as imagens do processo foram selecionadas de acordo com as opções em Opções de segmentação, no entanto, isso pode ser alterado rapidamente sem reprocessar todo o conjunto de dados (consulte a seção 4).
4. segmentação de dados e média de Ensemble
Nota: uma vez que o arquivo foi processado, picos no sinal de média de tecido (traço inferior direito, Figura 1a) terá sido detectado e rotulado por círculos vermelhos. Somente picos acima de um limite definido (linha azul no rastreamento definido pelo limite máximo) são contados. Além disso, os picos só são contados se forem suficientemente atrasados em comparação com os picos anteriores, definidos pela entrada min Peak Distance . O sinal é então segmentado com base nos picos detectados. Primeiro, o comprimento efetivo do ciclo (CL) de cada pico é calculado medindo-se o tempo entre ele e o próximo pico. Se um número de picos (definido pelo número mínimo de picos de entrada) tem CLS semelhantes (limiar para o qual é definido pela entrada de limite mínimo ), em seguida, eles são agrupados e a CL média para os picos calculados.
- Para mais segmentação dos dados, pressione o sinal do segmento. As opções de subsegmentação são: None – todos os picos com o mesmo CL agrupados juntos; Todos – segmentos de npicos dentro da constante CL vezes (npicos é definido pela entrada de tamanho do segmento ) são identificados; Last -final nPeaks antes de uma alteração CL são identificados e agrupados, e todos os outros não são analisados; e batida única – isso equivale a aplicar a segmentação All com nPeaks = 1 e, portanto, não é aplicada nenhuma média de agrupamento ou Ensemble (consulte 4,5). Isso pode ser aplicado selecionando o botão batida única .
- Aplique segmentação personalizada do sinal, ampliando o tempo de interesse e selecionando sinal de segmento. Isso adicionará uma opção adicional intitulada seção Zoomed à caixa de listagem de seção, correspondente aos pontos de tempo selecionados.
- Os resultados da segmentação aparecerá na lista-caixa adjacente ao sinal de média de tecido, e mostrará o número de seção e a CL estimada. Todas as seções de tempo segmentadas são indicadas por cores diferentes. Selecione um segmento na caixa de listagem para destacar essa seção em vermelho. Isso também acionará automaticamente as análises desta seção, como se o botão produzir mapas foi selecionado (consulte a seção 5).
- As análises dos picos agrupados serão realizadas nos dados da média de Ensemble. Isso envolve a média dos picos em um segmento em conjunto, sendo os tempos de referência os picos identificados na etapa 4,2. Atualize a janela de tempo para a média modificando as entradas antes e depois e pressionando o sinal de segmento.
5. potencial de ação/duração transitória do cálcio e análise da velocidade de condução
- Depois que as imagens forem processadas, o botão produzir mapas se tornará ativo. Pressione produzir mapas para aplicar a duração do potencial de ação (APD), tempo de ativação, velocidade de condução e análise SNR. Por padrão, a análise será aplicada ao primeiro segmento de sinal. Selecionar outros segmentos da lista-caixa aplicará a análise ao segmento escolhido.
Nota: os resultados da análise são exibidos na tabela de resultados, incluindo média, desvio padrão, erro padrão, variância e análise de percentil 5 a 95. Mapas de duração são denominados ' APD ' mapas no entanto, os sinais de cálcio processados usando as mesmas configurações irá medir a duração do cálcio transiente. - Selecione obter informações de pixel para ver uma exibição detalhada do sinal de qualquer pixel dentro da imagem e comparar pixels para plotar sinais simultaneamente de até 6 locais.
- Use o painel processamento de sinais para ajustar as configurações para a análise de duração. Estes são: duração – tempo de repolarização/deterioração percentual para medir a partir do pico; Linha de base ' APD ' – período de tempo de sinal que é definido como linha de base de referência para medições de amplitude; e ' APD ' hora de início – hora de início para medições de duração. Estas são as mesmas opções para decidir o tempo da ativação para mapas isócronos (discutidos abaixo) e são denominados: começo (d2F/DT2máximos), upstroke (DF/DTmáximo), ponto médio do despolarisation (tempo de amplitude de 50%), pico (tempo de amplitude máxima). Estas definições aplicadas aos potenciais de ação do rato e da cobaia são mostradas na Figura 2a.
Observação: alterar qualquer uma dessas opções atualizará automaticamente o mapa de duração e a tabela de resultados. Opções de escala de mapa e remoção de outlier também estão disponíveis.
- Use o painel processamento de sinais para ajustar as configurações para a análise de duração. Estes são: duração – tempo de repolarização/deterioração percentual para medir a partir do pico; Linha de base ' APD ' – período de tempo de sinal que é definido como linha de base de referência para medições de amplitude; e ' APD ' hora de início – hora de início para medições de duração. Estas são as mesmas opções para decidir o tempo da ativação para mapas isócronos (discutidos abaixo) e são denominados: começo (d2F/DT2máximos), upstroke (DF/DTmáximo), ponto médio do despolarisation (tempo de amplitude de 50%), pico (tempo de amplitude máxima). Estas definições aplicadas aos potenciais de ação do rato e da cobaia são mostradas na Figura 2a.
- Velocidade de condução também é medido automaticamente dentro da interface de software principal. Isso é conseguido usando o método multivetorial de Bayly et al26 a partir do mapa isócronos definido pela medida de ativação escolhida (discutida na etapa 5,4). Pressione pontos de ativação para renderizar uma representação 3D do mapa de ativação.
- O método de medição da velocidade de condução multivetorial segmenta espacialmente o mapa isócronos em regiões de n x n pixels. Defina o valor de n usando a entrada de tamanho de janela local e defina o intervalo de tempos de ativação para aplicar a análise para usar as entradas de tempos de ativação de encaixe .
Observação: para cada região local, uma superfície polinomial, f, é ajustada que melhor descreve a relação entre o tempo de ativação e a posição espacial, (x,y). O vetor de gradiente, CVlocal, desta superfície é então calculado como: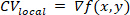 1
1
onde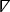 denota o operador diferencial espacial cartesiano bidimensional26.
denota o operador diferencial espacial cartesiano bidimensional26. - Para cada pixel no mapa isócronos, um vetor local que representa a velocidade e direção de condução é calculado. Selecione mapa isochronal com vetores no menu suspenso de exibição para ver esta análise.
- O SNR é calculado como a relação da amplitude máxima comparada ao desvio padrão do sinal na linha de base. Esta análise é executada após todas as etapas de processamento. Pressione o cálculo SNR no menu superior para editar as configurações do período do sinal definido como linha de base.
6. módulo de análise de condução
- Pressione a condução para alcançar uma análise mais detalhada da velocidade da condução. Isso abre um módulo separado onde a condução pode ser quantificada usando o método multivetor Bayly como na interface principal, métodos vetoriais únicos e como uma curva de ativação.
- Pressione vetor único para analisar a condução usando o método de vetor único, onde cv é calculado a partir do atraso no tempo de ativação entre dois pontos. Isso pode ser feito usando métodos automáticos ou manuais , selecionáveis abaixo do botão vetor único .
- Para o método de vetor único automático, selecione uma distância e um ponto inicial para medir a condução. O software executará então uma varredura 360-degree do ponto selecionado, medindo o atraso de tempo e calculando a velocidade associada da condução ao longo de todas as direções em incrementos de 1 grau. Os resultados desta análise são exibidos no gráfico adjacente ao mapa, e a direção da condução mais lenta é mostrada em vermelho.
- Para o método de vetor único manual, escolha um ponto inicial e final do mapa isócronos para calcular a velocidade de condução. Para selecionar um novo ponto de início, pressione limpar ponto de início.
- Pressione local vector para aplicar o método de vetor multi, com as configurações correspondentes a partir da interface principal. Dentro do módulo de condução, pode-se apresentar a distribuição das velocidades de condução, bem como a distribuição angular dos vetores calculados e a dependência angular da velocidade de condução.
- Pressione a curva de ativação para plotar a porcentagem de tecido ativada em função do tempo. O tempo para 100% de ativação é exibido automaticamente, enquanto valores personalizados para as porcentagens de ativação mínimas (azuis) e máximas (vermelhas) entre as quais a medida também podem ser selecionadas.
7. análises e módulos adicionais
- Além das análises de velocidade de condução e duração realizadas automaticamente, vários outros parâmetros podem ser quantificados usando o ElectroMap. Essas análises são selecionáveis no menu suspenso acima do mapa de exibição. Selecione uma dessas opções para realizar a análise, e os resultados aparecerão na 4ª linha da tabela de resultados: 1) intervalo diastólico – tempo de 90% de repolarização para o tempo de ativação do próximo potencial de ação; 2) freqüência dominante -o espectro de freqüência de cada pixel é calculado usando a transformada rápida de Fourier, e a freqüência com a maioria de poder é definida como a freqüência dominante. Os ajustes avançados da escala e da janela para a análise dominante da freqüência estão disponíveis selecionando o mapeamento da freqüência; 3) tempo de pico – o tempo de subida entre duas porcentagens selecionadas pelo usuário (padrão de 10 a 90%) da fase de despolarização do potencial de ação ou da libertação de cálcio. Os valores percentuais podem ser alterados selecionando TTP Settings; e 4) constante de relaxamento (τ) – constante de relaxamento é calculada ajustando uma decadência mono-exponencial da forma da forma:
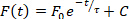 2
2
onde o nível de fluorescência no tempo t depende da fluorescência de pico, F0, e a deterioração subsequente (C é uma constante)27. O valor entre o qual ajustar a equação 2 são selecionáveis dentro das principais interfaces de usuário do ElectroMap, bem como um critério de exclusão de adequação baseado no valor de r2 . - Pressione análise de arquivo único para abrir um módulo dedicado para a análise de duração e condução de alta taxa de transferência de cada segmento identificado em um arquivo. A análise pode ser realizada tanto em toda a imagem (duração, condução e tempo de ativação) ou em regiões ou pontos de interesse selecionados (atualmente apenas a duração). Os resultados são outputted para um arquivo. csv.
Observação: para valores APD de toda a imagem, a primeira coluna no arquivo. csv é a média, enquanto a segunda coluna é o desvio padrão. - Pressione alternans para iniciar um módulo autônomo para análise dedicada e mapeamento de variabilidade batida-a-batida. Ver o ' Shea et al. 201913 para obter detalhes sobre as opções de processamento e análise Brachinus. Especificamente, este módulo é projetado para identificar duas oscilações de período, conhecidas como alternans. Os Brachinus da duração e da amplitude são calculados e outputted.
Nota: as alternações de duração são medidas comparando a medida de duração de um pico para o próximo; ou seja, se o pico um e dois e APD1 e APD2 respectivamente, em seguida, o ALTERNAN duração (δapd) é calculado como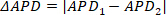 3
3
A medida da duração é executada usando as configurações na interface principal. Enquanto isso, as Brachinus de amplitude podem ser quantificadas e mapeadas em preparações multicelulares como mudança absoluta (definida como uma porcentagem onde 0% = mesma amplitude entre uma batida e a próxima). Além disso, os efeitos dos fenômenos tais como a carga do cálcio podem mais ser investigados medindo e comparando a carga e libere alternans, como tem sido relatado previamente28. Se L é definido como a amplitude máxima das batidas grandes (isto é. onde a amplitude é maior do que a batida precedente), S a amplitude das batidas pequenas, e D a carga diastólica das batidas pequenas, Brachinus da liberação (
D a carga diastólica das batidas pequenas, Brachinus da liberação ( 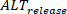 ) são definidos como:
) são definidos como: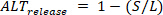 4
4
Inversamente, as Brachinus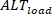 de carga () são definidas como:
de carga () são definidas como: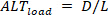 5
5
As medições de Alternans podem ser feitas em todo o tecido inteiro, e os resultados da análise são exibidos no canto inferior direito do módulo. Ao usar o módulo pela primeira vez, a análise é realizada em todo o arquivo experimental, e os resultados exibidos são uma diferença média de batida em todo o arquivo. No entanto, a análise pode ser restrita a horários específicos no arquivo, selecionando manter zoom pressionado, ampliando um período de tempo específico e selecionando analisar seção ampliada. Isso atualizará o painel de resultados para mostrar a análise do período de tempo selecionado.- Selecione reproduzir para mostrar um vídeo Beat-to-Beat da análise de Brachinus. Além disso, selecione criar mapa médio para exportar um mapa do comportamento alternado em média a partir dos pontos de tempo de seleção, que são definidos no menu pop-up ao usar esse recurso.
- Pressione o mapa de fase para iniciar o módulo de mapeamento de fase. Uma transformada de Hilbert é realizada para calcular a fase instantânea (entre-π e + π) dos sinais em cada ponto temporal. Pressione play ou arraste o controle deslizante para visualizar o comportamento da fase ao longo do tempo e clique em um pixel para renderizar um diagrama de fase.
8. exportando dados
- Os dados são exportados do ElectroMap em uma variedade de formulários. Pressione Exportar valores para salvar os valores do mapa exibido no momento na interface principal usada. Os valores medidos podem ser salvos como um mapa (preservando locais de pixel) ou condensados em uma única lista, e podem ser salvos como. csv,. txt ou. Arquivos MAT.
- Pressione Exportar mapa para apresentar um pop-up contendo o mapa atualmente exibido, que pode ser salvo em uma variedade de formatos de imagem. As opções de exibição para o mapa são controladas selecionando configurações do mapa , mas também podem ser editadas após a seleção do mapa de exportação . Por exemplo, uma barra de cores pode ser adicionada selecionando este ícone no menu superior e a escala pode ser definida selecionando editar > mapade cor.
- Pressione vídeo de ativação para renderizar uma animação da sequência de ativação, que pode ser salva como um arquivo. gif animado.
- Pressione segmentar vídeo para salvar um arquivo de vídeo. avi do parâmetro atualmente exibido de cada segmento identificado.
Resultados
Todo o trabalho realizado como parte deste estudo foi realizado de acordo com as diretrizes éticas estabelecidas pela lei de animais (procedimentos científicos) do Reino Unido 1986 e a diretiva 2010/63/UE do Parlamento Europeu sobre a proteção dos animais utilizados para fins científicos. Os experimentos foram aprovados pelo escritório doméstico (mouse: PPL 30/2967 e PFDAAF77F, cobaia: PPL PF75E5F7F) e os conselhos de revisão institucional da Universidade de Birmingham (mouse) e do King ' s College London (cobaia). Métodos detalhados para a coleta dos dados brutos que foram analisados aqui podem ser encontrados em nossas publicações anteriores5,6,14,19.
A interface principal a partir da qual o ElectroMap é controlado é mostrada na Figura 1a. As etapas necessárias para analisar um conjunto de dados são controladas principalmente pelas imagens de carregamento, processar imagense produzir botões de mapas , e são mostradas destacadas em verde, azul e vermelho, respectivamente na Figura 1a. Figura 1b-D mostra as operações que ocorrem na seleção de cada um desses botões. Carregar imagens aplica as opções de limiarização de imagem como selecionado pelo usuário (Figura 1b), enquanto imagens de processo (Figura 1C) aplica filtragem e correção de linha de base. Por fim, os mapas de produção serão os primeiros dados médios de acordo com a janela de tempo e as configurações de segmentação (a menos que a segmentação de batida única seja escolhida) e execute as análises descritas acima.
Um aspecto chave do ElectroMap é a sua flexibilidade em relação ao tipo de câmara e modelo experimental. Isso é crucial para a utilidade de um software de mapeamento óptico devido ao EP cardíaco distinto e às características anatômicas que existem entre os modelos amplamente utilizados. A Figura 2a , por exemplo, mostra a morfologia potencial da ação dos átrios murinos quando comparada ao ventrículo da cobaia, registrada com corantes sensíveis à tensão, conforme relatado anteriormente6,14. Apesar da forma distinta do potencial de ação, e o uso de duas câmeras de mapeamento óptico separadas com diferentes framerates e tamanhos de pixel, o ElectroMap pode ser utilizado para analisar com sucesso ambos os conjuntos de dados. No entanto, isso requer a modificação de alguns parâmetros dentro da interface do usuário (Figura 2b). Observe que o potencial de ação prolongado da cobaia necessita de uma janela de tempo maior. Adicionalmente, para impedir a correção da linha de base do Top-Hat que modifica unphysiologically os sinais opticamente gravados, seu comprimento de tempo deve ser aumentado de modo que seja maior do que o curso do tempo do potencial da ação.
O ElectroMap oferece uma infinidade de opções de processamento para ajudar a melhorar o SNR de sinais opticamente gravados que podem ser necessários para recuperar eficazmente os parâmetros do EP. Um exemplo é a média de Ensemble automatizada dos picos após a segmentação de dados. A Figura 3a-C demonstra como a aplicação da média do Ensemble, no lugar de outros métodos, pode melhorar o SNR dos átrios esquerdos murino isolados (n = 13). Isso reduz a heterogeneidade de medição e a probabilidade de falha na análise (Figura 3D). Por exemplo, uma alteração da frequência de estimulação de 3 Hz a 10 Hz não alterou a APD50, quando não se realizou uma média de Ensemble, mas uma diminuição esperada de29 no APD50 a 10 Hz de estimulação foi observada quando medida a partir de dados médios de Ensemble ( Figura 3E).
A Figura 4 demonstra a eficácia e a utilidade da detecção e segmentação automáticas de frequência de estimulação oferecidas pela electromap. Aqui, os átrios esquerdos do rato (n = 5) foram passeados em um comprimento do ciclo de 120 ms e o comprimento do ciclo foi encurtado incrementalmente por 10 ms até que alcangou 50 ms. o ElectroMap identificou automaticamente o comprimento do ciclo de estimulação e os picos da média do tecido agrupados em conformidade (figura 4a ). Isso foi conseguido com alta precisão em todos os conjuntos de dados (Figura 4B). A segmentação automatizada dos dados permitiu uma análise direta e de alto débito do abrandamento da velocidade de condução com aumento da frequência de estimulação/comprimento do ciclo encurtado (Figura 4C, D). Concomitantemente, a APD50 (Figura 4e) e o intervalo diastólico (Figura 4F) encurtaram. A amplitude dos picos medidos opticamente diminuiu, enquanto o tempo de pico aumentou (figura 4G, H). Estas são outra vez as respostas esperadas da restituição no tecido cardíaco29,30 e o uso do electromap pode ajudar conseqüentemente a elucidar mudanças em resposta à frequência de estimulação na presença de agentes farmacológicos, modificação genética, ou Estados de doença.
Uma consideração importante no uso de um software como o ElectroMap é a presença de artefatos nos dados subjacentes. A Figura 5, por exemplo, demonstra que artefatos de movimento (a distorção do sinal opticamente gravado pelo movimento tecidual) podem impedir medições exatas de ativação e, especialmente, a repolarização dentro do electromap. Consulte discussão para mais considerações.
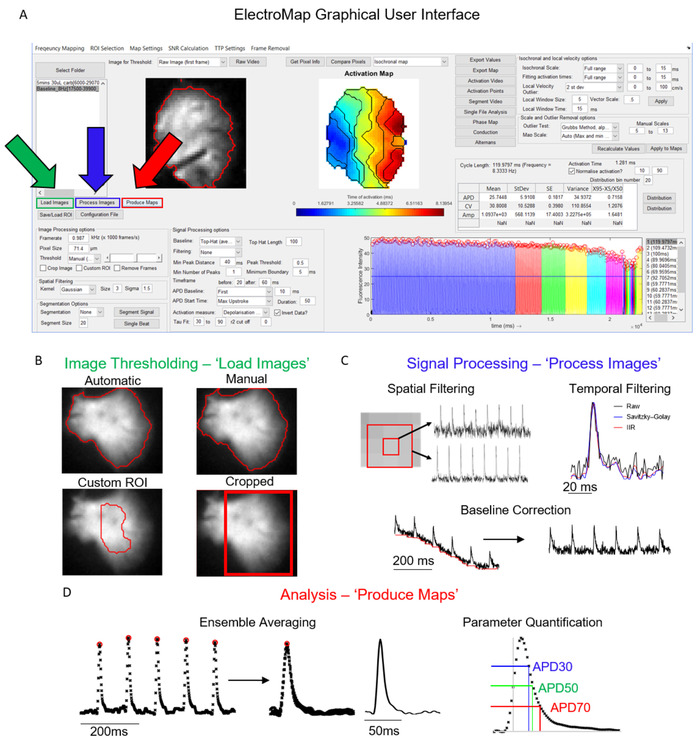
Figura 1: etapas de processamento principais do ElectroMap. (A) interface gráfica do usuário do electromap, com as imagens de carga (verde), imagens de processo (azul), e produzir mapas (vermelho) botões destacados. (B) opções de limiarização de imagem que podem ser aplicadas na seleção de carregar imagens. (C) as opções de processamento de sinal disponíveis para o usuário incluem filtragem espacial e temporal e correção de linha de base e podem ser aplicadas à pilha de imagens pressionando Process images. (D) a média do Ensemble e a quantificação do parâmetro (mostrada a medida APD) que é ativada selecionando produzir mapas. Figura adaptada de o ' Shea et al., 201913. Por favor clique aqui para ver uma versão maior desta figura.
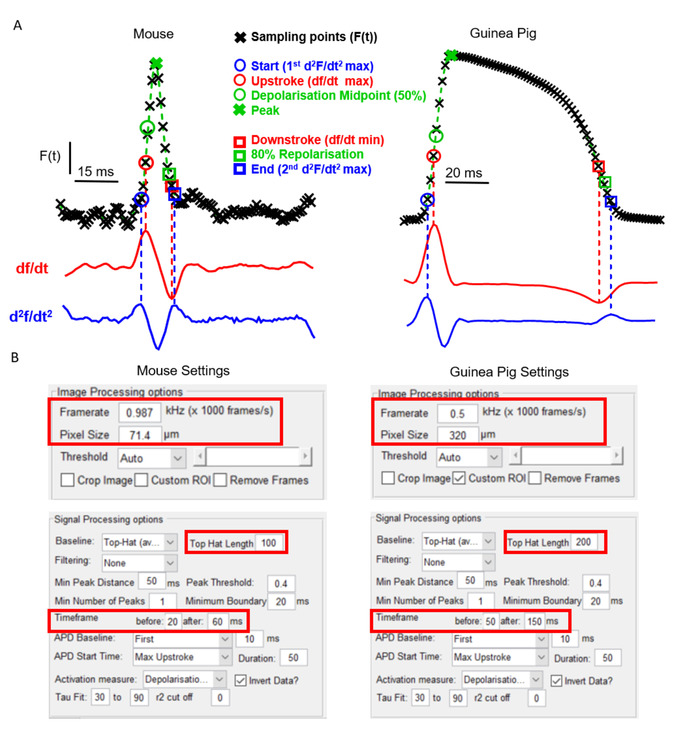
Figura 2: análise de dados do rato e da cobaia utilizando o ElectroMap. (A) potencial de ação gravado opticamente de átrios de camundongo e ventrículos de cobaia, juntamente com o primeiro derivados (DF/DT) e o segundo (d2f/DT2) desses sinais. As várias definições para a ativação e os tempos do repolarização empregáveis dentro de electromap são destacadas. (B) screenshots das configurações de processamento de imagem e de sinal utilizadas na interface electromaps. As caixas vermelhas destacam as configurações que exigiam a modificação entre análises de dados do mouse e da cobaia. Figura adaptada de o ' Shea et al., 201913. Por favor clique aqui para ver uma versão maior desta figura.
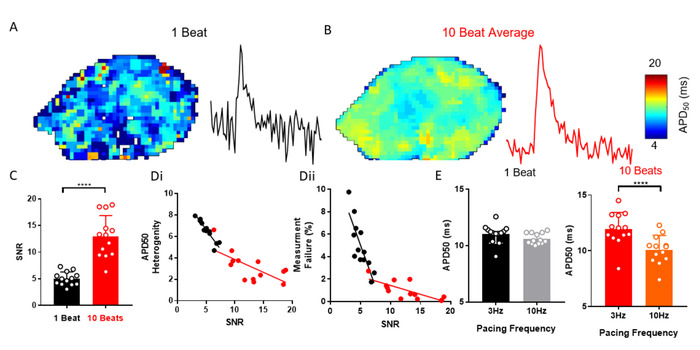
Figura 3: Ensemble média para resolver alterações APD. (A) APD50 mapa e exemplo único sinal do pixel dos potenciais óticos da ação da batida única. (B) APD50 mapa e exemplo de sinal de pixel único de potenciais de ação óptica gerados pela média de Ensemble de 10 batidas sucessivas (método Peak). (C) SNR de batida única em comparação com 10 sinais de batida média. (D) APD50 heterogeneidade (i) e número de falhas de medição (II) em função de SNR para batida única e 10 batimentos de APD em média50 mapas. (E) APD50 at 3 e 10 Hz frequência de estimulação, como medido a partir de batida única e 10 mapas de batida. (Dados mostrados como média ± erro padrão, n = 13 átrios esquerdos, * * * *p < 0, 1 pelo teste tpareado do aluno). Por favor clique aqui para ver uma versão maior desta figura.
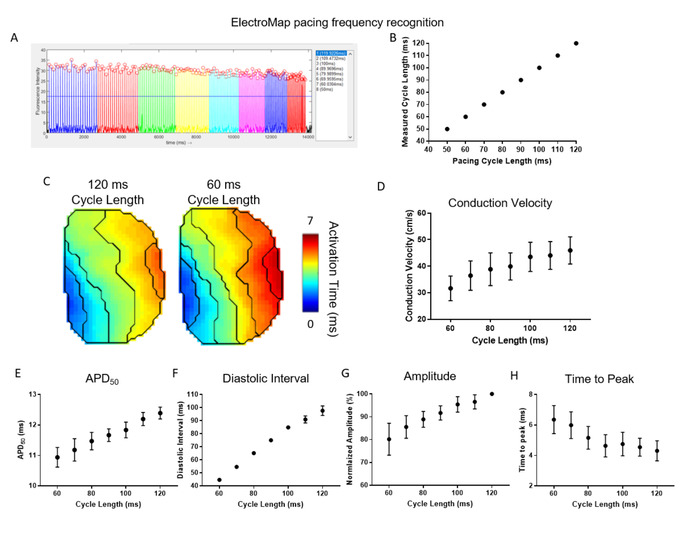
Figura 4: uso do ElectroMap para estudar as respostas de frequência de estimulação no tecido cardíaco. (A) exemplo de screenshot do electromap do reconhecimento e da segmentação da frequência de estimulação. B) comparação dos comprimentos de ciclo de estimulação medidos conhecidos e electromap. (C) mapas de ativação em 120 ms e 60 MS distâncias ciclo de estimulação. (D-H) Dados agrupados de velocidade de condução (D),APD 50 (e), intervalo diastólico (F), amplitude (G) e tempo até o pico (H) em função do comprimento do ciclo de estimulação diminuindo de 120 ms para 60 ms em incrementos de 10 ms. (Dados mostrados como média ± erro padrão, n = 5 átrios esquerdos) Por favor clique aqui para ver uma versão maior desta figura.
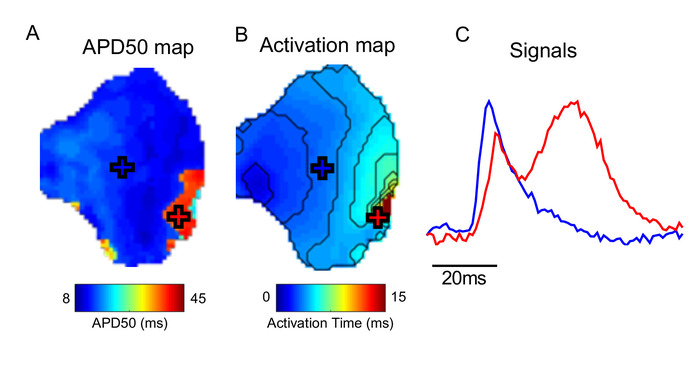
Figura 5: efeito de artefatos de movimento. (A) APD50 Map. (B) mapa de ativação. (C) sinais de exemplo de locais marcados (Cruzes) em APD e mapas de ativação. Na área do tecido marcado com a Cruz Vermelha, a contração não foi desacoplada com sucesso, distorce o sinal óptico medido. Por favor clique aqui para ver uma versão maior desta figura.
Discussão
Aqui, apresentamos um guia passo-a-passo para a utilização do software de código aberto ElectroMap para análise flexível e multivariável de conjuntos de dados de mapeamento óptico cardíaco. Para o uso bem sucedido de ElectroMap, os dados da imagem latente são exigidos para estar em. tif ou. Formatos MAT. O ElectroMap incorpora várias definições de utilizador modificáveis. Como demonstrado na Figura 2a, isso é necessário devido à ampla heterogeneidade que existe entre modelos experimentais e hardware de imagem. Isto significa, no entanto, que as configurações padrão dentro do software não será sempre ideal, então um passo crítico no uso do software é para o usuário para ajustar as configurações para a sua configuração experimental particular. Elas incluem configurações da câmera e escalas temporais, como mostrado na Figura 2b. Uma vez que as configurações ideais foram encontradas, elas podem ser salvas e recarregadas em momentos posteriores selecionando arquivo de configuração.
Incorporação de medição de CL automatizada e segmentação de sinal são as principais vantagens do software. Estas características permitem a análise de respostas agudas em gravações experimentais e amplia a análise do foco em únicas batidas isoladas. Uma vez que a segmentação desejada foi alcançada, o módulo de análise de arquivo único permite a análise automatizada de cada segmento individual (incluindo batidas individuais), percebendo a análise de alta taxa de transferência de várias variáveis em toda a gravação emitida em um arquivo. csv único. Em conjunto, a média de Ensemble dos picos agrupados é um método eficaz para melhorar a qualidade dos sinais ruidosos que são executados automaticamente no ElectroMap. Entretanto, a média do Ensemble não é onipresente benéfica, por exemplo nos estudos da variabilidade Beat-to-Beat. Portanto, o ElectroMap integra a segmentação de batida única para evitar a média de Ensemble, opções de processamento alternativas para melhorar o SNR (filtragem espacial e temporal) e inclui o módulo de análise alternans para investigar e mapear variabilidade batida-à-batida.
Os conjuntos de dados de mapeamento óptico geralmente exibem artefatos como deriva de linha de base e artefatos de movimento. Igualmente, os sinais gerados podem ser de baixa qualidade devido a pequenos tamanhos de pixel, tempos de exposição curtos e baixas alterações fluorescentes fracionárias2. Estes fatores impedem a análise eficaz e exata do comportamento subjacente do EP. Como descrito, o ElectroMap tem várias estratégias de processamento para superar estas questões. No entanto, a aplicação desses algoritmos a dados de qualidade/distorção fundamentalmente pobres ainda impedirá a análise efetiva. O SNR é conseqüentemente um dos parâmetros que é medido e indicado em ElectroMap. Igualmente, o usuário pode selecionar e comparar os sinais de regiões específicas da amostra usando o pixel info e comparar módulos, permitindo a identificação de fenômenos como artefatos de movimento mostrados na Figura 5, e apropriado exclusão de dados.
Atualmente, o ElectroMap não suporta a remoção de artefatos de movimento de dados brutos da mesma forma que a correção de linha de base. Conseqüentemente, um desenvolvimento futuro possível do software é inclusão da remoção do artefacto do movimento por métodos computacionais como foi relatado31,32. Além disso, o ElectroMap está actualmente limitado ao estudo de um sinal óptico. No entanto, para corantes ratiométricos e uso simultâneo de corantes de tensão e cálcio27, é necessário o processamento simultâneo de dois canais de comprimento de onda. A integração da análise de sinal duplo é, portanto, uma importante adição futura ao software. A extensão das opções de análise aplicáveis aos conjuntos de dados arrítmicos, como o rastreamento de singularidades de fase, ampliaria igualmente o escopo do software33,34. Finalmente, várias das opções de análise descritas também podem ser úteis na análise dos dados de mapeamento de eletrodos. De fato, o electromap tem sido usado para analisar os dados de mapeamento de eletrodos apesar da forma de onda contrastante do electrograma20,35, e mais otimização expandirá seu uso para esta modalidade.
Divulgações
A PK recebe apoio de pesquisa de diversas empresas de medicamentos e dispositivos ativas em fibrilação atrial e recebeu honorários de várias dessas empresas. L.F. recebeu pesquisa institucional concede UE, BHF, MRC, DFG e Gilead. A PK e a L.F. estão listadas como inventores em duas patentes detidas pela Universidade de Birmingham (terapia de fibrilação atrial WO 2015140571, marcadores para fibrilação atrial WO 2016012783).
Todos os outros autores não declaram nenhum conflito de interesses potencial.
Agradecimentos
Este trabalho foi financiado pelo EPSRC Studentship (SCI-PHY-4-centro de saúde para a formação de doutoramento L016346) para DP, K.R. e L.F., concessão de sementes de confiança Wellcome Grant (109604/Z/15/Z) para DP, British Heart Foundation subsídios (PG/17/55/33087, RG/17/15/33106) para DP , União Europeia (acordo de subvenção n. º 633196 [CATCH ME] a L.F.), Fundação britânica do coração (FS/13/43/30324 a p. p. e L.F.; PG/17/30/32961 a p. p. e A.H.), e Fundação Leducq para a paixao. JW é apoiado pela British Heart Foundation (FS/16/35/31952).
Materiais
| Name | Company | Catalog Number | Comments |
| MATLAB and Simulink R2018a | Mathworks, Inc, Natick, MA | MATLAB software |
Referências
- Efimov, I. R., Nikolski, V. P., Salama, G. Optical Imaging of the Heart. Circulation Research. 94, 21-33 (2004).
- Herron, T. J., Lee, P., Jalife, J. Optical imaging of voltage and calcium in cardiac cells & tissues. Circulation Research. 110, 609-623 (2012).
- Boukens, B. J., Efimov, I. R. A century of optocardiography. IEEE Reviews in Biomedical Engineering. 7, 115-125 (2014).
- Myles, R. C., Wang, L., Kang, C., Bers, D. M., Ripplinger, C. M. Local β-adrenergic stimulation overcomes source-sink mismatch to generate focal arrhythmia. Circulation Research. 110, 1454-1464 (2012).
- Syeda, F., et al. PITX2 Modulates Atrial Membrane Potential and the Antiarrhythmic Effects of Sodium-Channel Blockers. Journal of the American College of Cardiology. 68, 1881-1894 (2016).
- Winter, J., et al. Sympathetic nervous regulation of cardiac alternans in the intact heart. Frontiers in Physiology. 9, 1-12 (2018).
- Faggioni, M., et al. Suppression of spontaneous ca elevations prevents atrial fibrillation in calsequestrin 2-null hearts. Circulation: Arrhythmia and Electrophysiology. 7, 313-320 (2014).
- Sato, P. Y., et al. Loss of Plakophilin-2 Expression Leads to Decreased Sodium Current and Slower Conduction Velocity in Cultured Cardiac Myocytes. Circulation Research. 105, 523-526 (2009).
- Yu, T. Y., et al. Optical mapping design for murine atrial electrophysiology. Computer Methods in Biomechanics and Biomedical Engineering: Imaging & Visualization. 5, 368-378 (2017).
- Laughner, J. I., Ng, F. S., Sulkin, M. S., Arthur, R. M., Efimov, I. R. Processing and analysis of cardiac optical mapping data obtained with potentiometric dyes. American Journal of Physiology. Heart and Circulatory Physiology. 303, H753-H765 (2012).
- Crocini, C., Ferrantini, C., Pavone, F. S., Sacconi, L. Optogenetics gets to the heart: A guiding light beyond defibrillation. Progress in Biophysics and Molecular Biology. 130, 132-139 (2017).
- Entcheva, E., Bub, G. All-optical control of cardiac excitation: Combined high-resolution optogenetic actuation and optical mapping. The Journal of Physiology. 9, 2503-2510 (2016).
- O’Shea, C., et al. ElectroMap: High-throughput open-source software for analysis and mapping of cardiac electrophysiology. Scientific Reports. 9, 1-13 (2019).
- Yu, T. Y., et al. An automated system using spatial oversampling for optical mapping in murine atria. Development and validation with monophasic and transmembrane action potentials. Progress in Biophysics and Molecular Biology. 115, 340-348 (2014).
- Jaimes, R., et al. Functional response of the isolated, perfused normoxic heart to pyruvate dehydrogenase activation by dichloroacetate and pyruvate. Pflugers Archiv. 468, 131-142 (2016).
- Wang, K., et al. Cardiac tissue slices: preparation, handling, and successful optical mapping. American Journal of Physiology. Heart and Circulatory Physiology. 308, H1112-H1125 (2015).
- Parrish, D. C., et al. Transient denervation of viable myocardium after myocardial infarction does not alter arrhythmia susceptibility. American Journal of Physiology. Heart and Circulatory. , (2017).
- Ihara, K., et al. Electrophysiological Assessment of Murine Atria with High-Resolution Optical Mapping. Journal of Visualized Experiments. (132), e56478 (2018).
- Holmes, A. P., et al. A Regional Reduction in Ito and IKACh in the Murine Posterior Left Atrial Myocardium Is Associated with Action Potential Prolongation and Increased Ectopic Activity. Plos One. 11, e0154077 (2016).
- Lang, D., et al. Arrhythmogenic remodeling of β2 versus β1 adrenergic signaling in the human failing heart. Circulation: Arrhythmia and Electrophysiology. 8, 409-419 (2015).
- Kang, C., et al. Human Organotypic Cultured Cardiac Slices: New Platform For High Throughput Preclinical Human Trials. Scientific Reports. 6, 1-13 (2016).
- Wen, Q., et al. Transverse cardiac slicing and optical imaging for analysis of transmural gradients in membrane potential and Ca2+ transients in murine heart. The Journal of Physiology. 596, 3951-3965 (2018).
- Houston, C., et al. Characterisation of re-entrant circuit (or rotational activity) in vitro using the HL1-6 myocyte cell line. Journal of Molecular and Cellular Cardiology. 119, 155-164 (2018).
- Yu, T. Y., et al. Optical mapping design for murine atrial electrophysiology. Computer Methods in Biomechanics and Biomedical Engineering: Imaging and Visualization. 5, 368-376 (2017).
- Laughner, J. I., Ng, F. S., Sulkin, M. S., Arthur, R. M., Efimov, I. R. Processing and analysis of cardiac optical mapping data obtained with potentiometric dyes. AJP: Heart and Circulatory Physiology. 303, H753-H765 (2012).
- Bayly, P. V., et al. Estimation of Conduction Velocity Vector Fields from Epicardial Mapping Data. IEEE Transactions on Bio-Medical Engineering. 45, 563-571 (1998).
- Jaimes, R., et al. A technical review of optical mapping of intracellular calcium within myocardial tissue. American Journal of Physiology. Heart and Circulatory Physiology. 310, H1388-H1401 (2016).
- Wang, L., et al. Optical mapping of sarcoplasmic reticulum Ca2+ in the intact heart: Ryanodine receptor refractoriness during alternans and fibrillation. Circulation Research. 114, 1410-1421 (2014).
- Winter, J., Shattock, M. J. Geometrical considerations in cardiac electrophysiology and arrhythmogenesis. Europace. , (2016).
- Mironov, S., Jalife, J., Tolkacheva, E. G. Role of conduction velocity restitution and short-term memory in the development of action potential duration alternans in isolated rabbit hearts. Circulation. 118, 17-25 (2008).
- Khwaounjoo, P., et al. Image-Based Motion Correction for Optical Mapping of Cardiac Electrical Activity. Annals of Biomedical Engineering. 43, 1235-1246 (2014).
- Christoph, J., Luther, S. Marker-Free Tracking for Motion Artifact Compensation and Deformation Measurements in Optical Mapping Videos of Contracting Hearts. Frontiers in Physiology. 9, (2018).
- Umapathy, K., et al. Phase Mapping of Cardiac Fibrillation. Circulation: Arrhythmia and Electrophysiology. 3, 105-114 (2010).
- Tomii, N., et al. Detection Algorithm of Phase Singularity Using Phase Variance Analysis for Epicardial Optical Mapping Data. IEEE Transactions on Biomedical Engineering. 63, 1795-1803 (2016).
- Cantwell, C. D., et al. Techniques for automated local activation time annotation and conduction velocity estimation in cardiac mapping. Computers in Biology and Medicine. 65, (2015).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados