Method Article
Analisi ad alta velocità effettiva dei dati di mappatura ottica tramite ElectroMapHigh-Throughput Analysis of Optical Mapping Data Using ElectroMap
In questo articolo
Riepilogo
Questo protocollo descrive la configurazione e l'uso di ElectroMap, una piattaforma software open source basata su MATLAB per l'analisi dei dati di mappatura ottica cardiaca. ElectroMap fornisce uno strumento versatile ad alta produttività per l'analisi di dati di tensione di mappatura ottica e set di dati di calcio in un'ampia gamma di modelli sperimentali cardiaci.
Abstract
La mappatura ottica è una tecnica consolidata per lo studio ad alta risoluzione spatio-temporale dell'elettrofisiologia cardiaca nei preparati multicellulari. Qui presentiamo, in una guida passo-passo, l'uso di ElectroMap per l'analisi, la quantificazione e la mappatura dei set di dati di tensione e calcio ad alta risoluzione acquisiti dalla mappatura ottica. Le opzioni di analisi ElectroMap coprono un'ampia gamma di parametri elettrofisiologici chiave e l'interfaccia utente grafica consente una semplice modifica della pre-elaborazione e delle definizioni dei parametri, rendendo ElectroMap applicabile a una vasta gamma di modelli sperimentali. Mostriamo come il rilevamento della frequenza di stimolazione integrata e la segmentazione del segnale consente l'analisi ad alta velocità di registrazione sperimentale, risposte acute e variabilità singola beat-to-beat. Inoltre, ElectroMap incorpora una media multi-beat automatizzata per migliorare la qualità del segnale di set di dati rumorosi, e qui dimostriamo come questa funzione può aiutare a chiarire i cambiamenti elettrofisiologici che altrimenti potrebbero passare inosservati quando si utilizza singolo analisi del battito. I moduli personalizzati sono inclusi nel software per un'analisi dettagliata della conduzione, dell'analisi di un singolo file e degli alternari, come illustrato di seguito. Questa piattaforma software può essere utilizzata per consentire e accelerare l'elaborazione, l'analisi e la mappatura della complessa elettrofisiologia cardiaca.
Introduzione
La mappatura ottica utilizza reporter fluorescenti di tensione e/o concentrazione di calcio per interrogare l'elettrofisiologia cardiaca (EP) e la manipolazione del calcio in preparati multicellulari, con una risoluzione spaziale maggiore rispetto a quella realizzabile con le tradizionali tecniche1,2,3. Pertanto, la mappatura ottica è emersa come una tecnica importante e sempre più utilizzata, fornendo informazioni chiave sul comportamento elettrico fisiologico e patofisiologico nel cuore3,4,5 ,6,7,8. Un'efficace elaborazione e analisi dei dati ottenuti da esperimenti di mappatura ottica è complicata da diversi fattori. L'elevata risoluzione spatiotemporale dei set di dati di mappatura ottica produce file di video grezzi composti da migliaia di cornici di immagini, ognuna composta da un numero di singoli pixel, che danno origine a file di dati di grandi dimensioni che richiedono un'elevata produttività e automatizzati lavorazione9. Piccole dimensioni dei pixel, carico di coloranti scarsi e irregolari e piccoli cambiamenti frazionari nella fluorescenza provocano segnali ottici con basso rapporto segnale-rumore (SNR), che richiedono la pre-elaborazione prima che un'analisi efficace sia raggiungibile10. L'elaborazione e l'analisi possono essere ulteriormente complicate dall'uso di protocolli di stimolazione optogenetica che utilizzano la luce per avviare l'attivazione, potenzialmente distorcendo il segnale registrato dai sensori fluorescenti11,12. Inoltre, una volta elaborati i dati, è possibile applicare diverse tecniche e definizioni non coerenti per misurare i parametri di interesse, con le tecniche più applicabili che variano a seconda della configurazione sperimentale, del modello e della domanda2, 10,13. Queste limitazioni impediscono un'ulteriore assunzione della tecnologia e ostacolano un'analisi veramente oggettiva.
Per superare queste limitazioni, diversi gruppi di ricerca hanno progettato pipeline di elaborazione personalizzate su misura per il loro modello sperimentale, domanda e hardware7,14,15,16. Altri utilizzano software proprietario commerciale in cui gli algoritmi sottostanti possono essere difficili da accedere4,17. Di conseguenza, vi è una chiara necessità di una piattaforma software open source liberamente disponibile per l'elaborazione e l'analisi dei dati di mappatura ottica. È importante che questo software sia open-source, facile da usare, flessibile alla regolazione dei parametri, applicabile a una gamma di modelli sperimentali con proprietà EP distinte e consente in modo cruciale la quantificazione semplice e regolabile della gamma di parametri che possono essere studiati utilizzando la mappatura ottica.
Recentemente abbiamo pubblicato e rilasciato una piattaforma software completa, ElectroMap, per l'elaborazione, l'analisi e la mappatura di set di dati di mappatura ottica cardiaca13. Qui, presentiamo un manuale video per l'utilizzo di ElectroMap e dimostriamo come può essere utilizzato per elaborare, analizzare e mappare diversi set di dati di mappatura ottica. Ci concentriamo sull'uso di ElectroMap per quantificare le variabili standard di Gestione EP e calcio e dimostriamo l'uso della velocità di conduzione autonoma, analisi di un singolo file e moduli alternati.
Protocollo
1. Raccolta dati di mappatura ottica
- Eseguire la mappatura ottica cardiaca utilizzando uno di una vasta gamma di modelli sperimentali tra cui cuori interi intatti e isolati6,18, atri isolati14,19, cunei ventricolari20, fette cardiache 21 Mieto , 22e monostrati cellulari23. Vedere i riferimenti associati per i progetti sperimentali per raccogliere dati di mappatura ottica non elaborati da questi preparati. A condizione che i dati ottenuti possano essere convertiti in una pila tiff o salvati in un file . MAT file, dovrebbe essere analizzabile utilizzando ElectroMap. Sono inclusi i dati di dimensioni variabili (quadrato/rettangolare) e le risoluzioni (massimo testato attualmente 2048 pixel x 2048 pixel).
2. Installazione e avvio del software
NOTA: di seguito sono descritti in dettaglio i due metodi per l'installazione e l'esecuzione di ElectroMap, ovvero all'interno di MATLAB eseguito dal codice di origine (m) o come file eseguibile autonomo (.exe for windows). Il software finale e la sua funzionalità sono invarianti tra le due opzioni di installazione (diverse da alcune differenze nella navigazione nella directory). Pertanto, le considerazioni principali per la scelta della versione da installare sono l'accesso a MATLAB e alle caselle degli strumenti necessarie e se si desidera l'accesso al codice sorgente. Ove possibile, si consiglia di utilizzare la versione MATLAB per tempi di avvio più rapidi, tempi di elaborazione più brevi e una segnalazione degli errori più semplice.
-
Configurazione 1: elettromappa in esecuzione all'interno di MATLAB
- Installare MATLAB. ElectroMap è stato progettato in MATLAB 2017a, tuttavia, il software è stato testato per l'uso in tutte le versioni successive di MATLAB (fino a 2018b al momento della scrittura). Sono necessarie le seguenti caselle degli strumenti: Elaborazione immagine, Elaborazione del segnale, Statistiche e Apprendimento automatico e Adattamento curva.
- Scaricare/clonare tutti i file dall'ultima versione 'codice sorgente' di ElectroMap dal repository GitHub (https://github.com/CXO531/ElectroMap). Decomprimere il contenuto scaricato nella posizione desiderata.
- Aprire MATLAB e passare al percorso della cartella che ospita il codice sorgente ElectroMap. Aprire quindi il file ElectroMap.m e premere run nell'editor oppure digitare ElectroMap nella finestra di comando e premere INVIO. Verrà avviata l'interfaccia utente ElectroMap, Figura 1A.
-
Installazione 2: file .exe autonomo
- Scaricare il file del programma di installazione: https://drive.google.com/open?id=1nJyI07w9WIt5zWcit0aEyIbtg31tANxI.
- Seguire le istruzioni del programma di installazione, che scaricherà richiesto il runtime MATLAB dal web insieme al software ElectroMap.
- Eseguire ElectroMap.exe.
NOTA: il tempo di avvio per la versione standalone può essere di diversi minuti.
3. Caricamento e pre-elaborazione delle immagini
- Premere Seleziona cartella e passare alla posizione dei file di dati da analizzare. In questo modo la casella di riepilogo a sinistra verrà popolata con tutti i file all'interno di tale directory che sono del tipo di file corretto (.tif o . MAT). . I file MAT devono contenere solo la variabile dello stack di immagini.
NOTA: durante lo spostamento nel selettore di directory verranno visualizzate solo le cartelle e non i singoli file. - Selezionare il file da caricare dall'interno dell'interfaccia e premere Carica immagini.
- Una volta caricato, apparirà il primo fotogramma e il contorno rosso indicherà la soglia automatica dell'immagine. Se necessario, ricaricare i ROI utilizzati in precedenza selezionando Salva/Carica ROI. In questo caso, saltare il passaggio 3.3.
- Per impostazione predefinita, la soglia si basa sulle intensità dei pixel nel primo fotogramma. Se lo si desidera, modificarla a una soglia in base all'ampiezza del percorso del tempo del segnale modificando l'opzione nel menu a discesa Immagine per soglia. Si prega di notare che una volta selezionata la soglia, viene quindi applicato per l'intero stack di immagini.
- Se lo si desidera, modificare l'opzione di soglia su manuale, che attiverà il dispositivo di scorrimento per regolare manualmente la soglia dell'immagine. Inoltre, ritagliare le immagini (Ritaglia immagine) e/o disegnare un'area di interesse personalizzata (ROI personalizzato) per l'analisi selezionando le caselle di controllo appropriate sotto le opzioni di soglia. Si noti che le opzioni avanzate per la selezione dell'area di interesse, ad esempio il numero di aree, sono disponibili da Selezione ROI nel menu in alto.
- Una volta applicata una soglia appropriata, premere Elabora immagini per applicare l'elaborazione. Le impostazioni per l'elaborazione sono descritte in dettaglio di seguito (passaggio 3.4.1-3.4.5). A questo punto, assicurarsi che siano state immesse le impostazioni corrette della fotocamera. Queste sono le dimensioni dei pixel in : (IMPORTANTE: questa è la dimensione in pixel dell'immagine, e non le dimensioni dei pixel che compongono il chip o l'hardware equivalente nel dispositivo di imaging) e Framerate in kHz.
- Per l'inversione del segnale, selezionare la casella di controllo Inverti dati per abilitare. Se segnalato segnale fluorescente è inversamente proporzionale al parametro di interesse (come con i coloranti potentiometrici comunemente utilizzati) il segnale può essere invertito.
- Per il filtro spaziale, selezionare Gaussiano o Media dal menu del kernel. La dimensione dell'area mediata spazialmente è controllata dall'ingresso Dimensione adiacente al menu a discesa Kernel (cioè 3 genera un kernel di filtro 3 x 3 pixel). Quando si applica un filtro gaussiano, la deviazione standard può essere impostata anche dall'ingresso Sigma.
- Per la correzione della linea di base, selezionare Correzione a cappello24 o polinomiale (4o 11 gradi)dal menu Linea di base. La correzione può essere applicata a ogni pixel singolarmente (tempo di elaborazione prolungato) o come media dell'intera immagine (più veloce ma presuppone alterazioni della linea di base omogenee). La correzione del cappello superiore può essere modificata anche impostando la lunghezza del cappello in millisecondi, adiacente al menu a discesa di selezione della linea di base. La lunghezza del kernel Top-Hat deve essere maggiore della scala cronologica dei singoli potenziali di azione/transitori di calcio.
- Per il filtro temporale, selezionare Filtro Savitzky-Goaly o IIR (Infinite Impulse) dal menu Filtro.
NOTA: Oltre al segnale media del tessuto che appare in basso a sinistra, il filtraggio temporale viene applicato a ciascun pixel singolarmente al momento della quantificazione dei parametri dagli intervalli di immagini medi dell'ensemble. Questo è stato implementato per ridurre i tempi di elaborazione filtrando piccole sezioni di dati quando necessario, piuttosto che interi file. - Per la rimozione dei fotogrammi, si noti che se è selezionata l'opzione Rimuovi fotogrammi, è possibile rimuovere grandi picchi con ampiezza maggiore del segnale di interesse dal set di immagini. Questo può essere utile in set di dati a ritmo ottico come il ritmo optogenetico in cui la depolarizzazione viene avviata dall'attivazione ottica di operazioni come la channelrhodopsin 211,12.
NOTA: poiché la rimozione dei fotogrammi potrebbe introdurre modifiche non fisiologiche ai passaggi nei segnali dell'immagine, il filtraggio temporale può introdurre artefatti nei dati e quindi non è raccomandato qui.
- Si noti che il segnale verrà segmentato una volta che l'opzione Elabora immagini è stata selezionata in base alle opzioni di segmentazione,tuttavia questo può essere rapidamente modificato senza rielaborare l'intero set di dati (vedere la sezione 4).
4. Segmentazione dei dati e media dell'insieme
NOTA: Una volta che il file è stato elaborato, i picchi nel segnale media dei tessuti (traccia in basso a destra, Figura 1A) saranno stati rilevati ed etichettati da cerchi rossi. Vengono conteggiati solo i picchi superiori a una soglia impostata (linea blu sulla traccia impostata dalla sogliadi picco). Inoltre, i picchi vengono conteggiati solo se sono sufficientemente ritardati rispetto ai picchi precedenti, impostati dall'ingresso Distanza di picco min. Il segnale viene quindi segmentato in base ai picchi rilevati. In primo luogo, la lunghezza effettiva del ciclo (CL) di ogni picco viene calcolata misurando il tempo tra esso e il picco successivo. Se un numero di picchi (impostato dall'input Numero minimo di picchi) ha CL simili (soglia per la quale è impostato da Input limite minimo), vengono raggruppati e il CL medio per tali picchi calcolati.
- Per un'ulteriore segmentazione dei dati, premere Segment Signal. Le opzioni di sottosegmentazione sono: Nessuno – tutti i picchi con lo stesso CL raggruppati insieme; Tutto: vengono identificati segmenti di npicchi entro i tempi CL costanti (npicchi sono impostati dall'input Dimensione segmento); Ultimo – Ipicchi finali n prima di una modifica CL vengono identificati e raggruppati e tutti gli altri non vengono analizzati; e Single Beat – Equivale ad applicare la segmentazione Tutti con npicchi , 1 e quindi non viene applicato alcun raggruppamento o media dell'insieme (vedere 4.5). Questo può essere applicato selezionando il pulsante Battuta singola.
- Applicare la segmentazione personalizzata del segnale ingrandendo un momento di interesse e selezionando Segnale di segmento. Verrà aggiunta un'opzione aggiuntiva intitolata Sezione ingrandita alla casella di riepilogo della sezione, corrispondente ai punti temporali selezionati.
- I risultati della segmentazione appariranno nella casella di riepilogo adiacente al segnale mediato del tessuto e mostreranno il numero di sezione e il CL stimato. Tutte le sezioni temporali segmentate sono indicate da colori diversi. Selezionare un segmento dalla casella di riepilogo per evidenziare la sezione in rosso. Questo attiverà automaticamente anche le analisi di questa sezione, come se fosse stato selezionato il pulsante Produce Maps (vedi sezione 5).
- Le analisi dei picchi raggruppati verranno eseguite sui dati "in media dell'insieme". Ciò comporta la media dei picchi in un segmento insieme, con i tempi di riferimento i picchi identificati nel passaggio 4.2. Aggiornare l'intervallo di tempo per la media modificando gli ingressi prima e dopo e premendo Segment Signal.
5. Potenziale d'azione/durata transitoria del calcio e analisi della velocità di conduzione
- Una volta elaborate le immagini, il pulsante Produce Maps diventerà attivo. Premere Produce Maps per applicare la durata del potenziale di azione (APD), il tempo di attivazione, la velocità di conduzione e l'analisi SNR. Per impostazione predefinita, l'analisi verrà applicata al primo segmento di segnale. Seleziona altri segmenti dalla casella di riepilogo applicherà l'analisi al segmento selezionato.
NOTA: i risultati dell'analisi vengono visualizzati nella tabella dei risultati, tra cui la media, la deviazione standard, l'errore standard, la varianza e l'analisi dal quinto al 95o percentile. Le mappe di durata sono tuttavia definite mappe "APD", i segnali di calcio elaborati utilizzando le stesse impostazioni misureranno la durata transitoria del calcio. - Selezionare Ottieni informazioni pixel per visualizzare una visualizzazione dettagliata del segnale da qualsiasi pixel all'interno dell'immagine e Confronta pixel per tracciare contemporaneamente i segnali da un massimo di 6 posizioni.
- Utilizzare il pannello Elaborazione segnale per regolare le impostazioni per l'analisi della durata. Questi sono: Durata – Tempo di percentuale di ripolarizzazione/decadimento per misurare dal picco; Base 'APD': periodo di tempo del segnale definito come linea di base di riferimento per le misurazioni di ampiezza; e 'APD' Ora di inizio– Ora di inizio per le misurazioni della durata. Queste sono le stesse opzioni per decidere il tempo di attivazione per le mappe isocroniche (discusse di seguito) e sono definite: Start ( d2F/dt2max), Upstroke (dF/dtmax), Depolarizzazione del punto medio (tempo di ampiezza del 50%), Picco (tempo di massima ampiezza). Queste definizioni applicate ai potenziali di azione di topi e cavie sono illustrate nella Figura 2A.
NOTA: se si modifica una di queste opzioni, la mappa della durata e la tabella dei risultati verranno aggiornate automaticamente. Sono disponibili anche le opzioni di rimozione della scala della mappa e dell'outlier.
- Utilizzare il pannello Elaborazione segnale per regolare le impostazioni per l'analisi della durata. Questi sono: Durata – Tempo di percentuale di ripolarizzazione/decadimento per misurare dal picco; Base 'APD': periodo di tempo del segnale definito come linea di base di riferimento per le misurazioni di ampiezza; e 'APD' Ora di inizio– Ora di inizio per le misurazioni della durata. Queste sono le stesse opzioni per decidere il tempo di attivazione per le mappe isocroniche (discusse di seguito) e sono definite: Start ( d2F/dt2max), Upstroke (dF/dtmax), Depolarizzazione del punto medio (tempo di ampiezza del 50%), Picco (tempo di massima ampiezza). Queste definizioni applicate ai potenziali di azione di topi e cavie sono illustrate nella Figura 2A.
- Anche la velocità di conduzione viene misurata automaticamente all'interno dell'interfaccia software principale. Ciò si ottiene utilizzando il metodo multi-vettore di Bayly et al26 dalla mappa isoarta definita dalla misura di attivazione scelta (discussa nel passaggio 5.4). Premere Punti di attivazione per eseguire il rendering di una rappresentazione 3D della mappa di attivazione.
- Il metodo di misurazione della velocità di conduzione multivettore segmenta spazialmente la mappa isocronica in regioni di n x n pixel. Impostare il valore di n utilizzando l'input Dimensione finestra locale e impostare l'intervallo di tempi di attivazione per applicare l'analisi all'utilizzo degli input Tempi di attivazione adattamento.
NOTA: per ogni regione locale è disponibile una superficie polinomiale, f, che meglio descrive la relazione tra tempo di attivazione e posizione spaziale (x,y). Il vettore di gradiente, CVlocal, di questa superficie viene quindi calcolato come: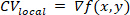 ①
①
dove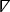 indica l'operatore differenziale spaziale cartesiano bidimensionale26.
indica l'operatore differenziale spaziale cartesiano bidimensionale26. - Per ogni pixel nella mappa isocronica, viene calcolato un vettore locale che rappresenta la velocità e la direzione di conduzione. Selezionare Mappa isocronologia con vettori dal menu a discesa di visualizzazione per visualizzare questa analisi.
- SNR viene calcolato come rapporto tra l'ampiezza massima rispetto alla deviazione standard del segnale al basale. Questa analisi viene eseguita dopo tutti i passaggi di elaborazione. Premere il calcolo SNR nel menu in alto per modificare le impostazioni per il periodo del segnale definito come linea di base.
6. Modulo di analisi della conduzione
- Premere Conduzione per accedere ad un'analisi più dettagliata della velocità di conduzione. Si apre un modulo separato in cui la conduzione può essere quantificata utilizzando il metodo Multi-vector Bayly come nell'interfaccia principale, metodi a vettore singolo e come curva di attivazione.
- Premere Single Vector per analizzare la conduzione utilizzando il metodo a singolo vettore, in cui CV viene calcolato dal ritardo nel tempo di attivazione tra due punti. Questa operazione può essere eseguita utilizzando i metodi Automatic o Manual, selezionabili sotto il pulsante Vettore singolo.
- Per il metodo a vettore singolo automatico, selezionare una distanza e un punto iniziale da cui misurare la conduzione. Il software eseguirà quindi una sweep di 360 gradi dal punto selezionato, misurando il ritardo di tempo e calcolando la velocità di conduzione associata lungo tutte le direzioni in incrementi di 1 grado. I risultati di questa analisi vengono visualizzati nel grafico adiacente alla mappa e la direzione di conduzione più lenta viene visualizzata in rosso.
- Per il metodo a vettore singolo manuale, scegliere un punto iniziale e un punto finale dalla mappa isocronologica per calcolare la velocità di conduzione. Per selezionare un nuovo punto iniziale, premere Cancella punto iniziale.
- Premere Vettore locale per applicare il metodo multivettore, con le impostazioni corrispondenti a quelle dell'interfaccia principale. All'interno del modulo di conduzione, è possibile visualizzare la distribuzione delle velocità di conduzione, nonché la distribuzione angolare dei vettori calcolati e la dipendenza angolare della velocità di conduzione.
- Premere la curva di attivazione per tracciare la percentuale di tessuto attivata in funzione del tempo. Viene visualizzata automaticamente l'attivazione del tempo al 100%, mentre è possibile selezionare automaticamente i valori personalizzati per le percentuali di attivazione minime (blu) e massime (rosse) tra cui misurare.
7. Ulteriori analisi e moduli
- Oltre alle analisi della durata e della velocità di conduzione eseguite automaticamente, è possibile quantificare diversi altri parametri utilizzando ElectroMap. Queste analisi sono selezionabili dal menu a discesa sopra la mappa di visualizzazione. Selezionare una di queste opzioni per eseguire l'analisi e i risultati verranno visualizzati nella riga 4 della tabella dei risultati: 1) Intervallo diastolico – Tempo dal 90% di ripolarizzazione al tempo di attivazione del potenziale di azione successivo; 2) Frequenza dominante – Lo spettro di frequenza di ogni pixel viene calcolato utilizzando la trasformazione veloce di Fourier, e la frequenza con la maggior potenza è definita come la frequenza dominante. Le impostazioni avanzate di intervallo e finestra per l'analisi della frequenza dominante sono disponibili selezionando Mappatura frequenza; 3) Tempo di picco – Il tempo di aumento tra due percentuali selezionate dall'utente (predefinito da 10 a 90%) della fase di depolarizzazione del potenziale d'azione o del rilascio di calcio. I valori percentuali possono essere modificati selezionando Impostazioni TTP; e 4) Costante di rilassamento ()– La costante di rilassamento viene calcolata montando un decadimento mono-esponenziale della forma della forma:
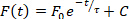 ②
②
dove il livello di fluorescenza al momento t dipende dalla fluorescenza di picco, F0e dal decadimento successivo (C è una costante)27. Il valore tra il quale adattare l'equazione 2 sono selezionabili all'interno delle interfacce utente principali di ElectroMap, nonché una bontà dei criteri di esclusione di adattamento in base al valore r 2. - Premere Single File Analysis per aprire un modulo dedicato per la durata ad alta velocità effettiva e l'analisi della conduzione di ogni segmento identificato in un file. L'analisi può essere eseguita sull'intera immagine (durata, conduzione e tempo di attivazione) o su regioni selezionate o punti di interesse (attualmente solo durata). I risultati vengono restituiti in un file CSV.
NOTA: per i valori APD dell'intera immagine, la prima colonna nel file CSV è la media, mentre la seconda colonna è la deviazione standard. - Premere Alternans per avviare un modulo autonomo per l'analisi dedicata e la mappatura della variabilità beat-to-beat. Vedere O'Shea et al. 201913 per informazioni dettagliate sulle opzioni di elaborazione e analisi delle opzioni di elaborazione e analisi degli alternani. In particolare, questo modulo è progettato per identificare due oscillazioni del periodo, note come alternani. Sia gli alternari di durata che di ampiezza vengono calcolati e restituiti.
NOTA: le alternanza di durata vengono misurate confrontando la misurazione della durata da un picco al successivo; cioè se il picco uno e due e APD1 e APD2 rispettivamente, allora la durata alternana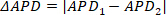 ③
③
La misurazione della durata viene eseguita utilizzando le impostazioni nell'interfaccia principale. Nel frattempo, gli alternanzi di ampiezza possono essere quantificati e mappati tra preparazioni multicellulari come cambiamento assoluto (definito come percentuale in cui 0% - stessa ampiezza tra un battito e l'altro). Inoltre, gli effetti di fenomeni come il carico di calcio possono essere ulteriormente studiati misurando e confrontando le alternanarie di carico e rilascio, come è stato precedentemente riportato28. Se L è definito come l'ampiezza di picco dei grandi battiti (cioè dove l'ampiezza è maggiore del battito precedente), S l'ampiezza dei piccoli battiti eD il carico diastolico dei piccoli battiti, il rilascio alternans (
precedente), S l'ampiezza dei piccoli battiti eD il carico diastolico dei piccoli battiti, il rilascio alternans ( 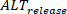 ) sono definiti come:
) sono definiti come: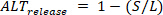 ④
④
Al contrario, le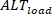 alternanni di carico ( ) sono definite come:
alternanni di carico ( ) sono definite come: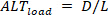 ⑤
⑤
Le misurazioni alternativi possono essere effettuate su tutto il tessuto e i risultati dell'analisi vengono visualizzati in basso a destra del modulo. Quando si utilizza il modulo per la prima volta, l'analisi viene eseguita su tutto il file sperimentale e i risultati visualizzati sono una differenza di beat-beat media nell'intero file. Tuttavia, l'analisi può essere limitata a orari specifici del file deselezionando Tieni premuto lo zoom, ingrandendo un periodo di tempo specifico e selezionando Analizza sezione ingrandita. Questo aggiornerà il pannello dei risultati per mostrare l'analisi del periodo di tempo selezionato.- Selezionare play per visualizzare un video beat-to-beat dell'analisi alternano. Inoltre, selezionare Crea mappa media per esportare una mappa del comportamento alternano mediato dai punti temporali selezionati, impostati nel menu a comparsa quando si utilizza questa funzione.
- Premere Fase Mappa per avviare il modulo di mappatura di fase. Una trasformazione di Hilbert viene eseguita per calcolare la fase istantanea (tra -e ) dei segnali in ogni punto temporale. Premere il dispositivo di scorrimento riproduzione o trascinamento per visualizzare il comportamento della fase nel tempo e fare clic su un pixel per eseguire il rendering di un diagramma di fase.
8. Esportazione dei dati
- I dati vengono esportati da ElectroMap in una varietà di forme. Premere Esporta valori per salvare i valori della mappa attualmente visualizzata nell'interfaccia principale utilizzata. I valori misurati possono essere salvati come mappa (preservando le posizioni dei pixel) o condensati in un unico elenco e possono essere salvati come .csv,.txt o . MAT.
- Premere Esporta mappa per visualizzare un popup contenente la mappa attualmente visualizzata, che può quindi essere salvata in una varietà di formati di immagine. Le opzioni di visualizzazione per la mappa vengono controllate selezionando Impostazioni mappa, ma possono essere modificate anche dopo aver selezionato Esporta mappa. Ad esempio, è possibile aggiungere una barra dei colori selezionando questa icona dal menu in alto e la scala può essere impostata selezionando Modifica > Mappa colori.
- Premere Video di attivazione per eseguire il rendering di un'animazione della sequenza di attivazione, che può essere salvata come file .gif animato.
- Premere SegmentO Video per salvare un file video .avi del parametro attualmente visualizzato di ogni segmento identificato.
Risultati
Tutto il lavoro svolto nell'ambito di questo studio è stato intrapreso in conformità con gli orientamenti etici stabiliti dalla legge britannica sugli animali (procedure scientifiche) del 1986 e dalla direttiva 2010/63/EU del Parlamento europeo sulla protezione degli animali utilizzati per scopi scientifici. Gli esperimenti sono stati approvati dall'ufficio di casa (mouse: PPL 30/2967 e PFDAAF77F, cavia: PPL PF75E5F7F) e dai comitati di revisione istituzionale presso l'Università di Birmingham (topo) e dal King's College di Londra (guinea pig). Metodi dettagliati per la raccolta dei dati grezzi che sono stati analizzati qui possono essere trovati nelle nostre pubblicazioni precedenti5,6,14,19.
L'interfaccia principale da cui è controllato ElectroMap è illustrata nella Figura 1A. I passaggi necessari per analizzare un set di dati sono controllati principalmente dai pulsanti Carica immagini, Elabora immaginie Produci mappe e vengono visualizzati evidenziati rispettivamente in verde, blu e rosso nella Figura 1A. Figura 1B-D Mostra le operazioni che si verificano sulla selezione di ciascuno di questi pulsanti. Carica immagini applica le opzioni di soglia dell'immagine selezionate dall'utente (Figura 1B), mentre Elabora immagini (Figura 1C) applica il filtro e la correzione della linea di base. Infine, Produce Maps eseguirà prima la media dei dati in base all'intervallo di tempo e alle impostazioni di segmentazione (a meno che non venga scelta la segmentazione del singolo beat) e quindi eseguirà le analisi descritte in precedenza.
Un aspetto chiave di ElectroMap è la sua flessibilità rispetto al tipo di fotocamera e al modello sperimentale. Questo è fondamentale per l'utilità di un software di mappatura ottica a causa delle distinte caratteristiche cardiache e anatomiche che esistono tra i modelli ampiamente utilizzati. La figura 2A, ad esempio, mostra il potenziale di morfologia dell'azione degli atri atri rispetto al ventricolo della cavia, registrato utilizzando coloranti sensibili alla tensione come riportato in precedenza6,14. Nonostante la forma distinta del potenziale di azione e l'uso di due videocamere di mappatura ottica separate con framerate e dimensioni dei pixel diversi, ElectroMap può essere utilizzato per analizzare correttamente entrambi i set di dati. Tuttavia, ciò richiede la modifica di alcuni parametri all'interno dell'interfaccia utente (Figura 2B). Si noti che il potenziale di azione prolungata di cavie richiede una finestra temporale più ampia. Inoltre, per evitare che la correzione della linea di base top-hat modifichi in modo non manuale i segnali registrati otticamente, la sua lunghezza di tempo deve essere aumentata in modo che sia maggiore del corso temporale del potenziale di azione.
ElectroMap offre una moltitudine di opzioni di elaborazione per contribuire a migliorare la SNR dei segnali registrati otticamente che possono essere necessari per recuperare efficacemente i parametri EP. Un esempio è costituito dalla media automatica dell'insieme dei picchi che seguono la segmentazione dei dati. Nella figura 3A-C viene illustrato come l'applicazione dell'insieme in media, al posto di altri metodi, possa migliorare la SNR da atria sinistra murina isolata (n - 13). Ciò riduce l'eterogeneità di misurazione e la probabilità di fallimento dell'analisi (Figura 3D). Ad esempio, un cambiamento della frequenza di stimolazione da 3 Hz a 10 Hz non ha alterato APD50, quando non viene intrapresa alcuna media dell'insieme, tuttavia è stata osservata una diminuzione prevista di29 in APD50 a 10 Hz di ritmo quando misurata da dati medi ensemble ( Figura 3E).
Figura 4 dimostra l'efficacia e l'utilità del rilevamento automatico della frequenza di stimolazione e segmentazione offerto da ElectroMap. Qui, gli atri atri atola a sinistra del topo (n e 5) sono stati accelerati a una lunghezza del ciclo di 120 ms e la lunghezza del ciclo è stata accorciata in modo incrementale di 10 ms fino a raggiungere i 50 ms. ). Ciò è stato ottenuto con alta precisione in tutti i set di dati (Figura 4B). La segmentazione automatizzata dei dati ha consentito un'analisi semplice e ad alta velocità effettiva del rallentamento della velocità di conduzione con maggiore frequenza di stimolazione/lunghezza del ciclo accorciata (Figura 4C,D). Contemporaneamente, APD50 (Figura 4E) e intervallo diastolico (Figura 4F) abbreviati. L'ampiezza dei picchi misurati otticamente è diminuita, mentre il tempo al picco è aumentato (Figura 4G,H). Queste sono ancora una volta le risposte di restituzione previste nel tessuto cardiaco29,30 e l'uso di ElectroMap può quindi aiutare a chiarire i cambiamenti in risposta alla frequenza di stimolazione in presenza di agenti farmacologici, modificazione genetica, o stati di malattia.
Una considerazione importante nell'uso di un software come ElectroMap è la presenza di artefatti nei dati sottostanti. Figura 5, per esempio dimostra che gli artefatti di movimento (la distorsione del segnale registrato otticamente dal movimento del tessuto) possono impedire misurazioni accurate di attivazione e in particolare la ripolarizzazione all'interno di ElectroMap. Vedere Discussione per ulteriori considerazioni.
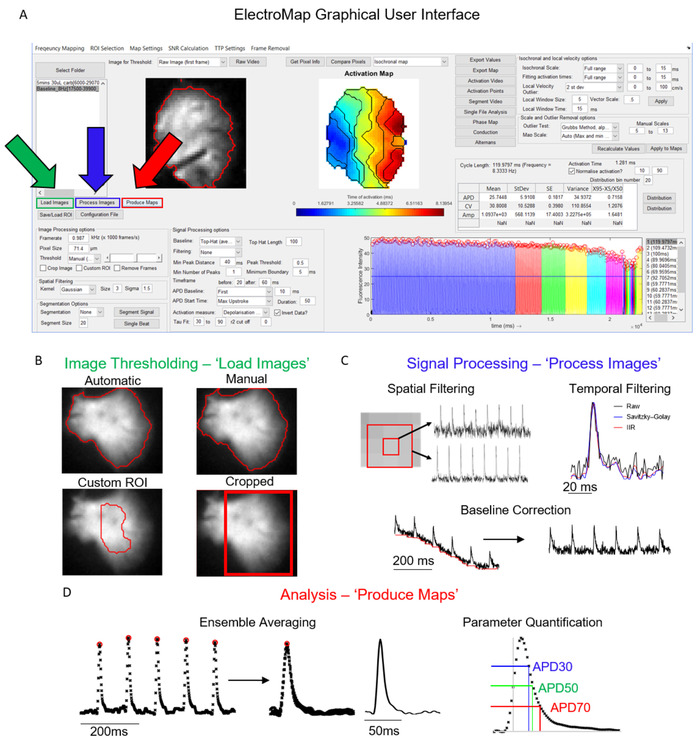
Figura 1: passaggi di elaborazione principali di ElectroMap.Figure 1: ElectroMap main processing steps. (A) Interfaccia utente grafica di ElectroMap, con i pulsanti Carica immagini (verde), Immagini di processo (blu) e Produci mappe (rosso) evidenziati. (B) Opzioni di soglia delle immagini che possono essere applicate selezionando Carica immagini. (C) Le opzioni di elaborazione del segnale disponibili per l'utente includono il filtraggio spaziale e temporale e la correzione della linea di base e possono essere applicate alla pila di immagini premendo Immagini di processo. (D) Media dell'insieme e quantificazione dei parametri (indicata misurazione APD) attivata selezionando Produce Maps. Figura adattata da O'Shea et al., 201913. Fare clic qui per visualizzare una versione più grande di questa figura.
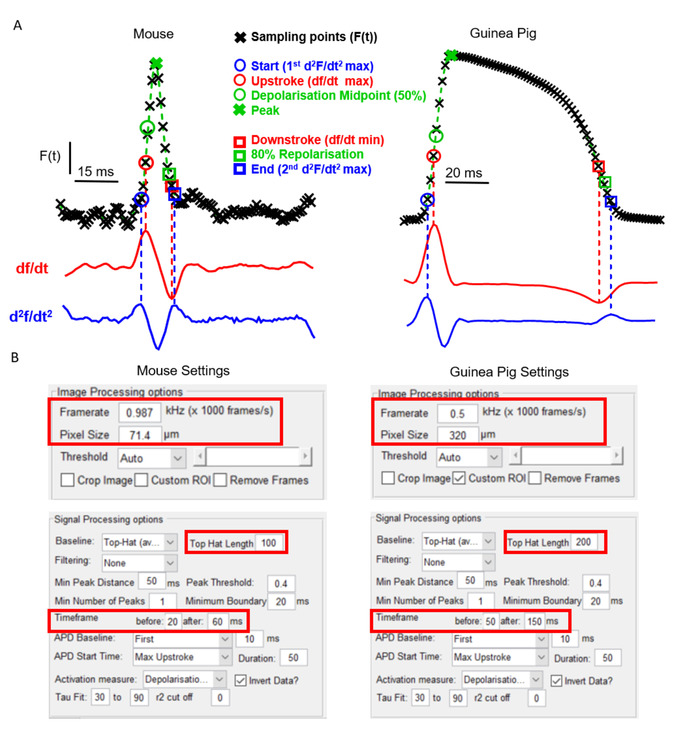
Figura 2: Analisi dei dati di topi e cavia utilizzando ElectroMap. (A) Potenziale d'azione registrato otticamente dagli atri e dai ventricoli delle cavie,insieme sia alprimo (df/dt) che al secondo (df/dt) derivato di questi segnali. Vengono evidenziate le varie definizioni per l'attivazione e la ripolarizzazione dei tempi impiegabili all'interno di ElectroMap. (B) Screenshot delle impostazioni di elaborazione dell'immagine e del segnale utilizzate nell'interfaccia ElectroMaps. Le caselle rosse evidenziano le impostazioni che richiedevano la modifica tra analisi dei dati di topi e cavia. Figura adattata da O'Shea et al., 201913. Fare clic qui per visualizzare una versione più grande di questa figura.
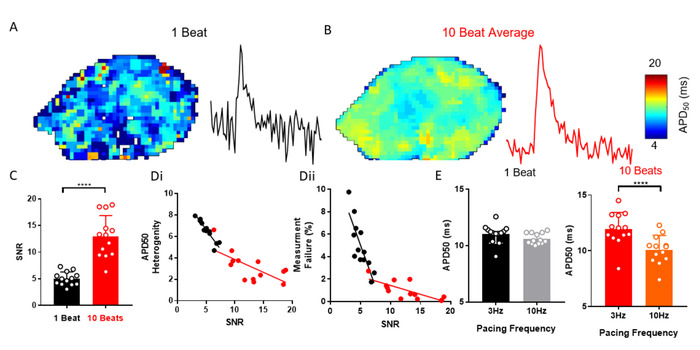
Figura 3: Insidia dell'insieme per risolvere le modifiche di APD. (A) Mappa APD50 ed esempio di segnale di singolo pixel da potenziali di azione ottica a batte singolo. (B) Mappa APD50 ed esempio di segnale a pixel singolo da potenziali di azione ottica generati dall'insieme in media di 10 battute successive (metodo di picco). (C) SNR di singolo battito rispetto a 10 beat segnali mediati. (D) APD50 eterogeneità (i) e numero di errori di misurazione (ii) in funzione della SNR per singolo battito e 10 beat media mappe APD50. (E) APD50 a frequenza di stimolazione a 3 e 10 Hz, misurata da mappe a battito singolo e a 10 battute. (Dati come media : errore standard, n - 13 atri di sinistra, p < 0,001 dal test taccoppiato dello studente). Fare clic qui per visualizzare una versione più grande di questa figura.
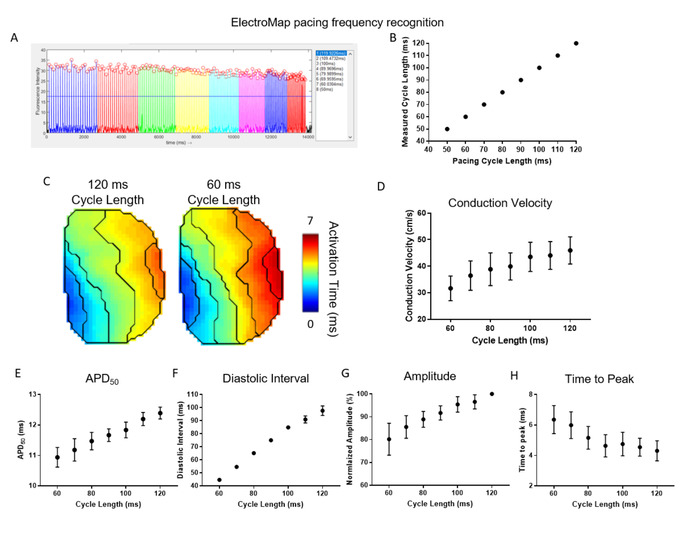
Figura 4: Uso di ElectroMap per studiare le risposte di frequenza del ritmo nel tessuto cardiaco. (A) Esempio di schermata ElectroMap del riconoscimento e della segmentazione della frequenza di stimolazione. (B) Confronto tra lunghezze del ciclo di stimolazione note ed ElectroMap misurate. (C) Mappe di attivazione a lunghezze del ciclo di stimolazione di 120 ms e 60 ms. (D-H) Dati raggruppati della velocità di conduzione (D), APD50 (E, intervallo diastolico (F), ampiezza (G) e tempo al picco (H) in funzione della lunghezza del ciclo di stimolazione decrescente da 120 ms a 60 ms in incrementi di 10 ms. (Dati indicati come media : errore standard, n - 5 atri sinistro) Fare clic qui per visualizzare una versione più grande di questa figura.
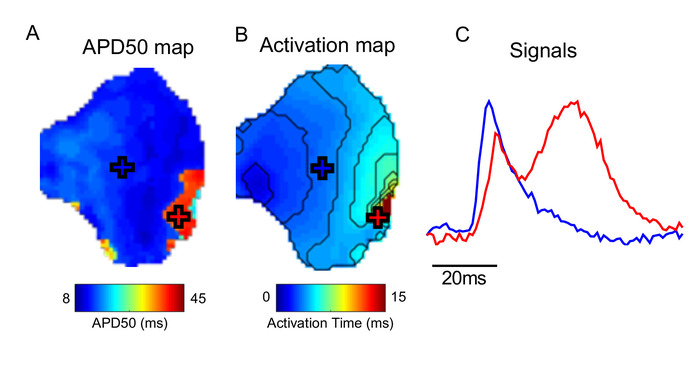
Figura 5: Effetto degli artefatti di movimento. (A) Mappa APD50. (B) Mappa di attivazione. (C) Esempi di segnali da posizioni contrassegnate (incrociate) su APD e mappe di attivazione. Nell'area del tessuto contrassegnata con la croce rossa, la contrazione non è stata disaccoppiata con successo, distorcendo il segnale ottico misurato. Fare clic qui per visualizzare una versione più grande di questa figura.
Discussione
Qui presentiamo una guida passo-passo per l'utilizzo del software open-source ElectroMap per un'analisi flessibile e multivariabile dei set di dati di mappatura ottica cardiaca. Per un uso efficace di ElectroMap, i dati di imaging devono essere in .tif o . formati MAT. ElectroMap incorpora diverse impostazioni utente modificabili. Come illustrato nella Figura 2A, ciò è necessario a causa dell'ampia eterogeneità esistente tra i modelli sperimentali e l'hardware di imaging. Ciò significa tuttavia che le impostazioni predefinite all'interno del software non saranno sempre ottimali, quindi un passo critico nell'utilizzo del software è per l'utente di sintonizzare le impostazioni per la loro particolare configurazione sperimentale. Questi includono le impostazioni della fotocamera e le scale cronologiche, come illustrato nella Figura 2B. Una volta trovate le impostazioni ottimali, queste possono essere salvate e ricaricate in momenti successivi selezionando File di configurazione.
L'incorporazione della misurazione CL automatizzata e la segmentazione del segnale sono i principali vantaggi del software. Queste caratteristiche consentono di l'analisi delle risposte acute nelle registrazioni sperimentali e di ampliare l'analisi concentrandosi su singole battute isolate. Una volta raggiunta la segmentazione desiderata, il modulo Single File Analysis consente l'analisi automatizzata di ogni singolo segmento (comprese le battute singole), realizzando l'analisi ad alta velocità effettiva di più variabili singolo file .csv. In congiunzione, la media di insieme dei picchi raggruppati è un metodo efficace per migliorare la qualità dei segnali rumorosi che vengono eseguiti automaticamente in ElectroMap. Tuttavia, l'insieme non è in grado di essere utile in modo medio, ad esempio negli studi sulla variabilità beat-to-beat. Pertanto, ElectroMap integra la segmentazione single beat per evitare la media dell'insieme, opzioni di elaborazione alternative per migliorare la SNR (filtro spaziale e temporale) e include il modulo di analisi Alternans per indagare ulteriormente e mappare variabilità beat-to-beat.
I set di dati di mappatura ottica spesso presentano artefatti come la deriva della linea di base e gli artefatti di movimento. Allo stesso modo, i segnali generati possono essere di bassa qualità a causa di piccole dimensioni dei pixel, tempi di esposizione brevi e bassi cambiamenti fluorescenti frazionari2. Questi fattori impediscono un'analisi efficace e accurata del comportamento sottostante eP. Come descritto, ElectroMap ha diverse strategie di elaborazione per superare questi problemi. Tuttavia, l'applicazione di questi algoritmi a dati fondamentalmente di scarsa qualità/distorti impedirà comunque un'analisi efficace. SNR è quindi uno dei parametri che viene misurato e visualizzato in ElectroMap. Allo stesso modo, l'utente può selezionare e confrontare i segnali provenienti da aree specifiche dal campione utilizzando i moduli Pixel Info e Compare, consentendo l'identificazione di fenomeni come gli artefatti di movimento mostrati nella Figura 5e l'esclusione dei dati.
Al momento, ElectroMap non supporta la rimozione di artefatti di movimento dai dati non elaborati nello stesso modo della correzione della linea di base. Pertanto, un possibile sviluppo futuro del software è l'inclusione della rimozione artefatto di movimento con metodi computazionali come è stato riportato31,32. Inoltre, ElectroMap è attualmente limitato allo studio di un segnale ottico. Tuttavia, per i coloranti ratiometrici e l'uso simultaneo di coloranti di tensione e calcio27, è necessaria l'elaborazione simultanea di due canali di lunghezza d'onda. L'integrazione dell'analisi a doppio segnale è quindi un'importante aggiunta futura al software. L'estensione delle opzioni di analisi applicabili ai set di dati aritmici, come il tracciamento della singolarità di fase, amplierebbe ugualmente l'ambito del software33,34. Infine, molte delle opzioni di analisi descritte possono essere utili anche nell'analisi dei dati di mappatura degli elettrodi. Infatti, ElectroMap è stato utilizzato per analizzare i dati di mappatura degli elettrodi nonostante la forma d'onda dell'elettrogramma a contrasto20,35, e un'ulteriore ottimizzazione espanderà il suo utilizzo per questa modalità.
Divulgazioni
P.K. riceve il sostegno della ricerca da diverse aziende di farmaci e dispositivi attive nella fibrillazione atriale e ha ricevuto onorari da diverse società di questo tipo. L.F. ha ricevuto sovvenzioni di ricerca istituzionali UE, BHF, MRC, DFG e Gilead. P.K. e L.F. sono elencati come inventori su due brevetti detenuti dall'Università di Birmingham (Atrial Fibrillation Therapy WO 2015140571, Markers for Atrial Fibrillation WO 2016012783).
Tutti gli altri autori non dichiarano alcun potenziale conflitto di interessi.
Riconoscimenti
Questo lavoro è stato finanziato dallo studenti EPSRC (Sci-Phy-4-Health Centre for Doctoral Training L016346) alla D.P., K.R. e L.F., Wellcome Trust Seed Award Grant (109604 / s/15 / s) a D.P., British Heart Foundation Grants (PG/17/55/33087, RG/17/15/33106) a D.P. , Unione europea (accordo di sovvenzione n. 633196 [CATCH ME] a P.K. e L.F.), British Heart Foundation (FS/13/43/30324 a P.K. e L.F.; PG/17/30/32961 a P.K. e A.H.) e Leducq Foundation a P.K.) J.W. è supportato dalla British Heart Foundation (FS/16/35/31952).
Materiali
| Name | Company | Catalog Number | Comments |
| MATLAB and Simulink R2018a | Mathworks, Inc, Natick, MA | MATLAB software |
Riferimenti
- Efimov, I. R., Nikolski, V. P., Salama, G. Optical Imaging of the Heart. Circulation Research. 94, 21-33 (2004).
- Herron, T. J., Lee, P., Jalife, J. Optical imaging of voltage and calcium in cardiac cells & tissues. Circulation Research. 110, 609-623 (2012).
- Boukens, B. J., Efimov, I. R. A century of optocardiography. IEEE Reviews in Biomedical Engineering. 7, 115-125 (2014).
- Myles, R. C., Wang, L., Kang, C., Bers, D. M., Ripplinger, C. M. Local β-adrenergic stimulation overcomes source-sink mismatch to generate focal arrhythmia. Circulation Research. 110, 1454-1464 (2012).
- Syeda, F., et al. PITX2 Modulates Atrial Membrane Potential and the Antiarrhythmic Effects of Sodium-Channel Blockers. Journal of the American College of Cardiology. 68, 1881-1894 (2016).
- Winter, J., et al. Sympathetic nervous regulation of cardiac alternans in the intact heart. Frontiers in Physiology. 9, 1-12 (2018).
- Faggioni, M., et al. Suppression of spontaneous ca elevations prevents atrial fibrillation in calsequestrin 2-null hearts. Circulation: Arrhythmia and Electrophysiology. 7, 313-320 (2014).
- Sato, P. Y., et al. Loss of Plakophilin-2 Expression Leads to Decreased Sodium Current and Slower Conduction Velocity in Cultured Cardiac Myocytes. Circulation Research. 105, 523-526 (2009).
- Yu, T. Y., et al. Optical mapping design for murine atrial electrophysiology. Computer Methods in Biomechanics and Biomedical Engineering: Imaging & Visualization. 5, 368-378 (2017).
- Laughner, J. I., Ng, F. S., Sulkin, M. S., Arthur, R. M., Efimov, I. R. Processing and analysis of cardiac optical mapping data obtained with potentiometric dyes. American Journal of Physiology. Heart and Circulatory Physiology. 303, H753-H765 (2012).
- Crocini, C., Ferrantini, C., Pavone, F. S., Sacconi, L. Optogenetics gets to the heart: A guiding light beyond defibrillation. Progress in Biophysics and Molecular Biology. 130, 132-139 (2017).
- Entcheva, E., Bub, G. All-optical control of cardiac excitation: Combined high-resolution optogenetic actuation and optical mapping. The Journal of Physiology. 9, 2503-2510 (2016).
- O’Shea, C., et al. ElectroMap: High-throughput open-source software for analysis and mapping of cardiac electrophysiology. Scientific Reports. 9, 1-13 (2019).
- Yu, T. Y., et al. An automated system using spatial oversampling for optical mapping in murine atria. Development and validation with monophasic and transmembrane action potentials. Progress in Biophysics and Molecular Biology. 115, 340-348 (2014).
- Jaimes, R., et al. Functional response of the isolated, perfused normoxic heart to pyruvate dehydrogenase activation by dichloroacetate and pyruvate. Pflugers Archiv. 468, 131-142 (2016).
- Wang, K., et al. Cardiac tissue slices: preparation, handling, and successful optical mapping. American Journal of Physiology. Heart and Circulatory Physiology. 308, H1112-H1125 (2015).
- Parrish, D. C., et al. Transient denervation of viable myocardium after myocardial infarction does not alter arrhythmia susceptibility. American Journal of Physiology. Heart and Circulatory. , (2017).
- Ihara, K., et al. Electrophysiological Assessment of Murine Atria with High-Resolution Optical Mapping. Journal of Visualized Experiments. (132), e56478 (2018).
- Holmes, A. P., et al. A Regional Reduction in Ito and IKACh in the Murine Posterior Left Atrial Myocardium Is Associated with Action Potential Prolongation and Increased Ectopic Activity. Plos One. 11, e0154077 (2016).
- Lang, D., et al. Arrhythmogenic remodeling of β2 versus β1 adrenergic signaling in the human failing heart. Circulation: Arrhythmia and Electrophysiology. 8, 409-419 (2015).
- Kang, C., et al. Human Organotypic Cultured Cardiac Slices: New Platform For High Throughput Preclinical Human Trials. Scientific Reports. 6, 1-13 (2016).
- Wen, Q., et al. Transverse cardiac slicing and optical imaging for analysis of transmural gradients in membrane potential and Ca2+ transients in murine heart. The Journal of Physiology. 596, 3951-3965 (2018).
- Houston, C., et al. Characterisation of re-entrant circuit (or rotational activity) in vitro using the HL1-6 myocyte cell line. Journal of Molecular and Cellular Cardiology. 119, 155-164 (2018).
- Yu, T. Y., et al. Optical mapping design for murine atrial electrophysiology. Computer Methods in Biomechanics and Biomedical Engineering: Imaging and Visualization. 5, 368-376 (2017).
- Laughner, J. I., Ng, F. S., Sulkin, M. S., Arthur, R. M., Efimov, I. R. Processing and analysis of cardiac optical mapping data obtained with potentiometric dyes. AJP: Heart and Circulatory Physiology. 303, H753-H765 (2012).
- Bayly, P. V., et al. Estimation of Conduction Velocity Vector Fields from Epicardial Mapping Data. IEEE Transactions on Bio-Medical Engineering. 45, 563-571 (1998).
- Jaimes, R., et al. A technical review of optical mapping of intracellular calcium within myocardial tissue. American Journal of Physiology. Heart and Circulatory Physiology. 310, H1388-H1401 (2016).
- Wang, L., et al. Optical mapping of sarcoplasmic reticulum Ca2+ in the intact heart: Ryanodine receptor refractoriness during alternans and fibrillation. Circulation Research. 114, 1410-1421 (2014).
- Winter, J., Shattock, M. J. Geometrical considerations in cardiac electrophysiology and arrhythmogenesis. Europace. , (2016).
- Mironov, S., Jalife, J., Tolkacheva, E. G. Role of conduction velocity restitution and short-term memory in the development of action potential duration alternans in isolated rabbit hearts. Circulation. 118, 17-25 (2008).
- Khwaounjoo, P., et al. Image-Based Motion Correction for Optical Mapping of Cardiac Electrical Activity. Annals of Biomedical Engineering. 43, 1235-1246 (2014).
- Christoph, J., Luther, S. Marker-Free Tracking for Motion Artifact Compensation and Deformation Measurements in Optical Mapping Videos of Contracting Hearts. Frontiers in Physiology. 9, (2018).
- Umapathy, K., et al. Phase Mapping of Cardiac Fibrillation. Circulation: Arrhythmia and Electrophysiology. 3, 105-114 (2010).
- Tomii, N., et al. Detection Algorithm of Phase Singularity Using Phase Variance Analysis for Epicardial Optical Mapping Data. IEEE Transactions on Biomedical Engineering. 63, 1795-1803 (2016).
- Cantwell, C. D., et al. Techniques for automated local activation time annotation and conduction velocity estimation in cardiac mapping. Computers in Biology and Medicine. 65, (2015).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon